3874
26 Марта 2021
Себастьяно Эмануэле Торриси, Ада Ванчери, Мауро Павоне, Джанлука Самбатаро, Стефано Палмуччи, Карло Ванчери
Италия
Ключевые слова: идиопатический легочный фиброз, сопутствующие заболевания, прогноз, рак легких, сердечно-сосудистые заболевания, легочная гипертензия
Аннотация. Идиопатический легочный фиброз (ИЛФ) - это тяжелое заболевание паренхимы легких, характеризующееся интенсивным отложением коллагена в интерстициальных пространствах. Внедрение антифиброзных препаратов увеличило ожидаемую продолжительность жизни пациентов, подчеркивая роль сопутствующих заболеваний в такт...
Италия
Ключевые слова: идиопатический легочный фиброз, сопутствующие заболевания, прогноз, рак легких, сердечно-сосудистые заболевания, легочная гипертензия
Аннотация. Идиопатический легочный фиброз (ИЛФ) - это тяжелое заболевание паренхимы легких, характеризующееся интенсивным отложением коллагена в интерстициальных пространствах. Внедрение антифиброзных препаратов увеличило ожидаемую продолжительность жизни пациентов, подчеркивая роль сопутствующих заболеваний в такт...
Себастьяно Эмануэле Торриси, Ада Ванчери, Мауро Павоне, Джанлука Самбатаро, Стефано Палмуччи, Карло Ванчери
Италия
Ключевые слова: идиопатический легочный фиброз, сопутствующие заболевания, прогноз, рак легких, сердечно-сосудистые заболевания, легочная гипертензия
Аннотация. Идиопатический легочный фиброз (ИЛФ) - это тяжелое заболевание паренхимы легких, характеризующееся интенсивным отложением коллагена в интерстициальных пространствах. Внедрение антифиброзных препаратов увеличило ожидаемую продолжительность жизни пациентов, подчеркивая роль сопутствующих заболеваний в тактике лечения и дальнейшем прогнозе. ИЛФ часто ассоциирован с другими заболеваниями, главным образом из-за его манифестации в среднем возрасте, а иногда и из-за наличия общих патогенетических путей, например, с развитием рака легких. Сопутствующие заболевания могут по-разному влиять на прогноз течения заболевания у пациентов, страдающих ИЛФ. Однако данные, изучающие влияние сопутствующих заболеваний (за исключением таких основных заболеваний, как рак легкого, легочная гипертензия и сердечно-сосудистые заболевания) на прогноз, все еще немногочисленны, а иногда и противоречивы, что подчеркивает необходимость новых крупных целевых исследований. В этом обзоре мы обсуждаем современные знания о наиболее распространенных сопутствующих заболеваниях, связанных с ИЛФ, - сердечно-сосудистых заболеваниях, легочной гипертензии, раке легких, эмфиземе, гастроэзофагеальном рефлюксе и депрессии, уделяя особое внимание их прогностической роли.
1. Введение
Идиопатический легочный фиброз (ИЛФ) - это хроническое прогрессирующее паренхиматозное заболевание легких, характеризующееся непредсказуемым клиническим течением, которое приводит к летальному исходу в среднем через 3-5 лет после постановки диагноза. Заболевание встречается у взрослых людей с коэффициентами заболеваемости и распространенности, увеличивающимися с возрастом [1]. Однако, несмотря на возрастающее число исследований, посвященных изучению этого заболевания, патогенез ИЛФ до конца остается неясным [2]. Стремительное снижение функции легких, непредсказуемое клиническое течение, плохой прогноз и отсутствие новых эффективных лекарственных препаратов делают лечение ИЛФ действительно трудным [63].
Как и при других заболеваниях, характерных для людей среднего возраста или пожилых людей, пациенты с ИЛФ часто страдают от одного или нескольких сопутствующих заболеваний. Чаще всего это сердечно-сосудистые, метаболические, гастроэнтерологические и неопластические заболевания, которые недавно были описаны Kreuter и соавт. как «коморбидность ИЛФ» [3] (рис. 1).
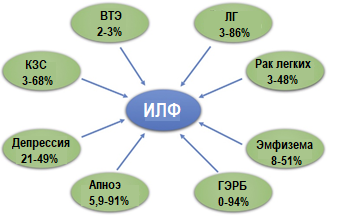 Рис. 1. Наиболее часто встречающиеся сопутствующие заболевания с относительной распространенностью
Рис. 1. Наиболее часто встречающиеся сопутствующие заболевания с относительной распространенностью
ИЛФ – идиопатический легочный фиброз, ВТЭ – венозная тромбоэмболия, ЛГ – легочная гипертензия, ГЭРБ – гастроэзофагеальная рефлюксная болезнь, КЗС – коронарные заболевания сердца.
Как правило, наличие сопутствующих заболеваний может привести к более поздней постановке диагноза и повлиять на клиническое течение заболевания, а также на лечение ИЛФ и, самое главное, на прогноз. К сожалению, эти специфические аспекты течения ИЛФ плохо изучены и нуждаются в более глубокой оценке. В этом обзоре освещается текущее состояние знаний о влиянии основных сопутствующих заболеваний на прогноз у пациентов с ИЛФ.
2. Сердечно-сосудистые заболевания
Сердечно-сосудистые заболевания (ССЗ) очень часто являются сопутствующей патологией у пациентов с ИЛФ, распространенность которых обычно увеличивается с возрастом, как и в случае других заболеваний, таких как хроническая обструктивная болезнь легких (ХОБЛ) или рак. Однако при ИЛФ распространенность сердечно-сосудистых заболеваний значительно выше, чем при других интерстициальных заболеваниях легких (ИЗЛ) или при ХОБЛ. Взаимосвязь между ИЛФ и ССЗ оценивалась в нескольких эпидемиологических исследованиях. Первые данные были получены от Hubbard и соавт., которые описали распространенность сердечно-сосудистых заболеваний, цереброваскулярных заболеваний и тромбоза глубоких вен (ТГВ) в когорте из 920 пациентов с ИЛФ и 3593 контрольных случаях. Это исследование продемонстрировало повышенный риск развития острого коронарного синдрома (ОКС) и ТГВ у пациентов с ИЛФ даже до того, как диагноз ИЛФ был поставлен (ОШ 1,53 и 1,98, соответственно). Интересно, что риск этих сопутствующих заболеваний увеличился во время периода наблюдения [4]. Этот факт был подтвержден в более широком исследовании Sode и соавт., в котором были проанализированы данные из национальных реестров Дании о 19 557 пациентах с идиопатической интерстициальной пневмонией (ИИП). Они обнаружили повышенный риск развития ИИП у пациентов с имеющимся диагнозом венозной тромбоэмболии (ВР 1.8) и ТГВ (ВР 1.3), с особенно высоким риском (ВР 2.4) у пациентов с тромбоэмболией легочной артерии (ТЭЛА) [5]. Sprunger и соавт. обнаружили аналогичные данные в большой когорте пациентов с ИЛФ. Они продемонстрировали распространенность венозной тромбоэмболии 1,74% (ОШ 1,34) и, что интересно, более высокий риск развития венозной тромбоэмболии у пациентов, причиной смерти которых являлся ИЛФ, чем у умерших от рака легкого (ОШ 1,66) или ХОБЛ (ОШ 1,41) [6].
Даже несмотря на то, что истинная причина этой связи еще не найдена, появились некоторые правдоподобные гипотезы, пытающиеся ее объяснить. Известно, что ИЛФ характеризуется интенсивным повреждением тканей и их фиброзным замещением. Факты свидетельствуют о том, что это патологическое состояние создает дисбаланс между коагулянтными и антикоагулянтными факторами, обусловливающий протромботическое состояние [7]. Кроме того, у пациентов с ИЛФ часто наблюдается интенсивная гипоксия, которая, в свою очередь, может также оправдать высокую частоту сердечно-сосудистых заболеваний. В настоящее время неясно, связан ли повышенный риск сердечно-сосудистых заболеваний именно с ИЛФ или же он связан с повышенной распространенностью общих факторов риска сердечно-сосудистых заболеваний, таких как артериальная гипертензия, сахарный диабет, гиперлипидемия, курение в анамнезе и возраст. Тем не менее, несомненно, что наличие сердечно-сосудистых заболеваний неизбежно влияет на лечение пациентов с ИЛФ и прогноз.
Nathan и соавт. показали увеличение частоты коронарных заболеваний сердца (ИБС), что было зарегистрировано в 68% когорты из 73 пациентов с ИЛФ, которые перенесли катетеризацию сердца для трансплантации. У пациентов с тяжелой ИБС прогноз был хуже (ВР 4,83), чем у других [8]. Подобные данные были также найдены в исследовании Hyldgaard и соавт., которые проанализировали датскую когорту из 121 пациента. В этом исследовании сердечно-сосудистые заболевания, диагностированные у пациентов с ИЛФ, оказали значительное влияние на прогноз (ВР 4,7, р <0,001) [9]. Также подобный анализ влияния сердечно-сосудистых заболеваний осветил в своей недавней работе Kreuter и соавт. Он обнаружил значительно худший прогноз у пациентов с другими сердечными заболеваниями (ВР 1,94, р = 0,005) и артериосклерозом (ВР 1,69, р = 0,039) и худший, хотя и несущественный, прогноз у пациентов с ИБС (ВР 1,32, р = 0,38) и венозной тромбоэмболией (ВР 1,58, р = 0,29) [3].
Доказательства протромботического состояния и высокая частота случаев сердечно-сосудистых заболеваний при ИЛФ в прошлом привели к теоретическому обоснованию применения антикоагулянтных препаратов. Однако, как известно, плацебо-контролируемое исследование, в котором проводилось тестирование варфарина, в конечном итоге не удалось из-за отсутствия положительных результатов и увеличения уровня смертности [10].
Таким образом, до настоящего времени не было выявлено каких-либо четко определенных причин для этой конкретной ассоциации, и нет никаких специфических методов лечения, которые могли бы уменьшить влияние сердечно-сосудистых заболеваний на прогноз у пациентов с ИЛФ.
3. Легочная гипертония
Легочная гипертензия (ЛГ) определяется как среднее давление в легочной артерии (ДЛАср.) > 25 мм рт. ст. с использованием катетеризации правых отделов сердца [11]. ЛГ является частым и фатальным осложнением ИЛФ с распространенностью, которая в значительной степени варьирует с учетом различий в определении тяжести ЛГ и разных методов измерения. Эти данные затрудняют определение реальной распространенности ЛГ. По данным исследований с использованием трансторакальной эхокардиографии (TT ЭхоКГ) [12, 13] Nadrous и соавт. сообщили о распространенности ЛГ 84%, в то время как в других исследованиях с использованием катетеризации правых отделов сердца сообщалось о другой распространенности, варьирующейся между 29% и 46% [14]. Обычно у пациентов с ЛГ и ИЛФ наблюдаются значительно более низкие показатели диффузной способности легких (DLCO), гипоксемия в покое, пониженная толерантность к физической нагрузке с быстрым снижением артериальной оксигенации при физической нагрузке и иногда, особенно при тяжелой стадии заболевания, признаки расширения легочной артерии и/или гипертрофия правого желудочка.
Из-за этих особенностей пациенты, страдающие ИЛФ, осложненным ЛГ, имеют очень низкое качество жизни, но, самое главное, что выживаемость пациентов с данной патологией очень низкая. Недавнее исследование, в котором проводился анализ данных пациентов с ИЛФ, прошедших обследование перед трансплантацией легких, продемонстрировало показатели смертности в течение 1 года 28% пациентов с ЛГ по сравнению с 5,5% пациентов без ЛГ [15]. Аналогичные результаты были также получены при проведении TT ЭхоКГ [13]. Эти данные подчеркивают, как значительно влияет на ведение пациентов с ИЛФ наличие ЛГ, и насколько важна ранняя диагностика, особенно для своевременного направления пациентов на трансплантацию легких [16].
В настоящее время не существует одобренных методов лечения ЛГ при ИЛФ. Большинство вазодилататорных препаратов, обычно используемых для лечения ЛАГ, таких как бозентан, амбризентан, мацитентан и риоцигуат, были изучены как возможные способы лечения ИЛФ с отрицательными результатами [17–20]. Тем не менее, небольшое, но положительное доказательство эффективности наблюдалось при тестировании силденафила на поздних стадиях ИЛФ. Даже несмотря на то, что в этом исследовании не удалось достичь первичного положительного результата, у некоторых пациентов наблюдалось небольшое уменьшение одышки и улучшение качества жизни [21]. Последующий ретроспективный анализ продемонстрировал увеличение дистанции ходьбы только у тех пациентов, у которых были признаки ЛГ при TT ЭхоКГ [22]. Это открытие привело к недавнему началу двух новых клинических испытаний (NCT02951429 и NCT02802345), в которых проводилось исследование эффективности силденафила в сочетании с антифиброзными препаратами у пациентов с ИЛФ с доказанным ЛГ.
4. Рак легких
У пациентов с ИЛФ риск развития рака легких (РЛ) до пяти раз выше по сравнению с населением в целом. Причина этой поразительной ассоциации на самом деле до сих пор неясна. Известно, что у этих двух заболеваний общие факторы риска, такие как курение в анамнезе, мужской пол и возраст, однако эта связь все же представляется более сложной. Некоторые исследования показали, что оба заболевания имеют сходные патогенетические механизмы, проливая свет на некоторые неизвестные аспекты патогенеза ИЛФ. Эти сходства были подчеркнуты Vancheri и соавт., которые показали, что ИЛФ и РЛ объединяют специфические эпигенетические и генетические изменения, извращенная реакция на регуляторные сигналы, аномальная экспрессия микроРНК и активация специфических сигнальных путей [23, 24].
Среди разных групп пациентов с ИЛФ распространенность РЛ колеблется от 3% до 48%. Тем не менее, общая заболеваемость имеет тенденцию к увеличению с течением времени и была оценена в 3,3%, 15,4% и 54,7% соответственно через 1,5 и 10 лет [25] после постановки диагноза ИЛФ, еще более высокая заболеваемость была отмечена у пациентов с синдромом сочетания фиброза и эмфиземы легких [26, 27]. Наиболее часто встречающимся гистологическим типом рака являются плоскоклеточный рак и аденокарцинома. Они обычно проявляются в виде узелков, развивающихся вблизи фиброзных областей [28–30]. В различных исследованиях было четко установлено влияние РЛ на прогноз ИЛФ. Выживаемость заметно снижается с медианой 19–38,7 мес. у пациентов с РЛ по сравнению со медианой 48–63,9 мес. у пациентов с ИЛФ без РЛ (ВР 2,9–5) [3, 4]. Лечение данных пациентов одинаково сложно из-за недостаточного опыта и отсутствия эффективных терапевтических возможностей. На ранних стадиях может рассматриваться вариант хирургической резекции, однако риск обострения, связанного с операцией, колеблется между 7% и 32% и является значительным [31–33]. Более того, исследования показали, что химиотерапия и лучевая терапия могут одинаково подвергать пациентов сравнительному риску.
Таким образом, плохой прогноз и отсутствие эффективных методов терапии делают РЛ одной из наиболее значительных сопутствующих ИЛФ патологий и, в то же время, одной самых значительных трудностей для клинициста при лечении ИЛФ.
5. Эмфизема
Эмфизема легких у пациентов с ИЛФ обнаруживается не реже чем в 8-51% случаев. Интересно, что у пациентов с этой комбинацией есть некоторые особенности. Обычно это мужчины с многолетним анамнезом курения, с сохраненным объемом легких на фоне снижения DLCO, низким уровнем кислорода в крови в покое и сниженной толерантностью к физической нагрузке. В 2005 году Cottin определил, что эти признаки являются частью специфического синдрома, называемого «синдромом сочетания фиброза и эмфиземы легких» (CPFE) [34].
На сегодняшний день причина сочетания эмфиземы и фиброза легких неясна и, конечно, не может объясняться только анамнезом курения. Исследования на животных моделях продемонстрировали потенциальную патогенную роль сурфактантного белка D, фактора некроза опухолей α, интерлейкина-1β и эластазы нейрофилов [35–38]. Тем не менее, эти результаты должны быть подтверждены у людей. Более того, дефект только одного сигнального пути не может полностью объяснить развитие этого синдрома, который, вероятно, вызван сочетанием нескольких факторов.
Пациенты с CPFE демонстрируют очень плохую выживаемость в диапазоне от 2,1 до 8,5 лет. Однако вопрос о том, является ли прогноз пациентов с CPFE по сравнению с ИЛФ более негативным, все еще неясен из-за противоречивых данных. Kurashima и соавт. обнаружили значительно более низкую выживаемость в когорте 129 пациентов с CPFE по сравнению с 233 пациентами с ИЛФ (7,5 лет против 8,5 лет; p = 0,0472) [39]. Подобные результаты были также представлены в исследовании Mejìa и соавт. (25 месяцев против 24 месяцев; р = 0,01) [40]. В противовес этим данным, другие исследования (Ryerson и соавт.) описали несущественную разницу в смертности пациентов с этими двумя заболеваниями (ВР 1,14, 95% ДИ 0,61–2,13; р = 0,69) [41].
Также известно, что пациенты с CPFE часто страдают от тяжелых осложнений. Было показано, что ИЛФ и эмфизема легких являются независимыми факторами риска развития РЛ. Поэтому его распространенность среди пациентов с CPFE выше, чем среди пациентов с ИЛФ, в диапазоне от 35,8% до 46,8% [26, 42]. Как уже было описано в предыдущем разделе, наличие у пациентов РЛ неизбежно значительно снижает их выживаемость. Вторым серьезным осложнением синдрома CPFE является ЛГ с невероятно высокой распространенностью - от 47% до 90% [43, 44]. Как и в случае с РЛ, наличие данного осложнения сильно влияет на прогноз, что приводит к ожидаемой однолетней выживаемости равной 60%.
В настоящее время не существует специальных методов лечения синдрома CPFE, потому что никакие специальные испытания до сих пор не были разработаны. Предположительно, и пирфенидон, и нинтеданиб могут способствовать замедлению естественного развития процесса, как и при ИЛФ. Тем не менее, из-за отсутствия данных рандомизированных клинических исследований (РКИ) принципы лечения фактически основаны на мнении экспертов и общих профилактических мерах, таких как прекращение курения, использование кислородотерапии и реабилитации.
6. Гастроэзофагеальный рефлюкс (ГЭРБ)
Частота диагностирования ГЭРБ у пациентов с ИЛФ широко варьирует от 0% до 94% [45]. Тем не менее, несмотря на то, что эта связь была достоверно установлена, остается неясным, играет ли этот механизм патогенную роль в возникновении ИЛФ и если да, то каким образом. Было высказано предположение, что наличие ГЭРБ и последующая микроаспирация, вызывающая повторное повреждение альвеолярных эпителиальных клеток, приводит к патологическому процессу заживления и, в конечном итоге, к фиброзу легких.
Исходя из этой гипотезы, следует ожидать положительного эффекта лечения ГЭРБ в отношении замедления прогрессирования заболевания или снижения смертности. К сожалению, конкретных РКИ по данному вопросу не было разработано, а уже имеющихся данных недостаточно, и они весьма противоречивы. Первые данные получены из серии исследований 4 случаев, когда пациенты получали антациды (Raghu и соавт.) и 14 случаев, когда пациентам была проведена фундопликация (Linden и соавт.).
В обеих группах у пациентов определялась стабильность функции легких в течение периода наблюдения [46, 47]. Более последовательные результаты получены в исследовании Lee и соавт., где анализ группы из 204 пациентов выявил, что использование препаратов для лечения ГЭРБ было независимым предиктором более продолжительного выживания у пациентов с ИЛФ [48]. В последующем ретроспективном анализе трех РКИ тот же автор продемонстрировал, что антацидное лечение определяло более медленное снижение функции легких и снижение частоты обострений [49]. Тем не менее, более поздний ретроспективный анализ, в котором оценивались 624 пациента с ИЛФ, пришедших из испытаний CAPACITY и ASCEND, не подтвердил предыдущее предположение об отсутствии улучшения результатов после антацидной терапии [50]. В недавней статье Raghu и соавт. предоставили новую интересную информацию о роли лапароскопической хирургии, которая была признана безопасной и хорошо переносимой. Это может открыть путь новым крупным рандомизированным исследованиям, изучающим, действительно ли данный вариант лечения необходим в этой популяции [64].
Таким образом, доказательства патогенной роли ГЭРБ при ИЛФ на самом деле неясны, как и неясна возможная полезность антацидного лечения. В настоящее время происходит отбор пациентов для новых текущих испытаний для предоставления возможных ответов на данные вопросы.
7. Апноэ во сне
У пациентов, страдающих ИЛФ, также был выявлен высокий уровень апноэ во сне, от 59% до 88% [51–53]. Степень связанности этих состояний до сих пор неясна. Вполне вероятно, что рестриктивные заболевания легких, такие как ИЛФ, могут снизить тонус верхних дыхательных путей, увеличивая их сжимаемость. Кроме того, по-видимому, при ИЛФ часто встречаются изменения в дыхательном центре, сопутствующие развитию синдрома апноэ во сне. В нескольких исследованиях подчеркивалось, что ночная десатурация связана с худшим прогнозом при ИЛФ [54–56]. Совсем недавно Bosi и соавт. подтвердили эти результаты и продемонстрировали четкую связь между наличием синдрома апноэ во сне и прогрессированием заболевания [57]. Учитывая это, пациентам с ИЛФ, у которых встречается апноэ во сне, следует предлагать лечение постоянным положительным давлением. Тем не менее, данные об эффективности этого лечения для снижения прогрессирования заболевания и смертности по-прежнему отсутствуют.
8. Депрессия
ИЛФ является тяжелым заболеванием, поэтому у таких пациентов часто встречаются депрессия и тревога в диапазоне от 24,3% до 49,2% [58, 59]. Исследования также продемонстрировали прямую корреляцию между этим явлением и выраженностью одышки, кашля и снижением функции легких [54, 60, 61]. Тем не менее, даже несмотря на то, что распространенность депрессии при ИЛФ хорошо установлена, данных о ее влиянии на исход мало. Lee и соавт. оценили этот аспект в проспективном исследовании, демонстрирующем отсутствие значительных различий в показателях выживаемости между пациентами с депрессией и без нее [62]. И наоборот, отрицательное, но не существенное влияние на выживаемость было также описано в ретроспективном исследовании Kreuter (ВР 2.01 p = 0.23) [3]. Следовательно, для оценки этого аспекта ИЛФ необходимы более обширные и точные данные.
9. Заключение
ИЛФ действительно является парадигматическим заболеванием, характеризующимся непредсказуемым клиническим течением и очень высокой смертностью. У пациентов с ИЛФ часто встречаются сопутствующие заболевания, которые могут по-разному влиять на прогноз. Однако, за исключением наиболее значимых факторов, как РЛ, ЛГ и сердечно-сосудистые заболевания, данные об их воздействии все еще немногочисленны и иногда противоречивы, вероятно, из-за оценки небольших когорт и различий в определениях каждой коморбидности. Учитывая это, сопутствующие заболевания ИЛФ должны изучаться систематически, поскольку ранняя диагностика и соответствующее лечение могут помочь в оптимизации терапии и улучшении качества жизни. Необходимы новые, крупные и целевые исследования, чтобы лучше оценить, как сопутствующие заболевания влияют на прогноз и как их лечение может влиять на прогрессирование заболевания и выживаемость.
Литература
Италия
Ключевые слова: идиопатический легочный фиброз, сопутствующие заболевания, прогноз, рак легких, сердечно-сосудистые заболевания, легочная гипертензия
Аннотация. Идиопатический легочный фиброз (ИЛФ) - это тяжелое заболевание паренхимы легких, характеризующееся интенсивным отложением коллагена в интерстициальных пространствах. Внедрение антифиброзных препаратов увеличило ожидаемую продолжительность жизни пациентов, подчеркивая роль сопутствующих заболеваний в тактике лечения и дальнейшем прогнозе. ИЛФ часто ассоциирован с другими заболеваниями, главным образом из-за его манифестации в среднем возрасте, а иногда и из-за наличия общих патогенетических путей, например, с развитием рака легких. Сопутствующие заболевания могут по-разному влиять на прогноз течения заболевания у пациентов, страдающих ИЛФ. Однако данные, изучающие влияние сопутствующих заболеваний (за исключением таких основных заболеваний, как рак легкого, легочная гипертензия и сердечно-сосудистые заболевания) на прогноз, все еще немногочисленны, а иногда и противоречивы, что подчеркивает необходимость новых крупных целевых исследований. В этом обзоре мы обсуждаем современные знания о наиболее распространенных сопутствующих заболеваниях, связанных с ИЛФ, - сердечно-сосудистых заболеваниях, легочной гипертензии, раке легких, эмфиземе, гастроэзофагеальном рефлюксе и депрессии, уделяя особое внимание их прогностической роли.
1. Введение
Идиопатический легочный фиброз (ИЛФ) - это хроническое прогрессирующее паренхиматозное заболевание легких, характеризующееся непредсказуемым клиническим течением, которое приводит к летальному исходу в среднем через 3-5 лет после постановки диагноза. Заболевание встречается у взрослых людей с коэффициентами заболеваемости и распространенности, увеличивающимися с возрастом [1]. Однако, несмотря на возрастающее число исследований, посвященных изучению этого заболевания, патогенез ИЛФ до конца остается неясным [2]. Стремительное снижение функции легких, непредсказуемое клиническое течение, плохой прогноз и отсутствие новых эффективных лекарственных препаратов делают лечение ИЛФ действительно трудным [63].
Как и при других заболеваниях, характерных для людей среднего возраста или пожилых людей, пациенты с ИЛФ часто страдают от одного или нескольких сопутствующих заболеваний. Чаще всего это сердечно-сосудистые, метаболические, гастроэнтерологические и неопластические заболевания, которые недавно были описаны Kreuter и соавт. как «коморбидность ИЛФ» [3] (рис. 1).
 Рис. 1. Наиболее часто встречающиеся сопутствующие заболевания с относительной распространенностью
Рис. 1. Наиболее часто встречающиеся сопутствующие заболевания с относительной распространенностьюИЛФ – идиопатический легочный фиброз, ВТЭ – венозная тромбоэмболия, ЛГ – легочная гипертензия, ГЭРБ – гастроэзофагеальная рефлюксная болезнь, КЗС – коронарные заболевания сердца.
Как правило, наличие сопутствующих заболеваний может привести к более поздней постановке диагноза и повлиять на клиническое течение заболевания, а также на лечение ИЛФ и, самое главное, на прогноз. К сожалению, эти специфические аспекты течения ИЛФ плохо изучены и нуждаются в более глубокой оценке. В этом обзоре освещается текущее состояние знаний о влиянии основных сопутствующих заболеваний на прогноз у пациентов с ИЛФ.
2. Сердечно-сосудистые заболевания
Сердечно-сосудистые заболевания (ССЗ) очень часто являются сопутствующей патологией у пациентов с ИЛФ, распространенность которых обычно увеличивается с возрастом, как и в случае других заболеваний, таких как хроническая обструктивная болезнь легких (ХОБЛ) или рак. Однако при ИЛФ распространенность сердечно-сосудистых заболеваний значительно выше, чем при других интерстициальных заболеваниях легких (ИЗЛ) или при ХОБЛ. Взаимосвязь между ИЛФ и ССЗ оценивалась в нескольких эпидемиологических исследованиях. Первые данные были получены от Hubbard и соавт., которые описали распространенность сердечно-сосудистых заболеваний, цереброваскулярных заболеваний и тромбоза глубоких вен (ТГВ) в когорте из 920 пациентов с ИЛФ и 3593 контрольных случаях. Это исследование продемонстрировало повышенный риск развития острого коронарного синдрома (ОКС) и ТГВ у пациентов с ИЛФ даже до того, как диагноз ИЛФ был поставлен (ОШ 1,53 и 1,98, соответственно). Интересно, что риск этих сопутствующих заболеваний увеличился во время периода наблюдения [4]. Этот факт был подтвержден в более широком исследовании Sode и соавт., в котором были проанализированы данные из национальных реестров Дании о 19 557 пациентах с идиопатической интерстициальной пневмонией (ИИП). Они обнаружили повышенный риск развития ИИП у пациентов с имеющимся диагнозом венозной тромбоэмболии (ВР 1.8) и ТГВ (ВР 1.3), с особенно высоким риском (ВР 2.4) у пациентов с тромбоэмболией легочной артерии (ТЭЛА) [5]. Sprunger и соавт. обнаружили аналогичные данные в большой когорте пациентов с ИЛФ. Они продемонстрировали распространенность венозной тромбоэмболии 1,74% (ОШ 1,34) и, что интересно, более высокий риск развития венозной тромбоэмболии у пациентов, причиной смерти которых являлся ИЛФ, чем у умерших от рака легкого (ОШ 1,66) или ХОБЛ (ОШ 1,41) [6].
Даже несмотря на то, что истинная причина этой связи еще не найдена, появились некоторые правдоподобные гипотезы, пытающиеся ее объяснить. Известно, что ИЛФ характеризуется интенсивным повреждением тканей и их фиброзным замещением. Факты свидетельствуют о том, что это патологическое состояние создает дисбаланс между коагулянтными и антикоагулянтными факторами, обусловливающий протромботическое состояние [7]. Кроме того, у пациентов с ИЛФ часто наблюдается интенсивная гипоксия, которая, в свою очередь, может также оправдать высокую частоту сердечно-сосудистых заболеваний. В настоящее время неясно, связан ли повышенный риск сердечно-сосудистых заболеваний именно с ИЛФ или же он связан с повышенной распространенностью общих факторов риска сердечно-сосудистых заболеваний, таких как артериальная гипертензия, сахарный диабет, гиперлипидемия, курение в анамнезе и возраст. Тем не менее, несомненно, что наличие сердечно-сосудистых заболеваний неизбежно влияет на лечение пациентов с ИЛФ и прогноз.
Nathan и соавт. показали увеличение частоты коронарных заболеваний сердца (ИБС), что было зарегистрировано в 68% когорты из 73 пациентов с ИЛФ, которые перенесли катетеризацию сердца для трансплантации. У пациентов с тяжелой ИБС прогноз был хуже (ВР 4,83), чем у других [8]. Подобные данные были также найдены в исследовании Hyldgaard и соавт., которые проанализировали датскую когорту из 121 пациента. В этом исследовании сердечно-сосудистые заболевания, диагностированные у пациентов с ИЛФ, оказали значительное влияние на прогноз (ВР 4,7, р <0,001) [9]. Также подобный анализ влияния сердечно-сосудистых заболеваний осветил в своей недавней работе Kreuter и соавт. Он обнаружил значительно худший прогноз у пациентов с другими сердечными заболеваниями (ВР 1,94, р = 0,005) и артериосклерозом (ВР 1,69, р = 0,039) и худший, хотя и несущественный, прогноз у пациентов с ИБС (ВР 1,32, р = 0,38) и венозной тромбоэмболией (ВР 1,58, р = 0,29) [3].
Доказательства протромботического состояния и высокая частота случаев сердечно-сосудистых заболеваний при ИЛФ в прошлом привели к теоретическому обоснованию применения антикоагулянтных препаратов. Однако, как известно, плацебо-контролируемое исследование, в котором проводилось тестирование варфарина, в конечном итоге не удалось из-за отсутствия положительных результатов и увеличения уровня смертности [10].
Таким образом, до настоящего времени не было выявлено каких-либо четко определенных причин для этой конкретной ассоциации, и нет никаких специфических методов лечения, которые могли бы уменьшить влияние сердечно-сосудистых заболеваний на прогноз у пациентов с ИЛФ.
3. Легочная гипертония
Легочная гипертензия (ЛГ) определяется как среднее давление в легочной артерии (ДЛАср.) > 25 мм рт. ст. с использованием катетеризации правых отделов сердца [11]. ЛГ является частым и фатальным осложнением ИЛФ с распространенностью, которая в значительной степени варьирует с учетом различий в определении тяжести ЛГ и разных методов измерения. Эти данные затрудняют определение реальной распространенности ЛГ. По данным исследований с использованием трансторакальной эхокардиографии (TT ЭхоКГ) [12, 13] Nadrous и соавт. сообщили о распространенности ЛГ 84%, в то время как в других исследованиях с использованием катетеризации правых отделов сердца сообщалось о другой распространенности, варьирующейся между 29% и 46% [14]. Обычно у пациентов с ЛГ и ИЛФ наблюдаются значительно более низкие показатели диффузной способности легких (DLCO), гипоксемия в покое, пониженная толерантность к физической нагрузке с быстрым снижением артериальной оксигенации при физической нагрузке и иногда, особенно при тяжелой стадии заболевания, признаки расширения легочной артерии и/или гипертрофия правого желудочка.
Из-за этих особенностей пациенты, страдающие ИЛФ, осложненным ЛГ, имеют очень низкое качество жизни, но, самое главное, что выживаемость пациентов с данной патологией очень низкая. Недавнее исследование, в котором проводился анализ данных пациентов с ИЛФ, прошедших обследование перед трансплантацией легких, продемонстрировало показатели смертности в течение 1 года 28% пациентов с ЛГ по сравнению с 5,5% пациентов без ЛГ [15]. Аналогичные результаты были также получены при проведении TT ЭхоКГ [13]. Эти данные подчеркивают, как значительно влияет на ведение пациентов с ИЛФ наличие ЛГ, и насколько важна ранняя диагностика, особенно для своевременного направления пациентов на трансплантацию легких [16].
В настоящее время не существует одобренных методов лечения ЛГ при ИЛФ. Большинство вазодилататорных препаратов, обычно используемых для лечения ЛАГ, таких как бозентан, амбризентан, мацитентан и риоцигуат, были изучены как возможные способы лечения ИЛФ с отрицательными результатами [17–20]. Тем не менее, небольшое, но положительное доказательство эффективности наблюдалось при тестировании силденафила на поздних стадиях ИЛФ. Даже несмотря на то, что в этом исследовании не удалось достичь первичного положительного результата, у некоторых пациентов наблюдалось небольшое уменьшение одышки и улучшение качества жизни [21]. Последующий ретроспективный анализ продемонстрировал увеличение дистанции ходьбы только у тех пациентов, у которых были признаки ЛГ при TT ЭхоКГ [22]. Это открытие привело к недавнему началу двух новых клинических испытаний (NCT02951429 и NCT02802345), в которых проводилось исследование эффективности силденафила в сочетании с антифиброзными препаратами у пациентов с ИЛФ с доказанным ЛГ.
4. Рак легких
У пациентов с ИЛФ риск развития рака легких (РЛ) до пяти раз выше по сравнению с населением в целом. Причина этой поразительной ассоциации на самом деле до сих пор неясна. Известно, что у этих двух заболеваний общие факторы риска, такие как курение в анамнезе, мужской пол и возраст, однако эта связь все же представляется более сложной. Некоторые исследования показали, что оба заболевания имеют сходные патогенетические механизмы, проливая свет на некоторые неизвестные аспекты патогенеза ИЛФ. Эти сходства были подчеркнуты Vancheri и соавт., которые показали, что ИЛФ и РЛ объединяют специфические эпигенетические и генетические изменения, извращенная реакция на регуляторные сигналы, аномальная экспрессия микроРНК и активация специфических сигнальных путей [23, 24].
Среди разных групп пациентов с ИЛФ распространенность РЛ колеблется от 3% до 48%. Тем не менее, общая заболеваемость имеет тенденцию к увеличению с течением времени и была оценена в 3,3%, 15,4% и 54,7% соответственно через 1,5 и 10 лет [25] после постановки диагноза ИЛФ, еще более высокая заболеваемость была отмечена у пациентов с синдромом сочетания фиброза и эмфиземы легких [26, 27]. Наиболее часто встречающимся гистологическим типом рака являются плоскоклеточный рак и аденокарцинома. Они обычно проявляются в виде узелков, развивающихся вблизи фиброзных областей [28–30]. В различных исследованиях было четко установлено влияние РЛ на прогноз ИЛФ. Выживаемость заметно снижается с медианой 19–38,7 мес. у пациентов с РЛ по сравнению со медианой 48–63,9 мес. у пациентов с ИЛФ без РЛ (ВР 2,9–5) [3, 4]. Лечение данных пациентов одинаково сложно из-за недостаточного опыта и отсутствия эффективных терапевтических возможностей. На ранних стадиях может рассматриваться вариант хирургической резекции, однако риск обострения, связанного с операцией, колеблется между 7% и 32% и является значительным [31–33]. Более того, исследования показали, что химиотерапия и лучевая терапия могут одинаково подвергать пациентов сравнительному риску.
Таким образом, плохой прогноз и отсутствие эффективных методов терапии делают РЛ одной из наиболее значительных сопутствующих ИЛФ патологий и, в то же время, одной самых значительных трудностей для клинициста при лечении ИЛФ.
5. Эмфизема
Эмфизема легких у пациентов с ИЛФ обнаруживается не реже чем в 8-51% случаев. Интересно, что у пациентов с этой комбинацией есть некоторые особенности. Обычно это мужчины с многолетним анамнезом курения, с сохраненным объемом легких на фоне снижения DLCO, низким уровнем кислорода в крови в покое и сниженной толерантностью к физической нагрузке. В 2005 году Cottin определил, что эти признаки являются частью специфического синдрома, называемого «синдромом сочетания фиброза и эмфиземы легких» (CPFE) [34].
На сегодняшний день причина сочетания эмфиземы и фиброза легких неясна и, конечно, не может объясняться только анамнезом курения. Исследования на животных моделях продемонстрировали потенциальную патогенную роль сурфактантного белка D, фактора некроза опухолей α, интерлейкина-1β и эластазы нейрофилов [35–38]. Тем не менее, эти результаты должны быть подтверждены у людей. Более того, дефект только одного сигнального пути не может полностью объяснить развитие этого синдрома, который, вероятно, вызван сочетанием нескольких факторов.
Пациенты с CPFE демонстрируют очень плохую выживаемость в диапазоне от 2,1 до 8,5 лет. Однако вопрос о том, является ли прогноз пациентов с CPFE по сравнению с ИЛФ более негативным, все еще неясен из-за противоречивых данных. Kurashima и соавт. обнаружили значительно более низкую выживаемость в когорте 129 пациентов с CPFE по сравнению с 233 пациентами с ИЛФ (7,5 лет против 8,5 лет; p = 0,0472) [39]. Подобные результаты были также представлены в исследовании Mejìa и соавт. (25 месяцев против 24 месяцев; р = 0,01) [40]. В противовес этим данным, другие исследования (Ryerson и соавт.) описали несущественную разницу в смертности пациентов с этими двумя заболеваниями (ВР 1,14, 95% ДИ 0,61–2,13; р = 0,69) [41].
Также известно, что пациенты с CPFE часто страдают от тяжелых осложнений. Было показано, что ИЛФ и эмфизема легких являются независимыми факторами риска развития РЛ. Поэтому его распространенность среди пациентов с CPFE выше, чем среди пациентов с ИЛФ, в диапазоне от 35,8% до 46,8% [26, 42]. Как уже было описано в предыдущем разделе, наличие у пациентов РЛ неизбежно значительно снижает их выживаемость. Вторым серьезным осложнением синдрома CPFE является ЛГ с невероятно высокой распространенностью - от 47% до 90% [43, 44]. Как и в случае с РЛ, наличие данного осложнения сильно влияет на прогноз, что приводит к ожидаемой однолетней выживаемости равной 60%.
В настоящее время не существует специальных методов лечения синдрома CPFE, потому что никакие специальные испытания до сих пор не были разработаны. Предположительно, и пирфенидон, и нинтеданиб могут способствовать замедлению естественного развития процесса, как и при ИЛФ. Тем не менее, из-за отсутствия данных рандомизированных клинических исследований (РКИ) принципы лечения фактически основаны на мнении экспертов и общих профилактических мерах, таких как прекращение курения, использование кислородотерапии и реабилитации.
6. Гастроэзофагеальный рефлюкс (ГЭРБ)
Частота диагностирования ГЭРБ у пациентов с ИЛФ широко варьирует от 0% до 94% [45]. Тем не менее, несмотря на то, что эта связь была достоверно установлена, остается неясным, играет ли этот механизм патогенную роль в возникновении ИЛФ и если да, то каким образом. Было высказано предположение, что наличие ГЭРБ и последующая микроаспирация, вызывающая повторное повреждение альвеолярных эпителиальных клеток, приводит к патологическому процессу заживления и, в конечном итоге, к фиброзу легких.
Исходя из этой гипотезы, следует ожидать положительного эффекта лечения ГЭРБ в отношении замедления прогрессирования заболевания или снижения смертности. К сожалению, конкретных РКИ по данному вопросу не было разработано, а уже имеющихся данных недостаточно, и они весьма противоречивы. Первые данные получены из серии исследований 4 случаев, когда пациенты получали антациды (Raghu и соавт.) и 14 случаев, когда пациентам была проведена фундопликация (Linden и соавт.).
В обеих группах у пациентов определялась стабильность функции легких в течение периода наблюдения [46, 47]. Более последовательные результаты получены в исследовании Lee и соавт., где анализ группы из 204 пациентов выявил, что использование препаратов для лечения ГЭРБ было независимым предиктором более продолжительного выживания у пациентов с ИЛФ [48]. В последующем ретроспективном анализе трех РКИ тот же автор продемонстрировал, что антацидное лечение определяло более медленное снижение функции легких и снижение частоты обострений [49]. Тем не менее, более поздний ретроспективный анализ, в котором оценивались 624 пациента с ИЛФ, пришедших из испытаний CAPACITY и ASCEND, не подтвердил предыдущее предположение об отсутствии улучшения результатов после антацидной терапии [50]. В недавней статье Raghu и соавт. предоставили новую интересную информацию о роли лапароскопической хирургии, которая была признана безопасной и хорошо переносимой. Это может открыть путь новым крупным рандомизированным исследованиям, изучающим, действительно ли данный вариант лечения необходим в этой популяции [64].
Таким образом, доказательства патогенной роли ГЭРБ при ИЛФ на самом деле неясны, как и неясна возможная полезность антацидного лечения. В настоящее время происходит отбор пациентов для новых текущих испытаний для предоставления возможных ответов на данные вопросы.
7. Апноэ во сне
У пациентов, страдающих ИЛФ, также был выявлен высокий уровень апноэ во сне, от 59% до 88% [51–53]. Степень связанности этих состояний до сих пор неясна. Вполне вероятно, что рестриктивные заболевания легких, такие как ИЛФ, могут снизить тонус верхних дыхательных путей, увеличивая их сжимаемость. Кроме того, по-видимому, при ИЛФ часто встречаются изменения в дыхательном центре, сопутствующие развитию синдрома апноэ во сне. В нескольких исследованиях подчеркивалось, что ночная десатурация связана с худшим прогнозом при ИЛФ [54–56]. Совсем недавно Bosi и соавт. подтвердили эти результаты и продемонстрировали четкую связь между наличием синдрома апноэ во сне и прогрессированием заболевания [57]. Учитывая это, пациентам с ИЛФ, у которых встречается апноэ во сне, следует предлагать лечение постоянным положительным давлением. Тем не менее, данные об эффективности этого лечения для снижения прогрессирования заболевания и смертности по-прежнему отсутствуют.
8. Депрессия
ИЛФ является тяжелым заболеванием, поэтому у таких пациентов часто встречаются депрессия и тревога в диапазоне от 24,3% до 49,2% [58, 59]. Исследования также продемонстрировали прямую корреляцию между этим явлением и выраженностью одышки, кашля и снижением функции легких [54, 60, 61]. Тем не менее, даже несмотря на то, что распространенность депрессии при ИЛФ хорошо установлена, данных о ее влиянии на исход мало. Lee и соавт. оценили этот аспект в проспективном исследовании, демонстрирующем отсутствие значительных различий в показателях выживаемости между пациентами с депрессией и без нее [62]. И наоборот, отрицательное, но не существенное влияние на выживаемость было также описано в ретроспективном исследовании Kreuter (ВР 2.01 p = 0.23) [3]. Следовательно, для оценки этого аспекта ИЛФ необходимы более обширные и точные данные.
9. Заключение
ИЛФ действительно является парадигматическим заболеванием, характеризующимся непредсказуемым клиническим течением и очень высокой смертностью. У пациентов с ИЛФ часто встречаются сопутствующие заболевания, которые могут по-разному влиять на прогноз. Однако, за исключением наиболее значимых факторов, как РЛ, ЛГ и сердечно-сосудистые заболевания, данные об их воздействии все еще немногочисленны и иногда противоречивы, вероятно, из-за оценки небольших когорт и различий в определениях каждой коморбидности. Учитывая это, сопутствующие заболевания ИЛФ должны изучаться систематически, поскольку ранняя диагностика и соответствующее лечение могут помочь в оптимизации терапии и улучшении качества жизни. Необходимы новые, крупные и целевые исследования, чтобы лучше оценить, как сопутствующие заболевания влияют на прогноз и как их лечение может влиять на прогрессирование заболевания и выживаемость.
Литература
- [1] G. Raghu, D. Weycker, J. Edelsberg, W.Z. Bradford, G. Oster, Incidence and pre- valence of idiopathic pulmonary fibrosis, Am. J. Respir. Crit. Care Med. 174 (2006) 810–816.
- [2] G. Raghu, H.R. Collard, J.J. Egan, F.J. Martinez, J. Behr, K.K. Brown, T.V. Colby, J.F. Cordier, K.R. Flaherty, J.A. Lasky, D.A. Lynch, J.H. Ryu, J.J. Swigris, A.U. Wells, J. Ancochea, D. Bouros, C. Carvalho, U. Costabel, M. Ebina, D.M. Hansell, T. Johkoh, D.S. Kim, T.E. Jr King, Y. Kondoh, J. Myers, N.L. Müller, A.G. Nicholson, L. Richeldi, M. Selman, R.F. Dudden, B.S. Griss, S.L. Protzko, H.J. Schünemann, ATS/ERS/JRS/ALAT Committee on Idiopathic Pulmonary Fibrosis, an official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management, Am. J. Respir. Crit. Care S.E. Torrisi et al. Pulmonary Pharmacology & Therapeutics 53 (2018) 6–11 Med. 183 (2011) 788–824.
- [3] M. Kreuter, S. Ehlers-Tenenbaum, K. Palmowski, J. Bruhwyler, U. Oltmanns, T. Muley, C.P. Heussel, A. Warth, M. Kolb, F.J. Herth, Impact of comorbidities on mortality in patients with idiopathic pulmonary fibrosis, PLoS One 11 (2016) e0151425.
- [4] R.B. Hubbard, C. Smith, I. Le Jeune, J. Gribbin, A.W. Fogarty, The association be- tween idiopathic pulmonary fibrosis and vascular disease: a population-based study, Am. J. Respir. Crit. Care Med. 178 (2008) 1257–1261.
- [5] B.F. Sode, M. Dahl, S.F. Nielsen, B.G. Nordestgaard, Venous thromboembolism and risk of idiopathic interstitial pneumonia: a nationwide study, Am. J. Respir. Crit. Care Med. 181 (2010) 1085–1092.
- [6] D.B. Sprunger, A.L. Olson, T.J. Huie, E.R. Fernandez-Perez, A. Fischer, J.J. Solomon, K.K. Brown, J.J. Swigris, Pulmonary fibrosis is associated with an elevated risk of thromboembolic disease, Eur. Respir. J. 39 (2012) 125–132.
- [7] V. Navaratnam, A.W. Fogarty, T. McKeever, N. Thompson, G. Jenkins, S.R. Johnson, G. Dolan, M. Kumaran, K. Pointon, R.B. Hubbard, Presence of a prothrombotic state in people with idiopathic pulmonary fibrosis: a population- based case-control study, Thorax 69 (2014) 207–215.
- [8] S.D. Nathan, A. Basavaraj, C. Reichner, O.A. Shlobin, S. Ahmad, J. Kiernan, N. Burton, S.D. Barnett, Prevalence and impact of coronary artery disease in idiopathic pulmonary fibrosis, Respir. Med. 104 (2010) 1035–1041.
- [9] C. Hyldgaard C, O. Hilberg, E. Bendstrup, How does comorbidity influence survival in idiopathic pulmonary fibrosis? Respir. Med. 108 (2014) 647–653.
- [10] I. Noth, K.J. Anstrom, S.B. Calvert, J. De Andrade, K.R. Flaherty, C. Glazer, R.J. Kaner, M.A. Olman, A placebo-controlled randomized trial of warfarin in idiopathic pulmonary fibrosis, Am. J. Respir. Crit. Care Med. 186 (2012) 88–95.
- [11] N. Galie, M. Humbert, J.L. Vachiery, S. Gibbs, I. Lang, A. Torbicki, G. Simonneau, A. Peacock, A. Vonk Noordegraaf, M. Beghetti, A. Ghofrani, M.A. Gomez Sanchez, G. Hansmann, W. Klepetko, P. Lancellotti, M. Matucci, T. McDonagh, L.A. Pierard, P.T. Trindade, M. Zompatori, M. Hoeper MESC Scientific Document Group, 2015 ESC/ERS guidelines for the diagnosis and treatment of pulmonary hyper- tension: the joint task force for the diagnosis and treatment of pulmonary hypertension of the European society of cardiology (ESC) and the European respiratory society (ERS): endorsed by: association for European paediatric and congenital cardiology (AEPC), international society for heart and lung transplantation (ISHLT), Eur. Heart J. 37 (2016) 67–119.
- [12] H.R. Collard, A.J. Ward, S. Lanes, D. Cortney Hayflinger, D.M. Rosenberg, E. Hunsche, Burden of illness in idiopathic pulmonary fibrosis, J. Med. Econ. 15 (2012) 829–835.
- [13] H.F. Nadrous, P.A. Pellikka, M.J. Krowka, K.L. Swanson, N. Chaowalit, P.A. Decker, J.H. Ryu, Pulmonary hypertension in patients with idiopathic pulmonary fibrosis, Chest 128 (2005) 2393–2399.
- [14] G. Raghu, V.C. Amatto, J. Behr, S. Stowasser, Comorbidities in idiopathic pul- monary fibrosis patients: a systematic literature review, Eur. Respir. J. 46 (2015) 1113–1130.
- [15] C.J. Lettieri, S.D. Nathan, S.D. Barnett, S. Ahmad, A.F. Shorr, Prevalence and out- comes of pulmonary arterial hypertension in advanced idiopathic pulmonary fibrosis, Chest 129 (2006) 746–752.
- [16] D. Weill, C. Benden, P.A. Corris, J.H. Dark, R.D. Davis, S. Keshavjee, D.J. Lederer, M.J. Mulligan, G.A. Patterson, L.G. Singer, G.I. Snell, G.M. Verleden, M.R. Zamore, A.R. Glanville, A consensus document for the selection of lung transplant candi- dates: 2014—an update from the pulmonary transplantation council of the inter- national society for heart and lung transplantation, J. Heart Lung Transplant. 34 (2015) 1–15.
- [17] T.E. Jr King, K.K. Brown, G. Raghu, R.M. du Bois, D.A. Lynch, F. Martinez, D. Valeyre, I. Leconte, A. Morganti, S. Roux, J. Behr, BUILD-3: a randomized, controlled trial of bosentan in idiopathic pulmo- nary fibrosis, Am. J. Respir. Crit. Care Med. 184 (2011) 92–99.
- [18] G. Raghu, J. Behr, K.K. Brown, J.J. Egan, S.M. Kawut, K.R. Flaherty, F.J. Martinez, S.D. Nathan, A.U. Wells, H.R. Collard, U. Costabel, L. Richeldi, J. de Andrade, N. Khalil, L.D. Morrison, D.J. Lederer, L. Shao, X. Li, P.S. Pedersen, A.B. Montgomery, J.W. Chien, T.G. O'Riordan, ARTEMIS-IPF Investigators, Treatment of idiopathic pulmonary fibrosis with ambrisentan: a parallel, randomized trial, Ann. Intern. Med. 158 (2013) 641–649.
- [19] G. Raghu, R. Million-Rousseau, A. Morganti, L. Perchenet, J. Behr, M.S. Group, Macitentan for the treatment of idiopathic pulmonary fibrosis: the randomised controlled MUSIC trial, Eur. Respir. J. 42 (2013) 1622–1632.
- [20] T.J. Corte, G.J. Keir, K. Dimopoulos, L. Howard, P.A. Corris, L. Parfitt, C. Foley, M. Yanez-Lopez, D. Babalis, P. Marino, T.M. Maher, E.A. Renzoni, L. Spencer, C.A. Elliot, S.S. Birring, K. O'Reilly, M.A. Gatzoulis, A.U. Wells, S.J. WortBPHIT Study Group, Bosentan in pulmonary hypertension associated with fibrotic idiopathic interstitial pneumonia, Am. J. Respir. Crit. Care Med. 190 (2014) 208–217.
- [21] D.A. Zisman, M. Schwarz, K.J. Anstrom, H.R. Collard, K.R. Flaherty, G.W. Hunninghake, A controlled trial of sildenafil in advanced idiopathic pulmonary fibrosis, N. Engl. J. Med. 363 (2010) 620–628.
- [22] M.K. Han, D.S. Bach, P.G. Hagan, E. Yow, K.R. Flaherty, G.B. Toews, K.J. Anstrom, F.J. Martinez, IPFnet Investigators, Sildenafil preserves exercise capacity in patients with idiopathic pulmonary fibrosis and right-sided ventricular dysfunction, Chest 143 (2013) 1699–1708.
- [23] C. Vancheri, Common pathways in idiopathic pulmonary fibrosis and cancer, Eur. Respir. Rev. 22 (2013) 265–272.
- [24] C. Vancheri, M. Failla, N. Crimi, G. Raghu, Idiopathic pulmonary fibrosis: a disease with similarities and links to cancer biology, Eur. Respir. J. 35 (2010) 496–504.
- [25] Y. Ozawa, T. Suda, T. Naito, N. Enomoto, D. Hashimoto, T. Fuijisawa, Y. Nakamura, N. Inui, H. Nakamura, K. Chida, Cumulative incidence of and predictive factors for lung cancer in IPF, Respirology 14 (2009) 723–728.
- [26] K. Usui, C. Tanai, Y. Tanaka, H. Noda, T. Ishihara, The prevalence of pulmonary fibrosis combined with emphysema in patients with lung cancer, Respirology 16 (2011) 326–331.
- [27] H.J. Koo, K.H. Do, J.B. Lee, S. Alblushi, S.M. Lee, Lung cancer in combined pulmonary fibrosis and emphysema: a systematic review and meta-analysis, PLoS One 11 (2016) e0161437.
- [28] T. Karampitsakos, V. Tzilas, R. Tringidou, P. Steiropoulos, V. Aidinis, S.A. Papiris, D. Bouros, A. Tzouvelekis, Lung cancer in patients with idiopathic pulmonary fibrosis, Pulm. Pharmacol. Therapeut. 45 (2017) 1–10.
- [29] A. Calio, V. Lever, A. Rossi, E. Gilioli, M. Brunelli, A. Dubini, S. Tomassetti, S. Piciucchi, A. Nottegar, G. Rossi, M. Kambouchner, A. Cancellieri, M. Barbareschi, G. Pelosi, C. Doglioni, A. Cavazza, R. Carella, P. Graziano, B. Murer, V. Poletti, M. Chilosi, Increased frequency of bronchiolar histotypes in lung carcinomas associated with idiopathic pulmonary fibrosis, Histopathology 71 (2017) 725–735.
- [30] S. Tomassetti, C. Gurioli, J.H. Ryu, P.A. Decker, C. Ravaglia, P. Tantalocco, M. Buccioli, S. Piciucchi, N. Sverzellati, A. Dubini, G. Gavelli, M. Chilosi, V. Poletti, The impact of lung cancer on survival of idiopathic pulmonary fibrosis, Chest 147 (2015) 157–164.
- [31] K. Kushibe, T. Kawaguchi, M. Takahama, M. Kimura, T. Tojo, S. Taniguchi, Operative indications for lung cancer with idiopathic pulmonary fibrosis, Thorac. Cardiovasc. Surg. 55 (2007) 505–508.
- [32] T. Omori, M. Tajiri, T. Baba, T. Ogura, T. Iwasawa, K. Okudela K, T. Takemura, M.S. Oba, T. Maehara, H. Nakayama, M. Tsuboi, M. Masuda, Pulmonary resection for lung cancer in patients with idiopathic interstitial pneumonia, Ann. Thorac. Surg. 100 (2015) 954–960.
- [33] A. Watanabe, T. Higami, S. Ohori, T. Koyanagi, S. Nakashima, T. Mawatari, Is lung cancer resection indicated in patients with idiopathic pulmonary fibrosis? J. Thorac. Cardiovasc. Surg. 136 (2008) 1357–1363.
- [34] V. Cottin, H. Nunes, P.Y. Brillet, P. Delavan, G. Devouassoux, I. Tillie-Leblond, D. Israel-Biet, I. Court-Fortune, D. Valeyre, J.F. Cordier, Groupe d'Etude et de Recherche sur les Maladies Orphelines Pulmonaires (GERM O P), Combined pulmonary fibrosis and emphysema: a distinct underrecognised entity, Eur. Respir. J. 26 (2005) 586–593.
- [35] S.E. Wert, M. Yoshida, A.M. LeVine AM, M. Ikegami, T. Jones, G.F. Ross, J.H. Fisher, T.R. Korfhagen, J.A. Whitsett, Increased metalloproteinase activity, oxidant production, and emphysema in surfactant protein D gene-inactivated mice, Proc. Natl. Acad. Sci. U.S.A. 97 (2000) 5972–5977.
- [36] M. Fujita, R.J. Mason, C. Cool, J.M. Shannon, N. Hara, K.A. Fagan, Pulmonary hypertension in TNF-a-overexpressing mice is associated with decreased VEGF gene expression, J. Appl. Physiol. 93 (2002) 2162–2170.
- [37] L.K. Lundblad, J. Thompson-Figueroa, T. Leclair, M.J. Sullivan, M.E. Poynter, C.G. Irvin, J.H. Bates, Tumor necrosis factor-a overexpression in lung disease: a single cause behind a complex phenotype, Am. J. Respir. Crit. Care Med. 171 (2005) 1363–1370.
- [38] U. Lappalainen, J.A. Whitsett, S.E. Wert, J.W. Tichelaar, K. Bry, Interleukin-1b causes pulmonary inflammation, emphysema, and airway remodeling in the adult murine lung, Am. J. Respir. Cell Mol. Biol. 32 (2005) 311–318.
- [39] K. Kurashima, N. Takayanagi, N. Tsuchiya, T. Kanauchi, M. Ueda, T. Hoshi, Y. Miyahara, Y. Sugita, The effect of emphysema on lung function and survival in patients with idiopathic pulmonary fibrosis, Respirology 15 (2010) 843–848.
- [40] M. Mejia, G. Carrillo, J. Rojas-Serrano, A. Estrada, T. Suarez, D. Alonso, E. Barrientos, M. Gaxiola, C. Navarro, M. Selman, Idiopathic pulmonary fibrosis and emphysema: decreased survival associated with severe pulmonary arterial hypertension, Chest 136 (2009) 10–15.
- [41] C.J. Ryerson, T. Hartman, B.M. Elicker, B. Ley, J.S. Lee, M. Abbritti, K.D. Jones, T.E. Jr King, J. Ryu, H.R. Collard, Clinical features and outcomes in combined pulmonary fibrosis and emphysema in idiopathic pulmonary fibrosis, Chest 144 (2013) 234–240.
- [42] N. Kwak, C.M. Park, J. Lee, Y.S. Park, S.M. Lee, J.J. Yim, C.G. Yoo, Y.W. Kim, S.K. Han, C.H. Lee, Lung cancer risk among patients with combined pulmonary fibrosis and emphysema, Respir. Med. 108 (2014) 524–530.
- [43] W. Seeger, Y. Adir, J.A. Barberà, H. Champion, J.G. Coghlan, V. Cottin, T. De Marco, N. Galiè, S. Ghio, S. Gibbs, F.J. Martinez, M.J. Semigran, G. Simonneau, A.U. Wells, J.L. Vachiéry, Pulmonary hypertension in chronic lung diseases, J. Am. Coll. Cardiol. 62 (2013) D109–D116.
- [44] A. Caminati, R. Cassandro, S. Harari, Pulmonary hypertension in chronic interstitial lung diseases, Eur. Respir. Rev. 22 (2013) 292–301.
- [45] C. Vancheri, Gastro-oesophageal reflux and idiopathic pulmonary fibrosis, Sarcoidosis Vasc, Diffuse Lung Dis 30 (suppl 1) (2013) 37–39.
- [46] G. Raghu, S.T. Yang, C. Spada, J. Hayes, C.A. Pellegrini, Sole treatment of acid gastroesophageal reflux in idiopathic pulmonary fibrosis: a case series, Chest 129 (2006) 794–800.
- [47] P.A. Linden, R.J. Gilbert, B.Y. Yeap, K. Boyle, A. Deykin, M.T. Jaklitsch, .J. Sugarbaker, R. Bueno, Laparoscopic fundoplication in patients with end-stage lung disease awaiting transplantation, J. Thorac. Cardiovasc. Surg. 131 (2006) 438–446.
- [48] J.S. Lee, J.H. Ryu, B.M. Elicker, C.P. Lydell, K.D. Jones, P.J. Wolters, T.E. Jr King, H.R. Collard, Gastroesophageal reflux therapy is associated with longer survival in patients with idiopathic pulmonary fibrosis, Am. J. Respir. Crit. Care Med. 184 (2011) 1390–1394.
- [49] J.S. Lee, H.R. Collard, K.J. Anstrom KJ, F.J. Martinez, I. Noth, R.S. Roberts, E. Yow, G. Raghu, IPFnet Investigators, Anti-acid treatment and disease progression in idiopathic pulmonary fibrosis: an analysis of data from three randomised controlled trials, Lancet Respir. Med. 1 (2013) 369–376.
- [50] M. Kreuter, W. Wuyts, E. Renzoni, D. Koschel, T.M. Maher, M. Kolb, D. Weycker, P. Spagnolo, K.U. Kirchgaessler, F.J. Herth, U. Costabel, Antacid therapy and S.E. Torrisi et al. Pulmonary Pharmacology & Therapeutics 53 (2018) 6–11 disease outcomes in idiopathic pulmonary fibrosis: a pooled analysis, Lancet Respir. Med. 4 (2016) 381–389.
- [51] A. Pihtili, Z. Bingol, E. Kiyan, C. Cuhadaroglu, H. Issever, Z. Gulbaran, Obstructive sleep apnea is common in patients with interstitial lung disease, Sleep Breath. 17 (2013) 1281–1288.
- [52] C. Mermigkis, E. Stagaki, S. Tryfon, S. Schiza, A. Amfilochiou, V. Polychronopoulos, P. Panagou, N. Galanis, A. Kallianos, D. Merkigkis, A. Kopanakis, G. Varouchakis, F. Kapsimalis, D. Bouros, How common is sleep-disordered breathing in patients with idiopathic pulmonary fibrosis? Sleep Breath. 14 (2010) 387–390.
- [53] L.H. Lancaster, W.R. Mason, J.A. Parnell, T.W. Rice, J.E. Loyd, A.P. Milstone, H.R. Collard, B.A. Malow, Obstructive sleep apnea is common in idiopathic pulmonary fibrosis, Chest 136 (2009) 772–778.
- [54] K. Pink, J. Boylan, B. Hope-Gill, An observational study of anxiety and depression in idiopathic pulmonary fibrosis, Adv. Res. 2 (2014) 320–331.
- [55] L. Kolilekas, E. Manali, K.A. Vlami, P. Lyberopoulos, C. Triantafillidou, K. Kagouridis, K. Baou, S. Gyftopoulos, K.N. Vougas, A. Karakatsani, M. Alchanatis, S. Papiris, Sleep oxygen desaturation predicts survival in idiopathic pulmonary fibrosis, J. Clin. Sleep Med. 9 (2013) 593–601.
- [56] T.J. Corte, S.J. Wort, S. Talbot, P.M. Macdonald, D.M. Hansel, M. Polkey, E. Renzoni, T.M. Maher, A.G. Nicholson, A.U. Wells, Elevated nocturnal desaturation index predicts mortality in interstitial lung disease, Sarcoidosis Vasc, Diffuse Lung Dis 29 (2012) 41–50.
- [57] M. Bosi, G. Milioli, F. Fanfulla, S. Tomassetti, J.R. Ryu, L. Parrino, S. Riccardi, A. Melpignano, A.E. Vaudano, C. Ravaglia, P. Tantalocco, A. Rossi, V. Poletti, OSA and prolonged oxygen desaturation during sleep are strong predictors of poor outcome in IPF, Lung 195 (2017) 643–651.
- [58] A.A. Akhtar, M.A. Ali, R.P. Smith, Depression in patients with idiopathic pulmonary fibrosis, Chron. Respir. Dis. 10 (2013) 127–133.
- [59] A. Amin, M. Zedan, K. Halima, A. Ismail, Depression in patients with idiopathic pulmonary fibrosis, AAMJ (Alpe Adria Microbiol. J.) 12 (2014) 195–211.
- [60] C.J. Ryerson, P.A. Arean, J. Berkeley, V.L. Carrieri-Kohlman, S.Z. Pantilat, C.S. Landefeld, H.R. Collard, Depression is a common and chronic comorbidity in patients with interstitial lung disease, Respirology 17 (2012) 525–532.
- [61] A.E. Holland, J.F. Fiore, E.C. Bell, N. Goh, G. Westall, K. Symons, L. Dowman, I. Glaspole, Dyspnoea and comorbidity contribute to anxiety and depression in interstitial lung disease, Respirology 19 (2014) 1215–1221.
- [62] Y.J. Lee, S.M. Choi, Y.J. Lee, Y.J. Cho, H.I. Yoon, J.H. Lee J-H, C.T. Lee, J.S. Park, Clinical impact of depression and anxiety in patients with idiopathic pulmonary fibrosis, PLoS One 12 (2017) e0184300.
- [63] S.E. Torrisi, M. Pavone, A. Vancheri, C. Vancheri, When to start and when to stop antifibrotic therapies, Eur. Respir. Rev. 26 (2017), doi.org pii: 170053.
- [64] G. Raghu, C.A. Pellegrini, E. Yow, K.R. Flaherty, K. Meyer, I. Noth, M.B. Scholand, J. Cello, L.A. Ho, S. Pipavath, J.S. Lee, J. Lin, J. Maloney, F.J. Martinez, E. Morrow, M.G. Patti, S. Rogers, P.J. Wolters, R. Yates, K.J. Anstrom, H.R. Collard, Laparoscopic anti-reflux surgery for the treatment of idiopathic pulmonary fibrosis (WRAP-IPF): a multicentre, randomised, controlled phase 2 Trial, Lancet Respir. Med. 6 (2018) 707–714. 11.





