4533
29 Ноября 2021
Авторское право © 2019, William W. Siljan, Jan C. Holter, Annika E. Michelsen, Ståle H. Nymo, Trine Lauritzen, Kjersti Oppen, Einar Husebye, Thor Ueland, Tom E. Mollnes, Pål Aukrust, Lars Heggelund (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Уильям В. Сильян, Ян К. Холтер, Анника Э. Михельсен, Столе Х. Нимо, Трине Лауритцен, Кьерсти Оппен, Эйнар Хусебье, Тор Уэланд, Том Э. Моллнес, Пол Аукруст, Ларс Хеггелунд
ERJ ...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Уильям В. Сильян, Ян К. Холтер, Анника Э. Михельсен, Столе Х. Нимо, Трине Лауритцен, Кьерсти Оппен, Эйнар Хусебье, Тор Уэланд, Том Э. Моллнес, Пол Аукруст, Ларс Хеггелунд
ERJ ...
Авторское право © 2019, William W. Siljan, Jan C. Holter, Annika E. Michelsen, Ståle H. Nymo, Trine Lauritzen, Kjersti Oppen, Einar Husebye, Thor Ueland, Tom E. Mollnes, Pål Aukrust, Lars Heggelund (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Уильям В. Сильян, Ян К. Холтер, Анника Э. Михельсен, Столе Х. Нимо, Трине Лауритцен, Кьерсти Оппен, Эйнар Хусебье, Тор Уэланд, Том Э. Моллнес, Пол Аукруст, Ларс Хеггелунд
ERJ Open Res. 2019 Feb; 5(1): 00014-2019.
Аннотация
Биомаркеры могут помогать в принятии клинических решений по поводу антимикробной терапии и прогнозировании течения внебольничной пневмонии (ВБП). Мы измерили уровни С-реактивного белка в сыворотке крови, прокальцитонина (ПКТ) и кальпротектина, а также уровни пентраксина плазмы 3 (ПTХ3) и пресепсина, количество лейкоцитов в цельной крови в трех временных точках, изучили их связь с микробной этиологией и неблагоприятными клиническими исходами при ВБП.
Методы
Образцы крови были получены при госпитализации, клинической стабилизации и 6-недельном последующем наблюдение у 267 госпитализированных взрослых с ВБП. Неблагоприятный краткосрочный исход определялся как госпитализация в отделение интенсивной терапии и смерть в течение ближайших 30 дней. Долгосрочный исход оценивался как 5-летняя смертность от всех причин.
Результаты
Пиковые уровни всех биомаркеров наблюдались при госпитализации. Повышенные уровни С-реактивного белка, ПКТ и кальпротектина были связаны с бактериальной этиологией ВБП, а повышенные уровни ПКТ, РТХ3 и пресепсина - с неблагоприятным краткосрочным исходом. В одномерных и многомерных регрессионных моделях лейкоциты и кальпротектин при 6-недельном последующем наблюдении были предикторами 5-летней смертности от всех причин.
Выводы
Кальпротектин выступает как потенциальный ранний маркер бактериальной этиологии ВБП и предиктор 5-летней смертности от всех причин при ВБП, тогда как ПКТ, РТХ3 и пресепсин могут предсказать краткосрочный исход.
Введение
Внебольничная пневмония (ВБП) по-прежнему относится к числу распространенных инфекционных заболеваний, обладающих высокими показателями частоты осложнений и смертности в краткосрочном и долгосрочном периоде [1]. Несмотря на профилактические меры, в будущем ожидается рост заболеваемости [2]. Для оптимального лечения ВБП и эффективного расходования финансовых средств здравоохранения приоритетным является раннее выявление причинного агента или агентов, ответственных за тяжесть заболевания и вероятность неблагоприятного клинического исхода. Определение биомаркеров с учетом клинической оценки тяжести ВБП способно дать дополнительную информацию о течении заболевания и о дифференцировке ВБП вирусной и бактериальной этиологии. В настоящее время биомаркеры, которые призваны дифференцировать бактериальный, вирусный или вирусно-бактериальный характер ВБП, не обладают ни достаточной для проведения патоген-специфической терапии точностью [3], ни преимуществами в построении краткосрочного и долгосрочного прогнозов по сравнению со шкалой клинической оценки тяжести ВБП. [4, 5]. Внести положительные изменения в диагностику и лечение ВБП способны новые неинвазивные методики, которые могут обеспечить более эффективную терапию, исключить нерациональное назначение антибиотиков и улучшить показатели краткосрочных исходов [6]. Благодаря таким биомаркерам можно определить пациентов с риском неблагоприятного исхода в долгосрочной перспективе, более точно обозначить подгруппы перенесших ВБП пациентов, требующих наиболее пристального внимания.
Уровень лейкоцитов (WBC) и относящийся к семейству пентраксинов С-реактивный белок (СРБ) – широко применяемые биомаркеры воспаления, которые обладают низкой и средней степени значимости прогностической способностью в отношении определения микробных этиологических факторов и оценки тяжести течения ВБП [7–9]. Прокальцитонин (ПКТ), предшественник кальцитонина, считается более пригодным для выявления бактериальной этиологии и прогноза ВБП, по сравнению с двумя маркерами, упомянутыми выше [4, 7, 10]. Кроме того, на его основе можно контролировать длительность приема антибиотиков при ВБП [11]. Помимо этого, растворимый подтип CD14 (sCD14), известный как пресепсин, обладает по сравнению с WBC, СРБ и ПКТ большей специфичностью к системным инфекциям. Пресепсин может использоваться в качестве возможного предиктора тяжести заболевания и риска летального исхода от ВБП в краткосрочном периоде [12, 13]. Не так давно открыты перспективные биомаркеры системной инфекции острой фазы: нейтрофил-ассоциированный маркер кальпротектин и длинный пентраксин 3 (РТХ3), отражающие местное и системное воспаление. Однако их использование в контексте ВБП пока достаточно не изучено [16, 17].
Ранее мы сообщали о высокой частоте выявления микробных этиологических факторов у строго отобранной когорты из 267 госпитализированных взрослых пациентов с ВБП [18]. Целью нашего исследование является определение уровня лейкоцитов, CPБ и ПКТ, как основных биомаркеров воспаления, а также кальпротектина, РТХ3 и пресепсина в трех временных точках и изучение связи между этими биомаркерами и микробными агентами, а также краткосрочными и долгосрочными исходами ВБП.
Материалы и методы
Выборка и дизайн исследования
Исследование проведено в отделении неотложных состояний многопрофильном госпитале в клинике «Вестре Викен» в г. Драммене на юго-востоке Норвегии в период с 1 января 2008 года по 31 января 2011 года. Было отобрано в общей сложности 267 пациентов в возрасте ≥18 лет, последовательно поступивших в терапевтическое отделение с подозрением на пневмонию. В течение 48 часов больных обследовали для выявления критериев наличия ВБП: 1) появление нового инфильтрата на рентгенограмме органов грудной полости, 2) температура тела >38.0°C, измеренная ректально 3) наличие по крайней мере одного из следующих симптомов: кашель (сухой или с отхождением мокроты), одышка, боль за грудиной при дыхании, хрипы в легких или ослабленное дыхание. Пациенты не включались в исследование, если они были госпитализированы в предшествующие две недели, либо на рентгенограмме было выявлено неинфекционное поражение легких. Пациенты с иммуносупрессией (т.е. первичным иммунодефицитом, онкологическими заболеваниями и принимающие лекарства, считающиеся согласно определению HOLTER et al. иммуносупрессивными [19]) не исключались из исследования для отображения общей популяции больных, поступающих в данный госпиталь. После выписки пациентам рекомендовался амбулаторный прием через ∼6 недель, то есть в период конвалесцентной фазы ВБП. Все пациенты подписали добровольное информированное согласие на участие в исследовании. Исследование одобрено региональным этическим комитетом по вопросам медицины и здравоохранения юго-восточной Норвегии (за номером S-06266a). Комитет выдал разрешение на несоблюдение требования дачи согласия в случае смерти пациента (2012/467 А).
Сбор данных и определение понятий
Исходные данные и определения приведены в других публикациях [18, 19]. Демографические, клинические и лабораторные данные собирались в течение 48 часов от момента поступления, среднее ±СО время от поступления до включения в исследование составило 0,6±0,5 дней, 260 из 267 (97%) включены в течение 24 часов. Микробный этиологический фактор устанавливался при применении сочетания методик (микробиологического посева, серологии, антигенов в моче и ПЦР). В настоящем исследовании клиническая стабилизация оценивалась каждый день в течение первых 12 дней госпитализации, уровень СРБ и лейкоцитов определялся каждый второй день. Стабильность клинической картины оценивалась по следующим критериям (1 балл на каждый критерий): 1) отсутствие необходимости менять антибиотик в предшествующие 2 дня, 2) улучшение общего состояния, 2) утренняя температура тела, измеренная ректально <38,0°C и 4) снижение на >25% уровня СРБ и лейкоцитов. Стабилизация считалась достигнутой при ≥3 баллах.
Анализ крови
Анализ крови брали при поступлении, при стабилизации клинической картины и на амбулаторной приеме через 6 недель после выписки, сыворотка и плазма собирались в апирогенные вакуумные пробирки. Пробирки с образцами плазмы содержали EDTA в качестве антикоагулянта. Сыворотку и плазму выделяли из цельной крови в течение 60 минут при центрифугировании с ускорением 2000g в течение 12 минут с охлаждением и хранили в нескольких аликвотах при −80°C.
Определение уровня биомаркеров
Уровень СРБ сыворотки определялся при помощи турбидиметрии (Abbott Architect ci16200; Abbott Diagnostics, Эббот Парк, шт. Иллинойс, США), подсчет лейкоцитов проводили на автоматическом гематологическом анализаторе CELL-DYN 4000 (Abbott Diagnostics) и Advia 120 (Siemens Healthineers, г. Эрланген, Германия). Анализ сыворотки на ПКТ выполнялся методом хемилюминесцентного анализа (Advia Centaur BRAHMS PCT; Siemens Healthineers). Уровень кальпротектина сыворотки определялся методом ИФА (Calpro AS, Осло, Норвегия) на автоматическом ИФА-анализаторе (Dynex DS2 Automated ELISA System; Dynex Technologies Inc., г. Шантийи, шт. Виргиния, США). Уровень РТХ3 и пресепсина определялись с помощью коммерчески доступного сэндвич-ИФА (R&D Systems, г. Миннеаполис, штат Миннесота, США, и MyBioSource Inc., Сан-Диего, шт. Калифорния, США соответственно).
Оценка результатов
На основании микробиологического анализа выделены четыре группы пациентов, в зависимости от этиологии заболевания: 1) бактериальная пневмония, 2) вирусная пневмония, 3) вирусно-бактериальная пневмония и 4) неизвестная пневмония. Тяжесть пневмонии оценивалась по шкале CURB-65 (спутанность сознания, мочевина >7 ммоль/л−1, частота дыхательных движений ≥30/мин, артериальное давление < 90 мм рт. ст. (систолическое) или ≤60 мм рт. ст. (диастолическое), возраст ≥65 лет); пациенты с ≤2 баллами по CURB-65 отнесены к низкой группе риска, с ≥3 баллами к высокой [20]. Краткосрочный результат представлялся в виде комбинированной конечной точки – нахождение в отделении реанимации и интенсивной терапии (ОРИТ) и выживаемость в течение 30 дней. Долгосрочный результат оценивался по 5-летней общей летальности.
Статистический анализ
Качественные переменные представлены в виде n (%). Непрерывные переменные представлены в виде среднего значения ± СО для равномерно распределенных величин или медианы (межквартильный интервал) для ассиметричных данных. Разница в уровнях биомаркеров в разных периодах времени анализированы по критерию Краскела–Уоллиса и Фридмана для сравнений нескольких групп, и критерию Манна–Уитни и критерию Уилкоксона для связных выборок при сравнении между двумя группами. Корреляционный анализ между непрерывными переменами проводили с использованием ранговой корреляции Спирмена. Выполнен однофакторный и многофакторный логистический регрессионный анализ для оценки ассоциации между биомаркерами и бактериальной причиной или краткосрочным исходом. Диагностическая точность биомаркеров при подтверждении бактериальной этиологии или прогнозе краткосрочного исхода заболевания вычислялась с помощью площади под кривой (AUC). При дихотомическом анализе бактериальная этиология определялась как чисто бактериальная и вирусно-бактериальная ВБП. Пороговое значение определялось индексом Юдена. Выживаемость за 30 дней до смерти или до конца периода наблюдения для всех перенесших заболевание пациентов описывалась с помощью графиков Каплана–Майера. Распределение выживаемости сравнивалось с помощью логрангового критерия. Для оценки ассоциации между биомаркерами и долгосрочным исходом использована однофакторная или многофакторная регрессия Кокса. В случае асимметричного распределения перед включением в регрессионный анализ проводили логарифмическое преобразование непрерывных переменных. Двустороннее р-значение <0,05 определялось как статистически значимое. Статистический анализ выполнен на программном обеспечении STATA версия 15.0 для Windows (Stata Corp LP, г. Колледж-Стейшн, шт. Техас, США) и SPSS версия 25.0 для Windows (IBM Corp, г. Армонк, шт. Нью-Йорк, США).
Результаты
Исходные данные
Исходные данные исследования описаны ранее [18]. Средний возраст пациентов составил 66 (52–78) лет, у 172 (64%) пациентов имелось как минимум одно сопутствующее заболевание. Микробный агент установлен у 167 (63%) больных; у 73 (28%) инфекция имела бактериальную этиологию, у 41 (15%) – вирусную, у 51 – (19%) вирусно-бактериальную, у 100 (37%) – этиология пневмонии осталась неизвестной (таблица 1).
Таблица 1. Выявление микробного агента у 267 пациентов, госпитализированных по поводу внебольничной пневмонии
Уровень биомаркеров в разных временных точках
У всех пациентов максимальная концентрация биомаркеров наблюдалась при поступлении и была значительно ниже на этапе клинической стабилизации во время пребывания в стационаре (p<0,001 во всех случаях) и при амбулаторном визите спустя 6 недель (p<0,001 во всех случаях) (Рисунок 1). Уровень гранулоцитарных нейтрофилов строго коррелирует с уровнем лейкоцитов во всех временных точках (коэффициент корреляции r=0,982, r=0,953 и r=0,937 во временных точках 1–3, соответственно; p<0,001 во всех случаях).
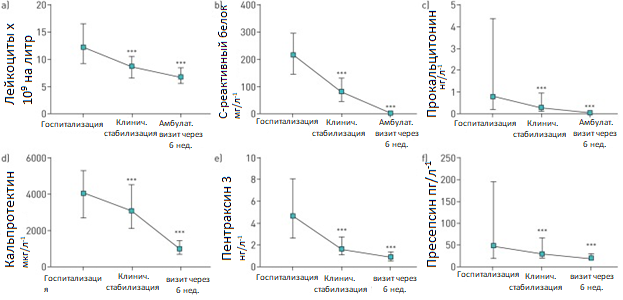 Рисунок 1. Уровень биомаркеров 267 пациентов, госпитализированных по поводу внебольничной пневмонии на момент поступления, на этапе клинической стабилизации и на амбулаторном приеме спустя 6 недель а) лейкоциты; б) C-реактивный белок; в) прокальцитонин; г) кальпротектин д) пентраксин 3; е) пресепсин. *: p<0,05; **: p<0,01; ***: p<0,001. При сравнении между двумя группами использован критерий знаковых рангов Уилкоксона.
Рисунок 1. Уровень биомаркеров 267 пациентов, госпитализированных по поводу внебольничной пневмонии на момент поступления, на этапе клинической стабилизации и на амбулаторном приеме спустя 6 недель а) лейкоциты; б) C-реактивный белок; в) прокальцитонин; г) кальпротектин д) пентраксин 3; е) пресепсин. *: p<0,05; **: p<0,01; ***: p<0,001. При сравнении между двумя группами использован критерий знаковых рангов Уилкоксона.
Уровень биомаркеров и их связь с этиологией заболевания
Уровень таких биомаркеров, как лейкоциты, PTX3 и пресепсин был примерно одинаков, независимо от микробного этиологического фактора (Рисунок 2 а–в). При этом уровень СРБ и ПКТ был значительно выше у пациентов с бактериальной и вирусно-бактериальной ВБП, чем у больных с вирусной ВБП (Рисунок 2 г и д), а уровень кальпротектина значимо выше при вирусно-бактериальной ВБП, чем при вирусной (Рисунок 2 е).
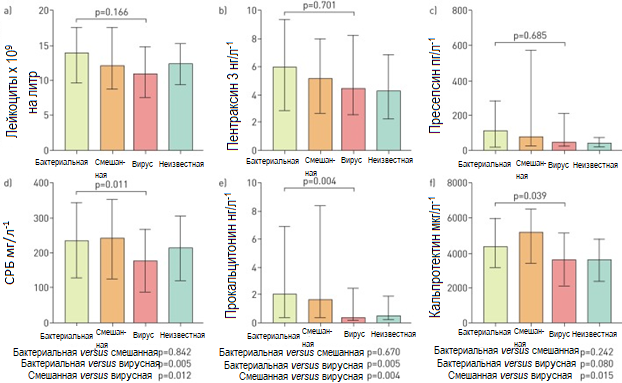 Рисунок 2. Уровни биомаркеров 267 пациентов, госпитализированных по поводу внебольничной пневмонии, распределены в соответствии с микробным этиологическим фактором заболевания. Данные представлены в виде медиан и межквартильного интервала. Сравнение между несколькими группами производилось тестом Крускала–Уаллиса, сравнение между двумя группами тестом Манн–Уитни. Пациенты с пневмонией неизвестной этиологии из анализа исключены. а) лейкоциты; б) C-реактивный белок (СРБ); в) прокальцитонин; г) кальпротектин д) пентраксин 3; е) пресепсин
Рисунок 2. Уровни биомаркеров 267 пациентов, госпитализированных по поводу внебольничной пневмонии, распределены в соответствии с микробным этиологическим фактором заболевания. Данные представлены в виде медиан и межквартильного интервала. Сравнение между несколькими группами производилось тестом Крускала–Уаллиса, сравнение между двумя группами тестом Манн–Уитни. Пациенты с пневмонией неизвестной этиологии из анализа исключены. а) лейкоциты; б) C-реактивный белок (СРБ); в) прокальцитонин; г) кальпротектин д) пентраксин 3; е) пресепсин
Согласно логистическому регрессионному анализу непрерывных переменных, повышенный уровень СРБ (ОР 1,90, 95% ДИ 1,16–3,12; р=0,011), ПКТ (ОР 1,44, 95% ДИ 1,15–1,81; р=0,002) и кальпротектина (ОР 2,15, 95% ДИ 1,05–4,45; р=0,036) был значимо ассоциирован с бактериальной этиологией ВБП (таблица 2). Однако диагностическая точность в дифференцировке бактериальной и вирусной инфекции при ВБП была умеренна для всех трех маркеров (таблица 2). Оптимальное пороговые значения для разделения бактериальной и вирусной инфекции составили 176 мг/л-1 для СРБ (чувствительность 72%, специфичность 51%), 0,45 нг/мл-1 для ПКТ (чувствительность 70%, специфичность 65%) и 3476 мг/л-1 для кальпротектина (чувствительность 73%, специфичность 50%).
Таблица 2. Логистический регрессионный анализ и диагностическая точность уровня биомаркеров на момент поступления для прогноза бактериальной этиологии заболевания у 267 пациентов, госпитализированных по поводу внебольничной пневмонии
При сравнении уровня биомаркеров на момент поступления среди пациентов с пневмонией, вызванной инкапсулированными бактериями (Streptococcus pneumonia или Haemophilus influenzae) и атипичными бактериальными агентами (Mycoplasma pneumoniae, Bordetella pertussis, Chlamydophila pneumoniae или Legionella pneumophila), обнаружено, что в первом случае наблюдался значимо более высокий уровень ПКТ (p=0,049) и лейкоцитов (р=0,003). Статистически значимых различий в уровнях СРБ, кальпротектина, РТХ3 или пресепсина не выявлено. (p=0,379, p=0,449, p=0,281 и p=0,063 соответственно).
Уровень биомаркеров на момент поступления и его связь с краткосрочным исходом заболевания
В общей сложности 51 (19%) пациент переводился в ОРИТ (n=48, 18%) и (или) умер в течение 30 дней с момента поступления (n=10, 4%). По сравнению с другими больными, пациенты с нежелательным краткосрочным исходом заболевания имели при поступлении значимо более высокий уровень ПКТ, РТХ3 и пресепсина, а уровень СРБ и лейкоцитов не различался. В соответствии с этим установлено, что высокий уровень ПКТ, РТХ3 и пресепсина был ассоциирован с неблагоприятным краткосрочным исходом при однофакторном логистическом регрессионном анализе и при анализе с коррекцией по значению по шкале CURB-65 (таблица 3).
Таблица 3. Логистический регрессионный анализ уровней биомаркеров при поступлении и их связь с неблагоприятным краткосрочным исходом среди 267 пациентов, госпитализированных по поводу внебольничной пневмонии
Тем не менее, исходный уровень ПКТ (AUC 0,66, 95% ДИ 0.57–0.75; p=0,001), РТХ3 (AUC 0,68, 95% ДИ 0,60–0,77; p<0,001) и пресепсина (AUC 0,65, 95% CI 0,56–0,74; p=0,002) обладают лишь умеренной способностью дифференцировки пациентов с благоприятным и неблагоприятным краткосрочным исходом (Рисунок 3). Оптимальное пороговое значение для этих двух категорий больных для ПКТ составляет 0,91 нг/мл-1 для ПКТ (чувствительность 72%, специфичность 58%) и 64,5 пг/мл-1 для пресепсина (чувствительность 64%, специфичность 61%).
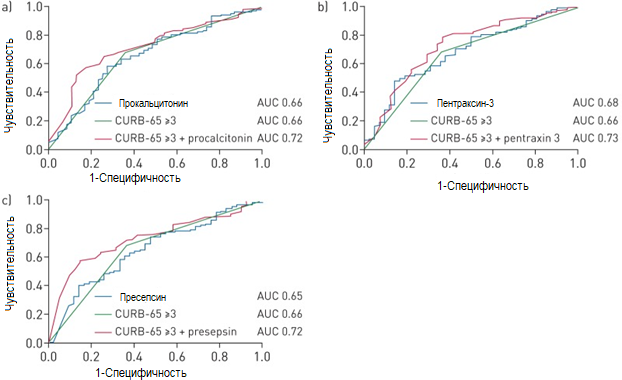 Рисунок 3. Рабочая характерическая кривая для биомаркеров и значения по шкале CURB-65 (спутанность сознания, мочевина >7 ммоль/л−1, частоты дыхательных движений ≥30/мин−1, артериальное давление <90 мм рт. ст. (систолическое) или ≤60 мм рт. ст. (диастолическое), возраст ≥65 лет) при поступлении в клинику для прогноза неблагоприятных исходов краткосрочных результатов. а) прокальцитонин; б) пентраксин 3; в) пресепсин. AUC: площадь под кривой
Рисунок 3. Рабочая характерическая кривая для биомаркеров и значения по шкале CURB-65 (спутанность сознания, мочевина >7 ммоль/л−1, частоты дыхательных движений ≥30/мин−1, артериальное давление <90 мм рт. ст. (систолическое) или ≤60 мм рт. ст. (диастолическое), возраст ≥65 лет) при поступлении в клинику для прогноза неблагоприятных исходов краткосрочных результатов. а) прокальцитонин; б) пентраксин 3; в) пресепсин. AUC: площадь под кривой
Уровень биомаркеров в сочетании с оценкой по шкале CURB-65 и их связь с краткосрочным исходом заболевания
Значение ≥3 баллов по CURB-65 статистически значимо ассоциировано с неблагоприятными краткосрочными исходами (ОР 3,83, 95%, ДИ 2,00–7,32; р<0,001) и в средней степени (AUC 0,66, 95% ДИ 0,58-0,75; р<0,001) способно определять краткосрочный исход заболевания (Рисунок 3). Сочетания показателя по CURB-65 ≥3 c исходным значением ПКТ (AUC 0,72, 95% ДИ 0,64–0,79; p<0,001), РТХ3 (AUC 0,73, 95% ДИ 0,64–0,82; p<0,001) и пресепсина (AUC 0,73, 95% ДИ 0,65–0,81; p<0,001) повышает точность диагностики для дифференцировки пациентов с благоприятным и неблагоприятным исходом заболевания, но статистически значимо только в отношении пресепсина (p=0,077, p=0,097 и p=0,042, соответственно) (Рисунок 3).
Уровень биомаркеров при поступлении в клинику и их связь с долгосрочным исходом
Из 257 пациентов, переживших краткосрочный период после ВБП, 67 (26%) умерло в течение 5 лет после выписки. Кумулятивная общая 5-летняя выживаемость составила 74% (95% ДИ 68%–79%). При проведении однофакторного регрессионного анализа Кокса повышенный уровень РТХ3 при поступлении был ассоциирован с 5-летней общей летальностью (отношение рисков (ОР) 1,63, 95% ДИ 1,13–2,35; р=0,010). Тем не менее, при корректировке на возраст и клинически значимую сопутствующую патологию (сердечная недостаточность, активное онкологическое заболевание, хроническая обструктивная болезнь легких, заболевание почек) РТХ3 такой ассоциации не продемонстрировал.
Уровень биомаркеров через 6 недель и связь с долгосрочным исходом
Повышенные уровни лейкоцитов, СРБ, ПКТ, кальпротектина и РТХ на 6-ю неделю после выписки ассоциированы с 5-летней общей летальностью согласно однофакторному регрессионному анализу Кокса (таблица 4). При коррекции на возраст и клинически значимую сопутствующую патологию, значимую ассоциацию с 5-летней общей летальностью продемонстрировали только уровень кальпротектина и лейкоцитов (Таблица 4 и рисунок 4).
Таблица 4. Регрессионный анализ Кокса для уровней биомаркеров на 6-ю неделю после выписки и их связь с 5-летней общей летальностью среди 267 пациентов, госпитализированных по поводу внебольничной пневмонии
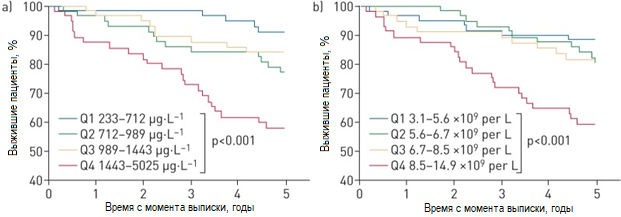 Рисунок 4. Диаграмма Каплан-Майера для биомаркеров на 6-ю неделю после выписки и их связь с 5-летней общей летальностью, разделенной по квартилям а) кальпротектин (p<0,001 по лог-ранковому тесту) и б) лейкоциты (p<0,001). Q: квартиль
Рисунок 4. Диаграмма Каплан-Майера для биомаркеров на 6-ю неделю после выписки и их связь с 5-летней общей летальностью, разделенной по квартилям а) кальпротектин (p<0,001 по лог-ранковому тесту) и б) лейкоциты (p<0,001). Q: квартиль
Обсуждение
Во-первых, в когорте 267 пациентов, госпитализированных по поводу ВБП, кальпротектин, в отличие от СРБ и ПКТ, выступал в качестве независимого фактора присутствия бактериальной этиологии и обладал точностью при дифференцировке бактериальной и вирусной инфекций. Таким образом, можно заключить, что он прежде всего реагирует на воспаление бактериального генеза. Во-вторых, недавно внедренные в практику маркеры воспаления РТХ3 и пресепсин, были, как и ПКТ, но не СРБ, связаны с неблагоприятными краткосрочными исходами ВБП, в том числе после корректировки на тяжесть по шкале CURB-65. В-третьих, уровни биомаркеров при поступлении не могли успешно использоваться в прогнозе долгосрочных исходов, но, что важно, уровень кальпротектина и лейкоцитов в конвалесцентной фазе ВБП и при амбулаторном визите спустя 6 недель, были независимыми предикторами 5-летней общей летальности.
Значительный перекрест значений уровня СРБ при бактериальной, вирусно-бактериальной и вирусной ВБП, который выявлен в нашем исследовании, полностью согласуется с результатами предыдущих работ и клиническим опытом [3, 7, 21]. При этом СРБ выступал в качестве независимого маркера бактериальной этиологии с умеренной способностью к дифференцировке, а результаты измерения уровня СРБ были схожими с таковыми для ПКТ. Как считается, уровень ПКТ, предшественника кальцитонина, резко возрастает в циркулирующей крови в течение 2–3 часов в ответ на бактериальную инфекцию и в случае сепсиса достигает значения, в 1000 раз превышающего нормальное. При этом вирусные инфекции не вызывают такой рост ПКТ [3, 7]. В большинстве исследований роли ПКТ при инфекциях нижних дыхательных путей этот маркер считается умеренно пригодным для дифференцировки бактериальной и вирусной причины [22, 23]. Это подтверждено и в нашем исследовании. Тем не менее, нами также установлено, что определение уровня ПКТ возможно не обладает большими, по сравнению с уровнем СРБ, преимуществами в дифференцировке ВБП бактериальной и вирусной этиологии.
Кальпротектин представляет собой комплекс S100A8 и S100A9, двух молекулярных маркеров повреждения. Они высвобождаются сразу после активации или гибели нейтрофилов через нейтрофильную внеклеточную ловушку (NET), однако источником кальпротектина также служат моноциты и макрофаги [24]. Кальпротективные комплексы являются медиаторами врожденного иммунитета при системных инфекциях, таких как пневмония и сепсис. Они активируют паттерн-распознающие молекулы или привлекают нейтрофилы и других иммунные клетки в место воспаления [25, 26]. Ранее сообщалось, что высокий уровень кальпротектина определяется в сыворотке крови и жидкости бронхоальвеолярного лаважа у пациентов с ВБП, обусловленной S. pneumoniae [16]. В нашем исследовании повышение уровня кальпротектина носило временный характер и ассоциировалось с бактериальной пневмонией, достигая максимально высоких значений при вирусно-бактериальном поражении. При этом важно отметить, что ни один из исследуемых биомаркеров не мог в достаточно надежной степени дифференцировать этиологию ВБП и указать на возможность безопасной отмены антибиотиков.
Маркеры воспаления ПКТ, РТХ3 и пресепсин были ассоциированы с краткосрочным неблагоприятным исходом, то есть переводом в ОРИТ и летальным исходом в течение 30 дней, и в умеренной степени могли дифференцировать благоприятный и неблагоприятный исход заболевания в краткосрочной перспективе. При сочетании уровня биомаркеров со значением ≥3 балла по шкале CURB-65, прогностическая способность значительно возрастает, однако только для пресепсина. Во многих предыдущих исследованиях, как и в нашем, установлено, что уровень ПКТ в умеренной и сильной степени ассоциирован со смертностью в краткосрочном периоде [4, 27]. Пресепсин – биомаркер воспаления, который является производным белка sCD14 [28]. По сравнению с ПКТ и другими биомаркерами, пресепсин раньше всех реагирует на системную инфекцию и является более специфичным [12, 28]. В некоторых исследованиях ВБП уровень пресепсина был выше у пациентов в тяжелом состоянии и являлся независимым фактором-предиктором тяжести ВБП и смертности в течение 28 дней [13, 29]. Наше исследование подтверждает результаты предыдущих работ, согласно которым пресепсин является новым биомаркером-предиктором краткосрочного исхода. Аналогичным образом, РТХ3, который как и СРБ относится к семейству белков-пентраксинов, прогнозировал в исследованной нами когорте краткосрочный исход заболевания. Считается, что в отличие от СРБ, РТХ3 синтезируется в месте локализации инфекции большим количеством клеток, в частности нейтрофилами и моноцитами под воздействием медиаторов воспаления (т.е. цитокинов и микробных агентов) [30]. При сепсисе РТХ3 выступает, по-видимому, как белок острой фазы, достигает своего максимального уровня в течение 6–8 часов и является предиктором летального исхода в краткосрочном периоде [30, 31]; при ВБП уровень РТХ3 коррелирует с тяжестью заболевания [17]. Результаты нашего исследования свидетельствуют о том, что РТХ3 можно считать прогностическим маркером при ВБП. Впервые установлена ассоциация между уровнем РТХ3 и неблагоприятным краткосрочным исходом болезни.
Становится все яснее, что по сравнению с общей популяцией у пациентов, перенесших ВБП, наблюдается высокий риск смертности в долгосрочном периоде после госпитализации [32]. Причина повышения риска летального исхода после пневмонии до конца неизвестна, хотя свой вклад могут вносить значительные сердечно-сосудистые осложнения [19, 33]. Ранее было показано, что с неблагоприятными прогнозами при ВБП ассоциированы измеренные при поступлении биомаркеры сердечно-сосудистых заболеваний (тропонин Т, N-концевой пропептид натрийуретического гормона B-типа и триметиламин-N-оксид), но не типичные маркеры воспаления (лейкоциты, СРБ и ПК) [5, 34–36]. Уровень интерлейкина-6 на момент выписки из больницы, как индикатор персистирующего воспаления, показал связь с одногодичной выживаемостью в исследовании «Генетические факторы и факторы воспаления при сепсисе» [37]. Среди пациентов нашей выборки уровень биомаркеров воспаления при поступлении не выступил как предиктор летального исхода в долгосрочном периоде. Однако в анализах, взятых в фазе конвалесценции примерно через 6 недель после выписки, уровень как кальпротектина, так и лейкоцитов оказался ассоциирован с общей 5-летней смертностью при анализе с корректировкой на возраст и имеющуюся сопутствующую патологию.
Данные того, что уровень кальпротектина и лейкоцитов, который строго коррелирует с уровнем нейтрофилов и выступает главным источником кальпротектина [24], могут являться долговременными прогностическими факторами, позволяют предположить, что уровень лимфоцитов и активность нейтрофилов влияют на поддержку воспаления после периода острой ВБП. Смертность в отдаленном периоде у больных, перенесших ВБП, чаще всего обусловлена сердечно-сосудистыми заболеваниями[19, 38]. Учитывая роль нейтрофилов в патогенезе ССЗ [39, 40], можно предположить, что эти клетки вносят вклад в неудовлетворительный долгосрочный прогноз у пациентов с ВБП. Однако это является предметом предстоящих исследований. Несмотря на это, полученные нами данные свидетельствуют о том, что пациенты с повышенными уровнями кальпротектина и лейкоцитов требуют более внимательного контроля, особенно в отношении развития сердечно-сосудистых заболеваний.
Недостатки и сильные стороны исследования
Для оценки краткосрочных исходов заболевания использовалась составная конечная точка – перевод в ОРИТ и смертность в течение 30 дней, и большинство пациентов квалифицированы с использованием нестрогой конечной точки перевода в ОРИТ, что, возможно, повлияло на полученные результаты. К сильным сторонам нашего исследования можно отнести большое количество больных с микробиологически подтвержденным диагнозом (63%), длительный период наблюдения (5 лет) и надежную информацию о долгосрочной летальности, поскольку из исследования выбыл только один пациент, и мы получили данные о 99,6% выборки.
Выводы
Кальпротектин может выступать в качестве маркера бактериальной этиологии и общей 5-летней летальности, в то время как РТХ3 и пресепсин, возможно, является новыми предикторами краткосрочных исходов ВБП. Повышенные уровни кальпротектина и лейкоцитов в фазе конвалесценции могут отражать нежелательное персистирующее воспаление и ассоциированы с риском летального исхода в долгосрочном периоде.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Уильям В. Сильян, Ян К. Холтер, Анника Э. Михельсен, Столе Х. Нимо, Трине Лауритцен, Кьерсти Оппен, Эйнар Хусебье, Тор Уэланд, Том Э. Моллнес, Пол Аукруст, Ларс Хеггелунд
ERJ Open Res. 2019 Feb; 5(1): 00014-2019.
Аннотация
Биомаркеры могут помогать в принятии клинических решений по поводу антимикробной терапии и прогнозировании течения внебольничной пневмонии (ВБП). Мы измерили уровни С-реактивного белка в сыворотке крови, прокальцитонина (ПКТ) и кальпротектина, а также уровни пентраксина плазмы 3 (ПTХ3) и пресепсина, количество лейкоцитов в цельной крови в трех временных точках, изучили их связь с микробной этиологией и неблагоприятными клиническими исходами при ВБП.
Методы
Образцы крови были получены при госпитализации, клинической стабилизации и 6-недельном последующем наблюдение у 267 госпитализированных взрослых с ВБП. Неблагоприятный краткосрочный исход определялся как госпитализация в отделение интенсивной терапии и смерть в течение ближайших 30 дней. Долгосрочный исход оценивался как 5-летняя смертность от всех причин.
Результаты
Пиковые уровни всех биомаркеров наблюдались при госпитализации. Повышенные уровни С-реактивного белка, ПКТ и кальпротектина были связаны с бактериальной этиологией ВБП, а повышенные уровни ПКТ, РТХ3 и пресепсина - с неблагоприятным краткосрочным исходом. В одномерных и многомерных регрессионных моделях лейкоциты и кальпротектин при 6-недельном последующем наблюдении были предикторами 5-летней смертности от всех причин.
Выводы
Кальпротектин выступает как потенциальный ранний маркер бактериальной этиологии ВБП и предиктор 5-летней смертности от всех причин при ВБП, тогда как ПКТ, РТХ3 и пресепсин могут предсказать краткосрочный исход.
Введение
Внебольничная пневмония (ВБП) по-прежнему относится к числу распространенных инфекционных заболеваний, обладающих высокими показателями частоты осложнений и смертности в краткосрочном и долгосрочном периоде [1]. Несмотря на профилактические меры, в будущем ожидается рост заболеваемости [2]. Для оптимального лечения ВБП и эффективного расходования финансовых средств здравоохранения приоритетным является раннее выявление причинного агента или агентов, ответственных за тяжесть заболевания и вероятность неблагоприятного клинического исхода. Определение биомаркеров с учетом клинической оценки тяжести ВБП способно дать дополнительную информацию о течении заболевания и о дифференцировке ВБП вирусной и бактериальной этиологии. В настоящее время биомаркеры, которые призваны дифференцировать бактериальный, вирусный или вирусно-бактериальный характер ВБП, не обладают ни достаточной для проведения патоген-специфической терапии точностью [3], ни преимуществами в построении краткосрочного и долгосрочного прогнозов по сравнению со шкалой клинической оценки тяжести ВБП. [4, 5]. Внести положительные изменения в диагностику и лечение ВБП способны новые неинвазивные методики, которые могут обеспечить более эффективную терапию, исключить нерациональное назначение антибиотиков и улучшить показатели краткосрочных исходов [6]. Благодаря таким биомаркерам можно определить пациентов с риском неблагоприятного исхода в долгосрочной перспективе, более точно обозначить подгруппы перенесших ВБП пациентов, требующих наиболее пристального внимания.
Уровень лейкоцитов (WBC) и относящийся к семейству пентраксинов С-реактивный белок (СРБ) – широко применяемые биомаркеры воспаления, которые обладают низкой и средней степени значимости прогностической способностью в отношении определения микробных этиологических факторов и оценки тяжести течения ВБП [7–9]. Прокальцитонин (ПКТ), предшественник кальцитонина, считается более пригодным для выявления бактериальной этиологии и прогноза ВБП, по сравнению с двумя маркерами, упомянутыми выше [4, 7, 10]. Кроме того, на его основе можно контролировать длительность приема антибиотиков при ВБП [11]. Помимо этого, растворимый подтип CD14 (sCD14), известный как пресепсин, обладает по сравнению с WBC, СРБ и ПКТ большей специфичностью к системным инфекциям. Пресепсин может использоваться в качестве возможного предиктора тяжести заболевания и риска летального исхода от ВБП в краткосрочном периоде [12, 13]. Не так давно открыты перспективные биомаркеры системной инфекции острой фазы: нейтрофил-ассоциированный маркер кальпротектин и длинный пентраксин 3 (РТХ3), отражающие местное и системное воспаление. Однако их использование в контексте ВБП пока достаточно не изучено [16, 17].
Ранее мы сообщали о высокой частоте выявления микробных этиологических факторов у строго отобранной когорты из 267 госпитализированных взрослых пациентов с ВБП [18]. Целью нашего исследование является определение уровня лейкоцитов, CPБ и ПКТ, как основных биомаркеров воспаления, а также кальпротектина, РТХ3 и пресепсина в трех временных точках и изучение связи между этими биомаркерами и микробными агентами, а также краткосрочными и долгосрочными исходами ВБП.
Материалы и методы
Выборка и дизайн исследования
Исследование проведено в отделении неотложных состояний многопрофильном госпитале в клинике «Вестре Викен» в г. Драммене на юго-востоке Норвегии в период с 1 января 2008 года по 31 января 2011 года. Было отобрано в общей сложности 267 пациентов в возрасте ≥18 лет, последовательно поступивших в терапевтическое отделение с подозрением на пневмонию. В течение 48 часов больных обследовали для выявления критериев наличия ВБП: 1) появление нового инфильтрата на рентгенограмме органов грудной полости, 2) температура тела >38.0°C, измеренная ректально 3) наличие по крайней мере одного из следующих симптомов: кашель (сухой или с отхождением мокроты), одышка, боль за грудиной при дыхании, хрипы в легких или ослабленное дыхание. Пациенты не включались в исследование, если они были госпитализированы в предшествующие две недели, либо на рентгенограмме было выявлено неинфекционное поражение легких. Пациенты с иммуносупрессией (т.е. первичным иммунодефицитом, онкологическими заболеваниями и принимающие лекарства, считающиеся согласно определению HOLTER et al. иммуносупрессивными [19]) не исключались из исследования для отображения общей популяции больных, поступающих в данный госпиталь. После выписки пациентам рекомендовался амбулаторный прием через ∼6 недель, то есть в период конвалесцентной фазы ВБП. Все пациенты подписали добровольное информированное согласие на участие в исследовании. Исследование одобрено региональным этическим комитетом по вопросам медицины и здравоохранения юго-восточной Норвегии (за номером S-06266a). Комитет выдал разрешение на несоблюдение требования дачи согласия в случае смерти пациента (2012/467 А).
Сбор данных и определение понятий
Исходные данные и определения приведены в других публикациях [18, 19]. Демографические, клинические и лабораторные данные собирались в течение 48 часов от момента поступления, среднее ±СО время от поступления до включения в исследование составило 0,6±0,5 дней, 260 из 267 (97%) включены в течение 24 часов. Микробный этиологический фактор устанавливался при применении сочетания методик (микробиологического посева, серологии, антигенов в моче и ПЦР). В настоящем исследовании клиническая стабилизация оценивалась каждый день в течение первых 12 дней госпитализации, уровень СРБ и лейкоцитов определялся каждый второй день. Стабильность клинической картины оценивалась по следующим критериям (1 балл на каждый критерий): 1) отсутствие необходимости менять антибиотик в предшествующие 2 дня, 2) улучшение общего состояния, 2) утренняя температура тела, измеренная ректально <38,0°C и 4) снижение на >25% уровня СРБ и лейкоцитов. Стабилизация считалась достигнутой при ≥3 баллах.
Анализ крови
Анализ крови брали при поступлении, при стабилизации клинической картины и на амбулаторной приеме через 6 недель после выписки, сыворотка и плазма собирались в апирогенные вакуумные пробирки. Пробирки с образцами плазмы содержали EDTA в качестве антикоагулянта. Сыворотку и плазму выделяли из цельной крови в течение 60 минут при центрифугировании с ускорением 2000g в течение 12 минут с охлаждением и хранили в нескольких аликвотах при −80°C.
Определение уровня биомаркеров
Уровень СРБ сыворотки определялся при помощи турбидиметрии (Abbott Architect ci16200; Abbott Diagnostics, Эббот Парк, шт. Иллинойс, США), подсчет лейкоцитов проводили на автоматическом гематологическом анализаторе CELL-DYN 4000 (Abbott Diagnostics) и Advia 120 (Siemens Healthineers, г. Эрланген, Германия). Анализ сыворотки на ПКТ выполнялся методом хемилюминесцентного анализа (Advia Centaur BRAHMS PCT; Siemens Healthineers). Уровень кальпротектина сыворотки определялся методом ИФА (Calpro AS, Осло, Норвегия) на автоматическом ИФА-анализаторе (Dynex DS2 Automated ELISA System; Dynex Technologies Inc., г. Шантийи, шт. Виргиния, США). Уровень РТХ3 и пресепсина определялись с помощью коммерчески доступного сэндвич-ИФА (R&D Systems, г. Миннеаполис, штат Миннесота, США, и MyBioSource Inc., Сан-Диего, шт. Калифорния, США соответственно).
Оценка результатов
На основании микробиологического анализа выделены четыре группы пациентов, в зависимости от этиологии заболевания: 1) бактериальная пневмония, 2) вирусная пневмония, 3) вирусно-бактериальная пневмония и 4) неизвестная пневмония. Тяжесть пневмонии оценивалась по шкале CURB-65 (спутанность сознания, мочевина >7 ммоль/л−1, частота дыхательных движений ≥30/мин, артериальное давление < 90 мм рт. ст. (систолическое) или ≤60 мм рт. ст. (диастолическое), возраст ≥65 лет); пациенты с ≤2 баллами по CURB-65 отнесены к низкой группе риска, с ≥3 баллами к высокой [20]. Краткосрочный результат представлялся в виде комбинированной конечной точки – нахождение в отделении реанимации и интенсивной терапии (ОРИТ) и выживаемость в течение 30 дней. Долгосрочный результат оценивался по 5-летней общей летальности.
Статистический анализ
Качественные переменные представлены в виде n (%). Непрерывные переменные представлены в виде среднего значения ± СО для равномерно распределенных величин или медианы (межквартильный интервал) для ассиметричных данных. Разница в уровнях биомаркеров в разных периодах времени анализированы по критерию Краскела–Уоллиса и Фридмана для сравнений нескольких групп, и критерию Манна–Уитни и критерию Уилкоксона для связных выборок при сравнении между двумя группами. Корреляционный анализ между непрерывными переменами проводили с использованием ранговой корреляции Спирмена. Выполнен однофакторный и многофакторный логистический регрессионный анализ для оценки ассоциации между биомаркерами и бактериальной причиной или краткосрочным исходом. Диагностическая точность биомаркеров при подтверждении бактериальной этиологии или прогнозе краткосрочного исхода заболевания вычислялась с помощью площади под кривой (AUC). При дихотомическом анализе бактериальная этиология определялась как чисто бактериальная и вирусно-бактериальная ВБП. Пороговое значение определялось индексом Юдена. Выживаемость за 30 дней до смерти или до конца периода наблюдения для всех перенесших заболевание пациентов описывалась с помощью графиков Каплана–Майера. Распределение выживаемости сравнивалось с помощью логрангового критерия. Для оценки ассоциации между биомаркерами и долгосрочным исходом использована однофакторная или многофакторная регрессия Кокса. В случае асимметричного распределения перед включением в регрессионный анализ проводили логарифмическое преобразование непрерывных переменных. Двустороннее р-значение <0,05 определялось как статистически значимое. Статистический анализ выполнен на программном обеспечении STATA версия 15.0 для Windows (Stata Corp LP, г. Колледж-Стейшн, шт. Техас, США) и SPSS версия 25.0 для Windows (IBM Corp, г. Армонк, шт. Нью-Йорк, США).
Результаты
Исходные данные
Исходные данные исследования описаны ранее [18]. Средний возраст пациентов составил 66 (52–78) лет, у 172 (64%) пациентов имелось как минимум одно сопутствующее заболевание. Микробный агент установлен у 167 (63%) больных; у 73 (28%) инфекция имела бактериальную этиологию, у 41 (15%) – вирусную, у 51 – (19%) вирусно-бактериальную, у 100 (37%) – этиология пневмонии осталась неизвестной (таблица 1).
Таблица 1. Выявление микробного агента у 267 пациентов, госпитализированных по поводу внебольничной пневмонии
Уровень биомаркеров в разных временных точках
У всех пациентов максимальная концентрация биомаркеров наблюдалась при поступлении и была значительно ниже на этапе клинической стабилизации во время пребывания в стационаре (p<0,001 во всех случаях) и при амбулаторном визите спустя 6 недель (p<0,001 во всех случаях) (Рисунок 1). Уровень гранулоцитарных нейтрофилов строго коррелирует с уровнем лейкоцитов во всех временных точках (коэффициент корреляции r=0,982, r=0,953 и r=0,937 во временных точках 1–3, соответственно; p<0,001 во всех случаях).
 Рисунок 1. Уровень биомаркеров 267 пациентов, госпитализированных по поводу внебольничной пневмонии на момент поступления, на этапе клинической стабилизации и на амбулаторном приеме спустя 6 недель а) лейкоциты; б) C-реактивный белок; в) прокальцитонин; г) кальпротектин д) пентраксин 3; е) пресепсин. *: p<0,05; **: p<0,01; ***: p<0,001. При сравнении между двумя группами использован критерий знаковых рангов Уилкоксона.
Рисунок 1. Уровень биомаркеров 267 пациентов, госпитализированных по поводу внебольничной пневмонии на момент поступления, на этапе клинической стабилизации и на амбулаторном приеме спустя 6 недель а) лейкоциты; б) C-реактивный белок; в) прокальцитонин; г) кальпротектин д) пентраксин 3; е) пресепсин. *: p<0,05; **: p<0,01; ***: p<0,001. При сравнении между двумя группами использован критерий знаковых рангов Уилкоксона. Уровень биомаркеров и их связь с этиологией заболевания
Уровень таких биомаркеров, как лейкоциты, PTX3 и пресепсин был примерно одинаков, независимо от микробного этиологического фактора (Рисунок 2 а–в). При этом уровень СРБ и ПКТ был значительно выше у пациентов с бактериальной и вирусно-бактериальной ВБП, чем у больных с вирусной ВБП (Рисунок 2 г и д), а уровень кальпротектина значимо выше при вирусно-бактериальной ВБП, чем при вирусной (Рисунок 2 е).
 Рисунок 2. Уровни биомаркеров 267 пациентов, госпитализированных по поводу внебольничной пневмонии, распределены в соответствии с микробным этиологическим фактором заболевания. Данные представлены в виде медиан и межквартильного интервала. Сравнение между несколькими группами производилось тестом Крускала–Уаллиса, сравнение между двумя группами тестом Манн–Уитни. Пациенты с пневмонией неизвестной этиологии из анализа исключены. а) лейкоциты; б) C-реактивный белок (СРБ); в) прокальцитонин; г) кальпротектин д) пентраксин 3; е) пресепсин
Рисунок 2. Уровни биомаркеров 267 пациентов, госпитализированных по поводу внебольничной пневмонии, распределены в соответствии с микробным этиологическим фактором заболевания. Данные представлены в виде медиан и межквартильного интервала. Сравнение между несколькими группами производилось тестом Крускала–Уаллиса, сравнение между двумя группами тестом Манн–Уитни. Пациенты с пневмонией неизвестной этиологии из анализа исключены. а) лейкоциты; б) C-реактивный белок (СРБ); в) прокальцитонин; г) кальпротектин д) пентраксин 3; е) пресепсинСогласно логистическому регрессионному анализу непрерывных переменных, повышенный уровень СРБ (ОР 1,90, 95% ДИ 1,16–3,12; р=0,011), ПКТ (ОР 1,44, 95% ДИ 1,15–1,81; р=0,002) и кальпротектина (ОР 2,15, 95% ДИ 1,05–4,45; р=0,036) был значимо ассоциирован с бактериальной этиологией ВБП (таблица 2). Однако диагностическая точность в дифференцировке бактериальной и вирусной инфекции при ВБП была умеренна для всех трех маркеров (таблица 2). Оптимальное пороговые значения для разделения бактериальной и вирусной инфекции составили 176 мг/л-1 для СРБ (чувствительность 72%, специфичность 51%), 0,45 нг/мл-1 для ПКТ (чувствительность 70%, специфичность 65%) и 3476 мг/л-1 для кальпротектина (чувствительность 73%, специфичность 50%).
Таблица 2. Логистический регрессионный анализ и диагностическая точность уровня биомаркеров на момент поступления для прогноза бактериальной этиологии заболевания у 267 пациентов, госпитализированных по поводу внебольничной пневмонии
При сравнении уровня биомаркеров на момент поступления среди пациентов с пневмонией, вызванной инкапсулированными бактериями (Streptococcus pneumonia или Haemophilus influenzae) и атипичными бактериальными агентами (Mycoplasma pneumoniae, Bordetella pertussis, Chlamydophila pneumoniae или Legionella pneumophila), обнаружено, что в первом случае наблюдался значимо более высокий уровень ПКТ (p=0,049) и лейкоцитов (р=0,003). Статистически значимых различий в уровнях СРБ, кальпротектина, РТХ3 или пресепсина не выявлено. (p=0,379, p=0,449, p=0,281 и p=0,063 соответственно).
Уровень биомаркеров на момент поступления и его связь с краткосрочным исходом заболевания
В общей сложности 51 (19%) пациент переводился в ОРИТ (n=48, 18%) и (или) умер в течение 30 дней с момента поступления (n=10, 4%). По сравнению с другими больными, пациенты с нежелательным краткосрочным исходом заболевания имели при поступлении значимо более высокий уровень ПКТ, РТХ3 и пресепсина, а уровень СРБ и лейкоцитов не различался. В соответствии с этим установлено, что высокий уровень ПКТ, РТХ3 и пресепсина был ассоциирован с неблагоприятным краткосрочным исходом при однофакторном логистическом регрессионном анализе и при анализе с коррекцией по значению по шкале CURB-65 (таблица 3).
Таблица 3. Логистический регрессионный анализ уровней биомаркеров при поступлении и их связь с неблагоприятным краткосрочным исходом среди 267 пациентов, госпитализированных по поводу внебольничной пневмонии
Тем не менее, исходный уровень ПКТ (AUC 0,66, 95% ДИ 0.57–0.75; p=0,001), РТХ3 (AUC 0,68, 95% ДИ 0,60–0,77; p<0,001) и пресепсина (AUC 0,65, 95% CI 0,56–0,74; p=0,002) обладают лишь умеренной способностью дифференцировки пациентов с благоприятным и неблагоприятным краткосрочным исходом (Рисунок 3). Оптимальное пороговое значение для этих двух категорий больных для ПКТ составляет 0,91 нг/мл-1 для ПКТ (чувствительность 72%, специфичность 58%) и 64,5 пг/мл-1 для пресепсина (чувствительность 64%, специфичность 61%).
 Рисунок 3. Рабочая характерическая кривая для биомаркеров и значения по шкале CURB-65 (спутанность сознания, мочевина >7 ммоль/л−1, частоты дыхательных движений ≥30/мин−1, артериальное давление <90 мм рт. ст. (систолическое) или ≤60 мм рт. ст. (диастолическое), возраст ≥65 лет) при поступлении в клинику для прогноза неблагоприятных исходов краткосрочных результатов. а) прокальцитонин; б) пентраксин 3; в) пресепсин. AUC: площадь под кривой
Рисунок 3. Рабочая характерическая кривая для биомаркеров и значения по шкале CURB-65 (спутанность сознания, мочевина >7 ммоль/л−1, частоты дыхательных движений ≥30/мин−1, артериальное давление <90 мм рт. ст. (систолическое) или ≤60 мм рт. ст. (диастолическое), возраст ≥65 лет) при поступлении в клинику для прогноза неблагоприятных исходов краткосрочных результатов. а) прокальцитонин; б) пентраксин 3; в) пресепсин. AUC: площадь под кривойУровень биомаркеров в сочетании с оценкой по шкале CURB-65 и их связь с краткосрочным исходом заболевания
Значение ≥3 баллов по CURB-65 статистически значимо ассоциировано с неблагоприятными краткосрочными исходами (ОР 3,83, 95%, ДИ 2,00–7,32; р<0,001) и в средней степени (AUC 0,66, 95% ДИ 0,58-0,75; р<0,001) способно определять краткосрочный исход заболевания (Рисунок 3). Сочетания показателя по CURB-65 ≥3 c исходным значением ПКТ (AUC 0,72, 95% ДИ 0,64–0,79; p<0,001), РТХ3 (AUC 0,73, 95% ДИ 0,64–0,82; p<0,001) и пресепсина (AUC 0,73, 95% ДИ 0,65–0,81; p<0,001) повышает точность диагностики для дифференцировки пациентов с благоприятным и неблагоприятным исходом заболевания, но статистически значимо только в отношении пресепсина (p=0,077, p=0,097 и p=0,042, соответственно) (Рисунок 3).
Уровень биомаркеров при поступлении в клинику и их связь с долгосрочным исходом
Из 257 пациентов, переживших краткосрочный период после ВБП, 67 (26%) умерло в течение 5 лет после выписки. Кумулятивная общая 5-летняя выживаемость составила 74% (95% ДИ 68%–79%). При проведении однофакторного регрессионного анализа Кокса повышенный уровень РТХ3 при поступлении был ассоциирован с 5-летней общей летальностью (отношение рисков (ОР) 1,63, 95% ДИ 1,13–2,35; р=0,010). Тем не менее, при корректировке на возраст и клинически значимую сопутствующую патологию (сердечная недостаточность, активное онкологическое заболевание, хроническая обструктивная болезнь легких, заболевание почек) РТХ3 такой ассоциации не продемонстрировал.
Уровень биомаркеров через 6 недель и связь с долгосрочным исходом
Повышенные уровни лейкоцитов, СРБ, ПКТ, кальпротектина и РТХ на 6-ю неделю после выписки ассоциированы с 5-летней общей летальностью согласно однофакторному регрессионному анализу Кокса (таблица 4). При коррекции на возраст и клинически значимую сопутствующую патологию, значимую ассоциацию с 5-летней общей летальностью продемонстрировали только уровень кальпротектина и лейкоцитов (Таблица 4 и рисунок 4).
Таблица 4. Регрессионный анализ Кокса для уровней биомаркеров на 6-ю неделю после выписки и их связь с 5-летней общей летальностью среди 267 пациентов, госпитализированных по поводу внебольничной пневмонии
 Рисунок 4. Диаграмма Каплан-Майера для биомаркеров на 6-ю неделю после выписки и их связь с 5-летней общей летальностью, разделенной по квартилям а) кальпротектин (p<0,001 по лог-ранковому тесту) и б) лейкоциты (p<0,001). Q: квартиль
Рисунок 4. Диаграмма Каплан-Майера для биомаркеров на 6-ю неделю после выписки и их связь с 5-летней общей летальностью, разделенной по квартилям а) кальпротектин (p<0,001 по лог-ранковому тесту) и б) лейкоциты (p<0,001). Q: квартильОбсуждение
Во-первых, в когорте 267 пациентов, госпитализированных по поводу ВБП, кальпротектин, в отличие от СРБ и ПКТ, выступал в качестве независимого фактора присутствия бактериальной этиологии и обладал точностью при дифференцировке бактериальной и вирусной инфекций. Таким образом, можно заключить, что он прежде всего реагирует на воспаление бактериального генеза. Во-вторых, недавно внедренные в практику маркеры воспаления РТХ3 и пресепсин, были, как и ПКТ, но не СРБ, связаны с неблагоприятными краткосрочными исходами ВБП, в том числе после корректировки на тяжесть по шкале CURB-65. В-третьих, уровни биомаркеров при поступлении не могли успешно использоваться в прогнозе долгосрочных исходов, но, что важно, уровень кальпротектина и лейкоцитов в конвалесцентной фазе ВБП и при амбулаторном визите спустя 6 недель, были независимыми предикторами 5-летней общей летальности.
Значительный перекрест значений уровня СРБ при бактериальной, вирусно-бактериальной и вирусной ВБП, который выявлен в нашем исследовании, полностью согласуется с результатами предыдущих работ и клиническим опытом [3, 7, 21]. При этом СРБ выступал в качестве независимого маркера бактериальной этиологии с умеренной способностью к дифференцировке, а результаты измерения уровня СРБ были схожими с таковыми для ПКТ. Как считается, уровень ПКТ, предшественника кальцитонина, резко возрастает в циркулирующей крови в течение 2–3 часов в ответ на бактериальную инфекцию и в случае сепсиса достигает значения, в 1000 раз превышающего нормальное. При этом вирусные инфекции не вызывают такой рост ПКТ [3, 7]. В большинстве исследований роли ПКТ при инфекциях нижних дыхательных путей этот маркер считается умеренно пригодным для дифференцировки бактериальной и вирусной причины [22, 23]. Это подтверждено и в нашем исследовании. Тем не менее, нами также установлено, что определение уровня ПКТ возможно не обладает большими, по сравнению с уровнем СРБ, преимуществами в дифференцировке ВБП бактериальной и вирусной этиологии.
Кальпротектин представляет собой комплекс S100A8 и S100A9, двух молекулярных маркеров повреждения. Они высвобождаются сразу после активации или гибели нейтрофилов через нейтрофильную внеклеточную ловушку (NET), однако источником кальпротектина также служат моноциты и макрофаги [24]. Кальпротективные комплексы являются медиаторами врожденного иммунитета при системных инфекциях, таких как пневмония и сепсис. Они активируют паттерн-распознающие молекулы или привлекают нейтрофилы и других иммунные клетки в место воспаления [25, 26]. Ранее сообщалось, что высокий уровень кальпротектина определяется в сыворотке крови и жидкости бронхоальвеолярного лаважа у пациентов с ВБП, обусловленной S. pneumoniae [16]. В нашем исследовании повышение уровня кальпротектина носило временный характер и ассоциировалось с бактериальной пневмонией, достигая максимально высоких значений при вирусно-бактериальном поражении. При этом важно отметить, что ни один из исследуемых биомаркеров не мог в достаточно надежной степени дифференцировать этиологию ВБП и указать на возможность безопасной отмены антибиотиков.
Маркеры воспаления ПКТ, РТХ3 и пресепсин были ассоциированы с краткосрочным неблагоприятным исходом, то есть переводом в ОРИТ и летальным исходом в течение 30 дней, и в умеренной степени могли дифференцировать благоприятный и неблагоприятный исход заболевания в краткосрочной перспективе. При сочетании уровня биомаркеров со значением ≥3 балла по шкале CURB-65, прогностическая способность значительно возрастает, однако только для пресепсина. Во многих предыдущих исследованиях, как и в нашем, установлено, что уровень ПКТ в умеренной и сильной степени ассоциирован со смертностью в краткосрочном периоде [4, 27]. Пресепсин – биомаркер воспаления, который является производным белка sCD14 [28]. По сравнению с ПКТ и другими биомаркерами, пресепсин раньше всех реагирует на системную инфекцию и является более специфичным [12, 28]. В некоторых исследованиях ВБП уровень пресепсина был выше у пациентов в тяжелом состоянии и являлся независимым фактором-предиктором тяжести ВБП и смертности в течение 28 дней [13, 29]. Наше исследование подтверждает результаты предыдущих работ, согласно которым пресепсин является новым биомаркером-предиктором краткосрочного исхода. Аналогичным образом, РТХ3, который как и СРБ относится к семейству белков-пентраксинов, прогнозировал в исследованной нами когорте краткосрочный исход заболевания. Считается, что в отличие от СРБ, РТХ3 синтезируется в месте локализации инфекции большим количеством клеток, в частности нейтрофилами и моноцитами под воздействием медиаторов воспаления (т.е. цитокинов и микробных агентов) [30]. При сепсисе РТХ3 выступает, по-видимому, как белок острой фазы, достигает своего максимального уровня в течение 6–8 часов и является предиктором летального исхода в краткосрочном периоде [30, 31]; при ВБП уровень РТХ3 коррелирует с тяжестью заболевания [17]. Результаты нашего исследования свидетельствуют о том, что РТХ3 можно считать прогностическим маркером при ВБП. Впервые установлена ассоциация между уровнем РТХ3 и неблагоприятным краткосрочным исходом болезни.
Становится все яснее, что по сравнению с общей популяцией у пациентов, перенесших ВБП, наблюдается высокий риск смертности в долгосрочном периоде после госпитализации [32]. Причина повышения риска летального исхода после пневмонии до конца неизвестна, хотя свой вклад могут вносить значительные сердечно-сосудистые осложнения [19, 33]. Ранее было показано, что с неблагоприятными прогнозами при ВБП ассоциированы измеренные при поступлении биомаркеры сердечно-сосудистых заболеваний (тропонин Т, N-концевой пропептид натрийуретического гормона B-типа и триметиламин-N-оксид), но не типичные маркеры воспаления (лейкоциты, СРБ и ПК) [5, 34–36]. Уровень интерлейкина-6 на момент выписки из больницы, как индикатор персистирующего воспаления, показал связь с одногодичной выживаемостью в исследовании «Генетические факторы и факторы воспаления при сепсисе» [37]. Среди пациентов нашей выборки уровень биомаркеров воспаления при поступлении не выступил как предиктор летального исхода в долгосрочном периоде. Однако в анализах, взятых в фазе конвалесценции примерно через 6 недель после выписки, уровень как кальпротектина, так и лейкоцитов оказался ассоциирован с общей 5-летней смертностью при анализе с корректировкой на возраст и имеющуюся сопутствующую патологию.
Данные того, что уровень кальпротектина и лейкоцитов, который строго коррелирует с уровнем нейтрофилов и выступает главным источником кальпротектина [24], могут являться долговременными прогностическими факторами, позволяют предположить, что уровень лимфоцитов и активность нейтрофилов влияют на поддержку воспаления после периода острой ВБП. Смертность в отдаленном периоде у больных, перенесших ВБП, чаще всего обусловлена сердечно-сосудистыми заболеваниями[19, 38]. Учитывая роль нейтрофилов в патогенезе ССЗ [39, 40], можно предположить, что эти клетки вносят вклад в неудовлетворительный долгосрочный прогноз у пациентов с ВБП. Однако это является предметом предстоящих исследований. Несмотря на это, полученные нами данные свидетельствуют о том, что пациенты с повышенными уровнями кальпротектина и лейкоцитов требуют более внимательного контроля, особенно в отношении развития сердечно-сосудистых заболеваний.
Недостатки и сильные стороны исследования
Для оценки краткосрочных исходов заболевания использовалась составная конечная точка – перевод в ОРИТ и смертность в течение 30 дней, и большинство пациентов квалифицированы с использованием нестрогой конечной точки перевода в ОРИТ, что, возможно, повлияло на полученные результаты. К сильным сторонам нашего исследования можно отнести большое количество больных с микробиологически подтвержденным диагнозом (63%), длительный период наблюдения (5 лет) и надежную информацию о долгосрочной летальности, поскольку из исследования выбыл только один пациент, и мы получили данные о 99,6% выборки.
Выводы
Кальпротектин может выступать в качестве маркера бактериальной этиологии и общей 5-летней летальности, в то время как РТХ3 и пресепсин, возможно, является новыми предикторами краткосрочных исходов ВБП. Повышенные уровни кальпротектина и лейкоцитов в фазе конвалесценции могут отражать нежелательное персистирующее воспаление и ассоциированы с риском летального исхода в долгосрочном периоде.
Список использованной литературы
- Wunderink RG, Waterer GW. Community-acquired pneumonia. N Engl J Med 2014; 370: 1863. [ PubMed] [ Google Scholar]
- Ewig S, Torres A. Community-acquired pneumonia as an emergency: time for an aggressive intervention to lower mortality. Eur Respir J 2011; 38: 253–260. [ PubMed] [ Google Scholar]
- Kruger S, Welte T. Biomarkers in community-acquired pneumonia. Expert Rev Respir Med 2012; 6: 203–214. [ PubMed] [ Google Scholar]
- Viasus D, Del Rio-Pertuz G, Simonetti AF, et al. Biomarkers for predicting short-term mortality in community-acquired pneumonia: a systematic review and meta-analysis. J Infect 2016; 72: 273–282. [ PubMed] [ Google Scholar]
- Alan M, Grolimund E, Kutz A, et al. Clinical risk scores and blood biomarkers as predictors of long-term outcome in patients with community-acquired pneumonia: a 6-year prospective follow-up study. J Intern Med 2015; 278: 174–184. [ PubMed] [ Google Scholar]
- Christ-Crain M, Muller B. Biomarkers in respiratory tract infections: diagnostic guides to antibiotic prescription, prognostic markers and mediators. Eur Respir J 2007; 30: 556–573. [ PubMed] [ Google Scholar]
- Esposito S, Di Gangi M, Cardinale F, et al. Sensitivity and specificity of soluble triggering receptor expressed on myeloid cells-1, midregional proatrial natriuretic peptide and midregional proadrenomedullin for distinguishing etiology and to assess severity in community-acquired pneumonia. PLoS One 2016; 11: e0163262. [ PMC free article] [ PubMed] [ Google Scholar]
- Chalmers JD, Singanayagam A, Hill AT. C-reactive protein is an independent predictor of severity in community-acquired pneumonia. Am J Med 2008; 121: 219–225. [ PubMed] [ Google Scholar]
- Muller B, Harbarth S, Stolz D, et al. Diagnostic and prognostic accuracy of clinical and laboratory parameters in community-acquired pneumonia. BMC Infect Dis 2007; 7: 10. [ PMC free article] [ PubMed] [ Google Scholar]
- Kruger S, Ewig S, Marre R, et al. Procalcitonin predicts patients at low risk of death from community-acquired pneumonia across all CRB-65 classes. Eur Respir J 2008; 31: 349–355. [ PubMed] [ Google Scholar]
- Schuetz P, Wirz Y, Sager R, et al. Effect of procalcitonin-guided antibiotic treatment on mortality in acute respiratory infections: a patient level meta-analysis. Lancet Infect Dis 2018; 18: 95–107. [ PubMed] [ Google Scholar]
- Shozushima T, Takahashi G, Matsumoto N, et al. Usefulness of presepsin (sCD14-ST) measurements as a marker for the diagnosis and severity of sepsis that satisfied diagnostic criteria of systemic inflammatory response syndrome. J Infect Chemother 2011; 17: 764–769. [ PubMed] [ Google Scholar]
- Liu B, Yin Q, Chen YX, et al. Role of Presepsin (sCD14-ST) and the CURB65 scoring system in predicting severity and outcome of community-acquired pneumonia in an emergency department. Respir Med 2014; 108: 1204–1213. [ PubMed] [ Google Scholar]
- Gao S, Yang Y, Fu Y, et al. Diagnostic and prognostic value of myeloid-related protein complex 8/14 for sepsis. Am J Emerg Med 2015; 33: 1278–1282. [ PubMed] [ Google Scholar]
- Liu S, Qu X, Liu F, et al. Pentraxin 3 as a prognostic biomarker in patients with systemic inflammation or infection. Mediators Inflamm 2014; 2014: 421429. [ PMC free article] [ PubMed] [ Google Scholar]
- Achouiti A, Vogl T, Endeman H, et al. Myeloid-related protein-8/14 facilitates bacterial growth during pneumococcal pneumonia. Thorax 2014; 69: 1034–1042. [ PubMed] [ Google Scholar]
- Kao SJ, Yang HW, Tsao SM, et al. Plasma long pentraxin 3 (PTX3) concentration is a novel marker of disease activity in patients with community-acquired pneumonia. Clin Chem Lab Med 2013; 51: 907–913. [PubMed] [Google Scholar]
- Holter JC, Muller F, Bjorang O, et al. Etiology of community-acquired pneumonia and diagnostic yields of microbiological methods: a 3-year prospective study in Norway. BMC Infect Dis 2015; 15: 64. [PMC free article] [PubMed] [Google Scholar]
- Holter JC, Ueland T, Jenum PA, et al. Risk factors for long-term mortality after hospitalization for community-acquired pneumonia: a 5-year prospective follow-up study. PLoS One 2016; 11: e0148741. [PMC free article] [PubMed] [Google Scholar]
- Lim WS, van der Eerden MM, Laing R, et al. Defining community acquired pneumonia severity on presentation to hospital: an international derivation and validation study. Thorax 2003; 58: 377–382. [PMC free article] [PubMed] [Google Scholar]
- Bello S, Minchole E, Fandos S, et al. Inflammatory response in mixed viral-bacterial community-acquired pneumonia. BMC Pulm Med 2014; 14: 123. [PMC free article] [PubMed] [Google Scholar]
- Self WH, Balk RA, Grijalva CG, et al. Procalcitonin as a marker of etiology in adults hospitalized with community-acquired pneumonia. Clin Infect Dis 2017; 65: 183–190. [PMC free article] [PubMed] [Google Scholar]
- Kruger S, Ewig S, Papassotiriou J, et al. Inflammatory parameters predict etiologic patterns but do not allow for individual prediction of etiology in patients with CAP: results from the German competence network CAPNETZ. Respir Res 2009; 10: 65. [PMC free article] [PubMed] [Google Scholar]
- Schiopu A, Cotoi OS. S100A8 and S100A9: DAMPs at the crossroads between innate immunity, traditional risk factors, and cardiovascular disease. Mediators Inflamm 2013; 2013: 828354. [PMC free article] [PubMed] [Google Scholar]
- van Zoelen MA, Vogl T, Foell D, et al. Expression and role of myeloid-related protein-14 in clinical and experimental sepsis. Am J Respir Crit Care Med 2009; 180: 1098–1106. [PubMed] [Google Scholar]
- Achouiti A, Vogl T, Van der Meer AJ, et al. Myeloid-related protein-14 deficiency promotes inflammation in staphylococcal pneumonia. Eur Respir J 2015; 46: 464–473. [PubMed] [Google Scholar]
- Fernandez JF, Sibila O, Restrepo MI. Predicting ICU admission in community-acquired pneumonia: clinical scores and biomarkers. Expert Rev Clin Pharmacol 2012; 5: 445–458. [PubMed] [Google Scholar]
- Masson S, Caironi P, Spanuth E, et al. Presepsin (soluble CD14 subtype) and procalcitonin levels for mortality prediction in sepsis: data from the Albumin Italian Outcome Sepsis trial. Crit Care 2014; 18: R6. [PMC free article] [PubMed] [Google Scholar]
- Klouche K, Cristol JP, Devin J, et al. Diagnostic and prognostic value of soluble CD14 subtype (Presepsin) for sepsis and community-acquired pneumonia in ICU patients. Ann Intensive Care 2016; 6: 59. [PMC free article] [PubMed] [Google Scholar]
- Daigo K, Inforzato A, Barajon I, et al. Pentraxins in the activation and regulation of innate immunity. Immunol Rev 2016; 274: 202–217. [PMC free article] [PubMed] [Google Scholar]
- Mauri T, Bellani G, Patroniti N, et al. Persisting high levels of plasma pentraxin 3 over the first days after severe sepsis and septic shock onset are associated with mortality. Intensive Care Med 2010; 36: 621–629. [PubMed] [Google Scholar]
- Eurich DT, Marrie TJ, Minhas-Sandhu JK, et al. Ten-year mortality after community-acquired pneumonia. A prospective cohort. Am J Respir Crit Care Med 2015; 192: 597–604. [PubMed] [Google Scholar]
- Corrales-Medina VF, Alvarez KN, Weissfeld LA, et al. Association between hospitalization for pneumonia and subsequent risk of cardiovascular disease. JAMA 2015; 313: 264–274. [PMC free article][PubMed] [Google Scholar]
- Vestjens SMT, Spoorenberg SMC, Rijkers GT, et al. High-sensitivity cardiac troponin T predicts mortality after hospitalization for community-acquired pneumonia. Respirology 2017; 22: 1000–1006. [PubMed] [Google Scholar]
- Ottiger M, Nickler M, Steuer C, et al. Trimethylamine-N-oxide (TMAO) predicts fatal outcomes in community-acquired pneumonia patients without evident coronary artery disease. Eur J Intern Med 2016; 36: 67–73. [PubMed] [Google Scholar]
- Chang CL, Mills GD, Karalus NC, et al. Biomarkers of cardiac dysfunction and mortality from community-acquired pneumonia in adults. PLoS One 2013; 8: e62612. [PMC free article] [PubMed] [Google Scholar]
- Yende S, D'Angelo G, Kellum JA, et al. Inflammatory markers at hospital discharge predict subsequent mortality after pneumonia and sepsis. Am J Respir Crit Care Med 2008; 177: 1242–1247. [PMC free article] [PubMed] [Google Scholar]
- Eurich DT, Marrie TJ, Minhas-Sandhu JK, et al. Risk of heart failure after community acquired pneumonia: prospective controlled study with 10 years of follow-up. BMJ 2017; 356: j413. [PMC free article] [PubMed] [Google Scholar]
- Guasti L, Dentali F, Castiglioni L, et al. Neutrophils and clinical outcomes in patients with acute coronary syndromes and/or cardiac revascularisation. A systematic review on more than 34,000 subjects. Thromb Haemost 2011; 106: 591–599. [PubMed] [Google Scholar]
- Langseth MS, Opstad TB, Bratseth V, et al. Markers of neutrophil extracellular traps are associated with adverse clinical outcome in stable coronary artery disease. Eur J Prev Cardiol 2018; 25: 762–769. [PubMed] [Google Scholar]





