2816
19 Октября 2021
Авторское право © 2018, Aldona Siennicka,1 Marta Zuchowski,1 Kornel Chełstowski, MiłosławCnotliwy, Jeremy Simon Clark, Maria Jastrzębska (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
BioMed Research International
Volume 2018, Article ID 3205324, 10 pages
Алдона Сенницкая, Марта Зуховски, Корнел Хелстовски, Милослав Кнотливы, Джереми Саймон Кларк, Мария Ястшембска
Аннотация
Гомоцистеин (ГЦ) может оказывать вли...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
BioMed Research International
Volume 2018, Article ID 3205324, 10 pages
Алдона Сенницкая, Марта Зуховски, Корнел Хелстовски, Милослав Кнотливы, Джереми Саймон Кларк, Мария Ястшембска
Аннотация
Гомоцистеин (ГЦ) может оказывать вли...
Авторское право © 2018, Aldona Siennicka,1 Marta Zuchowski,1 Kornel Chełstowski, MiłosławCnotliwy, Jeremy Simon Clark, Maria Jastrzębska (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
BioMed Research International
Volume 2018, Article ID 3205324, 10 pages
Алдона Сенницкая, Марта Зуховски, Корнел Хелстовски, Милослав Кнотливы, Джереми Саймон Кларк, Мария Ястшембска
Аннотация
Гомоцистеин (ГЦ) может оказывать влияние на патогенез аневризмы брюшной аорты (АБА) посредством стимуляции процесса протеолиза и нарушенной системы коагуляции и фибринолиза. Повышение гемостатической активности может стимулировать процесс местного протеолитического распада стенки аорты. Целью данного исследования являлось изучение влияния ГЦ на гемостатические и протеолитические процессы в образцах толстых и тонких фрагментов внутрипросветного тромба (ВПТ) и подлежащих стенок.
Субъекты и методы
В исследование включены 36 пациентов, прошедших хирургическое лечение по поводу АБА. В рамках серии экспериментов проведена инкубация образцов ткани аневризмы с DL-ГЦ (100 и 500 мкМ/л) с последующим анализом концентрации/активности протеолитических и гемостатических маркеров с помощью метода твердофазного иммуноферментного анализа.
Результаты
Инкубация образцов стенки аорты, лежащих под тонкими сегментами ВПТ (B), с DL-ГЦ привела к повышению уровня активных форм ММП-2 по сравнению с контрольной тканью (9,54 ± 5,88 против 7,44 ± 4,48, p=0,011). DL-ГЦ стимулировал повышение концентрации т-АП и плазминогена в тонких фрагментах тромба (B1) по сравнению с контрольной тканью (соответственно: 1,39 ± 1,65 против 0,84 ± 0,74, p=0,024; 11,64 ± 5,05 против 10,34 ± 5,52, p=0,018). В отличие от этого в образцах стенки аорты, прилегающих к толстым сегментам тромба (A), зафиксировано снижение активности ММП-2 и ТФ по сравнению с контрольной тканью (5,89 ± 3,39 против 7,26 ± 5,49, p=0,046; 67,13 ± 72,59 против 114,46 ± 106,29, p=0,007 соответственно). В толстых участках ВПТ (A1) DL-ГЦ привел к уменьшению активности ММП-2 и снижению концентрации т-АП и плазминогена по сравнению с контрольной тканью (2,53 ± 2,02 против 3,28 ± 2,65, p=0,006; 0,67 ± 0,57 против 0,96 ± 0,91, p=0,021; 9,25 ± 4,59 против 12,63 ± 9,56, p=0,017 соответственно). Во всех участках выявлена прямая корреляция между показателями активности/концентрации ММП-2, ТФ и ИАП-1 в контрольной ткани и после инкубации с DL-ГЦ.
Выводы
Полученные данные свидетельствуют о том, что повышение концентрации ГЦ может усугублять повреждение артериальной стенки в тонких участках АБА вследствие увеличения активности ММП-2 и фибринолитических факторов.
1. Введение
Аневризма брюшной аорты (АБА) представляет собой аномальное необратимое расширение брюшной аорты, приводящее в 70-80% случаев к летальному исходу по причине разрыва аневризмы. Считается, что патогенез АБА обуславливается несколькими факторами [1, 2]. Изменения в системе коагуляции/фибринолиза и протеолитической активности могут стимулировать развитие АБА, приводить к сегментарному снижению прочности сосудистой стенки и способствовать дальнейшему расширению, что в конечном итоге может привести к разрыву АБА [3, 4].
В ходе нескольких исследований показано, что повышение уровня общего гомоцистеина (ГЦ, серосодержащая аминокислота, образующаяся из метионина) в плазме крови является выраженным независимым фактором риска возникновения сердечно-сосудистых заболеваний. Более того, установлена взаимосвязь между гипергомоцистеинемией (ГГЦ) и размером, диаметром и темпом роста АБА [5–9]. Согласно результатам ранее проведенных исследований, для пациентов с АБА было характерно значительное повышение уровня ГЦ в плазме крови по сравнению с контрольной группой, что сильно коррелировало с разрывом внутреннего эластичного слоя [5, 10–12]. ГГЦ может стимулировать развитие АБА посредством нескольких разных механизмов, например, через нарушение функции эндотелия, активацию процесса протеолиза, нарушение процесса фибринолиза и окислительное повреждение. Все указанные механизмы являются ключевыми этапами патогенеза АБА. Документально подтверждено, что ГЦ может активировать зимогенные про-формы ММП-2 с последующим их превращением в активные формы матриксной металлопротеиназы-2 (ММП-2). ГГЦ не только активирует матриксные металлопротеиназы, но и изменяет экспрессию тканевых ингибиторов металлопротеиназ (ТИМП). Это приводит к аномальной активности ММП, что также может быть связано с развитием АБА [13, 14]. Авторы нескольких исследований предположили, что ГГЦ приводит к изменениям в процессах коагуляции и фибринолиза. Отмечено, что гомоцистеин проявляет антифибринолитические свойства, ингибируя связывание тканевого активатора плазминогена (т-АП) с клетками эндотелия вне зависимости от экспрессии т-АП. Также он способствует тромбообразованию, активируя тканевой фактор (ТФ) и стимулируя экспрессию гена ингибитора активатора плазминогена 1 (ИАП-1) и его секрецию в сосудистое русло [15–18]. В совокупности большая часть данных наблюдений свидетельствует о том, что ГГЦ приводит к протромботическим изменениям функции эндотелия и способствует тромбообразованию. Однако механизм, лежащий в основе усугубления повреждения сосудов при повышении уровня ГЦ, остается неизвестным.
Внутрипросветные тромбы (ВПТ) встречаются в большинстве случаев АБА. Размеры ВПТ варьируют, также как и степень заполнения просвета АБА тромбом [19–21]. ВПТ могут располагаться эксцентрически или же покрывать всю внутреннюю стенку АБА. Ранее установлено, что толщина ВПТ является важным местным фактором, оказывающим влияние на подлежащую сосудистую стенку и адсорбцию компонентов плазмы крови. ВПТ также выполняют роль участков высвобождения и активации протеаз, что впоследствии приводит к деградации внеклеточного матрикса [19, 21, 22]. В настоящее время роль ВПТ в процессе развития и потенциального разрыва АБА по-прежнему остается весьма спорной. Некоторые исследователи считают, что ВПТ могут стимулировать разрыв АБА [23, 24]. В то же время большое количество данных свидетельствует о том, что биологически активным сегментом ВПТ является лишь люминальный слой, находящийся в непосредственном контакте со стенкой аневризмы, и что процесс протеолиза более активно протекает в части АБА, расположенной вблизи люминального слоя [25–27]. В своей предыдущей статье авторы настоящего исследования отметили, что часть аневризмы, связанная с тонкими сегментами ВПТ, характеризовалась более высокими концентрацией ММП и активностью коагуляционных процессов по сравнению с частями, связанными с толстыми сегментами тромба [27, 28]. Также установлено, что ВПТ в разорвавшихся аневризмах оказались значительно тоньше по сравнению с тромбами неразорвавшихся аневризм [19]. В целом, данные результаты подтверждают гипотезу о влиянии толщины ВПТ на вероятность разрыва АБА и значительном варьировании активности процессов протеолиза и фибринолиза в тонких и толстых сегментах ВПТ.
На основании результатов предыдущих работ авторы настоящего исследования выдвинули гипотезу о том, что ГЦ может быть фактором, различным образом активизирующим протеолитические и гемостатические системы в сегментах АБА, прилегающих к толстым и тонким участкам ВПТ, и что толщина ВПТ, наряду с активностью ГЦ, обуславливает вероятность разрыва АБА. В задачи данного исследования входило (i) изучение в лабораторных условиях воздействия повышенного уровня DL-ГЦ на протеолитическую и гемостатическую активность в толстых и тонких участках тромба и стенках аорты, лежащих непосредственно под тромбом, и (ii) анализ взаимосвязей между протеолитическими и гемостатическими параметрами в разных отделах аневризмы после инкубации с или без ГЦ. Результаты исследования могут способствовать дальнейшему усовершенствованию методов наблюдения за развитием аневризмы и появлению новых средств прогностической диагностики, основанных не только на анализе размера АБА.
2. Методы
2.1. Пациенты
Образцы ткани аневризмы аорты получены от 36 пациентов (средний возраст – 71 ± 8 лет, возрастной диапазон – от 55 лет до 81 года), проходящих эндоваскулярное лечение АБА, путем хирургического вмешательства. Данная группа пациентов включала в себя 27 (75%) мужчин и 9 (25%) женщин. Наиболее важным критерием включения стало одновременное присутствие толстых (от 25 мм включительно) и тонких (до 10 мм включительно) внутрипросветных тромбов в одном из аневризматических мешков. Критерии исключения охватывали нарушение функции печени, гематологические расстройства, нарушение функции почек в анамнезе и хроническую антикоагуляционную терапию. Все пациенты подписали форму информированного согласия. Исследование одобрено Этическим комитетом Померанского медицинского университета и проведено в соответствии с правилами Хельсинкской декларации.
2.2. Оценка диаметра АБА
Диаметр АБА и толщина ВПТ оценивались с помощью метода компьютерной томографии (КТ). Аорта с диаметром инфраренального отдела более 30 мм определялась как аневризма брюшной аорты. Для изменения просвета аорты на уровне максимального расширения использовались снимки КТ. Вычисление толщины ВПТ проводилось на основании разницы между максимальным диаметром просвета аорты и диаметром просвета в месте прилегания ВПТ.
2.3. Общий гомоцистеин в сыворотке крови
Перед проведением хирургического вмешательства у пациентов с АБА произведен забор образцов крови натощак. Для изменения концентрации общего ГЦ (для определения взаимосвязи с диаметром АБА, толщиной ВПТ и гемостатическими параметрами) использовались образцы сыворотки крови, изготовленные из образцов цельной крови с помощью центрифугирования в течение 30 минут при ускорении 3000 x g и температуре 4°C. Измерения проведены с помощью метода хемилюминесцентного иммунного анализа на микрочастицах (ХИАМ) на системе ARCHITECT System Homocysteine, Abbott Diagnostics, Лейк Блафф, Иллинойс, США.
2.4. Отбор образцов ткани
Для оценки воздействия DL-гомоцистеина в качестве потенциального стимулятора определенных параметров в лабораторных условиях при проведении хирургического вмешательства у пациентов из группы исследования взяты образцы ткани из участков максимального диаметра визуально толстых и тонких сегментов тромба АБА. Перед иссечением образцов в каждом участке измерена толщина тромба, для чего использовался лазерный микрометр. Образцы ткани взяты из средней трети продольного размера мешка АБА (участки A и B) на том же уровне, что и участки тромба (A1 и B1) (Рисунок 1). Образцы аневризмы разделены на четыре группы: толстые участки тромба (A1); тонкие участки тромба (B1); стенка (A), прилежащая к толстому сегменту тромба; стенка (B), прилежащая к тонкому сегменту тромба. Образцы ткани промыты холодным физиологическим раствором и взвешены.
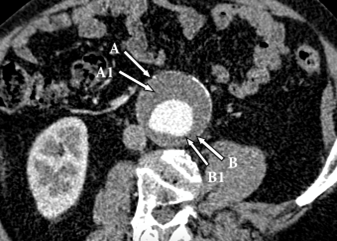 Рисунок 1. Стандартный снимок компьютерной томографии пациента с аневризмой брюшной аорты, где отображены участки взятия образцов: A - стенка, прилежащая к толстому сегменту тромба; A1 - толстый участок тромба; B - стенка, прилежащая к тонкому сегменту тромба; B1 - тонкий участок тромба
Рисунок 1. Стандартный снимок компьютерной томографии пациента с аневризмой брюшной аорты, где отображены участки взятия образцов: A - стенка, прилежащая к толстому сегменту тромба; A1 - толстый участок тромба; B - стенка, прилежащая к тонкому сегменту тромба; B1 - тонкий участок тромба
2.5. Инкубация образцов ткани
В ходе серии экспериментов все образцы ткани аневризмы прошли инкубацию в среде в присутствии DL-гомоцистеина или без него. Фрагменты аневризмы разрезаны на кусочки размером примерно 2 мм. Образцы ткани с одинаковым весом во влажном состоянии помещены в лунки 12-луночных планшетов, содержащих бессывороточную модифицированную по способу Дульбекко среду Игла (DMEM) с концентрацией глюкозы на уровне 4500 мг/л (без фенолового красного и L-глутамина; Sigma-Aldrich, Сент-Луис, Миссури, США). Фрагменты толстых и тонких участков ВПТ и образцы ткани прилегающих стенок инкубировались отдельно в присутствии DL-гомоцистеина в концентрации 100 мкМ/л или 500 мкМ/л (DL-Homocysteine ≥ 95%, Sigma-Aldrich) или без него при температуре 37°C в течение шести часов в условиях увлажненного воздуха с 5% объемным содержанием CO2. Из упоминаемого в литературных источниках широкого интервала концентраций DL-ГЦ (10-2000 мкМ/л) выбраны два значения (как было указано выше). Время инкубации выбрано на основании результатов ранее проведенных исследований [29]. В качестве контрольных образцов в каждом эксперименте использованы необработанные образцы ткани аневризмы. После обработки образцы ткани использовались для извлечения белков.
2.6. Извлечение белков
Прошедшие инкубацию образцы ткани стенки АБА и ВПТ измельчены до порошкообразного состояния при погружении в жидкий азот и последующем использовании гомогенизатора. Гомогенизированные ткани помещены в пробирки, содержащие лизирующий буфер: 150 мМ NaCl; 10 мМ Трис(гидроксиметил)аминометана гидрохлорида (Trizma-HCl) pH 7,4; 1% раствор Тритон X-100 и ингибитор (таблетки со смесью ингибиторов протеаз; все химические препараты производства компании Sigma-Aldrich). Суспензия инкубировалась на льду в течение 45 минут, после чего проводилось центрифугирование в течение 15 минут при ускорении 14 000 g и температуре 4°C. Надосадочная жидкость извлекалась из пробирок и хранилась при температуре -80°C до момента использования. Измерение концентрации белков в надосадочной жидкости проводилось с помощью реагента Бредфорда (BioRad, Геркулес, Калифорния, США) относительно калибровочной кривой, основанной на бычьем сывороточным альбумине. Образцы со значениями концентрации ниже необходимого для анализа уровня подвергались дополнительному центрифугированию (с помощью центробежного фильтра Amicon Ultra-0.5; Merck, Кенилворт, Нью-Джерси, США), после чего они вновь проходили анализ.
2.7. Измерения
2.7.1. Активность матричных металлопротеиназ
Авторы исследования провели анализ образцов тканевых белков для определения уровня активности ММП-2 и ММП-9 (с помощью наборов реактивов SensoLyte® 490 MMP-2 и SensoLyte® Plus 520 MMP-9; AnaSpec, Фримонт, Калифорния, США). Анализы проведены в соответствии с инструкциями производителя. Оба набора реактивов разработаны для определения активности ММП в различных биологических образцах, например, в гомогенате ткани, и предназначены для применения описанным ниже образом.
Для анализа активности ММП-2 используется пептид резонансного переноса энергии флуоресценции (FRET) с группой EDANS/DABCYL в качестве пары флуорофора/гасителя. Анализ проводился в черных 96-луночных микропланшетах. В качестве фонового контроля использовался аналитический буфер. Проведено измерение интенсивности флюоресценции (с помощью считывающего устройства для микропланшетов Multilabel Plate Reader, PerkinElmer, Уолтем, Массачусетс, США) при длине волн возбуждения и излучения 340 нм и 490 нм соответственно. Данные флюоресценции (конечные показания активности ММП) выражены в относительных единицах флуоресценции (ОЕФ) и переведены в мкМ на основании калибровочных кривых, полученных с помощью эталонного стандарта флуоресценции EDANS. Затем значения мкМ нормализованы с помощью концентрации общего белка для каждого образца. Результаты выражены в виде мкМ/мг общего белка.
Для анализа активности ММП-9 использовался флуорометрический набор реактивов ММП-9, содержащий предварительно окрашенные моноклональные антитела к ММП-9 человека. В качестве субстрата использовался пептид резонансного переноса энергии флуоресценции (FRET) с группой FAM/QXL520 в качестве пары флуорофора/гасителя. Анализ конечных результатов выполнен (с помощью считывающего устройства для микропланшетов Multilabel Plate Reader) при длине волн возбуждения 490 нм и излучения 520 нм. В качестве пустой пробы использовался аналитический буфер. ОЕФ переведены в нг с помощью калибровочной кривой, построенной с использованием очищенной ММП. Результаты нормализованы и выражены в виде нг/мг общего белка. Анализы проведены в двух параллельных опытах для четырех разных сегментов ткани каждого пациента.
2.7.2. Уровни концентрации гемостатических факторов
Для оценки гемостатических параметров гомогенатов ткани аорты использовался метод иммуноферментного твердофазного анализа (ИФА). Анализ проведен с помощью считывающего устройства для микропланшетов (EnVision Multilabel Plate Reader; PerkinElmer, США). Авторы работы выполнили анализ следующих параметров в соответствии с инструкциями производителя наборов реактивов (все химические препараты производства компании AssayPro, Сент-Чарльз, Миссури, США): активность тканевого фактора (набор реактивов AssaySense Human Tissue Factor (TF) Chromogenic Activity Assay Kit); концентрация тканевого активатора плазминогена (т-АП) (набор ИФА AssayMax Human tPA ELISA Kit); концентрация плазминогена (набор ИФА AssayMax Human Plasminogen ELISA Kit); концентрация ингибитора активатора плазминогена 1 (ИАП-1) (набор ИФА AssayMaxTM Human PAI-1 ELISA Kit). Уровень концентрации белка в гомогенатах ткани использовался для стандартизации значений. Окончательные значения концентрации и-АП и ИАП-1 выражены в виде нг/мг, значения концентрации плазминогена – в виде мкг/мг, а значения концентрации ТФ – в виде пМ/мг экстракта общего белка. Анализы проведены в двух параллельных опытах для четырех разных сегментов ткани каждого пациента.
2.8. Анализ данных
Авторами исследования выполнен статистический анализ данных (с помощью программного пакета Statistica v.13.0; StatSoft, Талса, Оклахома, США). Непрерывные переменные представлены в виде средних значений и стандартных отклонений. Для сравнения средних значений образцов, инкубированных при различных концентрациях ГЦ, применен однофакторный дисперсионный анализ (ANOVA) с ретроспективным анализом наименьшей значимой разности (НЗР). Взаимосвязь между параметрами установлена с помощью коэффициентов корреляции Пирсона. Статистическая значимость установлена на уровне p < 0,05.
3. Результаты
3.1. Уровень общего гомоцистеина в образцах
В таблице 1 приведены характеристики пациентов из группы АБА. ГГЦ определена как увеличение концентрации ГЦ в сыворотке крови выше 15 мкМ/л [30]. ГГЦ выявлена у 13 из 36 (36%) пациентов с АБА.
Таблица 1. Демографические, клинические и биохимические характеристики пациентов с аневризмой брюшной аорты (АБА)
3.2. Воздействие инкубации с DL-гомоцистеином на ММП и гемостатические параметры в тканях аневризмы
Результаты исследования свидетельствуют о том, что в отличие от тканей, инкубированных в среде, не содержащей DL-ГЦ, добавление DL-ГЦ оказало значительное воздействие на активность ММП-2 и ТФ, а также концентрацию плазминогена и т-АП. Данное воздействие имело дозозависимый характер и привело к различным эффектам в зависимости от толщины тромба (как описано ниже). Воздействие различных концентраций ГЦ на ткани аневризмы не привело к каким-либо значительным изменениям уровня активности ММП-9 и концентрации ИАП-1 по сравнению с показателями контрольной ткани аневризмы. Результаты исследования представлены на рисунке 2.
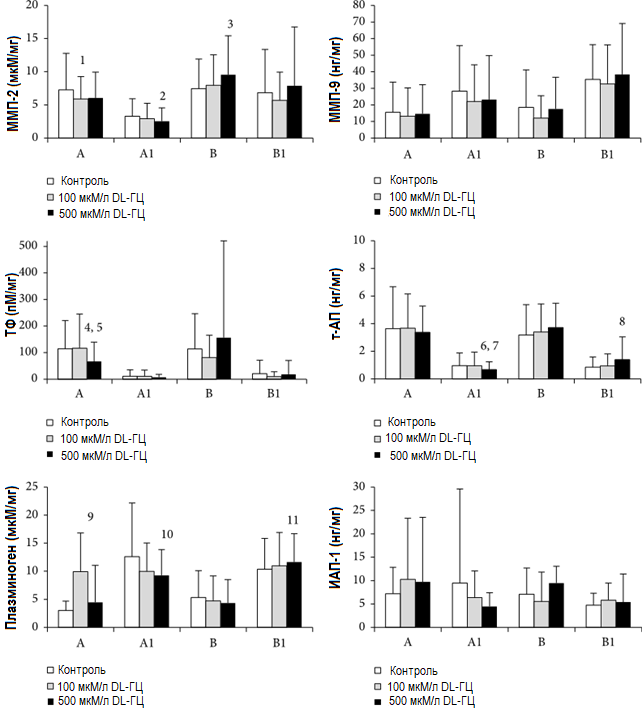 Рисунок 2. Воздействие DL-гомоцистеина (DL-ГЦ) на экспрессию протеолитических и гемостатических белков в тонких (B1) и толстых (A1) внутрипросветных тромбах и стенках, прилежащих к толстым (A) и тонким (B) внутрипросветным тромбам (n=36). Образцы ткани аневризмы инкубировались без DL-ГЦ (контроль) и в присутствии 100 или 500 мкМ/л DL-ГЦ в течение часов. Концентрация была определена в зависимости от массы общего белка. Столбцы отражают стандартные отклонения. Однофакторный дисперсионный анализ с ретроспективным анализом НЗР для парных сравнений контрольных образцов и тканей аневризмы, обработанных ГЦ. Ретроспективный анализ НЗР: 1, 100 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,046); 2, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,006); 3, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,011); 4, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,007); 5, 500 мкМ/л DL-ГЦ по сравнению с 100 мкМ/л DL-ГЦ (p=0,005); 6, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,021); 7, 500 мкМ/л DL-ГЦ по сравнению с 100 мкМ/л DL-ГЦ (p=0,031); 8, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,024); 9, 100 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,004); 10, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,017); 11, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,018)
Рисунок 2. Воздействие DL-гомоцистеина (DL-ГЦ) на экспрессию протеолитических и гемостатических белков в тонких (B1) и толстых (A1) внутрипросветных тромбах и стенках, прилежащих к толстым (A) и тонким (B) внутрипросветным тромбам (n=36). Образцы ткани аневризмы инкубировались без DL-ГЦ (контроль) и в присутствии 100 или 500 мкМ/л DL-ГЦ в течение часов. Концентрация была определена в зависимости от массы общего белка. Столбцы отражают стандартные отклонения. Однофакторный дисперсионный анализ с ретроспективным анализом НЗР для парных сравнений контрольных образцов и тканей аневризмы, обработанных ГЦ. Ретроспективный анализ НЗР: 1, 100 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,046); 2, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,006); 3, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,011); 4, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,007); 5, 500 мкМ/л DL-ГЦ по сравнению с 100 мкМ/л DL-ГЦ (p=0,005); 6, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,021); 7, 500 мкМ/л DL-ГЦ по сравнению с 100 мкМ/л DL-ГЦ (p=0,031); 8, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,024); 9, 100 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,004); 10, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,017); 11, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,018)
3.2.1. Тонкие участки аневризмы (B и B1)
Установлено, что по сравнению с контрольной тканью обработка DL-ГЦ в концентрации 500 мкм/л приводит к значительному повышению уровня активных форм ММП-2 в участках стенок, лежащих под тонкими сегментами ВПТ (B) (9,54 ± 5,88 против 7,44 ± 4,48, p=0,011). При обработке тонких сегментов тромба (B1) с помощью DL-ГЦ увеличение концентрации т-АП и плазминогена по сравнению с показателями контрольной ткани наблюдалось только при концентрации DL-ГЦ на уровне 500 мкМ/л (1,39 ± 1,65 против 0,84 ± 0,74, p=0,024; 11,65 ± 5,05 против 10,34 ± 5,52, p=0,018 соответственно).
3.2.2. Толстые участки аневризмы (A и A1)
Результаты анализа с тушением флуоресценции свидетельствуют о том, что обработка образцов ткани стенок, прилегающих к толстым сегментам тромба (A), с помощью DL-ГЦ в концентрации 100 мкМ/л приводила к значительному снижению концентрации активных форм ММП-2 по сравнению с показателями контрольной ткани (5,89 ± 3,39 против 7,26 ± 5,49, p=0,046). После обработки DL-ГЦ в концентрации 500 мкМ/л в толстых сегментах тромба (A1) также наблюдалось снижение концентрации активных форм ММП-2 (2,53 ± 2,02 против 3,28 ± 2,65, p=0,006). Образцы ткани стенок (A) характеризовались статистически значимым снижением активности ТФ при обработке DL-ГЦ в концентрации 500 мкМ/л по сравнению с контрольной тканью и тканями, инкубированными с DL-ГЦ в концентрации 100 мкМ/л (67,1 ± 72,6 против 114,5 ± 106,3, p=0,007; 67,1 ± 72,6 против 116,8 ± 128,3, p=0,005 соответственно). После обработки DL-ГЦ в концентрации 500 мкМ/л концентрация т-АП в толстых сегментах тромба (A1) была статистически значимо ниже по сравнению с показателями контрольной ткани (0,67 ± 0,57 против 0,96 ± 0,91, p=0,021) и тканей, обработанных DL-ГЦ в концентрации 100 мкМ/л (0,67 ± 0,57 против 0,94 ± 1,00, p=0,031). Уровень плазминогена также оказался значительно ниже в толстых сегментах тромба (A1), обработанных DL-ГЦ в концентрации 500 мкМ/л (9,25 ± 4,59 против 12,63 ± 9,56, p=0,017). Инкубация с DL-ГЦ в концентрации 100 мкМ/л приводила к значительному увеличению концентрации плазминогена в образцах ткани стенок (A) по сравнению с контрольными образцами (6,93 ± 6,88 против 3,01 ± 1,66, p=0,004).
3.3. Корреляции между уровнем ГЦ в сыворотке крови и диаметром АБА, толщиной ВПТ и гемостатическими параметрами
Выявлена выраженная положительная корреляция Пирсона между диаметром аневризмы и толщиной тромба (r=0,688, p=0,0001). Также обнаружены выраженные корреляции между уровнем ГЦ в сыворотке крови и концентрацией ТФ в тонких сегментах тромба (B1; r=0,653, p=0,0001) и концентрацией т-АП в образцах ткани стенок, прилегающих к толстым сегментам ВПТ (A; r=0,583, p=0,0001) (оба образца ткани инкубировались в среде, не содержащей ГЦ) (Таблица 2). Других значимых корреляций между уровнем ГЦ в сыворотке крои и оцениваемыми параметрами не наблюдалось.
Здесь Таблица 2
3.4. Корреляции между гемостатическими и протеолитическими параметрами в сегментах ВПТ и участках стенок АБА
Результаты оценки корреляций между парными параметрами после инкубации образцов из участков A, B, A1 и B1 в присутствии ГЦ и без него приведены в таблице 3. В таблице выделены статистические значимые значения (p<0,05). Анализ данных выявил положительные корреляции между уровнями активности/концентрацией ММП-2, ТФ и ИАП-1 во всех участках АБА. Оценка параметров проведена в контрольных образцах и образцах, обработанных DL-ГЦ в концентрации 100 и 500 мкМ/л. Важно отметить, что в образцах ткани стенок, прилегающих к толстым сегментам тромба (A), не выявлено выраженных корреляций с концентрацией плазминогена в контрольной ткани и после инкубации с DL-ГЦ в различной концентрации. Более того, не выявлено какой-либо корреляции с точки зрения активности ММП-9 в участках B1 (тонкие сегменты ВПТ).
Таблица 3. Корреляции между параметрами образцов ткани, инкубированных без DL-гомоцистеина (DL-ГЦ) (контроль), и теми же параметрами образцов ткани тонких и толстых сегментов внутрипросветного тромба (ВПТ) и прилегающих стенок аневризмы брюшной аорты (АБА) после инкубации с DL-ГЦ в различной концентрации
4. Обсуждение
Результаты ранее проведенных исследований свидетельствуют о наличии связи между концентрацией гомоцистеина и патогенезом аневризмы брюшной аорты [7, 8]. Выдвинута гипотеза о том, что ГЦ может приводить к деградации внеклеточного матрикса в результате изменения активности металлопротеиназ и параметров системы гемостаза, что в свою очередь является одним из ключевых этапов образования АБА, дальнейшего расширения аневризмы и, в конечном итоге, ее разрыва [6].
Основным выводом данного исследования является то, что инкубация образцов ткани аневризмы с ГЦ может оказывать воздействие на активность или концентрацию ММП, а также гемостатические параметры. Данное воздействие зависит от концентрации ГЦ и приводит к разным результатам в зависимости от толщины тромба. Помимо этого, авторы исследования установили, что активность/концентрация большей части гемостатических и протеолитических факторов в контрольных образцах (образцы ткани, инкубированные без ГЦ) в значительной мере коррелировали с показателями активности/концентрации после инкубации с ГЦ в различной концентрации. Данная закономерность наблюдалась для большей части оцениваемых параметров (за исключением концентрации плазминогена в участках A (ткань стенок, прилегающих к толстым сегментам ВПТ) и активности ММП-9 на участках B1 (тонкие сегменты ВПТ)). Это свидетельствует о том, что воздействие ГЦ в значительной мере зависит от исходной активности/концентрации данных факторов в сегментах ВПТ и прилегающих участках стенки аорты, а высокая активность протеолитических и гемостатических факторов в плазме крови пациентов в сочетании с повышенной концентрацией ГЦ может потенциально приводить к интенсификации процессов деградации сосудистой стенки и, следовательно, повышать риск разрыва АБА.
В ходе настоящего исследования авторы наблюдали, что ГЦ приводит к повышению активности ММП-2 и концентрации плазминогена и т-АП в тонких сегментах АБА (B и B1). Данное воздействие носило дозозависимый характер. Максимальные уровни активности/концентрации достигались при обработке ГЦ в концентрации 500 мкМ/л. Установлено, что инкубация толстых сегментов АБА (A и A1) с ГЦ приводит к уменьшению активности ММП-2 и ТФ, а также концентрации плазминогена и т-АП. Данное воздействие также носило дозозависимый характер. Полученные результаты отражают связанные с месторасположением отличия с точки зрения воздействия ГЦ на гемостатические и протеолитические процессы. Это позволяет сделать предположение о том, что ГЦ может принимать участие в патофизиологии АБА. ГЦ активирует или стимулирует накопление гемостатических и протеолитических факторов преимущественно в богатом кровью люминальном слое ВПТ, граничащем с кровотоком и являющемся биологически активным. В предыдущих исследованиях авторы показали, что в тонких сегментах АБА происходит активный протеолитический распад стенок аорты, и наблюдается высокая активность процесса коагуляции. [28]. На данные процессы могут оказывать стимулирующее воздействие факторы плазмы крови, включая ГЦ. Следовательно, можно предположить, что тонкие участки АБА в большей мере подвержены воздействию ГЦ. Тонкие тромбы значительно облегчают проникновение плазматических факторов и воспалительных клеток из просвета сосуда в стенку аневризмы по сравнению с толстыми тромбами [25]. Следует отметить, что существуют различные типы ВПТ, структура ВПТ разного типа различается, и тромбы могут менять свой тип [31]. ВПТ обладает богатым кровью люминальным слоем, граничащим с кровотоком и являющимся биологически активным в результате рекрутмента нейтрофилов, аккумуляции тромбоцитов, образования фибрина и удержания плазминогена и т-АП. Со временем люминальный слой ВПТ превращается в промежуточный и, в конечном итоге, в мертвый аблюминальный участок стенки АБА, что сопровождается лизисом эритроцитов, апоптозом лейкоцитов и фибринолизом различной степени выраженности. Самые старые аблюминальные слои обычно характеризуются крайне низким уровнем активности ферментов [32]. Как известно, только люминальный слой ВПТ содержит активные белки и характеризуется высокой прокоагуляционной активностью, а более глубокие слои ВПТ характеризуются более низкой концентрацией активных форм протеаз [28, 32]. Отсутствие клеток в более глубоких слоях ВПТ (толстых сегментах ВПТ) исключает возможность синтеза новых протеаз в данных участках. Также следует отметить, что толщина ВПТ не является постоянной на всем протяжении аневризмы [20, 21]. Она может варьировать в каждой отдельной аневризме. Таким образом, можно предположить, что тонкие сегменты образцов, проанализированных в настоящем исследовании, преимущественно включали в себя люминальные (биоактивные) участки, в то время как более толстые многослойные сегменты состояли из четко выраженных слоев с низкой, но определяемой концентрацией активных протеаз в люминальном слое. Вполне возможно, что стимуляция процесса протеолиза и нарушения в процессе фибринолиза в результате воздействия ГЦ в тонких сегментах АБА является частью цепной реакции, приводящей к разрушению стенки АБА и, в конечном итоге, к ее разрыву. Для подтверждения данной гипотезы необходимы дальнейшие исследования.
Известно, что повреждение стенки аорты в сочетании с АБА приводит к высвобождению ТФ, активирующего процессы коагуляции и образования ВПТ. Деградация стенки аорты также может играть определенную роль в активации фибринолиза через т-АП. Данные процессы ведут к образованию плазмина, активирующего ММП и выполняющего важную роль в последовательности событий, приводящих к разрушению аортальной матрицы в АБА. В некоторых исследованиях сделано предположение о том, что повышение концентрации ГЦ в крови может приводить к изменениям в данных процессах. Большая часть таких наблюдений свидетельствует о том, что ГГЦ приводит к нарушениям в процессах тромбообразования, фибринолиза и протеолиза [15–18, 33, 34].
Парадоксально, но результаты настоящего исследования показывают, что ГЦ негативно влияет на концентрацию активных форм ММП-2, однако никакого воздействия на активность ММП-9 выявлено не было. Отсутствие какой-либо связи и воздействия ГЦ на активность ММП-9 может стать доводом против того, что ГЦ принимает участие в процессе активации ММП-9. Тем не менее, ранее было установлено, что ГЦ приводит к активации латентных форм ММП-9. Авторы исследования Lee et al. [35] сообщали, что ГЦ увеличивает образование ММП-9 в макрофагах мышей. Авторы исследования Moshal et al. [14] наблюдали, что ГЦ стимулирует образование ММП-9 в эндотелиальных клетках микрососудов (MVEC). Более того, авторы исследования Tsarouhas et al. [36] выявили прямую корреляцию между концентрацией ММП-9 в тканях и сыворотке крови и концентрацией ГЦ в сыворотке крови. Они выдвинули гипотезу о том, что ГЦ принимает участие в патогенезе АБА, регулируя экспрессию ММП-9. Данное расхождение может быть частично объяснено двойственным эффектом, оказывающим ГЦ. Согласно авторам исследования Bescond et al. [13], высокая экспериментальная концентрация ГЦ подавляет активацию ММП при высоком молярном отношении. С другой стороны, снижение концентрации ГЦ приводит к повышению уровней экспрессии ММП-2 и ММП-9 и активации проММП-2 при низком молярном отношении. Интервал концентрации ГЦ для настоящего исследования выбран на основании имеющихся литературных данных. Несмотря на это следует отметить, что уровни концентрации, использованные в данном исследовании, значительно превышают уровень концентрации ГЦ в плазме крови здорового человека. Использованные в настоящем исследовании уровни концентрации ГЦ (100 и 500 мкМ/л) соответствуют ГГЦ средней или высокой степени тяжести [37].
Настоящее исследование не выявило какой-либо корреляции между размерами АБА и концентрацией общего ГЦ в сыворотке крови. Данное наблюдение подтверждает результаты исследования Lindqvist et al. [38], авторы которого не обнаружили взаимосвязи между АБА и гомоцистеином, однако оно контрастирует с результатами других работ [8, 10, 39]. В большей части предыдущих исследований, посвященных оценке концентрации ГЦ в циркулирующей крови, установлено, что для пациентов с АБА характерны более высокие уровни концентрации ГЦ по сравнению с представителями контрольных групп, не страдающих от АБА [9, 10, 39]. При проведении других исследований методом случай-контроль выявлено, что средний уровень ГЦ в плазме крови оказался выше у пациентов с АБА по сравнению с результатами настоящего исследования [5, 8–10]. Данное расхождение может быть обусловлено разным объемом выборки в ранее опубликованных исследованиях. В настоящем исследовании выявлены только две выраженные корреляции с уровнем концентрации ГЦ в сыворотке крови: данный показатель коррелирует с активность ТФ в контрольных образцах тонких сегментов ВПТ (B1) и с концентрацией т-АП в контрольных образцах ткани стенок, прилегающих к толстым сегментам ВПТ (A). Первая взаимосвязь может быть обусловлена характеристиками тонких тромбов, участвующих в процессе переноса из крови в стенку АБА большего количества стимулирующих факторов, принимающих участие в процессе протеолиза, в то время как толстые сегменты ВПТ выступают в роли барьера для таких факторов. Однако авторы исследования Wiernicki et al. [40] выявили связь между тонкими сегментами ВПТ и низкой концентрацией ГЦ в плазме крови, что, возможно, указывает на потенциальную роль ГЦ как протромботического маркера. Что касается корреляции между уровнем концентрации ГЦ в сыворотке крови и т-АП в тканях стенок, прилегающих к толстым сегментам ВПТ, результаты ранее проведенных исследований свидетельствуют о том, что т-АП преимущественно встречается именно в стенке аневризмы [4, 22]. Более того, в своем предыдущем исследовании авторы настоящей статьи установили, что наивысшие концентрации т-АП определялись в стенке АБА, в частности, в участках стенки, прилегающих к толстым сегментам ВПТ [28]. В рамках настоящего исследования проводились измерения параметров фрагментов тканей ВПТ и стенок АБА без кондиционированных сред. Факторы могут в той или иной мере удерживаться в тканях благодаря дифференциальному связыванию с различными структурными компонентами, или же они могут высвобождаться в среду. В данной работе высвобожденные белки не принимались во внимание.
Можно предположить, что взаимосвязь между возникновением АБА и повышенной концентрацией ГЦ является весьма сложной, так как на нее могут оказывать влияние различные факторы окружающей среды и генетические факторы, что также может служить объяснением расхождений между полученными результатами [6]. Неизвестно, является ли ГЦ фактором, инициирующим возникновение АБА, или же он интенсифицирует изменения в сосудистых стенках, возникающих под воздействием других факторов. Напрашивается мысль о том, что данная аминокислота является дополнительным фактором, действие которого накладывается на вредоносное воздействие других факторов. Если участие ГЦ в патогенезе АБА будет подтверждено, появится возможность разработки соответствующих консервативных методов лечения пациентов из группы риска. Это обуславливает необходимость проведения дальнейших исследований для определения того, принимает ли ГЦ участие в образовании и/или развитии аневризмы, или же ГЦ является всего лишь маркером данного заболевания.
Настоящее исследование характеризуется несколькими ограничениями. Эксперимент проведен в лабораторных условиях, и ограничения, связанные с экспериментами такого типа, не позволяют просто перенести полученные результаты на процессы, происходящие в организме человека. Естественные условия являются гораздо более сложными и характеризуются значительно более высокой степенью протеолитической и гемостатической активности. Относительные доли биологически активных регионов биоптатов могут различаться, в связи с чем анализ полнослойных гомогенатов, нормированный к концентрации общего белка, может влиять на результаты оценки общей экспрессии и активности люминальных компонентов. Кроме того, изучение участков стенки АБА без ВПТ пошло бы на пользу исследованию и позволило бы получить более достоверные результаты.
5. Выводы
Несмотря на упомянутые ограничения авторы исследования установили значительное воздействие инкубации тканей аневризмы с ГЦ в различной концентрации на фибринолитические и протеолитические параметры в зависимости от толщины тромба во всех проанализированных участках АБА. Результаты данного лабораторного исследования свидетельствуют о возможном наличии связи между повышением концентрации ГЦ и активацией ММП-2 и гемостатических факторов в тонких сегментах аневризмы. Системы фибринолиза и коагуляции обладают выраженной способностью к регулированию протеолиза внеклеточного матрикса стенки АБА. Принимая во внимание данный факт, информация о дифференциальных эффектах ГЦ в зависимости от пространственного распределения компонентов этих двух систем может быть использована для составления планов по наблюдению за АБА, оценки потенциального риска разрыва и, вероятно, выбора более эффективного метода лечения. Однако степень значимости данного наблюдения является неопределенной, так как некоторые фрагменты ткани подвергались воздействию крайне высоких концентраций ГЦ, хотя это и свидетельствует о потенциальной способности ГЦ в высоких концентрациях усугублять повреждение эластина артерий в тонких сегментах АБА в результате повышения активности ММП и других фибринолитических факторов. Определение четких механизмов взаимосвязи между воздействием ГЦ и образованием АБА должно стать предметом дальнейших исследований.
Список литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
BioMed Research International
Volume 2018, Article ID 3205324, 10 pages
Алдона Сенницкая, Марта Зуховски, Корнел Хелстовски, Милослав Кнотливы, Джереми Саймон Кларк, Мария Ястшембска
Аннотация
Гомоцистеин (ГЦ) может оказывать влияние на патогенез аневризмы брюшной аорты (АБА) посредством стимуляции процесса протеолиза и нарушенной системы коагуляции и фибринолиза. Повышение гемостатической активности может стимулировать процесс местного протеолитического распада стенки аорты. Целью данного исследования являлось изучение влияния ГЦ на гемостатические и протеолитические процессы в образцах толстых и тонких фрагментов внутрипросветного тромба (ВПТ) и подлежащих стенок.
Субъекты и методы
В исследование включены 36 пациентов, прошедших хирургическое лечение по поводу АБА. В рамках серии экспериментов проведена инкубация образцов ткани аневризмы с DL-ГЦ (100 и 500 мкМ/л) с последующим анализом концентрации/активности протеолитических и гемостатических маркеров с помощью метода твердофазного иммуноферментного анализа.
Результаты
Инкубация образцов стенки аорты, лежащих под тонкими сегментами ВПТ (B), с DL-ГЦ привела к повышению уровня активных форм ММП-2 по сравнению с контрольной тканью (9,54 ± 5,88 против 7,44 ± 4,48, p=0,011). DL-ГЦ стимулировал повышение концентрации т-АП и плазминогена в тонких фрагментах тромба (B1) по сравнению с контрольной тканью (соответственно: 1,39 ± 1,65 против 0,84 ± 0,74, p=0,024; 11,64 ± 5,05 против 10,34 ± 5,52, p=0,018). В отличие от этого в образцах стенки аорты, прилегающих к толстым сегментам тромба (A), зафиксировано снижение активности ММП-2 и ТФ по сравнению с контрольной тканью (5,89 ± 3,39 против 7,26 ± 5,49, p=0,046; 67,13 ± 72,59 против 114,46 ± 106,29, p=0,007 соответственно). В толстых участках ВПТ (A1) DL-ГЦ привел к уменьшению активности ММП-2 и снижению концентрации т-АП и плазминогена по сравнению с контрольной тканью (2,53 ± 2,02 против 3,28 ± 2,65, p=0,006; 0,67 ± 0,57 против 0,96 ± 0,91, p=0,021; 9,25 ± 4,59 против 12,63 ± 9,56, p=0,017 соответственно). Во всех участках выявлена прямая корреляция между показателями активности/концентрации ММП-2, ТФ и ИАП-1 в контрольной ткани и после инкубации с DL-ГЦ.
Выводы
Полученные данные свидетельствуют о том, что повышение концентрации ГЦ может усугублять повреждение артериальной стенки в тонких участках АБА вследствие увеличения активности ММП-2 и фибринолитических факторов.
1. Введение
Аневризма брюшной аорты (АБА) представляет собой аномальное необратимое расширение брюшной аорты, приводящее в 70-80% случаев к летальному исходу по причине разрыва аневризмы. Считается, что патогенез АБА обуславливается несколькими факторами [1, 2]. Изменения в системе коагуляции/фибринолиза и протеолитической активности могут стимулировать развитие АБА, приводить к сегментарному снижению прочности сосудистой стенки и способствовать дальнейшему расширению, что в конечном итоге может привести к разрыву АБА [3, 4].
В ходе нескольких исследований показано, что повышение уровня общего гомоцистеина (ГЦ, серосодержащая аминокислота, образующаяся из метионина) в плазме крови является выраженным независимым фактором риска возникновения сердечно-сосудистых заболеваний. Более того, установлена взаимосвязь между гипергомоцистеинемией (ГГЦ) и размером, диаметром и темпом роста АБА [5–9]. Согласно результатам ранее проведенных исследований, для пациентов с АБА было характерно значительное повышение уровня ГЦ в плазме крови по сравнению с контрольной группой, что сильно коррелировало с разрывом внутреннего эластичного слоя [5, 10–12]. ГГЦ может стимулировать развитие АБА посредством нескольких разных механизмов, например, через нарушение функции эндотелия, активацию процесса протеолиза, нарушение процесса фибринолиза и окислительное повреждение. Все указанные механизмы являются ключевыми этапами патогенеза АБА. Документально подтверждено, что ГЦ может активировать зимогенные про-формы ММП-2 с последующим их превращением в активные формы матриксной металлопротеиназы-2 (ММП-2). ГГЦ не только активирует матриксные металлопротеиназы, но и изменяет экспрессию тканевых ингибиторов металлопротеиназ (ТИМП). Это приводит к аномальной активности ММП, что также может быть связано с развитием АБА [13, 14]. Авторы нескольких исследований предположили, что ГГЦ приводит к изменениям в процессах коагуляции и фибринолиза. Отмечено, что гомоцистеин проявляет антифибринолитические свойства, ингибируя связывание тканевого активатора плазминогена (т-АП) с клетками эндотелия вне зависимости от экспрессии т-АП. Также он способствует тромбообразованию, активируя тканевой фактор (ТФ) и стимулируя экспрессию гена ингибитора активатора плазминогена 1 (ИАП-1) и его секрецию в сосудистое русло [15–18]. В совокупности большая часть данных наблюдений свидетельствует о том, что ГГЦ приводит к протромботическим изменениям функции эндотелия и способствует тромбообразованию. Однако механизм, лежащий в основе усугубления повреждения сосудов при повышении уровня ГЦ, остается неизвестным.
Внутрипросветные тромбы (ВПТ) встречаются в большинстве случаев АБА. Размеры ВПТ варьируют, также как и степень заполнения просвета АБА тромбом [19–21]. ВПТ могут располагаться эксцентрически или же покрывать всю внутреннюю стенку АБА. Ранее установлено, что толщина ВПТ является важным местным фактором, оказывающим влияние на подлежащую сосудистую стенку и адсорбцию компонентов плазмы крови. ВПТ также выполняют роль участков высвобождения и активации протеаз, что впоследствии приводит к деградации внеклеточного матрикса [19, 21, 22]. В настоящее время роль ВПТ в процессе развития и потенциального разрыва АБА по-прежнему остается весьма спорной. Некоторые исследователи считают, что ВПТ могут стимулировать разрыв АБА [23, 24]. В то же время большое количество данных свидетельствует о том, что биологически активным сегментом ВПТ является лишь люминальный слой, находящийся в непосредственном контакте со стенкой аневризмы, и что процесс протеолиза более активно протекает в части АБА, расположенной вблизи люминального слоя [25–27]. В своей предыдущей статье авторы настоящего исследования отметили, что часть аневризмы, связанная с тонкими сегментами ВПТ, характеризовалась более высокими концентрацией ММП и активностью коагуляционных процессов по сравнению с частями, связанными с толстыми сегментами тромба [27, 28]. Также установлено, что ВПТ в разорвавшихся аневризмах оказались значительно тоньше по сравнению с тромбами неразорвавшихся аневризм [19]. В целом, данные результаты подтверждают гипотезу о влиянии толщины ВПТ на вероятность разрыва АБА и значительном варьировании активности процессов протеолиза и фибринолиза в тонких и толстых сегментах ВПТ.
На основании результатов предыдущих работ авторы настоящего исследования выдвинули гипотезу о том, что ГЦ может быть фактором, различным образом активизирующим протеолитические и гемостатические системы в сегментах АБА, прилегающих к толстым и тонким участкам ВПТ, и что толщина ВПТ, наряду с активностью ГЦ, обуславливает вероятность разрыва АБА. В задачи данного исследования входило (i) изучение в лабораторных условиях воздействия повышенного уровня DL-ГЦ на протеолитическую и гемостатическую активность в толстых и тонких участках тромба и стенках аорты, лежащих непосредственно под тромбом, и (ii) анализ взаимосвязей между протеолитическими и гемостатическими параметрами в разных отделах аневризмы после инкубации с или без ГЦ. Результаты исследования могут способствовать дальнейшему усовершенствованию методов наблюдения за развитием аневризмы и появлению новых средств прогностической диагностики, основанных не только на анализе размера АБА.
2. Методы
2.1. Пациенты
Образцы ткани аневризмы аорты получены от 36 пациентов (средний возраст – 71 ± 8 лет, возрастной диапазон – от 55 лет до 81 года), проходящих эндоваскулярное лечение АБА, путем хирургического вмешательства. Данная группа пациентов включала в себя 27 (75%) мужчин и 9 (25%) женщин. Наиболее важным критерием включения стало одновременное присутствие толстых (от 25 мм включительно) и тонких (до 10 мм включительно) внутрипросветных тромбов в одном из аневризматических мешков. Критерии исключения охватывали нарушение функции печени, гематологические расстройства, нарушение функции почек в анамнезе и хроническую антикоагуляционную терапию. Все пациенты подписали форму информированного согласия. Исследование одобрено Этическим комитетом Померанского медицинского университета и проведено в соответствии с правилами Хельсинкской декларации.
2.2. Оценка диаметра АБА
Диаметр АБА и толщина ВПТ оценивались с помощью метода компьютерной томографии (КТ). Аорта с диаметром инфраренального отдела более 30 мм определялась как аневризма брюшной аорты. Для изменения просвета аорты на уровне максимального расширения использовались снимки КТ. Вычисление толщины ВПТ проводилось на основании разницы между максимальным диаметром просвета аорты и диаметром просвета в месте прилегания ВПТ.
2.3. Общий гомоцистеин в сыворотке крови
Перед проведением хирургического вмешательства у пациентов с АБА произведен забор образцов крови натощак. Для изменения концентрации общего ГЦ (для определения взаимосвязи с диаметром АБА, толщиной ВПТ и гемостатическими параметрами) использовались образцы сыворотки крови, изготовленные из образцов цельной крови с помощью центрифугирования в течение 30 минут при ускорении 3000 x g и температуре 4°C. Измерения проведены с помощью метода хемилюминесцентного иммунного анализа на микрочастицах (ХИАМ) на системе ARCHITECT System Homocysteine, Abbott Diagnostics, Лейк Блафф, Иллинойс, США.
2.4. Отбор образцов ткани
Для оценки воздействия DL-гомоцистеина в качестве потенциального стимулятора определенных параметров в лабораторных условиях при проведении хирургического вмешательства у пациентов из группы исследования взяты образцы ткани из участков максимального диаметра визуально толстых и тонких сегментов тромба АБА. Перед иссечением образцов в каждом участке измерена толщина тромба, для чего использовался лазерный микрометр. Образцы ткани взяты из средней трети продольного размера мешка АБА (участки A и B) на том же уровне, что и участки тромба (A1 и B1) (Рисунок 1). Образцы аневризмы разделены на четыре группы: толстые участки тромба (A1); тонкие участки тромба (B1); стенка (A), прилежащая к толстому сегменту тромба; стенка (B), прилежащая к тонкому сегменту тромба. Образцы ткани промыты холодным физиологическим раствором и взвешены.
 Рисунок 1. Стандартный снимок компьютерной томографии пациента с аневризмой брюшной аорты, где отображены участки взятия образцов: A - стенка, прилежащая к толстому сегменту тромба; A1 - толстый участок тромба; B - стенка, прилежащая к тонкому сегменту тромба; B1 - тонкий участок тромба
Рисунок 1. Стандартный снимок компьютерной томографии пациента с аневризмой брюшной аорты, где отображены участки взятия образцов: A - стенка, прилежащая к толстому сегменту тромба; A1 - толстый участок тромба; B - стенка, прилежащая к тонкому сегменту тромба; B1 - тонкий участок тромба2.5. Инкубация образцов ткани
В ходе серии экспериментов все образцы ткани аневризмы прошли инкубацию в среде в присутствии DL-гомоцистеина или без него. Фрагменты аневризмы разрезаны на кусочки размером примерно 2 мм. Образцы ткани с одинаковым весом во влажном состоянии помещены в лунки 12-луночных планшетов, содержащих бессывороточную модифицированную по способу Дульбекко среду Игла (DMEM) с концентрацией глюкозы на уровне 4500 мг/л (без фенолового красного и L-глутамина; Sigma-Aldrich, Сент-Луис, Миссури, США). Фрагменты толстых и тонких участков ВПТ и образцы ткани прилегающих стенок инкубировались отдельно в присутствии DL-гомоцистеина в концентрации 100 мкМ/л или 500 мкМ/л (DL-Homocysteine ≥ 95%, Sigma-Aldrich) или без него при температуре 37°C в течение шести часов в условиях увлажненного воздуха с 5% объемным содержанием CO2. Из упоминаемого в литературных источниках широкого интервала концентраций DL-ГЦ (10-2000 мкМ/л) выбраны два значения (как было указано выше). Время инкубации выбрано на основании результатов ранее проведенных исследований [29]. В качестве контрольных образцов в каждом эксперименте использованы необработанные образцы ткани аневризмы. После обработки образцы ткани использовались для извлечения белков.
2.6. Извлечение белков
Прошедшие инкубацию образцы ткани стенки АБА и ВПТ измельчены до порошкообразного состояния при погружении в жидкий азот и последующем использовании гомогенизатора. Гомогенизированные ткани помещены в пробирки, содержащие лизирующий буфер: 150 мМ NaCl; 10 мМ Трис(гидроксиметил)аминометана гидрохлорида (Trizma-HCl) pH 7,4; 1% раствор Тритон X-100 и ингибитор (таблетки со смесью ингибиторов протеаз; все химические препараты производства компании Sigma-Aldrich). Суспензия инкубировалась на льду в течение 45 минут, после чего проводилось центрифугирование в течение 15 минут при ускорении 14 000 g и температуре 4°C. Надосадочная жидкость извлекалась из пробирок и хранилась при температуре -80°C до момента использования. Измерение концентрации белков в надосадочной жидкости проводилось с помощью реагента Бредфорда (BioRad, Геркулес, Калифорния, США) относительно калибровочной кривой, основанной на бычьем сывороточным альбумине. Образцы со значениями концентрации ниже необходимого для анализа уровня подвергались дополнительному центрифугированию (с помощью центробежного фильтра Amicon Ultra-0.5; Merck, Кенилворт, Нью-Джерси, США), после чего они вновь проходили анализ.
2.7. Измерения
2.7.1. Активность матричных металлопротеиназ
Авторы исследования провели анализ образцов тканевых белков для определения уровня активности ММП-2 и ММП-9 (с помощью наборов реактивов SensoLyte® 490 MMP-2 и SensoLyte® Plus 520 MMP-9; AnaSpec, Фримонт, Калифорния, США). Анализы проведены в соответствии с инструкциями производителя. Оба набора реактивов разработаны для определения активности ММП в различных биологических образцах, например, в гомогенате ткани, и предназначены для применения описанным ниже образом.
Для анализа активности ММП-2 используется пептид резонансного переноса энергии флуоресценции (FRET) с группой EDANS/DABCYL в качестве пары флуорофора/гасителя. Анализ проводился в черных 96-луночных микропланшетах. В качестве фонового контроля использовался аналитический буфер. Проведено измерение интенсивности флюоресценции (с помощью считывающего устройства для микропланшетов Multilabel Plate Reader, PerkinElmer, Уолтем, Массачусетс, США) при длине волн возбуждения и излучения 340 нм и 490 нм соответственно. Данные флюоресценции (конечные показания активности ММП) выражены в относительных единицах флуоресценции (ОЕФ) и переведены в мкМ на основании калибровочных кривых, полученных с помощью эталонного стандарта флуоресценции EDANS. Затем значения мкМ нормализованы с помощью концентрации общего белка для каждого образца. Результаты выражены в виде мкМ/мг общего белка.
Для анализа активности ММП-9 использовался флуорометрический набор реактивов ММП-9, содержащий предварительно окрашенные моноклональные антитела к ММП-9 человека. В качестве субстрата использовался пептид резонансного переноса энергии флуоресценции (FRET) с группой FAM/QXL520 в качестве пары флуорофора/гасителя. Анализ конечных результатов выполнен (с помощью считывающего устройства для микропланшетов Multilabel Plate Reader) при длине волн возбуждения 490 нм и излучения 520 нм. В качестве пустой пробы использовался аналитический буфер. ОЕФ переведены в нг с помощью калибровочной кривой, построенной с использованием очищенной ММП. Результаты нормализованы и выражены в виде нг/мг общего белка. Анализы проведены в двух параллельных опытах для четырех разных сегментов ткани каждого пациента.
2.7.2. Уровни концентрации гемостатических факторов
Для оценки гемостатических параметров гомогенатов ткани аорты использовался метод иммуноферментного твердофазного анализа (ИФА). Анализ проведен с помощью считывающего устройства для микропланшетов (EnVision Multilabel Plate Reader; PerkinElmer, США). Авторы работы выполнили анализ следующих параметров в соответствии с инструкциями производителя наборов реактивов (все химические препараты производства компании AssayPro, Сент-Чарльз, Миссури, США): активность тканевого фактора (набор реактивов AssaySense Human Tissue Factor (TF) Chromogenic Activity Assay Kit); концентрация тканевого активатора плазминогена (т-АП) (набор ИФА AssayMax Human tPA ELISA Kit); концентрация плазминогена (набор ИФА AssayMax Human Plasminogen ELISA Kit); концентрация ингибитора активатора плазминогена 1 (ИАП-1) (набор ИФА AssayMaxTM Human PAI-1 ELISA Kit). Уровень концентрации белка в гомогенатах ткани использовался для стандартизации значений. Окончательные значения концентрации и-АП и ИАП-1 выражены в виде нг/мг, значения концентрации плазминогена – в виде мкг/мг, а значения концентрации ТФ – в виде пМ/мг экстракта общего белка. Анализы проведены в двух параллельных опытах для четырех разных сегментов ткани каждого пациента.
2.8. Анализ данных
Авторами исследования выполнен статистический анализ данных (с помощью программного пакета Statistica v.13.0; StatSoft, Талса, Оклахома, США). Непрерывные переменные представлены в виде средних значений и стандартных отклонений. Для сравнения средних значений образцов, инкубированных при различных концентрациях ГЦ, применен однофакторный дисперсионный анализ (ANOVA) с ретроспективным анализом наименьшей значимой разности (НЗР). Взаимосвязь между параметрами установлена с помощью коэффициентов корреляции Пирсона. Статистическая значимость установлена на уровне p < 0,05.
3. Результаты
3.1. Уровень общего гомоцистеина в образцах
В таблице 1 приведены характеристики пациентов из группы АБА. ГГЦ определена как увеличение концентрации ГЦ в сыворотке крови выше 15 мкМ/л [30]. ГГЦ выявлена у 13 из 36 (36%) пациентов с АБА.
Таблица 1. Демографические, клинические и биохимические характеристики пациентов с аневризмой брюшной аорты (АБА)
3.2. Воздействие инкубации с DL-гомоцистеином на ММП и гемостатические параметры в тканях аневризмы
Результаты исследования свидетельствуют о том, что в отличие от тканей, инкубированных в среде, не содержащей DL-ГЦ, добавление DL-ГЦ оказало значительное воздействие на активность ММП-2 и ТФ, а также концентрацию плазминогена и т-АП. Данное воздействие имело дозозависимый характер и привело к различным эффектам в зависимости от толщины тромба (как описано ниже). Воздействие различных концентраций ГЦ на ткани аневризмы не привело к каким-либо значительным изменениям уровня активности ММП-9 и концентрации ИАП-1 по сравнению с показателями контрольной ткани аневризмы. Результаты исследования представлены на рисунке 2.
 Рисунок 2. Воздействие DL-гомоцистеина (DL-ГЦ) на экспрессию протеолитических и гемостатических белков в тонких (B1) и толстых (A1) внутрипросветных тромбах и стенках, прилежащих к толстым (A) и тонким (B) внутрипросветным тромбам (n=36). Образцы ткани аневризмы инкубировались без DL-ГЦ (контроль) и в присутствии 100 или 500 мкМ/л DL-ГЦ в течение часов. Концентрация была определена в зависимости от массы общего белка. Столбцы отражают стандартные отклонения. Однофакторный дисперсионный анализ с ретроспективным анализом НЗР для парных сравнений контрольных образцов и тканей аневризмы, обработанных ГЦ. Ретроспективный анализ НЗР: 1, 100 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,046); 2, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,006); 3, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,011); 4, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,007); 5, 500 мкМ/л DL-ГЦ по сравнению с 100 мкМ/л DL-ГЦ (p=0,005); 6, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,021); 7, 500 мкМ/л DL-ГЦ по сравнению с 100 мкМ/л DL-ГЦ (p=0,031); 8, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,024); 9, 100 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,004); 10, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,017); 11, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,018)
Рисунок 2. Воздействие DL-гомоцистеина (DL-ГЦ) на экспрессию протеолитических и гемостатических белков в тонких (B1) и толстых (A1) внутрипросветных тромбах и стенках, прилежащих к толстым (A) и тонким (B) внутрипросветным тромбам (n=36). Образцы ткани аневризмы инкубировались без DL-ГЦ (контроль) и в присутствии 100 или 500 мкМ/л DL-ГЦ в течение часов. Концентрация была определена в зависимости от массы общего белка. Столбцы отражают стандартные отклонения. Однофакторный дисперсионный анализ с ретроспективным анализом НЗР для парных сравнений контрольных образцов и тканей аневризмы, обработанных ГЦ. Ретроспективный анализ НЗР: 1, 100 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,046); 2, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,006); 3, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,011); 4, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,007); 5, 500 мкМ/л DL-ГЦ по сравнению с 100 мкМ/л DL-ГЦ (p=0,005); 6, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,021); 7, 500 мкМ/л DL-ГЦ по сравнению с 100 мкМ/л DL-ГЦ (p=0,031); 8, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,024); 9, 100 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,004); 10, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,017); 11, 500 мкМ/л DL-ГЦ по сравнению с контрольной группой (p=0,018)3.2.1. Тонкие участки аневризмы (B и B1)
Установлено, что по сравнению с контрольной тканью обработка DL-ГЦ в концентрации 500 мкм/л приводит к значительному повышению уровня активных форм ММП-2 в участках стенок, лежащих под тонкими сегментами ВПТ (B) (9,54 ± 5,88 против 7,44 ± 4,48, p=0,011). При обработке тонких сегментов тромба (B1) с помощью DL-ГЦ увеличение концентрации т-АП и плазминогена по сравнению с показателями контрольной ткани наблюдалось только при концентрации DL-ГЦ на уровне 500 мкМ/л (1,39 ± 1,65 против 0,84 ± 0,74, p=0,024; 11,65 ± 5,05 против 10,34 ± 5,52, p=0,018 соответственно).
3.2.2. Толстые участки аневризмы (A и A1)
Результаты анализа с тушением флуоресценции свидетельствуют о том, что обработка образцов ткани стенок, прилегающих к толстым сегментам тромба (A), с помощью DL-ГЦ в концентрации 100 мкМ/л приводила к значительному снижению концентрации активных форм ММП-2 по сравнению с показателями контрольной ткани (5,89 ± 3,39 против 7,26 ± 5,49, p=0,046). После обработки DL-ГЦ в концентрации 500 мкМ/л в толстых сегментах тромба (A1) также наблюдалось снижение концентрации активных форм ММП-2 (2,53 ± 2,02 против 3,28 ± 2,65, p=0,006). Образцы ткани стенок (A) характеризовались статистически значимым снижением активности ТФ при обработке DL-ГЦ в концентрации 500 мкМ/л по сравнению с контрольной тканью и тканями, инкубированными с DL-ГЦ в концентрации 100 мкМ/л (67,1 ± 72,6 против 114,5 ± 106,3, p=0,007; 67,1 ± 72,6 против 116,8 ± 128,3, p=0,005 соответственно). После обработки DL-ГЦ в концентрации 500 мкМ/л концентрация т-АП в толстых сегментах тромба (A1) была статистически значимо ниже по сравнению с показателями контрольной ткани (0,67 ± 0,57 против 0,96 ± 0,91, p=0,021) и тканей, обработанных DL-ГЦ в концентрации 100 мкМ/л (0,67 ± 0,57 против 0,94 ± 1,00, p=0,031). Уровень плазминогена также оказался значительно ниже в толстых сегментах тромба (A1), обработанных DL-ГЦ в концентрации 500 мкМ/л (9,25 ± 4,59 против 12,63 ± 9,56, p=0,017). Инкубация с DL-ГЦ в концентрации 100 мкМ/л приводила к значительному увеличению концентрации плазминогена в образцах ткани стенок (A) по сравнению с контрольными образцами (6,93 ± 6,88 против 3,01 ± 1,66, p=0,004).
3.3. Корреляции между уровнем ГЦ в сыворотке крови и диаметром АБА, толщиной ВПТ и гемостатическими параметрами
Выявлена выраженная положительная корреляция Пирсона между диаметром аневризмы и толщиной тромба (r=0,688, p=0,0001). Также обнаружены выраженные корреляции между уровнем ГЦ в сыворотке крови и концентрацией ТФ в тонких сегментах тромба (B1; r=0,653, p=0,0001) и концентрацией т-АП в образцах ткани стенок, прилегающих к толстым сегментам ВПТ (A; r=0,583, p=0,0001) (оба образца ткани инкубировались в среде, не содержащей ГЦ) (Таблица 2). Других значимых корреляций между уровнем ГЦ в сыворотке крои и оцениваемыми параметрами не наблюдалось.
Здесь Таблица 2
3.4. Корреляции между гемостатическими и протеолитическими параметрами в сегментах ВПТ и участках стенок АБА
Результаты оценки корреляций между парными параметрами после инкубации образцов из участков A, B, A1 и B1 в присутствии ГЦ и без него приведены в таблице 3. В таблице выделены статистические значимые значения (p<0,05). Анализ данных выявил положительные корреляции между уровнями активности/концентрацией ММП-2, ТФ и ИАП-1 во всех участках АБА. Оценка параметров проведена в контрольных образцах и образцах, обработанных DL-ГЦ в концентрации 100 и 500 мкМ/л. Важно отметить, что в образцах ткани стенок, прилегающих к толстым сегментам тромба (A), не выявлено выраженных корреляций с концентрацией плазминогена в контрольной ткани и после инкубации с DL-ГЦ в различной концентрации. Более того, не выявлено какой-либо корреляции с точки зрения активности ММП-9 в участках B1 (тонкие сегменты ВПТ).
Таблица 3. Корреляции между параметрами образцов ткани, инкубированных без DL-гомоцистеина (DL-ГЦ) (контроль), и теми же параметрами образцов ткани тонких и толстых сегментов внутрипросветного тромба (ВПТ) и прилегающих стенок аневризмы брюшной аорты (АБА) после инкубации с DL-ГЦ в различной концентрации
4. Обсуждение
Результаты ранее проведенных исследований свидетельствуют о наличии связи между концентрацией гомоцистеина и патогенезом аневризмы брюшной аорты [7, 8]. Выдвинута гипотеза о том, что ГЦ может приводить к деградации внеклеточного матрикса в результате изменения активности металлопротеиназ и параметров системы гемостаза, что в свою очередь является одним из ключевых этапов образования АБА, дальнейшего расширения аневризмы и, в конечном итоге, ее разрыва [6].
Основным выводом данного исследования является то, что инкубация образцов ткани аневризмы с ГЦ может оказывать воздействие на активность или концентрацию ММП, а также гемостатические параметры. Данное воздействие зависит от концентрации ГЦ и приводит к разным результатам в зависимости от толщины тромба. Помимо этого, авторы исследования установили, что активность/концентрация большей части гемостатических и протеолитических факторов в контрольных образцах (образцы ткани, инкубированные без ГЦ) в значительной мере коррелировали с показателями активности/концентрации после инкубации с ГЦ в различной концентрации. Данная закономерность наблюдалась для большей части оцениваемых параметров (за исключением концентрации плазминогена в участках A (ткань стенок, прилегающих к толстым сегментам ВПТ) и активности ММП-9 на участках B1 (тонкие сегменты ВПТ)). Это свидетельствует о том, что воздействие ГЦ в значительной мере зависит от исходной активности/концентрации данных факторов в сегментах ВПТ и прилегающих участках стенки аорты, а высокая активность протеолитических и гемостатических факторов в плазме крови пациентов в сочетании с повышенной концентрацией ГЦ может потенциально приводить к интенсификации процессов деградации сосудистой стенки и, следовательно, повышать риск разрыва АБА.
В ходе настоящего исследования авторы наблюдали, что ГЦ приводит к повышению активности ММП-2 и концентрации плазминогена и т-АП в тонких сегментах АБА (B и B1). Данное воздействие носило дозозависимый характер. Максимальные уровни активности/концентрации достигались при обработке ГЦ в концентрации 500 мкМ/л. Установлено, что инкубация толстых сегментов АБА (A и A1) с ГЦ приводит к уменьшению активности ММП-2 и ТФ, а также концентрации плазминогена и т-АП. Данное воздействие также носило дозозависимый характер. Полученные результаты отражают связанные с месторасположением отличия с точки зрения воздействия ГЦ на гемостатические и протеолитические процессы. Это позволяет сделать предположение о том, что ГЦ может принимать участие в патофизиологии АБА. ГЦ активирует или стимулирует накопление гемостатических и протеолитических факторов преимущественно в богатом кровью люминальном слое ВПТ, граничащем с кровотоком и являющемся биологически активным. В предыдущих исследованиях авторы показали, что в тонких сегментах АБА происходит активный протеолитический распад стенок аорты, и наблюдается высокая активность процесса коагуляции. [28]. На данные процессы могут оказывать стимулирующее воздействие факторы плазмы крови, включая ГЦ. Следовательно, можно предположить, что тонкие участки АБА в большей мере подвержены воздействию ГЦ. Тонкие тромбы значительно облегчают проникновение плазматических факторов и воспалительных клеток из просвета сосуда в стенку аневризмы по сравнению с толстыми тромбами [25]. Следует отметить, что существуют различные типы ВПТ, структура ВПТ разного типа различается, и тромбы могут менять свой тип [31]. ВПТ обладает богатым кровью люминальным слоем, граничащим с кровотоком и являющимся биологически активным в результате рекрутмента нейтрофилов, аккумуляции тромбоцитов, образования фибрина и удержания плазминогена и т-АП. Со временем люминальный слой ВПТ превращается в промежуточный и, в конечном итоге, в мертвый аблюминальный участок стенки АБА, что сопровождается лизисом эритроцитов, апоптозом лейкоцитов и фибринолизом различной степени выраженности. Самые старые аблюминальные слои обычно характеризуются крайне низким уровнем активности ферментов [32]. Как известно, только люминальный слой ВПТ содержит активные белки и характеризуется высокой прокоагуляционной активностью, а более глубокие слои ВПТ характеризуются более низкой концентрацией активных форм протеаз [28, 32]. Отсутствие клеток в более глубоких слоях ВПТ (толстых сегментах ВПТ) исключает возможность синтеза новых протеаз в данных участках. Также следует отметить, что толщина ВПТ не является постоянной на всем протяжении аневризмы [20, 21]. Она может варьировать в каждой отдельной аневризме. Таким образом, можно предположить, что тонкие сегменты образцов, проанализированных в настоящем исследовании, преимущественно включали в себя люминальные (биоактивные) участки, в то время как более толстые многослойные сегменты состояли из четко выраженных слоев с низкой, но определяемой концентрацией активных протеаз в люминальном слое. Вполне возможно, что стимуляция процесса протеолиза и нарушения в процессе фибринолиза в результате воздействия ГЦ в тонких сегментах АБА является частью цепной реакции, приводящей к разрушению стенки АБА и, в конечном итоге, к ее разрыву. Для подтверждения данной гипотезы необходимы дальнейшие исследования.
Известно, что повреждение стенки аорты в сочетании с АБА приводит к высвобождению ТФ, активирующего процессы коагуляции и образования ВПТ. Деградация стенки аорты также может играть определенную роль в активации фибринолиза через т-АП. Данные процессы ведут к образованию плазмина, активирующего ММП и выполняющего важную роль в последовательности событий, приводящих к разрушению аортальной матрицы в АБА. В некоторых исследованиях сделано предположение о том, что повышение концентрации ГЦ в крови может приводить к изменениям в данных процессах. Большая часть таких наблюдений свидетельствует о том, что ГГЦ приводит к нарушениям в процессах тромбообразования, фибринолиза и протеолиза [15–18, 33, 34].
Парадоксально, но результаты настоящего исследования показывают, что ГЦ негативно влияет на концентрацию активных форм ММП-2, однако никакого воздействия на активность ММП-9 выявлено не было. Отсутствие какой-либо связи и воздействия ГЦ на активность ММП-9 может стать доводом против того, что ГЦ принимает участие в процессе активации ММП-9. Тем не менее, ранее было установлено, что ГЦ приводит к активации латентных форм ММП-9. Авторы исследования Lee et al. [35] сообщали, что ГЦ увеличивает образование ММП-9 в макрофагах мышей. Авторы исследования Moshal et al. [14] наблюдали, что ГЦ стимулирует образование ММП-9 в эндотелиальных клетках микрососудов (MVEC). Более того, авторы исследования Tsarouhas et al. [36] выявили прямую корреляцию между концентрацией ММП-9 в тканях и сыворотке крови и концентрацией ГЦ в сыворотке крови. Они выдвинули гипотезу о том, что ГЦ принимает участие в патогенезе АБА, регулируя экспрессию ММП-9. Данное расхождение может быть частично объяснено двойственным эффектом, оказывающим ГЦ. Согласно авторам исследования Bescond et al. [13], высокая экспериментальная концентрация ГЦ подавляет активацию ММП при высоком молярном отношении. С другой стороны, снижение концентрации ГЦ приводит к повышению уровней экспрессии ММП-2 и ММП-9 и активации проММП-2 при низком молярном отношении. Интервал концентрации ГЦ для настоящего исследования выбран на основании имеющихся литературных данных. Несмотря на это следует отметить, что уровни концентрации, использованные в данном исследовании, значительно превышают уровень концентрации ГЦ в плазме крови здорового человека. Использованные в настоящем исследовании уровни концентрации ГЦ (100 и 500 мкМ/л) соответствуют ГГЦ средней или высокой степени тяжести [37].
Настоящее исследование не выявило какой-либо корреляции между размерами АБА и концентрацией общего ГЦ в сыворотке крови. Данное наблюдение подтверждает результаты исследования Lindqvist et al. [38], авторы которого не обнаружили взаимосвязи между АБА и гомоцистеином, однако оно контрастирует с результатами других работ [8, 10, 39]. В большей части предыдущих исследований, посвященных оценке концентрации ГЦ в циркулирующей крови, установлено, что для пациентов с АБА характерны более высокие уровни концентрации ГЦ по сравнению с представителями контрольных групп, не страдающих от АБА [9, 10, 39]. При проведении других исследований методом случай-контроль выявлено, что средний уровень ГЦ в плазме крови оказался выше у пациентов с АБА по сравнению с результатами настоящего исследования [5, 8–10]. Данное расхождение может быть обусловлено разным объемом выборки в ранее опубликованных исследованиях. В настоящем исследовании выявлены только две выраженные корреляции с уровнем концентрации ГЦ в сыворотке крови: данный показатель коррелирует с активность ТФ в контрольных образцах тонких сегментов ВПТ (B1) и с концентрацией т-АП в контрольных образцах ткани стенок, прилегающих к толстым сегментам ВПТ (A). Первая взаимосвязь может быть обусловлена характеристиками тонких тромбов, участвующих в процессе переноса из крови в стенку АБА большего количества стимулирующих факторов, принимающих участие в процессе протеолиза, в то время как толстые сегменты ВПТ выступают в роли барьера для таких факторов. Однако авторы исследования Wiernicki et al. [40] выявили связь между тонкими сегментами ВПТ и низкой концентрацией ГЦ в плазме крови, что, возможно, указывает на потенциальную роль ГЦ как протромботического маркера. Что касается корреляции между уровнем концентрации ГЦ в сыворотке крови и т-АП в тканях стенок, прилегающих к толстым сегментам ВПТ, результаты ранее проведенных исследований свидетельствуют о том, что т-АП преимущественно встречается именно в стенке аневризмы [4, 22]. Более того, в своем предыдущем исследовании авторы настоящей статьи установили, что наивысшие концентрации т-АП определялись в стенке АБА, в частности, в участках стенки, прилегающих к толстым сегментам ВПТ [28]. В рамках настоящего исследования проводились измерения параметров фрагментов тканей ВПТ и стенок АБА без кондиционированных сред. Факторы могут в той или иной мере удерживаться в тканях благодаря дифференциальному связыванию с различными структурными компонентами, или же они могут высвобождаться в среду. В данной работе высвобожденные белки не принимались во внимание.
Можно предположить, что взаимосвязь между возникновением АБА и повышенной концентрацией ГЦ является весьма сложной, так как на нее могут оказывать влияние различные факторы окружающей среды и генетические факторы, что также может служить объяснением расхождений между полученными результатами [6]. Неизвестно, является ли ГЦ фактором, инициирующим возникновение АБА, или же он интенсифицирует изменения в сосудистых стенках, возникающих под воздействием других факторов. Напрашивается мысль о том, что данная аминокислота является дополнительным фактором, действие которого накладывается на вредоносное воздействие других факторов. Если участие ГЦ в патогенезе АБА будет подтверждено, появится возможность разработки соответствующих консервативных методов лечения пациентов из группы риска. Это обуславливает необходимость проведения дальнейших исследований для определения того, принимает ли ГЦ участие в образовании и/или развитии аневризмы, или же ГЦ является всего лишь маркером данного заболевания.
Настоящее исследование характеризуется несколькими ограничениями. Эксперимент проведен в лабораторных условиях, и ограничения, связанные с экспериментами такого типа, не позволяют просто перенести полученные результаты на процессы, происходящие в организме человека. Естественные условия являются гораздо более сложными и характеризуются значительно более высокой степенью протеолитической и гемостатической активности. Относительные доли биологически активных регионов биоптатов могут различаться, в связи с чем анализ полнослойных гомогенатов, нормированный к концентрации общего белка, может влиять на результаты оценки общей экспрессии и активности люминальных компонентов. Кроме того, изучение участков стенки АБА без ВПТ пошло бы на пользу исследованию и позволило бы получить более достоверные результаты.
5. Выводы
Несмотря на упомянутые ограничения авторы исследования установили значительное воздействие инкубации тканей аневризмы с ГЦ в различной концентрации на фибринолитические и протеолитические параметры в зависимости от толщины тромба во всех проанализированных участках АБА. Результаты данного лабораторного исследования свидетельствуют о возможном наличии связи между повышением концентрации ГЦ и активацией ММП-2 и гемостатических факторов в тонких сегментах аневризмы. Системы фибринолиза и коагуляции обладают выраженной способностью к регулированию протеолиза внеклеточного матрикса стенки АБА. Принимая во внимание данный факт, информация о дифференциальных эффектах ГЦ в зависимости от пространственного распределения компонентов этих двух систем может быть использована для составления планов по наблюдению за АБА, оценки потенциального риска разрыва и, вероятно, выбора более эффективного метода лечения. Однако степень значимости данного наблюдения является неопределенной, так как некоторые фрагменты ткани подвергались воздействию крайне высоких концентраций ГЦ, хотя это и свидетельствует о потенциальной способности ГЦ в высоких концентрациях усугублять повреждение эластина артерий в тонких сегментах АБА в результате повышения активности ММП и других фибринолитических факторов. Определение четких механизмов взаимосвязи между воздействием ГЦ и образованием АБА должно стать предметом дальнейших исследований.
Список литературы
- J. J. Alexander, “The pathobiology of aortic aneurysms,” Journal of Surgical Research, vol. 117, no. 1, pp. 163–175, 2004. View at Publisher View at Google Scholar View at Scopus
- M. J. Hobeika, R. W. Thompson, B. E. Muhs, P. C. Brooks, and P. J. Gagne, “Matrix metalloproteinases in peripheral vascular disease,” Journal of Vascular Surgery, vol. 45, no. 4, pp. 849–857, 2007. View at Publisher View at Google Scholar View at Scopus
- J. Schneiderman, G. M. Bordin, I. Engelberg et al., “Expression of fibrinolytic genes in atherosclerotic abdominal aortic aneurysm wall. A possible mechanism for aneurysm expansion,” The Journal of Clinical Investigation, vol. 96, no. 1, pp. 639–645, 1995. View at Publisher View at Google Scholar View at Scopus
- X. Houard, F. Rouzet, Z. Touat et al., “Topology of the fibrinolytic system within the mural thrombus of human abdominal aortic aneurysms,” The Journal of Pathology, vol. 212, no. 1, pp. 20–28, 2007. View at Publisher View at Google Scholar View at Scopus
- F. Sofi, R. Marcucci, B. Giusti et al., “High levels of homocysteine, lipoprotein (a) and plasminogen activator inhibitor-1 are present in patients with abdominal aortic aneurysm,” Thrombosis and Haemostasis, vol. 94, no. 5, pp. 1094–1098, 2005. View at Publisher View at Google Scholar View at Scopus
- P. Moroz, M. T. Q. Le, and P. E. Norman, “Homocysteine and abdominal aortic aneurysms,” ANZ Journal of Surgery, vol. 77, no. 5, pp. 329–332, 2007. View at Publisher View at Google Scholar View at Scopus
- K. Halazun, K. Bofkin, S. Asthana, C. Evans, M. Henderson, and J. Spark, “Hyperhomocysteinaemia is associated with the rate of abdominal aortic aneurysm expansion,” Journal of Vascular Surgery, vol. 45, no. 4, p. 863, 2007. View at Publisher View at Google Scholar
- Y. Y. E. Wong, J. Golledge, L. Flicker et al., “Plasma total homocysteine is associated with abdominal aortic aneurysm and aortic diameter in older men,” Journal of Vascular Surgery, vol. 58, no. 2, pp. 364–370, 2013. View at Publisher View at Google Scholar View at Scopus
- H. Cao, X. Hu, Q. Zhang et al., “Homocysteine level and risk of abdominal aortic aneurysm: a meta-analysis,” PLoS ONE, vol. 9, no. 1, p. e85831, 2014. View at Publisher View at Google Scholar
- A. A. Warsi, B. Davies, G. Morris-Stiff, D. Hullin, and M. H. Lewis, “Abdominal aortic aneurysm and its correlation to plasma homocysteine, and vitamins,” European Journal of Vascular and Endovascular Surgery, vol. 27, no. 1, pp. 75–79, 2004. View at Publisher View at Google Scholar View at Scopus
- P. Hämelahti, O. Järvinen, T. Sisto et al., “Methylenetetrahydrofolate reductase gene C677T mutation is related to the defects in the internal elastic lamina of the artery wall,” European Journal of Clinical Investigation, vol. 32, no. 12, pp. 869–873, 2002. View at Publisher View at Google Scholar View at Scopus
- S. J. Moat, D. Lang, I. F. W. McDowell et al., “Folate, homocysteine, endothelial function and cardiovascular disease,” The Journal of Nutritional Biochemistry, vol. 15, no. 2, pp. 64–79, 2004. View at Publisher View at Google Scholar View at Scopus
- A. Bescond, T. Augier, C. Chareyre, D. Garçon, W. Hornebeck, and P. Charpiot, “Influence of homocysteine on matrix metalloproteinase-2: Activation and activity,” Biochemical and Biophysical Research Communications, vol. 263, no. 2, pp. 498–503, 1999. View at Publisher View at Google Scholar View at Scopus
- K. S. Moshal, M. Singh, U. Sen et al., “Homocysteine-mediated activation and mitochondrial translocation of calpain regulates MMP-9 in MVEC,” American Journal of Physiology-Heart and Circulatory Physiology, vol. 291, no. 6, pp. H2825–H2835, 2006. View at Publisher View at Google Scholar View at Scopus
- R. H. Fryer, B. D. Wilson, D. B. Gubler, L. A. Fitzgerald, and G. M. Rodgers, “Homocysteine, a risk factor for premature vascular disease and thrombosis, induces tissue factor activity in endothelial cells,” Arteriosclerosis, Thrombosis, and Vascular Biology, vol. 13, no. 9, pp. 1327–1333, 1993. View at Publisher View at Google Scholar View at Scopus
- K. A. Hajjar, L. Mauri, A. T. Jacovina et al., “Tissue plasminogen activator binding to the annexin II tail domain: Direct modulation by homocysteine,” The Journal of Biological Chemistry, vol. 273, no. 16, pp. 9987–9993, 1998. View at Publisher View at Google Scholar View at Scopus
- A. Khajuria and D. S. Houston, “Induction of monocyte tissue factor expression by homocysteine: A possible mechanism for thrombosis,” Blood, vol. 96, no. 3, pp. 966–972, 2000. View at Google Scholar View at Scopus
- S. Midorikawa, H. Sanada, S. Hashimoto, and T. Watanabe, “Enhancement by homocysteine of plasminogen activator inhibitor-1 gene expression and secretion from vascular endothelial and smooth muscle cells,” Biochemical and Biophysical Research Communications, vol. 272, no. 1, pp. 182–185, 2000.View at Publisher View at Google Scholar View at Scopus
- M. Kazi, J. Thyberg, P. Religa et al., “Influence of intraluminal thrombus on structural and cellular composition of abdominal aortic aneurysm wall,” Journal of Vascular Surgery, vol. 38, no. 6, pp. 1283–1292, 2003. View at Publisher View at Google Scholar View at Scopus
- E. S. Di Martino, A. Bohra, J. P. V. Geest, N. Gupta, M. S. Makaroun, and D. A. Vorp, “Biomechanical properties of ruptured versus electively repaired abdominal aortic aneurysm wall tissue,” Journal of Vascular Surgery, vol. 43, no. 3, pp. 570–576, 2006. View at Publisher View at Google Scholar View at Scopus
- L. Speelman, G. W. H. Schurink, E. M. H. Bosboom et al., “The mechanical role of thrombus on the growth rate of an abdominal aortic aneurysm,” Journal of Vascular Surgery, vol. 51, no. 1, pp. 19–26, 2010. View at Publisher View at Google Scholar View at Scopus
- V. Fontaine, M.-P. Jacob, X. Houard et al., “Involvement of the mural thrombus as a site of protease release and activation in human aortic aneurysms,” The American Journal of Pathology, vol. 161, no. 5, pp. 1701–1710, 2002. View at Publisher View at Google Scholar View at Scopus
- D. Koole, H. J. A. Zandvoort, A. Schoneveld et al., “Intraluminal abdominal aortic aneurysm thrombus is associated with disruption of wall integrity,” Journal of Vascular Surgery, vol. 57, no. 1, pp. 77–83, 2013.View at Publisher View at Google Scholar View at Scopus
- D. A. Vorp, P. C. Lee, D. H. J. Wang et al., “Association of intraluminal thrombus in abdominal aortic aneurysm with local hypoxia and wall weakening,” Journal of Vascular Surgery, vol. 34, no. 2, pp. 291–299, 2001. View at Publisher View at Google Scholar View at Scopus
- R. Adolph, D. A. Vorp, D. L. Steed, M. W. Webster, M. V. Kameneva, and S. C. Watkins, “Cellular content and permeability of intraluminal thrombus in abdominal aortic aneurysm,” Journal of Vascular Surgery, vol. 25, no. 5, pp. 916–926, 1997. View at Publisher View at Google Scholar View at Scopus
- I. Wiernicki, E. Stachowska, K. Safranow et al., “Enhanced matrix-degrading proteolytic activity within the thin thrombus-covered wall of human abdominal aortic aneurysms,” Atherosclerosis, vol. 212, no. 1, pp. 161–165, 2010. View at Publisher View at Google Scholar View at Scopus
- A. Siennicka, M. Zuchowski, M. Kaczmarczyk, M. Cnotliwy, J. S. Clark, and M. Jastrzebska, “Spatial differences of matrix metalloproteinase-2 and matrix metalloproteinase-9 within abdominal aortic aneurysm wall and intraluminal thrombus,” Journal of Physiology and Pharmacology, vol. 67, no. 6, pp. 903–910, 2016. View at Google Scholar View at Scopus
- A. Siennicka, M. Zuchowski, M. Kaczmarczyk, M. Cnotliwy, J. S. Clark, and M. Jastrzębska, “Tissue factor levels and the fibrinolytic system in thin and thick intraluminal thrombus and underlying walls of abdominal aortic aneurysms,” Journal of Vascular Surgery, vol. 68, no. 6, pp. 30S–37S, 2018. View at Publisher View at Google Scholar
- G. Doronzo, I. Russo, P. Del Mese et al., “Role of NMDA receptor in homocysteine-induced activation of Mitogen-Activated Protein Kinase and Phosphatidyl Inositol 3-Kinase pathways in cultured human vascular smooth muscle cells,” Thrombosis Research, vol. 125, no. 2, pp. e23–e32, 2010. View at Publisher View at Google Scholar View at Scopus
- R. Christopher, D. Nagaraja, and S. K. Shankar, “Homocysteine and cerebral stroke in developing countries,” Current Medicinal Chemistry, vol. 14, no. 22, pp. 2393–2401, 2007. View at Publisher View at Google Scholar View at Scopus
- S. A. O'Leary, E. G. Kavanagh, P. A. Grace, T. M. McGloughlin, and B. J. Doyle, “The biaxial mechanical behaviour of abdominal aortic aneurysm intraluminal thrombus: classification of morphology and the determination of layer and region specific properties,” Journal of Biomechanics, vol. 47, no. 6, pp. 1430–1437, 2014. View at Publisher View at Google Scholar View at Scopus
- M. Folkesson, A. Silveira, P. Eriksson, and J. Swedenborg, “Protease activity in the multi-layered intra-luminal thrombus of abdominal aortic aneurysms,” Atherosclerosis, vol. 218, no. 2, pp. 294–299, 2011.View at Publisher View at Google Scholar View at Scopus
- A. A. Da Cunha, E. Scherer, M. J. Da Cunha et al., “Acute hyperhomocysteinemia alters the coagulation system and oxidative status in the blood of rats,” Molecular and Cellular Biochemistry, vol. 360, no. 1-2, pp. 205–214, 2012. View at Publisher View at Google Scholar View at Scopus
- X. D. Ke, A. Foucault-Bertaud, C. Genovesio, F. Dignat-George, E. Lamy, and P. Charpiot, “Homocysteine modulates the proteolytic potential of human arterial smooth muscle cells through a reactive oxygen species dependant mechanism,” Molecular and Cellular Biochemistry, vol. 335, no. 1-2, pp. 203–210, 2010. View at Publisher View at Google Scholar View at Scopus
- S. J. Lee, Y. S. Lee, K. W. Seo et al., “Homocysteine enhances MMP-9 production in murine macrophages via ERK and Akt signaling pathways,” Toxicology and Applied Pharmacology, vol. 260, no. 1, pp. 89–94, 2012. View at Publisher View at Google Scholar View at Scopus
- K. Tsarouhas, C. Tsitsimpikou, S. Apostolakis et al., “Homocysteine and metalloprotease-3 and - 9 in patients with ascending Aorta Aneurysms,” Thrombosis Research, vol. 128, no. 5, pp. e95–e99, 2011. View at Publisher View at Google Scholar View at Scopus
- S. M. Krishna, A. Dear, J. M. Craig, P. E. Norman, and J. Golledge, “The potential role of homocysteine mediated DNA methylation and associated epigenetic changes in abdominal aortic aneurysm formation,” Atherosclerosis, vol. 228, no. 2, pp. 295–305, 2013. View at Publisher View at Google Scholar View at Scopus
- T. Hosoda, “C-kit-positive cardiac stem cells and myocardial regeneration,” American Journal of Cardiovascular Disease, vol. 2, no. 1, pp. 58–67, 2012. View at Google Scholar
- T. Brunelli, D. Prisco, S. Fedi et al., “High prevalence of mild hyperhomocysteinemia in patients with abdominal aortic aneurysm,” Journal of Vascular Surgery, vol. 32, no. 3, pp. 531–536, 2000. View at Publisher View at Google Scholar View at Scopus
- I. Wiernicki, B. Millo, K. Safranow, B. Gorecka-Szyld, and P. Gutowski, “MMP-9, Homocysteine and CRP Circulating Levels Are Associated with Intraluminal Thrombus Thickness of Abdominal Aortic Aneurysms–New Implication of the Old Biomarkers,” Disease Markers, vol. 31, Article ID 783721, 8 pages, 2011. View at Publisher View at Google Scholar View at Scopus





