5013
09 Сентября 2021
Авторское право © 2018, Petr Panzner, Martina Vachová, Tomáš Vlas, Petra Vítovcová, Petra Brodská, Marek Malý (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Панцнер П., Вачова М., Влас Т.,Витовцова П.,Бродска П., Малый М.
Clinical and Translational Allergy20188:19
Аннотация
Введение
Основными источниками воздушных аллергенов в помещениях являются клещи домашней пыли, перхоть домашних животных и г...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Панцнер П., Вачова М., Влас Т.,Витовцова П.,Бродска П., Малый М.
Clinical and Translational Allergy20188:19
Аннотация
Введение
Основными источниками воздушных аллергенов в помещениях являются клещи домашней пыли, перхоть домашних животных и г...
Авторское право © 2018, Petr Panzner, Martina Vachová, Tomáš Vlas, Petra Vítovcová, Petra Brodská, Marek Malý (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Панцнер П., Вачова М., Влас Т.,Витовцова П.,Бродска П., Малый М.
Clinical and Translational Allergy20188:19
Аннотация
Введение
Основными источниками воздушных аллергенов в помещениях являются клещи домашней пыли, перхоть домашних животных и грызунов, тараканы и некоторые грибы. Клещи домашней пыли – основная причина аллергии в ряде стран с теплым климатом. Тем не менее, эпидемиологическая значимость аллергенов клещей домашней пыли и тараканов в Центральной Европе до сих пор не установлена.
Методы
Определены профили сенсибилизации к клещевым аллергенам домашней пыли и тараканов у пациентов с аллергией из Центрального Европейского региона. Проведена молекулярная диагностика с использованием микрочипа ISAC и обследование 1766 пациентов с основанным на клинической картине подозрением на аллергическое заболевание. У 1255 пациентов отмечен положительный результат исследования хотя бы на один аллерген и проведен статистический анализ полученных результатов.
Результаты
Сенсибилизация хотя бы к одной специфической для аллергенов клещей домашней пыли молекуле (Der p 1, 2, Der f 1, 2) наблюдалась относительно часто (32,7% пациентов). Отмечается перекрестная реактивность почти всех специфических IgE к молекулам аллергенов клещей домашней пыли 2-й группы. Аллергены 1-й группы также обладают перекрестной реактивностью, однако у некоторых пациентов наблюдался видоспецифический ответ. Относительно высокий уровень сенсибилизации исследованных пациентов к аллергенам как 1-й, так и 2-й группы указывает на важную роль косенсибилизации. Изолированная сенсибилизация к молекулам аллергенов глицифагидных клещей Lep d 2 и/или Blo t 5 без сенсибилизации к другим молекулам клещей наблюдалась исключительно редко (0,6% случаев). Истинная сенсибилизация хотя бы к одной специфичной для тараканов молекуле (Blag 1, 2, 5) наблюдалась очень редко (0,6% случаев), и почти во всех этих случаях отмечалась косенсибилизация к другим молекулам, не характерным для тараканов. Сенсибилизация к ингаляционному тропомиозину наблюдалась редко (у 2,2% пациентов) (Der p 10 у 1,9% и Bla g 7 у 1,5%). Косенсибилизация к ингаляционным тропомиозинам и к соответствующим специфичным для аллергенов клещей или тараканов молекулам наблюдалась лишь у небольшой части пациентов. Это позволяет предположить, что существует другой, более распространенный путь сенсибилизации.
Выводы
У большинства пациентов имеется сенсибилизация одновременно к нескольким молекулам соответствующего источника аллергенов. Определение молекулярного спектра сенсибилизации необходимо для выбора оптимального метода диагностики и подбора схемы лечения с учетом состава аллергенов в экстрактах клещей домашней пыли, применяющихся для диагностики и лечения. Кроме того, необходимо подчеркнуть важность количественного определения по крайней мере трех основных компонентов аллергенов клещей домашней пыли, Der f 1, Der p 1 и Der f 2 (или Der p 2) с учетом паттернов сенсибилизации пациентов из Центральной Европы.
Введение
Наличие реакции немедленной гиперчувствительности к домашним аллергенам является фактором риска развития астмы и аллергического ринита. Кроме того, сенсибилизация к данным аллергенам может играть роль в манифестации атопического дерматита. Основные источники воздушных аллергенов в помещениях - клещи домашней пыли (КДП), перхоть домашних животных и грызунов, тараканы и некоторые грибы. Учитывая, что большинство людей в европейских сообществах проводят в помещениях более 90% своей жизни, неудивительно, что домашние аллергены играют важную роль в развитии сенсибилизации и симптомов аллергии. Сенсибилизация к определенным молекулам может увеличивать риск развития астмы или атопического дерматита [1, 2]. В нескольких исследованиях высказывается предположение, что сенсибилизация ко множеству молекул («молекулярный спрединг») связана с более высокой вероятностью развития более тяжелых симптомов аллергии [2, 3, 4].
КДП являются основной причиной аллергии в некоторых странах с теплым климатом [5]; в Центральной Европе сенсибилизация к аллергенам клещей домашней пыли, некоторых животных (особенно кошачьим и собачьим аллергенам) и плесневых грибков (особенно рода Alternaria) встречается немногим реже, чем сенсибилизация к пыльце [6, 7]. Аллергия на тараканов играет большую роль в развитии астмы в некоторых регионах Америки и Азии [8], ее значимость для Центральной Европы до сих пор не установлена.
Диагноз «иммуноглобулин E (IgE)-опосредованная ингаляционная аллергия» ставится прежде всего на основании анамнеза и факта сенсибилизации. Сенсибилизация подтверждается путем проведения кожного прик-теста и определения аллерген-специфических IgE сыворотки, однако этот метод имеет ряд ограничений. Состав аллергенов, используемых при проведении аллергологического тестирования in vitro и in vivo, может различаться. Это связано с недостаточным количеством стандартизированных экстрактов аллергенов, что, в свою очередь, обусловлено природным разнообразием их источников аллергенов, а также производственным процессом. Эта проблема уже подтвердилась в отношении аллергенов КДП [9, 10, 11]. Еще более важный недостаток экстрактов аллергенов заключается в том, что при множественной сенсибилизации, которая наблюдается у многих пациентов, они не позволяют различить первичную сенсибилизацию и иммунологическую перекрестную реактивность. Тем не менее, еще несколько лет назад экстракты натуральных аллергенов были ключевым элементом диагностики ингаляционной аллергии. В настоящий момент благодаря достижениям молекулярной биологии появилась возможность проведения молекулярной диагностики, а также разработки широкого спектра очищенных натуральных и рекомбинантных молекул аллергенов. Такие повсеместно доступные в настоящее время реагенты позволяют применять для диагностики метод компонентной аллергодиагностики, а также проводить систематическое исследование основных аллергенов и процессов перекрестной реактивности, участвующих в аллергической сенсибилизации.
Внедрение технологии микрочипов, на которые нанесено большое количество очищенных или рекомбинантных молекул, является примером дальнейшего развития диагностики аллергических заболеваний. В настоящее время такие микрочипы представляют собой мощный инструмент для скрининга IgE-реактивности сыворотки крови, который позволяет определить профиль сенсибилизации пациентов. Выявление сенсибилизации и косенсибилизации к видоспецифическим и перекрестно-реагирующим компонентам аллергенов может быть особенно важным в случае принятия решений о применении аллерген-специфической иммунотерапии.
Целью данного исследования являлась оценка целесообразности проведения молекулярной диагностики с применением микрочипов для определения профилей сенсибилизации у жителей Центрального Европейского региона с сенсибилизацией к аллергенам КДП и тараканов. Особое внимание уделялось определению различий между перекрестной реактивностью и множественной сенсибилизацией к различным аллергенам. В настоящий момент доступен лишь небольшой объем данных о диагностической точности технологии микрочипов ImmunoCAP ISAC при аллергии на КДП и тараканов. Тем не менее, мы решили использовать этот подход, поскольку он может обеспечить анализ широкого спектра множественных сенсибилизаций. Кроме того, ряд исследований продемонстрировал сопоставимость результатов, полученных с помощью технологии микрочипов ISAC, основанной на определении компонентов аллергенов, и с помощью технологии CAP, основанной на определении целого аллергена [12, 13]. Тем не менее, при проведении исследования необходимо учитывать возможность разной степени чувствительности методики к отдельным молекулам.
Методы
Настоящее одномоментное обсервационное исследование проводилось в соответствии с рекомендациями по повышению качества составления отчетов об обсервационных исследованиях в эпидемиологии (Strengthening the Reporting of Observational Studies in Epidemiology, STROBE) [14], насколько это было применимо к дизайну данного исследования. Мы провели ретроспективный анализ данных 1766 пациентов из западной части Чешской Республики с подозрением на аллергию, обследованных в 2011–2014 гг. в поликлинической службе отделения иммунологии и аллергологии университетской больницы г. Пльзень. Было проведено дальнейшее обследование 1255 пациентов с положительным результатом анализа хотя бы на один компонент. Исследуемая группа состояла из 1255 сенсибилизированных пациентов с хотя бы одним из следующих диагнозов: хронический ринит (73%), бронхиальная астма (41%), атопический дерматит (34%), крапивница или отек (19%) и (или) анафилаксия (11%). Возраст пациентов находился в диапазоне от одного года до 68 лет со средним значением 29 лет. Соотношение по полу: 45,3% – мужчины и 54,7% – женщины.
Уровень специфических IgE ко множеству компонентов аллергена определяли с помощью технологии 112-компонентного микрочипа ImmunoCAP ISAC (Thermo Fisher Scientific, Уппсала, Швеция). Реакционный участок микрочипа инкубировали с 20 мкл неразведенной сыворотки крови пациента в течение двух часов для связывания аллерген-специфических IgE с соответствующими аллергенами. После этого слайды микрочипов ополаскивали и промывали для удаления несвязанных sIgE. После высушивания комплексы аллерген-связанных sIgE окрашивали флуоресцентно-мечеными вторичными антителами (IgE к белкам человека) при комнатной температуре в защищенном от света месте в течение 1 ч. После повторной процедуры ополаскивания и промывки сигналы флюоресцентной метки сканировали с помощью лазерного сканера (LuxScan 10K; CapitalBio, Пекин, Китай). Анализ соответствующих оцифрованных изображений микрочипа проводили с использованием программного обеспечения ImmunoCAP ISAC. Информацию с изображений переводили в числовой формат с использованием результатов сыворотки сравнения с известным содержанием IgE. Результаты выражали в стандартизированных единицах ISAC (ISU), результаты считали положительными при значениях 0,3 ISU/л и выше.
Проведенный анализ включал в себя компоненты ингаляционных аллергенов, специфичных для клещей домашней пыли и тараканов, а также потенциально перекрестно-реактивные компоненты. Все компоненты входили в систему ISAC. Специфические маркеры аллергии были представлены группой 1 (nDer p 1, nDer f 1), группой 2 (rDer p 2, rDer f 2, rLep d 2) группой 5/21 (rBlo t 5) аллергенов клещей домашней пыли, а также молекулами rBla g 1, аспарагиновой протеазы rBla g 2 и глутатион-S-трансферазы rBla g 5 тараканов. Также в анализ были включены такие паналлергены, как тропомиозины клещей домашней пыли и тараканов (rDer p 10 и nBla g 7), которые связаны с сенсибилизацией к другим тропомиозинам (nPen m 1 и rAni s 3).
Результаты
Ниже перечислены результаты анализа, описывающие паттерны сенсибилизации к аллергенам клещей домашней пыли и тараканов в группе из 1255 пациентов, сенсибилизированных по меньшей мере к одному компоненту аллергенов в исследуемом нами регионе. Процентные соотношения рассчитывали для всей группы из всех 1255 пациентов.
Клещи домашней пыли
Сенсибилизация хотя бы к одной специфической для клещей домашней пыли молекуле (Der p 1, 2, Der f 1, 2) наблюдалась у 32,7% пациентов. Изолированная сенсибилизация к молекулам глицифагидных клещей Lep d 2 и/или Blo t 5 без сенсибилизации к другим молекулам клещей наблюдалась лишь в 0,6% случаев.
Тараканы
Истинная сенсибилизация хотя бы к одной специфичной для тараканов молекуле (Bla g 1, 2, 5) встречалась очень редко (0,6% случаев). Почти во всех этих случаях отмечалась косенсибилизация к другим молекулам, не имеющим отношения к тараканам, в том числе у половины пациентов (4 случая) – к молекулам клещей домашней пыли.
Тропомиозины
Сенсибилизация к ингаляционным тропомиозинам клещей домашней пыли и тараканов наблюдалась у 2,2% пациентов (Der p 10 – у 1,9% и Bla g 7 – у 1,5% пациентов).
Косенсибилизация к Der p 10 и другим молекулам клещей домашней пыли наблюдалась у 0,7% пациентов. Косенсибилизация к Bla g 7 и другим специфичным для тараканов молекулам встречалась исключительно редко (у 0,1%), при этом ни в одном из случаев не отмечалось косенсибилизации к Der p 10.
У пациентов, сенсибилизированных к Der p 10 и не сенсибилизированных к Bla g 7 (0,6%), почти во всех случаях (0,5%) не наблюдалось сенсибилизации к другим тропомиозинам (Pen m 1, Ani s 3), а сенсибилизация к другим молекулам клещей домашней пыли наблюдалась лишь в 0,2% случаев. У пациентов, сенсибилизированных к Der p 10 и Bla g 7 (1,3%), сенсибилизация к другим тропомиозинам наблюдалась во всех случаях, а к другим молекулам клещей домашней пыли – в 0,5% случаев. Моносенсибилизация (в контексте тропомиозинов) к Bla g 7 отмечалась исключительно редко.
Частота сенсибилизации и косенсибилизации к отдельным молекулам клещей домашней пыли представлена на рисунках 1 и 2. Сенсибилизация и косенсибилизация в контексте тропомиозинов и аллергенов клещей домашней пыли представлена на рисунке 3. Сенсибилизация к специфичным для клещей домашней пыли молекулам в контексте сенсибилизации к молекулам специфичным для других ингаляционных аллергенов представлена на рисунке 4.
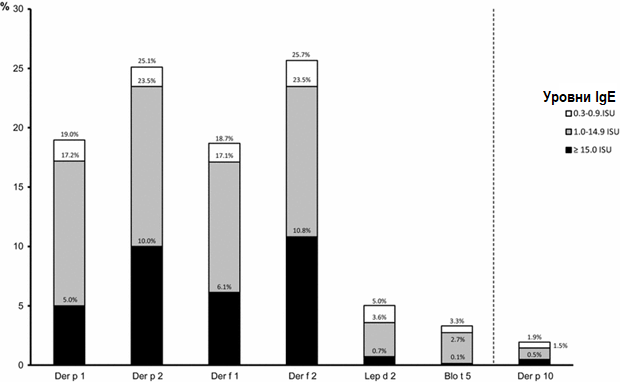 Рисунок 1. Частота сенсибилизации к молекулам клещей домашней пыли
Рисунок 1. Частота сенсибилизации к молекулам клещей домашней пыли
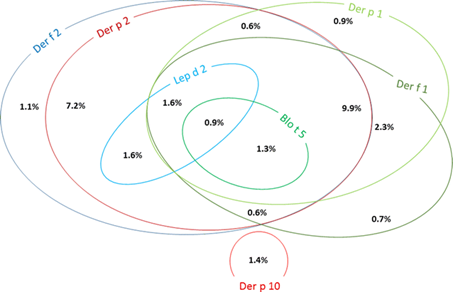 Рисунок 2. Диаграмма Венна, описывающая моно- и косенсибилизацию к молекулам клещей домашней пыли. Моно- и косенсибилизация с частотой менее 0,6% не показаны
Рисунок 2. Диаграмма Венна, описывающая моно- и косенсибилизацию к молекулам клещей домашней пыли. Моно- и косенсибилизация с частотой менее 0,6% не показаны
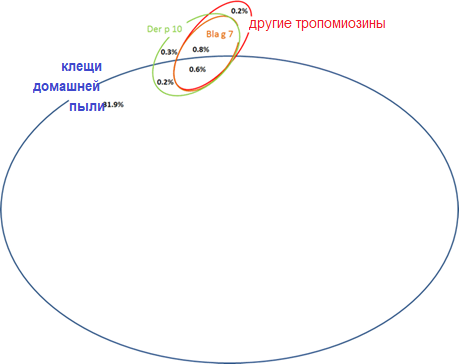 Рисунок 3. Диаграмма Венна, описывающая моно- и косенсибилизацию к тропомиозинам по отношению к сенсибилизации к клещам домашней пыли (= сенсибилизация хотя бы к одной специфичной для клеща домашней пыли молекуле). Моно- и косенсибилизация с частотой менее 0,2% не показаны
Рисунок 3. Диаграмма Венна, описывающая моно- и косенсибилизацию к тропомиозинам по отношению к сенсибилизации к клещам домашней пыли (= сенсибилизация хотя бы к одной специфичной для клеща домашней пыли молекуле). Моно- и косенсибилизация с частотой менее 0,2% не показаны
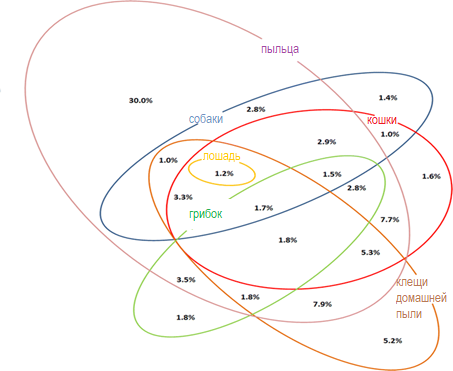 Рисунок 4. Диаграмма Венна, описывающая моно- и косенсибилизацию к различным группам молекул клещей домашней пыли и к другим ингаляционным аллергенам. Сенсибилизация к группе определяется как сенсибилизация хотя бы к одному из соответствующих видоспецифичных компонентов аллергенов клещей домашней пыли (Der p 1, Der p 2, Der f 1, Der f 2), кошек (Fel d 1, Fel d 4), собак (Can f 1, Can f 2, Can f 5), лошадей (Equ c 1), грибка Alternaria (Alt a 1, Alt a 6), пыльцы (Phl p 1, Phl p 2, Phl p 4, Phl p 5, Phl p 6, Phl p 11, Cyn d 1, Bet v 1, Aln g 1, Cor a 1, Cup a 1, Cry j 1, Ole e 1, Ole e 9, Pla a 2, Pla l 1, Art v 1, Che a 1). Моно- и косенсибилизация с частотой менее 1,0% не показаны
Рисунок 4. Диаграмма Венна, описывающая моно- и косенсибилизацию к различным группам молекул клещей домашней пыли и к другим ингаляционным аллергенам. Сенсибилизация к группе определяется как сенсибилизация хотя бы к одному из соответствующих видоспецифичных компонентов аллергенов клещей домашней пыли (Der p 1, Der p 2, Der f 1, Der f 2), кошек (Fel d 1, Fel d 4), собак (Can f 1, Can f 2, Can f 5), лошадей (Equ c 1), грибка Alternaria (Alt a 1, Alt a 6), пыльцы (Phl p 1, Phl p 2, Phl p 4, Phl p 5, Phl p 6, Phl p 11, Cyn d 1, Bet v 1, Aln g 1, Cor a 1, Cup a 1, Cry j 1, Ole e 1, Ole e 9, Pla a 2, Pla l 1, Art v 1, Che a 1). Моно- и косенсибилизация с частотой менее 1,0% не показаны
Обсуждение
В исследуемой группе пациентов сенсибилизация к круглогодичным ингаляционным молекулам наблюдалась реже, чем сенсибилизация к компонентам пыльцы [6]. Однако относительно высокая частота сенсибилизации к клещам домашней пыли подчеркивает клиническую важность этого аллергена для Центрального Европейского региона. Необходимо акцентировать внимание на том, что в данной статье мы описываем только частоту сенсибилизации, а не ее клиническую значимость. Проведение анализа клинической значимости в таких больших когортах без применения специфических провокационных тестов может быть достаточно сложным и нереалистичным.
Тараканы
Предполагается, что при проведении диагностических исследований у 50–64% пациентов можно обнаружить положительные реакции на смесь из пяти аллергенов Bla g 1 и/или Per a 1, Bla g 2, Bla g 4, Bla g 5 и Bla g 7 и/или Per a 7 [15, 16]. Степень гомологии между липокалином Bla g 4 и липокалинами млекопитающих невелика, поэтому ожидается лишь незначительная перекрестная реактивность с данными аллергенами млекопитающих [8]. Мы не анализировали эту перекрестную реактивность из-за очень низкой частоты сенсибилизации к Bla g 4 в исследуемой группе пациентов. Низкая частота сенсибилизации к молекулам тараканов была, по-видимому, обусловлена скорее небольшим количеством тараканов в нашем климате, чем отсутствием молекул при проведении анализа.
Клещи домашней пыли
По данным нескольких исследований самыми распространенными видами ингаляционной аллергии считаются аллергия на КДП и сенсибилизация к КДП.[5, 17, 18]. В нашем регионе этот аллерген находится на четвертом месте по частоте сенсибилизации после пыльцы трав (частота сенсибилизации к Phl p 1 – 60,8%), пыльцы березы (частота сенсибилизации к Bet v 1 – 47,3%) и кошачьих аллергенов (частота сенсибилизации к Fel d 1 – 31,5%) [6], что расходится с данными для других регионов [17, 19, 20]. Такое несоответствие может быть обусловлено географическими различиями или особенностями выбранной популяции, состоящей преимущественно из взрослых в основном с респираторной аллергией. В исследовании, проводившемся в северной Италии, также была продемонстрирована более высокая частота сенсибилизации к пыльце травы у подростков, тогда как у детей младшего возраста наиболее часто обнаруживалась сенсибилизация к аллергенам клещей домашней пыли [19].
Известно, что пациенты, сенсибилизированные к аллергенам клещей домашней пыли, не всегда были сенсибилизированы к молекулам, которые применялись в нашем исследовании. Несмотря на то что может наблюдаться сенсибилизация и к другим молекулам, существует лишь очень небольшое количество пациентов, сенсибилизированных только к ним [21, 22, 23, 24, 25]. Более того, описано, что сигнальные пути, активированные цистеиновыми протеазами (Der p 1, Der f 1), приводят к выраженной стимуляции TH2. Кроме того, аллергены 2-й группы связывают TLR4 путем связывания LPS. Таким образом, данные молекулы обладают более сильным иммуногенным потенциалом, что еще больше увеличивает многокомпонентность аллергий на клещей домашней пыли. Следовательно, эти молекулы могут играть ведущую роль в атопии, и частота сенсибилизации к различным аллергенам у детей и взрослых может отличаться [26]. Было показано, что у детей чаще встречается сенсибилизация к 1-й группе аллергенов [18], что указывает на возможную роль аллергенов 1-й группы в появлении сенсибилизации, которая, возможно, опосредована их протеолитической активностью и прямым повреждением эпителия [27]. Более высокая частота сенсибилизации к аллергенам 2-й группы у взрослых указывает на более позднюю сенсибилизацию к аллергенам 1-й группы, что обнаружено при исследовании пациентов одной возрастной когорты [26]. Вероятным объяснением данного наблюдения может быть способность аллергенов 2-й группы к прямому связыванию с TLR4. Кроме того, эти наблюдения могут объяснить более выраженное увеличение тяжести клинической картины аллергии при увеличении воздействия аллергенов КПД, чем при воздействии кошачьих аллергенов, при котором увеличение воздействия приводит, по-видимому, к развитию толерантности [28].
Dermatophagoides pteronyssinus является наиболее широко распространенным клещом домашней пыли во всем мире. Особенно он преобладает в регионах с высокой влажностью, где климат больше подвержен влиянию океана. Предполагается, что Dermatophagoides farinae чаще встречается в континентальных регионах Европы и в Средиземноморье, однако в большинстве стран наблюдаются смешанные популяции клещей домашней пыли [22, 29]. У исследованных нами пациентов частота сенсибилизации к D. pteronyssinus и к D. farinae почти не различалась, тогда как в Испании распространенность IgE к аллергенам D. pteronyssinu была несколько выше, чем к аллергенам D. farinae [18].
Хотя пироглифидные КДП D. pteronyssinus и D. farinae являются, по всей видимости, преобладающими видами, в некоторых регионах большое значение также могут иметь глицифагидные клещи [18, 21, 29].
Наиболее значимым видом клещей домашней пыли семейства Glycyphagidae является Blomia tropicalis. Он распространен преимущественно в тропических регионах [4, 29]. Показано, что гомологичность последовательностей основного аллергена Blo t 5 и аллергена Der p 5 составляет 40%, однако перекрестная реактивность между данными аллергенами не отмечается [29]. Поскольку B. tropicalis не является частью акарофауны Центральной Европы, присутствие некоторого уровня сенсибилизации у исследованных пациентов, скорее всего, связана с потенциальной перекрестной реактивностью аллергенов различных видов клещей (группы 5/21 молекул клещей), чем с истинной сенсибилизации. Это предположение подтверждается низкими уровнями сенсибилизации к Blo t 5 в исследованной нами группе. Результаты другого исследования позволяют предположить, что аллергены, не относящиеся к группе 5, также могут отвечать за частичную перекрестную реактивность к аллергенам других видов клещей [30].
Lepidoglyphus destructor, глицифагидный складской клещ, также может стать КДП [29]. Сенсибилизация при воздействии этого клеща в домашних условиях отмечалась в Швеции и во Франции. Невозможно определить, связан ли положительный результат исследования на Lep d 2 у исследованных нами пациентов с истинной сенсибилизацией или с перекрестным реагированием в контексте 2-й группы молекул клещей. Отсутствие у исследованных пациентов моносенсибилизации к Lep d 2 (в контексте молекул клещей) скорее свидетельствует о том, что сенсибилизация к этой молекуле обусловлена перекрестной реактивностью с другими аллергенами 2-й группы, что противоречит данным об ее отсутствии [18].
У исследованных нами сенсибилизированных к аллергенам клещей пациентов, как правило, отмечалась косенсибилизация к нескольким специфичным для клещей компонентам; моносенсибилизация встречалась заметно реже (рисунок 2). Предполагается, с развитием аллергии чаще всего связаны такие специфические компоненты как Der f 1 и Der p 1 (цистеиновые протеазы), а также Der f 2 и Der p 2 (липидсвязывающие белки). Преобладающая как в плане распространенности, так и в плане интенсивности сенсибилизация ко 2-й группе молекул клещей была описана ранее [17, 18, 25] и подтверждается полученными результатами. В проводившемся во Франции исследовании обнаружено преобладание сенсибилизации к Der p 1 (93% [31], и, по-видимому, данное различие связано с изучением другой популяции. Кроме того, в том же исследовании была обнаружена более высокая частота сенсибилизации к Der p 10 (28%), что указывает на то, что фактором первичной сенсибилизации, возможно, является креветка, которую намного чаще употребляют в пищу в средиземноморском регионе, чем в Центральной Европе.
Тропомиозины – молекулы, ответственные за перекрестную реактивность к аллергеном клещей, креветок и тараканов [32]. IgE связывающийся с аллергенами группы 10 клещей домашней пыли, редко встречается в Европе[21] и Австралии [33] и, по данным одного из исследований, пациенты из США сенсибилизированы и к КДП, и к тараканам [34]. Аналогично, в изученной нами популяции сенсибилизация к отдельным тропомиозинам встречалась намного реже, чем сенсибилизация к нескольким молекулам тропомиозина одновременно. Это позволяет предположить наличие перекрестной реактивности в пределах этой группы молекул (рисунок 3).
Сенсибилизация к тропомиозину Der p 10 у исследованных пациентов наблюдалась нечасто (1,9%), косенсибилизация с другими специфичными для клещей молекулами также встречалась нерегулярно (0,8%). Это указывает на то, что у значительной доли пациентов, по-видимому, существует другой путь сенсибилизации. Тропомиозины являются клинически значимыми аллергенами морепродуктов, однако роль тропомиозина клещей Der p 10 в развитии аллергии на клещей домашней пыли подробно не изучалась. Была выдвинута гипотеза о том, что сенсибилизация к тропомиозину может указывать на истинную пищевую аллергию независимую от респираторного заболевания, вызванного клещами домашней пыли [18]. Согласно другой гипотезе, Der p 10 может быть диагностическим маркером у пациентов с аллергией на клещей домашней пыли и с дополнительной сенсибилизацией к другим аллергенам, кроме Der p 1 и Der p 2. Такие пациенты могут требовать особого внимания в случае, если решается вопрос о проведении аллерген-специфической иммунотерапии [35].
Высокую частоту одновременной сенсибилизации к различным компонентам аллергенов клещей домашней пыли (рисунок 2) можно объяснить как косенсибилизацией, так и перекрестной реактивностью. Специфические IgE к Der p 2/Der f 2 почти всегда обладают перекрестной реактивностью, однако для Lep d 2 перекрестная реактивность не описана [18]. Аллергены 1-й группы также обладают перекрестной реактивностью, однако у некоторых пациентов отмечался видоспецифический ответ [18]. Относительно высокий уровень сенсибилизации исследованных нами пациентов к аллергенам как 1-й, так и 2-й группы указывает на важную роль косенсибилизации.
Выводы
В исследованной группе у подавляющего большинства сенсибилизированных к клещам домашней пыли пациентов была обнаружена полисенсибилизация к двум и более аллергенам обоих основных КДП (D. pteronyssinus и D. farinae). Напротив, лишь небольшая часть пациентов была сенсибилизирована к тропомиозинам клещей домашней пыли, и эта сенсибилизация нечасто сопровождалась сенсибилизацией к другим молекулам клещей. Это позволяет предположить, что преобладает другой путь сенсибилизации – посредством тропомиозинов пищевого происхождения.
Необходимо подчеркнуть необходимость информации об аллергенах, которые входят в состав экстракта клещей домашней пыли, применяющегося в диагностических и лечебных целях. Это является вкладом настоящего исследования в практическую медицину. Авторы ряда исследований сосредоточились на этой проблеме и проанализировали количество и качество аллергенов в составе некоторых коммерческих препаратов. Коммерческие экстракты существенно различаются по содержанию аллергенов [9, 10, 11]. Хотя некоторые авторы сомневаются в необходимости адаптации аллергенной иммунотерапии к вызвавшим сенсибилизацию видам [22], мы считаем, что это имеет значение для достижения оптимального терапевтического эффекта. Аллергены 2-й группы обладают выраженной перекрестной реактивностью. Тем не менее, поскольку сенсибилизация к аллергенам 1-й группы у некоторых пациентов может быть видоспецифичной, а ее распространенность выше у детей, при разработке вакцин от аллергии к клещам домашней пыли нужно правильно учесть баланс основных видов клещей и основных аллергенов. Что касается паттернов сенсибилизации пациентов Центральной Европы, необходимо подчеркнуть важность количественного определения по меньшей мере трех основных компонентов клещей домашней пыли, Der f 1, Der p 1 и Der f 2 (или Der p 2). Эта информация крайне важна для эффективной диагностики и лечения. Помимо этих молекул, при проведении аллерген-специфической иммунотерапии следует учитывать новый основной аллерген клещей домашней пыли Der p 23, [26, 36, 37]. Требуется исследовать важность потенциальных новых аллергенов (так называемых аллергенов «среднего уровня», например, Der p 5) в данном контексте. Чтобы прийти к консенсусу относительно дозы отдельных молекул при проведении аллерген-специфической иммунотерапии с аллергенами КДП, срочно требуются полноценные долгосрочные клинические исследования с определением критериев эффективности. [37, 38].
Литература
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Панцнер П., Вачова М., Влас Т.,Витовцова П.,Бродска П., Малый М.
Clinical and Translational Allergy20188:19
Аннотация
Введение
Основными источниками воздушных аллергенов в помещениях являются клещи домашней пыли, перхоть домашних животных и грызунов, тараканы и некоторые грибы. Клещи домашней пыли – основная причина аллергии в ряде стран с теплым климатом. Тем не менее, эпидемиологическая значимость аллергенов клещей домашней пыли и тараканов в Центральной Европе до сих пор не установлена.
Методы
Определены профили сенсибилизации к клещевым аллергенам домашней пыли и тараканов у пациентов с аллергией из Центрального Европейского региона. Проведена молекулярная диагностика с использованием микрочипа ISAC и обследование 1766 пациентов с основанным на клинической картине подозрением на аллергическое заболевание. У 1255 пациентов отмечен положительный результат исследования хотя бы на один аллерген и проведен статистический анализ полученных результатов.
Результаты
Сенсибилизация хотя бы к одной специфической для аллергенов клещей домашней пыли молекуле (Der p 1, 2, Der f 1, 2) наблюдалась относительно часто (32,7% пациентов). Отмечается перекрестная реактивность почти всех специфических IgE к молекулам аллергенов клещей домашней пыли 2-й группы. Аллергены 1-й группы также обладают перекрестной реактивностью, однако у некоторых пациентов наблюдался видоспецифический ответ. Относительно высокий уровень сенсибилизации исследованных пациентов к аллергенам как 1-й, так и 2-й группы указывает на важную роль косенсибилизации. Изолированная сенсибилизация к молекулам аллергенов глицифагидных клещей Lep d 2 и/или Blo t 5 без сенсибилизации к другим молекулам клещей наблюдалась исключительно редко (0,6% случаев). Истинная сенсибилизация хотя бы к одной специфичной для тараканов молекуле (Blag 1, 2, 5) наблюдалась очень редко (0,6% случаев), и почти во всех этих случаях отмечалась косенсибилизация к другим молекулам, не характерным для тараканов. Сенсибилизация к ингаляционному тропомиозину наблюдалась редко (у 2,2% пациентов) (Der p 10 у 1,9% и Bla g 7 у 1,5%). Косенсибилизация к ингаляционным тропомиозинам и к соответствующим специфичным для аллергенов клещей или тараканов молекулам наблюдалась лишь у небольшой части пациентов. Это позволяет предположить, что существует другой, более распространенный путь сенсибилизации.
Выводы
У большинства пациентов имеется сенсибилизация одновременно к нескольким молекулам соответствующего источника аллергенов. Определение молекулярного спектра сенсибилизации необходимо для выбора оптимального метода диагностики и подбора схемы лечения с учетом состава аллергенов в экстрактах клещей домашней пыли, применяющихся для диагностики и лечения. Кроме того, необходимо подчеркнуть важность количественного определения по крайней мере трех основных компонентов аллергенов клещей домашней пыли, Der f 1, Der p 1 и Der f 2 (или Der p 2) с учетом паттернов сенсибилизации пациентов из Центральной Европы.
Введение
Наличие реакции немедленной гиперчувствительности к домашним аллергенам является фактором риска развития астмы и аллергического ринита. Кроме того, сенсибилизация к данным аллергенам может играть роль в манифестации атопического дерматита. Основные источники воздушных аллергенов в помещениях - клещи домашней пыли (КДП), перхоть домашних животных и грызунов, тараканы и некоторые грибы. Учитывая, что большинство людей в европейских сообществах проводят в помещениях более 90% своей жизни, неудивительно, что домашние аллергены играют важную роль в развитии сенсибилизации и симптомов аллергии. Сенсибилизация к определенным молекулам может увеличивать риск развития астмы или атопического дерматита [1, 2]. В нескольких исследованиях высказывается предположение, что сенсибилизация ко множеству молекул («молекулярный спрединг») связана с более высокой вероятностью развития более тяжелых симптомов аллергии [2, 3, 4].
КДП являются основной причиной аллергии в некоторых странах с теплым климатом [5]; в Центральной Европе сенсибилизация к аллергенам клещей домашней пыли, некоторых животных (особенно кошачьим и собачьим аллергенам) и плесневых грибков (особенно рода Alternaria) встречается немногим реже, чем сенсибилизация к пыльце [6, 7]. Аллергия на тараканов играет большую роль в развитии астмы в некоторых регионах Америки и Азии [8], ее значимость для Центральной Европы до сих пор не установлена.
Диагноз «иммуноглобулин E (IgE)-опосредованная ингаляционная аллергия» ставится прежде всего на основании анамнеза и факта сенсибилизации. Сенсибилизация подтверждается путем проведения кожного прик-теста и определения аллерген-специфических IgE сыворотки, однако этот метод имеет ряд ограничений. Состав аллергенов, используемых при проведении аллергологического тестирования in vitro и in vivo, может различаться. Это связано с недостаточным количеством стандартизированных экстрактов аллергенов, что, в свою очередь, обусловлено природным разнообразием их источников аллергенов, а также производственным процессом. Эта проблема уже подтвердилась в отношении аллергенов КДП [9, 10, 11]. Еще более важный недостаток экстрактов аллергенов заключается в том, что при множественной сенсибилизации, которая наблюдается у многих пациентов, они не позволяют различить первичную сенсибилизацию и иммунологическую перекрестную реактивность. Тем не менее, еще несколько лет назад экстракты натуральных аллергенов были ключевым элементом диагностики ингаляционной аллергии. В настоящий момент благодаря достижениям молекулярной биологии появилась возможность проведения молекулярной диагностики, а также разработки широкого спектра очищенных натуральных и рекомбинантных молекул аллергенов. Такие повсеместно доступные в настоящее время реагенты позволяют применять для диагностики метод компонентной аллергодиагностики, а также проводить систематическое исследование основных аллергенов и процессов перекрестной реактивности, участвующих в аллергической сенсибилизации.
Внедрение технологии микрочипов, на которые нанесено большое количество очищенных или рекомбинантных молекул, является примером дальнейшего развития диагностики аллергических заболеваний. В настоящее время такие микрочипы представляют собой мощный инструмент для скрининга IgE-реактивности сыворотки крови, который позволяет определить профиль сенсибилизации пациентов. Выявление сенсибилизации и косенсибилизации к видоспецифическим и перекрестно-реагирующим компонентам аллергенов может быть особенно важным в случае принятия решений о применении аллерген-специфической иммунотерапии.
Целью данного исследования являлась оценка целесообразности проведения молекулярной диагностики с применением микрочипов для определения профилей сенсибилизации у жителей Центрального Европейского региона с сенсибилизацией к аллергенам КДП и тараканов. Особое внимание уделялось определению различий между перекрестной реактивностью и множественной сенсибилизацией к различным аллергенам. В настоящий момент доступен лишь небольшой объем данных о диагностической точности технологии микрочипов ImmunoCAP ISAC при аллергии на КДП и тараканов. Тем не менее, мы решили использовать этот подход, поскольку он может обеспечить анализ широкого спектра множественных сенсибилизаций. Кроме того, ряд исследований продемонстрировал сопоставимость результатов, полученных с помощью технологии микрочипов ISAC, основанной на определении компонентов аллергенов, и с помощью технологии CAP, основанной на определении целого аллергена [12, 13]. Тем не менее, при проведении исследования необходимо учитывать возможность разной степени чувствительности методики к отдельным молекулам.
Методы
Настоящее одномоментное обсервационное исследование проводилось в соответствии с рекомендациями по повышению качества составления отчетов об обсервационных исследованиях в эпидемиологии (Strengthening the Reporting of Observational Studies in Epidemiology, STROBE) [14], насколько это было применимо к дизайну данного исследования. Мы провели ретроспективный анализ данных 1766 пациентов из западной части Чешской Республики с подозрением на аллергию, обследованных в 2011–2014 гг. в поликлинической службе отделения иммунологии и аллергологии университетской больницы г. Пльзень. Было проведено дальнейшее обследование 1255 пациентов с положительным результатом анализа хотя бы на один компонент. Исследуемая группа состояла из 1255 сенсибилизированных пациентов с хотя бы одним из следующих диагнозов: хронический ринит (73%), бронхиальная астма (41%), атопический дерматит (34%), крапивница или отек (19%) и (или) анафилаксия (11%). Возраст пациентов находился в диапазоне от одного года до 68 лет со средним значением 29 лет. Соотношение по полу: 45,3% – мужчины и 54,7% – женщины.
Уровень специфических IgE ко множеству компонентов аллергена определяли с помощью технологии 112-компонентного микрочипа ImmunoCAP ISAC (Thermo Fisher Scientific, Уппсала, Швеция). Реакционный участок микрочипа инкубировали с 20 мкл неразведенной сыворотки крови пациента в течение двух часов для связывания аллерген-специфических IgE с соответствующими аллергенами. После этого слайды микрочипов ополаскивали и промывали для удаления несвязанных sIgE. После высушивания комплексы аллерген-связанных sIgE окрашивали флуоресцентно-мечеными вторичными антителами (IgE к белкам человека) при комнатной температуре в защищенном от света месте в течение 1 ч. После повторной процедуры ополаскивания и промывки сигналы флюоресцентной метки сканировали с помощью лазерного сканера (LuxScan 10K; CapitalBio, Пекин, Китай). Анализ соответствующих оцифрованных изображений микрочипа проводили с использованием программного обеспечения ImmunoCAP ISAC. Информацию с изображений переводили в числовой формат с использованием результатов сыворотки сравнения с известным содержанием IgE. Результаты выражали в стандартизированных единицах ISAC (ISU), результаты считали положительными при значениях 0,3 ISU/л и выше.
Проведенный анализ включал в себя компоненты ингаляционных аллергенов, специфичных для клещей домашней пыли и тараканов, а также потенциально перекрестно-реактивные компоненты. Все компоненты входили в систему ISAC. Специфические маркеры аллергии были представлены группой 1 (nDer p 1, nDer f 1), группой 2 (rDer p 2, rDer f 2, rLep d 2) группой 5/21 (rBlo t 5) аллергенов клещей домашней пыли, а также молекулами rBla g 1, аспарагиновой протеазы rBla g 2 и глутатион-S-трансферазы rBla g 5 тараканов. Также в анализ были включены такие паналлергены, как тропомиозины клещей домашней пыли и тараканов (rDer p 10 и nBla g 7), которые связаны с сенсибилизацией к другим тропомиозинам (nPen m 1 и rAni s 3).
Результаты
Ниже перечислены результаты анализа, описывающие паттерны сенсибилизации к аллергенам клещей домашней пыли и тараканов в группе из 1255 пациентов, сенсибилизированных по меньшей мере к одному компоненту аллергенов в исследуемом нами регионе. Процентные соотношения рассчитывали для всей группы из всех 1255 пациентов.
Клещи домашней пыли
Сенсибилизация хотя бы к одной специфической для клещей домашней пыли молекуле (Der p 1, 2, Der f 1, 2) наблюдалась у 32,7% пациентов. Изолированная сенсибилизация к молекулам глицифагидных клещей Lep d 2 и/или Blo t 5 без сенсибилизации к другим молекулам клещей наблюдалась лишь в 0,6% случаев.
Тараканы
Истинная сенсибилизация хотя бы к одной специфичной для тараканов молекуле (Bla g 1, 2, 5) встречалась очень редко (0,6% случаев). Почти во всех этих случаях отмечалась косенсибилизация к другим молекулам, не имеющим отношения к тараканам, в том числе у половины пациентов (4 случая) – к молекулам клещей домашней пыли.
Тропомиозины
Сенсибилизация к ингаляционным тропомиозинам клещей домашней пыли и тараканов наблюдалась у 2,2% пациентов (Der p 10 – у 1,9% и Bla g 7 – у 1,5% пациентов).
Косенсибилизация к Der p 10 и другим молекулам клещей домашней пыли наблюдалась у 0,7% пациентов. Косенсибилизация к Bla g 7 и другим специфичным для тараканов молекулам встречалась исключительно редко (у 0,1%), при этом ни в одном из случаев не отмечалось косенсибилизации к Der p 10.
У пациентов, сенсибилизированных к Der p 10 и не сенсибилизированных к Bla g 7 (0,6%), почти во всех случаях (0,5%) не наблюдалось сенсибилизации к другим тропомиозинам (Pen m 1, Ani s 3), а сенсибилизация к другим молекулам клещей домашней пыли наблюдалась лишь в 0,2% случаев. У пациентов, сенсибилизированных к Der p 10 и Bla g 7 (1,3%), сенсибилизация к другим тропомиозинам наблюдалась во всех случаях, а к другим молекулам клещей домашней пыли – в 0,5% случаев. Моносенсибилизация (в контексте тропомиозинов) к Bla g 7 отмечалась исключительно редко.
Частота сенсибилизации и косенсибилизации к отдельным молекулам клещей домашней пыли представлена на рисунках 1 и 2. Сенсибилизация и косенсибилизация в контексте тропомиозинов и аллергенов клещей домашней пыли представлена на рисунке 3. Сенсибилизация к специфичным для клещей домашней пыли молекулам в контексте сенсибилизации к молекулам специфичным для других ингаляционных аллергенов представлена на рисунке 4.
 Рисунок 1. Частота сенсибилизации к молекулам клещей домашней пыли
Рисунок 1. Частота сенсибилизации к молекулам клещей домашней пыли Рисунок 2. Диаграмма Венна, описывающая моно- и косенсибилизацию к молекулам клещей домашней пыли. Моно- и косенсибилизация с частотой менее 0,6% не показаны
Рисунок 2. Диаграмма Венна, описывающая моно- и косенсибилизацию к молекулам клещей домашней пыли. Моно- и косенсибилизация с частотой менее 0,6% не показаны Рисунок 3. Диаграмма Венна, описывающая моно- и косенсибилизацию к тропомиозинам по отношению к сенсибилизации к клещам домашней пыли (= сенсибилизация хотя бы к одной специфичной для клеща домашней пыли молекуле). Моно- и косенсибилизация с частотой менее 0,2% не показаны
Рисунок 3. Диаграмма Венна, описывающая моно- и косенсибилизацию к тропомиозинам по отношению к сенсибилизации к клещам домашней пыли (= сенсибилизация хотя бы к одной специфичной для клеща домашней пыли молекуле). Моно- и косенсибилизация с частотой менее 0,2% не показаны Рисунок 4. Диаграмма Венна, описывающая моно- и косенсибилизацию к различным группам молекул клещей домашней пыли и к другим ингаляционным аллергенам. Сенсибилизация к группе определяется как сенсибилизация хотя бы к одному из соответствующих видоспецифичных компонентов аллергенов клещей домашней пыли (Der p 1, Der p 2, Der f 1, Der f 2), кошек (Fel d 1, Fel d 4), собак (Can f 1, Can f 2, Can f 5), лошадей (Equ c 1), грибка Alternaria (Alt a 1, Alt a 6), пыльцы (Phl p 1, Phl p 2, Phl p 4, Phl p 5, Phl p 6, Phl p 11, Cyn d 1, Bet v 1, Aln g 1, Cor a 1, Cup a 1, Cry j 1, Ole e 1, Ole e 9, Pla a 2, Pla l 1, Art v 1, Che a 1). Моно- и косенсибилизация с частотой менее 1,0% не показаны
Рисунок 4. Диаграмма Венна, описывающая моно- и косенсибилизацию к различным группам молекул клещей домашней пыли и к другим ингаляционным аллергенам. Сенсибилизация к группе определяется как сенсибилизация хотя бы к одному из соответствующих видоспецифичных компонентов аллергенов клещей домашней пыли (Der p 1, Der p 2, Der f 1, Der f 2), кошек (Fel d 1, Fel d 4), собак (Can f 1, Can f 2, Can f 5), лошадей (Equ c 1), грибка Alternaria (Alt a 1, Alt a 6), пыльцы (Phl p 1, Phl p 2, Phl p 4, Phl p 5, Phl p 6, Phl p 11, Cyn d 1, Bet v 1, Aln g 1, Cor a 1, Cup a 1, Cry j 1, Ole e 1, Ole e 9, Pla a 2, Pla l 1, Art v 1, Che a 1). Моно- и косенсибилизация с частотой менее 1,0% не показаныОбсуждение
В исследуемой группе пациентов сенсибилизация к круглогодичным ингаляционным молекулам наблюдалась реже, чем сенсибилизация к компонентам пыльцы [6]. Однако относительно высокая частота сенсибилизации к клещам домашней пыли подчеркивает клиническую важность этого аллергена для Центрального Европейского региона. Необходимо акцентировать внимание на том, что в данной статье мы описываем только частоту сенсибилизации, а не ее клиническую значимость. Проведение анализа клинической значимости в таких больших когортах без применения специфических провокационных тестов может быть достаточно сложным и нереалистичным.
Тараканы
Предполагается, что при проведении диагностических исследований у 50–64% пациентов можно обнаружить положительные реакции на смесь из пяти аллергенов Bla g 1 и/или Per a 1, Bla g 2, Bla g 4, Bla g 5 и Bla g 7 и/или Per a 7 [15, 16]. Степень гомологии между липокалином Bla g 4 и липокалинами млекопитающих невелика, поэтому ожидается лишь незначительная перекрестная реактивность с данными аллергенами млекопитающих [8]. Мы не анализировали эту перекрестную реактивность из-за очень низкой частоты сенсибилизации к Bla g 4 в исследуемой группе пациентов. Низкая частота сенсибилизации к молекулам тараканов была, по-видимому, обусловлена скорее небольшим количеством тараканов в нашем климате, чем отсутствием молекул при проведении анализа.
Клещи домашней пыли
По данным нескольких исследований самыми распространенными видами ингаляционной аллергии считаются аллергия на КДП и сенсибилизация к КДП.[5, 17, 18]. В нашем регионе этот аллерген находится на четвертом месте по частоте сенсибилизации после пыльцы трав (частота сенсибилизации к Phl p 1 – 60,8%), пыльцы березы (частота сенсибилизации к Bet v 1 – 47,3%) и кошачьих аллергенов (частота сенсибилизации к Fel d 1 – 31,5%) [6], что расходится с данными для других регионов [17, 19, 20]. Такое несоответствие может быть обусловлено географическими различиями или особенностями выбранной популяции, состоящей преимущественно из взрослых в основном с респираторной аллергией. В исследовании, проводившемся в северной Италии, также была продемонстрирована более высокая частота сенсибилизации к пыльце травы у подростков, тогда как у детей младшего возраста наиболее часто обнаруживалась сенсибилизация к аллергенам клещей домашней пыли [19].
Известно, что пациенты, сенсибилизированные к аллергенам клещей домашней пыли, не всегда были сенсибилизированы к молекулам, которые применялись в нашем исследовании. Несмотря на то что может наблюдаться сенсибилизация и к другим молекулам, существует лишь очень небольшое количество пациентов, сенсибилизированных только к ним [21, 22, 23, 24, 25]. Более того, описано, что сигнальные пути, активированные цистеиновыми протеазами (Der p 1, Der f 1), приводят к выраженной стимуляции TH2. Кроме того, аллергены 2-й группы связывают TLR4 путем связывания LPS. Таким образом, данные молекулы обладают более сильным иммуногенным потенциалом, что еще больше увеличивает многокомпонентность аллергий на клещей домашней пыли. Следовательно, эти молекулы могут играть ведущую роль в атопии, и частота сенсибилизации к различным аллергенам у детей и взрослых может отличаться [26]. Было показано, что у детей чаще встречается сенсибилизация к 1-й группе аллергенов [18], что указывает на возможную роль аллергенов 1-й группы в появлении сенсибилизации, которая, возможно, опосредована их протеолитической активностью и прямым повреждением эпителия [27]. Более высокая частота сенсибилизации к аллергенам 2-й группы у взрослых указывает на более позднюю сенсибилизацию к аллергенам 1-й группы, что обнаружено при исследовании пациентов одной возрастной когорты [26]. Вероятным объяснением данного наблюдения может быть способность аллергенов 2-й группы к прямому связыванию с TLR4. Кроме того, эти наблюдения могут объяснить более выраженное увеличение тяжести клинической картины аллергии при увеличении воздействия аллергенов КПД, чем при воздействии кошачьих аллергенов, при котором увеличение воздействия приводит, по-видимому, к развитию толерантности [28].
Dermatophagoides pteronyssinus является наиболее широко распространенным клещом домашней пыли во всем мире. Особенно он преобладает в регионах с высокой влажностью, где климат больше подвержен влиянию океана. Предполагается, что Dermatophagoides farinae чаще встречается в континентальных регионах Европы и в Средиземноморье, однако в большинстве стран наблюдаются смешанные популяции клещей домашней пыли [22, 29]. У исследованных нами пациентов частота сенсибилизации к D. pteronyssinus и к D. farinae почти не различалась, тогда как в Испании распространенность IgE к аллергенам D. pteronyssinu была несколько выше, чем к аллергенам D. farinae [18].
Хотя пироглифидные КДП D. pteronyssinus и D. farinae являются, по всей видимости, преобладающими видами, в некоторых регионах большое значение также могут иметь глицифагидные клещи [18, 21, 29].
Наиболее значимым видом клещей домашней пыли семейства Glycyphagidae является Blomia tropicalis. Он распространен преимущественно в тропических регионах [4, 29]. Показано, что гомологичность последовательностей основного аллергена Blo t 5 и аллергена Der p 5 составляет 40%, однако перекрестная реактивность между данными аллергенами не отмечается [29]. Поскольку B. tropicalis не является частью акарофауны Центральной Европы, присутствие некоторого уровня сенсибилизации у исследованных пациентов, скорее всего, связана с потенциальной перекрестной реактивностью аллергенов различных видов клещей (группы 5/21 молекул клещей), чем с истинной сенсибилизации. Это предположение подтверждается низкими уровнями сенсибилизации к Blo t 5 в исследованной нами группе. Результаты другого исследования позволяют предположить, что аллергены, не относящиеся к группе 5, также могут отвечать за частичную перекрестную реактивность к аллергенам других видов клещей [30].
Lepidoglyphus destructor, глицифагидный складской клещ, также может стать КДП [29]. Сенсибилизация при воздействии этого клеща в домашних условиях отмечалась в Швеции и во Франции. Невозможно определить, связан ли положительный результат исследования на Lep d 2 у исследованных нами пациентов с истинной сенсибилизацией или с перекрестным реагированием в контексте 2-й группы молекул клещей. Отсутствие у исследованных пациентов моносенсибилизации к Lep d 2 (в контексте молекул клещей) скорее свидетельствует о том, что сенсибилизация к этой молекуле обусловлена перекрестной реактивностью с другими аллергенами 2-й группы, что противоречит данным об ее отсутствии [18].
У исследованных нами сенсибилизированных к аллергенам клещей пациентов, как правило, отмечалась косенсибилизация к нескольким специфичным для клещей компонентам; моносенсибилизация встречалась заметно реже (рисунок 2). Предполагается, с развитием аллергии чаще всего связаны такие специфические компоненты как Der f 1 и Der p 1 (цистеиновые протеазы), а также Der f 2 и Der p 2 (липидсвязывающие белки). Преобладающая как в плане распространенности, так и в плане интенсивности сенсибилизация ко 2-й группе молекул клещей была описана ранее [17, 18, 25] и подтверждается полученными результатами. В проводившемся во Франции исследовании обнаружено преобладание сенсибилизации к Der p 1 (93% [31], и, по-видимому, данное различие связано с изучением другой популяции. Кроме того, в том же исследовании была обнаружена более высокая частота сенсибилизации к Der p 10 (28%), что указывает на то, что фактором первичной сенсибилизации, возможно, является креветка, которую намного чаще употребляют в пищу в средиземноморском регионе, чем в Центральной Европе.
Тропомиозины – молекулы, ответственные за перекрестную реактивность к аллергеном клещей, креветок и тараканов [32]. IgE связывающийся с аллергенами группы 10 клещей домашней пыли, редко встречается в Европе[21] и Австралии [33] и, по данным одного из исследований, пациенты из США сенсибилизированы и к КДП, и к тараканам [34]. Аналогично, в изученной нами популяции сенсибилизация к отдельным тропомиозинам встречалась намного реже, чем сенсибилизация к нескольким молекулам тропомиозина одновременно. Это позволяет предположить наличие перекрестной реактивности в пределах этой группы молекул (рисунок 3).
Сенсибилизация к тропомиозину Der p 10 у исследованных пациентов наблюдалась нечасто (1,9%), косенсибилизация с другими специфичными для клещей молекулами также встречалась нерегулярно (0,8%). Это указывает на то, что у значительной доли пациентов, по-видимому, существует другой путь сенсибилизации. Тропомиозины являются клинически значимыми аллергенами морепродуктов, однако роль тропомиозина клещей Der p 10 в развитии аллергии на клещей домашней пыли подробно не изучалась. Была выдвинута гипотеза о том, что сенсибилизация к тропомиозину может указывать на истинную пищевую аллергию независимую от респираторного заболевания, вызванного клещами домашней пыли [18]. Согласно другой гипотезе, Der p 10 может быть диагностическим маркером у пациентов с аллергией на клещей домашней пыли и с дополнительной сенсибилизацией к другим аллергенам, кроме Der p 1 и Der p 2. Такие пациенты могут требовать особого внимания в случае, если решается вопрос о проведении аллерген-специфической иммунотерапии [35].
Высокую частоту одновременной сенсибилизации к различным компонентам аллергенов клещей домашней пыли (рисунок 2) можно объяснить как косенсибилизацией, так и перекрестной реактивностью. Специфические IgE к Der p 2/Der f 2 почти всегда обладают перекрестной реактивностью, однако для Lep d 2 перекрестная реактивность не описана [18]. Аллергены 1-й группы также обладают перекрестной реактивностью, однако у некоторых пациентов отмечался видоспецифический ответ [18]. Относительно высокий уровень сенсибилизации исследованных нами пациентов к аллергенам как 1-й, так и 2-й группы указывает на важную роль косенсибилизации.
Выводы
В исследованной группе у подавляющего большинства сенсибилизированных к клещам домашней пыли пациентов была обнаружена полисенсибилизация к двум и более аллергенам обоих основных КДП (D. pteronyssinus и D. farinae). Напротив, лишь небольшая часть пациентов была сенсибилизирована к тропомиозинам клещей домашней пыли, и эта сенсибилизация нечасто сопровождалась сенсибилизацией к другим молекулам клещей. Это позволяет предположить, что преобладает другой путь сенсибилизации – посредством тропомиозинов пищевого происхождения.
Необходимо подчеркнуть необходимость информации об аллергенах, которые входят в состав экстракта клещей домашней пыли, применяющегося в диагностических и лечебных целях. Это является вкладом настоящего исследования в практическую медицину. Авторы ряда исследований сосредоточились на этой проблеме и проанализировали количество и качество аллергенов в составе некоторых коммерческих препаратов. Коммерческие экстракты существенно различаются по содержанию аллергенов [9, 10, 11]. Хотя некоторые авторы сомневаются в необходимости адаптации аллергенной иммунотерапии к вызвавшим сенсибилизацию видам [22], мы считаем, что это имеет значение для достижения оптимального терапевтического эффекта. Аллергены 2-й группы обладают выраженной перекрестной реактивностью. Тем не менее, поскольку сенсибилизация к аллергенам 1-й группы у некоторых пациентов может быть видоспецифичной, а ее распространенность выше у детей, при разработке вакцин от аллергии к клещам домашней пыли нужно правильно учесть баланс основных видов клещей и основных аллергенов. Что касается паттернов сенсибилизации пациентов Центральной Европы, необходимо подчеркнуть важность количественного определения по меньшей мере трех основных компонентов клещей домашней пыли, Der f 1, Der p 1 и Der f 2 (или Der p 2). Эта информация крайне важна для эффективной диагностики и лечения. Помимо этих молекул, при проведении аллерген-специфической иммунотерапии следует учитывать новый основной аллерген клещей домашней пыли Der p 23, [26, 36, 37]. Требуется исследовать важность потенциальных новых аллергенов (так называемых аллергенов «среднего уровня», например, Der p 5) в данном контексте. Чтобы прийти к консенсусу относительно дозы отдельных молекул при проведении аллерген-специфической иммунотерапии с аллергенами КДП, срочно требуются полноценные долгосрочные клинические исследования с определением критериев эффективности. [37, 38].
Литература
- Банерджи С., Реш И., Чен КВ, Свобода I, Фокке-Тейкл М., Блатт К. и др. Der p 11 является основным аллергеном для пациентов с аллергией на клеща домашней пыли, страдающих атопическим дерматитом. J Инвест Дерматол. 2015;135(1):102–9.
- Реш Y, Мишель С., Кабеш М., Лупинек С., Валента Р., Вртала С. Различное распознавание IgE компонентов аллергена клеща у детей астматических и неастматических детей. J Аллергия Клин Иммунол. 2015;136(4):1083–91.
- Custovic A, Sonntag HJ, Buchan IE, Belgrave D, Simpson A, Prosperi MC. Эволюционные пути реакции IgE на аллергены травы и клещей на протяжении всего детства. J Аллергия Клин Иммунол. 2015;136(6):1645–52.
- Кидон МИ, Чианг ЧМ, Лью ВК, Онг ТК, Тионг ЙС, Вонг КН и др. Клещ компонентно-специфический репертуар IgE и фенотипы аллергических заболеваний в детском возрасте: тропическая перспектива. Педиатр Аллергия Иммунол. 2011;22(2):202–10.
- Буске П.Д., Чинн С., Янсон С., Когевинас М., Берни., Джарвис Д. и др. Географические различия в распространенности положительных кожных тестов на аэроаллергены окружающей среды в Обзоре респираторного здоровья Европейского сообщества I. Аллергия. 2007;62(3):301–9.
- Панцнер., Вачева М., Витовцова., Бродская., Влас Т. Комплексный анализ среднеевропейских профилей молекулярной сенсибилизации к аллергенам пыльцы. Int Arch Аллергия Иммунол. 2014;164(1):74–82.
- Стемеседер Т., Клинглмайр Е., Мозер С., Люфтенеггер Л., Ланг Р., Химли М. и др. Перекрестное исследование аллергической сенсибилизации австрийских подростков с использованием профилирования IgE на основе молекул. Аллергия. 2017;72(5):754–63.
- Помеся А, Арруда ЛК. Исследование аллергенов тараканов: с целью улучшения диагностики и лечения пациентов с аллергией на тараканов. Методика. 2014;66(1):75–85.
- Кассет А, Мари А, Пурохит А, Реш Й, Вегхофер М, Феррара Р и др. Различный состав и содержание аллергенов влияет in vivo на аллергенную активность коммерческих экстрактов Dermatophagoides pteronyssinus. Int Arch Аллергия Иммунол. 2012;159(3):253–62.
- Takai T, Okamoto Y, Okubo K, Nagata M, Sakaguchi M, Fukutomi Y и др. Доклад целевой группы Японского общества аллергологии о стандартизации вакцин против аллергенов клещ домашней пыли — вторичная публикация. Allergol Int. 2015;64(2):181–6.
- Brunetto B, Tinghino R, Braschi MC, Antonicelli L, Pini C, Iacovacci P. Characterization and comparison of commercially available mite extracts for in vivo diagnosis. Allergy. 2010;65(2):184–90.
- Melioli G, Bonifazi F, Bonini S, Maggi E, Mussap M, Passalacqua G, et al. The ImmunoCAP ISAC molecular allergology approach in adult multi-sensitized Italian patients with respiratory symptoms. Clin Biochem. 2011;44(12):1005–11.
- Huss-Marp J, Gutermuth J, Schaffner I, Darsow U, Pfab F, Brockow K и др. Сравнение молекулярной и экстракаторной диагностики аллергии с мультиплексным и одноплексным анализом. Allergo J Int. 2015;24:46–53.
- Vandenbroucke JP, von Elm E, Altman DG, Gotzsche PC, Mulrow CD, Pocock SJ и др. Усиление отчетности о обсервационных исследованиях в эпидемиологии (STROBE): объяснение и разработка. PLoS Med. 2007;4(10):e297.
- Барбоза МС, Сантос АБ, Ферриани ВИЦЕ, Помс А, Чепмен MD, Арруда ЛК. Эффективность рекомбинантных аллергенов для диагностики аллергии на тараканов у пациентов с астмой и/или ринитом. Int Arch Аллергия Иммунол. 2013;161(3):213–9.
- Arruda LK, Barbosa MC, Santos AB, Moreno AS, Chapman MD, Pomes A. Рекомбинантные аллергены для диагностики аллергии на тараканов. Curr Allergy Asthma Rep. 2014;14(4):428.
- Скала Е, Алессандри С, Бернарди МЛ, Феррара Р, Палаццо, Помпони Д и др. Перекрестное исследование реактивности иммуноглобулина Е у 23 077 субъектов с использованием системы обнаружения микрочипов на основе аллергенных молекул. Clin Exp Аллергия. 2010;40(6):911–21.
- Барбер Д., Ариас Ж., Бокете М., Кардона В., Каррильо Т., Гала Г. и др. Анализ больных аллергией на клеща на разнообразной территории с помощью усовершенствованных диагностических средств. Clin Exp Аллергия. 2012;42(7):1129–38.
- Мелиоли Г., Маркомини Л., Агацци А., Базурро Г., Тоска М., Росси Г.А. и др. Репертуар IgE у детей и подростков решен на уровне компонентов: поперечное исследование. Педиатр Аллергия Иммунол. 2012;23(5):433–40.
- Вестритшниг К., Сибанда Е., Томас У., Ауэр Х., Аспок Х., Питтнер Г. и др. Анализ профиля сенсибилизации к аллергенам в Центральной Африке. Clin Exp Аллергия. 2003;33(1):22–7.
- Питтнер Г., Вртала С., Томас В.Р., Вегхофер М., Кунди М., Хорак Ф. и др. Компонентная диагностика аллергии на клеща домашней пыли с очищенными природными и рекомбинантными аллергенами клеща. Clin Exp Аллергия. 2004;34(4):597–603.
- Томас WR. Аллергия на домашнюю пыль и иммунотерапия. Гум Вакцина Иммунотер. 2012;8( 10):1469–78.
- Hales BJ, Elliot CE, Chai LY, Pearce LJ, Tipayanon T, Hazell L, et al. Количественное сопоставление связывания IgE с аллергенами клеща домашней пыли Der p 15 и Der p 18 по сравнению с основными и средними аллергенами. Int Arch Аллергия Иммунол. 2013;160(3):233–40.
- Вегхофер М., Гроте М., Реш И., Кассет А., Кнайдингер М., Дж. Идентификация Der p 23, перитрофин-подобного белка, в качестве нового крупного аллергена Dermatophagoides pteronyssinus, связанного с перитрофическим матриксом фекальных гранул клеща. J Иммунол. 2013;190(7):3059–67.
- Томас WR. Иерархия и молекулярные свойства аллергенов клеща домашней пыли. Allergol Int. 2015;64(4):304–11.
- Поса Д., Перна С., Реш И., Люпинек С., Панетта В., Хофмайер С. и др. Эволюция и прогностическая ценность реакций IgE на комплексную панель аллергенов клеща домашней пыли в течение первых 2 десятилетий жизни. J Аллергия Клин Иммунол. 2017;139(2):541–9.
- Такай Т., Икеда С. Барьерная дисфункция, вызванная протеазами окружающей среды, в патогенезе аллергических заболеваний. Allergol Int. 2011;60(1):25–35.
- Renand A, Archila LD, McGinty J, Wambre E, Robinson D, Hales BJ и др. Хроническое воздействие аллергена кошки вызывает TH2-зависимый клеточный ответ IgG4, связанный с низкой сенсибилизацией. J Аллергия Клин Иммунол. 2015;136(6):1627–35.
- Томас WR. География аллергенов клеща домашней пыли. Азиатский Pac J Аллергия Иммунол. 2010;28(4):211–24.
- Симпсон А., Грин Р., Кустович А., Вудкок А., Арруда Л.К., Чепмен, доктор медицины. Кожный тест на реактивность природных и рекомбинантных аллергенов Blomia и Dermatophagoides spp. среди пациентов с аллергией на клещей в Великобритании. Аллергия. 2003;58(1):53–6.
- Броннерт М., Манчини Дж., Бирнбаум Ж., Агабриэль С., Лиабеф В., Порри Ф. и др. Диагностика с разрешением компонентов с коммерчески доступным D. pteronyssinus Der p 1, Der p 2 и Der p 10: соответствующие маркеры аллергии на клещей домашней пыли. Clin Exp Аллергия. 2012;42(9):1406–15.
- Ayuso R, Reese G, Leong-Kee S, Plante M, Lehrer SB. Молекулярные основы перекрестной реактивности членистоногих: IgE-связывающие перекрестно-реактивные эпитопы креветок, клеща домашней пыли и тропомиозины тараканов. Int Arch Аллергия Иммунол. 2002;129(1):38–48.
- Hales BJ, Martin AC, Pearce LJ, Laing IA, Hayden CM, Goldblatt J и др. IgE и IgG антидомовые пылевые клеща специфичности при аллергических заболеваниях. J Аллергия Клин Иммунол. 2006;118(2):361–7.
- Satinover SM, Reefer AJ, Pomes A, Chapman MD, Platts-Mills TAE, Woodfolk JA. Специфические паттерны связывания антител IgE и IgG с рекомбинантными аллергенами тараканов. J Аллергия Клин Иммунол. 2005;115(4):803–9.
- Реш Й., Вегхофер М., Зайберлер С., Хорак Ф., Шайбблхофер С., Линхарт Б и др. Молекулярная характеристика Der p 10: диагностический маркер широкой сенсибилизации при аллергии на клеща домашней пыли. Clin Exp Аллергия. 2011;41(10):1468–77.
- Мюллер Г.А., Рэндалл Т.А., Глеснер Дж., Педерсен Л.К., Перера Л., Эдвардс Л.Л. и др. Серологический, геномный и структурный анализ основного аллергена клеща Der p 23. Clin Exp Аллергия. 2016;46(2):365–76.
- Батард Т., Барон-Бодо V, Мартелет А., Ле Миньон М., Лемуан., Джайн К. и др. Паттерны сенсибилизации IgE у пациентов с аллергией на клеща домашней пыли: последствия для аллергенной иммунотерапии. Аллергия. 2016;71(2):220–9.
- Кальдерон М., Казале Т., Нельсон Х., Демоли. Научно обоснованный анализ иммунотерапии аллергенов клещами домашней пыли: призыв к более строгим клиническим исследованиям. J Аллергия Клин Иммунол. 2013;132(6):1322–36.





