2087
14 Апреля 2021
Giuseppe Cornaglia, Helen Giamarellou, Gian Maria Rossolini
Опубликовано в Lancet Infect Dis 2011; 11: 381–93
Металло-бета-лактамазы являются детерминантами устойчивости возрастающей клинической значимости у грамотрицательных бактерий. В связи с их широким спектром, мощной карбапенемазной активностью и устойчивостью к ингибиторам, эти ферменты могут обеспечить устойчивость практически ко всем бета-лактамам. С 1990-х годов ряд металло-бета-лактамаз, кодируемых подвижной ДНК, был обнаружен у важнейших грамотрицательных патогенов (таких как Enterobacteriaceae, Pseudomonas aeruginosa, и Aci...
Опубликовано в Lancet Infect Dis 2011; 11: 381–93
Металло-бета-лактамазы являются детерминантами устойчивости возрастающей клинической значимости у грамотрицательных бактерий. В связи с их широким спектром, мощной карбапенемазной активностью и устойчивостью к ингибиторам, эти ферменты могут обеспечить устойчивость практически ко всем бета-лактамам. С 1990-х годов ряд металло-бета-лактамаз, кодируемых подвижной ДНК, был обнаружен у важнейших грамотрицательных патогенов (таких как Enterobacteriaceae, Pseudomonas aeruginosa, и Aci...
Giuseppe Cornaglia, Helen Giamarellou, Gian Maria Rossolini
Опубликовано в Lancet Infect Dis 2011; 11: 381–93
Металло-бета-лактамазы являются детерминантами устойчивости возрастающей клинической значимости у грамотрицательных бактерий. В связи с их широким спектром, мощной карбапенемазной активностью и устойчивостью к ингибиторам, эти ферменты могут обеспечить устойчивость практически ко всем бета-лактамам. С 1990-х годов ряд металло-бета-лактамаз, кодируемых подвижной ДНК, был обнаружен у важнейших грамотрицательных патогенов (таких как Enterobacteriaceae, Pseudomonas aeruginosa, и Acinetobacter baumannii). Некоторые из этих ферментов (например: VIM-1 и NDM-1) имели отношение к недавнему кризису в результате международного распространения устойчивой к карбапенемам Klebsiella pneumoniae и других энтеробактерий. Несмотря на наличие обширных знаний в области молекулярной биологии и генетики металло-бета-лактамаз, эпидемиологические данные противоречивы, а клинического опыта все еще недостаточно. Поэтому остается ряд нерешенных или спорных вопросов по лечению инфекций, вызванных продуцентами металло-бета-лактамаз.
Введение
Выделяют два семейства бета-лактамаз, развившихся в бактериях: сериновые бета-лактамазы и металло-бета-лактамазы. Различные механизмы данных семейств обуславливают их разное поведение с хелаторами металлов (например, с ЭДТА [этилендиаминтетрауксусной кислотой]), которые не влияют на активность сериновых бета-лактамаз, но ингибируют металло-бета-лактамазы и являются основной отличительной особенностью двух ферментов. Механическая разница между металло-бета-лактамазами и сериновыми бета-лактамазами свидетельствует о различиях в их молекулярной структуре и филогении. Сериновые бета-лактамазы принадлежат к ацилтрансферазам суперсемейства SxxK и по своей структуре и механизму относятся к пенициллин-связывающим белкам, тогда как металло-бета-лактамазы относятся к суперсемейству, включающему белки с некоторыми другими функциями.
Металло-бета-лактамазы, обнаруженные в середине 1960-х годов (примерно через 25 лет после сериновых бета-лактамаз), изначально были выявлены только у видов с низким патогенным потенциалом. В 1990-х годах, с распространением генов, кодирующих металло-бета-лактамазы, которые переносятся среди основных грамотрицательных патогенов в составе мобильных генетических элементов, клиническая значимость этих ферментов выросла, что привело к недавнему кризису в результате международного распространения устойчивых к карбапенемам представителей семейства Enterobacteriaceae, продуцирующих металло-бета-лактамазы типа VIM-1 и типа NDM-1.1
Общие характеристики металло-бета-лактамаз
Помимо инактивации хелатирующими агентами, все металло-бета-лактамазы имеют дополнительные функциональные особенности, которые включают мощную карбапенемазную активность, устойчивость к клиническим ингибиторам бета-лактамаз (клавуланатам и сульфонам) и отсутствие активности в отношении монобактамов. Активность в отношении бета-лактамов отличается у разных металло-бета-лактамаз, а субстратная специфичность может варьироваться от узкой (например, ген CphA металло-бета-лактамазы Aeromonas hydrophila) до широкой (например, металло-бета-лактамазы типа VIM, которые могут расщеплять практически все классы бета-лактамов, за исключением монобактамов)2–4. Карбапенемазная активность и устойчивость к ингибиторам в клиническом аспекте являются наиболее тревожными особенностями металло-бета-лактамаз.
Разнообразие и классификация металло-бета-лактамаз
Металло-бета-лактамазы принадлежат к классу В по молекулярной классификации бета-лактамаз5 и подразделяютя на 3 основных структурных субкласса, отличаясь при этом значительным внутренним разнообразием. Представители различных субклассов отличаются не только высокой степенью разнообразия последовательностей, но также структорой их активного центра. У ферментов субклассов B1 и B3, активный центр содержит 2 иона цинка, у элементов субкласса B2 он содержит только один, объясняя таким образом более узкую субстратную специфичность этого субкласса. Каждый субкласс включает несколько разных типов металло-бета-лактамаз, многие из которых имеют несколько аллельных вариантов. Значение аминокислотного разнообразия, составляющее не менее 30%, используется в качестве порога для классификации новых металло-бета-лактамаз3. Металло-бета-лактамазы кодируются либо генами, которые являются частью хромосомной структуры у некоторых видов бактерий (резидентные металло-бета-лактамазы), или гетерологичными генами, приобретенными посредством горизонтального переноса генов (приобретенные металло-бета-лактамазы). Лишь несколько резидентных металло-бета-лактамаз обнаружены у видов клинической значимости, таких как Bacillus spp, Stenotrophomonas maltophilia, некоторых видов Aeromonas, Bacteroides fragilis, различных флавобактерий и Pseudomonas otitidis2, 6, у которых они могут улучшать собственный профиль устойчивости к бета-лактамам. Приобретенные металло-бета-лактамазы были обнаружены в штаммах представителей семейства Enterobacteriaceae, Pseudomonas aeruginosa, Acinetobacter baumannii, и других грамотрицательных неферментирующих бактерий. Почти все приобретенные типы относятся к субклассу B1, что свидетельствует об общей высокой предрасположенности представителей этого субкласса к захвату и распространению посредством мобильных генетических элементов, чем у представителей субклассов B2 и B3.
Приобретенные металло-бета-лактамазы
Существует по меньшей мере девять разных типов приобретенных металло-бета-лактамаз (см. рисунок 1).
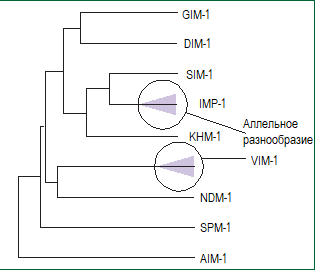 Рисунок 1: Разнообразие различных типов металло-бета-лактамаз.
Рисунок 1: Разнообразие различных типов металло-бета-лактамаз.
Дендрограмма показывает разнообразие и структурные отношения между различными типами металло-бета-лактамаз. Затемненные участки, перекрывающии линии типов IMP и VIM, указывают на существование несколькоих аллельных вариантов в рамках этих линий.
Важнейшими типами по эпидемиологической распространенности и клинической значимости являются ферменты типов IMP, VIM, SPM и NDM.
Ферменты типа IMP впервые были обнаружены в Японии в конце 1980-х годов8 и впоследствии были зарегистрированы по всему миру у представителей семейства Enterobacteriaceae и грамотрицательных неферментирующих бактерий (в основном у P aeruginosa и Acinetobacter spp). Было описано более 20 различных аллотипов IMP, принадлежащих разным сублиниям (см. рисунок 2).
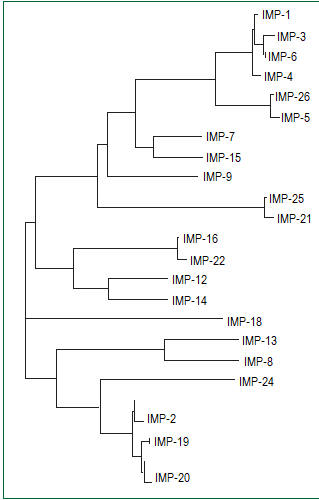 Рисунок 2: Разнообразие аллельных вариантов ферментов типа IMP
Рисунок 2: Разнообразие аллельных вариантов ферментов типа IMP
Дендрограмма демонстрирует разнообразие и структурные отношения между аллельными вариантами металло-бета-лактамаз типа IMP.
Различные варианты IMP, как правило, привязаны к определенным географическим регионам, однако некоторые (например, IMP-1, IMP-4 и IMP-7) обнаруживались на других географических территориях, что демонстрирует их потенциал для межконтинентального распространения. Ферменты типа IMP имеют широкий спектр субстратной специфичности с выскокой афинностью к цефалоспоринам и карбапенемам, но низкой активностью по отношению к темоциллину (6-альфа-метокси пенициллин, не имеющий клинической ценности при лечении инфекций, вызванных продуцентами IMP) 4, 23. Существенные кинетические отличия среди вариантов IMP у некоторых субстратов свидетельствуют о том, что аллотипическое разнообразие может иметь функциональные последствия; тем не менее, различия не имеют серьезных клинических последствий.
Ферменты типа VIM были впервые обнаружены в Европе в конце 1990-х гг.11 и впоследствии были зарегистрированы по всему миру. Известно более 20 различных аллотипов VIM, принадлежащих трем сублиниям. Как и в случае с ферментами типа IMP, варианты VIM имеют определенное географическое распространение. Однако типы VIM-1 и VIM-2 имеют более широкое распространение, чем ферменты типа IMP, демонстрируя тем самым свою поразительную тенденцию к распространению. Ферменты типа VIM впервые были обнаружены у P aeruginosa и других грамотрицательных неферментирующих видов, но впоследствии появились у представителей семейства Enterobacteriaceae и в некоторых случаях стали представлять серьезную проблему. Металло-бета-лактамазы типа VIM показывают еще более широкую субстратную специфичность, чем типы IMP, поскольку могут гидролизовать 6-альфа-метокси пенициллины. Кроме того, ферменты типа VIM являются уникальными металло-бета-лактамазами, имея выскую афинность с карбапенемами69. Аллотипы VIM также демонстрируют функциональную гетерогенность, хотя она и не имеет клинической значимости, которая предполагает, что активность фермента может быть изменена посредством точечных или многоточечных мутаций.
Фермент SPM-1 является третьим типом приобретенной металло-бета-лактамазы, выделенный в начале XXI века у изолятов P aeruginosa из Бразилии59. К настоящему времени этот фермент распространен в основном в Бразилии и у P aeruginosa. Данная низкая предрасположенность к распространению может быть обусловлена различными связанными типами мобильных генетических элементов. SPM-1 имеет очень широкую субстратную специфичность, включающую карбапенемы, цефалоспорины и пенициллины70.
Фермент NDM-1 является одиним из новых типов металло-бета-лактамаз и его предрасположенность к межконтинентальному распространению представляет серьезную проблему1. NDM-1 впервые был обнаружен в штамме Klebsiella pneumoniae, выделенном в 2008 г. у пациента, вернувшегося в Швецию из Индии, где NDM-1 широко распространен у представителей семейства Enterobacteriaceae71. Впоследствии сообщалось об инфекциях, вызываемых продуцентами NDM-1 A baumannii. Другие приобретенные металло-бета-лактамазы (SIM-1, GIM-1, AIM-1 и DIM-1) имеют более низкую скорость распространения и меньшее клиническое воздействие в отличие от NDM-1.
Происхождение генов приобретенных металло-бета-лактамаз неизвестно. Наиболее вероятными источниками являются бактерии окружающей среды, от которых грамотрицательные неферментирующие бактерии и семейство Enterobacteriaceae могли приобрести детерминанты устойчивости, разделяя при этом несколько общих экологических ниш. В клинических условиях штаммы с приобретенными генами металло-бета-лактамазы могут отбираться путем воздействия на них противомикробных препаратов и становиться вторичным резервуаром в условиях медицинских учреждениий. Распространение генов приобретенных металло-бета-лактамаз среди грамотрицательных патогенов активируется мобильными элементами ДНК, что объясняет, почему один и тот же ген может быть связан с плазмидами или встроен в хромосому у разных штаммов. Большинство приобретенных генов переносятся в мобильных генетических кассетах в составе интегронов2, 62, 68, и, как следствие, они могут использовать систему рекомбинации интегронов и мобильность элементов ДНК, с которыми связаны интегроны (транспозоны и плазмиды). Тем не менее, ген blaSPM-1 связан с ISCR4, являющейся представителем семейства ISCR и может мобилизовать фланкирующие сегменты ДНК72. Ген blaNDM-1 связан с различными типами инсерционных последовательностей73.
Различная природа мобильных генетических элементов, которые связаны с генами приобретенных металло-бета-лактамаз, частично может объяснять отличие в их склонности к распространению.
Большинство интегронов, которые содержат генетические кассеты для металло-бета-лактамаз, также имеют дополнительные генетические кассеты, несущие детерминанты устойчивости к другим классам антибиотиков (например, к аминогликозидам и хлорамфениколу) или дезинфектантам, или даже гены других бета-лактамаз. Таким образом, передача интегрона может привести одномоментной передаче сложного фенотипа множественной лекарственной устойчивости.
Эпидемиология приобретенных металло-бета-лактамаз
Возрастающий интерес к металло-бета-лактамазам не сопровождается надежными эпидемиологическими данными. Поскольку молекулярная идентификация металло-бета-лактамаз в рамках крупномасштабных исследований выполнялась нечасто, а данные по численности группы риска при расчете показателя инфекционной заболеваемости часто отсутствуют, эпидемиологическая информация не является достоверной. Если данные имеются, то, как правило, показывают, что особенности эпидемиологии зависят от страны. Некоторые факторы, включая региональное применение антибиотиков и практики лечебных учреждений, могут отчасти объяснять данные различия.
Азия
IMP-1 у P aeruginosa и Serratia marcescens из Японии был первой выявленной приобретенной металло-бета-лактамазой7, 8.
Далее последовали многоцелевые отчеты о IMP-1 у других представителей семейства Enterobacteriaeae, P aeruginosa и других неферментирующих бактерий9, 10, 25. IMP-2 был обнаружен у Acinetobacter spp74, а IMP-7 - у P aeruginosa75. Новыми выявленными вариантами фермента IMP были IMP-312, IMP-616, IMP-10 (номер доступа в GenBank AB074436)22 и IMP-11 (номер доступа в GenBank AB074437)9. Ферменты типа VIM были выявлены позже и имели явно более низкую распространенность, чем ферменты типа IMP. Новая металло-бета-лактамаза KHM-1 была обнаружена в клиническом изоляте Citrobacter freundii65.
VIM-2 была первой металло-бета-лактамазой, обнаруженной в Корее, и быстро распространилась среди Pseudomonas spp2, энтеробактерий2 и Acinetobacter spp.36. Ранее неизвестный ген blaSIM-1 был обнаружен у A baumannii62, и также было выявлено его сосуществование с blaIMP-1 и blaVIM-2, а также у геномовида 10 Acinetobacte76. Виды Acinetobacter и P aeruginosa, продуцирующие ферменты типа IMP (IMP-1 у обеих, а также IMP-6 у последней) впоследствии были зарегистрированы по всей стране77, 78.
Первой зарегистрированной металло-бета-лактамазой в Китае была IMP-4, обнаруженная у Citrobacter youngae14 и у четырех неродственных изолятов Acinetobacter spp, а позже у Klebsiella13, 79. IMP-1 была зарегистрирована у P aeruginosa80 и Enterobacter cloacae81, в то время как IMP-8 и IMP-9 были зарегистрированы у Acinetobacter spp19 и P aeruginosa соответственно21. VIM-2 является единственной металло-бета-лактамазой типа VIM, зарегистрированной у штаммов P aeruginosa в разных лечебных учреждениях Китая82.
IMP-1, VIM-2 и ее вариант VIM-3 - все были обнаружены у Pseudomonas spp при первом исследовании металло-бета-лактамаз в Тайвани39. VIM-2 и VIM-3 были также зарегистрированы у других неферментирующих бактерий, как VIM-3 у E cloacae30. VIM-11 были обнаружены у представителей семейства Enterobacteriaceae и у неферментирующих бактерий51. IMP-1 была многократно зарегистрирована у клинически важной Acinetobacter spp83. Вариант IMP-2 IMP-8 был обнаружен у нескольких изолятов Enterobacteriaceae18,37 и у A baumannii30. IMP-24 была описана у S marcescens30.
В настоящее время многочисленные сообщения о типе NDM-1 у представителей семейства Enterobacteriaceae поступают из нескольких центров Индии, Пакистана и Бангладеша. Наличие фермента также выявлено у A baumannii1, 67, 71. Ряд типов VIM (VIM-2, VIM-5, VIM-6, VIM-11 и новый VIM-18) широко распространен у Pseudomonas spp57. IMP представляется наиболее распространенной металло-бета-лактамазой у представителей семейства Enterobacteriaceae и у A baumannii84. В рамках недавнего исследования были обнаружены изоляты K pneumoniae и Enterobacter aerogenes, несущие ген blaSIM-1, ассоциированный с blaIMP или blaVIM-1.
В Малайзии, IMP-72 и IMP-485 были выявлены у P aeruginosa и A baumannii соответственно. Впоследствии было обнаружено, что собранные случайным образом клинические изоляты содержат VIM-2 и VIM-11.86
Выделенные в Сингапуре IMP-1 и VIM-6 были обнаружены у Pseudomonas fluorescens и Pseudomonas putida соответственно 46 . Разные типы металло-бета-лактамаз были обнаружены у P aeruginosa, а именно IMP-1, IMP-7, VIM-2, VIM-6, и IMP-26. 2,31 IMP-4 была обнаружена у A baumannii.87
На Ближнем Востоке гены blaVIM были обнаружены у P aeruginosa, выделенные в Саудовской Аравии88 и Иране89. IMP-1 была обнаружена в Бейруте, Ливии90, о наличии NDM-1 позже сообщалось из Омана. 91
Европа
Италия была первой европейской страной, сообщившей о приоретенных металло-бета-лактамазах, а именно: IMP-2 и VIM-1.13,32 IMP-12,23 IMP-1324 и VIM-1454 впервые появились в Италии. Впоследствии сообщалось как о небольших, так и о крупных вспышках инфекций в разных регионах страны, при этом VIM-1, VIM-2 и IMP-13 были самыми распространенными ферментами3. Также сообщалось о случаях NDM-1-продуцирующей Escherichia coli.92
Ферменты типа VIM распространены в Греции, где VIM-1, VIM-2 и VIM-4 быстро распространились у Enterobacteriaceae4, P aeruginosa2,40 и других неферментирующих бактерий34, 38, 43. Также сообщалось о VIM-1993 VIM-1252и VIM-1756.
VIM-5 была впервые зарегистрирована в Турции у P aeruginosa45 и у представителей семейства Enterobacteriaceae44. Также в Турции впервые были выявлены VIM-1 у K pneumoniae94 и VIM-2 у P aeruginosa95. IMP-1 была выявлена у E cloacae и у P aeruginosa.96
Первой металло-бета-лактамазой во Франции была VIM-2 у P aeruginosa, которая была выделена в Марселе35. Первой зарегисрированной IMP была ранее неизвестная IMP-19, которая также была первой IMP у Aeromonas caviae28. VIM-1 также была первой металло-бета-лактамазой, выявленной у K pneumoniae33, а IMP-1 была распространена у изолятов E aerogenes97. Общенациональное исследование изолятов P aeruginosa выявило только три VIM-2 и одну IMP-18, демонстрируя тем самым все еще низкую распросраненность металло-бета-лактамаз98. NDM-1 и VIM-4 были идентифицированы у изолята C freundii у пациента, вернувшегося из Индии.99
Первая приобретенная металло-бета-лактамаза, зарегистрированная в Великобритании, по всей вероятности производная blaIMP, была описана у завезенного изолята A baumannii2. P aeruginosa, собранная во время программы наблюдения Британского общества противомикробной химиотерапии, являлась носителем VIM-2.4 Два новых фермента VIM-9 и VIM-10 обнаружены у изолятов, которые были направлены в национальную референтную лабораторию49. 37 изолятов E coli и K pneumonia, которые были переданы в ту же лабораторию, показали положительный результат по наличию NDM-1, многие пациенты недавно приехали из Индии или Пакистана, или иным образом имели отношение к этим странам71. Также сообщалось об инфекциях с продуцирующим NDM-1 A baumannii67. Хотя ферменты типа VIM быстро распространились в Испании100, общая распространенность продуцентов металло-бета-лактамаз в лечебных учреждениях Испании до сих пор является низкой. Два первичных производных фермента VIM (VIM-1353 и VIM-20 [номер доступа ACV13198]) были описаны у P aeruginosa, а также сообщалось о первом случае NDM-1-продуцирующей K pneumoniae.92
IMP-5, обнаруженная у A baumannii, была первой зарегистрированной металло-бета-лактамазой в Португалии15. Еще одно сообщение о гене blaIMP поступило по факту выявления IMP-8 у Pseudomonas mendocina20. VIM-2 была идентифицирована у нескольких изолятов P aeruginosa в 1995.2
Устойчивая ко многим лекарственным препаратам P aeruginosa, продуцирующая VIM-2, была обнаружена в Бельгии101, где впервые был описан вызванный продукцией NDM-1 летальный исход у пациента, ранее госпитализированного в Пакистане92. Второй случай продуцирующей NDM-1 Enterobacteriaceae был выявлен у пациента, ранее госпитализированного в Черногории102. В Нидерландах в 2009 году был обнаружен принципиально новый фермент DIM-1 в штамме Pseudomonas stutzeri68. Два пациента, путешествовавших по Индии, были колонизированы различными изолятами K pneumoniae, содержащими NDM-1.103
Продуценты металло-бета-лактамаз P aeruginosa все чаще обнаруживаются в Норвегии и Швеции и часто завозятся из других стран. В основном это ферменты группы VIM (а именно VIM-2 и VIM-4), но также сообщалось о IMP-14.104, 105 NDM-1 изначально была идентифицирована у пациента, репатриированного в Швецию после поступления в больницу в Нью Дели66, и с тех пор была обнаружена в Норвегии (снова у пациентов, госпитализированных в Индии)106 и в Дании у пациента, который перевелся из больницы в Боснии и Герцеговине107.
В Германии VIM-1 была обнаружена у P aeruginosa108 и у представителей семейства Enterobacteriaceae109. VIM-2 была многократно обнаружена у P aeruginosa108 и в выделенном из мочи изоляте P aeruginosa в Мюнхене, продуцирующем ранее неизвестный вариант VIM-2 ‒ VIM-16.55 GIM-1 была обнаружена в пяти изолятах P aeruginosa от разных пациентов в Дюссельдорфе60, также сообщалось о его высокой распространенности у Pseudomonas spp и Enterobacteriaceae. Недавно сообщалось об инфекции с NDM-1-продуцирующими Enterobacteriaceae и A baumannii92, 110. Различные типы металло-бета-лактамаз (IMP-13, IMP-22 и VIM-2), продуцируемые P aeruginosa, а также продуцирующие NDM-1 энтеробактерии были выявлены в Австрии.29, 92
VIM-2 у P aeruginosa был первым обнаруженным в Польше2 типом металло-бета-лактамаз и с тех пор был зарегистрирован во многих центрах3. VIM-4 стала эндемичной у изолятов P aeruginosa, инфицирующей детей в хирургических отделениях в Польше2. IMP-7 была обнаружена в двух изолятах P aeruginosa111. Также сообщалось о распространении A baumannii с ферментом типа VIM и K pneumoniae, продуцирующей неустановленную металло-бета-лактамазу112, 113. Первым зарегистрированным в Венгрии типом металло-бета-лактамаз был VIM-4,114 который впоследствии был идентифицирован у штамма A hydrophila42 и у Klebsiella spp115. Также были описаны P aeruginosa, продуцирующие либо VIM-1,116 либо VIM-24.
P aeruginosa, продуцирующая IMP-7, была обнаружена в Словакии117 и Чешской Республике.118
На Балканах VIM-2 была обнаружена у изолятов P aeruginosa из Сербии119 и Хорватии120, а VIM-2 ‒ VIM-15 был выделен у P aeruginosa в Болгарии55. Сообщения о NDM-1 у пациентов, которые были госпитализированы или в Черногории102, или в Боснии и Герцеговине106, или посещавших эти регионы92, дают основание предполагать, что как и в случае с индийским субконтинентом, Балканы могут быть вторым регионом, эндемичным для штаммов, несущих данный фермент.
Ген blaVIM-2 был идентифицирован у изолята P aeruginosa из России121. 11 штаммов P aeruginosa, имеющие генетические детерминанты группы VIM, были изолированы в хирургическом отделении в Москве.122
Остальные страны
В Бразилии SPM-1 является основной металло-бета-лактамазой, но IMP-1 (у Enterobacteriaceae123 и грамотрицательных неферментирующих бактерий72), IMP-16 и VIM-2 (оба у P aeruginosa) также имеются26. SPM-1 была впервые обнаружена в штамме P aeruginosa, выделенном в Сан Паулу59, и впоследствии распространилась по стране с существенными различиями между географическими областями. Единственный случай выявления SPM-1 за пределами Бразилии был зарегистрирован у изолята P aeruginosa у пациента из Швейцарии, получавшего первичную медицинскую помощь в Ресифи, Бразилия.124
Сообщений о случаях из других стран Южной Америки на удивление немного ввиду высоких показателей устойчивости к карбапенемам на этом континенте. IMP-1 (у Acinetobacter spp), IMP-13 и VIM-11 (оба у P aeruginosa) были обнаружены в Аргентине50, 125, 126. VIM-2 была выявлена в Чили (P fluorescens) и Венесуэле (P aeruginosa)125. В результате вспышки устойчивой к карбапенемам P aeruginosa в Кали, Колумбия48 было получено первое сообщение о VIM-8, VIM-2 также была обнаружена у P aeruginosa в некоторых городах этой страны.127
Металло-бета-лактамазы редко встречаются в США. Первым зарегистрированным случаем была VIM-7, филогенетически отличный вариант, которая была обнаружена в Техасе у изолята P aeruginosa47. Первая вспышка нозокомиальной инфекции с VIM-2,128 и первое появление металло-бета-лактамаз типа IMP в США - IMP-1827, также были зарегистрированы у P aeruginosa. В начале 2010 годов NDM-1129 и VIM130 были выявлены у представителей семейства Enterobacteriaceae.
В Канаде первой зарегистрированной металло-бета-лактамазой была IMP-7, новый фермент, обнаруженный у P aeruginosa17. Тем не менее, из всех нечувствительных к IPM P aeruginosa, которые были выделены в Калгарийском округе здравоохранения с 2002 по 2004 годы, 43% продуцировали VIM-2 и только 2% продуцировали IMP-7.131,132 Продуцирующая NDM-1 E coli была выделена у пациента, недавно посетившего Индию.133
IMP-1525 и IMP-18 были обнаружены у клинических изолятов из различных учреждений Мексики134. Также сообщалось о сосуществовании в той же больнице штаммов P aeruginosa, продуцирующих либо IMP-15, либо VIM-2.135 VIM-2 также была обнаружена у 2 штаммов E cloacae и у одного Klebsiella oxytoca.136
Первой и наиболее распространенной металло-бета-лактамазой в Австралии была IMP-4, обнаруженная у P aeruginosa2 и представителей семейства Enterobacteriaceae2, 3. Также была обнаружена VIM-4.137 AIM-1 была обнаружена у P aeruginosa64, 138, зарегистрирована продуцирующая NDM-1 E coli.139
VIM-2 (P aeruginosa)140 и VIM-4 (K pneumoniae)141 были обнаружены в Тунисе. Металло-бета-лактамазы были выявлены у A baumannii, но тип фермента не сообщался.142
Пять разных штаммов Enterobacteriaceae, выделенных в Алжире, содержали новую металло-бета-лактамазу, обозначенную как VIM-19 и отличающуюся от VIM-4 только одной заменой. Данное открытие подтверждает появление VIM-4-подобных ферментов у Enterobacteriaceae из стран Средиземноморского региона.58
Продуцирующая VIM-2 P aeruginosa была выделена у туриста из Венгрии, первично госпитализированного в Египте143. Аналогичным образом фермент VIM-2 , выделенный у P aeruginosa, был ассоциирован с пациентом, переведенным в больницу в Норвегии после продолжительной госпитализации в Гане105.
Три клонально-родственные группы P aeruginosa, продуцирующие VIM-2, стали причиной вспышек нозокомиальных инфекций в Кении144, первые африканские NDM-1-положительные изоляты были зарегистрированы там же.145
Применение в клинической практике
Штаммы-продуценты металло-бета-лактамаз, как правило, имеют сложные профили множественной лекарственной устойчивости, в том числе к большинству бета-лактамов. Хотя азтреонам не гидролизуется металло-бета-лактамазами, на возможность его использования в отношении продуцентов металло-бета-лактамаз зачастую влияют дополнительные механизмы устойчивости. Доклиническое исследование на модели пневмонии у крыс показало, что азтреонам может быть эффективным в отношении продуцирующей VIM-2 P aeruginosa с низкой минимальной подавляющей концентрацией (МПК) (0·25 мкг/мл)2. Тем не менее, достоверность модели сомнительна, поскольку аналогичный эффект также наблюдался с другими бета-лактамами, несмотря на высокие МПК. В то же время, азтреонам не смог значительно улучшить выживаемость у мышей с нейротропенией, которые были инфицированы P aeruginosa, продуцирующей IMP.146
МПК карбапенемов могут оставаться ниже пограничных концентраций для данных препаратов (особенно для представителей семейства Enterobacteriaceae), хотя для изолятов дикого типа того же вида они выше147. Несмотря на то, что Институт клинических и лабораторных стандартов и Европейский комитет по определению чувствительности к противомикробным препаратам подтвердили, что информация по МПК карбапенемов является достаточной для клинического применения, по-прежнему вызывает озабоченность возможность применения карбапенемов для лечения инфекций, вызванных продуцентами металло-бета-лактамаз с МПК в пределах диапазона чувствительности. Данный вопрос очень важен, учитывая всего несколько возможных методов лечения, когда речь идет о продуцентах металло-бета-лактамаз. Данные доклинических исследований, полученные на основании модели инфекции бедра у мышей с VIM-1-продуцирующими штаммами K pneumoniae с разными МПК карбапенемов показали, что имипенем был эффективным в отношении продуцирующих металло-бета-лактамазу штаммов с низкими МПК147. Тем не менее, данные рандомизированных исследований отсутствуют. Имеются единичные сообщения, описывающие как неэффективность терапии, так и положительную динамику после лечения карбапенемами пациентов, зараженных VIM-положительными штаммами, но чувствительными к карбапенемам in vitro.147,148
Данные из Греции показали, что монотерапия карбапенемами не была эффективнее некорректной терапии для показателей 14-дневной летальности, тогда как карбапенемы с другим активным веществом in vitro (колистином или аминогликозидом) были ассоциированы с определенно более низкой летальностью, чем в случае с одними карбапенемами147. Из этого следует, что насколько эффективной будет монотерапия карбапенемами для лечения инфекций, вызванных такими организмами, неизвестно, и каким образом рассматривать такие изоляты в отчете по определению чувствительности также неясно.
Ввиду отсутствия альтернативных вариантов монотерапии, эффективность комбинаций бета-лактамов и других препаратов изучались in vitro у изолятов-продуцентов металло-бета-лактамаз. Имипенем с колистином изучались по времени гибели в отношении группы генетически отличимых изолятов K pneumoniae, продуцирующих VIM-1. Хотя данная комбинация оказалась синергичной в отношении 50% чувствительных к колистину штаммов, она часто проявляла антагонизм в отношении устойчивых к колистину штаммов (МПК>4 мкг/мл)149. Кроме того, исследования времени гибели штаммов P aeruginosa, содержащих металло-бета-лактамазу, как с применением одного азтреонама, так и в тройной комбинации с цефтазидимом и амикацином, продемонстрировали усиленный бактерицидный эффект при использовании комбинации противомикробных препаратов по сравнению с одним азтреонамом.150
Механизмы устойчивости к аминогликозидам и хинолонам распространены у штаммов-продуцентов металло-бета-лактамазы3, что обычно оставляет очень мало вариантов для лечения. Два из них, а именно колистин и тигециклин, не проявляют никакой активности по отношению к Proteeae, а тигециклин также неактивен в отношении P aeruginosa. По этой причине появление металло-бета-лактамаз у Proteus mirabilis и других представителей этой группы вызывает серьезную озабоченность.
Колистин, который обычно считается неудачным выбором в связи с его неблагоприятной фармакокинетикой и токсическими эффектами, зачастую является единственным доступным антибиотиком в отношении организмов, продуцирующих металло-бета-лактамазу, особенно когда речь идет о штаммах Pseudomonas spp. Единственное исследование, когда колистин применялся против доказанно продуцирующей металло-бета-лактамазу P aeruginosa, отмечало положительную реакцию у 15 (67%) из 22 пациентов с преимущественно госпитальной и ИВЛ-ассоциированной пневмонией.151
Для семейства Enterobacteriaceae 12 случаев бактериемии или ИВЛ-ассоциированной пневмонии, вызванных (в основном неклональными) blaVIM-1-продуцирующими изолятами, были успешно вылечены одним колистином или в комбинации либо с карбапенемом, либо с активным аминогликозидом in vitro. Связанная с этим летальность составила 8%.152 В обоих исследованиях одновременный прием по меньшей мере одного из активных антибиотиков не позволяет качественно оценить фактическую эффективность колистина. Тем не менее, ретроспективный анализ показал, что для колистина с меропенемом результат лечения не был синергическим или даже аддитивным153. Исследователи сообщали об успешном лечении колистином гайморита, орбитального целлюлита и пневмонии, вызванных продуцентом металло-бета-лактамазы P aeruginosa, у пациента с нейтропенией147, а также продуцирующей металло-бета-лактамазу blaVIM-1 E cloacae-диссеминированной инфекции у пациента, перенесшего пересадку печени154. Широко распространенное эмпирическое применение колистина привело к появлению металло-бета-лактамаз-положительных штаммов устойчивой к колистину K pneumoniae с последующими летальными исходами, и, вероятно, способствовало появлению видов бактерий, устойчивых к колистину, таких как Proteus spp and Providencia spp.155
Небольшой опыт был получен в результате применения тигециклина для лечения инфекций, вызванных продуцирующими металло-бета-лактамазу Enterobacteriaceae. Из шести пациентов с нозокомиальной пневмонией или инфекциями кровотока 2 пациента, получавших тигециклин плюс полимиксин В или полмиксин Е (колистин), выжили, у остальных четырех результаты были неблагоприятными или неопределенными.147 В ретроспективном обсервационном исследовании девять из 13 пациентов (69%), инфецированных продуцирующими металло-бета-лактамазу Enterobacteriaceae, имели положительный результат лечения тигециклином147. В греческой серии случаев152, включающей 14 случаев бактериемии и три случая ИВЛ-ассоциированной пневмонии, которые были вызваны энтеробактерией-продуцентом blaVIM-1,152 тигециклин был активен в отношении всех изолятов. Тигециклин также успешно применялся для лечения пациента с продолжительной бактериемией, вызванной продуцентами VIM-1 и SHV-12 K pneumonia156. Тем не менее, низкие концентрации тигециклина в сыворотке крови указывают на необходимость проявления осторожности и выполнения тщательной оценки значений МПК перед применением данного препарата для лечения инфекций кровотока.157
Результаты метаанализа дают основание предполагать, что практически забытый антибиотик фосфомицин может применяться в качестве возможного метода лечения инфекций, вызванных P aeruginosa и Enterobacteriaceae c множественной лекарственной устойчивостью, включая продуцентов металло-бета-лактамаз158. Имеется только один известный клинический случай успешного лечения простатита, вызванного продуцирующей VIM-2 P aeruginosa, с использованием фосфомицина плюс азтреонама147. В случае с Enterobacteriaceae одно проспективное исследование описывает 11 взрослых пациентов в интенсивной терапии, которые были заражены устойчивой к карбапенемам K pneumoniae и получавших фосфомицин внутривенно (2–4 г каждые 6 часов) вместе с другими антибиотиками. Все пациенты имели хорошие бактериологические и клинические исходы заболевания без связанных с применением фосфомицина побочных эффектов147. Отсутствие клинического опыта, а также профиль безопасности фосфомицина требуют обязательного проведения дополнительных исследований. Также необходимо проработать выбор подходящих вспомогательных антибиотиков ввиду быстрого появления устойчивости при монотерапии фосфомицином.
Данные по хинолонам также отсутствуют. Согласно отчету из Австралии, большинство представителей семейства Enterobacteriaceae, продуцирующих IMP-4, были чувствительны к хинолонам. Четыре пациента, инфицированные неклональными штаммами трех разных видов (K pneumoniae, S marcescens и E cloacae), получили эффективное лечение препаратом данного класса147. Эндокардит искуственного клапана сердца, вызванный продуцирующей металло-бета-лактамазу P aeruginosa, также был успешно вылечен препаратами ципрофлоксацина и гентамицина147. Исследования потенциальных факторов риска колонизации или инфицирования продуцирующими металло-бета-лактамазы неферминтирующими бактериями определили продолжительное пребывание в больнице147 и применение в прошлом хинолонов159 либо бета-лактамов147 в качестве независимых прогностических факторов.
Смертность при тяжелых формах инфекциий, вызванных P aeruginosa, варьировалась от 70% до 95%; раннее и надлежащее лечение противомикробными препаратами является единственным изменяемым фактором, способным уменьшить эти цифры147, 160. Показатели смертности в результате инфекций, вызванных представителями семейства Enterobacteriaceae, продуцирующих металло-бета-лактамазы, составляли от 19% до 67% 147, 152. Смертность от инфекций кровотока, вызванных продуцирующей VIM-1 K pneumoniae с МПК 4 мкг/мл была ниже, чем у изолятов с концентрациями, превышающими 4 мкг/мл (13% против 54%), и статистически существенно не отличалась от контрольной группы пациентов, инфицированных не имеющими металло-бета-лактамаз штаммами.152
Выводы
Распространенность изолятов, продуцирующих металло-бета-лактамазу, и их выделение из угрожающих жизни инфекций, растет во всем мире с пугающей скоростью. Столь быстрое распространение обеспечивает научное сообщество большим количеством информации по молекулярной эпидемиологии металлобеталактамазы и ее генетическом окружении. Тем не менее, точной информации о том, как решать эту проблему в клинических условиях до сих пор нет. Клинических данных недостаточно, а поскольку получают их из регионов, где распространены ферменты типа VIM, они не охватывают постоянно растущее внутреннее разнообразие металло-бета-лактамаз. Более того, данные не показывают распространение металло-бета-лактамаз у различных видов семейства Enterobacteriaceae. После клинических исследований с учетом различий между патогенами, ферментами и клиническими синдромами, сдерживание распространения продуцирующих металло-бета-лактамазы организмов в целом зависит от выполнения жестких мероприятий по инфекционному контролю, гарантируя таким образом быстрое и точное их выявление в лаборатории клинической микробиологии.
Тот факт, что металло-бета-лактамазы стали представлять серьезную угрозу для здоровья должен побудить органы здравоохранения разработать план готовности для немедленного выполнения как на национальном, так и на наднациональном уровнях. Данный план должен обеспечивать раннее выявление первых случаев заболевания, а также применение классической стратегии по поиску и обезвреживанию в условиях, когда встречаются единичные случаи или полное отсутствие продуцентов металло-бета-лактамаз. Более того, максимальное сдерживание в регионах или странах с распространенностью металло-бета-лактамаз дожно стать приоритетным147. Распространение металло-бета-лактамаз представляет серьезную проблему как в плане лечения отдельных пациентов, так и в отношении политики в области инфекционного контроля, подчеркивая тем самым фактическое отсутствие готовности со стороны органов здравоохранения к решению данной проблемы.
Литература
Опубликовано в Lancet Infect Dis 2011; 11: 381–93
Металло-бета-лактамазы являются детерминантами устойчивости возрастающей клинической значимости у грамотрицательных бактерий. В связи с их широким спектром, мощной карбапенемазной активностью и устойчивостью к ингибиторам, эти ферменты могут обеспечить устойчивость практически ко всем бета-лактамам. С 1990-х годов ряд металло-бета-лактамаз, кодируемых подвижной ДНК, был обнаружен у важнейших грамотрицательных патогенов (таких как Enterobacteriaceae, Pseudomonas aeruginosa, и Acinetobacter baumannii). Некоторые из этих ферментов (например: VIM-1 и NDM-1) имели отношение к недавнему кризису в результате международного распространения устойчивой к карбапенемам Klebsiella pneumoniae и других энтеробактерий. Несмотря на наличие обширных знаний в области молекулярной биологии и генетики металло-бета-лактамаз, эпидемиологические данные противоречивы, а клинического опыта все еще недостаточно. Поэтому остается ряд нерешенных или спорных вопросов по лечению инфекций, вызванных продуцентами металло-бета-лактамаз.
Введение
Выделяют два семейства бета-лактамаз, развившихся в бактериях: сериновые бета-лактамазы и металло-бета-лактамазы. Различные механизмы данных семейств обуславливают их разное поведение с хелаторами металлов (например, с ЭДТА [этилендиаминтетрауксусной кислотой]), которые не влияют на активность сериновых бета-лактамаз, но ингибируют металло-бета-лактамазы и являются основной отличительной особенностью двух ферментов. Механическая разница между металло-бета-лактамазами и сериновыми бета-лактамазами свидетельствует о различиях в их молекулярной структуре и филогении. Сериновые бета-лактамазы принадлежат к ацилтрансферазам суперсемейства SxxK и по своей структуре и механизму относятся к пенициллин-связывающим белкам, тогда как металло-бета-лактамазы относятся к суперсемейству, включающему белки с некоторыми другими функциями.
Металло-бета-лактамазы, обнаруженные в середине 1960-х годов (примерно через 25 лет после сериновых бета-лактамаз), изначально были выявлены только у видов с низким патогенным потенциалом. В 1990-х годах, с распространением генов, кодирующих металло-бета-лактамазы, которые переносятся среди основных грамотрицательных патогенов в составе мобильных генетических элементов, клиническая значимость этих ферментов выросла, что привело к недавнему кризису в результате международного распространения устойчивых к карбапенемам представителей семейства Enterobacteriaceae, продуцирующих металло-бета-лактамазы типа VIM-1 и типа NDM-1.1
Общие характеристики металло-бета-лактамаз
Помимо инактивации хелатирующими агентами, все металло-бета-лактамазы имеют дополнительные функциональные особенности, которые включают мощную карбапенемазную активность, устойчивость к клиническим ингибиторам бета-лактамаз (клавуланатам и сульфонам) и отсутствие активности в отношении монобактамов. Активность в отношении бета-лактамов отличается у разных металло-бета-лактамаз, а субстратная специфичность может варьироваться от узкой (например, ген CphA металло-бета-лактамазы Aeromonas hydrophila) до широкой (например, металло-бета-лактамазы типа VIM, которые могут расщеплять практически все классы бета-лактамов, за исключением монобактамов)2–4. Карбапенемазная активность и устойчивость к ингибиторам в клиническом аспекте являются наиболее тревожными особенностями металло-бета-лактамаз.
Разнообразие и классификация металло-бета-лактамаз
Металло-бета-лактамазы принадлежат к классу В по молекулярной классификации бета-лактамаз5 и подразделяютя на 3 основных структурных субкласса, отличаясь при этом значительным внутренним разнообразием. Представители различных субклассов отличаются не только высокой степенью разнообразия последовательностей, но также структорой их активного центра. У ферментов субклассов B1 и B3, активный центр содержит 2 иона цинка, у элементов субкласса B2 он содержит только один, объясняя таким образом более узкую субстратную специфичность этого субкласса. Каждый субкласс включает несколько разных типов металло-бета-лактамаз, многие из которых имеют несколько аллельных вариантов. Значение аминокислотного разнообразия, составляющее не менее 30%, используется в качестве порога для классификации новых металло-бета-лактамаз3. Металло-бета-лактамазы кодируются либо генами, которые являются частью хромосомной структуры у некоторых видов бактерий (резидентные металло-бета-лактамазы), или гетерологичными генами, приобретенными посредством горизонтального переноса генов (приобретенные металло-бета-лактамазы). Лишь несколько резидентных металло-бета-лактамаз обнаружены у видов клинической значимости, таких как Bacillus spp, Stenotrophomonas maltophilia, некоторых видов Aeromonas, Bacteroides fragilis, различных флавобактерий и Pseudomonas otitidis2, 6, у которых они могут улучшать собственный профиль устойчивости к бета-лактамам. Приобретенные металло-бета-лактамазы были обнаружены в штаммах представителей семейства Enterobacteriaceae, Pseudomonas aeruginosa, Acinetobacter baumannii, и других грамотрицательных неферментирующих бактерий. Почти все приобретенные типы относятся к субклассу B1, что свидетельствует об общей высокой предрасположенности представителей этого субкласса к захвату и распространению посредством мобильных генетических элементов, чем у представителей субклассов B2 и B3.
Приобретенные металло-бета-лактамазы
Существует по меньшей мере девять разных типов приобретенных металло-бета-лактамаз (см. рисунок 1).
 Рисунок 1: Разнообразие различных типов металло-бета-лактамаз.
Рисунок 1: Разнообразие различных типов металло-бета-лактамаз.Дендрограмма показывает разнообразие и структурные отношения между различными типами металло-бета-лактамаз. Затемненные участки, перекрывающии линии типов IMP и VIM, указывают на существование несколькоих аллельных вариантов в рамках этих линий.
Важнейшими типами по эпидемиологической распространенности и клинической значимости являются ферменты типов IMP, VIM, SPM и NDM.
Ферменты типа IMP впервые были обнаружены в Японии в конце 1980-х годов8 и впоследствии были зарегистрированы по всему миру у представителей семейства Enterobacteriaceae и грамотрицательных неферментирующих бактерий (в основном у P aeruginosa и Acinetobacter spp). Было описано более 20 различных аллотипов IMP, принадлежащих разным сублиниям (см. рисунок 2).
 Рисунок 2: Разнообразие аллельных вариантов ферментов типа IMP
Рисунок 2: Разнообразие аллельных вариантов ферментов типа IMPДендрограмма демонстрирует разнообразие и структурные отношения между аллельными вариантами металло-бета-лактамаз типа IMP.
Различные варианты IMP, как правило, привязаны к определенным географическим регионам, однако некоторые (например, IMP-1, IMP-4 и IMP-7) обнаруживались на других географических территориях, что демонстрирует их потенциал для межконтинентального распространения. Ферменты типа IMP имеют широкий спектр субстратной специфичности с выскокой афинностью к цефалоспоринам и карбапенемам, но низкой активностью по отношению к темоциллину (6-альфа-метокси пенициллин, не имеющий клинической ценности при лечении инфекций, вызванных продуцентами IMP) 4, 23. Существенные кинетические отличия среди вариантов IMP у некоторых субстратов свидетельствуют о том, что аллотипическое разнообразие может иметь функциональные последствия; тем не менее, различия не имеют серьезных клинических последствий.
Ферменты типа VIM были впервые обнаружены в Европе в конце 1990-х гг.11 и впоследствии были зарегистрированы по всему миру. Известно более 20 различных аллотипов VIM, принадлежащих трем сублиниям. Как и в случае с ферментами типа IMP, варианты VIM имеют определенное географическое распространение. Однако типы VIM-1 и VIM-2 имеют более широкое распространение, чем ферменты типа IMP, демонстрируя тем самым свою поразительную тенденцию к распространению. Ферменты типа VIM впервые были обнаружены у P aeruginosa и других грамотрицательных неферментирующих видов, но впоследствии появились у представителей семейства Enterobacteriaceae и в некоторых случаях стали представлять серьезную проблему. Металло-бета-лактамазы типа VIM показывают еще более широкую субстратную специфичность, чем типы IMP, поскольку могут гидролизовать 6-альфа-метокси пенициллины. Кроме того, ферменты типа VIM являются уникальными металло-бета-лактамазами, имея выскую афинность с карбапенемами69. Аллотипы VIM также демонстрируют функциональную гетерогенность, хотя она и не имеет клинической значимости, которая предполагает, что активность фермента может быть изменена посредством точечных или многоточечных мутаций.
Фермент SPM-1 является третьим типом приобретенной металло-бета-лактамазы, выделенный в начале XXI века у изолятов P aeruginosa из Бразилии59. К настоящему времени этот фермент распространен в основном в Бразилии и у P aeruginosa. Данная низкая предрасположенность к распространению может быть обусловлена различными связанными типами мобильных генетических элементов. SPM-1 имеет очень широкую субстратную специфичность, включающую карбапенемы, цефалоспорины и пенициллины70.
Фермент NDM-1 является одиним из новых типов металло-бета-лактамаз и его предрасположенность к межконтинентальному распространению представляет серьезную проблему1. NDM-1 впервые был обнаружен в штамме Klebsiella pneumoniae, выделенном в 2008 г. у пациента, вернувшегося в Швецию из Индии, где NDM-1 широко распространен у представителей семейства Enterobacteriaceae71. Впоследствии сообщалось об инфекциях, вызываемых продуцентами NDM-1 A baumannii. Другие приобретенные металло-бета-лактамазы (SIM-1, GIM-1, AIM-1 и DIM-1) имеют более низкую скорость распространения и меньшее клиническое воздействие в отличие от NDM-1.
Происхождение генов приобретенных металло-бета-лактамаз неизвестно. Наиболее вероятными источниками являются бактерии окружающей среды, от которых грамотрицательные неферментирующие бактерии и семейство Enterobacteriaceae могли приобрести детерминанты устойчивости, разделяя при этом несколько общих экологических ниш. В клинических условиях штаммы с приобретенными генами металло-бета-лактамазы могут отбираться путем воздействия на них противомикробных препаратов и становиться вторичным резервуаром в условиях медицинских учреждениий. Распространение генов приобретенных металло-бета-лактамаз среди грамотрицательных патогенов активируется мобильными элементами ДНК, что объясняет, почему один и тот же ген может быть связан с плазмидами или встроен в хромосому у разных штаммов. Большинство приобретенных генов переносятся в мобильных генетических кассетах в составе интегронов2, 62, 68, и, как следствие, они могут использовать систему рекомбинации интегронов и мобильность элементов ДНК, с которыми связаны интегроны (транспозоны и плазмиды). Тем не менее, ген blaSPM-1 связан с ISCR4, являющейся представителем семейства ISCR и может мобилизовать фланкирующие сегменты ДНК72. Ген blaNDM-1 связан с различными типами инсерционных последовательностей73.
Различная природа мобильных генетических элементов, которые связаны с генами приобретенных металло-бета-лактамаз, частично может объяснять отличие в их склонности к распространению.
Большинство интегронов, которые содержат генетические кассеты для металло-бета-лактамаз, также имеют дополнительные генетические кассеты, несущие детерминанты устойчивости к другим классам антибиотиков (например, к аминогликозидам и хлорамфениколу) или дезинфектантам, или даже гены других бета-лактамаз. Таким образом, передача интегрона может привести одномоментной передаче сложного фенотипа множественной лекарственной устойчивости.
Эпидемиология приобретенных металло-бета-лактамаз
Возрастающий интерес к металло-бета-лактамазам не сопровождается надежными эпидемиологическими данными. Поскольку молекулярная идентификация металло-бета-лактамаз в рамках крупномасштабных исследований выполнялась нечасто, а данные по численности группы риска при расчете показателя инфекционной заболеваемости часто отсутствуют, эпидемиологическая информация не является достоверной. Если данные имеются, то, как правило, показывают, что особенности эпидемиологии зависят от страны. Некоторые факторы, включая региональное применение антибиотиков и практики лечебных учреждений, могут отчасти объяснять данные различия.
Азия
IMP-1 у P aeruginosa и Serratia marcescens из Японии был первой выявленной приобретенной металло-бета-лактамазой7, 8.
Далее последовали многоцелевые отчеты о IMP-1 у других представителей семейства Enterobacteriaeae, P aeruginosa и других неферментирующих бактерий9, 10, 25. IMP-2 был обнаружен у Acinetobacter spp74, а IMP-7 - у P aeruginosa75. Новыми выявленными вариантами фермента IMP были IMP-312, IMP-616, IMP-10 (номер доступа в GenBank AB074436)22 и IMP-11 (номер доступа в GenBank AB074437)9. Ферменты типа VIM были выявлены позже и имели явно более низкую распространенность, чем ферменты типа IMP. Новая металло-бета-лактамаза KHM-1 была обнаружена в клиническом изоляте Citrobacter freundii65.
VIM-2 была первой металло-бета-лактамазой, обнаруженной в Корее, и быстро распространилась среди Pseudomonas spp2, энтеробактерий2 и Acinetobacter spp.36. Ранее неизвестный ген blaSIM-1 был обнаружен у A baumannii62, и также было выявлено его сосуществование с blaIMP-1 и blaVIM-2, а также у геномовида 10 Acinetobacte76. Виды Acinetobacter и P aeruginosa, продуцирующие ферменты типа IMP (IMP-1 у обеих, а также IMP-6 у последней) впоследствии были зарегистрированы по всей стране77, 78.
Первой зарегистрированной металло-бета-лактамазой в Китае была IMP-4, обнаруженная у Citrobacter youngae14 и у четырех неродственных изолятов Acinetobacter spp, а позже у Klebsiella13, 79. IMP-1 была зарегистрирована у P aeruginosa80 и Enterobacter cloacae81, в то время как IMP-8 и IMP-9 были зарегистрированы у Acinetobacter spp19 и P aeruginosa соответственно21. VIM-2 является единственной металло-бета-лактамазой типа VIM, зарегистрированной у штаммов P aeruginosa в разных лечебных учреждениях Китая82.
IMP-1, VIM-2 и ее вариант VIM-3 - все были обнаружены у Pseudomonas spp при первом исследовании металло-бета-лактамаз в Тайвани39. VIM-2 и VIM-3 были также зарегистрированы у других неферментирующих бактерий, как VIM-3 у E cloacae30. VIM-11 были обнаружены у представителей семейства Enterobacteriaceae и у неферментирующих бактерий51. IMP-1 была многократно зарегистрирована у клинически важной Acinetobacter spp83. Вариант IMP-2 IMP-8 был обнаружен у нескольких изолятов Enterobacteriaceae18,37 и у A baumannii30. IMP-24 была описана у S marcescens30.
В настоящее время многочисленные сообщения о типе NDM-1 у представителей семейства Enterobacteriaceae поступают из нескольких центров Индии, Пакистана и Бангладеша. Наличие фермента также выявлено у A baumannii1, 67, 71. Ряд типов VIM (VIM-2, VIM-5, VIM-6, VIM-11 и новый VIM-18) широко распространен у Pseudomonas spp57. IMP представляется наиболее распространенной металло-бета-лактамазой у представителей семейства Enterobacteriaceae и у A baumannii84. В рамках недавнего исследования были обнаружены изоляты K pneumoniae и Enterobacter aerogenes, несущие ген blaSIM-1, ассоциированный с blaIMP или blaVIM-1.
В Малайзии, IMP-72 и IMP-485 были выявлены у P aeruginosa и A baumannii соответственно. Впоследствии было обнаружено, что собранные случайным образом клинические изоляты содержат VIM-2 и VIM-11.86
Выделенные в Сингапуре IMP-1 и VIM-6 были обнаружены у Pseudomonas fluorescens и Pseudomonas putida соответственно 46 . Разные типы металло-бета-лактамаз были обнаружены у P aeruginosa, а именно IMP-1, IMP-7, VIM-2, VIM-6, и IMP-26. 2,31 IMP-4 была обнаружена у A baumannii.87
На Ближнем Востоке гены blaVIM были обнаружены у P aeruginosa, выделенные в Саудовской Аравии88 и Иране89. IMP-1 была обнаружена в Бейруте, Ливии90, о наличии NDM-1 позже сообщалось из Омана. 91
Европа
Италия была первой европейской страной, сообщившей о приоретенных металло-бета-лактамазах, а именно: IMP-2 и VIM-1.13,32 IMP-12,23 IMP-1324 и VIM-1454 впервые появились в Италии. Впоследствии сообщалось как о небольших, так и о крупных вспышках инфекций в разных регионах страны, при этом VIM-1, VIM-2 и IMP-13 были самыми распространенными ферментами3. Также сообщалось о случаях NDM-1-продуцирующей Escherichia coli.92
Ферменты типа VIM распространены в Греции, где VIM-1, VIM-2 и VIM-4 быстро распространились у Enterobacteriaceae4, P aeruginosa2,40 и других неферментирующих бактерий34, 38, 43. Также сообщалось о VIM-1993 VIM-1252и VIM-1756.
VIM-5 была впервые зарегистрирована в Турции у P aeruginosa45 и у представителей семейства Enterobacteriaceae44. Также в Турции впервые были выявлены VIM-1 у K pneumoniae94 и VIM-2 у P aeruginosa95. IMP-1 была выявлена у E cloacae и у P aeruginosa.96
Первой металло-бета-лактамазой во Франции была VIM-2 у P aeruginosa, которая была выделена в Марселе35. Первой зарегисрированной IMP была ранее неизвестная IMP-19, которая также была первой IMP у Aeromonas caviae28. VIM-1 также была первой металло-бета-лактамазой, выявленной у K pneumoniae33, а IMP-1 была распространена у изолятов E aerogenes97. Общенациональное исследование изолятов P aeruginosa выявило только три VIM-2 и одну IMP-18, демонстрируя тем самым все еще низкую распросраненность металло-бета-лактамаз98. NDM-1 и VIM-4 были идентифицированы у изолята C freundii у пациента, вернувшегося из Индии.99
Первая приобретенная металло-бета-лактамаза, зарегистрированная в Великобритании, по всей вероятности производная blaIMP, была описана у завезенного изолята A baumannii2. P aeruginosa, собранная во время программы наблюдения Британского общества противомикробной химиотерапии, являлась носителем VIM-2.4 Два новых фермента VIM-9 и VIM-10 обнаружены у изолятов, которые были направлены в национальную референтную лабораторию49. 37 изолятов E coli и K pneumonia, которые были переданы в ту же лабораторию, показали положительный результат по наличию NDM-1, многие пациенты недавно приехали из Индии или Пакистана, или иным образом имели отношение к этим странам71. Также сообщалось об инфекциях с продуцирующим NDM-1 A baumannii67. Хотя ферменты типа VIM быстро распространились в Испании100, общая распространенность продуцентов металло-бета-лактамаз в лечебных учреждениях Испании до сих пор является низкой. Два первичных производных фермента VIM (VIM-1353 и VIM-20 [номер доступа ACV13198]) были описаны у P aeruginosa, а также сообщалось о первом случае NDM-1-продуцирующей K pneumoniae.92
IMP-5, обнаруженная у A baumannii, была первой зарегистрированной металло-бета-лактамазой в Португалии15. Еще одно сообщение о гене blaIMP поступило по факту выявления IMP-8 у Pseudomonas mendocina20. VIM-2 была идентифицирована у нескольких изолятов P aeruginosa в 1995.2
Устойчивая ко многим лекарственным препаратам P aeruginosa, продуцирующая VIM-2, была обнаружена в Бельгии101, где впервые был описан вызванный продукцией NDM-1 летальный исход у пациента, ранее госпитализированного в Пакистане92. Второй случай продуцирующей NDM-1 Enterobacteriaceae был выявлен у пациента, ранее госпитализированного в Черногории102. В Нидерландах в 2009 году был обнаружен принципиально новый фермент DIM-1 в штамме Pseudomonas stutzeri68. Два пациента, путешествовавших по Индии, были колонизированы различными изолятами K pneumoniae, содержащими NDM-1.103
Продуценты металло-бета-лактамаз P aeruginosa все чаще обнаруживаются в Норвегии и Швеции и часто завозятся из других стран. В основном это ферменты группы VIM (а именно VIM-2 и VIM-4), но также сообщалось о IMP-14.104, 105 NDM-1 изначально была идентифицирована у пациента, репатриированного в Швецию после поступления в больницу в Нью Дели66, и с тех пор была обнаружена в Норвегии (снова у пациентов, госпитализированных в Индии)106 и в Дании у пациента, который перевелся из больницы в Боснии и Герцеговине107.
В Германии VIM-1 была обнаружена у P aeruginosa108 и у представителей семейства Enterobacteriaceae109. VIM-2 была многократно обнаружена у P aeruginosa108 и в выделенном из мочи изоляте P aeruginosa в Мюнхене, продуцирующем ранее неизвестный вариант VIM-2 ‒ VIM-16.55 GIM-1 была обнаружена в пяти изолятах P aeruginosa от разных пациентов в Дюссельдорфе60, также сообщалось о его высокой распространенности у Pseudomonas spp и Enterobacteriaceae. Недавно сообщалось об инфекции с NDM-1-продуцирующими Enterobacteriaceae и A baumannii92, 110. Различные типы металло-бета-лактамаз (IMP-13, IMP-22 и VIM-2), продуцируемые P aeruginosa, а также продуцирующие NDM-1 энтеробактерии были выявлены в Австрии.29, 92
VIM-2 у P aeruginosa был первым обнаруженным в Польше2 типом металло-бета-лактамаз и с тех пор был зарегистрирован во многих центрах3. VIM-4 стала эндемичной у изолятов P aeruginosa, инфицирующей детей в хирургических отделениях в Польше2. IMP-7 была обнаружена в двух изолятах P aeruginosa111. Также сообщалось о распространении A baumannii с ферментом типа VIM и K pneumoniae, продуцирующей неустановленную металло-бета-лактамазу112, 113. Первым зарегистрированным в Венгрии типом металло-бета-лактамаз был VIM-4,114 который впоследствии был идентифицирован у штамма A hydrophila42 и у Klebsiella spp115. Также были описаны P aeruginosa, продуцирующие либо VIM-1,116 либо VIM-24.
P aeruginosa, продуцирующая IMP-7, была обнаружена в Словакии117 и Чешской Республике.118
На Балканах VIM-2 была обнаружена у изолятов P aeruginosa из Сербии119 и Хорватии120, а VIM-2 ‒ VIM-15 был выделен у P aeruginosa в Болгарии55. Сообщения о NDM-1 у пациентов, которые были госпитализированы или в Черногории102, или в Боснии и Герцеговине106, или посещавших эти регионы92, дают основание предполагать, что как и в случае с индийским субконтинентом, Балканы могут быть вторым регионом, эндемичным для штаммов, несущих данный фермент.
Ген blaVIM-2 был идентифицирован у изолята P aeruginosa из России121. 11 штаммов P aeruginosa, имеющие генетические детерминанты группы VIM, были изолированы в хирургическом отделении в Москве.122
Остальные страны
В Бразилии SPM-1 является основной металло-бета-лактамазой, но IMP-1 (у Enterobacteriaceae123 и грамотрицательных неферментирующих бактерий72), IMP-16 и VIM-2 (оба у P aeruginosa) также имеются26. SPM-1 была впервые обнаружена в штамме P aeruginosa, выделенном в Сан Паулу59, и впоследствии распространилась по стране с существенными различиями между географическими областями. Единственный случай выявления SPM-1 за пределами Бразилии был зарегистрирован у изолята P aeruginosa у пациента из Швейцарии, получавшего первичную медицинскую помощь в Ресифи, Бразилия.124
Сообщений о случаях из других стран Южной Америки на удивление немного ввиду высоких показателей устойчивости к карбапенемам на этом континенте. IMP-1 (у Acinetobacter spp), IMP-13 и VIM-11 (оба у P aeruginosa) были обнаружены в Аргентине50, 125, 126. VIM-2 была выявлена в Чили (P fluorescens) и Венесуэле (P aeruginosa)125. В результате вспышки устойчивой к карбапенемам P aeruginosa в Кали, Колумбия48 было получено первое сообщение о VIM-8, VIM-2 также была обнаружена у P aeruginosa в некоторых городах этой страны.127
Металло-бета-лактамазы редко встречаются в США. Первым зарегистрированным случаем была VIM-7, филогенетически отличный вариант, которая была обнаружена в Техасе у изолята P aeruginosa47. Первая вспышка нозокомиальной инфекции с VIM-2,128 и первое появление металло-бета-лактамаз типа IMP в США - IMP-1827, также были зарегистрированы у P aeruginosa. В начале 2010 годов NDM-1129 и VIM130 были выявлены у представителей семейства Enterobacteriaceae.
В Канаде первой зарегистрированной металло-бета-лактамазой была IMP-7, новый фермент, обнаруженный у P aeruginosa17. Тем не менее, из всех нечувствительных к IPM P aeruginosa, которые были выделены в Калгарийском округе здравоохранения с 2002 по 2004 годы, 43% продуцировали VIM-2 и только 2% продуцировали IMP-7.131,132 Продуцирующая NDM-1 E coli была выделена у пациента, недавно посетившего Индию.133
IMP-1525 и IMP-18 были обнаружены у клинических изолятов из различных учреждений Мексики134. Также сообщалось о сосуществовании в той же больнице штаммов P aeruginosa, продуцирующих либо IMP-15, либо VIM-2.135 VIM-2 также была обнаружена у 2 штаммов E cloacae и у одного Klebsiella oxytoca.136
Первой и наиболее распространенной металло-бета-лактамазой в Австралии была IMP-4, обнаруженная у P aeruginosa2 и представителей семейства Enterobacteriaceae2, 3. Также была обнаружена VIM-4.137 AIM-1 была обнаружена у P aeruginosa64, 138, зарегистрирована продуцирующая NDM-1 E coli.139
VIM-2 (P aeruginosa)140 и VIM-4 (K pneumoniae)141 были обнаружены в Тунисе. Металло-бета-лактамазы были выявлены у A baumannii, но тип фермента не сообщался.142
Пять разных штаммов Enterobacteriaceae, выделенных в Алжире, содержали новую металло-бета-лактамазу, обозначенную как VIM-19 и отличающуюся от VIM-4 только одной заменой. Данное открытие подтверждает появление VIM-4-подобных ферментов у Enterobacteriaceae из стран Средиземноморского региона.58
Продуцирующая VIM-2 P aeruginosa была выделена у туриста из Венгрии, первично госпитализированного в Египте143. Аналогичным образом фермент VIM-2 , выделенный у P aeruginosa, был ассоциирован с пациентом, переведенным в больницу в Норвегии после продолжительной госпитализации в Гане105.
Три клонально-родственные группы P aeruginosa, продуцирующие VIM-2, стали причиной вспышек нозокомиальных инфекций в Кении144, первые африканские NDM-1-положительные изоляты были зарегистрированы там же.145
Применение в клинической практике
Штаммы-продуценты металло-бета-лактамаз, как правило, имеют сложные профили множественной лекарственной устойчивости, в том числе к большинству бета-лактамов. Хотя азтреонам не гидролизуется металло-бета-лактамазами, на возможность его использования в отношении продуцентов металло-бета-лактамаз зачастую влияют дополнительные механизмы устойчивости. Доклиническое исследование на модели пневмонии у крыс показало, что азтреонам может быть эффективным в отношении продуцирующей VIM-2 P aeruginosa с низкой минимальной подавляющей концентрацией (МПК) (0·25 мкг/мл)2. Тем не менее, достоверность модели сомнительна, поскольку аналогичный эффект также наблюдался с другими бета-лактамами, несмотря на высокие МПК. В то же время, азтреонам не смог значительно улучшить выживаемость у мышей с нейротропенией, которые были инфицированы P aeruginosa, продуцирующей IMP.146
МПК карбапенемов могут оставаться ниже пограничных концентраций для данных препаратов (особенно для представителей семейства Enterobacteriaceae), хотя для изолятов дикого типа того же вида они выше147. Несмотря на то, что Институт клинических и лабораторных стандартов и Европейский комитет по определению чувствительности к противомикробным препаратам подтвердили, что информация по МПК карбапенемов является достаточной для клинического применения, по-прежнему вызывает озабоченность возможность применения карбапенемов для лечения инфекций, вызванных продуцентами металло-бета-лактамаз с МПК в пределах диапазона чувствительности. Данный вопрос очень важен, учитывая всего несколько возможных методов лечения, когда речь идет о продуцентах металло-бета-лактамаз. Данные доклинических исследований, полученные на основании модели инфекции бедра у мышей с VIM-1-продуцирующими штаммами K pneumoniae с разными МПК карбапенемов показали, что имипенем был эффективным в отношении продуцирующих металло-бета-лактамазу штаммов с низкими МПК147. Тем не менее, данные рандомизированных исследований отсутствуют. Имеются единичные сообщения, описывающие как неэффективность терапии, так и положительную динамику после лечения карбапенемами пациентов, зараженных VIM-положительными штаммами, но чувствительными к карбапенемам in vitro.147,148
Данные из Греции показали, что монотерапия карбапенемами не была эффективнее некорректной терапии для показателей 14-дневной летальности, тогда как карбапенемы с другим активным веществом in vitro (колистином или аминогликозидом) были ассоциированы с определенно более низкой летальностью, чем в случае с одними карбапенемами147. Из этого следует, что насколько эффективной будет монотерапия карбапенемами для лечения инфекций, вызванных такими организмами, неизвестно, и каким образом рассматривать такие изоляты в отчете по определению чувствительности также неясно.
Ввиду отсутствия альтернативных вариантов монотерапии, эффективность комбинаций бета-лактамов и других препаратов изучались in vitro у изолятов-продуцентов металло-бета-лактамаз. Имипенем с колистином изучались по времени гибели в отношении группы генетически отличимых изолятов K pneumoniae, продуцирующих VIM-1. Хотя данная комбинация оказалась синергичной в отношении 50% чувствительных к колистину штаммов, она часто проявляла антагонизм в отношении устойчивых к колистину штаммов (МПК>4 мкг/мл)149. Кроме того, исследования времени гибели штаммов P aeruginosa, содержащих металло-бета-лактамазу, как с применением одного азтреонама, так и в тройной комбинации с цефтазидимом и амикацином, продемонстрировали усиленный бактерицидный эффект при использовании комбинации противомикробных препаратов по сравнению с одним азтреонамом.150
Механизмы устойчивости к аминогликозидам и хинолонам распространены у штаммов-продуцентов металло-бета-лактамазы3, что обычно оставляет очень мало вариантов для лечения. Два из них, а именно колистин и тигециклин, не проявляют никакой активности по отношению к Proteeae, а тигециклин также неактивен в отношении P aeruginosa. По этой причине появление металло-бета-лактамаз у Proteus mirabilis и других представителей этой группы вызывает серьезную озабоченность.
Колистин, который обычно считается неудачным выбором в связи с его неблагоприятной фармакокинетикой и токсическими эффектами, зачастую является единственным доступным антибиотиком в отношении организмов, продуцирующих металло-бета-лактамазу, особенно когда речь идет о штаммах Pseudomonas spp. Единственное исследование, когда колистин применялся против доказанно продуцирующей металло-бета-лактамазу P aeruginosa, отмечало положительную реакцию у 15 (67%) из 22 пациентов с преимущественно госпитальной и ИВЛ-ассоциированной пневмонией.151
Для семейства Enterobacteriaceae 12 случаев бактериемии или ИВЛ-ассоциированной пневмонии, вызванных (в основном неклональными) blaVIM-1-продуцирующими изолятами, были успешно вылечены одним колистином или в комбинации либо с карбапенемом, либо с активным аминогликозидом in vitro. Связанная с этим летальность составила 8%.152 В обоих исследованиях одновременный прием по меньшей мере одного из активных антибиотиков не позволяет качественно оценить фактическую эффективность колистина. Тем не менее, ретроспективный анализ показал, что для колистина с меропенемом результат лечения не был синергическим или даже аддитивным153. Исследователи сообщали об успешном лечении колистином гайморита, орбитального целлюлита и пневмонии, вызванных продуцентом металло-бета-лактамазы P aeruginosa, у пациента с нейтропенией147, а также продуцирующей металло-бета-лактамазу blaVIM-1 E cloacae-диссеминированной инфекции у пациента, перенесшего пересадку печени154. Широко распространенное эмпирическое применение колистина привело к появлению металло-бета-лактамаз-положительных штаммов устойчивой к колистину K pneumoniae с последующими летальными исходами, и, вероятно, способствовало появлению видов бактерий, устойчивых к колистину, таких как Proteus spp and Providencia spp.155
Небольшой опыт был получен в результате применения тигециклина для лечения инфекций, вызванных продуцирующими металло-бета-лактамазу Enterobacteriaceae. Из шести пациентов с нозокомиальной пневмонией или инфекциями кровотока 2 пациента, получавших тигециклин плюс полимиксин В или полмиксин Е (колистин), выжили, у остальных четырех результаты были неблагоприятными или неопределенными.147 В ретроспективном обсервационном исследовании девять из 13 пациентов (69%), инфецированных продуцирующими металло-бета-лактамазу Enterobacteriaceae, имели положительный результат лечения тигециклином147. В греческой серии случаев152, включающей 14 случаев бактериемии и три случая ИВЛ-ассоциированной пневмонии, которые были вызваны энтеробактерией-продуцентом blaVIM-1,152 тигециклин был активен в отношении всех изолятов. Тигециклин также успешно применялся для лечения пациента с продолжительной бактериемией, вызванной продуцентами VIM-1 и SHV-12 K pneumonia156. Тем не менее, низкие концентрации тигециклина в сыворотке крови указывают на необходимость проявления осторожности и выполнения тщательной оценки значений МПК перед применением данного препарата для лечения инфекций кровотока.157
Результаты метаанализа дают основание предполагать, что практически забытый антибиотик фосфомицин может применяться в качестве возможного метода лечения инфекций, вызванных P aeruginosa и Enterobacteriaceae c множественной лекарственной устойчивостью, включая продуцентов металло-бета-лактамаз158. Имеется только один известный клинический случай успешного лечения простатита, вызванного продуцирующей VIM-2 P aeruginosa, с использованием фосфомицина плюс азтреонама147. В случае с Enterobacteriaceae одно проспективное исследование описывает 11 взрослых пациентов в интенсивной терапии, которые были заражены устойчивой к карбапенемам K pneumoniae и получавших фосфомицин внутривенно (2–4 г каждые 6 часов) вместе с другими антибиотиками. Все пациенты имели хорошие бактериологические и клинические исходы заболевания без связанных с применением фосфомицина побочных эффектов147. Отсутствие клинического опыта, а также профиль безопасности фосфомицина требуют обязательного проведения дополнительных исследований. Также необходимо проработать выбор подходящих вспомогательных антибиотиков ввиду быстрого появления устойчивости при монотерапии фосфомицином.
Данные по хинолонам также отсутствуют. Согласно отчету из Австралии, большинство представителей семейства Enterobacteriaceae, продуцирующих IMP-4, были чувствительны к хинолонам. Четыре пациента, инфицированные неклональными штаммами трех разных видов (K pneumoniae, S marcescens и E cloacae), получили эффективное лечение препаратом данного класса147. Эндокардит искуственного клапана сердца, вызванный продуцирующей металло-бета-лактамазу P aeruginosa, также был успешно вылечен препаратами ципрофлоксацина и гентамицина147. Исследования потенциальных факторов риска колонизации или инфицирования продуцирующими металло-бета-лактамазы неферминтирующими бактериями определили продолжительное пребывание в больнице147 и применение в прошлом хинолонов159 либо бета-лактамов147 в качестве независимых прогностических факторов.
Смертность при тяжелых формах инфекциий, вызванных P aeruginosa, варьировалась от 70% до 95%; раннее и надлежащее лечение противомикробными препаратами является единственным изменяемым фактором, способным уменьшить эти цифры147, 160. Показатели смертности в результате инфекций, вызванных представителями семейства Enterobacteriaceae, продуцирующих металло-бета-лактамазы, составляли от 19% до 67% 147, 152. Смертность от инфекций кровотока, вызванных продуцирующей VIM-1 K pneumoniae с МПК 4 мкг/мл была ниже, чем у изолятов с концентрациями, превышающими 4 мкг/мл (13% против 54%), и статистически существенно не отличалась от контрольной группы пациентов, инфицированных не имеющими металло-бета-лактамаз штаммами.152
Выводы
Распространенность изолятов, продуцирующих металло-бета-лактамазу, и их выделение из угрожающих жизни инфекций, растет во всем мире с пугающей скоростью. Столь быстрое распространение обеспечивает научное сообщество большим количеством информации по молекулярной эпидемиологии металлобеталактамазы и ее генетическом окружении. Тем не менее, точной информации о том, как решать эту проблему в клинических условиях до сих пор нет. Клинических данных недостаточно, а поскольку получают их из регионов, где распространены ферменты типа VIM, они не охватывают постоянно растущее внутреннее разнообразие металло-бета-лактамаз. Более того, данные не показывают распространение металло-бета-лактамаз у различных видов семейства Enterobacteriaceae. После клинических исследований с учетом различий между патогенами, ферментами и клиническими синдромами, сдерживание распространения продуцирующих металло-бета-лактамазы организмов в целом зависит от выполнения жестких мероприятий по инфекционному контролю, гарантируя таким образом быстрое и точное их выявление в лаборатории клинической микробиологии.
Тот факт, что металло-бета-лактамазы стали представлять серьезную угрозу для здоровья должен побудить органы здравоохранения разработать план готовности для немедленного выполнения как на национальном, так и на наднациональном уровнях. Данный план должен обеспечивать раннее выявление первых случаев заболевания, а также применение классической стратегии по поиску и обезвреживанию в условиях, когда встречаются единичные случаи или полное отсутствие продуцентов металло-бета-лактамаз. Более того, максимальное сдерживание в регионах или странах с распространенностью металло-бета-лактамаз дожно стать приоритетным147. Распространение металло-бета-лактамаз представляет серьезную проблему как в плане лечения отдельных пациентов, так и в отношении политики в области инфекционного контроля, подчеркивая тем самым фактическое отсутствие готовности со стороны органов здравоохранения к решению данной проблемы.
Литература
- Rolain JM, Parola P, Cornaglia G. New Delhi metallo-beta-lactamase (NDM-1): towards a new pandemia? Clin Microbiol Infect 2010; 16: 1699–701.
- Walsh TR, Toleman MA, Poirel L, Nordmann P. Metallo-β-lactamases: the quiet before the storm? Clin Microbiol Rev 2005; 18: 306–25.
- Cornaglia G, Akova M, Amicosante G, et al, for the ESCMID Study Group for Antimicrobial Resistance Surveillance (ESGARS). Metallo- β-lactamases as emerging resistance determinants in Gram-negative pathogens: open issues. Int J Antimicrob Agents 2007; 2ft: 380–88.
- Miriagou V, Cornaglia G, Edelstein M, et al. Acquired carbapenemases in Gram-negative bacterial pathogens: detection and surveillance issues. Clin Microbiol Infect 2010; 16: 112–22.
- Bush K, Jacoby GA. Updated functional classification of β-lactamases. Antimicrob Agents Chemother 2010; 54: 969–76.
- Thaller MC, Borgianni L, Di Lallo G, et al. Metallo-β-lactamase production by Pseudomonas otitidis: a species-related trait. Antimicrob Agents Chemother 2011; 55: 118–23.
- Watanabe M, Iyobe S, Inoue M, Mitsuhashi S. Transferable imipenem resistance in Pseudomonas aeruginosa. Antimicrob Agents Chemother 1991; 35: 147–51.
- Osano E, Arakawa Y, Wacharotayankun R, et al. Molecular characterization of an enterobacterial metallo β-lactamase found in a clinical isolate of Serratia marcescens that shows imipenem resistance. Antimicrob Agents Chemother 1994; 38: 71–78.
- Jones RN, Deshpande LM, Bell JM, et al. Evaluation of the contemporary occurrence rates of metallo-β-lactamases in multidrug-resistant Gram-negative bacilli in Japan: report from the SENTRY Antimicrobial Surveillance Program (1998–2002). Diagn Microbiol Infect Dis 2004; 4ft: 289–94.
- Shibata N, Doi Y, Yamane K, et al. PCR typing of genetic determinants for metallo-β-lactamases and integrases carried by Gram-negative bacteria isolated in Japan, with focus on the class 3 integron. J Clin Microbiol 2003; 41: 5407–13.
- Lauretti L, Riccio ML, Mazzariol A, et al. Cloning and characterization of blaVIM, a new integron-borne metallo-β-lactamase gene from a Pseudomonas aeruginosa clinical isolate. Antimicrob Agents Chemother 1999; 43: 1584–90.
- Iyobe S, Kusadokoro H, Ozaki J, et al. Amino acid substitutions in a variant of IMP-1 metallo-β-lactamase. Antimicrob Agents Chemother 2000; 44: 2023–27.
- Chu YW, Aal-Shah M, Houang ET, et al. IMP-4, a novel metallo-β-lactamase from nosocomial Acinetobacter spp collected in Hong Kong between 1994 and 1998. Antimicrob Agents Chemother 2001; 45: 710–14.
- Hawkey PM, Xiong J, Ye H, Li H, M’Zali FH. Occurrence of a new metallo-β-lactamase IMP-4 carried on a conjugative plasmid in Citrobacter youngae from the People’s Republic of China. FEMS Microbiol Lett 2001; 1ft4: 53–57.
- Da Silva GJ, Correia M, Vital C, et al. Molecular characterization of blaIMP-5, a new integron-borne metallo-β-lactamase gene from an Acinetobacter baumannii nosocomial isolate in Portugal. FEMS Microbiol Lett 2002; 215: 33–39.
- Yano H, Kuga A, Okamoto R, Kitasato H, Kobayashi T, Inoue M. Plasmid-encoded metallo-β-lactamase (IMP-6) conferring resistance to carbapenems, especially meropenem. Antimicrob Agents Chemother 2001; 45: 1343–48.
- Gibb AP, Tribuddharat C, Moore RA, et al. Nosocomial outbreak of carbapenem-resistant Pseudomonas aeruginosa with a new blaIMP allele, blaIMP-7. Antimicrob Agents Chemother 2002; 46: 255–58.
- Yan JJ, Ko WC, Wu JJ. Identification of a plasmid encoding SHV-12, TEM-1, and a variant of IMP-2 metallo-β-lactamase, IMP-8, from a clinical isolate of Klebsiella pneumoniae. Antimicrob Agents Chemother 2001; 45: 2368–71.
- Wang H, Guo P, Sun H, et al. Molecular epidemiology of clinical isolates of carbapenem-resistant Acinetobacter spp from Chinese hospitals. Antimicrob Agents Chemother 2007; 51: 4022–28.
- Santos C, Caetano T, Ferreira S, Mendo S. First description of blaIMP-8 in a Pseudomonas mendocina isolated at the Hospital Infante D. Pedro, Aveiro, Portugal. Res Microbiol 2010; 161: 305–07.
- Xiong J, Hynes MF, Ye H, et al. blaIMP-9 and its association with large plasmids carried by Pseudomonas aeruginosa isolates from the People’s Republic of China. Antimicrob Agents Chemother 2006; 50: 355–58.
- Iyobe S, Kusadokoro H, Takahashi A, et al. Detection of a variant metallo-β-lactamase, IMP-10, from two unrelated strains of Pseudomonas aeruginosa and an Alcaligenes xylosoxidans strain. Antimicrob Agents Chemother 2002; 46: 2014–16.
- Docquier JD, Riccio ML, Mugnaioli C, et al. IMP-12, a new plasmid-encoded metallo-β-lactamase from a Pseudomonas putida clinical isolate. Antimicrob Agents Chemother 2003; 47: 1522–28.
- Pagani L, Colinon C, Migliavacca R, et al. Nosocomial outbreak caused by multidrug-resistant Pseudomonas aeruginosa producing IMP-13 metallo-β-lactamase. J Clin Microbiol 2005; 43: 3824–28.
- Garza-Ramos U, Morfin-Otero R, Sader HS, et al. Metallo-β-lactamase gene blaIMP-15 in a class 1 integron, In95, from Pseudomonas aeruginosa clinical isolates from a hospital in Mexico. Antimicrob Agents Chemother 2008; 52: 2943–46.
- Mendes RE, Toleman MA, Ribeiro J, Sader HS, Jones RN, Walsh TR. Integron carrying a novel metallo-β-lactamase gene, blaIMP-16, and a fused form of aminoglycoside-resistant gene aac(6’)-30/aac(6’)-Ib’: report from the SENTRY Antimicrobial Surveillance Program. Antimicrob Agents Chemother 2004; 48: 4693–702.
- Hanson ND, Hossain A, Buck L, Moland ES, Thomson KS. First occurrence of a Pseudomonas aeruginosa isolate in the United States producing an IMP metallo-β-lactamase, IMP-18. Antimicrob Agents Chemother 2006; 50: 2272–73.
- Neuwirth C, Siebor E, Robin F, Bonnet R. First occurrence of an IMP metallo-β-lactamase in Aeromonas caviae: IMP-19 in an isolate from France. Antimicrob Agents Chemother 2007; 51: 4486–88.
- Duljasz W, Gniadkowski M, Sitter S, Wojna A, Jebelean C. First organisms with acquired metallo-β-lactamases (IMP-13, IMP-22, and VIM-2) reported in Austria. Antimicrob Agents Chemother 2009; 53: 2221–22.
- Lee MF, Peng CF, Hsu HJ, Chen YH. Molecular characterisation of the metallo-β-lactamase genes in imipenem-resistant Gram-negative bacteria from a university hospital in southern Taiwan. Int J Antimicrob Agents 2008; 32: 475–80.
- Koh TH, Khoo CT, Tan TT, et al. Multilocus sequence types of carbapenem-resistant Pseudomonas aeruginosa in Singapore carrying metallo-β-lactamase genes, including the novel blaIMP-26 gene. J Clin Microbiol 2010; 48: 2563–64.
- Cornaglia G, Riccio ML, Mazzariol A, Lauretti L, Fontana R, Rossolini GM. Appearance of IMP-1 metallo-β-lactamase in Europe. Lancet 1999; 353: 899–900.
- Lartigue MF, Poirel L, Nordmann P. First detection of a carbapenem-hydrolyzing metalloenzyme in an Enterobacteriaceae isolate in France. Antimicrob Agents Chemother 2004; 48: 4929–30.
- Tsakris A, Ikonomidis A, Pournaras S, et al. VIM-1 metallo-β- lactamase in Acinetobacter baumannii. Emerg Infect Dis 2006; 12: 981–83.
- Poirel L, Naas T, Nicolas D, et al. Characterization of VIM-2, a carbapenem-hydrolyzing metallo-β-lactamase and its plasmid- and integron-borne gene from a Pseudomonas aeruginosa clinical isolate in France. Antimicrob Agents Chemother 2000; 44: 891–97.
- Yum JH, Yi K, Lee H, et al. Molecular characterization of metallo-β-lactamase-producing Acinetobacter baumannii and Acinetobacter genomospecies 3 from Korea: identification of two new integrons carrying the blaVIM-2 gene cassettes. J Antimicrob Chemother 2002; 4ft: 837–40.
- Yan JJ, Ko WC, Chuang CL, Wu JJ. Metallo-β-lactamase-producing Enterobacteriaceae isolates in a university hospital in Taiwan: prevalence of IMP-8 in Enterobacter cloacae and first identification of VIM-2 in Citrobacter freundii. J Antimicrob Chemother 2002; 50: 503–11.
- Sofianou D, Markogiannakis A, Metzidie E, Pournaras S, Tsakris A. VIM-2 metallo-β-lactamase in Achromobacter xylosoxidans in Europe. Eur J Clin Microbiol Infect Dis 2005; 24: 854–55.
- Yan JJ, Hsueh PR, Ko WC, et al. Metallo-β-lactamases in clinical Pseudomonas isolates in Taiwan and identification of VIM-3, a novel variant of the VIM-2 enzyme. Antimicrob Agents Chemother 2001; 45: 2224–28.
- Pournaras S, Tsakris A, Maniati M, Tzouvelekis LS, Maniatis AN. Novel variant (blaVIM-4) of the metallo-β-lactamase gene blaVIM-1 in a clinical strain of Pseudomonas aeruginosa. Antimicrob Agents Chemother 2002; 46: 4026–28.
- Luzzaro F, Docquier JD, Colinon C, et al. Emergence in Klebsiella pneumoniae and Enterobacter cloacae clinical isolates of the VIM-4 metallo-β-lactamase encoded by a conjugative plasmid. Antimicrob Agents Chemother 2004; 48: 648–50.
- Libisch B, Giske CG, Kovács B, Tóth TG, Füzi M. Identification of the first VIM metallo-β-lactamase-producing multiresistant Aeromonas hydrophila strain. J Clin Microbiol 2008; 46: 1878–80.
- Figueiredo S, Poirel L, Papa A, Koulourida V, Nordmann P. First identification of VIM-4 metallo-β-lactamase in Acinetobacter spp. Clin Microbiol Infect 2008; 14: 289–90.
- Midilli K, Aygün G, Kuskucu M, et al. A new variant of metallo-β-lactamase detected in a Klebsiella pneumoniae strain: VIM-5. KLIMIK Congress; Istanbul, Turkey; 2003. S-21 (in Turkish).
- Bahar G, Mazzariol A, Koncan R, et al. Detection of VIM-5 metallo-β-lactamase in a Pseudomonas aeruginosa clinical isolate from Turkey. J Antimicrob Chemother 2004; 54: 282–83.
- Koh TH, Wang GC, Sng LH. IMP-1 and a novel metallo-β- lactamase, VIM-6, in fluorescent pseudomonads isolated in Singapore. Antimicrob Agents Chemother 2004; 48: 2334–36.
- Toleman MA, Rolston K, Jones RN, Walsh TR. blaVIM-7, an evolutionarily distinct metallo-β-lactamase gene in a Pseudomonas aeruginosa isolate from the United States. Antimicrob Agents Chemother 2004; 48: 329–32.
- Crespo MP, Woodford N, Sinclair A, et al. Outbreak of carbapeneçsistant Pseudomonas aeruginosa producing VIM-8, a novel metallo-β-lactamase, in a tertiary care center in Cali, Colombia. J Clin Microbiol 2004; 42: 5094–101.
- Woodford N, Zhang J, Kaufmann ME, et al. Detection of Pseudomonas aeruginosa isolates producing VEB-type extended-spectrum β-lactamases in the United Kingdom. J Antimicrob Chemother 2008; 62: 1265–68.
- Pasteran F, Faccone D, Petroni A, et al. Novel variant blaVIM-11 of the metallo-β-lactamase blaVIM family in a GES-1 extended- spectrum-β-lactamase-producing Pseudomonas aeruginosa clinical isolate in Argentina. Antimicrob Agents Chemother 2005; 4ft: 474–75.
- Lin YC, Sheng WH, Chen YC, Chang SC, Hsia KC, Li SY. Differences in carbapenem resistance genes among Acinetobacter baumannii, Acinetobacter genospecies 3 and Acinetobacter genospecies 13TU in Taiwan. Int J Antimicrob Agents 2010; 35: 439–43.
- Pournaras S, Ikonomidis A, Tzouvelekis LS, et al. VIM-12, a novel plasmid-mediated metallo-β-lactamase from Klebsiella pneumoniae that resembles a VIM-1/VIM-2 hybrid. Antimicrob Agents Chemother 2005; 4ft: 5153–56.
- Juan C, Beceiro A, Gutiérrez O, et al. Characterization of the new metallo-β-lactamase VIM-13 and its integron-borne gene from a Pseudomonas aeruginosa clinical isolate in Spain. Antimicrob Agents Chemother 2008; 52: 3589–96.
- Mazzariol A, Mammina C, Koncan R, et al. A novel VIM-type metallo-β-lactamase (VIM-14) in a Pseudomonas aeruginosa clinical isolate from a neonatal intensive care unit. Clin Microbiol Infect 2010; published online Dec 14. DOI:10.1111/j.1469-0691.2010.03424.x.
- Schneider I, Keuleyan E, Rasshofer R, Markovska R, Queenan AM, Bauernfeind A. VIM-15 and VIM-16, two new VIM-2-like metallo-β-lactamases in Pseudomonas aeruginosa isolates from Bulgaria and Germany. Antimicrob Agents Chemother 2008; 52: 2977–79.
- Siarkou VI, Vitti D, Protonotariou E, Ikonomidis A, Sofianou D. Molecular epidemiology of outbreak-related Pseudomonas aeruginosa strains carrying the novel variant blaVIM-17 metallo-β-lactamase gene. Antimicrob Agents Chemother 2009; 53: 1325–30.
- Castanheira M, Bell JM, Turnidge JD, Mathai D, Jones RN. Carbapenem resistance among Pseudomonas aeruginosa strains from India: evidence for nationwide endemicity of multiple metallo-β-lactamase clones (VIM-2, -5, -6, and -11 and the newly characterized VIM-18). Antimicrob Agents Chemother 2009; 53: 1225–27.
- Robin F, Aggoune-Khinache N, Delmas J, Naim M, Bonnet R. Novel VIM metallo-β-lactamase variant from clinical isolates of Enterobacteriaceae from Algeria. Antimicrob Agents Chemother 2010; 54: 466–70.
- Toleman MA, Simm AM, Murphy TA, et al. Molecular characterization of SPM-1, a novel metallo-β-lactamase isolated in Latin America: report from the SENTRY antimicrobial surveillance programme. J Antimicrob Chemother 2002; 50: 673–79.
- Castanheira M, Toleman MA, Jones RN, Schmidt FJ, Walsh TR. Molecular characterization of a β-lactamase gene, blaGIM-1, encoding a new subclass of metallo-β-lactamase. Antimicrob Agents Chemother 2004; 48: 4654–61.
- Brodner AHB, Wydra S, Henrich B, Mackenzie CR. High prevalence of GIM-1 metallo-β-lactamase (MBL) in Pseudomonas spp and emergence in Enterobacteriaceae in Düsseldorf, Germany. 50th Interscience Conference on Antimicrobial Agents and Chemotherapy; Boston, USA; Sept 12–15, 2010. C1-1417.
- Lee K, Yum JH, Yong D, et al. Novel acquired metallo-β-lactamase gene, blaSIM-1, in a class 1 integron from Acinetobacter baumannii clinical isolates from Korea. Antimicrob Agents Chemother 2005; 4ft: 4485–91.
- Dwivedi M, Mishra A, Azim A, et al. Ventilator-associated pneumonia caused by carbapenem-resistant Enterobacteriaceae carrying multiple metallo-β-lactamase genes. Indian J Pathol Microbiol 2009; 52: 339–42.
- Yong D, Bell JM, Ritchie B, Pratt R, Toleman MA, Walsh TR. A novel sub-group metallo-β-lactamase (MBL), AIM-1 emerges in Pseudomonas aeruginosa (PSA) from Australia. 47th Interscience Conference on Antimicrobial Agents and Chemotherapy; Chicago, USA; Sept 17–20, 2007. C1-1417.
- Sekiguchi J, Morita K, Kitao T, et al. KHM-1, a novel plasmid- mediated metallo-β-lactamase from a Citrobacter freundii clinical isolate. Antimicrob Agents Chemother 2008; 52: 4194–97.
- Yong D, Toleman MA, Giske CG, et al. Characterization of a new metallo-β-lactamase gene, blaNDM-1, and a novel erythromycin esterase gene carried on a unique genetic structure in Klebsiella pneumoniae sequence type 14 from India. Antimicrob Agents Chemother 2009; 53: 5046–54.
- Kumarasamy K, Thirunarayan MA, Krishnan P. Coexistence of blaOXA-23 with blaNDM-1 and armA in clinical isolates of Acinetobacter baumannii from India. J Antimicrob Chemother 2010; 65: 2253–2254.
- Poirel L, Rodríguez-Martínez JM, Al Naiemi N, Debets-Ossenkopp YJ, Nordmann P. Characterization of DIM-1, an integron-encoded metallo-β-lactamase from a Pseudomonas stutzeri clinical isolate in the Netherlands. Antimicrob Agents Chemother 2010; 54: 2420–24.
- Docquier JD, Lamotte-Brasseur J, Galleni M, Amicosante G, Frère JM, Rossolini GM. On functional and structural heterogeneity of VIM-type metallo-β-lactamases. J Antimicrob Chemother 2003; 51: 257–66.
- Murphy TA, Simm AM, Toleman MA, Jones RN, Walsh TR. Biochemical characterization of the acquired metallo-β-lactamase SPM-1 from Pseudomonas aeruginosa. Antimicrob Agents Chemother 2003; 47: 582–87.
- Kumarasamy KK, Toleman MA, Walsh TR, et al. Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study. Lancet Infect Dis 2010; 10: 597–602.
- Picão RC, Poirel L, Gales AC, Nordmann P. Diversity of β-lactamases produced by ceftazidime-resistant Pseudomonas aeruginosa isolates causing bloodstream infections in Brazil. Antimicrob Agents Chemother 2009; 53: 3908–13.
- Toleman MA, Weeks J, Walsh T. Close association between ISCR elements and the MBL gene blaNDM-1. 50th Interscience Conference on Antimicrobial Agents and Chemotherapy; Boston, USA; Sept 12–15, 2010. C2-1335.
- Fukigai S, Alba J, Kimura S, et al. Nosocomial outbreak of genetically related IMP-1 β-lactamase-producing Klebsiella pneumoniae in a general hospital in Japan. Int J Antimicrob Agents 2007; 2ft: 306–10.
- Kouda S, Kuwahara R, Ohara M, et al. First isolation of blaIMP-7 in a Pseudomonas aeruginosa in Japan. J Infect Chemother 2007; 13: 276–77.
- Lee K, Kim CK, Hong SG, et al. Characteristics of clinical isolates of Acinetobacter genomospecies 10 carrying two different metallo-β-lactamases. Int J Antimicrob Agents 2010; 36: 259–63.
- Nho SO, Jin JS, Kim JW, et al. Dissemination of the blaIMP-1 and blaVIM-2 metallo-β-lactamase genes among genetically unrelated Pseudomonas aeruginosa isolates in a South Korean hospital. Int J Antimicrob Agents 2008; 31: 586–88.
- Ryoo NH, Lee K, Lim JB, Lee YH, Bae IK, Jeong SH. Outbreak by meropenem-resistant Pseudomonas aeruginosa producing IMP-6 metallo-β-lactamase in a Korean hospital. Diagn Microbiol Infect Dis 2009; 63: 115–17.
- Mendes RE, Bell JM, Turnidge JD, et al. Carbapenem-resistant isolates of Klebsiella pneumoniae in China and detection of a conjugative plasmid (blaKPC-2 plus qnrB4) and a blaIMP-4 gene. Antimicrob Agents Chemother 2008; 52: 798–99.
- Cheng X, Wang P, Wang Y, et al. Identification and distribution of the clinical isolates of imipenem-resistant Pseudomonas aeruginosa carrying metallo-β-lactamase and/or class 1 integron genes. J Huazhong Univ Sci Technolog Med Sci 2008; 28: 235–38.
- Chen LR, Zhou HW, Cai JC, Zhang R, Chen GX. Detection of plasmid-mediated IMP-1 metallo-β-lactamase and quinolone resistance determinants in an ertapenem-resistant Enterobacter cloacae isolate. J Zhejiang Univ Sci B 2009; 10: 348–54.
- Wang C, Wang J, Mi Z. Pseudomonas aeruginosa producing VIM-2 metallo-β-lactamases and carrying two aminoglycoside-modifying enzymes in China. J Hosp Infect 2006; 62: 522–24.
- Chiu CH, Lee HY, Tseng LY, et al. Mechanisms of resistance to ciprofloxacin, ampicillin/sulbactam and imipenem in Acinetobacter baumannii clinical isolates in Taiwan. Int J Antimicrob Agents 2010; 35: 382–86.
- Azim A, Dwivedi M, Rao PB, et al. Epidemiology of bacterial colonization at intensive care unit admission with emphasis on extended-spectrum β-lactamase- and metallo-β-lactamase-producing Gram-negative bacteria—an Indian experience. J Med Microbiol 2010; 5ft: 955–60.
- Hwa WE, Subramaniam G, Navaratnam P, Sekaran SD. Detection and characterization of class 1 integrons among carbapenem- resistant isolates of Acinetobacter spp in Malaysia. J Microbiol Immunol Infect 2009; 42: 54–62.
- Khosravi Y, Tee Tay S, Vadivelu J. Metallo-β-lactamase-producing imipenem-resistant Pseudomonas aeruginosa clinical isolates in a university teaching hospital in Malaysia: detection of IMP-7 and first identification of IMP-4, VIM-2, and VIM-11. Diagn Microbiol Infect Dis 2010; 67: 294–96.
- Koh TH, Sng LH, Wang GC, Hsu LY, Zhao Y. IMP-4 and OXA β-lactamases in Acinetobacter baumannii from Singapore. J Antimicrob Chemother 2007; 5ft: 627–32.
- Al-Agamy MH, Shibl AM, Tawfik AF, Radwan HH. High prevalence of metallo-β-lactamase-producing Pseudomonas aeruginosa from Saudi Arabia. J Chemother 2009; 21: 461–62.
- Khosravi AD, Mihani F. Detection of metallo-β-lactamase-producing Pseudomonas aeruginosa strains isolated from burn patients in Ahwaz, Iran. Diagn Microbiol Infect Dis 2008; 60: 125–28.
- Daoud Z, Hobeika E, Choucair A, Rohban R. Isolation of the first metallo-β-lactamase producing Klebsiella pneumoniae in Lebanon. Rev Esp Quimioter 2008; 21: 123–26.
- Poirel L, Al Maskari Z, Al Rashdi F, Bernabeu S, Nordmann P. NDM-1-producing Klebsiella pneumoniae isolated in the Sultanate of Oman. J Antimicrob Chemother 2010; published online Nov 23. DOI:10.1093/jac/dkq428.
- Struelens MJ, Monnet DL, Magiorakos AP, O’Connor FS, Giesecke J, for the European NDM-1 Survey Participants. New Delhi metallo-β-lactamase 1-producing Enterobacteriaceae: emergence and response in Europe. Euro Surveill 2010; 15: 19716.
- Pournaras S, Poulou A, Voulgari E, Vrioni G, Kristo I, Tsakris A. Detection of the new metallo-β-lactamase VIM-19 along with KPC-2, CMY-2 and CTX-M-15 in Klebsiella pneumoniae. J Antimicrob Chemother 2010; 65: 1604–07.
- Yildirim I, Ceyhan M, Gur D, Mugnaioli C, Rossolini GM. First detection of VIM-1 type metallo-β-lactamase in a multidrug- resistant Klebsiella pneumoniae clinical isolate from Turkey also producing the CTX-M-15 extended-spectrum β-lactamase. J Chemother 2007; 1ft: 467–68.
- Yakupogullari Y, Poirel L, Bernabeu S, Kizirgil A, Nordmann P. Multidrug-resistant Pseudomonas aeruginosa isolate co-expressing extended-spectrum β-lactamase PER-1 and metallo-β-lactamase VIM-2 from Turkey. J Antimicrob Chemother 2008; 61: 221–22.
- Ozgumus OB, Caylan R, Tosun I, Sandalli C, Aydin K, Koksal I. Molecular epidemiology of clinical Pseudomonas aeruginosa isolates carrying IMP-1 metallo-β-lactamase gene in a University Hospital in Turkey. Microb Drug Resist 2007; 13: 191–98.
- Biendo M, Canarelli B, Thomas D, et al. Successive emergence of extended-spectrum β-lactamase-producing and carbapenemase- producing Enterobacter aerogenes isolates in a university hospital. J Clin Microbiol 2008; 46: 1037–44.
- Hocquet D, Plésiat P, Dehecq B, Mariotte P, Talon D, Bertrand X, for the Observatoire National de l’Epidémiologie de la Résistance Bactérienne aux Antibiotiques. Nationwide investigation of extended- spectrum β-lactamases, metallo-β-lactamases, and extended- spectrum oxacillinases produced by Pseudomonas aeruginosa strains in France. Antimicrob Agents Chemother 2010; 54: 3512–15.
- Poirel L, Ros A, Carricajo A, et al. Extremely drug-resistant Citrobacter freundii identified in a patient returning from India and producing NDM-1 and other carbapenemases. Antimicrob Agents Chemother 2010; 55: 447–48.
- Peña C, Suarez C, Tubau F, et al. Nosocomial spread of Pseudomonas aeruginosa producing the metallo-β-lactamase VIM-2 in a Spanish hospital: clinical and epidemiological implications. Clin Microbiol Infect 2007; 13: 1026–29.
- Deplano A, Rodriguez-Villalobos H, Glupczynski Y, et al. Emergence and dissemination of multidrug resistant clones of Pseudomonas aeruginosa producing VIM-2 metallo-β-lactamase in Belgium. Euro Surveill 2007; 12: E070118.2.
- Bogaerts P, Verroken A, Jans B, Denis O, Glupczynski Y. Global spread of New Delhi metallo-β-lactamase 1. Lancet Infect Dis 2010; 10: 831–32.
- Leverstein-van Hall MA, Stuart JC, Voets GM, Versteeg D, Roelofsen E, Fluit AC. Carbapenem-resistant Klebsiella pneumoniae following foreign travel. Ned Tijdschr Geneeskd 2010; 154: A2013 (in Dutch).
- Samuelsen O, Toleman MA, Sundsfjord A, et al. Molecular epidemiology of metallo-β-lactamase-producing Pseudomonas aeruginosa isolates from Norway and Sweden shows import of international clones and local clonal expansion. Antimicrob Agents Chemother 2010; 54: 346–52.
- Samuelsen O, Buarø L, Toleman MA, et al. The first metallo-β- lactamase identified in Norway is associated with a TniC-like transposon in a Pseudomonas aeruginosa isolate of sequence type 233 imported from Ghana. Antimicrob Agents Chemother 2009; 53: 331–32.
- Samuelsen O, Thilesen CM, Heggelund L, Vada AN, Kümmel A, Sunsfjord A. Identification of NDM-1-producing Enterobacteriaceae in Norway. J Antimicrob Chemother 2011; 66: 670–72.
- Valenza G, Joseph B, Elias J, et al. First survey of metallo-β-lactamases in clinical isolates of Pseudomonas aeruginosa in a German university hospital. Antimicrob Agents Chemother 2010; 54: 3493–97.
- Weile J, Rahmig H, Gfröer S, Schroeppel K, Knabbe C, Susa M. First detection of a VIM-1 metallo-β-lactamase in a carbapenem- resistant Citrobacter freundii clinical isolate in an acute hospital in Germany. Scand J Infect Dis 2007; 3ft: 264–66.
- Göttig S, Pfeifer Y, Wichelhas TA, et al. Global spread of New Delhi metallo-β-lactamase 1. Lancet Infect Dis 2010; 10: 828–29.
- Hrabák J, Cervená D, Izdebski R, et al. Regional spread of Pseudomonas aeruginosa ST357 producing the IMP-7 metallo-β- lactamase in central Europe. J Clin Microbiol 2011; 4ft: 474–75.
- Wroblewska MM, Towner KJ, Marchel H, Luczak M. Emergence and spread of carbapenem-resistant strains of Acinetobacter baumannii in a tertiary-care hospital in Poland. Clin Microbiol Infect 2007; 13: 490–96.
- Sekowska A, Hryniewicz W, Gniadkowski M, Deptuła A, Kusza K, Gospodarek E. Antimicrobial susceptibility of metallo-β-lactamase positive and negative Klebsiella pneumoniae strains isolated from intensive care unit patients. Pol J Microbiol 2010; 5ft: 67–69.
- Libisch B, Gacs M, Csiszár K, Muzslay M, Rókusz L, Füzi M. Isolation of an integron-borne blaVIM-4 type metallo-β-lactamase gene from a carbapenem-resistant Pseudomonas aeruginosa clinical isolate in Hungary. Antimicrob Agents Chemother 2004; 48: 3576–78.
- Kristóf K, Tóth A, Damjanova I, et al. Identification of a blaVIM-4 gene in the internationally successful Klebsiella pneumoniae ST11 clone and in a Klebsiella oxytoca strain in Hungary. J Antimicrob Chemother 2010; 65: 1303–05.
- Giske CG, Libisch B, Colinon C, et al. Establishing clonal relationships between VIM-1-like metallo-β-lactamase-producing Pseudomonas aeruginosa strains from four European countries by multilocus sequence typing. J Clin Microbiol 2006; 44: 4309–15.
- Ohlasova D, Kmet V, Niks M. First report of the carbapenem- resistant Pseudomonas aeruginosa producing IMP-7 metallo-β- lactamase in Slovakia. Int J Antimicrob Agents 2007; 30: 370–71.
- Hrabák J, Fridrichová M, Stolbová M, Bergerová T, Zemlickova H, Urbaskova P. First identification of metallo-β-lactamase-producing Pseudomonas aeruginosa in the Czech Republic. Euro Surveill 2009; 14: 19102.
- Lepsanovic Z, Libisch B, Tomanovic B, Nonkovici Z, Balogh B, Füzi M. Characterisation of the first VIM metallo-β-lactamase- producing Pseudomonas aeruginosa clinical isolate in Serbia. Acta Microbiol Immunol Hung 2008; 55: 447–54.
- Bosnjak Z, Bedenić B, Mazzariol A, Jarza-Davila N, Suto S, Kalenić S. VIM-2 β-lactamase in Pseudomonas aeruginosa isolates from Zagreb, Croatia. Scand J Infect Dis 2010; 42: 193–97.
- Toleman MA, Vinodh H, Sekar U, Kamat V, Walsh TR. blaVIM-2-harboring integrons isolated in India, Russia, and the United States arise from an ancestral class 1 integron predating the formation of the 3´ conserved sequence. Antimicrob Agents Chemother 2007; 51: 2636–38.
- Krapivina IV, Galeeva EV, Veshutova NS, Ivanov DV, Sidorenko SV. Antimicrobial susceptibility and molecular mechanisms of resistance to β-lactams of gram-negative microorganisms— causative agents of nosocomial infections. Zh Mikrobiol Epidemiol Immunobiol 2007; 5: 16–20 (in Russian).
- Lincopan N, McCulloch JA, Reinert C, Cassettari VC, Gales AC, Mamizuka EM. First isolation of metallo-β-lactamase-producing multiresistant Klebsiella pneumoniae from a patient in Brazil. J Clin Microbiol 2005; 43: 516–19.
- Salabi AE, Toleman MA, Weeks J, Bruderer T, Frei R, Walsh TR. First report of the metallo-β-lactamase SPM-1 in Europe. Antimicrob Agents Chemother 2010; 54: 582.
- Jones RN, Biedenbach DJ, Sader HS, Fritsche TR, Toleman MA, Walsh TR. Emerging epidemic of metallo-β-lactamase-mediated resistances. Diagn Microbiol Infect Dis 2005; 51: 77–84.
- Santella G, Pollini S, Docquier JD, et al. Intercontinental dissemination of IMP-13-producing Pseudomonas aeruginosa belonging in sequence type 621. J Clin Microbiol 2010; 48: 4342–43.
- Villegas MV, Lolans K, del Rosario Olivera M, et al, for the Colombian Nosocoimal Resistance Study Group. First detection of metallo-β-lactamase VIM-2 in Pseudomonas aeruginosa isolates from Colombia. Antimicrob Agents Chemother 2006; 50: 226–29.
- Lolans K, Queenan AM, Bush K, Sahud A, Quinn JP. First nosocomial outbreak of Pseudomonas aeruginosa producing an integron-borne metallo-β-lactamase (VIM-2) in the United States. Antimicrob Agents Chemother 2005; 4ft: 3538–40.
- Centers for Disease Control and Prevention (CDC). Detection of Enterobacteriaceae isolates carrying metallo-β-lactamase—United States, 2010. MMWR Morb Mortal Wkly Rep 2010; 5ft: 750.
- Centers for Disease Control and Prevention (CDC). Update: detection of a verona integron-encoded metallo-β-lactamase in Klebsiella pneumonia—United States, 2010. MMWR Morb Mortal Wkly Rep 2010; 5ft: 1212.
- Laupland KB, Parkins MD, Church DL, et al. Population-based epidemiological study of infections caused by carbapenem-resistant Pseudomonas aeruginosa in the Calgary Health Region: importance of metallo-β-lactamase (MBL)-producing strains. J Infect Dis 2005; 1ft2: 1606–12.
- Pitout JD, Chow BL, Gregson DB, Laupland KB, Elsayed S, Church DL. Molecular epidemiology of metallo-β-lactamase- producing Pseudomonas aeruginosa in the Calgary Health Region: emergence of VIM-2-producing isolates. J Clin Microbiol 2007; 45: 294–98.
- Mulvey MR, Grant JM, Plewes K, Roscoe D, Boyd DA. New Delhi metallo-β-lactamase in Klebsiella pneumoniae and Escherichia coli, Canada. Emerg Infect Dis 2011; 17: 103–06.
- Garza-Ramos U, Tinoco P, Silva-Sanchez J, et al. Metallo-β-lactamase IMP-18 is located in a class 1 integron (In96) in a clinical isolate of Pseudomonas aeruginosa from Mexico. Int J Antimicrob Agents 2008; 31: 78–80.
- Quinones-Falconi F, Galicia-Velasco M, Marchiaro P, et al. Emergence of Pseudomonas aeruginosa strains producing metallo-β-lactamases of the IMP-15 and VIM-2 types in Mexico. Clin Microbiol Infect 2010; 16: 126–31.
- Morfin-Otero R, Rodriguez-Noriega E, Deshpande LM, Sader HS, Castanheira M. Dissemination of a blaVIM-2-carrying integron among Enterobacteriaceae species in Mexico: report from the SENTRY Antimicrobial Surveillance Program. Microb Drug Resist 2009; 15: 33–35.
- Peleg AY, Bell JM, Hofmeyr A, Wiese P. Inter-country transfer of Gram-negative organisms carrying the VIM-4 and OXA-58 carbapenem-hydrolysing enzymes. J Antimicrob Chemother 2006; 57: 794–95.
- Toleman MA, Bell J, Walsh T. 2010. Persistence and movement of the metallo-β-lactamase (MBL) AIM-1 in Pseudomonas from Australia, abstr. 50th Interscience Conference on Antimicrobial Agents and Chemotherapy; Boston, USA; Sept 12–15, 2010. 1805.
- Poirel L, Lagrutta E, Taylor P, Pham J, Nordmann P. Emergence of metallo-β-lactamase NDM-1-producing multidrug resistant Escherichia coli in Australia. Antimicrob Agents Chemother 2010; 54: 4914–16.
- Mansour W, Poirel L, Bettaieb D, Bouallegue O, Boujaafar N, Nordmann P. Metallo-β-lactamase-producing Pseudomonas aeruginosa isolates in Tunisia. Diagn Microbiol Infect Dis 2009; 64: 458–61.
- Ktari S, Arlet G, Mnif B, et al. Emergence of multidrug-resistant Klebsiella pneumoniae isolates producing VIM-4 metallo-β-lactamase, CTX-M-15 extended-spectrum β-lactamase, and CMY-4 AmpC β-lactamase in a Tunisian university hospital. Antimicrob Agents Chemother 2006; 50: 4198–201.
- Ben Othman A, Zribi M, Masmoudi A, Abdellatif S, Ben Lakhal S, Fendri C. Phenotypic and molecular epidemiology of Acinetobacter baumannii strains isolated in Rabta Hospital, Tunisia. Arch Inst Pasteur Tunis 2007; 84: 11–19.
- Szabó D, Szentandrássy J, Juhász Z, Katona K, Nagy K, Rókusz L. Imported PER-1 producing Pseudomonas aeruginosa, PER-1 producing Acinetobacter baumanii and VIM-2-producing Pseudomonas aeruginosa strains in Hungary. Ann Clin Microbiol Antimicrob 2008; 7: 12.
- Pitout JD, Revathi G, Chow BL,et al. Metallo-β-lactamase-producing Pseudomonas aeruginosa isolated from a large tertiary centre in Kenya. Clin Microbiol Infect 2008; 14: 755–59.
- Poirel L, Revathi G, Bernabeu S, Nordmann P. Detection of NDM-1-producing Klebsiella pneumoniae in Kenya. Antimicrob Agents Chemother 2011; 55: 934–36.
- Miyajima Y, Hiramatsu K, Mizukami E, et al. In vitro and in vivo potency of polymyxin B against IMP-type metallo-β-lactamase- producing Pseudomonas aeruginosa. Int J Antimicrob Agents 2008; 32: 437–40.
- Carmeli Y, Akova M, Cornaglia G, et al. Controlling the spread of carbapenemase-producing Gram-negatives: therapeutic approach and infection control. Clin Microbiol Infect 2010; 16: 102–11.
- Mantengoli E, Luzzaro F, Pecile P, et al. Escherichia coli ST131 producing extended-spectrum β-lactamases plus VIM-1 carbapenemase: further narrowing of treatment options. Clin Infect Dis 2011; 52: 690–91.
- Souli M, Rekatsina P, Chryssouli Z, Galani I, Giamarellou H, Kanelakopoulou K. Does the activity of the combination of imipenem and colistin in vitro exceed the problem of resistance in metallo-β-lactamase-producing Klebsiella pneumoniae isolates? Antimicrob Agents Chemother 2009; 53: 2133–35.
- Oie S, Fukui Y, Yamamoto M, Masuda Y, Kamiya A. In vitro antimicrobial effect of aztreonam, colistin, and 3-drug combination of aztreonam, ceftazidime and amikacin on metallo-β-lactamase- producing Pseudomonas aeruginosa. BMC Infect Dis 2009; ft: 123.
- Sabuda DM, Laupland K, Pitout J, et al. Utilization of colistin for treatment of multidrug-resistant Pseudomonas aeruginosa. Can J Infect Dis Med Microbiol 2008; 1ft: 413–18.
- Souli M, Kontopidou FV, Papadomichelakis E, Galani I, Armaganidis A, Giamarellou H. Clinical experience of serious infections caused by Enterobacteriaceae producing VIM-1 metallo-β-lactamase in a Greek University Hospital. Clin Infect Dis 2008; 46: 847–54.
- Falagas ME, Rafailidis PI, Ioannidou E, et al. Colistin therapy for microbiologically documented multidrug-resistant Gram-negative bacterial infections: a retrospective cohort study of 258 patients. Int J Antimicrob Agents 2010; 35: 194–99.
- Tascini C, Urbani L, Biancofiore G, et al. Colistin in combination with rifampin and imipenem for treating a blaVIM-1 metallo-β- lactamase-producing Enterobacter cloacae disseminated infection in a liver transplant patient. Minerva Anestesiol 2008; 74: 47–79.
- Antoniadou A, Kontopidou F, Poulakou G, et al. Colistin-resistant isolates of Klebsiella pneumoniae emerging in intensive care unit patients: first report of a multiclonal cluster. J Antimicrob Chemother 2007; 5ft: 786–90.
- Cobo J, Morosini MI, Pintado V, et al. Use of tigecycline for the treatment of prolonged bacteremia due to a multiresistant VIM-1 and SHV-12 β-lactamase-producing Klebsiella pneumoniae epidemic clone. Diagn Microbiol Infect Dis 2008; 60: 319–22.
- Peleg AY, Potoski BA, Rea R, et al. Acinetobacter baumannii bloodstream infection while receiving tigecycline: a cautionary report. J Antimicrob Chemother 2007; 5ft: 128–31.
- Falagas ME, Kastoris AC, Karageorgopoulos DE, Rafailidis PI. Fosfomycin for the treatment of infections caused by multidrug-resistant non-fermenting Gram-negative bacilli: a systematic review of microbiological, animal and clinical studies. Int J Antimicrob Agents 2009; 34: 111–20.
- Nouér SA, Nucci M, de-Oliveira MP, Pellegrino FL, Moreira BM. Risk factors for acquisition of multidrug-resistant Pseudomonas aeruginosa producing SPM metallo- β-lactamase. Antimicrob Agents Chemother 2005; 4ft: 3663–67.
- Zavascki AP, Barth AL, Gonçalves AL, et al. The influence of metallo-β-lactamase production on mortality in nosocomial Pseudomonas aeruginosa infections. J Antimicrob Chemother 2006; 58: 387–92.





