377
04 Октября 2021
Авторское право © 2018, Konstantinos Sfakianoudis, Mara Simopoulou, Yorgos Nikas, Anna Rapani, Nikolaos Nitsos, Katerina Pierouli, Athanasios Pappas, Agni Pantou, Christina Markomichali, Michael Koutsilieris, Konstantinos Pantos (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Константинос Сфакианоудис, Мара Симопулу, Йоргос Никас, Анна Рапани, Николаос Ницос, Катерина Пьерули, Афанасий Паппас, Агни Панту, Кристина Марк...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Константинос Сфакианоудис, Мара Симопулу, Йоргос Никас, Анна Рапани, Николаос Ницос, Катерина Пьерули, Афанасий Паппас, Агни Панту, Кристина Марк...
Авторское право © 2018, Konstantinos Sfakianoudis, Mara Simopoulou, Yorgos Nikas, Anna Rapani, Nikolaos Nitsos, Katerina Pierouli, Athanasios Pappas, Agni Pantou, Christina Markomichali, Michael Koutsilieris, Konstantinos Pantos (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Константинос Сфакианоудис, Мара Симопулу, Йоргос Никас, Анна Рапани, Николаос Ницос, Катерина Пьерули, Афанасий Паппас, Агни Панту, Кристина Маркомичали, Майкл Куцилерис, Константинос Пантос
BMC Women's Health201818:197
Аннотация
Введение
Ранняя диагностика и эффективное лечение хронического эндометрита (ХЭ) у пациенток, проходящих лечение в связи с нарушением фертильности, – две ключевые цели каждого специалиста. Лечение антибиотиками демонстрирует хорошие результаты с учетом способности эндометрия обновляться. Однако несмотря на повышение результативности экстракорпорального оплодотворения (ЭКО), убедительные рекомендации по терапии еще не выработаны, а оптимальный метод лечения пока отсутствует. Данная работа представляет собой первую публикацию об эффективном методе внутриматочного введения антибиотиков для лечения ХЭ при решении проблемы бесплодия.
Описание случаев
Мы представим информацию о трех пациентках с тремя неудачными попытками ЭКО в анамнезе на фоне диагностированного ХЭ, в прошлом не получавших эффективного лечения. После первичной консультации в нашей клинике и уточнения диагноза «ХЭ» пациенткам назначен пероральный прием антибиотиков с учетом выявленного возбудителя. При контрольном обследовании выявлены незначительные улучшения в микрофлоре эндометрия, но воспалительный процесс продолжался. В качестве альтернативы пациенткам был предложен внутриматочный метод введения антибиотика. У всех женщин в итоге наступила беременность после короткого периода лечения, у одной пациентки родилась живая двойня, у двух других беременность на момент написания статьи еще протекала.
Выводы
Описание серии случаев расширяет медицинские представления как об эффективном лечении ХЭ, так и о ведении пациенток с бесплодием на фоне этого заболевания. Современная традиция назначения перорального приема антибиотиков при ХЭ подчеркивает необходимость поиска новых решений и требует более глубоких исследований его применения в клинической практике. Новый способ стимулирует возможность естественного зачатия у пациенток с повторными неудачными имплантациями (recurrent implantation failure, RIF) после нескольких попыток ЭКО. Метод представляется важным как альтернативный способ лечения и требует дальнейшего изучения.
Ключевые слова
Хронический эндометрит (ХЭ) – серьезная патология, вызывающая нарушение фертильности у 12–46% пациенток [1]. Воспаление эндометрия – основная особенность данного заболевания, характеризующаяся высоким содержанием в эндометрии плазматических клеток наряду с несколькими возбудителями инфекции, приводящими к соответствующей симптоматике [2]. Вопрос о тесной взаимосвязи ХЭ и бесплодия до недавнего времени не рассматривался и не вызывал интереса у специалистов.
По причине своей сложности диагностика и лечение ХЭ занимают немало времени. Предложенный изначально метод гистологического исследования биопсийного материала эндометрия до сих пор остается золотым стандартом в арсенале врачей [3]. Однако при наличии в норме воспалительных клеток в эндометрии выявление ХЭ представляет собой определенные трудности. Проведение жидкостной гистероскопии как вспомогательного метода диагностики может выявить микрополипы, стромальный отек, локальную или диффузную гиперемию [4]. Корреляция ХЭ и наличия эозинофилов в эндометрии, а также антител CD138 плазматических клеток является более достоверным методом подтверждения диагноза [5]. Назрела необходимость выработки четких критериев для постановки диагноза и наиболее оптимальных методов диагностики, сроков лечения и показателей выздоровления.
Так, в частности, при проведении попыток ЭКО ХЭ обнаруживается у 42% женщин с RIF [6]. Рецептивность эндометрия – фактора, оказывающего огромное влияние на исход ЭКО – снижается в условиях нарушенной микрофлоры, наблюдаемой при ХЭ [7]. У пациенток с хроническим эндометритом и RIF процент успешных ЭКО очень низок. Слабовыраженный ХЭ трудно диагностировать [3], особенно у направленных на ЭКО пациенток, для которых фактор времени имеет принципиальное значение. Безусловно, врачи заинтересованы в составных методах диагностики для точной интерпретации имеющихся признаков заболевания.
Лечение ХЭ предполагает прием различных антибиотиков в зависимости от типа выявленного возбудителя. Вначале антибактериальные препараты назначаются перорально, по завершении курса анализируется состояние эндометрия. Необходимо подчеркнуть, что помимо различий в группах назначаемых антибиотиков для каждого конкретного случая подбираются свои дозировки и схемы приема. Ожидается, что после курса антибиотиков рецептивность эндометрия восстановится. Однако в научной литературе отсутствуют данные о значимой корреляции между лечением антибиотиками и успешными результатами ЭКО, то есть утверждение, что антибактериальная терапия способствует наступлению беременности после ЭКО, можно считать несостоятельным [8, 9].
Иммунный ответ при ХЭ редко приводит к системному воспалению [10], поэтому у нашей группы экспертов назрел вопрос о целесообразности выбора системного пути введения антибиотика. В настоящей статье мы приводим серию клинических случаев с тремя пациентками, которым проведено внутриматочное введение антибиотика после неэффективного перорального курса. Цель работы – обратить внимание врачей на альтернативный новый метод, предполагающий внутриматочное введение антибиотиков у таких пациенток и обладающий в совокупности с нынешними методиками серьезными преимуществами как обоснованный, надежный и эффективный способ лечения ХЭ.
Описание клинических случаев
У всех пациенток, поступивших к нам в клинику, в прошлом имелись несколько неудачных попыток ЭКО и диагноз «ХЭ». Они обследовались как женщины с RIF. Проходимость маточных труб подтверждена у всех пациенток. Результаты спермограмм партнеров исключили роль мужского фактора. В довершение к этому, для соответствия критериям возможности естественного зачатия определялись показатели фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ) и антимюллерова (АГ) гормонов. В частности, уровень ФСГ у трех пациенток следующий: пациентка 1 – 5,12 мМЕ/мл, пациентка 2 – 3,1 мМЕ/мл, пациентка 3 – 5,81 мМЕ/мл. Уровни АМГ распределились следующим образом: пациентка 1 – 18 нг/мл, пациентка 2 – 26 нг/мл, пациентка 3 – 20 нг/мл. Сделан вывод, что снижение фертильности связано с ХЭ, так как гистологический анализ биопсийного материала эндометрия и микробиологический анализ подтвердили наличие эндометрита (рисунок 1). В следующем разделе описана схожая для всех трех пациенток стратегия лечения. Приведена подробная информация о протоколах ведения, применяемых при ХЭ, его диагностике и лечении при нарушении фертильности.
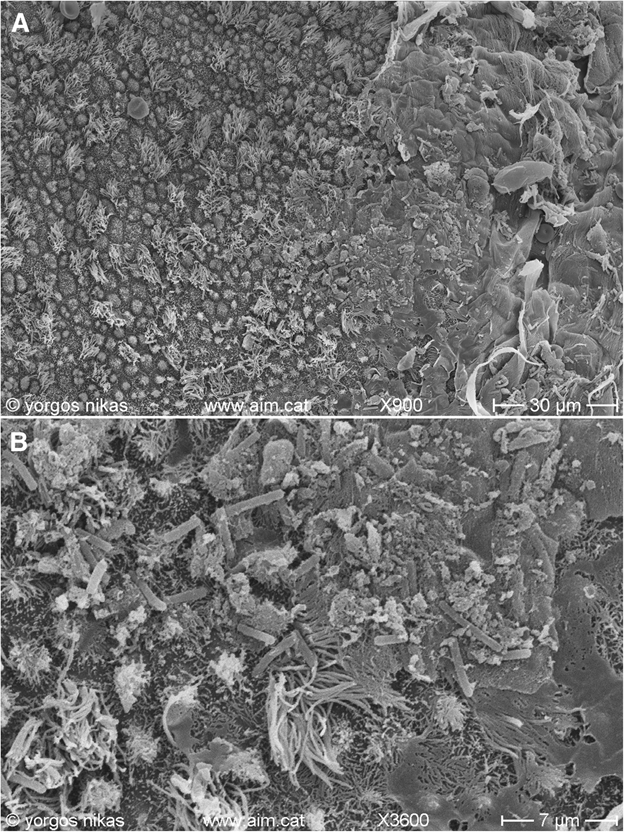 Рисунок 1. a Микроснимок растрового электронного микроскопа поверхности эндометрия пациентки с ХЭ. Обратите внимание на тонкий слизистый слой (справа), содержащий участки некроза и красные кровяные клетки. b Увеличенный участок изображения 1а. Слизь и многочисленные бактерии плотно осели в микроворсинках и ресничках эпителиальных клеток эндометрия
Рисунок 1. a Микроснимок растрового электронного микроскопа поверхности эндометрия пациентки с ХЭ. Обратите внимание на тонкий слизистый слой (справа), содержащий участки некроза и красные кровяные клетки. b Увеличенный участок изображения 1а. Слизь и многочисленные бактерии плотно осели в микроворсинках и ресничках эпителиальных клеток эндометрия
Диагностическая гистероскопия
Все пациентки проходили диагностическую гистероскопию в фолликулярную фазу менструального цикла с использованием линзового мини-гистероскопа внешним диаметром 3 мм с углом обзора 1058 градусов, с 3,5 диагностическим тубусом односторонней подачи жидкости 3,5 мм. Для расширения полости матки подавался физиологический раствор, уровень освещения – 300 Вт ксеноновой лампой, использовалась цифровая камера, выводившая изображение на цветной монитор диагональю 21 дюйм. Достигнут панорамный обзор полости матки, проведено детальное обследование слизистой эндометрия. Во всех случаях подтвержден диагноз эндометрита, на фоне полипоидного эндометрия, микрополипов, отека стромы и диффузной гиперемии.
Биопсия эндометрия
С целью идентификации микробного агента производилась биопсия эндометрия с использованием 3 мм кюретты Novak, соединенной с шприцом емкостью 20 мл. Для снижения риска контаминации после установки гинекологического зеркала и обработки шейки матки раствором йода, канюля Novak вводилась в полость матки под четким визуальным контролем, избегая любых соприкосновений со стенками влагалища. Образцы эндометрия замачивались в 2 мл физиологического раствора и разделялись на две части – для гистологического и микробиологического анализов.
Гистологический анализ
Для фиксации гистологического материала образцов эндометрия применялся нейтральный формалин и парафин. Окраска микросрезов проводилась гемотоксилином-эозионом. Важнейшими признаками наличия ХЭ считались повышение плотности стромы, поверхностный стромальный отек и плейоморфное воспаление стромы.
Микробиологический анализ
Образцы эндометрия после окраски по Граму помещались на агаровую среду, основу колумбийского агара с 5% содержанием крови овцы, шоколадный агар, солевой агар с маннитом и агар МакКонки (Bio Merieux, Рим, Италия). Перед анализом образцы выдерживались 48 часов на воздухе или в 5% СО2. Идентификация бактерий проводилась по опубликованным критериям (Dade International Inc., Милан, Италия). Анализ выявил наличие Mycoplasma species и Ureaplasma urealyticum, описывающихся в литературе как наиболее частые возбудители ХЭ.
Пероральная схема приема антибиотиков
На основе выявленного возбудителя и определения его чувствительности к антибиотикам назначался соответствующий препарат. Следуя клиническим рекомендациям и отработанным методикам нашей клиники, мы включали в схему лечения доксициклин. Курс перорального приема этого антибиотика составлял 21 день.
Контрольный осмотр и внутриматочное введение антибиотика
После традиционного метода лечения ХЭ, включающего пероральный прием антибиотиков, повторные гистологический и микробиологический анализы выявили частичное снижение выраженности ХЭ. Тем не менее значительного положительного эффекта достигнуто не было, результаты можно было назвать в целом неудовлетворительными. У всех трех пациенток после перорального курса приема антибиотиков состояние эндометрия улучшалось незначительно, так как гистологический и микробиологический анализы подтвердили наличие воспалительного процесса и микробных агентов. Растровый электронный микроскоп (РЭМ) выявил слабое улучшение, но в целом патологическая картина сохранилась (рисунок 2).
 Рисунок 2. а Поверхность эндометрия после лечения ХЭ пероральным курсом антибиотика. Обратите внимание на волокна слизистой (нижняя часть фото) и конгломераты красных кровяных телец (верхняя часть фото). b Увеличенный участок изображения 2а. Отложения фибрина с красными кровяными тельцами (посередине), по-видимому, образующегося путем диапедеза, и отдельные бактерии (посередине, нижняя часть фото), заметные на эпителии
Рисунок 2. а Поверхность эндометрия после лечения ХЭ пероральным курсом антибиотика. Обратите внимание на волокна слизистой (нижняя часть фото) и конгломераты красных кровяных телец (верхняя часть фото). b Увеличенный участок изображения 2а. Отложения фибрина с красными кровяными тельцами (посередине), по-видимому, образующегося путем диапедеза, и отдельные бактерии (посередине, нижняя часть фото), заметные на эпителии
В целях более эффективного лечения истинной причины ХЭ мы предложили пациенткам методику внутриматочного введения антибиотика. Перед процедурой все пациентки подписали добровольное информированное согласие на внутриматочное введение препаратов. Совет по вопросам этики клиники «Генезис» в Афинах одобрил протокол исследования, подтвердив его соответствие Хельсинской декларации.
Содержание дизайна исследования отражало протокол лечения. В соответствии с рекомендациями по приему ципроксина, приводящимися в свидетельстве дополнительной охраны антибактериального препарата, лечение антибиотиком воспалительных заболеваний органов малого таза (ВЗОМТ) должно длиться 10 дней. Исходя из этого, лечение продолжалось 10 дней. Однако при этом внутриматочное введение не может осуществляться 10 дней подряд. Инфузии выполнялись каждые три дня, потому что жидкость от предыдущего введения визуализировалась в полости матки на второй день после процедуры, исчезая лишь на третий день. Следовательно, весь курс составил один месяц, в течение которого выполнено 10 введений лекарств через одинаковый промежуток времени. Объем инфузии составлял 3–4 мл, что соответствует максимальному объему полости матки. Вводился раствор ципрофлоксацина для внутривенных инъекций в концентрации 200 мг / 100 мл. Процедура осуществлялась 23 см катетером для переноса эмбрионов.
После курса проведенной терапии производился контрольный осмотр пациенток в фолликулярной фазе следующего менструального цикла, включавший в себя биопсию эндометрия для гистологического и микробиологического анализов упомянутым ранее способом. Получены многообещающие результаты: внутриматочное введение антибиотиков не только хорошо переносится пациентками в отсутствие нежелательных или непредвиденных явлений, но и в значительной мере устраняет основные признаки ХЭ. Данные об этом приведены на рисунке 3. После подтверждения эффективности лечения и получения положительных показателей функции и состояния эндометрия пациенткам предложена стратегия наступления беременности естественным путем. В итоге естественная беременность наступила у всех трех женщин. У пациентки 1 беременность наступила через четыре месяца после внутривенных инфузий, у пациентки 2 – через два месяца, у пациентки 3 – через шесть месяцев после курса лечения. Пациентка 1 в возрасте 35 лет имела в анамнезе шесть неудачных попыток ЭКО и семь лет бесплодного брака. Пациентка 2 в возрасте 38 лет – три неудачные попытки ЭКО и пять лет бесплодного брака, пациентка 3 в возрасте 33 лет – четыре неудачные попытки ЭКО и четыре года бесплодного брака. В настоящее время у пациенток 1 и 3 протекает неосложненная беременность – 19 и 20 недель соответственно. У пациентки 2 естественная беременность после курса внутривенного введения антибиотика разрешилась рождением двойни на 37-й неделе, весом 2660 г и 2680 г, с высокими показателями по шкале Апгар.
 Рисунок 3. а Поверхность эндометрия после внутриматочного введения антибиотиков при ХЭ чистая с богато представленными пиноподиями. b Увеличенный участок изображения 3а. Обратите внимание на хорошо развитые пиноподии и небольшие скопления слизи (снизу слева)
Рисунок 3. а Поверхность эндометрия после внутриматочного введения антибиотиков при ХЭ чистая с богато представленными пиноподиями. b Увеличенный участок изображения 3а. Обратите внимание на хорошо развитые пиноподии и небольшие скопления слизи (снизу слева)
Поводом для обращения всех пациенток послужило наличие RIF и ХЭ. RIF включал в себя неудачные попытки ЭКО (от трех до шести) и продолжительность бесплодного брака (от четырех до семи лет). Все пациентки возрастом от 33 до 38 лет лечились по идентичному протоколу, включавшему в себя пероральный прием антибиотиков, контрольное обследование и внутриматочную инфузию антибактериальных препаратов в связи с подтверждением неэффективности предыдущей методики терапии. Следует подчеркнуть, что единственными различающимися компонентами в серии случаев являлись возраст и особенности анамнеза.
Все гистероскопии проведены KS. Анализ РЭМ проводился в Афинском центре инновационной микроскопии (АЦИМ), соответствующие снимки РЭМ предоставлены YN. Все микробиологические анализы проводились NN, все внутриматочные инфузии – KS.
Обсуждение и выводы
Неудовлетворительные результаты и многочисленные сообщения о противоречивых методах лечения ХЭ ясно подчеркивают недостатки существующих подходов в достижении желаемого результата по избавлению от бесплодия. Поиск оптимальной схемы лечения ХЭ продолжается до сих пор – начиная от способа введения, заканчивая интенсивностью антибактериальной терапии, ее продолжительностью, временем введения препаратов и методами оценки результатов. Врачи могут почувствовать замешательство при выборе наиболее эффективного подхода, так как представленные в настоящее время литературные данные противоречивы. Нарушения фертильности и неудачные попытки ЭКО еще больше осложняют ситуацию и подчеркивают необходимость выбора правильного и своевременного лечения. Определять и учитывать временной фактор следует отдельно, так как пациентки с нарушением фертильности получают более эффективное лечение при его выстраивании с учетом временных рамок. Кроме того, у больных с ХЭ, получающих терапию в связи с бесплодием, могут выявиться дополнительные этиологические факторы, осложняющие их ведение и приводящие к отсроченному определению диагноза.
Не будучи правильно и вовремя диагностированным, ХЭ может стать барьером для определенного числа пациенток, желающих забеременеть при помощи ЭКО. Продолжающиеся попытки ЭКО на фоне ХЭ приводят к чувству безысходности, стрессу, психологическому истощению, финансовым трудностям и впоследствии более высокому риску для здоровья пациенток [11, 12]. При неустановленной или нелеченой причине бесплодия в большинстве случаев множественные попытки не приводят к желаемой беременности. Влияние хронического эндометрита на фертильность объясняется вероятным действием микроорганизмов на рецептивность эндометрия. [13]. Говоря точнее, субпопуляции лимфоцитов и аномальная микрофлора нарушает рецептивную функцию, что впоследствии во многих случаях препятствует имплантации эмбриона. Подробный механизм полностью не изучен. Однако предполагается, что наличие микробов в полости матки представляет собой триггерный механизм для иммунной системы. Ее ответ приводит к возникновению вышеупомянутой аномальной микросреды с привлечением циркулирующих B-клеток наряду с запуском большого количества факторов воспаления [14]. Кроме того, научные данные показывают, что пораженный ХЭ эндометрий плохо отвечает на действие гормонов яичника, необходимых для обеспечения его рецептивности [14].
В исследованиях, проводимых на коровах, доказано, что внутриматочная бактериальная контаминация напрямую связана с нарушением целостности эпителия, сопровождается миграцией нейтрофилов, секрецией хемокинов и цитокинов, создавая картину персистирующего воспалительного процесса [15]. В итоге, эндокринные нарушения отражаются на эндометрии и, как можно предположить, препятствуют имплантации эмбриона [16]. При изучении эмбрионов крупного рогатого скота отмечалось сниженное количество клеток трофобласта при условии развития хронического воспаления [17].
В исследованиях внутриматочного введения антибиотиков на животной модели приводятся интересные результаты, служащие основой для нашей методики [18]. Мы отыскали несколько научных исследований, результаты которых оказались противоречивы. Как уже отмечалось выше, внутриматочные инфузии на животной модели могут быть эффективны. В то же время обнаружены и негативные результаты [20]. По неподтвержденной информации, пероральный прием антибиотиков у человека не способен вылечить ХЭ во всех случаях, с показателем неудач в 10% [21]. Напротив, местное введение антибиотиков описано как метод, обладающий большей эффективностью. Однако в различных областях медицины местное применение может сопровождаться нерешительностью со стороны врача-специалиста. Основная дилемма состоит в том, что продолжающиеся местные инфузии могут привести к развитию резистентности бактерий, и последующее системное введение не приведет к желаемому эффекту [22]. С другой стороны, местная инфузия сопровождается низким уровнем системной абсорбции наряду с мягко выраженными побочными явлениями, что придает этому способу дополнительное преимущество [23]. Решение о местном введении антибиотиков в нашей клинике было клинически целесообразным, основывалось на обнаруженных в научной литературе подтверждениях того, что локальный прием препаратов сможет заменить системный путь введения [24]. Это позволяет применять высокие концентрации лекарства, не опасаясь возникновения токсического эффекта. Кроме того, резистентность некоторых штаммов, возникшая, возможно, на фоне стандартных доз антибиотика, может быть устранена за счет местного введения предельно высокой концентрацией препарата [24]. Оба вышеупомянутых преимущества местного введения антибиотиков закладывают основу оптимальности этого нового метода.
В исследовании, проведенном на коровах, обнаружено большое количество явлений, способствующих анализу механизма, который мог бы пролить свет на внутриматочные инфузии антибиотиков. Присутствие патогенов в полости матки снизилось, воспалительный процесс прекратился, повысилась местная иммунная защита, что в конечном итоге привело к восстановлению эндометрия [25]. Подобные результаты могут аналогично наблюдаться и в организме человека.
Неэффективность первоначального перорального курса антибиотиков была доказана микробиологически и гистологически: оба анализа выявили персистирование ХЭ при незначительном улучшении картины. РЭС затем также подтвердил незначительный эффект лечения ХЭ. Все три пациентки испытывали чувство безысходности и беспокойства за временной фактор, учитывая неудачные попытки ЭКО в прошлом и соответствующий возраст. Но они упорно следовали рекомендованному нашей командой курсу лечения нарушения фертильности и поддерживали нас в поиске альтернативных способов достижения желаемого результата. Местное введение антибиотиков в полость матки – целесообразный метод, основанный на упомянутых ранее данных научных публикаций. Авторы не берутся заявлять, что новый метод основывался на полностью подтвержденной безопасности продукта, так как результаты соответствующих исследований эффективности и безопасности метода на животной модели могут рассматриваться как противоречивые [19, 20]. Таким образом, авторы действовали по информированному решению и основывали новый метод лечения серии случаев на опубликованных исследованиях внутриматочного введения антибиотика на животной модели, подтверждавших его эффективность и безопасность. Необходимо также отметить, что, по мнению врачей, лечение таких пациенток с ХЭ достигло своего плато. Такая установка может привести к дальнейшим попыткам ЭКО с риском их злоупотребления, а это в свою очередь – к исследованию проблемы суррогатного материнства при нерецептивном эндометрии пациентки.
До согласования предстоящего лечения подробно обсуждался вопрос безопасности метода. Ключевым моментом являлся риск возникновения резистентности. Наши результаты показывают, что представленная новейшая методика значительно улучшает состояние эндометрия у пациенток, а пероральные антибиотики, принятые как первая линия терапии, не привели к удовлетворительным результатам. В итоге у всех пациенток после нескольких лет бесплодного брака и неудачных попыток ЭКО наступила беременность естественным путем. Однако наше исследование не проливает свет на данную проблему. Для определения длительности полученного эффекта, его постоянства, оптимальной периодичности лечения, объема и адекватной схемы антибиотикотерапии требуется провести рандомизированные клинические исследования. Также нельзя забывать о рисках, связанных с вырабатываемыми бактериями факторами резистентности, особенно в случаях неоптимальных (при этом продолжающихся) методов лечения ХЭ. Местное лечение антибиотиками – распространенная практика, дающая хорошие результаты. В случае местного введения существует вероятность снижения рисков, характерных для перорального введения, о чем упоминалось выше. Подтверждение того, что польза перевешивает риски, может послужить основой внедрения этого новейшего метода в практику.
Оптимальная корректировка настоящих методов и оценка новых схем лечения, опробованных на животной модели, может открыть перспективы для исследований. Нашим приоритетом остается эффективность и безопасность. Считаем строго обязательной скрупулезную проверку схемы лечения на обоснованность и правомерность, что было бы подтверждено научным сообществом.
Представленная серия случаев не может считаться убедительным основанием назначения внутриматочной инфузии антибиотиков, но подчеркивает необходимость разработки новых подходов к ведению пациенток с ХЭ в контексте лечения бесплодия. Дальнейшее подтверждение наших результатов на более обширной выборке пациенток может зарекомендовать наш метод как эффективный и возможно наиболее предпочтительный для лечения больных с ХЭ, а также расширить существующие медицинские представления. Метод особенно важен в тех случаях, когда обычные схемы приема, занимающие продолжительное время, а также многочисленные неудачные попытки ЭКО на фоне неэффективного лечения ХЭ представляют опасность для репродуктивного здоровья женщины.
Список литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Константинос Сфакианоудис, Мара Симопулу, Йоргос Никас, Анна Рапани, Николаос Ницос, Катерина Пьерули, Афанасий Паппас, Агни Панту, Кристина Маркомичали, Майкл Куцилерис, Константинос Пантос
BMC Women's Health201818:197
Аннотация
Введение
Ранняя диагностика и эффективное лечение хронического эндометрита (ХЭ) у пациенток, проходящих лечение в связи с нарушением фертильности, – две ключевые цели каждого специалиста. Лечение антибиотиками демонстрирует хорошие результаты с учетом способности эндометрия обновляться. Однако несмотря на повышение результативности экстракорпорального оплодотворения (ЭКО), убедительные рекомендации по терапии еще не выработаны, а оптимальный метод лечения пока отсутствует. Данная работа представляет собой первую публикацию об эффективном методе внутриматочного введения антибиотиков для лечения ХЭ при решении проблемы бесплодия.
Описание случаев
Мы представим информацию о трех пациентках с тремя неудачными попытками ЭКО в анамнезе на фоне диагностированного ХЭ, в прошлом не получавших эффективного лечения. После первичной консультации в нашей клинике и уточнения диагноза «ХЭ» пациенткам назначен пероральный прием антибиотиков с учетом выявленного возбудителя. При контрольном обследовании выявлены незначительные улучшения в микрофлоре эндометрия, но воспалительный процесс продолжался. В качестве альтернативы пациенткам был предложен внутриматочный метод введения антибиотика. У всех женщин в итоге наступила беременность после короткого периода лечения, у одной пациентки родилась живая двойня, у двух других беременность на момент написания статьи еще протекала.
Выводы
Описание серии случаев расширяет медицинские представления как об эффективном лечении ХЭ, так и о ведении пациенток с бесплодием на фоне этого заболевания. Современная традиция назначения перорального приема антибиотиков при ХЭ подчеркивает необходимость поиска новых решений и требует более глубоких исследований его применения в клинической практике. Новый способ стимулирует возможность естественного зачатия у пациенток с повторными неудачными имплантациями (recurrent implantation failure, RIF) после нескольких попыток ЭКО. Метод представляется важным как альтернативный способ лечения и требует дальнейшего изучения.
Ключевые слова
- Хронический эндометрит
- Антибиотики
- Внутриматочное введение
- Естественное оплодотворение
Хронический эндометрит (ХЭ) – серьезная патология, вызывающая нарушение фертильности у 12–46% пациенток [1]. Воспаление эндометрия – основная особенность данного заболевания, характеризующаяся высоким содержанием в эндометрии плазматических клеток наряду с несколькими возбудителями инфекции, приводящими к соответствующей симптоматике [2]. Вопрос о тесной взаимосвязи ХЭ и бесплодия до недавнего времени не рассматривался и не вызывал интереса у специалистов.
По причине своей сложности диагностика и лечение ХЭ занимают немало времени. Предложенный изначально метод гистологического исследования биопсийного материала эндометрия до сих пор остается золотым стандартом в арсенале врачей [3]. Однако при наличии в норме воспалительных клеток в эндометрии выявление ХЭ представляет собой определенные трудности. Проведение жидкостной гистероскопии как вспомогательного метода диагностики может выявить микрополипы, стромальный отек, локальную или диффузную гиперемию [4]. Корреляция ХЭ и наличия эозинофилов в эндометрии, а также антител CD138 плазматических клеток является более достоверным методом подтверждения диагноза [5]. Назрела необходимость выработки четких критериев для постановки диагноза и наиболее оптимальных методов диагностики, сроков лечения и показателей выздоровления.
Так, в частности, при проведении попыток ЭКО ХЭ обнаруживается у 42% женщин с RIF [6]. Рецептивность эндометрия – фактора, оказывающего огромное влияние на исход ЭКО – снижается в условиях нарушенной микрофлоры, наблюдаемой при ХЭ [7]. У пациенток с хроническим эндометритом и RIF процент успешных ЭКО очень низок. Слабовыраженный ХЭ трудно диагностировать [3], особенно у направленных на ЭКО пациенток, для которых фактор времени имеет принципиальное значение. Безусловно, врачи заинтересованы в составных методах диагностики для точной интерпретации имеющихся признаков заболевания.
Лечение ХЭ предполагает прием различных антибиотиков в зависимости от типа выявленного возбудителя. Вначале антибактериальные препараты назначаются перорально, по завершении курса анализируется состояние эндометрия. Необходимо подчеркнуть, что помимо различий в группах назначаемых антибиотиков для каждого конкретного случая подбираются свои дозировки и схемы приема. Ожидается, что после курса антибиотиков рецептивность эндометрия восстановится. Однако в научной литературе отсутствуют данные о значимой корреляции между лечением антибиотиками и успешными результатами ЭКО, то есть утверждение, что антибактериальная терапия способствует наступлению беременности после ЭКО, можно считать несостоятельным [8, 9].
Иммунный ответ при ХЭ редко приводит к системному воспалению [10], поэтому у нашей группы экспертов назрел вопрос о целесообразности выбора системного пути введения антибиотика. В настоящей статье мы приводим серию клинических случаев с тремя пациентками, которым проведено внутриматочное введение антибиотика после неэффективного перорального курса. Цель работы – обратить внимание врачей на альтернативный новый метод, предполагающий внутриматочное введение антибиотиков у таких пациенток и обладающий в совокупности с нынешними методиками серьезными преимуществами как обоснованный, надежный и эффективный способ лечения ХЭ.
Описание клинических случаев
У всех пациенток, поступивших к нам в клинику, в прошлом имелись несколько неудачных попыток ЭКО и диагноз «ХЭ». Они обследовались как женщины с RIF. Проходимость маточных труб подтверждена у всех пациенток. Результаты спермограмм партнеров исключили роль мужского фактора. В довершение к этому, для соответствия критериям возможности естественного зачатия определялись показатели фолликулостимулирующего (ФСГ), лютеинизирующего (ЛГ) и антимюллерова (АГ) гормонов. В частности, уровень ФСГ у трех пациенток следующий: пациентка 1 – 5,12 мМЕ/мл, пациентка 2 – 3,1 мМЕ/мл, пациентка 3 – 5,81 мМЕ/мл. Уровни АМГ распределились следующим образом: пациентка 1 – 18 нг/мл, пациентка 2 – 26 нг/мл, пациентка 3 – 20 нг/мл. Сделан вывод, что снижение фертильности связано с ХЭ, так как гистологический анализ биопсийного материала эндометрия и микробиологический анализ подтвердили наличие эндометрита (рисунок 1). В следующем разделе описана схожая для всех трех пациенток стратегия лечения. Приведена подробная информация о протоколах ведения, применяемых при ХЭ, его диагностике и лечении при нарушении фертильности.
 Рисунок 1. a Микроснимок растрового электронного микроскопа поверхности эндометрия пациентки с ХЭ. Обратите внимание на тонкий слизистый слой (справа), содержащий участки некроза и красные кровяные клетки. b Увеличенный участок изображения 1а. Слизь и многочисленные бактерии плотно осели в микроворсинках и ресничках эпителиальных клеток эндометрия
Рисунок 1. a Микроснимок растрового электронного микроскопа поверхности эндометрия пациентки с ХЭ. Обратите внимание на тонкий слизистый слой (справа), содержащий участки некроза и красные кровяные клетки. b Увеличенный участок изображения 1а. Слизь и многочисленные бактерии плотно осели в микроворсинках и ресничках эпителиальных клеток эндометрияДиагностическая гистероскопия
Все пациентки проходили диагностическую гистероскопию в фолликулярную фазу менструального цикла с использованием линзового мини-гистероскопа внешним диаметром 3 мм с углом обзора 1058 градусов, с 3,5 диагностическим тубусом односторонней подачи жидкости 3,5 мм. Для расширения полости матки подавался физиологический раствор, уровень освещения – 300 Вт ксеноновой лампой, использовалась цифровая камера, выводившая изображение на цветной монитор диагональю 21 дюйм. Достигнут панорамный обзор полости матки, проведено детальное обследование слизистой эндометрия. Во всех случаях подтвержден диагноз эндометрита, на фоне полипоидного эндометрия, микрополипов, отека стромы и диффузной гиперемии.
Биопсия эндометрия
С целью идентификации микробного агента производилась биопсия эндометрия с использованием 3 мм кюретты Novak, соединенной с шприцом емкостью 20 мл. Для снижения риска контаминации после установки гинекологического зеркала и обработки шейки матки раствором йода, канюля Novak вводилась в полость матки под четким визуальным контролем, избегая любых соприкосновений со стенками влагалища. Образцы эндометрия замачивались в 2 мл физиологического раствора и разделялись на две части – для гистологического и микробиологического анализов.
Гистологический анализ
Для фиксации гистологического материала образцов эндометрия применялся нейтральный формалин и парафин. Окраска микросрезов проводилась гемотоксилином-эозионом. Важнейшими признаками наличия ХЭ считались повышение плотности стромы, поверхностный стромальный отек и плейоморфное воспаление стромы.
Микробиологический анализ
Образцы эндометрия после окраски по Граму помещались на агаровую среду, основу колумбийского агара с 5% содержанием крови овцы, шоколадный агар, солевой агар с маннитом и агар МакКонки (Bio Merieux, Рим, Италия). Перед анализом образцы выдерживались 48 часов на воздухе или в 5% СО2. Идентификация бактерий проводилась по опубликованным критериям (Dade International Inc., Милан, Италия). Анализ выявил наличие Mycoplasma species и Ureaplasma urealyticum, описывающихся в литературе как наиболее частые возбудители ХЭ.
Пероральная схема приема антибиотиков
На основе выявленного возбудителя и определения его чувствительности к антибиотикам назначался соответствующий препарат. Следуя клиническим рекомендациям и отработанным методикам нашей клиники, мы включали в схему лечения доксициклин. Курс перорального приема этого антибиотика составлял 21 день.
Контрольный осмотр и внутриматочное введение антибиотика
После традиционного метода лечения ХЭ, включающего пероральный прием антибиотиков, повторные гистологический и микробиологический анализы выявили частичное снижение выраженности ХЭ. Тем не менее значительного положительного эффекта достигнуто не было, результаты можно было назвать в целом неудовлетворительными. У всех трех пациенток после перорального курса приема антибиотиков состояние эндометрия улучшалось незначительно, так как гистологический и микробиологический анализы подтвердили наличие воспалительного процесса и микробных агентов. Растровый электронный микроскоп (РЭМ) выявил слабое улучшение, но в целом патологическая картина сохранилась (рисунок 2).
 Рисунок 2. а Поверхность эндометрия после лечения ХЭ пероральным курсом антибиотика. Обратите внимание на волокна слизистой (нижняя часть фото) и конгломераты красных кровяных телец (верхняя часть фото). b Увеличенный участок изображения 2а. Отложения фибрина с красными кровяными тельцами (посередине), по-видимому, образующегося путем диапедеза, и отдельные бактерии (посередине, нижняя часть фото), заметные на эпителии
Рисунок 2. а Поверхность эндометрия после лечения ХЭ пероральным курсом антибиотика. Обратите внимание на волокна слизистой (нижняя часть фото) и конгломераты красных кровяных телец (верхняя часть фото). b Увеличенный участок изображения 2а. Отложения фибрина с красными кровяными тельцами (посередине), по-видимому, образующегося путем диапедеза, и отдельные бактерии (посередине, нижняя часть фото), заметные на эпителииВ целях более эффективного лечения истинной причины ХЭ мы предложили пациенткам методику внутриматочного введения антибиотика. Перед процедурой все пациентки подписали добровольное информированное согласие на внутриматочное введение препаратов. Совет по вопросам этики клиники «Генезис» в Афинах одобрил протокол исследования, подтвердив его соответствие Хельсинской декларации.
Содержание дизайна исследования отражало протокол лечения. В соответствии с рекомендациями по приему ципроксина, приводящимися в свидетельстве дополнительной охраны антибактериального препарата, лечение антибиотиком воспалительных заболеваний органов малого таза (ВЗОМТ) должно длиться 10 дней. Исходя из этого, лечение продолжалось 10 дней. Однако при этом внутриматочное введение не может осуществляться 10 дней подряд. Инфузии выполнялись каждые три дня, потому что жидкость от предыдущего введения визуализировалась в полости матки на второй день после процедуры, исчезая лишь на третий день. Следовательно, весь курс составил один месяц, в течение которого выполнено 10 введений лекарств через одинаковый промежуток времени. Объем инфузии составлял 3–4 мл, что соответствует максимальному объему полости матки. Вводился раствор ципрофлоксацина для внутривенных инъекций в концентрации 200 мг / 100 мл. Процедура осуществлялась 23 см катетером для переноса эмбрионов.
После курса проведенной терапии производился контрольный осмотр пациенток в фолликулярной фазе следующего менструального цикла, включавший в себя биопсию эндометрия для гистологического и микробиологического анализов упомянутым ранее способом. Получены многообещающие результаты: внутриматочное введение антибиотиков не только хорошо переносится пациентками в отсутствие нежелательных или непредвиденных явлений, но и в значительной мере устраняет основные признаки ХЭ. Данные об этом приведены на рисунке 3. После подтверждения эффективности лечения и получения положительных показателей функции и состояния эндометрия пациенткам предложена стратегия наступления беременности естественным путем. В итоге естественная беременность наступила у всех трех женщин. У пациентки 1 беременность наступила через четыре месяца после внутривенных инфузий, у пациентки 2 – через два месяца, у пациентки 3 – через шесть месяцев после курса лечения. Пациентка 1 в возрасте 35 лет имела в анамнезе шесть неудачных попыток ЭКО и семь лет бесплодного брака. Пациентка 2 в возрасте 38 лет – три неудачные попытки ЭКО и пять лет бесплодного брака, пациентка 3 в возрасте 33 лет – четыре неудачные попытки ЭКО и четыре года бесплодного брака. В настоящее время у пациенток 1 и 3 протекает неосложненная беременность – 19 и 20 недель соответственно. У пациентки 2 естественная беременность после курса внутривенного введения антибиотика разрешилась рождением двойни на 37-й неделе, весом 2660 г и 2680 г, с высокими показателями по шкале Апгар.
 Рисунок 3. а Поверхность эндометрия после внутриматочного введения антибиотиков при ХЭ чистая с богато представленными пиноподиями. b Увеличенный участок изображения 3а. Обратите внимание на хорошо развитые пиноподии и небольшие скопления слизи (снизу слева)
Рисунок 3. а Поверхность эндометрия после внутриматочного введения антибиотиков при ХЭ чистая с богато представленными пиноподиями. b Увеличенный участок изображения 3а. Обратите внимание на хорошо развитые пиноподии и небольшие скопления слизи (снизу слева)Поводом для обращения всех пациенток послужило наличие RIF и ХЭ. RIF включал в себя неудачные попытки ЭКО (от трех до шести) и продолжительность бесплодного брака (от четырех до семи лет). Все пациентки возрастом от 33 до 38 лет лечились по идентичному протоколу, включавшему в себя пероральный прием антибиотиков, контрольное обследование и внутриматочную инфузию антибактериальных препаратов в связи с подтверждением неэффективности предыдущей методики терапии. Следует подчеркнуть, что единственными различающимися компонентами в серии случаев являлись возраст и особенности анамнеза.
Все гистероскопии проведены KS. Анализ РЭМ проводился в Афинском центре инновационной микроскопии (АЦИМ), соответствующие снимки РЭМ предоставлены YN. Все микробиологические анализы проводились NN, все внутриматочные инфузии – KS.
Обсуждение и выводы
Неудовлетворительные результаты и многочисленные сообщения о противоречивых методах лечения ХЭ ясно подчеркивают недостатки существующих подходов в достижении желаемого результата по избавлению от бесплодия. Поиск оптимальной схемы лечения ХЭ продолжается до сих пор – начиная от способа введения, заканчивая интенсивностью антибактериальной терапии, ее продолжительностью, временем введения препаратов и методами оценки результатов. Врачи могут почувствовать замешательство при выборе наиболее эффективного подхода, так как представленные в настоящее время литературные данные противоречивы. Нарушения фертильности и неудачные попытки ЭКО еще больше осложняют ситуацию и подчеркивают необходимость выбора правильного и своевременного лечения. Определять и учитывать временной фактор следует отдельно, так как пациентки с нарушением фертильности получают более эффективное лечение при его выстраивании с учетом временных рамок. Кроме того, у больных с ХЭ, получающих терапию в связи с бесплодием, могут выявиться дополнительные этиологические факторы, осложняющие их ведение и приводящие к отсроченному определению диагноза.
Не будучи правильно и вовремя диагностированным, ХЭ может стать барьером для определенного числа пациенток, желающих забеременеть при помощи ЭКО. Продолжающиеся попытки ЭКО на фоне ХЭ приводят к чувству безысходности, стрессу, психологическому истощению, финансовым трудностям и впоследствии более высокому риску для здоровья пациенток [11, 12]. При неустановленной или нелеченой причине бесплодия в большинстве случаев множественные попытки не приводят к желаемой беременности. Влияние хронического эндометрита на фертильность объясняется вероятным действием микроорганизмов на рецептивность эндометрия. [13]. Говоря точнее, субпопуляции лимфоцитов и аномальная микрофлора нарушает рецептивную функцию, что впоследствии во многих случаях препятствует имплантации эмбриона. Подробный механизм полностью не изучен. Однако предполагается, что наличие микробов в полости матки представляет собой триггерный механизм для иммунной системы. Ее ответ приводит к возникновению вышеупомянутой аномальной микросреды с привлечением циркулирующих B-клеток наряду с запуском большого количества факторов воспаления [14]. Кроме того, научные данные показывают, что пораженный ХЭ эндометрий плохо отвечает на действие гормонов яичника, необходимых для обеспечения его рецептивности [14].
В исследованиях, проводимых на коровах, доказано, что внутриматочная бактериальная контаминация напрямую связана с нарушением целостности эпителия, сопровождается миграцией нейтрофилов, секрецией хемокинов и цитокинов, создавая картину персистирующего воспалительного процесса [15]. В итоге, эндокринные нарушения отражаются на эндометрии и, как можно предположить, препятствуют имплантации эмбриона [16]. При изучении эмбрионов крупного рогатого скота отмечалось сниженное количество клеток трофобласта при условии развития хронического воспаления [17].
В исследованиях внутриматочного введения антибиотиков на животной модели приводятся интересные результаты, служащие основой для нашей методики [18]. Мы отыскали несколько научных исследований, результаты которых оказались противоречивы. Как уже отмечалось выше, внутриматочные инфузии на животной модели могут быть эффективны. В то же время обнаружены и негативные результаты [20]. По неподтвержденной информации, пероральный прием антибиотиков у человека не способен вылечить ХЭ во всех случаях, с показателем неудач в 10% [21]. Напротив, местное введение антибиотиков описано как метод, обладающий большей эффективностью. Однако в различных областях медицины местное применение может сопровождаться нерешительностью со стороны врача-специалиста. Основная дилемма состоит в том, что продолжающиеся местные инфузии могут привести к развитию резистентности бактерий, и последующее системное введение не приведет к желаемому эффекту [22]. С другой стороны, местная инфузия сопровождается низким уровнем системной абсорбции наряду с мягко выраженными побочными явлениями, что придает этому способу дополнительное преимущество [23]. Решение о местном введении антибиотиков в нашей клинике было клинически целесообразным, основывалось на обнаруженных в научной литературе подтверждениях того, что локальный прием препаратов сможет заменить системный путь введения [24]. Это позволяет применять высокие концентрации лекарства, не опасаясь возникновения токсического эффекта. Кроме того, резистентность некоторых штаммов, возникшая, возможно, на фоне стандартных доз антибиотика, может быть устранена за счет местного введения предельно высокой концентрацией препарата [24]. Оба вышеупомянутых преимущества местного введения антибиотиков закладывают основу оптимальности этого нового метода.
В исследовании, проведенном на коровах, обнаружено большое количество явлений, способствующих анализу механизма, который мог бы пролить свет на внутриматочные инфузии антибиотиков. Присутствие патогенов в полости матки снизилось, воспалительный процесс прекратился, повысилась местная иммунная защита, что в конечном итоге привело к восстановлению эндометрия [25]. Подобные результаты могут аналогично наблюдаться и в организме человека.
Неэффективность первоначального перорального курса антибиотиков была доказана микробиологически и гистологически: оба анализа выявили персистирование ХЭ при незначительном улучшении картины. РЭС затем также подтвердил незначительный эффект лечения ХЭ. Все три пациентки испытывали чувство безысходности и беспокойства за временной фактор, учитывая неудачные попытки ЭКО в прошлом и соответствующий возраст. Но они упорно следовали рекомендованному нашей командой курсу лечения нарушения фертильности и поддерживали нас в поиске альтернативных способов достижения желаемого результата. Местное введение антибиотиков в полость матки – целесообразный метод, основанный на упомянутых ранее данных научных публикаций. Авторы не берутся заявлять, что новый метод основывался на полностью подтвержденной безопасности продукта, так как результаты соответствующих исследований эффективности и безопасности метода на животной модели могут рассматриваться как противоречивые [19, 20]. Таким образом, авторы действовали по информированному решению и основывали новый метод лечения серии случаев на опубликованных исследованиях внутриматочного введения антибиотика на животной модели, подтверждавших его эффективность и безопасность. Необходимо также отметить, что, по мнению врачей, лечение таких пациенток с ХЭ достигло своего плато. Такая установка может привести к дальнейшим попыткам ЭКО с риском их злоупотребления, а это в свою очередь – к исследованию проблемы суррогатного материнства при нерецептивном эндометрии пациентки.
До согласования предстоящего лечения подробно обсуждался вопрос безопасности метода. Ключевым моментом являлся риск возникновения резистентности. Наши результаты показывают, что представленная новейшая методика значительно улучшает состояние эндометрия у пациенток, а пероральные антибиотики, принятые как первая линия терапии, не привели к удовлетворительным результатам. В итоге у всех пациенток после нескольких лет бесплодного брака и неудачных попыток ЭКО наступила беременность естественным путем. Однако наше исследование не проливает свет на данную проблему. Для определения длительности полученного эффекта, его постоянства, оптимальной периодичности лечения, объема и адекватной схемы антибиотикотерапии требуется провести рандомизированные клинические исследования. Также нельзя забывать о рисках, связанных с вырабатываемыми бактериями факторами резистентности, особенно в случаях неоптимальных (при этом продолжающихся) методов лечения ХЭ. Местное лечение антибиотиками – распространенная практика, дающая хорошие результаты. В случае местного введения существует вероятность снижения рисков, характерных для перорального введения, о чем упоминалось выше. Подтверждение того, что польза перевешивает риски, может послужить основой внедрения этого новейшего метода в практику.
Оптимальная корректировка настоящих методов и оценка новых схем лечения, опробованных на животной модели, может открыть перспективы для исследований. Нашим приоритетом остается эффективность и безопасность. Считаем строго обязательной скрупулезную проверку схемы лечения на обоснованность и правомерность, что было бы подтверждено научным сообществом.
Представленная серия случаев не может считаться убедительным основанием назначения внутриматочной инфузии антибиотиков, но подчеркивает необходимость разработки новых подходов к ведению пациенток с ХЭ в контексте лечения бесплодия. Дальнейшее подтверждение наших результатов на более обширной выборке пациенток может зарекомендовать наш метод как эффективный и возможно наиболее предпочтительный для лечения больных с ХЭ, а также расширить существующие медицинские представления. Метод особенно важен в тех случаях, когда обычные схемы приема, занимающие продолжительное время, а также многочисленные неудачные попытки ЭКО на фоне неэффективного лечения ХЭ представляют опасность для репродуктивного здоровья женщины.
Список литературы
- Takebayashi A, Kimura F, Kishi Y, Ishida M, Takahashi A, Yamanaka A, Takahashi K, Suginami H, Murakami T. The association between endometriosis and chronic endometritis. PLoS One. 2014;9(2):e88354. ViewArticlePubMedPubMedCentralGoogle Scholar
- McQueen DB, Perfetto CO, Hazard FK, Lathi RB. Pregnancy outcomes in women with chronic endometritis and recurrent pregnancy loss. Fertil Steril. 2015;104(4):927–31. ViewArticlePubMedGoogle Scholar
- Kasius J, Broekmans F, Sie-Go D, Bourgain C, Eijkemans M, Fauser B, Devroey P, Fatemi H. The reliability of the histological diagnosis of endometritis in asymptomatic IVF cases: a multicenter observer study. Hum Reprod. 2011;27(1):153–8. ViewArticlePubMedGoogle Scholar
- Cicinelli E, Matteo M, Tinelli R, Pinto V, Marinaccio M, Indraccolo U, De Ziegler D, Resta L. Chronic endometritis due to common bacteria is prevalent in women with recurrent miscarriage as confirmed by improved pregnancy outcome after antibiotic treatment. Reprod Sci. 2014;21(5):640–7. ViewArticlePubMedPubMedCentralGoogle Scholar
- Park HJ, Kim YS, Yoon TK, Lee WS. Chronic endometritis and infertility. Clin Exp Reprod Med. 2016;43(4):185–92. ViewArticlePubMedPubMedCentralGoogle Scholar
- Romero R, Espinoza J, Mazor M. Can endometrial infection/inflammation explain implantation failure, spontaneous abortion, and preterm birth after in vitro fertilization? Fertil Steril. 2004;82(4):799–804. ViewArticlePubMedGoogleScholar
- Matteo M, Cicinelli E, Greco P, Massenzio F, Baldini D, Falagario T, Rosenberg P, Castellana L, Specchia G, Liso A. Abnormal pattern of lymphocyte subpopulations in the endometrium of infertile women with chronic endometritis. Am J Reprod Immunol. 2009;61(5):322–9. ViewArticlePubMedGoogle Scholar
- Lamonica R, Hartnett J, Engmann L, Sanders M, Maier D, Benadiva C. P-389: immunohistochemistry confirms the presence of chronic endometritis in patients with recurrent implantation failure. Fertil Steril. 2006;86(3):S280. ViewArticleGoogle Scholar
- Johnston-MacAnanny EB, Hartnett J, Engmann LL, Nulsen JC, Sanders MM, Benadiva CA. Chronic endometritis is a frequent finding in women with recurrent implantation failure after in vitro fertilization. Fertil Steril. 2010;93(2):437–41. ViewArticlePubMedGoogle Scholar
- Kushnir VA, Solouki S, Sarig-Meth T, Vega MG, Albertini DF, Darmon SK, Deligdisch L, Barad DH, Gleicher N. Systemic inflammation and autoimmunity in women with chronic endometritis. Am J Reprod Immunol. 2016;75(6):672–7. ViewArticlePubMedGoogle Scholar
- Slade P, Emery J, Lieberman B. A prospective, longitudinal study of emotions and relationships in in-vitro fertilization treatment. Hum Reprod (Oxford, England). 1997;12(1):183–90. ViewArticleGoogle Scholar
- Verhaak C, Smeenk J, Van Minnen A, Kremer J, Kraaimaat F. A longitudinal, prospective study on emotional adjustment before, during and after consecutive fertility treatment cycles. Hum Reprod. 2005;20(8):2253–60. ViewArticlePubMedGoogle Scholar
- Wold ASD, Pham N, Arici A. Anatomic factors in recurrent pregnancy loss. In: Seminars in reproductive medicine: 2006: copyright© 2006 by Thieme medical publishers, Inc., 333 seventh avenue, New York, NY 10001, USA.; 2006: 025–032. Google Scholar
- Kitaya K, Takeuchi T, Mizuta S, Matsubayashi H, Ishikawa T. Endometritis: new time, new concepts. Fertility and Sterility. 2018;110(3):344–50. ViewArticlePubMedGoogleScholar
- Sheldon I, Noakes D, Rycroft A, Pfeiffer D, Dobson H. Influence of uterine bacterial contamination after parturition on ovarian dominant follicle selection and follicle growth and function in cattle. Reproduction. 2002;123(6):837–45. ViewArticlePubMedGoogle Scholar
- Sheldon I, Price S, Cronin J, Gilbert R, Gadsby J. Mechanisms of infertility associated with clinical and subclinical endometritis in high producing dairy cattle. Reprod Domest Anim. 2009;44:1–9. ViewArticlePubMedGoogle Scholar
- Hill J, Gilbert R. Reduced quality of bovine embryos cultured in media conditioned by exposure to an inflamed endometrium. Aust Vet J. 2008;86(8):312–6. ViewArticlePubMedGoogle Scholar
- Denis-Robichaud J, Dubuc J. Randomized clinical trial of intrauterine cephapirin infusion in dairy cows for the treatment of purulent vaginal discharge and cytological endometritis. J Dairy Sci. 2015;98(10):6856–64. ViewArticlePubMedGoogle Scholar
- Brick TA, Schuenemann GM, Bas S, Daniels JB, Pinto C, Rings DM, Rajala-Schultz PJ. Effect of intrauterine dextrose or antibiotic therapy on reproductive performance of lactating dairy cows diagnosed with clinical endometritis. J Dairy Sci. 2012;95(4):1894–905. ViewArticlePubMedGoogle Scholar
- Machado V, Oikonomou G, Ganda E, Stephens L, Milhomem M, Freitas G, Zinicola M, Pearson J, Wieland M, Guard C. The effect of intrauterine infusion of dextrose on clinical endometritis cure rate and reproductive performance of dairy cows. J Dairy Sci. 2015;98(6):3849–58. ViewArticlePubMedGoogle Scholar
- French L. Prevention and treatment of postpartum endometritis. Curr Women's Health Rep. 2003;3(4):274–9. Google Scholar
- Gelmetti C. Local antibiotics in dermatology. Dermatol Ther. 2008;21(3):187–95. ViewArticlePubMedGoogle Scholar
- Ha KR, Psaltis AJ, Butcher AR, Wormald PJ, Tan LW. In vitro activity of mupirocin on clinical isolates of Staphylococcus aureus and its potential implications in chronic rhinosinusitis. Laryngoscope. 2008;118(3):535–40. ViewArticlePubMedGoogle Scholar
- Hanssen AD. Local antibiotic delivery vehicles in the treatment of musculoskeletal infection. Clin Orthop Relat Res. 2005;437:91–6. ViewArticleGoogle Scholar
- Lefebvre RC, Stock AE. Therapeutic efficiency of antibiotics and prostaglandin F2α in postpartum dairy cows with clinical endometritis: an evidence-based evaluation. Vet Clin Food Anim Pract. 2012;28(1):79–96. ViewArticleGoogle Scholar
- Smith AD, Tilling K, Nelson SM, Lawlor DA. Live-birth rate associated with repeat in vitro fertilization treatment cycles. Jama. 2015;314(24):2654–62. ViewArticlePubMedPubMedCentralGoogle Scholar





