2646
15 Июня 2021
Авторское право © 2017, Andrzej Bożek
Связаться с автором Посмотреть профиль на ORCID Krzysztof Kołodziejczyk,Renata Kozłowska и Giorgio Walter Canonica (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0
Анджей Бошек, Кшиштоф Колодзейчик, Рената Козловска, Джорджо Вальтер Каноника
Clinical and Translational Allergy20177:43
Аннотация
Введение
Целесообразность проведения аллерген-специфической иммунотерап...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0
Анджей Бошек, Кшиштоф Колодзейчик, Рената Козловска, Джорджо Вальтер Каноника
Clinical and Translational Allergy20177:43
Аннотация
Введение
Целесообразность проведения аллерген-специфической иммунотерап...
Авторское право © 2017, Andrzej Bożek
Связаться с автором Посмотреть профиль на ORCID Krzysztof Kołodziejczyk,Renata Kozłowska и Giorgio Walter Canonica (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0
Анджей Бошек, Кшиштоф Колодзейчик, Рената Козловска, Джорджо Вальтер Каноника
Clinical and Translational Allergy20177:43
Аннотация
Введение
Целесообразность проведения аллерген-специфической иммунотерапии (АСИТ) у пожилых пациентов является спорной. На данный момент отсутствует достаточное количество данных в поддержку безопасности и эффективности этого метода лечения для исследуемой популяции. Целью данного исследования была оценка безопасности и эффективности АСИТ аллергенами клещей домашней пыли у пациентов старше 65 лет с аллергическим ринитом (АР) и подтвержденной аллергией на клещей домашней пыли. Первичной конечной точкой являлось отклонение от исходного уровня средней разницы средних значений по усредненной скорректированной шкале оценки симптомов (average adjusted symptom score, AAdSS) и по общему результату по комбинированной шкале оценки ринита (total combined rhinitis score, TCRS), вычисленных методом наименьших квадратов, в группе активного препарата в сравнении с группой плацебо.
Методы
Пятьдесят восемь пациентов пожилого возраста с АР и моносенсибилизацией к аллергенам клещей домашней пыли прошли индивидуальную рандомизацию и поделены на две группы с сопоставимым количеством участников. Проводились следующие вмешательства: два года круглогодичной АСИТ препаратом Пуретал Майтс (PURETHAL Mites) или плацебо. Симптомы и баллы по шкале необходимости приема препарата представлены в виде баллов по шкалам AAdSS и TCRS. Качество жизни контролировали по опроснику качества жизни при риноконъюнктивите (rhinoconjunctivitis quality of life questionnaire, RQLQ), по реакции на провокацию назальным аллергеном, по уровню аллерген-специфических IgG4 сыворотки крови к D. pteronyssinus и D. farinae и Der p1 и Der p2. Анализировали популяцию ITT (intent-to-treat, популяция всех рандомизированных для лечения пациентов).
Результаты
Через 24 месяца после начала АСИТ оценка по шкале AAdSS значительно снизилась с 4,27 ± 1,58 баллов до 1,82 ± 0,71 (p <0,05). Оценка по TCRS значительно снизилась через два года после начала АСИТ. В период проведения АСИТ в исследуемой группе повысился уровень специфических IgG4 сыворотки крови против D. pteronyssinus, D. farinae, Der p1, и Der p2. У пациентов, получавших АСИТ, показатели по шкале опросника RQLQ существенно улучшились – с 1,86 (95% ДИ 1,51–1,78) до 1,26 (95% ДИ 1,09–1,55). За время проведения АСИТ в группе активного препарата были зарегистрировано две легкие системные анафилактические реакции (I степени) после инъекций.
Выводы
Результаты двойного слепого плацебо-контролируемого исследования показали, что АСИТ аллергенами клещей домашней пыли эффективна и безопасна при применении у пациентов пожилого возраста с аллергическим ринитом.
Регистрация исследования
Настоящее рандомизированное двойное слепое плацебо-контролируемое исследование проводилось в одном центре (номер в базе данных ClinicalTrials.gov NCT03209245)
Ключевые слова: иммунотерапия, аллергический ринит, пожилой возраст, клещи домашней пыли.
Введение
Значимость аллергического ринита у пожилых пациентов часто недооценена. Рекомендации по диагностике и лечению аллергических заболеваний редко фокусируются на популяции пожилых людей и часто полностью ее игнорируют. Тем не менее, аллергический ринит и астма, вызванные ингаляционными аллергенами, такими как аллергены клещей домашней пыли (КДП) чаще встречаются именно у пациентов старше 65 лет [1, 2]. Аллерген-специфическая иммунотерапия (АСИТ) является безопасным и эффективным методом лечения, особенно в случае аллергического ринита. Эффективность данного вида терапии у лиц молодого возраста была подтверждена несколькими исследованиями [3, 4]. КДП являются основным аллергеном, и в нескольких рандомизированных контролируемых исследованиях была зарегистрирована высокая степень безопасности и эффективности проведения иммунотерапии [5, 6, 7, 8]. Несмотря на отсутствие объективных противопоказаний, специфическая иммунотерапия редко применяется у пожилых пациентов. Это может быть связано с отсутствием данных по безопасности в данной группе. В нескольких исследованиях было подтверждено, что использование АСИТ, прежде всего сублингвальной, у пожилых пациентов является безопасным и эффективным [9, 10]. Наконец, неизвестно, может ли иммунотерапия вызвать достаточную толерантность к аллергену у пациентов с характерным для пожилых людей иммунным ответом.
Целью настоящего исследования была оценка безопасности и эффективности подкожного введения аллергенов КДП у пожилых пациентов с аллергическим ринитом, вызванным КДП.
Методы
Дизайн исследования
Настоящее исследование было рандомизированным, двойным слепым, плацебо-контролируемым (исследованием в параллельных группах) и проводилось в одном центре. Исследование было одобрено локальным этическим комитетом Силезского медицинского университета в Польше. Все пациенты предоставили письменное информированное согласие. Исследование было зарегистрировано в базе данных ClinicalTrials.gov под записью протокола NCT03209245.
Участники
Участники регистрировались для участия в исследовании с мая по июль 2014 года. Для начала необходимо было провести предварительный скрининг примерно 157 пациентов подходящего возраста с ингаляционными аллергиями. Применяли следующие критерии включения:
В период включения в исследование проводились следующие диагностические процедуры.
Все участники были рандомизированы для получения активного препарата Пуретал Майтс (20 000 УЕэкв/мл, HAL Allergy B.V., Лейден, Нидерланды) или плацебо. Препарат Пуретал Майтс содержит основные эквиваленты аллергенов в концентрации 14,0 мкг/мл (группа 1) и 20,0 мкг/мл (группа 2), которую измеряли в экстракте методом твердофазного иммуноферментного анализа (ИФА) непосредственно перед модификацией и адсорбцией на алюминия гидроксиде. Препарат Пуретал Майтс вводили круглогодично, используя следующую схему: 1 доза (0,1 мл), 2 дозы (0,2 мл) и 3 дозы (0,5 мл) в неделю и 0,5 мл каждые четыре недели в течение 24 месяцев. При этой схеме каждому пациенту, получавшему терапию активным препаратом в течение двух лет среднюю кумулятивную дозу 560 500 БАЕ (биоэквивалентных аллергических единиц) вводили в течение двух лет исследования.
Плацебо вводили по тому же протоколу, что и Пуретал. Плацебо представляло собой стерильную суспензию алюминия гидроксида, упакованную в емкость, похожую на флакон с активным препаратом, и в такие же белые картонные коробки без опознавательных знаков с указанием только идентификационного номера пациента и ключевого номера препарата. Все ключевые коды для идентификации активного препарата или плацебо до завершения исследования хранились у независимого координатора, который не участвовал в исследовании.
В целях маскировки все пациенты получали одинаковый объем препарата и одинаковое количество инъекций.
Участников обеспечили препаратами для неотложной терапии (пероральные антигистаминные препараты, назальные кортикостероиды, пероральные кортикостероиды) и проинструктировали применять их для лечения аллергического ринита по ступенчатой схеме (см. ниже).
Исходы
Оценка эффективности
В качестве шкалы оценки симптомов и необходимости приема препаратов использовали усредненную скорректированную шкалу оценки симптомов (AAdSS). Первичной конечной точкой было отклонение от исходного уровня к концу исследования средней разницы средних значений по шкалам AAdSS и по TCRS, вычисленных методом наименьших квадратов, в группе активного препарата в сравнении с группой плацебо. Баллы по шкале AAdSS было принято использовать в качестве первичной конечной точки в исследованиях аллерген-специфической иммунотерапии риноконъюнктивитов [15]. Эта оценка включает в себя такую шкалу общей оценки симптомов со стороны носа и глаз, связанных с аллергией на клещей домашней пыли, как шкала общей оценки риноконъюнктивита (rhinoconjunctivitis total symptoms score, RTSS), которую можно скорректировать для применения при симптоматической терапии [15]. Кроме того, проводили ретроспективный анализ общего результата по комбинированной шкале оценки симптомов ринита (total combined rhinitis score, TCRS), которая сконцентрирована на симптомах со стороны носа и препаратах для лечения аллергического ринита [15].
Пациенты отмечали симптомы со стороны носа и глаз, а также препараты, которые они применяли каждый день в период наблюдения (один год до исследования и два года в период АСИТ). Контролировали четыре симптома со стороны носа (чихание, насморк, зуд и воспаление) и два симптома со стороны глаз (зуд и слезотечение). Каждый день пациент оценивал тяжесть каждого отдельного симптома за последние 24 часа по четырехбалльной шкале: 0 = нет симптомов, 1 = легкие симптомы, 2 = умеренно выраженные симптомы и 3 = тяжелые симптомы.
Шкала необходимости приема препаратов для неотложной терапии основывалась на рекомендациях Всемирной организации аллергологов (World Allergy Organization, WAO): 1 балл – антигистаминные препараты, 2 балла – назальные кортикостероиды и 3 балла – пероральные кортикостероиды [16].
Оценка вторичных исходов включала качество жизни, баллы по шкале улучшения симптомов, оценку безопасности и контроль IgE к Der p 1, Der p 2, а также IgG4. Местные реакции оценивали через 30 минут после инъекции и измеряли в сантиметрах. Системные реакции оценивали по критериям Европейской академии аллергологии и клинической иммунологии (European Academy of Allergy and Clinical Immunology, EAACI) [17].
Качество жизни
Качество жизни пациента оценивали в баллах по опроснику качества жизни при риноконъюнктивите (rhinoconjunctivitis quality of life questionnaire, RQLQ) для взрослых, который заполняли каждый год в период наблюдения [18]. Опросники собирались медицинским персоналом.
Аллерген-специфические IgE и IgG4
Уровни специфических IgE, IgG и IgG4 сыворотки крови к КДП (D. pteronyssinus, D. farinae), а также к Der p1 и Der p2 определяли до начала терапии исследуемым препаратом, через один год и в конце исследования с помощью технологии Immuno CAP (ThermoFisher Scientific, Уппсала, Швеция) согласно инструкциям производителя.
Результаты считали положительными при концентрации sIgE выше 0,35 МЕ/мл. Кроме того, измеряли ответ аллерген-специфических IgE и аллерген-специфических IgG4 сыворотки на Der p1 и Der p2 тем же самым методом ИФА. Результаты фиксировали в начале и в конце исследования.
Данные всех пациентов собирали до начала терапии исследуемым препаратом, через один и два года после начала лечения в исследовательском центре.
Размер выборки
Количество включенных пациентов определяли на основании подсчета мощности, учитывающей ожидаемую величину эффекта, стандартное отклонение для исходов и ранговую переменную для сравнительного исследования. Для сравнения двух пропорций использовали следующую формулу: N = 16p (1 − p)/(po − p1)2 и p = (p0 + p1)/2 для p0 = 0,2 и p1 = 0,15.
С помощью двойного слепого метода пятьдесят девять пациентов прошли индивидуальную процедуру рандомизации и были поделены на две параллельные группы с сопоставимым количеством участников (рис. 1).
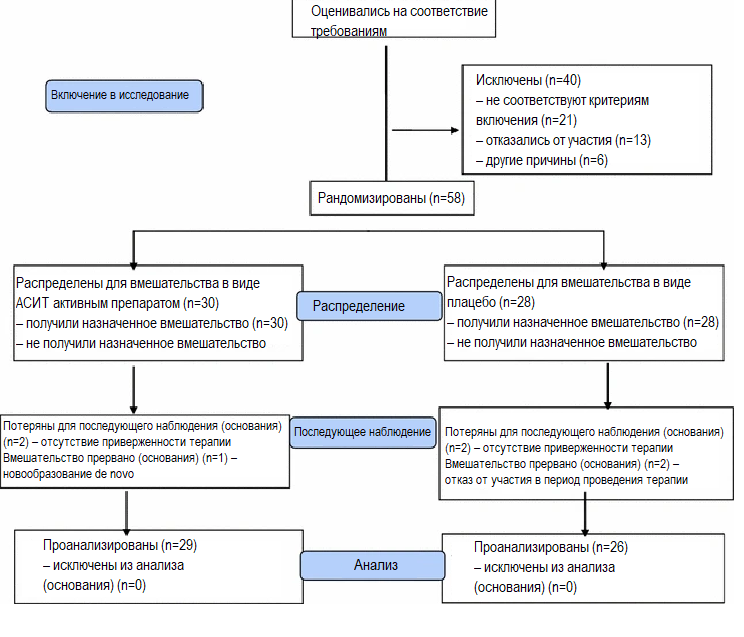 Рисунок 1.Количество участников, прошедших оценку на приемлемость, которые завершили исследование
Рисунок 1.Количество участников, прошедших оценку на приемлемость, которые завершили исследование
Процедура рандомизации
Отвечающие требованиям участники были рандомизированы в соотношении 1:1 для получения плацебо или активной терапии экстрактом КДП с помощью сгенерированного компьютером списка рандомизации (размер блока – 6). Для использования случайно распределенной последовательности для всех участников применяли последовательно пронумерованные контейнеры с Пуреталом или плацебо. Номера были сгенерированы компьютерной программой и контролировались координатором исследования. Исследователи, участники исследования и персонал оставались в неведении на протяжении всего исследования, пока была заблокирована база данных.
Статистические методы
Статистический анализ проводили с использованием программы Statistica software, версия 8.12 (SoftPol, Краков, Польша). В популяцию ITT (intent-to-treat, популяция всех рандомизированных для лечения пациентов) были включены все рандомизированные пациенты. Модифицированная популяция ITT включала всех рандомизированных участников, достигших подлежащей оценке конечной точки. Популяция пациентов, прошедших лечение по протоколу (per-protocol patients, PP), включала участников, соблюдавших схему лечения исследуемым препаратом, то есть получившие 80% и более терапии исследуемым препаратом за период проведения исследования. Первичный анализ основывался на отклонении результатов оценки по шкале AAdSS по сравнению с исходными значениями с помощью модели ANOVA. Ретроспективный анализ результатов оценки по TCRS проводили по той же модели. Вторичные исходы оценивали с помощью соответствующих непараметрических методов (Хи-квадрат, критерий Вилкоксона). Разницу считали статистически значимой при p <0,05.
Результаты
Количество участников на момент регистрации, рандомизации, в период проведения терапии и в период последующего наблюдения представлено на рисунке 1. Исходные характеристики каждой группы представлены в таблице 1.
Таблица 1. Исходные характеристики пациентов
Всего в исследование было включено 58 пациентов,55 (93%) пациентов завершили оценку первичной конечной точки через два года (прошли лечение по протоколу).
Двадцать девять участников из группы АСИТ и двадцать шесть участников из группы плацебо завершили двухлетний период наблюдения.
Приверженность инъекционной терапии регистрировалась персоналом на протяжении всего исследования. За двухлетний период терапии в ITT-популяции 100% завершивших исследование участников получили более 75% инъекций, 93% участников получили более 80% и 98 участников получили более 90%.
Первичные конечные точки
Клинический эффект АСИТ по поводу аллергии на КДП наблюдался через 24 месяца на основании сравнения полученных оценок по шкале AАdSS с результатами оценок, полученными до начала терапии, и в сравнении с оценками в группе плацебо. В популяции ITT в группе терапии активным препаратом по шкале AAdSS существенно снизились примерно у 64% участников: с 4,27 ± 1,58 до начала терапии до 1,82 ± 0,71 через два года АСИТ, p <0,05. В группе терапии активным препаратом через 24 месяца АСИТ оценка была лучше, чем в группе плацебо на 52%: 1,82 ± 0,71 в сравнении с 3,97 ± 0,96, p <0,05. Результаты популяции ITT и модифицированной популяции ITT представлены в таблице 2.
Таблица 2. Эффективность АСИТ в сравнении с плацебо
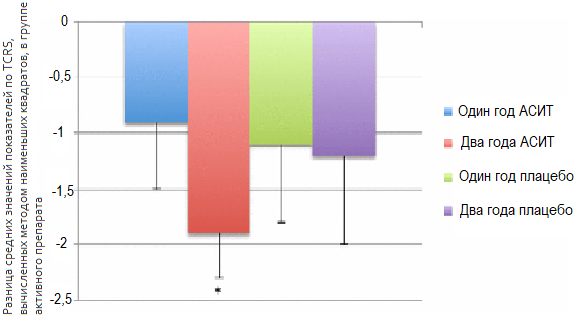 Рисунок 2. Ретроспективный анализ показателей TCRS в популяции ITT продемонстрировал их значительное снижение через два года после начала АСИТ
Рисунок 2. Ретроспективный анализ показателей TCRS в популяции ITT продемонстрировал их значительное снижение через два года после начала АСИТ
Вторичные исходы
Иммунологические маркеры
За период исследования АСИТ уровень специфических IgE сыворотки крови к D. pteronyssinus, D. farinae, D pter 1 и D pter 2 в популяции ITT снизился (рисунок 3). За период проведения АСИТ в группе, получавшей исследуемый препарат, повысились уровни специфических IgG4 сыворотки крови к D. pteronyssinus, D. farinae, Der p1 и Der p2 (рисунок 4). Концентрация IgG4 сыворотки в группе плацебо была постоянной, с низкими уровнями IgG4 к анализируемым аллергенам.
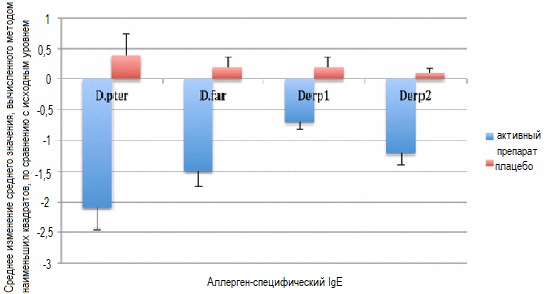 Рисунок 3. Снижение уровней КДП-специфических IgE (SE) в сравнении с плацебо через три и шесть лет после начала лечения. D. pter – среднее значение изменения уровней IgE к D. pteronyssinus от исходного до уровня через два года АСИТ или в сравнении с плацебо, D. far – среднее значение изменения уровней IgE к D. farinae от исходного до уровня через два года АСИТ или в сравнении с плацебо, Derp1 – среднее значение изменения уровней IgE к антигену D. pter 1 от исходного до уровня через два года АСИТ или в сравнении с плацебо, D. pter 2 – среднее значение изменения уровней IgE к антигену D. pter 2 от исходного до уровня через два года АСИТ или в сравнении с плацебо. Наблюдались значимые различия по всем анализируемым параметрам между группой активного препарата и группой плацебо
Рисунок 3. Снижение уровней КДП-специфических IgE (SE) в сравнении с плацебо через три и шесть лет после начала лечения. D. pter – среднее значение изменения уровней IgE к D. pteronyssinus от исходного до уровня через два года АСИТ или в сравнении с плацебо, D. far – среднее значение изменения уровней IgE к D. farinae от исходного до уровня через два года АСИТ или в сравнении с плацебо, Derp1 – среднее значение изменения уровней IgE к антигену D. pter 1 от исходного до уровня через два года АСИТ или в сравнении с плацебо, D. pter 2 – среднее значение изменения уровней IgE к антигену D. pter 2 от исходного до уровня через два года АСИТ или в сравнении с плацебо. Наблюдались значимые различия по всем анализируемым параметрам между группой активного препарата и группой плацебо
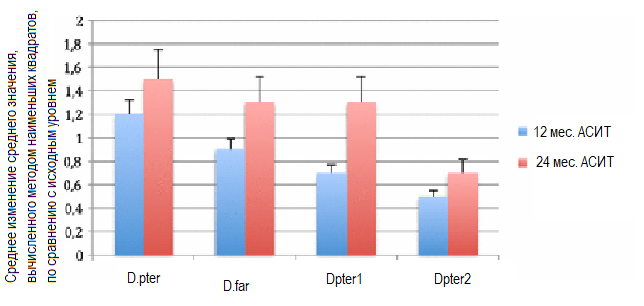 Рисунок 4. Повышение уровней КДП-специфических IgG4 (SE) через 12 и 24 месяца после начала лечения. D. pter – среднее значение изменения уровней IgG4 к D. pteronyssinus по сравнению с исходным уровнем, D. far – среднее значение изменения уровней IgG4 к D. farinae по сравнению с исходным уровнем, Derp1 – среднее значение изменения уровней IgG4 к D. pter 1 по сравнению с исходным уровнем, D. pter 2 – среднее значение изменения уровней IgG4 к D. pter 2 по сравнению с исходным уровнем
Рисунок 4. Повышение уровней КДП-специфических IgG4 (SE) через 12 и 24 месяца после начала лечения. D. pter – среднее значение изменения уровней IgG4 к D. pteronyssinus по сравнению с исходным уровнем, D. far – среднее значение изменения уровней IgG4 к D. farinae по сравнению с исходным уровнем, Derp1 – среднее значение изменения уровней IgG4 к D. pter 1 по сравнению с исходным уровнем, D. pter 2 – среднее значение изменения уровней IgG4 к D. pter 2 по сравнению с исходным уровнем
Качество жизни
В популяции ITT качество жизни (на основании оценки по шкале опросника RQLQ) у пациентов, получавших АСИТ, существенно улучшилось – с 1,82 (95% ДИ 1,54–1,92) до 1,26 (95% ДИ 1,09–1,55). В группе плацебо качество жизни было значительно ниже: уровень оставался неизменным на протяжении исследования и составлял 1,74 (95% ДИ 1,27–1,86).
Оценка безопасности
В группе активного препарата за период проведения АСИТ наблюдались две легкие системные анафилактические реакции (I степени) и ни одной реакции II, III или IV степени. После 49 (4,11%) инъекций Пуретала наблюдались эритема или волдыри размером <5 см. В группе активной терапии волдыри <5 см наблюдались после 19 (1,12%) инъекций. В группе плацебо не было ни одной нежелательной реакции.
Обсуждение
За время настоящего исследования оценка по шкале AAdSS, которая являлась первичной конечной точкой нашего анализа, существенно снизилась в группе активного препарата. Данное исследование является двойным слепым плацебо-контролируемым исследованием проведения АСИТ у пациентов пожилого возраста с аллергиями на клещей домашней пыли. У пациентов старше 65 лет иммунотерапия применяется редко. Однако распространенность IgE-зависимого аллергического ринита и других атопических заболеваний среди пациентов пожилого возраста увеличивается [2, 19]. Только в одном исследовании, помимо нашего, изучали использование сублингвальной иммунотерапии при аллергиях на клещей домашней пыли у пациентов пожилого возраста [9]. Результаты нашего исследования сопоставимы с результатами вышеупомянутого исследования (т. е. отмечаются сходные клинические эффекты через три года после начала АСИТ или сопоставимый уровень безопасности). Эти результаты также сопоставимы с результатами других исследований, в частности сравнимы показатели у молодых пациентов после АСИТ аллергенами клещей домашней пыли [20, 21].
Кроме того, на основании отдельного анализа симптомов ринита в качестве первичной конечной точки наблюдалось значительное улучшение оценок по TCRS. Этот результат особенно важен для пожилых пациентов, поскольку нарушения работы носа существенно снижают качество жизни [22].
Изменения исследуемых показателей иммунной системы коррелировало с клиническим улучшением в группе активного препарата. Отмечалось явное повышение уровней IgG4 к D. pteronyssinus, D. farinae, Der p1 and Der p2 во время и после проведения АСИТ. В то же время концентрация аллерген-специфических IgE к соответствующим аллергенам в целом снижалась, однако не у всех пациентов. Подобное влияние АСИТ на концентрацию IgG4 и специфических IgE другие авторы наблюдали у молодых пациентов с аллергиями [23]. Эти результаты могут служить доказательством того, что в пожилом возрасте иммунная система способна вырабатывать толерантность к аллергенам. Однако не следует забывать, что «старение» иммунной системы является важным событием в пожилом возрасте. Оно затрагивает также местные назальные иммунные реакции. Иммунная система пожилых людей претерпевает множество изменений, в том числе наблюдается снижение неспецифических иммунных ответов с уменьшением активности фагоцитов и цитотоксических клеток. В период старения наблюдаются значительные изменения профилей T-лимфоцитов [24]. В профиле лимфоцитов преобладают Th2. Иммунная система пожилых людей слабо реагирует на новые антигены. Такой ответ обусловлен превалированием лимфоцитов памяти и существенным снижением количества наивных клеток. Однако, по-видимому, эти изменения не оказывают существенного влияния на частоту новых случаев аллергий [25, 26, 27].
Пуретал, применявшийся в данном исследовании, является аллергоидом с высоким уровнем эффективности и безопасности вне зависимости от режима дозирования и типа аллергена; этот вывод подтверждается несколькими исследованиями [28, 29, 30]. Полученный результат свидетельствует о том, что не смотря на старение иммунной системы наблюдаемый иммуномодулирующий эффект у исследуемых пациентов пожилого возраста схож с эффектом у пациентов молодого возраста. Кроме того, снижение потребности в симптоматических лекарственных средствах и, прежде всего, уменьшение зависимости от антигистаминных препаратов улучшает профиль безопасности для лиц пожилого возраста. У пожилых пациентов нежелательные реакции чаще всего возникают на антигистаминные препараты [31]. Настоящее исследование поддерживает применение иммунотерапии у пожилых пациентов и демонстрирует приемлемый профиль ее безопасности, так как за три года терапии не наблюдалось клинически значимых системных реакций. Наблюдаемое повышение качества жизни имеет большое значение для пожилых пациентов и подтверждает эффективность АСИТ в данной возрастной группе [9, 10, 32].
Основным ограничением данного исследования является относительно небольшой размер группы анализируемых пациентов. Кроме того, мы не анализировали специфические IgE и IgG4 к другим антигенам клещей домашней пыли, поэтому не могли оценить разные типы аллергий на клещей домашней пыли у исследуемых пациентов, а также другие ответы на АСИТ. Более того, мы фокусировались на типичных аллергических нежелательных реакциях и не анализировали неаллергические типы нежелательных явлений, такие как приливы, головная боль, тошнота, диарея, слабость, повышение температуры тела и заложенность носа. Исходя из этого, данное наблюдение может быть недостаточно полным для общей оценки.
Выводы
Настоящее исследование показало, что АСИТ с использованием аллергенов домашней пыли привела к значительному клиническому улучшению в группе активного препарата в сравнении с группой плацебо. Исследуемая терапия хорошо переносилась. Настоящее исследование поддерживает применение АСИТ у пожилых пациентов и указывает на необходимость проведения более масштабных исследований.
Литература
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0
Анджей Бошек, Кшиштоф Колодзейчик, Рената Козловска, Джорджо Вальтер Каноника
Clinical and Translational Allergy20177:43
Аннотация
Введение
Целесообразность проведения аллерген-специфической иммунотерапии (АСИТ) у пожилых пациентов является спорной. На данный момент отсутствует достаточное количество данных в поддержку безопасности и эффективности этого метода лечения для исследуемой популяции. Целью данного исследования была оценка безопасности и эффективности АСИТ аллергенами клещей домашней пыли у пациентов старше 65 лет с аллергическим ринитом (АР) и подтвержденной аллергией на клещей домашней пыли. Первичной конечной точкой являлось отклонение от исходного уровня средней разницы средних значений по усредненной скорректированной шкале оценки симптомов (average adjusted symptom score, AAdSS) и по общему результату по комбинированной шкале оценки ринита (total combined rhinitis score, TCRS), вычисленных методом наименьших квадратов, в группе активного препарата в сравнении с группой плацебо.
Методы
Пятьдесят восемь пациентов пожилого возраста с АР и моносенсибилизацией к аллергенам клещей домашней пыли прошли индивидуальную рандомизацию и поделены на две группы с сопоставимым количеством участников. Проводились следующие вмешательства: два года круглогодичной АСИТ препаратом Пуретал Майтс (PURETHAL Mites) или плацебо. Симптомы и баллы по шкале необходимости приема препарата представлены в виде баллов по шкалам AAdSS и TCRS. Качество жизни контролировали по опроснику качества жизни при риноконъюнктивите (rhinoconjunctivitis quality of life questionnaire, RQLQ), по реакции на провокацию назальным аллергеном, по уровню аллерген-специфических IgG4 сыворотки крови к D. pteronyssinus и D. farinae и Der p1 и Der p2. Анализировали популяцию ITT (intent-to-treat, популяция всех рандомизированных для лечения пациентов).
Результаты
Через 24 месяца после начала АСИТ оценка по шкале AAdSS значительно снизилась с 4,27 ± 1,58 баллов до 1,82 ± 0,71 (p <0,05). Оценка по TCRS значительно снизилась через два года после начала АСИТ. В период проведения АСИТ в исследуемой группе повысился уровень специфических IgG4 сыворотки крови против D. pteronyssinus, D. farinae, Der p1, и Der p2. У пациентов, получавших АСИТ, показатели по шкале опросника RQLQ существенно улучшились – с 1,86 (95% ДИ 1,51–1,78) до 1,26 (95% ДИ 1,09–1,55). За время проведения АСИТ в группе активного препарата были зарегистрировано две легкие системные анафилактические реакции (I степени) после инъекций.
Выводы
Результаты двойного слепого плацебо-контролируемого исследования показали, что АСИТ аллергенами клещей домашней пыли эффективна и безопасна при применении у пациентов пожилого возраста с аллергическим ринитом.
Регистрация исследования
Настоящее рандомизированное двойное слепое плацебо-контролируемое исследование проводилось в одном центре (номер в базе данных ClinicalTrials.gov NCT03209245)
Ключевые слова: иммунотерапия, аллергический ринит, пожилой возраст, клещи домашней пыли.
Введение
Значимость аллергического ринита у пожилых пациентов часто недооценена. Рекомендации по диагностике и лечению аллергических заболеваний редко фокусируются на популяции пожилых людей и часто полностью ее игнорируют. Тем не менее, аллергический ринит и астма, вызванные ингаляционными аллергенами, такими как аллергены клещей домашней пыли (КДП) чаще встречаются именно у пациентов старше 65 лет [1, 2]. Аллерген-специфическая иммунотерапия (АСИТ) является безопасным и эффективным методом лечения, особенно в случае аллергического ринита. Эффективность данного вида терапии у лиц молодого возраста была подтверждена несколькими исследованиями [3, 4]. КДП являются основным аллергеном, и в нескольких рандомизированных контролируемых исследованиях была зарегистрирована высокая степень безопасности и эффективности проведения иммунотерапии [5, 6, 7, 8]. Несмотря на отсутствие объективных противопоказаний, специфическая иммунотерапия редко применяется у пожилых пациентов. Это может быть связано с отсутствием данных по безопасности в данной группе. В нескольких исследованиях было подтверждено, что использование АСИТ, прежде всего сублингвальной, у пожилых пациентов является безопасным и эффективным [9, 10]. Наконец, неизвестно, может ли иммунотерапия вызвать достаточную толерантность к аллергену у пациентов с характерным для пожилых людей иммунным ответом.
Целью настоящего исследования была оценка безопасности и эффективности подкожного введения аллергенов КДП у пожилых пациентов с аллергическим ринитом, вызванным КДП.
Методы
Дизайн исследования
Настоящее исследование было рандомизированным, двойным слепым, плацебо-контролируемым (исследованием в параллельных группах) и проводилось в одном центре. Исследование было одобрено локальным этическим комитетом Силезского медицинского университета в Польше. Все пациенты предоставили письменное информированное согласие. Исследование было зарегистрировано в базе данных ClinicalTrials.gov под записью протокола NCT03209245.
Участники
Участники регистрировались для участия в исследовании с мая по июль 2014 года. Для начала необходимо было провести предварительный скрининг примерно 157 пациентов подходящего возраста с ингаляционными аллергиями. Применяли следующие критерии включения:
- пациенты с тяжелым интермиттирующим аллергическим ринитом или с интермиттирующим аллергическим ринитом средней тяжести, которые соответствуют критериям рекомендаций «Аллергический ринит и его влияние на астму (Allergic Rhinitis and its Impact on Asthma, ARIA)» [11];
- положительный кожный прик-тест (КПТ) и положительный результат исследования на специфический иммуноглобулин E (sIgE) к аллергенам D. pteronyssinus и D. Farinae;
- положительный назальный провокационный тест (НПК) на аллергены D. pteronyssinus и D. farinae.
В период включения в исследование проводились следующие диагностические процедуры.
- Всем пациентам тщательно обследовали глаза, уши, нос и глотку. Тяжесть круглогодичного аллергического ринита (АР) оценивали согласно рекомендациям «Аллергический ринит и его влияние на астму» (ARIA) [11].
- Проводили кожный прик-тест с использованием панели ингаляционных аллергенов (HAL Allergy B.V., Лейден, Нидерланды): D. pteronyssinus, D. farinae, смеси пяти трав (Phleum pratense, Dactylis glomerata, Anthoxanthum odoratum, Lolium perenne и Poa pratensis), смеси из аллергенов деревьев, полыни, Alternaria, Cladosporium, собачьих и кошачьих аллергенов. Исследование также включало положительный (гистамин 10 мг/мл) и отрицательный (физиологический раствор) контроль. Аллергия на клещей домашней пыли определялась при положительном кожном тесте на аллергены D. pteronyssinus и D. farinae с диаметром волдыря на три и более мм превышающим диаметр волдыря при негативном контроле [12]. Пациентов с отрицательными результатами теста на чувствительность к гистамину исключали из дальнейшего анализа. Определение уровня IgE описано ниже.
- Назальный провокационный тест (НПТ) проводили с использованием акустической ринометрии с коммерческим аллергеном D. pteronyssinus. Концентрация составляла 10 000 УЕ/мл, в каждую ноздрю вводили по одному впрыскиванию смеси (HAL Allergy B.V., Лейден, Нидерланды) методом, описанным Bachert et al. [13] и Dordal et al. [14]. Снижение пикового назального инспираторного потока на 40% и более, а также увеличение оценки симптомов на пять и более пунктов рассматривали как критерии положительного результата НПТ согласно определению Bachert et al. [13] и Dordal et al. [14].
Все участники были рандомизированы для получения активного препарата Пуретал Майтс (20 000 УЕэкв/мл, HAL Allergy B.V., Лейден, Нидерланды) или плацебо. Препарат Пуретал Майтс содержит основные эквиваленты аллергенов в концентрации 14,0 мкг/мл (группа 1) и 20,0 мкг/мл (группа 2), которую измеряли в экстракте методом твердофазного иммуноферментного анализа (ИФА) непосредственно перед модификацией и адсорбцией на алюминия гидроксиде. Препарат Пуретал Майтс вводили круглогодично, используя следующую схему: 1 доза (0,1 мл), 2 дозы (0,2 мл) и 3 дозы (0,5 мл) в неделю и 0,5 мл каждые четыре недели в течение 24 месяцев. При этой схеме каждому пациенту, получавшему терапию активным препаратом в течение двух лет среднюю кумулятивную дозу 560 500 БАЕ (биоэквивалентных аллергических единиц) вводили в течение двух лет исследования.
Плацебо вводили по тому же протоколу, что и Пуретал. Плацебо представляло собой стерильную суспензию алюминия гидроксида, упакованную в емкость, похожую на флакон с активным препаратом, и в такие же белые картонные коробки без опознавательных знаков с указанием только идентификационного номера пациента и ключевого номера препарата. Все ключевые коды для идентификации активного препарата или плацебо до завершения исследования хранились у независимого координатора, который не участвовал в исследовании.
В целях маскировки все пациенты получали одинаковый объем препарата и одинаковое количество инъекций.
Участников обеспечили препаратами для неотложной терапии (пероральные антигистаминные препараты, назальные кортикостероиды, пероральные кортикостероиды) и проинструктировали применять их для лечения аллергического ринита по ступенчатой схеме (см. ниже).
Исходы
Оценка эффективности
В качестве шкалы оценки симптомов и необходимости приема препаратов использовали усредненную скорректированную шкалу оценки симптомов (AAdSS). Первичной конечной точкой было отклонение от исходного уровня к концу исследования средней разницы средних значений по шкалам AAdSS и по TCRS, вычисленных методом наименьших квадратов, в группе активного препарата в сравнении с группой плацебо. Баллы по шкале AAdSS было принято использовать в качестве первичной конечной точки в исследованиях аллерген-специфической иммунотерапии риноконъюнктивитов [15]. Эта оценка включает в себя такую шкалу общей оценки симптомов со стороны носа и глаз, связанных с аллергией на клещей домашней пыли, как шкала общей оценки риноконъюнктивита (rhinoconjunctivitis total symptoms score, RTSS), которую можно скорректировать для применения при симптоматической терапии [15]. Кроме того, проводили ретроспективный анализ общего результата по комбинированной шкале оценки симптомов ринита (total combined rhinitis score, TCRS), которая сконцентрирована на симптомах со стороны носа и препаратах для лечения аллергического ринита [15].
Пациенты отмечали симптомы со стороны носа и глаз, а также препараты, которые они применяли каждый день в период наблюдения (один год до исследования и два года в период АСИТ). Контролировали четыре симптома со стороны носа (чихание, насморк, зуд и воспаление) и два симптома со стороны глаз (зуд и слезотечение). Каждый день пациент оценивал тяжесть каждого отдельного симптома за последние 24 часа по четырехбалльной шкале: 0 = нет симптомов, 1 = легкие симптомы, 2 = умеренно выраженные симптомы и 3 = тяжелые симптомы.
Шкала необходимости приема препаратов для неотложной терапии основывалась на рекомендациях Всемирной организации аллергологов (World Allergy Organization, WAO): 1 балл – антигистаминные препараты, 2 балла – назальные кортикостероиды и 3 балла – пероральные кортикостероиды [16].
Оценка вторичных исходов включала качество жизни, баллы по шкале улучшения симптомов, оценку безопасности и контроль IgE к Der p 1, Der p 2, а также IgG4. Местные реакции оценивали через 30 минут после инъекции и измеряли в сантиметрах. Системные реакции оценивали по критериям Европейской академии аллергологии и клинической иммунологии (European Academy of Allergy and Clinical Immunology, EAACI) [17].
Качество жизни
Качество жизни пациента оценивали в баллах по опроснику качества жизни при риноконъюнктивите (rhinoconjunctivitis quality of life questionnaire, RQLQ) для взрослых, который заполняли каждый год в период наблюдения [18]. Опросники собирались медицинским персоналом.
Аллерген-специфические IgE и IgG4
Уровни специфических IgE, IgG и IgG4 сыворотки крови к КДП (D. pteronyssinus, D. farinae), а также к Der p1 и Der p2 определяли до начала терапии исследуемым препаратом, через один год и в конце исследования с помощью технологии Immuno CAP (ThermoFisher Scientific, Уппсала, Швеция) согласно инструкциям производителя.
Результаты считали положительными при концентрации sIgE выше 0,35 МЕ/мл. Кроме того, измеряли ответ аллерген-специфических IgE и аллерген-специфических IgG4 сыворотки на Der p1 и Der p2 тем же самым методом ИФА. Результаты фиксировали в начале и в конце исследования.
Данные всех пациентов собирали до начала терапии исследуемым препаратом, через один и два года после начала лечения в исследовательском центре.
Размер выборки
Количество включенных пациентов определяли на основании подсчета мощности, учитывающей ожидаемую величину эффекта, стандартное отклонение для исходов и ранговую переменную для сравнительного исследования. Для сравнения двух пропорций использовали следующую формулу: N = 16p (1 − p)/(po − p1)2 и p = (p0 + p1)/2 для p0 = 0,2 и p1 = 0,15.
С помощью двойного слепого метода пятьдесят девять пациентов прошли индивидуальную процедуру рандомизации и были поделены на две параллельные группы с сопоставимым количеством участников (рис. 1).
 Рисунок 1.Количество участников, прошедших оценку на приемлемость, которые завершили исследование
Рисунок 1.Количество участников, прошедших оценку на приемлемость, которые завершили исследованиеПроцедура рандомизации
Отвечающие требованиям участники были рандомизированы в соотношении 1:1 для получения плацебо или активной терапии экстрактом КДП с помощью сгенерированного компьютером списка рандомизации (размер блока – 6). Для использования случайно распределенной последовательности для всех участников применяли последовательно пронумерованные контейнеры с Пуреталом или плацебо. Номера были сгенерированы компьютерной программой и контролировались координатором исследования. Исследователи, участники исследования и персонал оставались в неведении на протяжении всего исследования, пока была заблокирована база данных.
Статистические методы
Статистический анализ проводили с использованием программы Statistica software, версия 8.12 (SoftPol, Краков, Польша). В популяцию ITT (intent-to-treat, популяция всех рандомизированных для лечения пациентов) были включены все рандомизированные пациенты. Модифицированная популяция ITT включала всех рандомизированных участников, достигших подлежащей оценке конечной точки. Популяция пациентов, прошедших лечение по протоколу (per-protocol patients, PP), включала участников, соблюдавших схему лечения исследуемым препаратом, то есть получившие 80% и более терапии исследуемым препаратом за период проведения исследования. Первичный анализ основывался на отклонении результатов оценки по шкале AAdSS по сравнению с исходными значениями с помощью модели ANOVA. Ретроспективный анализ результатов оценки по TCRS проводили по той же модели. Вторичные исходы оценивали с помощью соответствующих непараметрических методов (Хи-квадрат, критерий Вилкоксона). Разницу считали статистически значимой при p <0,05.
Результаты
Количество участников на момент регистрации, рандомизации, в период проведения терапии и в период последующего наблюдения представлено на рисунке 1. Исходные характеристики каждой группы представлены в таблице 1.
Таблица 1. Исходные характеристики пациентов
Всего в исследование было включено 58 пациентов,55 (93%) пациентов завершили оценку первичной конечной точки через два года (прошли лечение по протоколу).
Двадцать девять участников из группы АСИТ и двадцать шесть участников из группы плацебо завершили двухлетний период наблюдения.
Приверженность инъекционной терапии регистрировалась персоналом на протяжении всего исследования. За двухлетний период терапии в ITT-популяции 100% завершивших исследование участников получили более 75% инъекций, 93% участников получили более 80% и 98 участников получили более 90%.
Первичные конечные точки
Клинический эффект АСИТ по поводу аллергии на КДП наблюдался через 24 месяца на основании сравнения полученных оценок по шкале AАdSS с результатами оценок, полученными до начала терапии, и в сравнении с оценками в группе плацебо. В популяции ITT в группе терапии активным препаратом по шкале AAdSS существенно снизились примерно у 64% участников: с 4,27 ± 1,58 до начала терапии до 1,82 ± 0,71 через два года АСИТ, p <0,05. В группе терапии активным препаратом через 24 месяца АСИТ оценка была лучше, чем в группе плацебо на 52%: 1,82 ± 0,71 в сравнении с 3,97 ± 0,96, p <0,05. Результаты популяции ITT и модифицированной популяции ITT представлены в таблице 2.
Таблица 2. Эффективность АСИТ в сравнении с плацебо
 Рисунок 2. Ретроспективный анализ показателей TCRS в популяции ITT продемонстрировал их значительное снижение через два года после начала АСИТ
Рисунок 2. Ретроспективный анализ показателей TCRS в популяции ITT продемонстрировал их значительное снижение через два года после начала АСИТВторичные исходы
Иммунологические маркеры
За период исследования АСИТ уровень специфических IgE сыворотки крови к D. pteronyssinus, D. farinae, D pter 1 и D pter 2 в популяции ITT снизился (рисунок 3). За период проведения АСИТ в группе, получавшей исследуемый препарат, повысились уровни специфических IgG4 сыворотки крови к D. pteronyssinus, D. farinae, Der p1 и Der p2 (рисунок 4). Концентрация IgG4 сыворотки в группе плацебо была постоянной, с низкими уровнями IgG4 к анализируемым аллергенам.
 Рисунок 3. Снижение уровней КДП-специфических IgE (SE) в сравнении с плацебо через три и шесть лет после начала лечения. D. pter – среднее значение изменения уровней IgE к D. pteronyssinus от исходного до уровня через два года АСИТ или в сравнении с плацебо, D. far – среднее значение изменения уровней IgE к D. farinae от исходного до уровня через два года АСИТ или в сравнении с плацебо, Derp1 – среднее значение изменения уровней IgE к антигену D. pter 1 от исходного до уровня через два года АСИТ или в сравнении с плацебо, D. pter 2 – среднее значение изменения уровней IgE к антигену D. pter 2 от исходного до уровня через два года АСИТ или в сравнении с плацебо. Наблюдались значимые различия по всем анализируемым параметрам между группой активного препарата и группой плацебо
Рисунок 3. Снижение уровней КДП-специфических IgE (SE) в сравнении с плацебо через три и шесть лет после начала лечения. D. pter – среднее значение изменения уровней IgE к D. pteronyssinus от исходного до уровня через два года АСИТ или в сравнении с плацебо, D. far – среднее значение изменения уровней IgE к D. farinae от исходного до уровня через два года АСИТ или в сравнении с плацебо, Derp1 – среднее значение изменения уровней IgE к антигену D. pter 1 от исходного до уровня через два года АСИТ или в сравнении с плацебо, D. pter 2 – среднее значение изменения уровней IgE к антигену D. pter 2 от исходного до уровня через два года АСИТ или в сравнении с плацебо. Наблюдались значимые различия по всем анализируемым параметрам между группой активного препарата и группой плацебо Рисунок 4. Повышение уровней КДП-специфических IgG4 (SE) через 12 и 24 месяца после начала лечения. D. pter – среднее значение изменения уровней IgG4 к D. pteronyssinus по сравнению с исходным уровнем, D. far – среднее значение изменения уровней IgG4 к D. farinae по сравнению с исходным уровнем, Derp1 – среднее значение изменения уровней IgG4 к D. pter 1 по сравнению с исходным уровнем, D. pter 2 – среднее значение изменения уровней IgG4 к D. pter 2 по сравнению с исходным уровнем
Рисунок 4. Повышение уровней КДП-специфических IgG4 (SE) через 12 и 24 месяца после начала лечения. D. pter – среднее значение изменения уровней IgG4 к D. pteronyssinus по сравнению с исходным уровнем, D. far – среднее значение изменения уровней IgG4 к D. farinae по сравнению с исходным уровнем, Derp1 – среднее значение изменения уровней IgG4 к D. pter 1 по сравнению с исходным уровнем, D. pter 2 – среднее значение изменения уровней IgG4 к D. pter 2 по сравнению с исходным уровнемКачество жизни
В популяции ITT качество жизни (на основании оценки по шкале опросника RQLQ) у пациентов, получавших АСИТ, существенно улучшилось – с 1,82 (95% ДИ 1,54–1,92) до 1,26 (95% ДИ 1,09–1,55). В группе плацебо качество жизни было значительно ниже: уровень оставался неизменным на протяжении исследования и составлял 1,74 (95% ДИ 1,27–1,86).
Оценка безопасности
В группе активного препарата за период проведения АСИТ наблюдались две легкие системные анафилактические реакции (I степени) и ни одной реакции II, III или IV степени. После 49 (4,11%) инъекций Пуретала наблюдались эритема или волдыри размером <5 см. В группе активной терапии волдыри <5 см наблюдались после 19 (1,12%) инъекций. В группе плацебо не было ни одной нежелательной реакции.
Обсуждение
За время настоящего исследования оценка по шкале AAdSS, которая являлась первичной конечной точкой нашего анализа, существенно снизилась в группе активного препарата. Данное исследование является двойным слепым плацебо-контролируемым исследованием проведения АСИТ у пациентов пожилого возраста с аллергиями на клещей домашней пыли. У пациентов старше 65 лет иммунотерапия применяется редко. Однако распространенность IgE-зависимого аллергического ринита и других атопических заболеваний среди пациентов пожилого возраста увеличивается [2, 19]. Только в одном исследовании, помимо нашего, изучали использование сублингвальной иммунотерапии при аллергиях на клещей домашней пыли у пациентов пожилого возраста [9]. Результаты нашего исследования сопоставимы с результатами вышеупомянутого исследования (т. е. отмечаются сходные клинические эффекты через три года после начала АСИТ или сопоставимый уровень безопасности). Эти результаты также сопоставимы с результатами других исследований, в частности сравнимы показатели у молодых пациентов после АСИТ аллергенами клещей домашней пыли [20, 21].
Кроме того, на основании отдельного анализа симптомов ринита в качестве первичной конечной точки наблюдалось значительное улучшение оценок по TCRS. Этот результат особенно важен для пожилых пациентов, поскольку нарушения работы носа существенно снижают качество жизни [22].
Изменения исследуемых показателей иммунной системы коррелировало с клиническим улучшением в группе активного препарата. Отмечалось явное повышение уровней IgG4 к D. pteronyssinus, D. farinae, Der p1 and Der p2 во время и после проведения АСИТ. В то же время концентрация аллерген-специфических IgE к соответствующим аллергенам в целом снижалась, однако не у всех пациентов. Подобное влияние АСИТ на концентрацию IgG4 и специфических IgE другие авторы наблюдали у молодых пациентов с аллергиями [23]. Эти результаты могут служить доказательством того, что в пожилом возрасте иммунная система способна вырабатывать толерантность к аллергенам. Однако не следует забывать, что «старение» иммунной системы является важным событием в пожилом возрасте. Оно затрагивает также местные назальные иммунные реакции. Иммунная система пожилых людей претерпевает множество изменений, в том числе наблюдается снижение неспецифических иммунных ответов с уменьшением активности фагоцитов и цитотоксических клеток. В период старения наблюдаются значительные изменения профилей T-лимфоцитов [24]. В профиле лимфоцитов преобладают Th2. Иммунная система пожилых людей слабо реагирует на новые антигены. Такой ответ обусловлен превалированием лимфоцитов памяти и существенным снижением количества наивных клеток. Однако, по-видимому, эти изменения не оказывают существенного влияния на частоту новых случаев аллергий [25, 26, 27].
Пуретал, применявшийся в данном исследовании, является аллергоидом с высоким уровнем эффективности и безопасности вне зависимости от режима дозирования и типа аллергена; этот вывод подтверждается несколькими исследованиями [28, 29, 30]. Полученный результат свидетельствует о том, что не смотря на старение иммунной системы наблюдаемый иммуномодулирующий эффект у исследуемых пациентов пожилого возраста схож с эффектом у пациентов молодого возраста. Кроме того, снижение потребности в симптоматических лекарственных средствах и, прежде всего, уменьшение зависимости от антигистаминных препаратов улучшает профиль безопасности для лиц пожилого возраста. У пожилых пациентов нежелательные реакции чаще всего возникают на антигистаминные препараты [31]. Настоящее исследование поддерживает применение иммунотерапии у пожилых пациентов и демонстрирует приемлемый профиль ее безопасности, так как за три года терапии не наблюдалось клинически значимых системных реакций. Наблюдаемое повышение качества жизни имеет большое значение для пожилых пациентов и подтверждает эффективность АСИТ в данной возрастной группе [9, 10, 32].
Основным ограничением данного исследования является относительно небольшой размер группы анализируемых пациентов. Кроме того, мы не анализировали специфические IgE и IgG4 к другим антигенам клещей домашней пыли, поэтому не могли оценить разные типы аллергий на клещей домашней пыли у исследуемых пациентов, а также другие ответы на АСИТ. Более того, мы фокусировались на типичных аллергических нежелательных реакциях и не анализировали неаллергические типы нежелательных явлений, такие как приливы, головная боль, тошнота, диарея, слабость, повышение температуры тела и заложенность носа. Исходя из этого, данное наблюдение может быть недостаточно полным для общей оценки.
Выводы
Настоящее исследование показало, что АСИТ с использованием аллергенов домашней пыли привела к значительному клиническому улучшению в группе активного препарата в сравнении с группой плацебо. Исследуемая терапия хорошо переносилась. Настоящее исследование поддерживает применение АСИТ у пожилых пациентов и указывает на необходимость проведения более масштабных исследований.
Литература
- Wolkewitz M, Rothenbacher D, Low M, et al. Lifetime prevalence of self-reported atopic diseases in a population-based sample of elderly subjects: results of the ESTHER study. Br J Dermatol. 2007;156:693–7.
- Becerril MA, Vazquez CLM, Angeles UG, et al. Prevalence of allergic diseases in the elderly. Rev Alerg Mex. 2008;55:85–91.
- Bousquet J, Lockey R, Malling HJ. Allergen immunotherapy; therapeutic vaccines for allergic diseases—a WHO position paper. J Allergy Clin Immunol. 1998;102:558–62.
- Dhami S, Nurmatov U, Arasi S, et al. Allergen immunotherapy for allergic rhinoconjunctivitis. Allergen immunotherapy guidelines part I: systematic reviewes. EAACI 2017, p. 125–169.
- Wang H, Lin X, Hao C, et al. A double-blind, placebo-controlled study of house dust mite immunotherapy in Chinese asthmatic patients. Allergy. 2006;61:191–7.
- Yukselen A, Kendrili SG, Yilmaz M, et al. Effect of one-year subcutaneous and sublingual immunotherapy on clinical and laboratory parameters in children with rhinitis and asthma: a randomized, placebo-controlled, double blind, double-dummy study. Int Arch Allergy Immunol. 2012;157:288–98.
- Compalati E, Passalacqua G, Bonini M, et al. The efficacy of sublingual immunotherapy for house dust mites respiratory allergy: results of GA2LEN meta-analysis. Allergy. 2009;64:1570–9.
- Varney VA, Tabbah K, Mavroleon G, et al. Usefulness of specific immunotherapy in patients with severe perennial rhinitis induced by house dust mite: a double-blind, randomized, placebo-controlled trial. Clin Exp Allergy. 2003;33:1076–82.
- Bozek A, Ignasiak B, Filipowska B, Jarzab J. House dust mite sublingual immunotherapy: a double-blind, placebo-controlled study in elderly patients with allergic rhinitis. Clin Exp Allergy. 2012;43:242–8.
- Bozek A, Kołodziejczyk K, Krajewska-Wojtys A, Jarzab J. Pre-seasonal, subcutaneous immunotherapy: a double blind, placebo-controlled study in elderly patients with an allergy to grass. Ann Allergy Asthma Immunol. 2016;116:156–61.
- Bousquet J, Khaltaev N, Cruz AA. Allergic rhinitis and its impact on asthma (ARIA) 2008 update (in collaboration with the World Health Organization, GA(2)LEN and AllerGen). Allergy. 2008;63(Suppl. 86):8–160.
- Heinzerling LM, Burbach GJ, Edenharter G, et al. GA(2)LEN skin test study I: GA(2)LEN harmonization of skin prick testing: novel sensitization patterns for inhalant allergens in Europe. Allergy. 2009;64:1498–506.
- Bachert C, Berdel D, Enzmann H. Richtlinien fur die Durchfuhrung von nasalen Provocationtests mit Allergen bei Erkrankungen der oberen Luftwege. Allergologie. 1990;13:53–5.
- Dordal MT, Lluch-Bernal M, Sánchez MC, et al. AllerGen-specific nasal provocation testing: review by the Rhinoconjunctivitis Committee of the Spanish Society of Allergy and Clinical Immunology. J Investig Allergol Clin Immunol. 2011;21:1–12.
- Canonica GW, Baena-Cagnani CE, Bousquet J, et al. Recommendations for standardization of clinical trials with Allergen specific immunotherapy for respiratory allergy. A statement of a World Allergy Organization (WAO) taskforce. Allergy. 2007;62:317–24.
- Grouin JM, Vicaut E, Jean-Alphonse S, et al. The average adjusted symptom score, a new primary efficacy end-point for specific allergen immunotherapy trials. Clin Exp Allergy. 2011;41:1282–8.
- Calderón MA, Rodríguez Del Río P, Vidal C, et al. An EAACI “European survey on adverse systemic reactions in Allergen immunotherapy (EASSI)”: the methodology. Clin Transl Allergy. 2014;4:22.
- Tripathi A, Patterson R. Impact of allergic rhinitis treatment on quality of life. Pharmacoeconomics. 2001;19:891–9.
- Raherison C, Nejjari C, Marty ML, et al. IgE level and Phadiatop in an elderly population from the PAQUID cohort: relationship to respiratory symptoms and smoking. Allergy. 2004;59:940–5.
- Karakoc-Aydiner E, Eifan AO, Baris S, et al. Long-term effect of sublingual and subcutaneous immunotherapy in dust mite-allergic children with asthma/rhinitis: a 3-year prospective randomized controlled trial. Investig Allergol Clin Immunol. 2015;25(5):334–42.
- Song W, Lin X, Chai R. Evaluation of long-term effect for house dust mite subcutaneous immunotherapy for patients with allergic rhinitis. Zhonghua Er Bi Yan Hou Tou Jing Wai Ke Za Zhi. 2015;50(8):632–5.
- Yilmaz Sahin AA, Corey JP. Rhinitis in the elderly. Curr Allergy Asthma Rep. 2006;6:125–31.
- Shamji MH, James LK, Durham SR. Serum immunologic markers for monitoring allergen-specific immunotherapy. Immunol Allergy Clin North Am. 2011;31:311–23.
- Canonica GW, Caria M, Venuti D, Cipro G, Ciprandi G, Bagnasco M. T cell activation through different membrane structures (T3/Ti, T11, T44) and frequency analysis of proliferating and interleukin-2 producer T lymphocyte precursors in aged individuals. Mech Ageing Dev. 1988;42(1):27–35.
- Ogra LP. Ageing and its possible impact on mucosal immune responses. Ageing Res Rev. 2010;9:101–6.
- Woodland DL, Blackman MA. Immunity and age: living in the past? Trends Immunol. 2006;27:303–7.
- Busse PJ, Mathur SK. Age-related changes in immune function: effect on airway inflammation. J Allergy Clin Immunol. 2010;126(4):690–9.
- Pfaar O, van Twuijver E, Hecker H, Boot JD, van Ree R, Klimek L. Accelerated up-dosing of subcutaneous immunotherapy with a registered allergoid grass pollen preparation. Int Arch Allergy Immunol. 2013;160:420–4.
- Hansen I, Hörmann K, Stuck BA, Schneider-Gêne S, Mösges R, Klimek L. Cluster-immunotherapy in seasonal allergic rhinitis: safety aspects of induction therapy with depot allergoids (Purethal). Laryngo Rhino Otologie. 2003;82:558–63.
- Ceuppens JL, Bullens D, Kleinjans H, van der Werf J. Immunotherapy with a modified birch pollen extract in allergic rhinoconjunctivitis: clinical and immunological effects. Clin Exp Allergy. 2009;39:1903–9.
- Armentia A, Fernandez A, Tapias JA, et al. Immunotherapy with allergic extracts in geriatric patients: evaluation of effectiveness and safety. Allergol Immunopathol. 1995;21:193–6.
- Asero R. Efficacy of injection immunotherapy with ragweed and birch pollen in elderly patients. Int Arch Allergy Immunol. 2004;135:332–5.





