5391
24 Августа 2020
Philipp Schuetz*, Yannick Wirz*, Ramon Sager*, Mirjam Christ-Crain, Daiana Stolz, Michael Tamm, Lila Bouadma, Charles E Luyt, Michel Wolff, Jean Chastre, Florence Tubach, Kristina B Kristoffersen, Olaf Burkhardt, Tobias Welte, Stefan Schroeder, Vandack Nobre, Long Wei, Heiner C Bucher, Djillali Annane, Konrad Reinhart, Ann R Falsey, Angela Branche, Pierre Damas, Maarten Nijsten, Dylan W de Lange, Rodrigo O Deliberato, Carolina F Oliveira, Vera Maravić-Stojković, Alessia Verduri, Bianca Beghé, Bin Cao, Yahya Shehabi, Jens-Ulrik S Jensen, Caspar Corti, Jos A H van Oers, Albertus Beishuizen, A...
Philipp Schuetz*, Yannick Wirz*, Ramon Sager*, Mirjam Christ-Crain, Daiana Stolz, Michael Tamm, Lila Bouadma, Charles E Luyt, Michel Wolff, Jean Chastre, Florence Tubach, Kristina B Kristoffersen, Olaf Burkhardt, Tobias Welte, Stefan Schroeder, Vandack Nobre, Long Wei, Heiner C Bucher, Djillali Annane, Konrad Reinhart, Ann R Falsey, Angela Branche, Pierre Damas, Maarten Nijsten, Dylan W de Lange, Rodrigo O Deliberato, Carolina F Oliveira, Vera Maravić-Stojković, Alessia Verduri, Bianca Beghé, Bin Cao, Yahya Shehabi, Jens-Ulrik S Jensen, Caspar Corti, Jos A H van Oers, Albertus Beishuizen, Armand R J Girbes, Evelien de Jong, Matthias Briel*, Beat Mueller
Lancet Infect Dis 2018;
18: 95-107
Опубликовано онлайн
13 октября 2017 г. dx.doi.org S1473-3099(17)30592-3
Резюме
Предпосылки к проведению исследования. В феврале 2017 г. Управление США по контролю качества пищевых продуктов и лекарственных средств (FDA) одобрило использование показателя уровня прокальцитонина в крови как маркера бактериальной инфекции при выборе антибактериальной терапии у пациентов с острыми респираторными инфекциями. Был проведен метаанализ данных пациентов 26 рандомизированных контролируемых исследований с целью оценки безопасность терапии, назначаемой на основании уровня прокальцитонина у пациентов с острыми респираторными заболеваниями в различных клинических условиях.
Методы. Основываясь на предварительно заданном протоколе Кокрановского сотрудничества, мы провели систематический обзор научной литературы Кокрановского центрального реестра контролируемых исследований, баз данных MEDLINE и Embase и объединенных индивидуальных данных участников клинических исследований с острыми респираторными заболеваниями. Участники были случайным образом разделены на две группы: основную, где всем был назначен антибиотик, доза которого рассчитывалась исходя из концентрации прокальцитонина (группа назначения терапии с учетом уровня прокальцитонина), и контрольную. Сопутствующие основные конечные точки включали смертность в течение 30 дней и неэффективность лечения в связи с клиническими условиями. Дополнительные конечные точки включали применение антибиотиков, продолжительность пребывания в стационаре и побочные эффекты, связанные с применением антибиотиков.
Результаты. В результате обзора научной литературы было обнаружено 990 записей, из которых после исключения 919 материалов 71 материал оценили на соответствие критериям. Нами были отобраны данные 6708 пациентов из 26 соответствующих критериям исследований, которые были проведены в 12 странах. Уровень смертности в течение 30 дней оказался значительно ниже в основной группе, где было назначено лечение на основании оценки уровня прокальцитонина, по сравнению с контрольной группой: 286 (9%) смертельных исходов среди 3336 пациентов в основной группе и 336 (10%) смертельных исходов среди 3372 пациентов в контрольной группе; скорректированное отношение шансов (ОШ) 0,83; 95% ДИ от 0,70 до 0,99, p = 0,037. Снижение смертности было схожим во всех подгруппах, выделенных в зависимости от клинических условий и типов инфекции (pвзаимодействия > 0,05), несмотря на то что уровень смертности был очень низким в условиях первичной медицинской помощи и среди пациентов с острым бронхитом. Назначение лечения на основании оценки уровня прокальцитонина также было связано с сокращением продолжительности воздействия антибиотиков на 2,4 дня (5,7 и 8,1 дня; 95% ДИ от -2,71 до -2,15, p < 0,0001) и снижением частоты развития побочных эффектов, связанных с применением антибиотиков (16% и 22%, скорректированное ОШ 0,68; 95% ДИ от 0,57 до 0,82, p < 0,0001).
Интерпретация результатов. Использование показателя уровня прокальцитонина при выборе антибактериальной терапии у пациентов с острыми респираторными заболеваниями снижает резистентность к воздействию антибиотиков, частоту развития побочных эффектов и улучшает показатели выживаемости. Таким образом, повсеместное внедрение протоколов определения уровня прокальцитонина при острых респираторных инфекциях может повысить эффективность антибактериальной терапии в отношении клинических исходов и существующей в настоящее время угрозы развития полирезистентности к антибиотикам.
Финансирование. Национальный институт здоровья
Вводная информация
В феврале 2017 года Управление США по контролю качества пищевых продуктов и лекарственных средств (FDA) одобрило использование показателя уровня прокальцитонина в крови как маркера бактериальной инфекции при выборе антибактериальной терапии острых респираторных заболеваний и сепсиса [1]. Прокальцитонин представляет собой продукт гена, родственного кальцитонину, который выделяется клетками эпителия в ответ на присутствие бактериальных инфекций. При вирусных инфекциях его количество, напротив, снижается [2, 3]. Результаты исследований указывают на стремительное падение концентрации прокальцитонина в период восстановления после острых бактериальных инфекций [4]. Было предложено использовать уровень прокальцитонина в качестве суррогатного маркера ответа организма на бактериальную инфекцию в дополнение к стандартным клиническим и/или диагностическим параметрам, чтобы облегчить ведение пациентов с клиническими симптомами системных инфекций и упростить процесс выбора антибиотиков при назначении лечения [5].
Острые респираторные инфекции являются одной из основных причин госпитализации и смертности среди взрослого населения по всему миру и связаны с избыточным применение антибиотиков [6]. Несмотря на то что более 40% респираторных инфекций имеют вирусную природу, неточность бактериальных исследований и обеспокоенность работников здравоохранения по поводу развития множественных инфекций в большинстве случаев приводят к назначению антибиотиков [7]. Результаты нескольких исследований указывают на значительное снижение применения антибиотиков в тех случаях, когда решения о назначении антибиотиков пациентам в группе низкого риска (например, у пациентов с клиническими проявлениями бронхита в отделении экстренной медицинской помощи), как и решения о продолжительности терапии у пациентов в группе высокого риска (например, у пациентов с пневмонией), принимаются на основании оценки уровня прокальцитонина [8]. Однако несмотря на то что в ходе одного исследования [9] было подтверждено снижение уровня смертности в отделении интенсивной терапии (ОИТ) в связи с назначением антибактериальной терапии на основании уровня прокальцитонина, из-за недостаточной статистической значимости большинства отдельных исследований все еще сложно получить убедительные доказательства безопасности такого подхода в любых клинических условиях и при разных типах респираторных инфекций [9].
Кроме того, в ходе предыдущих метаанализов [10-12] было установлено, что несмотря на эффективность использования показателей уровня прокальцитонина в отношении снижения применения антибиотиков, убедительные данные об эффективности назначения антибактериальной терапии на основании оценки уровня прокальцитонина отсутствовали. Эти метаанализы основаны скорее на сводных данных, а не на индивидуальных показателях пациентов, что ограничивает возможность согласовать определения клинических исходов и оценить различия между подгруппами. Кроме того, метаанализы имели узкую направленность, поэтому включали только ограниченное число исследований.
Мы выполнили поиск и метаанализ индивидуальных данных пациентов из 26 рандомизированных клинических исследований [9, 13-37], следуя заранее определенному протоколу Кокрановского сотрудничества [38, 39], с целью полной и однозначной оценки безопасности использования уровня прокальцитонина при выборе антибактериальной терапии у пациентов с респираторными заболеваниями в разных клинических условиях и при разных типах респираторных инфекций. Данный анализ представляет собой обновленную версию предыдущего метаанализа, выполненного в 2012 году [39]. Расширенная версия этого обзора будет опубликована в Кокрановской библиотеке.
Методы
Стратегия поиска и критерии отбора
Выбор исследований и сбор данных для этого систематического обзора и метаанализа был проведен на основе протокола, опубликованного в Кокрановской библиотеке, и отчета, подготовленного в соответствии с рекомендациями по сбору индивидуальных данных пациентов PRISMA [40, 41].
Мы собрали индивидуальные данные пациентов, которые участвовали в рандомизированных контролируемых исследованиях, соответствующих критериям, с клиническим диагнозом «острые инфекции верхних или нижних дыхательных путей», включая внебольничную пневмонию, внутрибольничную пневмонию, вентиляционно-ассоциированную пневмонию, обострение ХОБЛ и бронхит. Мы исключили из анализа исследования с участием детей и исследования, в которых не применяли показатели уровня прокальцитонина при назначении и определении продолжительности антибактериальной терапии.
Стратегия поиска данных для обзора была обновлена 10 февраля 2017 г. совместно с Кокрановским сотрудничеством и применялась ко всем базам данных, начиная с момента их появления и до 10 февраля 2017 г. Все ссылки были проверены на соответствие критериям. Поиск был выполнен в следующих базах данных: Кокрановский центральный реестр контролируемых исследований (CENTRAL, 10 февраля 2017 г., номер 1), MEDLINE (с 1966 г. по 10 февраля 2017 г.) и Embase (с 1980 г. по 10 февраля 2017 г.). Ограничения по языку или стране публикации отсутствовали.
Два рецензента (YW и RS) самостоятельно оценивали соответствие исследований критериям на основе заголовков, аннотаций, полных текстов отчетов и более подробной информации от исследователей при необходимости. У исследователей запросили протоколы, индивидуальные регистрационные карты и неотредактированные базы данных с индивидуальными данными пациентов, представленными во всех исследованиях и соответствующих критериям. Данные каждого исследования проверили на соответствие заявленным результатам, все запросы были разрешены при участии основного исследователя, менеджера данных клинических исследований и статиста. Данные всех исследований оценивали последовательно с использованием стандартных определений и параметров, поэтому показатели смертности и частоты нежелательных исходов незначительно отличались от предыдущих отчетов.
В соответствии с Кокрановской методикой мы применяли систему GRADE [42] для оценки риска систематической ошибки, связанной с отбором, ходом исследования, выявлением исхода, выбыванием участников, сообщением информации пациентом, и других систематических ошибок.
Анализ данных
Всех пациентов с острыми респираторными инфекциями включили в анализ и рандомизировали на две группы: основную, где всем был назначен антибиотик, доза которого рассчитывалась исходя из концентрации прокальцитонина (группа назначения терапии с учетом уровня прокальцитонина), и контрольную. Две заранее определенные основные конечные точки представляли собой смертность по любым причинам в течение 30 дней после рандомизации и неэффективность терапии в течение 30 дней после рандомизации. Для исследований с более коротким периодом наблюдения использовали имеющиеся данные (такие как неэффективность лечения на момент выписки из больницы). Определения неэффективности терапии варьировали и отличались для каждого типа клинических условий. В условиях первичной медицинской помощи неэффективность терапии определяли как смертельный исход, госпитализация, развитие осложнений, связанных с инфекцией (эмпиемы при инфекциях нижних дыхательных путей или менингита при инфекциях верхних дыхательных путей), рецидив или усугубление инфекции и сообщения пациентов о симптомах непроходящей респираторной инфекции (лихорадке, кашле, одышке) в период последующего наблюдения, продолжительность которого составила 30 дней. Рецидив или усугубление инфекции определяли как применение нового курса антибиотиков у пациентов, которые прекратили антибактериальную терапию, или повышение дозы или частоты приема у пациентов, которые уже получают лечение по поводу той же индексной инфекции. Для пациентов, состояние которых изначально оценивали в отделении скорой помощи или больнице, но не в ОИТ, неэффективность лечения определяли как смертельный исход, последующий перевод в ОИТ, повторная госпитализация после выписки, развитие осложнений, связанных с инфекцией (эмпиемы или синдрома острой дыхательной недостаточности), и рецидив или усугубление симптомов инфекции в период последующего наблюдения, продолжительность которого составила 30 дней. В условиях ОИТ неэффективность терапии определяли как смертельный исход в период последующего наблюдения продолжительностью 30 дней, рецидив или усугубление симптомов инфекции.
Дополнительными конечными точками были показатели применения антибиотиков, которые определяли как назначение антибиотиков, продолжительность антибактериальной терапии (в днях) и средний показатель воздействия антибиотиков (общее число дней применения антибиотиков, деленное на число пациентов). Предварительный анализ других клинических исходов включал продолжительность пребывания в стационаре, госпитализацию в ОИТ, продолжительность пребывания в ОИТ, частоту развития побочных эффектов, связанных с применением антибиотиков (приложение, с. 8), и количество дней с ограничениями повседневной физической активности в течение 14 дней после рандомизации.
Для сопутствующих основных конечных точек (смертность и неэффективность терапии) мы рассчитали отношение шансов (ОШ) и 95% доверительные интервалы (ДИ) с использованием многофакторной иерархической логистической регрессии [43, 44]. В этом многофакторном анализе в качестве переменных использовали группу лечения, возраст, пол и тип инфекции. Для контроля изменчивости в рамках одного исследования и между исследованиями мы добавили в модель переменную «исследование» в качестве случайного эффекта. Модели линейной регрессии скорректировали по непрерывным конечным точкам, логистические модели скорректировали по бинарным дополнительным конечным точкам. Анализ выполняли, ориентируясь на назначенное лечение, то есть данные пациентов оценивали исходя из того, в какую группу они были рандомизированы. Из анализа исключили пациентов, которые отозвали информированное согласие, и пациентов, с которыми была утрачена связь для последующего наблюдения до 30-го дня после рандомизации. Данные пациентов с продолжительностью наблюдения короче 30 дней цензурировали, чтобы выполнить анализы времени до наступления события.
Были выполнены заранее установленные анализы чувствительности исследования в отношении показателей качества, сокрытия порядка распределения, оценки клинических исходов с использованием слепого метода, продолжительности последующего наблюдения и соблюдения протокола (< 70% в сравнении с ≥ 70%). Мы оценивали гетерогенность тяжести заболевания в популяции пациентов при помощи заранее установленных анализов чувствительности, стратифицированных по клиническим условиям и диагнозу. Мы проанализировали эффекты в подгруппах, добавив в модель условия взаимодействия. Наконец, гетерогенность и несогласованность оценили в ходе дальнейшего метаанализа сводных данных всех исследований, соответствующих критериям, с использованием величины I2 и Кокрановского Q-критерия [45]. Статистический анализ выполнили с использованием программ Stata (версия 9.2) и Review Manager (версия 5.3).
Роль источника финансирования
Спонсор данного исследования не принимал участия в разработке дизайна исследования, сборе, анализе и интерпретации данных или написании этого отчета. Ответственный автор имел полный доступ ко всем данным, полученным в ходе исследования, и является ответственным за окончательное решение о публикации материала.
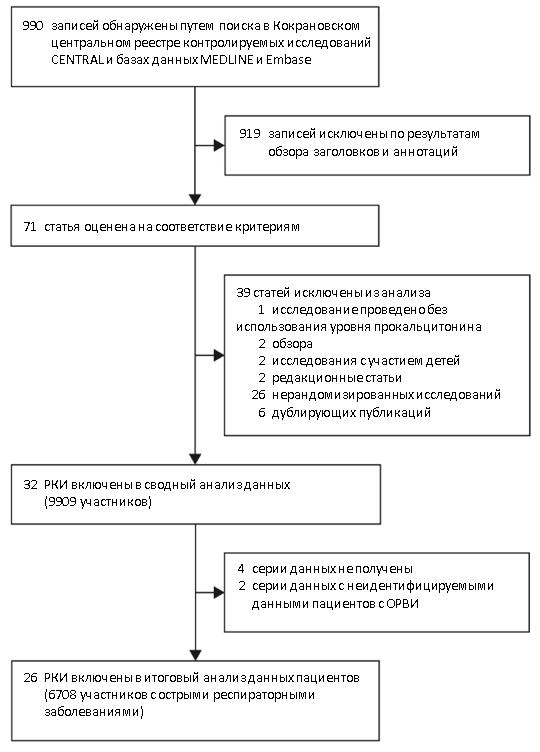 Рисунок 1. Выборка исследований (РКИ — рандомизированное клиническое исследование)
Рисунок 1. Выборка исследований (РКИ — рандомизированное клиническое исследование)
Taблица 1. Характеристики исследований, включенных в анализ
Результаты
В результате обзора научной литературы было обнаружено 990 записей, из которых после исключения 919 материалов 71 материал был оценен на соответствие критериям (рис. 1). Были получены данные 6708 пациентов, которые затем были включены в метаанализ 26 исследований, соответствующих критериям. Были исключены два исследования, в которых респираторные инфекции у пациентов не были подтверждены. Кроме того, данные пациентов в четырех дополнительных исследованиях были недоступны.
Исследования проводились в 12 странах: Австралии, Бельгии, Бразилии, Китае, Дании, Франции, Германии, Италии, Нидерландах, Сербии, Швейцарии и США (таблица 1, приложение, стр. 1). Были включены два исследования в отделениях первичной медицинской помощи у пациентов с инфекциями верхних и нижних дыхательных путей (n = 1008), 11 исследований, проведенных в ОСП и терапевтических отделениях у пациентов с инфекциями нижних дыхательных путей (n = 3253), и 13 исследований в ОИТ у пациентов с сепсисом, вызванным инфекциями нижних дыхательных путей (n = 2447). Алгоритмы учета уровня прокальцитонина, использованные в разных исследованиях, имели схожие схемы и схожие рекомендации по назначению и продолжению антибактериальной терапии на основании пороговых уровней прокальцитонина. Уровень приверженности пациентов алгоритмам лечения варьировал от 44% до 100% (приложение, стр. 3). Качество исследований, определенное согласно критериям GRADE, варьировало от умеренного до высокого (приложение, стр. 6). В большинстве исследований медицинские работники и пациенты не имели сведений о вмешательстве, но в половине исследований не выполнялась оценка исходов с применением слепого метода. По данным оценки воронкообразной диаграммы признаки систематических ошибок, связанных с публикацией, отсутствовали (приложение, стр. 7).
Исходные характеристики отдельных пациентов были схожими в группе, где использовалась оценка уровня прокальцитонина, и в контрольной группе (таблица 2). Большинство участников находились в ОСП или ОИТ. Внутрибольничная пневмония была наиболее частым диагнозом и отмечалась более чем у 40% пациентов (таблица 2).
Taблица 2. Исходные характеристики пациентов, включенных в исследование
Данные представлены как среднее значение (СО) или n (%). ОИТ — отделение интенсивной терапии. ХОБЛ — хроническая обструктивная болезнь легких
В течение 30 дней было зарегистрировано 286 (9%) смертельных исходов среди 3336 пациентов основной группы, которым проводилось лечение на основании оценки уровня прокальцитонина, и 336 (10%) смертельных исходов среди 3372 пациентов в контрольной группе. Эти показатели могут рассматриваться как статистически значимые и демонстрируют более низкий уровень смертности при назначении терапии на основании уровня прокальцитонина (скорректированное ОШ 0,83; 95% ДИ 0,70–0,99, p = 0,037; таблица 3). Этот эффект наблюдался во всех клинических условиях (статистически значимые различия, связанные с эффектом в подгруппе, отсутствовали), несмотря на то что оценить смертность в условиях первичной терапии не представлялось возможным и в контрольной группе был зарегистрирован только один смертельный исход. Влияние на смертность также было одинаковым при разных типах инфекций (отсутствовали статистически значимые различия для каждого вида взаимодействий) за исключением пациентов с бронхитом, у которых оценить показатели смертности не представлялось возможным (таблица 3).
Taблица 3. Клинические конечные точки в общем и стратифицированные по клиническим условиям и диагнозу
Данные представлены как значения n, среднее значение (СО) или n (%), если не указано иное. ОШ — отношение шансов. ОИТ — отделение интенсивной терапии. ХОБЛ — хроническая обструктивная болезнь легких. *Многофакторная иерархическая регрессия с исходом, представляющим интерес, в качестве зависимой переменной, возрастом и диагнозом инфекции дыхательных путей в качестве независимых переменных и исследованием в качестве случайного эффекта.
В группе, где использовалась оценка уровня прокальцитонина, показатели неэффективности терапии были численно ниже таковых, наблюдавшихся в контрольной группе, но статистически значимые различия отсутствовали (23,0% и 24,9%; скорректированное ОШ 0,90; 95% ДИ 0,80–1,01, p = 0,068). Схожие результаты были получены в подгруппах, выделенных в зависимости от клинических условий и типа респираторной инфекции (pвзаимодействий > 0,05; таблица 3). Показатели смертности и неэффективности терапии также значимо не отличались от результатов основного анализа, выполненного в рамках анализа чувствительности на базе основных показателей качества исследований, при этом не было получено данных, свидетельствующих об изменении эффекта (приложение, стр. 5).
В качестве дополнительного анализа чувствительности был проведен метаанализ сводных результатов всех исследований, соответствующих критериям, включая шесть исследований, изначально исключенных из анализа индивидуальных данных пациентов (рис. 2). Точечная оценка смертности была аналогична результатам анализа индивидуальных данных пациентов, но не была статистически значимой (ОШ 0,89; 95% ДИ 0,78–1,01). Результаты сводного анализа данных по неэффективности лечения указывают на статистически значимое снижение риска неэффективности терапии при назначении лечения на основании оценки уровня прокальцитонина (0,90; 0,81–0,99). Гетерогенность для обеих конечных точек была низкой, указывая на схожие эффекты в разных подгруппах (I2 = 0 % в обоих случаях).

 Рисунок 2. Лесовидная диаграмма, показывающая общую смертность (A) и неэффективность терапии (B) через 30 дней, по данным метаанализа сводных данных (Отношение шансов, рассчитанное с помощью модели со случайными эффектами Мантеля-Хензеля)
Рисунок 2. Лесовидная диаграмма, показывающая общую смертность (A) и неэффективность терапии (B) через 30 дней, по данным метаанализа сводных данных (Отношение шансов, рассчитанное с помощью модели со случайными эффектами Мантеля-Хензеля)
Назначение лечения на основании оценки уровня прокальцитонина было связано со снижением общей величины воздействия антибиотиков (в среднем на 5,7 дня в сравнении с 8,1 дня в контрольной группе, скорректированный коэффициент регрессии -2,43 дня; 95% ДИ от -2,71 до 2,15, p < 0,0001; таблица 4, рис. 3). В основной группе, где оценивался показатель уровня прокальцитонина, антибиотики назначались меньшему числу пациентов, чем в контрольной группе, и продолжительность антибактериальной терапии была меньше. Влияние на объем применения антибиотиков различалось в зависимости от клинических условий. В условиях первичной медицинской помощи меньшая величина воздействия антибиотиков была обусловлена в основном более низкой исходной частотой назначения антибиотиков в группе, где оценивался уровень прокальцитонина, по сравнению с контрольной (pвзаимодействий < 0,0001). Аналогичным образом меньшее воздействие антибиотиков, обусловленное более низкой частотой назначения, отмечалось при некоторых инфекциях, например, при остром бронхите.
Taблица 4. Показатели антибактериальной терапии в целом и стратифицированные по клиническим условиям и диагнозу
Данные представлены как значения n, среднее значение (СО) или n (%), если не указано иное. ОШ — отношение шансов. ХОБЛ – хроническая обструктивная болезнь легких. *Многофакторная иерархическая регрессия, скорректированная по возрасту и диагнозу, в которой исследование используется как случайный эффект. †Общее количество дней приема антибиотиков у всех пациентов. ‡ Общее количество дней приема антибиотиков у пациентов, рандомизированно распределенных в группы лечения.
 Рисунок 3. Применение антибиотиков: (A) Доля пациентов, получавших антибиотики. (B) Средняя продолжительность применения антибиотиков
Рисунок 3. Применение антибиотиков: (A) Доля пациентов, получавших антибиотики. (B) Средняя продолжительность применения антибиотиков
Низкая частота назначения антибиотиков и меньшая продолжительность антибактериальной терапии играли определенную роль в снижении величины воздействия антибактериальной терапии в отделении скорой помощи. В условиях ОИТ и у пациентов с внутрибольничной пневмонией меньшая величина воздействия антибиотиков в основном объяснялась коротким периодом лечения.
Наблюдалось статистически значимое снижение частоты развития побочных эффектов, связанных с применением антибиотиков, в группе, где оценивался уровень прокальцитонина (16% и 22%; скорректированное ОШ 0,68; 95% ДИ 0,57–0,82, p < 0,0001).
Этот клинический исход оценивали только в условиях первичной медицинской помощи и неотложной помощи (шесть исследований). Данные, свидетельствующие об эффекте в подгруппах, отсутствовали (pвзаимодействий > 0,05; таблица 3).
Показатели продолжительности пребывания в стационаре (скорректированный коэффициент регрессии -0,19 дня; 95% ДИ от -0,96 до 0,58, p = 0,626) и ОИТ (0,39 дня; 95% ДИ от -0,81 до 1,58, p = 0,524) были схожими в основной и контрольной группах, а также в подгруппах, выделенных в зависимости от клинических условий и заболеваний (pвзаимодействий > 0,05; таблица 3).
Обсуждение
Насколько нам известно, этот отчет о систематическом обзоре и метаанализе индивидуальных данных пациентов из 26 рандомизированных исследований, проведенных с участием 6708 пациентов, является первым отчетом, описывающим статистически значимое и важное улучшение клинических исходов и, в особенности, сниженный риск смертности при острых респираторных заболеваниях в случае использования оценки уровня прокальцитонина в процессе принятия решений относительно антибактериальной терапии. Этот эффект наблюдался при всех клинических условиях и типах инфекций и его устойчивость была подтверждена в ходе различных анализов чувствительности. Среди пациентов из отделений первичной медицинской помощи и пациентов с острым бронхитом уровень смертности был очень низким, и благоприятный эффект использования уровня прокальцитонина не поддавался надежной оценке.
Использование показателя уровня прокальцитонина при выборе антибактериальной терапии привело к снижению частоты развития побочных эффектов, связанных с применением антибиотиков, но не повлияло на продолжительность пребывания в ОИТ или стационаре.
Известно, что острые респираторные инфекции возникаю в результате бактериального, вирусного заражения и по другим причинам, а для их лечения часто применяют антибиотики [6, 7, 46]. Несмотря на то что раннее начало антибактериальной терапии снижает тяжесть течения заболевания, связанного с бактериальной инфекций, избыточное применение антибиотиков у пациентов с вирусным бронхитом и сепсисом приводит к развитию мультирезистентных бактериальных патогенов [47, 48]. Сокращение объема применения антибиотиков без повышения риска нежелательных исходов считается приоритетом в международном медицинском сообществе. Последние 10 лет особое внимание уделялось прокальцитонину - маркеру бактериальной инфекции в крови как вспомогательному инструменту клинической оценки заболевания и определения стандартных клинических параметров в рамках процедур принятия решений относительно назначения антибактериальной терапии пациентам с острыми респираторными инфекциями. Уровень прокальцитонина повышается в течение первых 6–12 часов с момента инфицирования в ответ на высвобождение провоспалительных медиаторов, достигая максимальных значений при бактериемии, и коррелирует с тяжестью заболевания и клиническими исходами инфицированных пациентов [49, 50].
В отличие от других маркеров воспаления высвобождение прокальцитонина блокируется цитокинами, что характеризует типичный ответ иммунной системы на вирусные инфекции, заключающийся в выработке интерферона γ [51]. Поэтому прокальцитонин является более специфическим маркером бактериальных инфекций, чем С-реактивный белок или лейкоциты [52-54]. Концентрация прокальцитонина снижается примерно на 50% в день в период выздоровления, поэтому этот показатель можно использовать для контроля течения заболевания и в качестве вспомогательного инструмента при принятии решений относительно прекращения антибактериальной терапии.
Важным препятствием для оценки и валидации любого маркера сепсиса является отсутствие надежного эталона для определения бактериальной инфекции, в особенности эталона для определения респираторных инфекций. В предыдущих исследованиях, где использовали посев крови в качестве стандарта, чувствительность и специфичность определения уровня прокальцитонина составляла около 80% [55, 56]. Для повышения чувствительности и специфичности анализа на прокальцитонин в существующих алгоритмах используются различные пороговые значения в сочетании с клиническими критериями [10]. Хотя наблюдательные исследования не позволяют определить диагностическую точность уровня прокальцитонина, можно провести интервенционные исследования, чтобы оценить клинический эффект таких алгоритмов. В ходе нескольких исследований сравнили применение антибиотиков и клинических исходов острых респираторных инфекций у пациентов, которые получали лечение на основании оценки уровня прокальцитонина и без него. В этих исследованиях алгоритмы назначения антибактериальной терапии на основании уровня прокальцитонина объединили с показаниями или противопоказаниями к назначению и продолжению применения антибиотиков на основании клинической стабильности, определенных уровней прокальцитонина или кинетики прокальцитонина [10].
Несмотря на то что результаты большинства исследований указывают на эффективность такой стратегии в отношении уменьшения объема применения антибиотиков, безопасность данного подхода все еще вызывает обеспокоенность.
Анализ результатов назначения антибактериальной терапии на основании оценки уровня прокальцитонина, проведенный нами в крупной сводной популяции пациентов из разных исследований и стран, не предоставил никаких убедительных данных, свидетельствующих о вреде такого подхода, и, что важно, выявил статистически значимое снижение смертности при его применении. Эти результаты согласуются с результатами крупнейшего исследования, проведенного с участием пациентов в ОИТ, которые также указывали на снижение уровня смертности при назначении антибактериальной терапии на основании оценки уровня прокальцитонина [9]. Относительное снижение смертности составило 14% (10,0–8,6%) и было самым высоким в исследованиях в ОИТ (15%) и среди пациентов с внутрибольничной пневмонией (13%) и вентиляционно-ассоциированной пневмонией (23%). У пациентов в отделении неотложной помощи относительное снижение смертности составило 8%, в то время как в условиях первичной медицинской помощи не наблюдалось такого эффекта в связи с низким количеством событий. Эти результаты также были подтверждены в ходе метаанализа сводных данных, который включал 32 исследования, соответствовавших критериям. По всей видимости, использование оценки уровня прокальцитонина несет наибольшую клиническую пользу в популяциях пациентов из группы высокого риска и не связано с проблемами безопасности в группах низкого риска.
Существует несколько возможных объяснений благоприятного влияния антибактериальной терапии, учитывающей уровень прокальцитонина, на снижение смертности среди пациентов с острыми респираторными инфекциями. Во-первых, уровень прокальцитонина дает возможность получить дополнительную прогностическую информацию при оценке состояния пациентов, которая может помочь принять решение относительно места оказания помощи и сроков выписки [29]. В ходе крупномасштабного исследования, проведенного в США [57], было доказано, что кинетика прокальцитонина в течение 72 часов является надежным и независимым прогностическим фактором смертности. Кроме того, раннее выявление пациентов, не ответивших на антибактериальную и другую лекарственную терапию, может помочь профилактике развития нежелательных явлений. Во-вторых, повышенный риск неэффективности терапии в контрольной группе может быть связан с продолжительным приемом антибиотиков, риском развития вторичных осложнений и повторной госпитализации [58, 59]. В проведенном нами исследовании назначение антибактериальной терапии на основании оценки уровня прокальцитонина также было связано с низкой частотой развития побочных эффектов, связанных с применением антибиотиков, которые могут влиять как на показатели неэффективности терапии, так и на показатели смертности. В-третьих, у больных с симптомами острого респираторного заболевания концентрация прокальцитонина ниже ожидаемой может указывать на необходимость искать иные заболевания (например, легочную эмболию или сердечную недостаточность). Наконец, согласно действующим клиническим рекомендациям по лечению сепсиса, в ходе нескольких наблюдательных исследований отмечалось снижение уровня смертности и риска неэффективности терапии в связи с ранним понижением дозы антибиотиков у пациентов с сепсисом по сравнению с пациентами, у которых дозу антибиотиков не снижали [60, 61].
Несмотря на то что в ходе большинства исследований была доказана польза применения алгоритмов назначения антибактериальной терапии на основании оценки уровня прокальцитонина у пациентов в ОИТ и ОСП, клиническая ценность измерения уровня прокальцитонина при оказании первичной медицинской помощи все еще не до конца изучена. Данные наблюдения амбулаторных больных были очень неубедительными в отношении дополнительной клинической ценности изменения уровня прокальцитонина для диагностики инфекций в сравнении с другими маркерами и клиническими параметрами. В ходе выполненного нами анализа, который включал два исследования не меньшей эффективности в условиях первичной медицинской помощи у 1008 пациентов, измерение уровня прокальцитонина оказало значительное влияние на объем применения антибиотиков. Кроме того, судя по количеству дней с ограниченной повседневной физической активностью, показатели выздоровления были схожими между основной группой, где оценивали уровень прокальцитонина, и контрольной группой. Это указывает на то, что пациенты, распределенные в группу использования уровня прокальцитонина и не получавшие антибиотики, не нуждались в антибактериальных препаратах.
Что касается первичной медицинской помощи, можно предположить, что любое вмешательство с использованием других биомаркеров или клинических параметров может снизить объем применения антибиотиков в группе низкого риска и высокой частотой избыточного назначения антибиотиков. В исследованиях, направленных на сравнение уровней прокальцитонина и С-реактивного белка, была установлена слабая корреляция этих биомаркеров, указывая на то, что существуют важные различия, которые могут привести к расхождениям в рекомендациях по применению антибиотиков у отдельных пациентов [62, 63]. Однако все еще существует необходимость в прямых сравнительных исследованиях по оценке клинического эффекта алгоритмов назначения антибактериальной терапии на основании уровня прокальцитонина в сравнении с С-реактивным белком. Наконец, была одна стратегия, которая в условиях стационара оказывала влияние на исходы пациентов. Она заключалась в раннем уведомлении медицинских работников о показателях уровня прокальцитонина. Эта стратегия может повысить эффективность алгоритмов назначения антибактериальной терапии на основании оценки уровня прокальцитонина при их использовании в дальнейших исследованиях в отделениях первичной медицинской помощи.
Мощность данного метаанализа обусловлена тем, что использовался заранее определенный протокол исследования, был выполнен всесторонний поиск, найдены все актуальные исследования и использовалась сеть, которая позволила включить в анализ индивидуальные данные пациентов из большинства исследований, соответствующих критериям. Мы также стандартизировали определения клинических исходов во всех исследованиях и провели соответствующие анализы чувствительности в подгруппах, что позволило преодолеть ограничение предыдущих метаанализов сводных данных и сделать окончательные выводы.
Однако проведенное нами исследование все же имело определенные ограничения. Прежде всего, соблюдение алгоритмов назначения антибактериальной терапии на основании оценки уровня прокальцитонина варьировало от 44 до 100%. Однако результаты анализа чувствительности указывали на то, что в исследованиях с низким и высоким уровнем приверженности наблюдались схожие эффекты. Во-вторых, наш анализ включал только взрослых иммунокомпетентных пациентов с острыми респираторными инфекциями, что снижало обобщаемость наших выводов по отношению к другим популяциям пациентов. В-третьих, наша популяция пациентов была достаточно гетерогенной в отношении клинических условий и типов респираторных инфекций. Эта гетерогенность также ограничивает обобщаемость результатов, в особенности в отношении основной конечной точки (смертности), в частности, остается открытым вопрос, ведет ли назначение антибактериальной терапии на основании оценки уровня прокальцитонина к снижению смертности в условиях первичной медицинской помощи. Наконец, мы не проводили анализ клинико-экономической эффективности в связи с отсутствием данных по затратам в большинстве исследований. В дальнейших исследованиях необходимо изучить экономическую эффективность выбора терапии с учетом оценки уровня прокальцитонина [56].
Таким образом, назначение антибактериальной терапии с учетом оценки уровня прокальцитонина при острых респираторных заболеваниях способствует эффективному снижению величины воздействия антибиотиков и частоты развития побочных эффектов, связанных с их применением, а также к снижению частоты смертельных исходов. Эти результаты наблюдались во всех клинических условиях и при всех клинических проявлениях острых респираторных инфекций, несмотря на то что оценить уровень смертности в условиях первичной медицинской помощи и при остром бронхите не представлялось возможным. Внедренный в клинические алгоритмы параметр уровня прокальцитонина может предоставить дополнительную информацию и улучшить практику ведения пациентов с острыми респираторными заболеваниями за счет снижения величины воздействия антибиотиков и связанного с ним риска развития резистентности, а также, что особенно важно, за счет улучшения клинических исходов. Полученные результаты могут иметь весомое значение для клинической практики и общественного здравоохранения.
Заявление о конфликте интересов
Авторы PS, MC-C и BM получали поддержку от компаний «Термо-Фишер» и «биоМерье» за посещение совещаний и участие в них в качестве докладчиков. BM выступал в качестве консультанта и получал исследовательскую поддержку от компании «Термо-Фишер». HCB и MB получили исследовательскую поддержку от компании «Термо-Фишер» за предыдущий метаанализ данных по вопросам измерения уровней прокальцитонина. Больница DWdL получала финансовую поддержку в проведении рандомизации от компании «Термо-Фишер». DS, OB и MT получали исследовательскую поддержку от компании «Термо-Фишер». TW и SS получали гонорары за лекции и исследовательскую поддержку от компании «Термо-Фишер». CEL получал гонорары за лекции от компаний «Брамс», «Мерк Шарп и Доум-Шибре». JC получал гонорары за консультирование и лекции от компаний «Пфайзер», «Брамс», «Вайт», «Джонсон энд Джонсон», «Нектар-Байер» и «Арпида». CEL получал гонорары за лекции и консультирование от компаний «Мерк Шарп и Доум-Шибре», «Янссен-Силаг», «Жиле», «Астеллас», «Санофи» и «Термо-Фишер». Организация FT получала спонсорскую поддержку от компании «Брамс». Автор CC получил неограниченный грант на 2000 евро от компании «Термо-Фишер Сайентифик» и нефинансовую поддержку от компании «биоМерье» за исследование ProToCOLD. Автор YS получал неограниченные исследовательские гранты от компаний «Термо-Фишер», «биоМерье», «Орион Фарма» и «Пфайзер». Автор ARF участвовал в работе экспертных советов компаний «Новавакс», «Холоджик», «Жиле» и «МедИммьюн», а также получал финансирование исследований от компаний «АстраЗенека», «Санофи Пастер», «ГлаксоСмитКлайн» и «АДМА Байолоджикс». Автор J-USJ заявляет, что в 2016 году он получал приглашение на совещание Европейского респираторного общества от компании «Рош Фармасьютикалз». Авторы YW, RS, LB, KBK, TW, VN, LW, DA, KR, ABr, PD, MN, ROD, CFO, VM-S, AV, BB, BC, JAHvO, ABe, ARJG и EdJ заявляют об отсутствии конфликта интересов.
Благодарность
Национальный институт исследований в области здравоохранения (NIHR) предоставил исследовательский грант для обновления данного обзора. Обзор 2012 г. был подготовлен при поддержке неограниченных исследовательских грантов от компании «Термо-Фишер Сайентифик», фонда Готтфрида и Джулии Бангертер-Райнер, швейцарского фонда грантов по биологии и медицине (SSMBS, PASMP3-127684/1) и компании «Сантесуис». Мы благодарим всех исследователей и пациентов, участвовавших в отдельных исследованиях, за предоставление данных.
Список литературы
Lancet Infect Dis 2018;
18: 95-107
Опубликовано онлайн
13 октября 2017 г. dx.doi.org S1473-3099(17)30592-3
Резюме
Предпосылки к проведению исследования. В феврале 2017 г. Управление США по контролю качества пищевых продуктов и лекарственных средств (FDA) одобрило использование показателя уровня прокальцитонина в крови как маркера бактериальной инфекции при выборе антибактериальной терапии у пациентов с острыми респираторными инфекциями. Был проведен метаанализ данных пациентов 26 рандомизированных контролируемых исследований с целью оценки безопасность терапии, назначаемой на основании уровня прокальцитонина у пациентов с острыми респираторными заболеваниями в различных клинических условиях.
Методы. Основываясь на предварительно заданном протоколе Кокрановского сотрудничества, мы провели систематический обзор научной литературы Кокрановского центрального реестра контролируемых исследований, баз данных MEDLINE и Embase и объединенных индивидуальных данных участников клинических исследований с острыми респираторными заболеваниями. Участники были случайным образом разделены на две группы: основную, где всем был назначен антибиотик, доза которого рассчитывалась исходя из концентрации прокальцитонина (группа назначения терапии с учетом уровня прокальцитонина), и контрольную. Сопутствующие основные конечные точки включали смертность в течение 30 дней и неэффективность лечения в связи с клиническими условиями. Дополнительные конечные точки включали применение антибиотиков, продолжительность пребывания в стационаре и побочные эффекты, связанные с применением антибиотиков.
Результаты. В результате обзора научной литературы было обнаружено 990 записей, из которых после исключения 919 материалов 71 материал оценили на соответствие критериям. Нами были отобраны данные 6708 пациентов из 26 соответствующих критериям исследований, которые были проведены в 12 странах. Уровень смертности в течение 30 дней оказался значительно ниже в основной группе, где было назначено лечение на основании оценки уровня прокальцитонина, по сравнению с контрольной группой: 286 (9%) смертельных исходов среди 3336 пациентов в основной группе и 336 (10%) смертельных исходов среди 3372 пациентов в контрольной группе; скорректированное отношение шансов (ОШ) 0,83; 95% ДИ от 0,70 до 0,99, p = 0,037. Снижение смертности было схожим во всех подгруппах, выделенных в зависимости от клинических условий и типов инфекции (pвзаимодействия > 0,05), несмотря на то что уровень смертности был очень низким в условиях первичной медицинской помощи и среди пациентов с острым бронхитом. Назначение лечения на основании оценки уровня прокальцитонина также было связано с сокращением продолжительности воздействия антибиотиков на 2,4 дня (5,7 и 8,1 дня; 95% ДИ от -2,71 до -2,15, p < 0,0001) и снижением частоты развития побочных эффектов, связанных с применением антибиотиков (16% и 22%, скорректированное ОШ 0,68; 95% ДИ от 0,57 до 0,82, p < 0,0001).
Интерпретация результатов. Использование показателя уровня прокальцитонина при выборе антибактериальной терапии у пациентов с острыми респираторными заболеваниями снижает резистентность к воздействию антибиотиков, частоту развития побочных эффектов и улучшает показатели выживаемости. Таким образом, повсеместное внедрение протоколов определения уровня прокальцитонина при острых респираторных инфекциях может повысить эффективность антибактериальной терапии в отношении клинических исходов и существующей в настоящее время угрозы развития полирезистентности к антибиотикам.
Финансирование. Национальный институт здоровья
Вводная информация
В феврале 2017 года Управление США по контролю качества пищевых продуктов и лекарственных средств (FDA) одобрило использование показателя уровня прокальцитонина в крови как маркера бактериальной инфекции при выборе антибактериальной терапии острых респираторных заболеваний и сепсиса [1]. Прокальцитонин представляет собой продукт гена, родственного кальцитонину, который выделяется клетками эпителия в ответ на присутствие бактериальных инфекций. При вирусных инфекциях его количество, напротив, снижается [2, 3]. Результаты исследований указывают на стремительное падение концентрации прокальцитонина в период восстановления после острых бактериальных инфекций [4]. Было предложено использовать уровень прокальцитонина в качестве суррогатного маркера ответа организма на бактериальную инфекцию в дополнение к стандартным клиническим и/или диагностическим параметрам, чтобы облегчить ведение пациентов с клиническими симптомами системных инфекций и упростить процесс выбора антибиотиков при назначении лечения [5].
Острые респираторные инфекции являются одной из основных причин госпитализации и смертности среди взрослого населения по всему миру и связаны с избыточным применение антибиотиков [6]. Несмотря на то что более 40% респираторных инфекций имеют вирусную природу, неточность бактериальных исследований и обеспокоенность работников здравоохранения по поводу развития множественных инфекций в большинстве случаев приводят к назначению антибиотиков [7]. Результаты нескольких исследований указывают на значительное снижение применения антибиотиков в тех случаях, когда решения о назначении антибиотиков пациентам в группе низкого риска (например, у пациентов с клиническими проявлениями бронхита в отделении экстренной медицинской помощи), как и решения о продолжительности терапии у пациентов в группе высокого риска (например, у пациентов с пневмонией), принимаются на основании оценки уровня прокальцитонина [8]. Однако несмотря на то что в ходе одного исследования [9] было подтверждено снижение уровня смертности в отделении интенсивной терапии (ОИТ) в связи с назначением антибактериальной терапии на основании уровня прокальцитонина, из-за недостаточной статистической значимости большинства отдельных исследований все еще сложно получить убедительные доказательства безопасности такого подхода в любых клинических условиях и при разных типах респираторных инфекций [9].
Кроме того, в ходе предыдущих метаанализов [10-12] было установлено, что несмотря на эффективность использования показателей уровня прокальцитонина в отношении снижения применения антибиотиков, убедительные данные об эффективности назначения антибактериальной терапии на основании оценки уровня прокальцитонина отсутствовали. Эти метаанализы основаны скорее на сводных данных, а не на индивидуальных показателях пациентов, что ограничивает возможность согласовать определения клинических исходов и оценить различия между подгруппами. Кроме того, метаанализы имели узкую направленность, поэтому включали только ограниченное число исследований.
Мы выполнили поиск и метаанализ индивидуальных данных пациентов из 26 рандомизированных клинических исследований [9, 13-37], следуя заранее определенному протоколу Кокрановского сотрудничества [38, 39], с целью полной и однозначной оценки безопасности использования уровня прокальцитонина при выборе антибактериальной терапии у пациентов с респираторными заболеваниями в разных клинических условиях и при разных типах респираторных инфекций. Данный анализ представляет собой обновленную версию предыдущего метаанализа, выполненного в 2012 году [39]. Расширенная версия этого обзора будет опубликована в Кокрановской библиотеке.
| Исследование в контексте Данные, имевшиеся до начала исследования Последние 10 лет особое внимание уделяется использованию маркера бактериальной инфекции прокальцитонина в качестве вспомогательной процедуры при клинической оценке заболевания для разграничения вирусной и бактериальной инфекции, назначении антибактериальной терапии и определении ее продолжительности. В некоторых отдельных исследованиях было отмечено положительное влияние снижения воздействия антибиотиков на пациентов с респираторными инфекциями. Однако сохраняется обеспокоенность по поводу безопасности такого подхода в отношении смертности. В предыдущих метаанализах не было выявлено существенного изменения уровня смертности, однако доверительные интервалы были широкими, поэтому потенциальный вред нельзя исключать. На основе протокола, опубликованного ранее в Кокрановской библиотеке, нами был проведен систематический поиск научной литературы в Кокрановском центральном реестре контролируемых исследований (CENTRAL; январь 2017 г., номер 1) и базах данных MEDLINE (с 1966 г. по февраль 2017 г.) и Embase (с 1980 г. по февраль 2017 г.). Был проведен поиск в базе данных PubMed с использованием терминов «кальцитонин», «прокальцитонин», «ПКТ», «антибактериальные препараты», «антибиотики», «Антибиотики», «антибактериальные», «амоксициллин», «пенициллин», «ампициллин», «ко-тримоксазол», «хлорамфеникол», «триметоприм», «сульфаметоксазол», «Триметоприм/сульфаметоксазол», «биомаркеры», «маркер», «уровень», «уровни», «определять на основании», «на основании», «рандомизированное контролируемое исследование», «рандомизированное», «плацебо», «лекарственная терапия», «рандомизированный», «исследование», «группы», с исключением терминов «животные», «не человек». При поиске в других базах данных использовали схожие поисковые термины. Были отобраны индивидуальные данные пациентов, которые участвовали в рандомизированных контролируемых исследованиях, соответствующих критериям, с клиническим диагнозом острых инфекций верхних или нижних дыхательных путей. |
Дополнительная ценность исследования
Результаты данного исследования указывают на значительное относительное или абсолютное снижение применения антибиотиков у пациентов с респираторными инфекциями при применении протоколов назначения антибактериальной терапии на основании оценки уровня прокальцитонина в сравнении с пациентами в контрольной группе. Хотя такое снижение наблюдалось и в ходе ранее проведенных исследований, что было важным моментом в этой крупной когорте пациентов, мы также отметили улучшение клинических исходов, а именно снижение уровня смертности в течение 30 дней и частоты развития побочных эффектов, связанных с применением антибиотиков. Насколько нам известно, данный анализ впервые продемонстрировал улучшение клинических показателей помимо снижения воздействия антибиотиков при применении протоколов назначения антибактериальной терапии на основании уровня прокальцитонина. Практическая применимость всех имеющихся данных Данный отчет содержит большинство имеющихся данных по уровням прокальцитонина у пациентов с острыми респираторными инфекциями, принимавшими участие в рандомизированных клинических исследованиях. Учитывая положительные результаты, связанные с уменьшением применения антибиотиков и улучшением клинических исходов, данный отчет подтверждает обоснованность использования уровня прокальцитонина при принятии решений относительно назначения антибактериальной терапии пациентам с острыми респираторными заболеваниями. |
Методы
Стратегия поиска и критерии отбора
Выбор исследований и сбор данных для этого систематического обзора и метаанализа был проведен на основе протокола, опубликованного в Кокрановской библиотеке, и отчета, подготовленного в соответствии с рекомендациями по сбору индивидуальных данных пациентов PRISMA [40, 41].
Мы собрали индивидуальные данные пациентов, которые участвовали в рандомизированных контролируемых исследованиях, соответствующих критериям, с клиническим диагнозом «острые инфекции верхних или нижних дыхательных путей», включая внебольничную пневмонию, внутрибольничную пневмонию, вентиляционно-ассоциированную пневмонию, обострение ХОБЛ и бронхит. Мы исключили из анализа исследования с участием детей и исследования, в которых не применяли показатели уровня прокальцитонина при назначении и определении продолжительности антибактериальной терапии.
Стратегия поиска данных для обзора была обновлена 10 февраля 2017 г. совместно с Кокрановским сотрудничеством и применялась ко всем базам данных, начиная с момента их появления и до 10 февраля 2017 г. Все ссылки были проверены на соответствие критериям. Поиск был выполнен в следующих базах данных: Кокрановский центральный реестр контролируемых исследований (CENTRAL, 10 февраля 2017 г., номер 1), MEDLINE (с 1966 г. по 10 февраля 2017 г.) и Embase (с 1980 г. по 10 февраля 2017 г.). Ограничения по языку или стране публикации отсутствовали.
Два рецензента (YW и RS) самостоятельно оценивали соответствие исследований критериям на основе заголовков, аннотаций, полных текстов отчетов и более подробной информации от исследователей при необходимости. У исследователей запросили протоколы, индивидуальные регистрационные карты и неотредактированные базы данных с индивидуальными данными пациентов, представленными во всех исследованиях и соответствующих критериям. Данные каждого исследования проверили на соответствие заявленным результатам, все запросы были разрешены при участии основного исследователя, менеджера данных клинических исследований и статиста. Данные всех исследований оценивали последовательно с использованием стандартных определений и параметров, поэтому показатели смертности и частоты нежелательных исходов незначительно отличались от предыдущих отчетов.
В соответствии с Кокрановской методикой мы применяли систему GRADE [42] для оценки риска систематической ошибки, связанной с отбором, ходом исследования, выявлением исхода, выбыванием участников, сообщением информации пациентом, и других систематических ошибок.
Анализ данных
Всех пациентов с острыми респираторными инфекциями включили в анализ и рандомизировали на две группы: основную, где всем был назначен антибиотик, доза которого рассчитывалась исходя из концентрации прокальцитонина (группа назначения терапии с учетом уровня прокальцитонина), и контрольную. Две заранее определенные основные конечные точки представляли собой смертность по любым причинам в течение 30 дней после рандомизации и неэффективность терапии в течение 30 дней после рандомизации. Для исследований с более коротким периодом наблюдения использовали имеющиеся данные (такие как неэффективность лечения на момент выписки из больницы). Определения неэффективности терапии варьировали и отличались для каждого типа клинических условий. В условиях первичной медицинской помощи неэффективность терапии определяли как смертельный исход, госпитализация, развитие осложнений, связанных с инфекцией (эмпиемы при инфекциях нижних дыхательных путей или менингита при инфекциях верхних дыхательных путей), рецидив или усугубление инфекции и сообщения пациентов о симптомах непроходящей респираторной инфекции (лихорадке, кашле, одышке) в период последующего наблюдения, продолжительность которого составила 30 дней. Рецидив или усугубление инфекции определяли как применение нового курса антибиотиков у пациентов, которые прекратили антибактериальную терапию, или повышение дозы или частоты приема у пациентов, которые уже получают лечение по поводу той же индексной инфекции. Для пациентов, состояние которых изначально оценивали в отделении скорой помощи или больнице, но не в ОИТ, неэффективность лечения определяли как смертельный исход, последующий перевод в ОИТ, повторная госпитализация после выписки, развитие осложнений, связанных с инфекцией (эмпиемы или синдрома острой дыхательной недостаточности), и рецидив или усугубление симптомов инфекции в период последующего наблюдения, продолжительность которого составила 30 дней. В условиях ОИТ неэффективность терапии определяли как смертельный исход в период последующего наблюдения продолжительностью 30 дней, рецидив или усугубление симптомов инфекции.
Дополнительными конечными точками были показатели применения антибиотиков, которые определяли как назначение антибиотиков, продолжительность антибактериальной терапии (в днях) и средний показатель воздействия антибиотиков (общее число дней применения антибиотиков, деленное на число пациентов). Предварительный анализ других клинических исходов включал продолжительность пребывания в стационаре, госпитализацию в ОИТ, продолжительность пребывания в ОИТ, частоту развития побочных эффектов, связанных с применением антибиотиков (приложение, с. 8), и количество дней с ограничениями повседневной физической активности в течение 14 дней после рандомизации.
Для сопутствующих основных конечных точек (смертность и неэффективность терапии) мы рассчитали отношение шансов (ОШ) и 95% доверительные интервалы (ДИ) с использованием многофакторной иерархической логистической регрессии [43, 44]. В этом многофакторном анализе в качестве переменных использовали группу лечения, возраст, пол и тип инфекции. Для контроля изменчивости в рамках одного исследования и между исследованиями мы добавили в модель переменную «исследование» в качестве случайного эффекта. Модели линейной регрессии скорректировали по непрерывным конечным точкам, логистические модели скорректировали по бинарным дополнительным конечным точкам. Анализ выполняли, ориентируясь на назначенное лечение, то есть данные пациентов оценивали исходя из того, в какую группу они были рандомизированы. Из анализа исключили пациентов, которые отозвали информированное согласие, и пациентов, с которыми была утрачена связь для последующего наблюдения до 30-го дня после рандомизации. Данные пациентов с продолжительностью наблюдения короче 30 дней цензурировали, чтобы выполнить анализы времени до наступления события.
Были выполнены заранее установленные анализы чувствительности исследования в отношении показателей качества, сокрытия порядка распределения, оценки клинических исходов с использованием слепого метода, продолжительности последующего наблюдения и соблюдения протокола (< 70% в сравнении с ≥ 70%). Мы оценивали гетерогенность тяжести заболевания в популяции пациентов при помощи заранее установленных анализов чувствительности, стратифицированных по клиническим условиям и диагнозу. Мы проанализировали эффекты в подгруппах, добавив в модель условия взаимодействия. Наконец, гетерогенность и несогласованность оценили в ходе дальнейшего метаанализа сводных данных всех исследований, соответствующих критериям, с использованием величины I2 и Кокрановского Q-критерия [45]. Статистический анализ выполнили с использованием программ Stata (версия 9.2) и Review Manager (версия 5.3).
Роль источника финансирования
Спонсор данного исследования не принимал участия в разработке дизайна исследования, сборе, анализе и интерпретации данных или написании этого отчета. Ответственный автор имел полный доступ ко всем данным, полученным в ходе исследования, и является ответственным за окончательное решение о публикации материала.
 Рисунок 1. Выборка исследований (РКИ — рандомизированное клиническое исследование)
Рисунок 1. Выборка исследований (РКИ — рандомизированное клиническое исследование)Taблица 1. Характеристики исследований, включенных в анализ
| Страна | Клинические условия, тип исследования | Клинический диагноз | Тип использованного алгоритма учета уровня прокальцитонина и предельных концентраций прокальцитонина | |
| Bloos et al (2016)13 | Германия | ОИТ, многоцентровое | Тяжелый сепсис или септический шок | Прекращение лечения на 4-й, 7-й и 10-й день, противопоказания к применению антибиотиков: < 1,0 мкг/л или снижение более чем на 50 % по сравнению с предыдущим показателем |
| Bouadma et al (2010)14 | Франция | ОИТ, многоцентровое | Подозрение на бактериальную инфекцию в период пребывания в ОИТ без предшествующей антибактериальной терапии (< 24 ч.) | Начало и продолжительность терапии, противопоказания к применению антибиотиков: < 0,5 мкг/л (< 0,25 мкг/л); показания к применению антибиотиков: > 0,5 мкг/л (> 1,0 мкг/л) |
| Branche et al (2015)15 | США | ОСП, терапевтическое отделение, одноцентровое | Острая инфекция нижних дыхательных путей | Начало и продолжительность терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л (< 0,1 мкг/л); показания к применению антибиотиков: > 0,25 мкг/л (> 0,5 мкг/л) |
| Briel et al (2008)16 | Швейцария | Отделение первичной медицинской помощи, многоцентровое | Острая инфекция верхних и нижних дыхательных путей | Начало и продолжительность терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л (< 0,1 мкг/л); показания к применению антибиотиков: > 0,25 мкг/л (> 0,5 мкг/л) |
| Burkhardt et al (2010)17 | Германия | Отделение первичной медицинской помощи, многоцентровое | Острая инфекция верхних и нижних дыхательных путей | Начало терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л, показания к применению антибиотиков: > 0,25 мкг/л |
| Christ-Crain et al (2004)18 | Швейцария | ОСП, одноцентровое | Острая инфекция нижних дыхательных путей, подтвержденная данными рентгенографического исследования | Начало терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л (< 0,1 мкг/л); показания к применению антибиотиков: > 0,25 мкг/л (> 0,5 мкг/л) |
| Christ-Crain et al (2006)19 | Швейцария | ОСП, терапевтическое отделение, одноцентровое | Внутрибольничная пневмония, подтвержденная данными рентгенографического исследования | Начало и продолжительность терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л (< 0,1 мкг/л); показания к применению антибиотиков: > 0,25 мкг/л (> 0,5 мкг/л) |
| Corti et al (2016)20 | Дания | ОСП, одноцентровое | Тяжелое обострение ХОБЛ | Начало и продолжительность терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л (0,15 мкг/л)/снижение на 80%, показания к применению антибиотиков: > 0,25 мкг/л |
| de Jong et al (2016)9 | Нидерланды | ОИТ, многоцентровое | Пациенты в критическом состоянии с подозрением на инфекцию | Продолжительность терапии, противопоказания к применению антибиотиков: < 0,5 мкг/л или снижение более чем на 80% |
| Deliberato et al (2013)21 | Бразилия | ОИТ, одноцентровое | Пациенты с сепсисом и подтвержденной бактериальной инфекцией | Продолжительность терапии, противопоказания к применению антибиотиков: < 0,5 мкг/л или снижение более чем на 90% |
| Hochreiter et al (2009)22 | Германия | Хирургическое ОИТ, одноцентровое | Подозрение на бактериальные инфекции и более одного критерия синдрома системной воспалительной реакции | Продолжительность терапии, противопоказания к применению антибиотиков: < 1 мкг/л или снижение более чем на 65% в течение 3 дней |
| Kristoffersen et al (2009)23 | Дания | ОСП, терапевтическая палата, многоцентровое | Острая инфекция нижних дыхательных путей без рентгенографического подтверждения | Начало и продолжительность терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л, показания к применению антибиотиков: > 0,25 мкг/л (> 0,5 мкг/л) |
| Layios et al (2012)24 | Бельгия | ОИТ, одноцентровое | Подозрение на инфекцию | Начало терапии, противопоказания к применению антибиотиков: < 0,5 мкг/л (< 0,25 мкг/л); показания к применению антибиотиков: > 0,5 мкг/л (> 1,0 мкг/л) |
| Long et al (2009)26 | Китай | ОСП, амбулаторные пациенты, одноцентровое | Внутрибольничная пневмония, подтвержденная данными рентгенографического исследования | Начало и продолжительность терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л, показания к применению антибиотиков: > 0,25 мкг/л |
| Long et al (2011)25 | Китай | ОСП, амбулаторные пациенты, одноцентровое; | Внутрибольничная пневмония, подтвержденная данными рентгенографического исследования | Начало и продолжительность терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л, показания к применению антибиотиков: > 0,25 мкг/л |
| Long et al (2014)27 | Китай | ОСП, одноцентровое | Тяжелое обострение астмы | Начало терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л (< 0,1 мкг/л); показания к применению антибиотиков: > 0,25 мкг/л |
| Maravić-Stojković et al (2011)28 | Сербия | Хирургическое ОИТ, одноцентровое | Инфекция после операции на открытом сердце | Начало терапии, показания к применению антибиотиков: > 0,5 мкг/л |
| Nobre et al (2008)29 | Швейцария | ОИТ, одноцентровое | Подозрение на тяжелый сепсис или септический шок | Продолжительность терапии, противопоказания к применению антибиотиков: < 0,5 мкг/л (< 0,25 мкг/л) или снижение более чем на 90%; показания к применению антибиотиков: > 0,5 мкг/л (> 1,0 мкг/л) |
| Oliveira et al (2013)30 | Бразилия | ОИТ, двухцентровое | Тяжелый сепсис или септический шок | Прекращение терапии, исходный уровень < 1,0 мкг/л: противопоказания к применению антибиотиков: 0,1 мкг/л на 4-й день; исходный уровень > 1,0 мкг/л: противопоказания к применению: снижение более чем на 90 % |
| Schroeder et al (2009)31 | Германия | Хирургическое ОИТ, одноцентровое | Тяжелый сепсис после хирургического вмешательства на органах брюшной полости | Продолжительность терапии, противопоказания к применению антибиотиков: < 1 мкг/л или снижение более чем на 65% в течение 3 дней |
| Schuetz et al (2009)32 | Швейцария | ОСП, терапевтическая палата, многоцентровое | Острая инфекция нижних дыхательных путей, подтвержденная данными рентгенографического исследования | Начало и продолжительность терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л (< 0,1 мкг/л); показания к применению антибиотиков: > 0,25 мкг/л (> 0,5 мкг/л) |
| Shehabi et al (2014)33 | Австралия | ОИТ, многоцентровое | Подозрение на сепсис, недифференцируемые инфекции | Продолжительность терапии, противопоказания к применению антибиотиков: < 0,25 мкг/л (< 0,1 мкг/л) или снижение более чем на 90% |
Результаты
В результате обзора научной литературы было обнаружено 990 записей, из которых после исключения 919 материалов 71 материал был оценен на соответствие критериям (рис. 1). Были получены данные 6708 пациентов, которые затем были включены в метаанализ 26 исследований, соответствующих критериям. Были исключены два исследования, в которых респираторные инфекции у пациентов не были подтверждены. Кроме того, данные пациентов в четырех дополнительных исследованиях были недоступны.
Исследования проводились в 12 странах: Австралии, Бельгии, Бразилии, Китае, Дании, Франции, Германии, Италии, Нидерландах, Сербии, Швейцарии и США (таблица 1, приложение, стр. 1). Были включены два исследования в отделениях первичной медицинской помощи у пациентов с инфекциями верхних и нижних дыхательных путей (n = 1008), 11 исследований, проведенных в ОСП и терапевтических отделениях у пациентов с инфекциями нижних дыхательных путей (n = 3253), и 13 исследований в ОИТ у пациентов с сепсисом, вызванным инфекциями нижних дыхательных путей (n = 2447). Алгоритмы учета уровня прокальцитонина, использованные в разных исследованиях, имели схожие схемы и схожие рекомендации по назначению и продолжению антибактериальной терапии на основании пороговых уровней прокальцитонина. Уровень приверженности пациентов алгоритмам лечения варьировал от 44% до 100% (приложение, стр. 3). Качество исследований, определенное согласно критериям GRADE, варьировало от умеренного до высокого (приложение, стр. 6). В большинстве исследований медицинские работники и пациенты не имели сведений о вмешательстве, но в половине исследований не выполнялась оценка исходов с применением слепого метода. По данным оценки воронкообразной диаграммы признаки систематических ошибок, связанных с публикацией, отсутствовали (приложение, стр. 7).
Исходные характеристики отдельных пациентов были схожими в группе, где использовалась оценка уровня прокальцитонина, и в контрольной группе (таблица 2). Большинство участников находились в ОСП или ОИТ. Внутрибольничная пневмония была наиболее частым диагнозом и отмечалась более чем у 40% пациентов (таблица 2).
Taблица 2. Исходные характеристики пациентов, включенных в исследование
| Контрольная группа (n = 3372) | Группа использования уровня прокальцитонина (n = 3336) | |
| Возраст (годы) | 61,2 (18,4) | 60,7 (18,8) |
| Пол | ||
| Мужчины | 1910 (57%) | 1898 (57%) |
| Женщины | 1462 (43%) | 1438 (43%) |
| Клинические условия | ||
| Первичная медицинская помощь | 501 (15%) | 507 (15%) |
| Отделение скорой помощи | 1638 (49%) | 1615 (48%) |
| ОИТ | 1233 (37%) | 1214 (36%) |
| Первичный диагноз | ||
| Общее число пациентов с острой инфекцией верхних дыхательных путей | 280 (8%) | 292 (9%) |
| Простуда | 156 (5%) | 149 (4%) |
| Риносинусит, отит | 67 (2%) | 73 (2%) |
| Фарингит, тонзиллит | 46 (1%) | 61 (2%) |
| Общее число пациентов с острой инфекцией нижних дыхательных путей | 3092 (92%) | 3044 (91%) |
| Внебольничная пневмония | 1468 (44%) | 1442 (43%) |
| Внутрибольничная пневмония | 262 (8%) | 243 (7%) |
| Вентиляционно-ассоциированная пневмония | 186 (6%) | 194 (6%) |
| Острый бронхит | 287 (9%) | 257 (8%) |
| Обострение ХОБЛ | 631 (19%) | 621 (19%) |
| Обострение астмы | 127 (4%) | 143 (4%) |
| Другие острые инфекция нижних дыхательных путей | 131 (4%) | 144 (4%) |
| Уровень прокальцитонина на момент включения в исследование | ||
| Данные доступны | 2590 (77%) | 3171 (95%) |
| < 0,1 мкг/л | 921 (36%) | 981 (31%) |
| 0,1–0,25 мкг/л | 521 (20%) | 608 (19%) |
| > 0,25–0,5 мкг/л | 308 (12%) | 383 (12%) |
| > 0,5–2,0 мкг/л | 358 (14%) | 520 (16%) |
| > 2,0 мкг/л | 482 (19%) | 679 (21%) |
Данные представлены как среднее значение (СО) или n (%). ОИТ — отделение интенсивной терапии. ХОБЛ — хроническая обструктивная болезнь легких
В течение 30 дней было зарегистрировано 286 (9%) смертельных исходов среди 3336 пациентов основной группы, которым проводилось лечение на основании оценки уровня прокальцитонина, и 336 (10%) смертельных исходов среди 3372 пациентов в контрольной группе. Эти показатели могут рассматриваться как статистически значимые и демонстрируют более низкий уровень смертности при назначении терапии на основании уровня прокальцитонина (скорректированное ОШ 0,83; 95% ДИ 0,70–0,99, p = 0,037; таблица 3). Этот эффект наблюдался во всех клинических условиях (статистически значимые различия, связанные с эффектом в подгруппе, отсутствовали), несмотря на то что оценить смертность в условиях первичной терапии не представлялось возможным и в контрольной группе был зарегистрирован только один смертельный исход. Влияние на смертность также было одинаковым при разных типах инфекций (отсутствовали статистически значимые различия для каждого вида взаимодействий) за исключением пациентов с бронхитом, у которых оценить показатели смертности не представлялось возможным (таблица 3).
Taблица 3. Клинические конечные точки в общем и стратифицированные по клиническим условиям и диагнозу
| Контрольная группа (n = 3372) | Группа использования уровня прокальцитонина (n = 3336) | Скорректированное ОШ (95% ДИ)*, р-значение | pвзаимодействий | |
| Общий показатель | ||||
| Смертность в течение 30 дней | 336 (10%) | 286 (9 %) | 0,83 (от 0,7 до 0,99), p = 0,037 | .. |
| Неэффективность лечения | 841 (25%) | 768 (23 %) | 0,90 (от 0,80 до 1,01), p = 0,068 | .. |
| Продолжительность пребывания в ОИТ (дни) | 13,3 (16,0) | 13,7 (17,2) | 0,39 (от -0,81 до 1,58), p = 0,524 | .. |
| Продолжительность пребывания в стационаре (дни) | 13,7 (20,6) | 13,4 (18,4) | -0,19 (от -0,96 до 0,58), p = 0,626 | .. |
| Побочные эффекты, связанные с применением антибиотиков | 336/1521 (22%) | 247/1513 (16 %) | 0,68 (от 0,57 до 0,82), p < 0,0001 | .. |
| Исходы, связанные с клиническими условиями | ||||
| Первичная медицинская помощь | 501 | 507 | .. | .. |
| Смертность в течение 30 дней | 1 (< 1%) | 0 (0) | .. | .. |
| Неэффективность лечения | 164 (33%) | 159 (31%) | 0,96 (от 0,73 до 1,25), p = 0,751 | 0,715 |
| Количество дней с ограничениями физической активности | 8,9 (4,2) | 8,9 (4,1) | 0,07 (от -0,44 до 0,59), p = 0,777 | |
| Побочные эффекты, связанные с применением антибиотиков | 128/498 (26%) | 102/506 (20%) | 0,65 (от 0,46 до 0,91), p = 0,012 | 0,596 |
| Отделение скорой помощи | 1638 | 1615 | .. | .. |
| Смертность в течение 30 дней | 62 (4%) | 57 (4%) | 0,91 (от 0,63 до 1,33), p = 0,635 | 0,546 |
| Неэффективность лечения | 292 (18%) | 259 (16%) | 0,87 (от 0,72 до 1,05), p = 0,141 | 0,807 |
| Продолжительность пребывания в стационаре (дни) | 8,2 (10,5) | 8,1 (7,5) | -0,14 (от -0,73 до 0,44), p = 0,631 | 0,684 |
| Побочные эффекты, связанные с применением антибиотиков | 208/1023 (20%) | 145/1007 (14%) | 0,66 (от 0,52 до 0,83), p = 0,001 | 0,596 |
| Палата интенсивной терапии | 1233 | 1214 | .. | .. |
| Смертность в течение 30 дней | 273 (22%) | 229 (19%) | 0,84 (от 0,69 до 1,02), p = 0,081 | 0,619 |
| Продолжительность пребывания в ОИТ (дни) | 14,8 (16,2) | 15,3 (17,5) | 0,56 (от -0,82 до 1,93), p = 0,427 | 0,849 |
| Продолжительность пребывания в стационаре (дни) | 26,3 (26,9) | 25,8 (23,9) | -0,33 (от -2,28 до 1,62), p = 0,739 | 0,641 |
| Клинические исходы, связанные с заболеванием | ||||
| Внебольничная пневмония | 1468 | 1442 | .. | .. |
| Смертность в течение 30 дней | 206 (14%) | 175 (12%) | 0,82 (от 0,66 до 1,03), p = 0,083 | 0,958 |
| Неэффективность лечения | 385 (26%) | 317 (22%) | 0,78 (от 0,66 до 0,93), p = 0,005 | 0,052 |
| Продолжительность пребывания в ОИТ (дни) | 10,5 (10,3) | 11,9 (13,3) | 1,45 (от 0,15 до 2,75), p = 0,029 | 0,119 |
| Продолжительность пребывания в стационаре (дни) | 13,3 (15,7) | 13,9 (16,1) | 0,74 (от -0,25 до 1,73), p = 0,143 | 0,094 |
| Побочные эффекты, связанные с применением антибиотиков | 186/671 (28%) | 127/666 (19%) | 0,62 (от 0,48 до 0,8), p < 0,0001 | 0,227 |
| Обострение ХОБЛ | 631 | 621 | .. | .. |
| Смертность в течение 30 дней | 24 (4%) | 19 (3%) | 0,80 (от 0,43 до 1,48), p = 0,472 | 0,847 |
| Неэффективность лечения | 110 (17%) | 104 (17%) | 0,94 (от 0,7 до 1,27), p = 0,704 | 0,676 |
| Продолжительность пребывания в стационаре (дни) | 9,3 (13,9) | 8,4 (7,2) | -0,6 (от -1,84 до 0,64), p = 0,342 | 0,658 |
| Побочные эффекты, связанные с применением антибиотиков | 30/274 (11%) | 29/275 (11%) | 0,93 (от 0,53 до 1,63), p = 0,805 | 0,198 |
| Острый бронхит | 287 | 257 | .. | .. |
| Смертность в течение 30 дней | 0 (0) | 2 (1%) | .. | .. |
| Неэффективность лечения | 55 (19%) | 52 (20%) | 1,11 (от 0,72 до 1,7), p = 0,643 | 0,4 |
| Продолжительность пребывания в стационаре (дни) | 2,6 (5,7) | 2,2 (4,7) | -0,21 (от -0,9 до 0,48), p = 0,556 | 0,97 |
| Побочные эффекты, связанные с применением антибиотиков | 54/250 (22%) | 39/226 (17%) | 0,77 (от 0,49 до 1,22), p = 0,263 | 0,657 |
| Вентиляционно-ассоциированная пневмония | 186 | 194 | .. | .. |
| Смертность в течение 30 дней | 29 (16%) | 23 (12%) | 0,75 (от 0,41 до 1,39), p = 0,366 | 0,644 |
| Неэффективность лечения | 51 (27%) | 44 (23%) | 0,78 (от 0,48 до 1,28), p = 0,332 | 0,522 |
| Продолжительность пребывания в ОИТ (дни) | 23,5 (20,5) | 21,8 (19,1) | -1,74 (от -5,64 до 2,17), p = 0,383 | 0,441 |
| Продолжительность пребывания в стационаре (дни) | 33,8 (27,6) | 32,0 (23,1) | -2,14 (от -7,04 до 2,75), p = 0,391 | 0,448 |
Данные представлены как значения n, среднее значение (СО) или n (%), если не указано иное. ОШ — отношение шансов. ОИТ — отделение интенсивной терапии. ХОБЛ — хроническая обструктивная болезнь легких. *Многофакторная иерархическая регрессия с исходом, представляющим интерес, в качестве зависимой переменной, возрастом и диагнозом инфекции дыхательных путей в качестве независимых переменных и исследованием в качестве случайного эффекта.
В группе, где использовалась оценка уровня прокальцитонина, показатели неэффективности терапии были численно ниже таковых, наблюдавшихся в контрольной группе, но статистически значимые различия отсутствовали (23,0% и 24,9%; скорректированное ОШ 0,90; 95% ДИ 0,80–1,01, p = 0,068). Схожие результаты были получены в подгруппах, выделенных в зависимости от клинических условий и типа респираторной инфекции (pвзаимодействий > 0,05; таблица 3). Показатели смертности и неэффективности терапии также значимо не отличались от результатов основного анализа, выполненного в рамках анализа чувствительности на базе основных показателей качества исследований, при этом не было получено данных, свидетельствующих об изменении эффекта (приложение, стр. 5).
В качестве дополнительного анализа чувствительности был проведен метаанализ сводных результатов всех исследований, соответствующих критериям, включая шесть исследований, изначально исключенных из анализа индивидуальных данных пациентов (рис. 2). Точечная оценка смертности была аналогична результатам анализа индивидуальных данных пациентов, но не была статистически значимой (ОШ 0,89; 95% ДИ 0,78–1,01). Результаты сводного анализа данных по неэффективности лечения указывают на статистически значимое снижение риска неэффективности терапии при назначении лечения на основании оценки уровня прокальцитонина (0,90; 0,81–0,99). Гетерогенность для обеих конечных точек была низкой, указывая на схожие эффекты в разных подгруппах (I2 = 0 % в обоих случаях).

 Рисунок 2. Лесовидная диаграмма, показывающая общую смертность (A) и неэффективность терапии (B) через 30 дней, по данным метаанализа сводных данных (Отношение шансов, рассчитанное с помощью модели со случайными эффектами Мантеля-Хензеля)
Рисунок 2. Лесовидная диаграмма, показывающая общую смертность (A) и неэффективность терапии (B) через 30 дней, по данным метаанализа сводных данных (Отношение шансов, рассчитанное с помощью модели со случайными эффектами Мантеля-Хензеля)Назначение лечения на основании оценки уровня прокальцитонина было связано со снижением общей величины воздействия антибиотиков (в среднем на 5,7 дня в сравнении с 8,1 дня в контрольной группе, скорректированный коэффициент регрессии -2,43 дня; 95% ДИ от -2,71 до 2,15, p < 0,0001; таблица 4, рис. 3). В основной группе, где оценивался показатель уровня прокальцитонина, антибиотики назначались меньшему числу пациентов, чем в контрольной группе, и продолжительность антибактериальной терапии была меньше. Влияние на объем применения антибиотиков различалось в зависимости от клинических условий. В условиях первичной медицинской помощи меньшая величина воздействия антибиотиков была обусловлена в основном более низкой исходной частотой назначения антибиотиков в группе, где оценивался уровень прокальцитонина, по сравнению с контрольной (pвзаимодействий < 0,0001). Аналогичным образом меньшее воздействие антибиотиков, обусловленное более низкой частотой назначения, отмечалось при некоторых инфекциях, например, при остром бронхите.
Taблица 4. Показатели антибактериальной терапии в целом и стратифицированные по клиническим условиям и диагнозу
| Контрольная группа (n = 3372) | Группа, где оценивался уровен прокальцитонина (n = 3336) | Скорректированное ОШ или разность (95% ДИ), р-значение* | pвзаимодействий | |
| Общий показатель | ||||
| Назначение антибактериальной терапии | 2894 (86%) | 2351 (70%) | 0,27 (от 0,24 до 0,32), p < 0,0001 | .. |
| Продолжительность антибактериальной терапии (дни)† | 9,4 (6,2) | 8,0 (6,5) | -1,83 (от -2,15 до -1,5), p < 0,0001 | .. |
| Общая продолжительность воздействия антибиотиков (дни)‡ | 8,1 (6,6) | 5,7 (6,6) | -2,43 (от -2,71 до -2,15), p < 0,0001 | .. |
| Исходы, связанные с клиническими условиями | ||||
| Первичная медицинская помощь | 501 | 507 | .. | .. |
| Назначение антибактериальной терапии | 316 (63%) | 116 (23%) | 0,13 (от 0,09 до 0,18), p < 0,0001 | < 0,0001 |
| Продолжительность антибактериальной терапии (дни)† | 7,3 (2,5) | 7,0 (2,8) | -0,52 (от -1,07 до 0,04), p = 0,068 | 0,064 |
| Общая продолжительность воздействия антибиотиков (дни)‡ | 4,6 (4,1) | 1,6 (3,2) | -3,02 (от -3,45 до -2,58), p < 0,0001 | 0,101 |
| Отделение скорой помощи | 1638 | 1615 | .. | .. |
| Назначение антибактериальной терапии | 1354 (83%) | 1119 (69%) | 0,49 (от 0,41 до 0,58), p < 0,0001 | < 0,0001 |
| Продолжительность антибактериальной терапии (дни)† | 9,8 (5,4) | 7,3 (5,1) | -2,45 (от -2,86 до -2,05), p < 0,0001 | < 0,0001 |
| Общая продолжительность воздействия антибиотиков (дни)‡ | 8,2 (6,2) | 5,2 (5,4) | -3,02 (от -3,41 до -2,62), p < 0,0001 | < 0,0001 |
| Палата интенсивной терапии | 1233 | 1214 | .. | .. |
| Назначение антибактериальной терапии | 1224 (99%) | 1116 (92%) | 0,02 (от 0,01 до 0,05), p < 0,0001 | < 0,0001 |
| Продолжительность антибактериальной терапии (дни)† | 9,5 (7,4) | 8,8 (7,8) | -1,23 (от -1,82 до -0,65), p < 0,0001 | < 0,0001 |
| Общее воздействие антибиотиков (дни)‡ | 9,5 (7,4) | 8,1 (7,9) | -1,44 (от -1,99 до -0,88), p < 0,0001 | < 0,0001 |
| Клинические исходы, связанные с заболеванием | ||||
| Внебольничная пневмония | 1468 | 1442 | .. | .. |
| Назначение антибактериальной терапии | 1455 (99%) | 1340 (93%) | 0,08 (от 0,04 до 0,15), p < 0,0001 | < 0,0001 |
| Продолжительность антибактериальной терапии (дни)† | 10,5 (6,2) | 8,0 (5,7) | -2,45 (от -2,87 до -2,02), p < 0,0001 | < 0,0001 |
| Общая продолжительность воздействия антибиотиков (дни)‡ | 10,4 (6,2) | 7,5 (5,9) | -2,94 (от -3,38 до -2,5), p < 0,0001 | 0,004 |
| Обострение ХОБЛ | 631 | 621 | .. | .. |
| Назначение антибактериальной терапии | 453 (72%) | 266 (43%) | 0,29 (от 0,23 до 0,36), p < 0,0001 | 0,017 |
| Продолжительность антибактериальной терапии (дни)† | 7,4 (5,3) | 7,2 (6,7) | -1,15 (от -2 до -0,31), p = 0,007 | 0,003 |
| Общая продолжительность воздействия антибиотиков (дни)‡ | 5,3 (5,6) | 3,1 (5,6) | -2,22 (от -2,83 до -1,6), p < 0,0001 | 0,506 |
| Острый бронхит | 287 | 257 | .. | .. |
| Назначение антибактериальной терапии | 189 (66%) | 68 (26%) | 0,18 (от 0,12 до 0,26), p < 0,0001 | < 0,0001 |
| Продолжительность антибактериальной терапии (дни)† | 7,1 (3,0) | 6,4 (3,5) | -0,35 (от -1,15 до 0,45), p = 0,393 | 0,359 |
| Общая продолжительность воздействия антибиотиков (дни)‡ | 4,7 (4,2) | 1,7 (3,3) | -2,95 (от -3,59 до -2,31), p < 0,0001 | 0,33 |
| Вентиляционно-ассоциированная пневмония | 186 | 194 | .. | .. |
| Назначение антибактериальной терапии | 186 (100%) | 193 (100%) | .. | .. |
| Продолжительность антибактериальной терапии (дни)† | 13,1 (7,9) | 10,8 (8,7) | -2,22 (от -3,8 до -0,65), p = 0,006 | 0,253 |
| Общая продолжительность воздействия антибиотиков (дни)‡ | 13,1 (7,9) | 10,8 (8,7) | -2,45 (от -4,09 до -0,82), p = 0,003 | 0,786 |
Данные представлены как значения n, среднее значение (СО) или n (%), если не указано иное. ОШ — отношение шансов. ХОБЛ – хроническая обструктивная болезнь легких. *Многофакторная иерархическая регрессия, скорректированная по возрасту и диагнозу, в которой исследование используется как случайный эффект. †Общее количество дней приема антибиотиков у всех пациентов. ‡ Общее количество дней приема антибиотиков у пациентов, рандомизированно распределенных в группы лечения.
 Рисунок 3. Применение антибиотиков: (A) Доля пациентов, получавших антибиотики. (B) Средняя продолжительность применения антибиотиков
Рисунок 3. Применение антибиотиков: (A) Доля пациентов, получавших антибиотики. (B) Средняя продолжительность применения антибиотиковНизкая частота назначения антибиотиков и меньшая продолжительность антибактериальной терапии играли определенную роль в снижении величины воздействия антибактериальной терапии в отделении скорой помощи. В условиях ОИТ и у пациентов с внутрибольничной пневмонией меньшая величина воздействия антибиотиков в основном объяснялась коротким периодом лечения.
Наблюдалось статистически значимое снижение частоты развития побочных эффектов, связанных с применением антибиотиков, в группе, где оценивался уровень прокальцитонина (16% и 22%; скорректированное ОШ 0,68; 95% ДИ 0,57–0,82, p < 0,0001).
Этот клинический исход оценивали только в условиях первичной медицинской помощи и неотложной помощи (шесть исследований). Данные, свидетельствующие об эффекте в подгруппах, отсутствовали (pвзаимодействий > 0,05; таблица 3).
Показатели продолжительности пребывания в стационаре (скорректированный коэффициент регрессии -0,19 дня; 95% ДИ от -0,96 до 0,58, p = 0,626) и ОИТ (0,39 дня; 95% ДИ от -0,81 до 1,58, p = 0,524) были схожими в основной и контрольной группах, а также в подгруппах, выделенных в зависимости от клинических условий и заболеваний (pвзаимодействий > 0,05; таблица 3).
Обсуждение
Насколько нам известно, этот отчет о систематическом обзоре и метаанализе индивидуальных данных пациентов из 26 рандомизированных исследований, проведенных с участием 6708 пациентов, является первым отчетом, описывающим статистически значимое и важное улучшение клинических исходов и, в особенности, сниженный риск смертности при острых респираторных заболеваниях в случае использования оценки уровня прокальцитонина в процессе принятия решений относительно антибактериальной терапии. Этот эффект наблюдался при всех клинических условиях и типах инфекций и его устойчивость была подтверждена в ходе различных анализов чувствительности. Среди пациентов из отделений первичной медицинской помощи и пациентов с острым бронхитом уровень смертности был очень низким, и благоприятный эффект использования уровня прокальцитонина не поддавался надежной оценке.
Использование показателя уровня прокальцитонина при выборе антибактериальной терапии привело к снижению частоты развития побочных эффектов, связанных с применением антибиотиков, но не повлияло на продолжительность пребывания в ОИТ или стационаре.
Известно, что острые респираторные инфекции возникаю в результате бактериального, вирусного заражения и по другим причинам, а для их лечения часто применяют антибиотики [6, 7, 46]. Несмотря на то что раннее начало антибактериальной терапии снижает тяжесть течения заболевания, связанного с бактериальной инфекций, избыточное применение антибиотиков у пациентов с вирусным бронхитом и сепсисом приводит к развитию мультирезистентных бактериальных патогенов [47, 48]. Сокращение объема применения антибиотиков без повышения риска нежелательных исходов считается приоритетом в международном медицинском сообществе. Последние 10 лет особое внимание уделялось прокальцитонину - маркеру бактериальной инфекции в крови как вспомогательному инструменту клинической оценки заболевания и определения стандартных клинических параметров в рамках процедур принятия решений относительно назначения антибактериальной терапии пациентам с острыми респираторными инфекциями. Уровень прокальцитонина повышается в течение первых 6–12 часов с момента инфицирования в ответ на высвобождение провоспалительных медиаторов, достигая максимальных значений при бактериемии, и коррелирует с тяжестью заболевания и клиническими исходами инфицированных пациентов [49, 50].
В отличие от других маркеров воспаления высвобождение прокальцитонина блокируется цитокинами, что характеризует типичный ответ иммунной системы на вирусные инфекции, заключающийся в выработке интерферона γ [51]. Поэтому прокальцитонин является более специфическим маркером бактериальных инфекций, чем С-реактивный белок или лейкоциты [52-54]. Концентрация прокальцитонина снижается примерно на 50% в день в период выздоровления, поэтому этот показатель можно использовать для контроля течения заболевания и в качестве вспомогательного инструмента при принятии решений относительно прекращения антибактериальной терапии.
Важным препятствием для оценки и валидации любого маркера сепсиса является отсутствие надежного эталона для определения бактериальной инфекции, в особенности эталона для определения респираторных инфекций. В предыдущих исследованиях, где использовали посев крови в качестве стандарта, чувствительность и специфичность определения уровня прокальцитонина составляла около 80% [55, 56]. Для повышения чувствительности и специфичности анализа на прокальцитонин в существующих алгоритмах используются различные пороговые значения в сочетании с клиническими критериями [10]. Хотя наблюдательные исследования не позволяют определить диагностическую точность уровня прокальцитонина, можно провести интервенционные исследования, чтобы оценить клинический эффект таких алгоритмов. В ходе нескольких исследований сравнили применение антибиотиков и клинических исходов острых респираторных инфекций у пациентов, которые получали лечение на основании оценки уровня прокальцитонина и без него. В этих исследованиях алгоритмы назначения антибактериальной терапии на основании уровня прокальцитонина объединили с показаниями или противопоказаниями к назначению и продолжению применения антибиотиков на основании клинической стабильности, определенных уровней прокальцитонина или кинетики прокальцитонина [10].
Несмотря на то что результаты большинства исследований указывают на эффективность такой стратегии в отношении уменьшения объема применения антибиотиков, безопасность данного подхода все еще вызывает обеспокоенность.
Анализ результатов назначения антибактериальной терапии на основании оценки уровня прокальцитонина, проведенный нами в крупной сводной популяции пациентов из разных исследований и стран, не предоставил никаких убедительных данных, свидетельствующих о вреде такого подхода, и, что важно, выявил статистически значимое снижение смертности при его применении. Эти результаты согласуются с результатами крупнейшего исследования, проведенного с участием пациентов в ОИТ, которые также указывали на снижение уровня смертности при назначении антибактериальной терапии на основании оценки уровня прокальцитонина [9]. Относительное снижение смертности составило 14% (10,0–8,6%) и было самым высоким в исследованиях в ОИТ (15%) и среди пациентов с внутрибольничной пневмонией (13%) и вентиляционно-ассоциированной пневмонией (23%). У пациентов в отделении неотложной помощи относительное снижение смертности составило 8%, в то время как в условиях первичной медицинской помощи не наблюдалось такого эффекта в связи с низким количеством событий. Эти результаты также были подтверждены в ходе метаанализа сводных данных, который включал 32 исследования, соответствовавших критериям. По всей видимости, использование оценки уровня прокальцитонина несет наибольшую клиническую пользу в популяциях пациентов из группы высокого риска и не связано с проблемами безопасности в группах низкого риска.
Существует несколько возможных объяснений благоприятного влияния антибактериальной терапии, учитывающей уровень прокальцитонина, на снижение смертности среди пациентов с острыми респираторными инфекциями. Во-первых, уровень прокальцитонина дает возможность получить дополнительную прогностическую информацию при оценке состояния пациентов, которая может помочь принять решение относительно места оказания помощи и сроков выписки [29]. В ходе крупномасштабного исследования, проведенного в США [57], было доказано, что кинетика прокальцитонина в течение 72 часов является надежным и независимым прогностическим фактором смертности. Кроме того, раннее выявление пациентов, не ответивших на антибактериальную и другую лекарственную терапию, может помочь профилактике развития нежелательных явлений. Во-вторых, повышенный риск неэффективности терапии в контрольной группе может быть связан с продолжительным приемом антибиотиков, риском развития вторичных осложнений и повторной госпитализации [58, 59]. В проведенном нами исследовании назначение антибактериальной терапии на основании оценки уровня прокальцитонина также было связано с низкой частотой развития побочных эффектов, связанных с применением антибиотиков, которые могут влиять как на показатели неэффективности терапии, так и на показатели смертности. В-третьих, у больных с симптомами острого респираторного заболевания концентрация прокальцитонина ниже ожидаемой может указывать на необходимость искать иные заболевания (например, легочную эмболию или сердечную недостаточность). Наконец, согласно действующим клиническим рекомендациям по лечению сепсиса, в ходе нескольких наблюдательных исследований отмечалось снижение уровня смертности и риска неэффективности терапии в связи с ранним понижением дозы антибиотиков у пациентов с сепсисом по сравнению с пациентами, у которых дозу антибиотиков не снижали [60, 61].
Несмотря на то что в ходе большинства исследований была доказана польза применения алгоритмов назначения антибактериальной терапии на основании оценки уровня прокальцитонина у пациентов в ОИТ и ОСП, клиническая ценность измерения уровня прокальцитонина при оказании первичной медицинской помощи все еще не до конца изучена. Данные наблюдения амбулаторных больных были очень неубедительными в отношении дополнительной клинической ценности изменения уровня прокальцитонина для диагностики инфекций в сравнении с другими маркерами и клиническими параметрами. В ходе выполненного нами анализа, который включал два исследования не меньшей эффективности в условиях первичной медицинской помощи у 1008 пациентов, измерение уровня прокальцитонина оказало значительное влияние на объем применения антибиотиков. Кроме того, судя по количеству дней с ограниченной повседневной физической активностью, показатели выздоровления были схожими между основной группой, где оценивали уровень прокальцитонина, и контрольной группой. Это указывает на то, что пациенты, распределенные в группу использования уровня прокальцитонина и не получавшие антибиотики, не нуждались в антибактериальных препаратах.
Что касается первичной медицинской помощи, можно предположить, что любое вмешательство с использованием других биомаркеров или клинических параметров может снизить объем применения антибиотиков в группе низкого риска и высокой частотой избыточного назначения антибиотиков. В исследованиях, направленных на сравнение уровней прокальцитонина и С-реактивного белка, была установлена слабая корреляция этих биомаркеров, указывая на то, что существуют важные различия, которые могут привести к расхождениям в рекомендациях по применению антибиотиков у отдельных пациентов [62, 63]. Однако все еще существует необходимость в прямых сравнительных исследованиях по оценке клинического эффекта алгоритмов назначения антибактериальной терапии на основании уровня прокальцитонина в сравнении с С-реактивным белком. Наконец, была одна стратегия, которая в условиях стационара оказывала влияние на исходы пациентов. Она заключалась в раннем уведомлении медицинских работников о показателях уровня прокальцитонина. Эта стратегия может повысить эффективность алгоритмов назначения антибактериальной терапии на основании оценки уровня прокальцитонина при их использовании в дальнейших исследованиях в отделениях первичной медицинской помощи.
Мощность данного метаанализа обусловлена тем, что использовался заранее определенный протокол исследования, был выполнен всесторонний поиск, найдены все актуальные исследования и использовалась сеть, которая позволила включить в анализ индивидуальные данные пациентов из большинства исследований, соответствующих критериям. Мы также стандартизировали определения клинических исходов во всех исследованиях и провели соответствующие анализы чувствительности в подгруппах, что позволило преодолеть ограничение предыдущих метаанализов сводных данных и сделать окончательные выводы.
Однако проведенное нами исследование все же имело определенные ограничения. Прежде всего, соблюдение алгоритмов назначения антибактериальной терапии на основании оценки уровня прокальцитонина варьировало от 44 до 100%. Однако результаты анализа чувствительности указывали на то, что в исследованиях с низким и высоким уровнем приверженности наблюдались схожие эффекты. Во-вторых, наш анализ включал только взрослых иммунокомпетентных пациентов с острыми респираторными инфекциями, что снижало обобщаемость наших выводов по отношению к другим популяциям пациентов. В-третьих, наша популяция пациентов была достаточно гетерогенной в отношении клинических условий и типов респираторных инфекций. Эта гетерогенность также ограничивает обобщаемость результатов, в особенности в отношении основной конечной точки (смертности), в частности, остается открытым вопрос, ведет ли назначение антибактериальной терапии на основании оценки уровня прокальцитонина к снижению смертности в условиях первичной медицинской помощи. Наконец, мы не проводили анализ клинико-экономической эффективности в связи с отсутствием данных по затратам в большинстве исследований. В дальнейших исследованиях необходимо изучить экономическую эффективность выбора терапии с учетом оценки уровня прокальцитонина [56].
Таким образом, назначение антибактериальной терапии с учетом оценки уровня прокальцитонина при острых респираторных заболеваниях способствует эффективному снижению величины воздействия антибиотиков и частоты развития побочных эффектов, связанных с их применением, а также к снижению частоты смертельных исходов. Эти результаты наблюдались во всех клинических условиях и при всех клинических проявлениях острых респираторных инфекций, несмотря на то что оценить уровень смертности в условиях первичной медицинской помощи и при остром бронхите не представлялось возможным. Внедренный в клинические алгоритмы параметр уровня прокальцитонина может предоставить дополнительную информацию и улучшить практику ведения пациентов с острыми респираторными заболеваниями за счет снижения величины воздействия антибиотиков и связанного с ним риска развития резистентности, а также, что особенно важно, за счет улучшения клинических исходов. Полученные результаты могут иметь весомое значение для клинической практики и общественного здравоохранения.
Заявление о конфликте интересов
Авторы PS, MC-C и BM получали поддержку от компаний «Термо-Фишер» и «биоМерье» за посещение совещаний и участие в них в качестве докладчиков. BM выступал в качестве консультанта и получал исследовательскую поддержку от компании «Термо-Фишер». HCB и MB получили исследовательскую поддержку от компании «Термо-Фишер» за предыдущий метаанализ данных по вопросам измерения уровней прокальцитонина. Больница DWdL получала финансовую поддержку в проведении рандомизации от компании «Термо-Фишер». DS, OB и MT получали исследовательскую поддержку от компании «Термо-Фишер». TW и SS получали гонорары за лекции и исследовательскую поддержку от компании «Термо-Фишер». CEL получал гонорары за лекции от компаний «Брамс», «Мерк Шарп и Доум-Шибре». JC получал гонорары за консультирование и лекции от компаний «Пфайзер», «Брамс», «Вайт», «Джонсон энд Джонсон», «Нектар-Байер» и «Арпида». CEL получал гонорары за лекции и консультирование от компаний «Мерк Шарп и Доум-Шибре», «Янссен-Силаг», «Жиле», «Астеллас», «Санофи» и «Термо-Фишер». Организация FT получала спонсорскую поддержку от компании «Брамс». Автор CC получил неограниченный грант на 2000 евро от компании «Термо-Фишер Сайентифик» и нефинансовую поддержку от компании «биоМерье» за исследование ProToCOLD. Автор YS получал неограниченные исследовательские гранты от компаний «Термо-Фишер», «биоМерье», «Орион Фарма» и «Пфайзер». Автор ARF участвовал в работе экспертных советов компаний «Новавакс», «Холоджик», «Жиле» и «МедИммьюн», а также получал финансирование исследований от компаний «АстраЗенека», «Санофи Пастер», «ГлаксоСмитКлайн» и «АДМА Байолоджикс». Автор J-USJ заявляет, что в 2016 году он получал приглашение на совещание Европейского респираторного общества от компании «Рош Фармасьютикалз». Авторы YW, RS, LB, KBK, TW, VN, LW, DA, KR, ABr, PD, MN, ROD, CFO, VM-S, AV, BB, BC, JAHvO, ABe, ARJG и EdJ заявляют об отсутствии конфликта интересов.
Благодарность
Национальный институт исследований в области здравоохранения (NIHR) предоставил исследовательский грант для обновления данного обзора. Обзор 2012 г. был подготовлен при поддержке неограниченных исследовательских грантов от компании «Термо-Фишер Сайентифик», фонда Готтфрида и Джулии Бангертер-Райнер, швейцарского фонда грантов по биологии и медицине (SSMBS, PASMP3-127684/1) и компании «Сантесуис». Мы благодарим всех исследователей и пациентов, участвовавших в отдельных исследованиях, за предоставление данных.
Список литературы
- US Food and Drug Administration. FDA press release. FDA clears test to help manage antibiotic treatment for lower respiratory tract infections and sepsis. Feb 23, 2017. www.fda.gov (accessed Oct 2, 2017).
- Schuetz P., Albrich W., Mueller B. Procalcitonin for diagnosis of infection and guide to antibiotic decisions: past, present and future. BMC Med 2011; 9: 107.
- Schuetz P., Christ-Crain M., Muller B. Procalcitonin and other biomarkers to improve assessment and antibiotic stewardship in infections — hope for hype? Swiss Med Wkly 2009; 139: 318-26.
- Charles P.E., Tinel C., Barbar S., et al. Procalcitonin kinetics within the first days of sepsis: relationship with the appropriateness of antibiotic therapy and the outcome. Crit Care 2009; 13: R38.
- Sager R., Kutz A,. Mueller B., Schuetz P. Procalcitonin-guided diagnosis and antibiotic stewardship revisited. BMC Med 2017; 15: 15.
- Musher D.M., Thorner A.R. Community-acquired pneumonia. N Engl J Med 2014; 371: 1619-28.
- Silverman M., Povitz M., Sontrop J.M., et al. Antibiotic prescribing for nonbacterial acute upper respiratory infections in elderly persons. Ann Intern Med 2017; 166: 765-74.
- Schuetz P., Albrich W., et al. Procalcitonin for guidance of antibiotic therapy. Expert Rev Anti Infect Ther 2010; 8: 575-87.
- de Jong E., van Oers J.A., Beishuizen A., et al. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: a randomised, controlled, open-label trial. Lancet Infect Dis 2016; 16: 819-27.
- Schuetz P., Chiappa V., Briel M., Greenwald J.L. Procalcitonin algorithms for antibiotic therapy decisions: a systematic review of randomized controlled trials and recommendations for clinical algorithms. Arch Intern Med 2011; 171: 1322-31.
- Wu M.H., Lin C.C., Huang S.L., et al. Can procalcitonin tests aid in identifying bacterial infections associated with influenza pneumonia? A systematic review and meta-analysis. Influenza Other Respir Viruses 2012; 7: 349-55.
- Berg P., Lindhardt B.O. The role of procalcitonin in adult patients with community-acquired pneumonia — a systematic review. Dan Med J 2012; 59: A4357.
- Bloos F., Trips E., Nierhaus A., et al. Effect of sodium selenite administration and procalcitonin-guided therapy on mortality in patients with severe sepsis or septic shock: a randomized clinical trial. JAMA Intern Med 2016; 176: 1266-76.
- Bouadma L., Luyt C.E., Tubach F., et al. Use of procalcitonin to reduce patients' exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet 2010; 375: 463-74.
- Branche A.R., Walsh E.E., Vargas R., et al. Serum procalcitonin measurement and viral testing to guide antibiotic use for respiratory infections in hospitalized adults: a randomized controlled trial. J Infect Dis 2015; 212: 1692-700.
- Briel M., Schuetz P., Mueller B., et al. Procalcitonin-guided antibiotic use vs a standard approach for acute respiratory tract infections in primary care. Arch Intern Med 2008; 168: 2000-07.
- Burkhardt O., Ewig S., Haagen U., et al. Procalcitonin guidance and reduction of antibiotic use in acute respiratory tract infection. Eur Respir J 2010; 36: 601-07.
- Christ-Crain M., Jaccard-Stolz D., Bingisser R., et al. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections: cluster-randomised, single-blinded intervention trial. Lancet 2004; 363: 600-07.
- Christ-Crain M., Stolz D., Bingisser R., et al. Procalcitonin guidance of antibiotic therapy in community-acquired pneumonia: a randomized trial. Am J Respir Crit Care Med 2006; 174: 84-93.
- Corti C, Fally M., Fabricius-Bjerre A., et al. Point-of-care procalcitonin test to reduce antibiotic exposure in patients hospitalized with acute exacerbation of COPD. Int J Chron Obstruct Pulmon Dis 2016; 11: 1381-89.
- Deliberato R.O., Marra A.R., Sanches P.R., et al. Clinical and economic impact of procalcitonin to shorten antimicrobial therapy in septic patients with proven bacterial infection in an intensive care setting. Diagn Microbiol Infect Dis 2013; 76: 266-71.
- Hochreiter M., Kohler T., Schweiger A.M., et al. Procalcitonin to guide duration of antibiotic therapy in intensive care patients: a randomized prospective controlled trial. Crit Care 2009; 13: R83.
- Kristoffersen K.B., Sogaard O.S., Wejse C., et al. Antibiotic treatment interruption of suspected lower respiratory tract infections based on a single procalcitonin measurement at hospital admission—a randomized trial. Clin Microbiol Infect 2009; 15: 481-7.
- Layios N., Lambermont B., Canivet J.L., et al. Procalcitonin usefulness for the initiation of antibiotic treatment in intensive care unit patients. Crit Care Med 2012; 40: 2304-9.
- Long W., Deng X., et al. Procalcitonin guidance for reduction of antibiotic use in low-risk outpatients with community-acquired pneumonia. Respirology 2011; 16: 819-24.
- Long W., Deng X.Q., Tang J.G., et al. The value of serum procalcitonin in treatment of community acquired pneumonia in outpatient. Chin J Intern Med 2009; 48: 216-19 (in Chinese).
- Long W., Li L.J., Huang G.Z., et al. Procalcitonin guidance for reduction of antibiotic use in patients hospitalized with severe acute exacerbations of asthma: a randomized controlled study with 12-month follow-up. Crit Care 2014; 18: 471.
- Maravić-Stojković V., Lausević-Vuk L., et al. Procalcitonin-based therapeutic strategy to reduce antibiotic use in patients after cardiac surgery: a randomized controlled trial. Srp Arh Celok Lek 2011; 139: 736-42.
- Nobre V., Harbarth S., Graf J.D., Rohner P., Pugin J. Use of procalcitonin to shorten antibiotic treatment duration in septic patients: a randomized trial. Am J Respir Crit Care Med 2008; 177: 498-505.
- Oliveira C.F., Botoni F.A., Oliveira C.R., et al. Procalcitonin versus C-reactive protein for guiding antibiotic therapy in sepsis: a randomized trial. Crit Care Med 2013; 41: 2336-43.
- Schroeder S., Hochreiter M., Koehler T., et al. Procalcitonin (PCT)-guided algorithm reduces length of antibiotic treatment in surgical intensive care patients with severe sepsis: results of a prospective randomized study. Langenbecks Arch Surg 2009; 394: 221-26.
- Schuetz P., Christ-Crain M., Thomann R., et al. Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections: the ProHOSP randomized controlled trial. JAMA 2009; 302: 1059-66.
- Shehabi Y., Sterba M., Garrett P.M., et al. Procalcitonin algorithm in critically ill adults with undifferentiated infection or suspected sepsis. A randomized controlled trial. Am J Respir Crit Care Med 2014; 190: 1102-10.
- Stolz D., Christ-Crain M., Bingisser R., et al. Antibiotic treatment of exacerbations of COPD: a randomized, controlled trial comparing procalcitonin-guidance with standard therapy. Chest 2007; 131: 9-19.
- Stolz D., Smyrnios N., Eggimann P., et al. Procalcitonin for reduced antibiotic exposure in ventilator-associated pneumonia: a randomised study. Eur Respir J 2009; 34: 1364-75.
- Verduri A., Luppi F., D'Amico R., et al. Antibiotic treatment of severe exacerbations of chronic obstructive pulmonary disease with procalcitonin: a randomized noninferiority trial. PLoS One 2015; 10: e0118241.
- Wang J.X., Zhang S.M., et al. Acute exacerbations of chronic obstructive pulmonary disease with low serum procalcitonin values do not benefit from antibiotic treatment: a prospective randomized controlled trial. Int J Infect Dis 2016; 48: 40-45.
- Schuetz P., Briel M., Christ-Crain M., et al. Procalcitonin to initiate or withhold antibiotics in acute respiratory tract infections (protocol). Cochrane Database Syst Rev 2008; 4: CD007498.
- Schuetz P., Muller B., Christ-Crain M., et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev 2012; 9: CD007498.
- Stewart L.A., Clarke M., Rovers M., et al. Preferred Reporting Items for Systematic Review and Meta-Analyses of individual participant data: the PRISMA-IPD Statement. JAMA 2015; 313: 1657-65.
- Liberati A., Altman D.G., Tetzlaff J., et al. The PRISMA statement for reporting systematic reviews and meta-analyses of studies that evaluate health care interventions: explanation and elaboration. J Clin Epidemiol 2009; 62: e1-34.
- Guyatt G.H., Oxman A.D., Vist G.E., et al. GRADE: an emerging consensus on rating quality of evidence and strength of recommendations. BMJ 2008; 336: 924-26.
- Thompson S.G., Turner R.M., Warn D.E. Multilevel models for meta-analysis, and their application to absolute risk differences. Stat Methods Med Res 2001; 10: 375-92.
- Turner R.M., Omar R.Z., et al. A multilevel model framework for meta-analysis of clinical trials with binary outcomes. Stat Med 2000; 19: 3417-32.
- Higgins J.P., Thompson S.G., Deeks J.J., Altman D.G. Measuring inconsistency in meta-analyses. BMJ 2003; 327: 557-60.
- Mizgerd J.P. Acute lower respiratory tract infection. N Engl J Med 2008; 358: 716-27.
- Gonzales R., Steiner J.F., Sande M.A. Antibiotic prescribing for adults with colds, upper respiratory tract infections, and bronchitis by ambulatory care physicians. JAMA 1997; 278: 901-04.
- Lawrence K.L., Kollef M.H. Antimicrobial stewardship in the intensive care unit: advances and obstacles. Am J Respir Crit Care Med 2009; 179: 434-38.
- Kutz A., Briel M., Christ-Crain M., et al. Prognostic value of procalcitonin in respiratory tract infections across clinical settings. Crit Care 2015; 19: 74.
- Schuetz P., Hausfater P., Amin D., et al. Biomarkers from distinct biological pathways improve early risk stratification in medical emergency patients: the multinational, prospective, observational TRIAGE study. Crit Care 2015; 19: 377.
- Linscheid P., Seboek D., et al. Expression and secretion of procalcitonin and calcitonin gene-related peptide by adherent monocytes and by macrophage-activated adipocytes. Crit Care Med 2004; 32: 1715-21.
- Christ-Crain M., Muller B. Procalcitonin in bacterial infections— hype, hope, more or less? Swiss Med Wkly 2005; 135: 451-60.
- Christ-Crain M., Muller B. Biomarkers in respiratory tract infections: diagnostic guides to antibiotic prescription, prognostic markers and mediators. Eur Respir J 2007; 30: 556-73.
- Linscheid P., Seboek D., et al. Autocrine/paracrine role of inflammation-mediated calcitonin gene-related peptide and adrenomedullin expression in human adipose tissue. Endocrinology 2005; 146: 2699-708.
- Wacker C., Prkno A., Brunkhorst F.M., Schlattmann P. Procalcitonin as a diagnostic marker for sepsis: a systematic review and meta-analysis. Lancet Infect Dis 2013; 13: 426-35.
- Muller F., Christ-Crain M., Bregenzer T., et al. Procalcitonin levels predict bacteremia in patients with community-acquired pneumonia: a prospective cohort trial. Chest 2010; 138: 121-29.
- Schuetz P., Birkhahn R., Sherwin R., et al. Serial procalcitonin predicts mortality in severe sepsis patients: results from the Multicenter Procalcitonin MOnitoring SEpsis (MOSES) Study. Crit Care Med 2017; 45: 781-89.
- Roberts R.R., Hota B., Ahmad I., et al. Hospital and societal costs of antimicrobial-resistant infections in a Chicago teaching hospital: implications for antibiotic stewardship. Clin Infect Dis 2009; 49: 1175 84.
- Classen D.C., Jaser L., Budnitz D.S. Adverse drug events among hospitalized Medicare patients: epidemiology and national estimates from a new approach to surveillance. Jt Comm J Qual Patient Saf 2010; 36: 12-21.
- Garnacho-Montero J., Gutierrez-Pizarraya A., Escoresca-Ortega A., et al. De-escalation of empirical therapy is associated with lower mortality in patients with severe sepsis and septic shock. Intensive Care Med 2014; 40: 32-40.
- Schuetz P., Mueller B. Biomarker-guided de-escalation of empirical therapy is associated with lower risk for adverse outcomes. Intensive Care Med 2014; 40: 141.
- Meili M., Kutz A., Briel M., et al. Infection biomarkers in primary care patients with acute respiratory tract infections-comparison of procalcitonin and C-reactive protein. BMC Pulm Med 2016; 16: 43.
- Meili M., Muller B., Kulkarni P., Schutz P. Management of patients with respiratory infections in primary care: procalcitonin, C-reactive protein or both? Expert Rev Respir Med 2015; 9: 587-601.





