31168
23 Марта 2021
Обзорная статья – Доброкачественная гиперплазия предстательной железы
Юаньшань Цуй, Юн Чжан
Ключевые слова: андрогены, предстательная железа, метаанализ, рандомизированное контролируемое исследование.
Резюме
Предпосылки: Андрогенозаместительная терапия (АЗТ) является широко распространенным во всем мире видом лечения пожилых мужчин с синдромом позднего гипогонадизма. Возможность того, что АЗТ может стать причиной роста предстательной железы, вызывает обеспокоенность урологов.
Цель: Оценить связь между АЗТ и ростом предстательной железы.
Сбор фактических данных:...
Юаньшань Цуй, Юн Чжан
Ключевые слова: андрогены, предстательная железа, метаанализ, рандомизированное контролируемое исследование.
Резюме
Предпосылки: Андрогенозаместительная терапия (АЗТ) является широко распространенным во всем мире видом лечения пожилых мужчин с синдромом позднего гипогонадизма. Возможность того, что АЗТ может стать причиной роста предстательной железы, вызывает обеспокоенность урологов.
Цель: Оценить связь между АЗТ и ростом предстательной железы.
Сбор фактических данных:...
Обзорная статья – Доброкачественная гиперплазия предстательной железы
Юаньшань Цуй, Юн Чжан
Ключевые слова: андрогены, предстательная железа, метаанализ, рандомизированное контролируемое исследование.
Резюме
Предпосылки: Андрогенозаместительная терапия (АЗТ) является широко распространенным во всем мире видом лечения пожилых мужчин с синдромом позднего гипогонадизма. Возможность того, что АЗТ может стать причиной роста предстательной железы, вызывает обеспокоенность урологов.
Цель: Оценить связь между АЗТ и ростом предстательной железы.
Сбор фактических данных: Был проведен обзор литературы для выявления всех опубликованных рандомизированных контролируемых исследований (РКИ) терапии андрогенами при гипогонадизме. Поиск охватывал базы данных Medline, Embase и Кокрановский реестр контролируемых исследований (Cochrane Controlled Trials Register). Кроме того, были изучены библиографические списки найденных работ. Были выполнены систематический обзор и метаанализ.
Синтез данных: Были проанализированы результаты 16 РКИ, в которых участвовало 1030 пациентов. Семь РКИ были краткосрочными (<12 месяцев) и девять были долгосрочными (12-36 месяцев) сравнениями АЗТ с плацебо; АЗТ применяли в виде трансдермального введения, перорального введения или путем инъекцией. Соответствующие значения p для применения методами инъекций, трансдермального введения и перорального введения при краткосрочной АЗТ были следующими: уровень ПСА: 0,07, 0,01 и 0,95; объем предстательной железы: 0,70, 0,79 и 0,32; оценка по шкале МШПС: 0,78, 0,98 и отсутствует при пероральном введении; Qmax: 0,92, отсутствует при трансдермальном введении и 0,10. Соответствующие значения p для инъекций, трансдермального введения и перорального введения при долгосрочной АЗТ были следующими: уровень ПСА: 0,42, 0,51 и 57; объем предстательной железы: 0,35, 0,59 и 0,47; оценка по шкале МШПС: 0,34, 0,32 и 0,97; Qmax: 0,11, 0,63 и отсутствует при пероральном введении. Ни после краткосрочной, ни после долгосрочной АЗТ не было обнаружено значительных изменений значений четырех показателей увеличения объема предстательной железы по сравнению с группой, получавшей плацебо.
Выводы: Проведенный метаанализ показывает, что независимо от способа введения, ни краткосрочная, ни долгосрочная АЗТ не увеличивают риск роста предстательной железы. Для подтверждения этого заключения необходимы дальнейшие тщательно спланированные проспективные исследования.
1. Введение
Андрогенный дефицит у стареющих мужчин стал предметом растущего интереса и дискуссий во всем мире. Результаты одномоментных и долгосрочных исследований показывают, что уровень тестостерона с возрастом постепенно снижается - у значительной части мужчин в возрасте старше 60 лет содержание тестостерона в сыворотке крови ниже нижнего предела в сравнении с мужчинами 20-30 лет [1-3]. Гипогонадизм с поздним началом (ГПН) – это клинический и биохимический синдром, проявляющийся в зрелом возрасте и характеризующийся недостаточным содержанием тестостерона в сыворотке, а также другими признаками и симптомами. [4, 5]. ГПН может существенно ухудшать качество жизни и негативно влиять на функцию многих органов и систем.
Андрогенозаместительная терапия (АЗТ) является широко распространенным методом лечения, позволяющим предотвратить или облегчить многие из симптомов и состояний, связанных с ГПН у мужчин в период старения.
Исследования, проведенные за последнее десятилетие, свидетельствуют о положительном воздействии андрогенной терапии на ряд целевых органов у мужчин с гипогонадизмом, включая кратковременные положительные эффекты тестостерона у мужчин старшего возраста, сходные с наблюдаемыми у более молодых мужчин [6]. АЗТ чаще всего применяют путем инъекционного, трансдермального или перорального введения.
Иногда постепенное увеличение объема предстательной железы, сопутствующее прогрессирующему снижению уровня тестостерона в среднем возрасте, отражает развитие доброкачественной гиперплазии предстательной железы (ДГПЖ) [7]. Хорошо известно, что андроген играет важную роль в развитии ДГПЖ, поэтому было высказано предположение, что АЗТ потенциально может способствовать росту предстательной железы [8-11]. Многих урологов тревожит то, что АЗТ может ускорить рост предстательной железы не только при злокачественных, но и при доброкачественных опухолевых заболеваниях.
2. Сбор фактических данных
2.1. Стратегия поиска
С целью выявления рандомизированных контролируемых исследований (РКИ), в которых упоминается влияние АЗТ на предстательную железу, провели поиск по базам данных Medline (с 1966 по октябрь 2012 года), Embase (с 1974 по октябрь 2012 года) и в Кокрановском реестре контролируемых исследований. Мы также провели анализ библиографических списков найденных работ. Были использованы следующие поисковые термины: андроген, предстательная железа и рандомизированные контролируемые исследования.
2.2. Критерии включения в анализ и выбор клинических исследований
В анализ включали РКИ, соответствующие следующим критериям: (1) дизайн исследования предполагал применение АЗТ; (2) в исследовании были получены точные данные, пригодные для анализа, включая общее количество субъектов и значения каждого показателя роста предстательной железы, таких как уровень простатического специфического антигена (ПСА), объем предстательной железы, оценка по Международной шкале простатических симптомов (МШПС) и максимальная объемная скорость потока мочи (Qmax); (3) имеется доступ к полному тексту публикации. Если одно и то же исследование было опубликовано в разных журналах или в разные годы, для метаанализа использовали самую последнюю публикацию. Если одна и та же группа исследователей изучала группу субъектов в нескольких экспериментах, в анализ включали все работы. Блок-схема процесса отбора исследований представлена на рисунке.
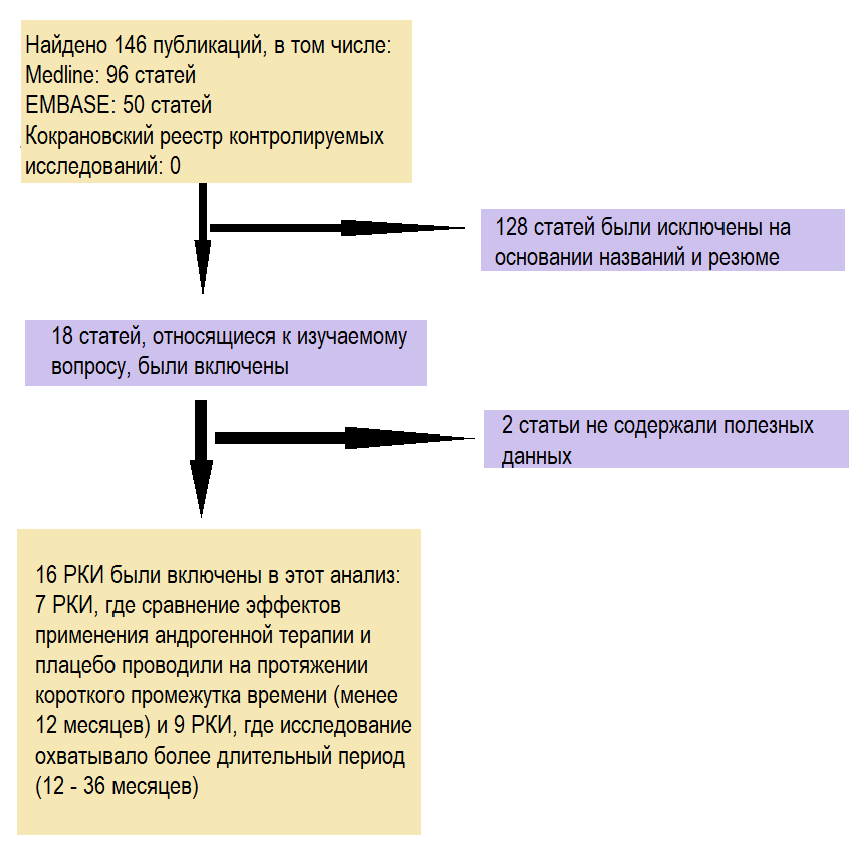
Рис. Блок-схема процесса отбора исследований
Примечание: РКИ — рандомизированное контролируемое исследование.
2.3. Оценка качества
Качество найденных РКИ оценивали по шкале Джадада [12]. В этот анализ были включены все найденные РКИ независимо от оценки качества. Методологическое качество каждого исследования оценивали на основании использованных принципов распределения пациентов по группам, сокрытия процедур распределения, маскировки данных и потерь данных вследствие отсева участников. Затем исследования классифицировали по качественным признакам в соответствии с рекомендациями, опубликованными в Кокрановском руководстве по составлению систематических обзоров о вмешательствах v.5.1.0. [13]. На основании критериев оценки качества выполняли оценку каждого исследования и относили его к одной из трех следующих групп:
A. Если все критерии качества были соблюдены должным образом, считали, что исследование имеет низкий риск смещения.
Б. Если один или более критериев качества соблюдены лишь частично или не выполнены, считали, что исследование имеет умеренный риск смещения.
В. Если один или более критериев качества не выполнены или не рассматривались, считали, что исследование характеризуется высоким риском смещения.
Разногласия в отношении распределения решали путем обсуждения между авторами.
2.4. Извлечение данных
Для каждого исследования проводили сбор следующих данных: (1) имя первого автора и год публикации; (2) дизайн исследования и размер выборки; (3) терапия, которую получали пациенты; (4) страна, где проводилось исследование; (5) данные о четырех показателях роста предстательной железы (т.е. уровень ПСА, объем предстательной железы, оценка по шкале МШПС, Qmax); (6) метод применения АЗТ и дозировка.
2.5. Статистический анализ и метаанализ
Метаанализ сопоставимых данных выполняли с использованием RevMan v.5.1.0 (Кокрановское сотрудничество, Оксфорд, Великобритания) [13]. Изменения значений всех четырех показателей роста предстательной железы определяли как различия между исходным уровнем (на входе в исследование) и уровнем после завершения исследования. Мы оценили относительный риск дихотомических исходов и стандартизированную разность средних (СРС) для непрерывных данных, объединенных в исследования с использованием модели случайных эффектов ДерСимоняна и Лейрда [14]. Использовали доверительный интервал (ДИ), равный 95%. Если в результате анализа оказывалось, что p> 0,05, эти исследования считали гомогенными и выбирали для метаанализа модель фиксированного эффекта.
В противном случае выбирали модель случайных эффектов. Для количественной оценки неоднородности данных использовали статистику I2, которая описывает долю гетерогенности в исследованиях, не являющуюся случайной и характеризующую степень истинной неоднородности результатов разных исследований [15]. I2 <25% свидетельствует о низком уровне неоднородности, а I2 >50% указывает на значительную неоднородность.
2.6. Анализ в подгруппах и анализ чувствительности
Для выяснения причин неоднородности и взаимодействия между подгруппами подгруппы для анализа определяли априори с учетом следующих факторов:
3.1. Характеристики индивидуальных исследований
Поиск в базе данных обнаружил 146 статей, которые могли быть включены в данный метаанализ. 128 статей были исключены после прочтения названий и резюме статей на основании критериев включения и исключения. Две статьи не содержали полезных данных. Всего в этот анализ были включены 16 статей [16-31], содержавших данные 16 РКИ. В 7 РКИ сравнение эффектов андрогенной терапии и плацебо проводили на протяжении короткого периода (менее 12 мес.), а в 9 РКИ исследование охватывало длительный период времени (12-36 мес.). В исследованиях использовали три различных способа применения: пероральный, трансдермальный и инъекционный (рис.). Основные характеристики исследований, включенных в метаанализ, представлены в таблице 1.
Таблица 1. Характеристики исследований и участников
Только в четырех из отобранных исследований для оценки конечных результатов применяли одинаковые показатели роста предстательной железы, использованные и в настоящем анализе (т.е. объем предстательной железы, оценку МШПС, уровень ПСА и Qmax). Все 16 РКИ, включенные в наш анализ, предполагали проведение тщательного периодического контроля состояния пациентов; лечение прекращали при появлении симптомов, характерных для рака предстательной железы, или других серьезных осложнений. У нескольких пациентов с серьезными осложнениями и у всех пациентов, отказавшихся от лечения, при долгосрочной оценке наблюдали возврат к норме. В пяти из 16 РКИ [18, 21, 23, 25, 26] сообщалось, что нескольких пациентов с повышенным уровнем ПСА в последующем подвергли биопсии простаты (табл. 3) и гистологическое исследование образцов биопсийного материала обнаружило доброкачественный характер изменений.
Все 16 РКИ содержали исходные значения уровня ПСА, объема предстательной железы, оценки по шкале МШПС и Qmax, и только у одного пациента из этих исследований [29] наблюдали симптомы ДГПЖ (табл. 3). Кроме того, во всех 16 РКИ в начале исследования ни у одного пациента не было отмечено увеличения предстательной железы, у всех пациентов содержание ПСА было нормальным (табл. 3) и ни один пациент не подвергался ранее биопсии предстательной железы.
3.2. Качество отдельных исследований
Во всех 16 РКИ применяли двойной слепой метод и все они содержали описание использованных методов рандомизации. Все, за исключением исследования Кенни и соавт. [22], предполагали определение мощности для расчета оптимального размера выборки, а в семи из них проводили анализ в соответствии с назначенным лечением (табл. 2). Все отобранные исследования имели уровень качества А (табл. 2). Воронкообразная диаграмма, построенная для качественной оценки публикационного смещения в исследованиях, не обнаружила признаков смещения (рис. 4).
Таблица 2. Оценка качества отдельных исследований
Таблица 3. Данные оценки исходного состояния пациентов в нашем исследовании
3.3. Сравнение применения краткосрочной андроген-заместительной терапии и плацебо
3.3.1. Уровень простатического специфического антигена
Шесть РКИ, охватывающие 345 участников (170 в группе, получавшей андрогенную терапию, и 175 в контрольной группе), содержали данные определения ПСА [16, 22, 23, 26, 30, 31]. В трех исследованиях для проведения терапии использовали инъекции [16, 22, 23]; в двух – трансдермальное введение [26, 30]; и в одном – пероральное [31]. Гетерогенности между исследованиями обнаружено не было. Для трех РКИ, где терапию применяли в виде инъекций, при оценке с фиксированным эффектом СРС составила 0,50 (95% ДИ, -0,04–1,05; p = 0,07). Для РКИ, где терапию применяли трансдермально, СРС составила 0,30 (95% ДИ, 0,07–0,54; p = 0,002). Для исследования, где терапию применяли перорально, СРС составила -0,02 (95% ДИ, -0,64–0,60; p = 0,95). Эти результаты показывают, что при трансдермальном введении АЗТ приводит к повышению уровня ПСА с большей вероятностью по сравнению с применением плацебо.
3.3.2. Изменения объема предстательной железы
Четыре РКИ [16, 23, 30, 31], охватывающие 103 участника (50 в группе, получавшей андрогенную терапию, и 53 в контрольной группе), содержали данные об изменении объема предстательной железы. В двух исследованиях терапию применяли путем инъекций [16, 23], в одном использовали трансдермальное введение [30] и еще в одном – пероральное введение [31]. Между исследованиями, где терапию применяли перорально, гетерогенности обнаружено не было; СРС составила 0,95 (95% ДИ, -3,82–5,72; p = 0,70). Для РКИ, где терапию применяли трансдермально [30], СРС составила 0,40 (95% ДИ, -2,62–3,41; p = 0,79). Для исследования, где применяли пероральную терапию [31], СРС составила 3,00 (95% ДИ, -2,96–8,96; p = 0,32). Эти результаты показывают, что независимо от способа введения, видимых различий между изменениями объема предстательной железы в случае применения андрогенной терапии и плацебо обнаружено не было.
3.3.3. Изменения оценки по Международной шкале простатических симптомов
Пять РКИ [22-24, 26, 30], охватывающие 346 участников (173 в группе, получавшей андрогенную терапию, и 173 в контрольной группе), включали данные изменения оценки по шкале МШПС. В двух исследованиях АЗТ или плацебо применяли путем инъекций [22,23], и в трех использовали трансдермальное введение [24, 26, 30]. Между исследованиями, где терапию применяли путем инъекций, гетерогенности обнаружено не было [22, 23]; СРС составила -0,46 (95% ДИ, -3,74–2,82; p = 0,78). Не было обнаружено гетерогенности и между исследованиями, где терапию применяли трансдермально [24, 26, 30]; СРС составила -0,02 (95% ДИ, -1,01–1,04; p = 0,98). Эти результаты показывают, что АЗТ и плацебо приводят к подобным изменениям оценки МШПС, независимо от того, применялись они путем инъекцией или трансдермально.
3.3.4. Изменения максимальной объемной скорости потока мочи
Только два РКИ [23,31], включавшие в общем 63 участника (32 в группе, получавшей андрогенную терапию, и 31 в контрольной группе), содержали данные об изменении Qmax. В одном из них терапию применяли путем инъекций [23], а в другом – перорально [31]. Гетерогенности между исследованиями обнаружено не было. СРС составила 0,22 (95% ДИ, -4,35–4,79) для РКИ, где терапию применяли путем инъекций и 5,00 (95% ДИ, -0,96–10,96) для исследования, где терапию применяли перорально (p = 0,28). Следовательно, ни при инъекционном введении, ни при пероральном введении андрогенная терапия не уменьшала Qmax по сравнению с плацебо.
3.4. Сравнение применения долгосрочной андроген-заместительной терапии и плацебо
3.4.1. Уровень простатического специфического антигена
Девять РКИ [17-21, 25, 27-29] содержали данные об уровне ПСА у 670 участников (255 в группе, получавшей андрогенную терапию, и 315 в контрольной группе). В трех из них применяли инъекционную терапию [17, 21, 29], в четырех – трансдермальную [18, 19, 27, 28] и в двух – пероральную [20, 25]. Проведенный анализ не обнаружил гетерогенности между исследованиями. СРС составили 0,15 (95% ДИ, -0,22–0,53; p = 0,42), -0,06 (95% ДИ, -0,23–0,12; p = 0,51) и -0,08 (95% ДИ, -0,36–0,20; p = 0,57) в случае применения АЗТ путем инъекций, трансдермального введения и перорального введения, соответственно. Эти результаты указывают на отсутствие явных различий в изменениях уровня ПСА между группами, получавшими АЗТ и плацебо, независимо от способа применения.
3.4.2. Изменения объема предстательной железы
Четыре РКИ [21, 25, 27, 28], охватывавшие в целом 402 участника (216 в группе, получавшей андрогенную терапию, и 186 в контрольной группе), содержали данные об изменениях объема предстательной железы. В одном исследовании терапию применяли путем инъекций [21], в двух использовали трансдермальное [27, 28] и в одном – пероральное введение [25]. Гетерогенности между исследованиями обнаружено не было. Проведенный анализ показал, что в случае введения путем инъекций СРС составила 4 (95% ДИ, -4,32–12,32; p = 0,35), для трансдермального введения СРС равнялась -0,42 (95% ДИ, -1,99–1,14; p = 0,59), а для перорального введения СРС – 1,20 (95% ДИ, -2,02–4,42; p = 0,47). Этот результат говорит об отсутствии отличий в изменениях объема предстательной железы между группами, получавшими АЗТ и плацебо, для всех трех способов применения.
3.4.3. Изменения оценки по Международной шкале простатических симптомов
Шесть РКИ [18-20, 25, 28, 29], охватывающие 563 участника (286 в группе, получавшей андрогенную терапию, и 277 в контрольной группе), содержали данные оценки по шкале МШПС. В одном исследовании терапию применяли путем инъекций [29], в трех использовали трансдермальное введение [18, 19, 28], а в двух – пероральное введение [20, 25]. Гетерогенности между исследованиями обнаружено не было, что позволило выбрать для анализа модель c фиксированными эффектами. СРС составили 2,70 (95% ДИ, -2,88–8,28; p = 0,34), 0,42 (95% ДИ, -0,41–1,24; p = 0,32) и 0,02 (95% ДИ, -1,11–1,15; p = 0,97) в случае применения терапии путем инъекций, трансдермального введения и перорального введения, соответственно. Поэтому мы пришли к выводу, что андрогенная терапия и прием плацебо практически не отличаются по влиянию на изменения оценки по шкале МШПС для всех трех методов применения.
3.4.4. Изменения максимальной объемной скорости потока мочи
Только два РКИ [18, 29], включавшие в целом 142 участника (68 в группе, получавшей андрогенную терапию, и 74 в контрольной группе), содержали данные об изменениях Qmax. В одном терапию применяли путем инъекций [29], а в другом использовали трансдермальное введение [18]. Гетерогенности между исследованиями обнаружено не было. СРС составила 3,70 (95% ДИ, -0,85–8,25) для исследования, где использовали введение путем инъекций [29], и -0,60 (95% ДИ, -3,04–1,84) для исследования, где использовали трансдермальное введение [18] (p = 0,74). Из этого можно сделать вывод о том, что АЗТ ни при введении путем инъекций, ни при пероральном введении не уменьшала Qmax по сравнению с плацебо.
3.5. Анализ в подгруппах и анализ чувствительности
Для проведения анализа в подгруппах мы разделили отобранные исследования на три группы на основании исходных данных о содержании ПСА и критериев включения в анализ: ПСА > 2 нг/мл, ПСА – 1-2 нг/мл и ПСА < 1 нг/мл. Сравнительный анализ изменений четырех показателей роста предстательной железы не обнаружил различий между группами, получавшими АЗТ и плацебо (табл. 4). Анализ в подгруппах показал, что все результаты показателей роста предстательной железы в группах, получавших АЗТ и плацебо, соответствуют нашим результатам (табл. 4) за исключением того, что АЗТ при трансдермальном применении с большей вероятностью сопровождалось ростом уровня ПСА по сравнению с плацебо (p = 0,0005) в возрастной группе старше 65 лет (табл. 4).
Был проведен анализ чувствительности путем исключения исследований, для которых создание последовательности распределения участников в группы выполняли неадекватно. Этот анализ указывает, что краткосрочная АЗТ при трансдермальном применении с большей вероятностью приводит к росту уровня ПСА по сравнению с приемом плацебо (p = 0,01) (табл. 4). В долгосрочных исследованиях между группами, получавшими АЗТ и плацебо, не было обнаружено различий в изменениях уровня ПСА (р = 0,57), объема предстательной железы (р = 1,00), оценки по шкале МШПС (р = 0,41) или Qmax (р = 0,63) (табл. 4).
Таблица 4. Результаты распределения в подгруппы, анализа чувствительности и предварительного запланированного анализа в подгруппах
3.6. Обсуждение
Рост предстательной железы зависит от наличия андрогенов и, наоборот, антиандроген и орхидэктомия могут вызвать уменьшение объема предстательной железы у пациентов с ДГПЖ [9]. Было высказано предположение, что АЗТ потенциально способно привести к увеличению объема предстательной железы. Урологи выражают обеспокоенность тем, что введение андрогена может стимулировать рост предстательной железы не только при злокачественных, но и при доброкачественных опухолевых заболеваниях. Решение этого вопроса повлияет на методы лечения ГПН, сопровождающегося изменениями предстательной железы.
Проведенный анализ обнаружил, что краткосрочная АЗТ в случае трансдермального применения с большей вероятностью приводила к повышению уровня ПСА по сравнению с приемом плацебо. Таким образом, можно утверждать, что у пациентов, которые получали терапию трансдермально, через 12 месяцев наблюдали повышение уровня ПСА. Однако это не соответствует клиническим проявлениям. Есть два возможных объяснения этого несоответствия. Одно состоит в том, что в кожных покровах повышена активность 5α-редуктазы; поэтому при нанесении геля с тестостероном на кожу достигаются более высокие концентрации дигидротестостерона, чем в случае приема сравнимой дозы энантата тестостерона [32-34], что может приводить к повышению уровня ПСА. Другое заключается в том, что ПСА чувствителен к изменениям уровня тестостерона при низких концентрациях, когда еще доступны несвязанные рецепторы для ответа на повышение уровня тестостерона. При повышении в клинических условиях уровня тестостерона до эугонадального уровня (характерного для мужчин с нормально функционирующими половыми железами) происходит насыщение рецепторов, и дальнейшее повышение уровня тестостерона не оказывает никакого влияния на уровень ПСА [35].
Некоторые урологи считают, что рост предстательной железы линейно зависит от содержания тестостерона, и, согласно доминировавшей в прошлом теории, нарушения функции предстательной железы, являются неблагоприятными последствиями этой зависимости. Теперь сформировалась новая парадигма: модель насыщения тестостероном и предстательная железа [36]. Эта теория утверждает, что влияние тестостерона на предстательную железу достигает точи насыщения значительно ниже физиологического уровня тестостерона, встречающегося в клинических условиях, после достижения которого повышение содержания тестостерона не оказывает дополнительного эффекта. Эта теория находит подтверждение в современных исследованиях. Например, в работе Пейджа с соавт. [30] критерии отбора пациентов, получавших лечение трансдермально, включали уровень ПСА <2 нг/мл, что ниже, чем в других краткосрочных исследованиях (табл. 1). Возможно, из-за относительно низкого содержания тестостерона несвязанные рецепторы способны реагировать на его повышение, результатом чего является повышение уровня ПСА в краткосрочной перспективе. На основании результатов долгосрочных исследований мы установили, что АЗТ сопровождается небольшим увеличением уровня ПСА. Тем не менее, при сравнении изменений уровня ПСА, произошедших за период терапии, достоверных различий между двумя группами не наблюдали. На основании этого мы предполагаем, что содержание ПСА немного увеличивается на ранней стадии АЗТ, а затем снижается до сравнительно низкого уровня, который все же превышает исходный уровень, и остается относительно стабильным в течение длительного времени на протяжении АЗТ.
Мы также провели оценку безопасности долгосрочной АЗТ (12-36 месяцев) для роста предстательной железы. Все 16 РКИ, включенные в наш анализ, предполагали проведение тщательного периодического контроля состояния пациентов; лечение прекращали при появлении симптомов, характерных для рака предстательной железы, или других серьезных осложнений. Кроме того, во всех 16 РКИ в начале исследования ни у одного пациента не было отмечено увеличения предстательной железы, у всех пациентов содержание ПСА было нормальным, и ни один пациент не подвергался ранее биопсии предстательной железы (табл. 3). Следовательно, долгосрочная АЗТ безопасна с точки зрения влияния на рост предстательной железы, тем не менее тщательный контроль является обязательным.
Наш вывод основан на том, что АЗТ не оказывает негативного влияния на увеличение предстательной железы у пациентов без гиперплазии предстательной железы. Вопрос, увеличивает ли АЗТ риск роста предстательной железы у пациентов с ДГПЖ, требует дополнительного изучения в более масштабных и качественных исследованиях.
В настоящее время для лабораторного подтверждения диагноза ГПН используют определение общего тестостерона в образце сыворотки, взятой с 7:00 до 11:00 [37]. Принято считать, что при уровне общего тестостерона >12 нмоль/л (350 нг/дл) не требуется заместительной терапии [5] и что уровень свободного тестостерона <225 пмоль/л (65 пг/мл) можно рассматривать как доказательство, подтверждающее необходимость терапии тестостероном [38]. В 11 из 16 исследований, включенных в данный метаанализ, когорты оценивали с использованием общепринятых методов диагностики (табл. 1). По данным наших исследований, применение АЗТ в дозе, соответствующей стандартной для данного диагноза, не увеличивает риска роста предстательной железы. Для определения оптимального содержания тестостерона в сыворотке, который бы обеспечивал эффективность и безопасность терапии, данных недостаточно. В настоящее время для молодых взрослых мужчин умеренный и низкий уровень концентрации тестостерона в сыворотке представляется адекватным и должен рассматриваться как терапевтическая цель. Хотя в выбранных для анализа РКИ применяли различные методы и дозы, супрафизиологических уровней в них не использовали.
Данный метаанализ включал 16 РКИ, проведенных с использованием двойного слепого метода. Согласно разработанной нами шкале оценки качества, качество отдельных исследований, включенных в метаанализ, было высоким. Результаты проведенного анализа важны с научной точки зрения и применимы к повседневной клинической практике, в частности благодаря проведенному анализу данных в зависимости от способа применения АЗТ. Результаты анализа в подгруппах и анализа чувствительности совпадают с нашими результатами, что подтверждает устойчивость и надежность полученных результатов.
Тем не менее, проведенный анализ имеет определенные ограничения. Данные об объеме предстательной железы и о Qmax после краткосрочной АЗТ были получены с использованием сравнительно небольшой выборки, поскольку таких исследований было мало и размеры когорт в них были невелики [16, 17, 22, 31]. К основным ограничениям можно отнести гетерогенность участников исследований, применявшихся доз андрогенов (табл. 1) и исходного состояния предстательной железы (за исключением уровня ПСА) (табл. 3). ГПН – это клинический и биохимический синдром, который отрицательно влияет на функцию многих систем и органов. Наличие симптомов ГПН не было постоянным во всех включенных исследованиях, и это также могло внести вклад в гетерогенность участников. Хотя мы провели для оценки качества исследований анализ в подгруппах и анализ чувствительности, полностью избежать проблемы гетерогенности не удалось. Только в четырех из отобранных исследований в качестве оценки конечных результатов применяли одинаковые показатели роста предстательной железы, использованные и в настоящем анализе (т.е. объем предстательной железы, оценку МШПС, уровень ПСА и Qmax). Хотя в 15 из 16 РКИ для определения тестостерона использовали утренние пробы крови, в 11 из 15 исследований сообщалось о 6 методах измерения, среди которых тандемная масс-спектрометрия и жидкостная хроматография, масс-спектроскопия, хемилюминесцентный иммуноанализ, радиоиммуноанализ, флуоресцентный иммуноанализ и электрохемилюминесцентный иммуноанализ. Общеизвестно, что стандартным методом является первый из них. Хотя результаты анализа в подгруппах, сформированных по методам определения тестостерона (общепринятый стандартный метод и необщепринятый метод) соответствовали нашим результатам, включение в анализ исследований с использованием различных методов является проблематичным и потенциально могло повлиять на результаты метаанализа.
4. Выводы
Проведенный метаанализ показывает, что, независимо от способа применения, ни краткосрочная, ни долгосрочная АЗТ не увеличивают риска роста предстательной железы. Для подтверждения этого заключения необходимы дальнейшие тщательно спланированные проспективные исследования.
References
[1] Araujo AB, Esche GR, Kupelian V, et al. Prevalence of symptomatic androgen deficiency in men. J Clin Endocrinol Metab 2007;92: 4241-7.
[2] Harman SM, Metter EJ, Tobin JD, Pearson J, Blackman MR. Longitu¬dinal effects of aging on serum total and free testosterone levels in healthy men. Baltimore Longitudinal Study of Aging. J Clin Endo¬crinol Metab 2001;86:724-31.
[3] Wu FC, Tajar A, Pye SR, et al. Hypothalamic-pituitary-testicular axis disruptions in older men are differentially linked to age and modi¬fiable risk factors. J Clin Endocrinol Metab 2008;93:2737-45.
[4] Wang C, Nieschlag E, Swerdloff R, et al. Investigation, treatment, and monitoring of late-onset hypogonadism in males: ISA, ISSAM, EAU, EAA, and ASA recommendations. Eur Urol 2009;55:121-30.
[5] Morales A, Schulman CC, Tostain J, Wu FCW. Testosterone deficien¬cy syndrome (TDS) needs to be named appropriately—the impor¬tance of accurate terminology. Eur Urol 2006;50:407-9.
[6] Kaufman JM, Vermeulen A. The decline of androgen levels in elderly men and its clinical and therapeutic implications. Endocr Rev 2005;26:833-76.
[7] Meigs JB, Mohr B, Barry MJ, Collins MM, McKinlay JB. Risk factors for clinical benign prostatic hyperplasia in a community-based popu¬lation of healthy aging men. J Clin Epidemiol 2001;54:935-44.
[8] Roehrborn CG, Boyle P, Nickel JC, Hoefner K, Andriole G. Efficacy and safety of a dual inhibitor of 5-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia. Urology 2002;60:434-41.
[9] Roehrborn CG, Siami P, Barkin J, et al. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT Study. Eur Urol 2010;57:123-31.
[10] Fowler Jr JE, Whitmore Jr WF. Considerations for the use of testos¬terone with systemic chemotherapy in prostatic cancer. Cancer 1982;49:1373-7.
[11] McConnell JD. Prostatic growth: new insights into hormonal regu¬lation. Br J Urol 1995;76(Suppl 1):5-10.
[12] Jadad AR. Randomised controlled trials. London, UK: BMJ Publish¬ing Group; 1998.
[13] Higgins JPT, Green S, editors. Cochrane handbook for systematic reviews of interventions, v.5.1. Cochrane Collaboration Web site. Updated March 2011.
[14] DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials 1986;7:177-88.
[15] Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring incon¬sistency in meta-analyses. BMJ 2003;327:557-60.
[16] Tenover JS. Effects of testosterone supplementation in the aging male. J Clin Endocrinol Metab 1992;75:1092-8.
[17] Sih R, Morlet JE, Kaiser FE, Perry III HM, Patrick P, Ross C. Testos¬terone replacement in older hypogonadal men: a 12-month ran¬domized controlled trial. J Clin Endocrinol Metab 1997;82: 1661-7.
[18] Snyder PJ, Peachey H, Hannoush P, et al. Effect of testosterone treatment on bone mineral density in men over 65 years of age. J Clin Endocrinol Metab 1999;84:1966-72.
[19] Kenny AM, Prestwood KM, Gruman CA, Marcello KM, Raisz LG. Effects of transdermal testosterone on bone and muscle in older men with low bioavailable testosterone levels. J Gerontol A Biol Sci Med Sci 2001;565:266-72.
[20] Wittert GA, Chapman IM, Haren MT, Mackintosh, Coates P, Morley JE. Oral testosterone supplementation increases muscle and decreases fat mass in healthy elderly males with low-normal gonadal status. J Gerontol A Biol Sci Med Sci 2003;587:618-25.
[21] Amory JK, Watts NB, Easley KA, et al. Exogenous testosterone or testosterone with finasteride increases bone mineral density in older men with low serum testosterone. J Clin Endocrinol Metab 2004;89:503-10.
[22] Kenny AM, Fabregas G, Song C, Biskup B, Bellantonio S. Effects of testosterone on behavior, depression, and cognitive function in older men with mild cognitive loss. J Gerontol A Biol Sci Med Sci 2004;591:75-8.
[23] Marks LS, Mazer NA, Mostaghel E, et al. Effect of testosterone replacement therapy on prostate tissue in men with late-onset hypogonadism. JAMA 2006;296:2351-61.
[24] Chiang HS, Hwang TIS, Hsui YS, et al. Transdermal testosterone gel increases serum testosterone levels in hypogonadal men in Taiwan with improvements in sexual function. Int J Impot Res 2007;19: 411-7.
[25] Emmelot-Vonk MH, Verhaar HJJ, Pour HRN, et al. Effect of testos¬terone supplementation on functional mobility, cognition, and other parameters in older men. JAMA 2008;299:39-52.
[26] Srinivas-Shankar U, Roberts SA, Connolly MJ, et al. Effects of tes¬tosterone on muscle strength, physical function, body composition, and quality of life in intermediate-frail and frail elderly men: a randomized, double-blind, placebo-controlled study. J Clin Endo¬crinol Metab 2010;95:639-50.
[27] Aversa A, Bruzziches R, Francomano D, et al. Effects of testosterone undecanoate on cardiovascular risk factors and atherosclerosis in middle-aged men with late-onset hypogonadism and metabolic syndrome: results from a 24-month, randomized, double-blind, placebo-controlled study. J Sex Med 2010;7:3495-503.
[28] Idan A, Griffiths KA, Harwood DT, et al. Long-term effects of dihydro-testosterone treatment on prostate growth in healthy, middle-aged men without prostate disease. Ann Intern Med 2010;153:621-32.
[29] Shigehara K, Sugimoto K, Konaka H, et al. Androgen replacement therapy contributes to improving lower urinary tract symptoms in patients with hypogonadism and benign prostate hypertrophy: a randomised controlled study. Aging Male 2011;14:53-8.
[30] Page ST, Lin DW, Mostaghel EA, et al. Dihydrotestosterone admin¬istration does not increase intraprostatic androgen concentrations or alter prostate androgen action in healthy men: a randomized- controlled trial. J Clin Endocrinol Metab 2011;96:430-7.
[31 ] Holmang S, Marin P, Lindstedt G, Hedelin H. Effect of long-term oral testosterone undecanoate treatment on prostate volume and se¬rum prostate-specific antigen concentration in eugonadal middle- aged men. Prostate 1993;23:99-106.
[32] Wang C, Berman N, Longstreth JA, et al. Pharmacokinetics of transdermal testosterone gel in hypogonadal men: application of gel at one site versus four sites: a General Clinical Research Center Study. J Clin Endocrinol Metab 2000;85:964-9.
[33] Swerdloff RS, Wang C, Cunningham G, et al. Long-term pharmaco¬kinetics of transdermal testosterone gel in hypogonadal men. J Clin Endocrinol Metab 2000;85:4500-10.
[34] Bhasin S, Travison TG, Storer TW, et al. Effect of testosterone supplementation with and without a dual 5a-reductase inhibitor on fat-free mass in men with suppressed testosterone production: a randomized controlled trial. JAMA 2012;307:931-9.
[35] Polackwich AS, Ostrowski KA, Hedges JC. Testosterone replacement therapy and prostate health. Curr Urol Rep 2012;13:441-6.
[36] Morgentaler A, Traish AM. Shifting the paradigm of testosterone and prostate cancer: the saturation model and the limits of androgen-dependent growth. Eur Urol 2009;55:310-21.
[37] Diver MJ, Imtiaz KE, Ahmad AM, Vora JP, Fraser WD. Diurnal rhythms of serum total, free and bioavailable testosterone and of SHBG in middle-aged men compared with those in young men. Clin Endocrinol 2003;58:710-7.
[38] Rosner W, Auchus RJ, Azziz R, Sluss PM, Raff H. Utility, limitations, and pitfalls in measuring testosterone: an Endocrine Society Posi¬tion Statement. J Clin Endocrinol Metab 2007;92:405-13.
Юаньшань Цуй, Юн Чжан
Ключевые слова: андрогены, предстательная железа, метаанализ, рандомизированное контролируемое исследование.
Резюме
Предпосылки: Андрогенозаместительная терапия (АЗТ) является широко распространенным во всем мире видом лечения пожилых мужчин с синдромом позднего гипогонадизма. Возможность того, что АЗТ может стать причиной роста предстательной железы, вызывает обеспокоенность урологов.
Цель: Оценить связь между АЗТ и ростом предстательной железы.
Сбор фактических данных: Был проведен обзор литературы для выявления всех опубликованных рандомизированных контролируемых исследований (РКИ) терапии андрогенами при гипогонадизме. Поиск охватывал базы данных Medline, Embase и Кокрановский реестр контролируемых исследований (Cochrane Controlled Trials Register). Кроме того, были изучены библиографические списки найденных работ. Были выполнены систематический обзор и метаанализ.
Синтез данных: Были проанализированы результаты 16 РКИ, в которых участвовало 1030 пациентов. Семь РКИ были краткосрочными (<12 месяцев) и девять были долгосрочными (12-36 месяцев) сравнениями АЗТ с плацебо; АЗТ применяли в виде трансдермального введения, перорального введения или путем инъекцией. Соответствующие значения p для применения методами инъекций, трансдермального введения и перорального введения при краткосрочной АЗТ были следующими: уровень ПСА: 0,07, 0,01 и 0,95; объем предстательной железы: 0,70, 0,79 и 0,32; оценка по шкале МШПС: 0,78, 0,98 и отсутствует при пероральном введении; Qmax: 0,92, отсутствует при трансдермальном введении и 0,10. Соответствующие значения p для инъекций, трансдермального введения и перорального введения при долгосрочной АЗТ были следующими: уровень ПСА: 0,42, 0,51 и 57; объем предстательной железы: 0,35, 0,59 и 0,47; оценка по шкале МШПС: 0,34, 0,32 и 0,97; Qmax: 0,11, 0,63 и отсутствует при пероральном введении. Ни после краткосрочной, ни после долгосрочной АЗТ не было обнаружено значительных изменений значений четырех показателей увеличения объема предстательной железы по сравнению с группой, получавшей плацебо.
Выводы: Проведенный метаанализ показывает, что независимо от способа введения, ни краткосрочная, ни долгосрочная АЗТ не увеличивают риск роста предстательной железы. Для подтверждения этого заключения необходимы дальнейшие тщательно спланированные проспективные исследования.
1. Введение
Андрогенный дефицит у стареющих мужчин стал предметом растущего интереса и дискуссий во всем мире. Результаты одномоментных и долгосрочных исследований показывают, что уровень тестостерона с возрастом постепенно снижается - у значительной части мужчин в возрасте старше 60 лет содержание тестостерона в сыворотке крови ниже нижнего предела в сравнении с мужчинами 20-30 лет [1-3]. Гипогонадизм с поздним началом (ГПН) – это клинический и биохимический синдром, проявляющийся в зрелом возрасте и характеризующийся недостаточным содержанием тестостерона в сыворотке, а также другими признаками и симптомами. [4, 5]. ГПН может существенно ухудшать качество жизни и негативно влиять на функцию многих органов и систем.
Андрогенозаместительная терапия (АЗТ) является широко распространенным методом лечения, позволяющим предотвратить или облегчить многие из симптомов и состояний, связанных с ГПН у мужчин в период старения.
Исследования, проведенные за последнее десятилетие, свидетельствуют о положительном воздействии андрогенной терапии на ряд целевых органов у мужчин с гипогонадизмом, включая кратковременные положительные эффекты тестостерона у мужчин старшего возраста, сходные с наблюдаемыми у более молодых мужчин [6]. АЗТ чаще всего применяют путем инъекционного, трансдермального или перорального введения.
Иногда постепенное увеличение объема предстательной железы, сопутствующее прогрессирующему снижению уровня тестостерона в среднем возрасте, отражает развитие доброкачественной гиперплазии предстательной железы (ДГПЖ) [7]. Хорошо известно, что андроген играет важную роль в развитии ДГПЖ, поэтому было высказано предположение, что АЗТ потенциально может способствовать росту предстательной железы [8-11]. Многих урологов тревожит то, что АЗТ может ускорить рост предстательной железы не только при злокачественных, но и при доброкачественных опухолевых заболеваниях.
2. Сбор фактических данных
2.1. Стратегия поиска
С целью выявления рандомизированных контролируемых исследований (РКИ), в которых упоминается влияние АЗТ на предстательную железу, провели поиск по базам данных Medline (с 1966 по октябрь 2012 года), Embase (с 1974 по октябрь 2012 года) и в Кокрановском реестре контролируемых исследований. Мы также провели анализ библиографических списков найденных работ. Были использованы следующие поисковые термины: андроген, предстательная железа и рандомизированные контролируемые исследования.
2.2. Критерии включения в анализ и выбор клинических исследований
В анализ включали РКИ, соответствующие следующим критериям: (1) дизайн исследования предполагал применение АЗТ; (2) в исследовании были получены точные данные, пригодные для анализа, включая общее количество субъектов и значения каждого показателя роста предстательной железы, таких как уровень простатического специфического антигена (ПСА), объем предстательной железы, оценка по Международной шкале простатических симптомов (МШПС) и максимальная объемная скорость потока мочи (Qmax); (3) имеется доступ к полному тексту публикации. Если одно и то же исследование было опубликовано в разных журналах или в разные годы, для метаанализа использовали самую последнюю публикацию. Если одна и та же группа исследователей изучала группу субъектов в нескольких экспериментах, в анализ включали все работы. Блок-схема процесса отбора исследований представлена на рисунке.
Рис. Блок-схема процесса отбора исследований
Примечание: РКИ — рандомизированное контролируемое исследование.
2.3. Оценка качества
Качество найденных РКИ оценивали по шкале Джадада [12]. В этот анализ были включены все найденные РКИ независимо от оценки качества. Методологическое качество каждого исследования оценивали на основании использованных принципов распределения пациентов по группам, сокрытия процедур распределения, маскировки данных и потерь данных вследствие отсева участников. Затем исследования классифицировали по качественным признакам в соответствии с рекомендациями, опубликованными в Кокрановском руководстве по составлению систематических обзоров о вмешательствах v.5.1.0. [13]. На основании критериев оценки качества выполняли оценку каждого исследования и относили его к одной из трех следующих групп:
A. Если все критерии качества были соблюдены должным образом, считали, что исследование имеет низкий риск смещения.
Б. Если один или более критериев качества соблюдены лишь частично или не выполнены, считали, что исследование имеет умеренный риск смещения.
В. Если один или более критериев качества не выполнены или не рассматривались, считали, что исследование характеризуется высоким риском смещения.
Разногласия в отношении распределения решали путем обсуждения между авторами.
2.4. Извлечение данных
Для каждого исследования проводили сбор следующих данных: (1) имя первого автора и год публикации; (2) дизайн исследования и размер выборки; (3) терапия, которую получали пациенты; (4) страна, где проводилось исследование; (5) данные о четырех показателях роста предстательной железы (т.е. уровень ПСА, объем предстательной железы, оценка по шкале МШПС, Qmax); (6) метод применения АЗТ и дозировка.
2.5. Статистический анализ и метаанализ
Метаанализ сопоставимых данных выполняли с использованием RevMan v.5.1.0 (Кокрановское сотрудничество, Оксфорд, Великобритания) [13]. Изменения значений всех четырех показателей роста предстательной железы определяли как различия между исходным уровнем (на входе в исследование) и уровнем после завершения исследования. Мы оценили относительный риск дихотомических исходов и стандартизированную разность средних (СРС) для непрерывных данных, объединенных в исследования с использованием модели случайных эффектов ДерСимоняна и Лейрда [14]. Использовали доверительный интервал (ДИ), равный 95%. Если в результате анализа оказывалось, что p> 0,05, эти исследования считали гомогенными и выбирали для метаанализа модель фиксированного эффекта.
В противном случае выбирали модель случайных эффектов. Для количественной оценки неоднородности данных использовали статистику I2, которая описывает долю гетерогенности в исследованиях, не являющуюся случайной и характеризующую степень истинной неоднородности результатов разных исследований [15]. I2 <25% свидетельствует о низком уровне неоднородности, а I2 >50% указывает на значительную неоднородность.
2.6. Анализ в подгруппах и анализ чувствительности
Для выяснения причин неоднородности и взаимодействия между подгруппами подгруппы для анализа определяли априори с учетом следующих факторов:
- Участники: возрастная группа до 65 лет и старше 65 лет; исходный уровень общего содержания тестостерона (содержание тестостерона считали низким в случае, если оно было <350 нг/дл или 12 нмоль/л); при отсутствии данных про общий тестостерон использовали нижний предел нормы для содержания биодоступного или свободного тестостерона; при отсутствии сведений об общем или свободном тестостероне исследования делили на группы в соответствии с уровнями ПСА.
- Терапия: лекарственная форма тестостерона, способ применения.
- Характеристика результатов: длительность последующего наблюдения (<12 мес. или >12 мес.).
- Оценка качества исследований: доля пациентов, не явившихся для последующего наблюдения (<10% или >10%), сокрытие порядка распределения по группам и маскировка данных пациентов.
3.1. Характеристики индивидуальных исследований
Поиск в базе данных обнаружил 146 статей, которые могли быть включены в данный метаанализ. 128 статей были исключены после прочтения названий и резюме статей на основании критериев включения и исключения. Две статьи не содержали полезных данных. Всего в этот анализ были включены 16 статей [16-31], содержавших данные 16 РКИ. В 7 РКИ сравнение эффектов андрогенной терапии и плацебо проводили на протяжении короткого периода (менее 12 мес.), а в 9 РКИ исследование охватывало длительный период времени (12-36 мес.). В исследованиях использовали три различных способа применения: пероральный, трансдермальный и инъекционный (рис.). Основные характеристики исследований, включенных в метаанализ, представлены в таблице 1.
Таблица 1. Характеристики исследований и участников
Только в четырех из отобранных исследований для оценки конечных результатов применяли одинаковые показатели роста предстательной железы, использованные и в настоящем анализе (т.е. объем предстательной железы, оценку МШПС, уровень ПСА и Qmax). Все 16 РКИ, включенные в наш анализ, предполагали проведение тщательного периодического контроля состояния пациентов; лечение прекращали при появлении симптомов, характерных для рака предстательной железы, или других серьезных осложнений. У нескольких пациентов с серьезными осложнениями и у всех пациентов, отказавшихся от лечения, при долгосрочной оценке наблюдали возврат к норме. В пяти из 16 РКИ [18, 21, 23, 25, 26] сообщалось, что нескольких пациентов с повышенным уровнем ПСА в последующем подвергли биопсии простаты (табл. 3) и гистологическое исследование образцов биопсийного материала обнаружило доброкачественный характер изменений.
Все 16 РКИ содержали исходные значения уровня ПСА, объема предстательной железы, оценки по шкале МШПС и Qmax, и только у одного пациента из этих исследований [29] наблюдали симптомы ДГПЖ (табл. 3). Кроме того, во всех 16 РКИ в начале исследования ни у одного пациента не было отмечено увеличения предстательной железы, у всех пациентов содержание ПСА было нормальным (табл. 3) и ни один пациент не подвергался ранее биопсии предстательной железы.
3.2. Качество отдельных исследований
Во всех 16 РКИ применяли двойной слепой метод и все они содержали описание использованных методов рандомизации. Все, за исключением исследования Кенни и соавт. [22], предполагали определение мощности для расчета оптимального размера выборки, а в семи из них проводили анализ в соответствии с назначенным лечением (табл. 2). Все отобранные исследования имели уровень качества А (табл. 2). Воронкообразная диаграмма, построенная для качественной оценки публикационного смещения в исследованиях, не обнаружила признаков смещения (рис. 4).
Таблица 2. Оценка качества отдельных исследований
Таблица 3. Данные оценки исходного состояния пациентов в нашем исследовании
3.3. Сравнение применения краткосрочной андроген-заместительной терапии и плацебо
3.3.1. Уровень простатического специфического антигена
Шесть РКИ, охватывающие 345 участников (170 в группе, получавшей андрогенную терапию, и 175 в контрольной группе), содержали данные определения ПСА [16, 22, 23, 26, 30, 31]. В трех исследованиях для проведения терапии использовали инъекции [16, 22, 23]; в двух – трансдермальное введение [26, 30]; и в одном – пероральное [31]. Гетерогенности между исследованиями обнаружено не было. Для трех РКИ, где терапию применяли в виде инъекций, при оценке с фиксированным эффектом СРС составила 0,50 (95% ДИ, -0,04–1,05; p = 0,07). Для РКИ, где терапию применяли трансдермально, СРС составила 0,30 (95% ДИ, 0,07–0,54; p = 0,002). Для исследования, где терапию применяли перорально, СРС составила -0,02 (95% ДИ, -0,64–0,60; p = 0,95). Эти результаты показывают, что при трансдермальном введении АЗТ приводит к повышению уровня ПСА с большей вероятностью по сравнению с применением плацебо.
3.3.2. Изменения объема предстательной железы
Четыре РКИ [16, 23, 30, 31], охватывающие 103 участника (50 в группе, получавшей андрогенную терапию, и 53 в контрольной группе), содержали данные об изменении объема предстательной железы. В двух исследованиях терапию применяли путем инъекций [16, 23], в одном использовали трансдермальное введение [30] и еще в одном – пероральное введение [31]. Между исследованиями, где терапию применяли перорально, гетерогенности обнаружено не было; СРС составила 0,95 (95% ДИ, -3,82–5,72; p = 0,70). Для РКИ, где терапию применяли трансдермально [30], СРС составила 0,40 (95% ДИ, -2,62–3,41; p = 0,79). Для исследования, где применяли пероральную терапию [31], СРС составила 3,00 (95% ДИ, -2,96–8,96; p = 0,32). Эти результаты показывают, что независимо от способа введения, видимых различий между изменениями объема предстательной железы в случае применения андрогенной терапии и плацебо обнаружено не было.
3.3.3. Изменения оценки по Международной шкале простатических симптомов
Пять РКИ [22-24, 26, 30], охватывающие 346 участников (173 в группе, получавшей андрогенную терапию, и 173 в контрольной группе), включали данные изменения оценки по шкале МШПС. В двух исследованиях АЗТ или плацебо применяли путем инъекций [22,23], и в трех использовали трансдермальное введение [24, 26, 30]. Между исследованиями, где терапию применяли путем инъекций, гетерогенности обнаружено не было [22, 23]; СРС составила -0,46 (95% ДИ, -3,74–2,82; p = 0,78). Не было обнаружено гетерогенности и между исследованиями, где терапию применяли трансдермально [24, 26, 30]; СРС составила -0,02 (95% ДИ, -1,01–1,04; p = 0,98). Эти результаты показывают, что АЗТ и плацебо приводят к подобным изменениям оценки МШПС, независимо от того, применялись они путем инъекцией или трансдермально.
3.3.4. Изменения максимальной объемной скорости потока мочи
Только два РКИ [23,31], включавшие в общем 63 участника (32 в группе, получавшей андрогенную терапию, и 31 в контрольной группе), содержали данные об изменении Qmax. В одном из них терапию применяли путем инъекций [23], а в другом – перорально [31]. Гетерогенности между исследованиями обнаружено не было. СРС составила 0,22 (95% ДИ, -4,35–4,79) для РКИ, где терапию применяли путем инъекций и 5,00 (95% ДИ, -0,96–10,96) для исследования, где терапию применяли перорально (p = 0,28). Следовательно, ни при инъекционном введении, ни при пероральном введении андрогенная терапия не уменьшала Qmax по сравнению с плацебо.
3.4. Сравнение применения долгосрочной андроген-заместительной терапии и плацебо
3.4.1. Уровень простатического специфического антигена
Девять РКИ [17-21, 25, 27-29] содержали данные об уровне ПСА у 670 участников (255 в группе, получавшей андрогенную терапию, и 315 в контрольной группе). В трех из них применяли инъекционную терапию [17, 21, 29], в четырех – трансдермальную [18, 19, 27, 28] и в двух – пероральную [20, 25]. Проведенный анализ не обнаружил гетерогенности между исследованиями. СРС составили 0,15 (95% ДИ, -0,22–0,53; p = 0,42), -0,06 (95% ДИ, -0,23–0,12; p = 0,51) и -0,08 (95% ДИ, -0,36–0,20; p = 0,57) в случае применения АЗТ путем инъекций, трансдермального введения и перорального введения, соответственно. Эти результаты указывают на отсутствие явных различий в изменениях уровня ПСА между группами, получавшими АЗТ и плацебо, независимо от способа применения.
3.4.2. Изменения объема предстательной железы
Четыре РКИ [21, 25, 27, 28], охватывавшие в целом 402 участника (216 в группе, получавшей андрогенную терапию, и 186 в контрольной группе), содержали данные об изменениях объема предстательной железы. В одном исследовании терапию применяли путем инъекций [21], в двух использовали трансдермальное [27, 28] и в одном – пероральное введение [25]. Гетерогенности между исследованиями обнаружено не было. Проведенный анализ показал, что в случае введения путем инъекций СРС составила 4 (95% ДИ, -4,32–12,32; p = 0,35), для трансдермального введения СРС равнялась -0,42 (95% ДИ, -1,99–1,14; p = 0,59), а для перорального введения СРС – 1,20 (95% ДИ, -2,02–4,42; p = 0,47). Этот результат говорит об отсутствии отличий в изменениях объема предстательной железы между группами, получавшими АЗТ и плацебо, для всех трех способов применения.
3.4.3. Изменения оценки по Международной шкале простатических симптомов
Шесть РКИ [18-20, 25, 28, 29], охватывающие 563 участника (286 в группе, получавшей андрогенную терапию, и 277 в контрольной группе), содержали данные оценки по шкале МШПС. В одном исследовании терапию применяли путем инъекций [29], в трех использовали трансдермальное введение [18, 19, 28], а в двух – пероральное введение [20, 25]. Гетерогенности между исследованиями обнаружено не было, что позволило выбрать для анализа модель c фиксированными эффектами. СРС составили 2,70 (95% ДИ, -2,88–8,28; p = 0,34), 0,42 (95% ДИ, -0,41–1,24; p = 0,32) и 0,02 (95% ДИ, -1,11–1,15; p = 0,97) в случае применения терапии путем инъекций, трансдермального введения и перорального введения, соответственно. Поэтому мы пришли к выводу, что андрогенная терапия и прием плацебо практически не отличаются по влиянию на изменения оценки по шкале МШПС для всех трех методов применения.
3.4.4. Изменения максимальной объемной скорости потока мочи
Только два РКИ [18, 29], включавшие в целом 142 участника (68 в группе, получавшей андрогенную терапию, и 74 в контрольной группе), содержали данные об изменениях Qmax. В одном терапию применяли путем инъекций [29], а в другом использовали трансдермальное введение [18]. Гетерогенности между исследованиями обнаружено не было. СРС составила 3,70 (95% ДИ, -0,85–8,25) для исследования, где использовали введение путем инъекций [29], и -0,60 (95% ДИ, -3,04–1,84) для исследования, где использовали трансдермальное введение [18] (p = 0,74). Из этого можно сделать вывод о том, что АЗТ ни при введении путем инъекций, ни при пероральном введении не уменьшала Qmax по сравнению с плацебо.
3.5. Анализ в подгруппах и анализ чувствительности
Для проведения анализа в подгруппах мы разделили отобранные исследования на три группы на основании исходных данных о содержании ПСА и критериев включения в анализ: ПСА > 2 нг/мл, ПСА – 1-2 нг/мл и ПСА < 1 нг/мл. Сравнительный анализ изменений четырех показателей роста предстательной железы не обнаружил различий между группами, получавшими АЗТ и плацебо (табл. 4). Анализ в подгруппах показал, что все результаты показателей роста предстательной железы в группах, получавших АЗТ и плацебо, соответствуют нашим результатам (табл. 4) за исключением того, что АЗТ при трансдермальном применении с большей вероятностью сопровождалось ростом уровня ПСА по сравнению с плацебо (p = 0,0005) в возрастной группе старше 65 лет (табл. 4).
Был проведен анализ чувствительности путем исключения исследований, для которых создание последовательности распределения участников в группы выполняли неадекватно. Этот анализ указывает, что краткосрочная АЗТ при трансдермальном применении с большей вероятностью приводит к росту уровня ПСА по сравнению с приемом плацебо (p = 0,01) (табл. 4). В долгосрочных исследованиях между группами, получавшими АЗТ и плацебо, не было обнаружено различий в изменениях уровня ПСА (р = 0,57), объема предстательной железы (р = 1,00), оценки по шкале МШПС (р = 0,41) или Qmax (р = 0,63) (табл. 4).
Таблица 4. Результаты распределения в подгруппы, анализа чувствительности и предварительного запланированного анализа в подгруппах
3.6. Обсуждение
Рост предстательной железы зависит от наличия андрогенов и, наоборот, антиандроген и орхидэктомия могут вызвать уменьшение объема предстательной железы у пациентов с ДГПЖ [9]. Было высказано предположение, что АЗТ потенциально способно привести к увеличению объема предстательной железы. Урологи выражают обеспокоенность тем, что введение андрогена может стимулировать рост предстательной железы не только при злокачественных, но и при доброкачественных опухолевых заболеваниях. Решение этого вопроса повлияет на методы лечения ГПН, сопровождающегося изменениями предстательной железы.
Проведенный анализ обнаружил, что краткосрочная АЗТ в случае трансдермального применения с большей вероятностью приводила к повышению уровня ПСА по сравнению с приемом плацебо. Таким образом, можно утверждать, что у пациентов, которые получали терапию трансдермально, через 12 месяцев наблюдали повышение уровня ПСА. Однако это не соответствует клиническим проявлениям. Есть два возможных объяснения этого несоответствия. Одно состоит в том, что в кожных покровах повышена активность 5α-редуктазы; поэтому при нанесении геля с тестостероном на кожу достигаются более высокие концентрации дигидротестостерона, чем в случае приема сравнимой дозы энантата тестостерона [32-34], что может приводить к повышению уровня ПСА. Другое заключается в том, что ПСА чувствителен к изменениям уровня тестостерона при низких концентрациях, когда еще доступны несвязанные рецепторы для ответа на повышение уровня тестостерона. При повышении в клинических условиях уровня тестостерона до эугонадального уровня (характерного для мужчин с нормально функционирующими половыми железами) происходит насыщение рецепторов, и дальнейшее повышение уровня тестостерона не оказывает никакого влияния на уровень ПСА [35].
Некоторые урологи считают, что рост предстательной железы линейно зависит от содержания тестостерона, и, согласно доминировавшей в прошлом теории, нарушения функции предстательной железы, являются неблагоприятными последствиями этой зависимости. Теперь сформировалась новая парадигма: модель насыщения тестостероном и предстательная железа [36]. Эта теория утверждает, что влияние тестостерона на предстательную железу достигает точи насыщения значительно ниже физиологического уровня тестостерона, встречающегося в клинических условиях, после достижения которого повышение содержания тестостерона не оказывает дополнительного эффекта. Эта теория находит подтверждение в современных исследованиях. Например, в работе Пейджа с соавт. [30] критерии отбора пациентов, получавших лечение трансдермально, включали уровень ПСА <2 нг/мл, что ниже, чем в других краткосрочных исследованиях (табл. 1). Возможно, из-за относительно низкого содержания тестостерона несвязанные рецепторы способны реагировать на его повышение, результатом чего является повышение уровня ПСА в краткосрочной перспективе. На основании результатов долгосрочных исследований мы установили, что АЗТ сопровождается небольшим увеличением уровня ПСА. Тем не менее, при сравнении изменений уровня ПСА, произошедших за период терапии, достоверных различий между двумя группами не наблюдали. На основании этого мы предполагаем, что содержание ПСА немного увеличивается на ранней стадии АЗТ, а затем снижается до сравнительно низкого уровня, который все же превышает исходный уровень, и остается относительно стабильным в течение длительного времени на протяжении АЗТ.
Мы также провели оценку безопасности долгосрочной АЗТ (12-36 месяцев) для роста предстательной железы. Все 16 РКИ, включенные в наш анализ, предполагали проведение тщательного периодического контроля состояния пациентов; лечение прекращали при появлении симптомов, характерных для рака предстательной железы, или других серьезных осложнений. Кроме того, во всех 16 РКИ в начале исследования ни у одного пациента не было отмечено увеличения предстательной железы, у всех пациентов содержание ПСА было нормальным, и ни один пациент не подвергался ранее биопсии предстательной железы (табл. 3). Следовательно, долгосрочная АЗТ безопасна с точки зрения влияния на рост предстательной железы, тем не менее тщательный контроль является обязательным.
Наш вывод основан на том, что АЗТ не оказывает негативного влияния на увеличение предстательной железы у пациентов без гиперплазии предстательной железы. Вопрос, увеличивает ли АЗТ риск роста предстательной железы у пациентов с ДГПЖ, требует дополнительного изучения в более масштабных и качественных исследованиях.
В настоящее время для лабораторного подтверждения диагноза ГПН используют определение общего тестостерона в образце сыворотки, взятой с 7:00 до 11:00 [37]. Принято считать, что при уровне общего тестостерона >12 нмоль/л (350 нг/дл) не требуется заместительной терапии [5] и что уровень свободного тестостерона <225 пмоль/л (65 пг/мл) можно рассматривать как доказательство, подтверждающее необходимость терапии тестостероном [38]. В 11 из 16 исследований, включенных в данный метаанализ, когорты оценивали с использованием общепринятых методов диагностики (табл. 1). По данным наших исследований, применение АЗТ в дозе, соответствующей стандартной для данного диагноза, не увеличивает риска роста предстательной железы. Для определения оптимального содержания тестостерона в сыворотке, который бы обеспечивал эффективность и безопасность терапии, данных недостаточно. В настоящее время для молодых взрослых мужчин умеренный и низкий уровень концентрации тестостерона в сыворотке представляется адекватным и должен рассматриваться как терапевтическая цель. Хотя в выбранных для анализа РКИ применяли различные методы и дозы, супрафизиологических уровней в них не использовали.
Данный метаанализ включал 16 РКИ, проведенных с использованием двойного слепого метода. Согласно разработанной нами шкале оценки качества, качество отдельных исследований, включенных в метаанализ, было высоким. Результаты проведенного анализа важны с научной точки зрения и применимы к повседневной клинической практике, в частности благодаря проведенному анализу данных в зависимости от способа применения АЗТ. Результаты анализа в подгруппах и анализа чувствительности совпадают с нашими результатами, что подтверждает устойчивость и надежность полученных результатов.
Тем не менее, проведенный анализ имеет определенные ограничения. Данные об объеме предстательной железы и о Qmax после краткосрочной АЗТ были получены с использованием сравнительно небольшой выборки, поскольку таких исследований было мало и размеры когорт в них были невелики [16, 17, 22, 31]. К основным ограничениям можно отнести гетерогенность участников исследований, применявшихся доз андрогенов (табл. 1) и исходного состояния предстательной железы (за исключением уровня ПСА) (табл. 3). ГПН – это клинический и биохимический синдром, который отрицательно влияет на функцию многих систем и органов. Наличие симптомов ГПН не было постоянным во всех включенных исследованиях, и это также могло внести вклад в гетерогенность участников. Хотя мы провели для оценки качества исследований анализ в подгруппах и анализ чувствительности, полностью избежать проблемы гетерогенности не удалось. Только в четырех из отобранных исследований в качестве оценки конечных результатов применяли одинаковые показатели роста предстательной железы, использованные и в настоящем анализе (т.е. объем предстательной железы, оценку МШПС, уровень ПСА и Qmax). Хотя в 15 из 16 РКИ для определения тестостерона использовали утренние пробы крови, в 11 из 15 исследований сообщалось о 6 методах измерения, среди которых тандемная масс-спектрометрия и жидкостная хроматография, масс-спектроскопия, хемилюминесцентный иммуноанализ, радиоиммуноанализ, флуоресцентный иммуноанализ и электрохемилюминесцентный иммуноанализ. Общеизвестно, что стандартным методом является первый из них. Хотя результаты анализа в подгруппах, сформированных по методам определения тестостерона (общепринятый стандартный метод и необщепринятый метод) соответствовали нашим результатам, включение в анализ исследований с использованием различных методов является проблематичным и потенциально могло повлиять на результаты метаанализа.
4. Выводы
Проведенный метаанализ показывает, что, независимо от способа применения, ни краткосрочная, ни долгосрочная АЗТ не увеличивают риска роста предстательной железы. Для подтверждения этого заключения необходимы дальнейшие тщательно спланированные проспективные исследования.
References
[1] Araujo AB, Esche GR, Kupelian V, et al. Prevalence of symptomatic androgen deficiency in men. J Clin Endocrinol Metab 2007;92: 4241-7.
[2] Harman SM, Metter EJ, Tobin JD, Pearson J, Blackman MR. Longitu¬dinal effects of aging on serum total and free testosterone levels in healthy men. Baltimore Longitudinal Study of Aging. J Clin Endo¬crinol Metab 2001;86:724-31.
[3] Wu FC, Tajar A, Pye SR, et al. Hypothalamic-pituitary-testicular axis disruptions in older men are differentially linked to age and modi¬fiable risk factors. J Clin Endocrinol Metab 2008;93:2737-45.
[4] Wang C, Nieschlag E, Swerdloff R, et al. Investigation, treatment, and monitoring of late-onset hypogonadism in males: ISA, ISSAM, EAU, EAA, and ASA recommendations. Eur Urol 2009;55:121-30.
[5] Morales A, Schulman CC, Tostain J, Wu FCW. Testosterone deficien¬cy syndrome (TDS) needs to be named appropriately—the impor¬tance of accurate terminology. Eur Urol 2006;50:407-9.
[6] Kaufman JM, Vermeulen A. The decline of androgen levels in elderly men and its clinical and therapeutic implications. Endocr Rev 2005;26:833-76.
[7] Meigs JB, Mohr B, Barry MJ, Collins MM, McKinlay JB. Risk factors for clinical benign prostatic hyperplasia in a community-based popu¬lation of healthy aging men. J Clin Epidemiol 2001;54:935-44.
[8] Roehrborn CG, Boyle P, Nickel JC, Hoefner K, Andriole G. Efficacy and safety of a dual inhibitor of 5-alpha-reductase types 1 and 2 (dutasteride) in men with benign prostatic hyperplasia. Urology 2002;60:434-41.
[9] Roehrborn CG, Siami P, Barkin J, et al. The effects of combination therapy with dutasteride and tamsulosin on clinical outcomes in men with symptomatic benign prostatic hyperplasia: 4-year results from the CombAT Study. Eur Urol 2010;57:123-31.
[10] Fowler Jr JE, Whitmore Jr WF. Considerations for the use of testos¬terone with systemic chemotherapy in prostatic cancer. Cancer 1982;49:1373-7.
[11] McConnell JD. Prostatic growth: new insights into hormonal regu¬lation. Br J Urol 1995;76(Suppl 1):5-10.
[12] Jadad AR. Randomised controlled trials. London, UK: BMJ Publish¬ing Group; 1998.
[13] Higgins JPT, Green S, editors. Cochrane handbook for systematic reviews of interventions, v.5.1. Cochrane Collaboration Web site. Updated March 2011.
[14] DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials 1986;7:177-88.
[15] Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring incon¬sistency in meta-analyses. BMJ 2003;327:557-60.
[16] Tenover JS. Effects of testosterone supplementation in the aging male. J Clin Endocrinol Metab 1992;75:1092-8.
[17] Sih R, Morlet JE, Kaiser FE, Perry III HM, Patrick P, Ross C. Testos¬terone replacement in older hypogonadal men: a 12-month ran¬domized controlled trial. J Clin Endocrinol Metab 1997;82: 1661-7.
[18] Snyder PJ, Peachey H, Hannoush P, et al. Effect of testosterone treatment on bone mineral density in men over 65 years of age. J Clin Endocrinol Metab 1999;84:1966-72.
[19] Kenny AM, Prestwood KM, Gruman CA, Marcello KM, Raisz LG. Effects of transdermal testosterone on bone and muscle in older men with low bioavailable testosterone levels. J Gerontol A Biol Sci Med Sci 2001;565:266-72.
[20] Wittert GA, Chapman IM, Haren MT, Mackintosh, Coates P, Morley JE. Oral testosterone supplementation increases muscle and decreases fat mass in healthy elderly males with low-normal gonadal status. J Gerontol A Biol Sci Med Sci 2003;587:618-25.
[21] Amory JK, Watts NB, Easley KA, et al. Exogenous testosterone or testosterone with finasteride increases bone mineral density in older men with low serum testosterone. J Clin Endocrinol Metab 2004;89:503-10.
[22] Kenny AM, Fabregas G, Song C, Biskup B, Bellantonio S. Effects of testosterone on behavior, depression, and cognitive function in older men with mild cognitive loss. J Gerontol A Biol Sci Med Sci 2004;591:75-8.
[23] Marks LS, Mazer NA, Mostaghel E, et al. Effect of testosterone replacement therapy on prostate tissue in men with late-onset hypogonadism. JAMA 2006;296:2351-61.
[24] Chiang HS, Hwang TIS, Hsui YS, et al. Transdermal testosterone gel increases serum testosterone levels in hypogonadal men in Taiwan with improvements in sexual function. Int J Impot Res 2007;19: 411-7.
[25] Emmelot-Vonk MH, Verhaar HJJ, Pour HRN, et al. Effect of testos¬terone supplementation on functional mobility, cognition, and other parameters in older men. JAMA 2008;299:39-52.
[26] Srinivas-Shankar U, Roberts SA, Connolly MJ, et al. Effects of tes¬tosterone on muscle strength, physical function, body composition, and quality of life in intermediate-frail and frail elderly men: a randomized, double-blind, placebo-controlled study. J Clin Endo¬crinol Metab 2010;95:639-50.
[27] Aversa A, Bruzziches R, Francomano D, et al. Effects of testosterone undecanoate on cardiovascular risk factors and atherosclerosis in middle-aged men with late-onset hypogonadism and metabolic syndrome: results from a 24-month, randomized, double-blind, placebo-controlled study. J Sex Med 2010;7:3495-503.
[28] Idan A, Griffiths KA, Harwood DT, et al. Long-term effects of dihydro-testosterone treatment on prostate growth in healthy, middle-aged men without prostate disease. Ann Intern Med 2010;153:621-32.
[29] Shigehara K, Sugimoto K, Konaka H, et al. Androgen replacement therapy contributes to improving lower urinary tract symptoms in patients with hypogonadism and benign prostate hypertrophy: a randomised controlled study. Aging Male 2011;14:53-8.
[30] Page ST, Lin DW, Mostaghel EA, et al. Dihydrotestosterone admin¬istration does not increase intraprostatic androgen concentrations or alter prostate androgen action in healthy men: a randomized- controlled trial. J Clin Endocrinol Metab 2011;96:430-7.
[31 ] Holmang S, Marin P, Lindstedt G, Hedelin H. Effect of long-term oral testosterone undecanoate treatment on prostate volume and se¬rum prostate-specific antigen concentration in eugonadal middle- aged men. Prostate 1993;23:99-106.
[32] Wang C, Berman N, Longstreth JA, et al. Pharmacokinetics of transdermal testosterone gel in hypogonadal men: application of gel at one site versus four sites: a General Clinical Research Center Study. J Clin Endocrinol Metab 2000;85:964-9.
[33] Swerdloff RS, Wang C, Cunningham G, et al. Long-term pharmaco¬kinetics of transdermal testosterone gel in hypogonadal men. J Clin Endocrinol Metab 2000;85:4500-10.
[34] Bhasin S, Travison TG, Storer TW, et al. Effect of testosterone supplementation with and without a dual 5a-reductase inhibitor on fat-free mass in men with suppressed testosterone production: a randomized controlled trial. JAMA 2012;307:931-9.
[35] Polackwich AS, Ostrowski KA, Hedges JC. Testosterone replacement therapy and prostate health. Curr Urol Rep 2012;13:441-6.
[36] Morgentaler A, Traish AM. Shifting the paradigm of testosterone and prostate cancer: the saturation model and the limits of androgen-dependent growth. Eur Urol 2009;55:310-21.
[37] Diver MJ, Imtiaz KE, Ahmad AM, Vora JP, Fraser WD. Diurnal rhythms of serum total, free and bioavailable testosterone and of SHBG in middle-aged men compared with those in young men. Clin Endocrinol 2003;58:710-7.
[38] Rosner W, Auchus RJ, Azziz R, Sluss PM, Raff H. Utility, limitations, and pitfalls in measuring testosterone: an Endocrine Society Posi¬tion Statement. J Clin Endocrinol Metab 2007;92:405-13.





