6018
01 Июля 2021
Авторское право © 2019,
Janneke Evelyne Stalenhoef, 1
Cees van Nieuwkoop,2
Darius Cameron Wilson,3
Willize Elizabeth van der Starre,1
Tanny J. K. van der Reijden,1
Nathalie Manon Delfos,4
Eliane Madeleine Sophie Leyten,5
Ted Koster,6
Hans Christiaan Ablij,7
Johannes (Jan) Willem van ‘t Wout,7 и
Jaap Tamino van Dissel1 (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0
Janneke Evelyne Stalenhoef, Cees v...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0
Janneke Evelyne Stalenhoef, Cees v...
Авторское право © 2019,
Janneke Evelyne Stalenhoef, 1
Cees van Nieuwkoop,2
Darius Cameron Wilson,3
Willize Elizabeth van der Starre,1
Tanny J. K. van der Reijden,1
Nathalie Manon Delfos,4
Eliane Madeleine Sophie Leyten,5
Ted Koster,6
Hans Christiaan Ablij,7
Johannes (Jan) Willem van ‘t Wout,7 и
Jaap Tamino van Dissel1 (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0
Janneke Evelyne Stalenhoef, Cees van Nieuwkoop, Darius Cameron Wilson, Willize Elizabeth van der Starre, Tanny J. K. van der Reijden, Nathalie Manon Delfos, Eliane Madeleine Sophie Leyten, Ted Koster, Hans Christiaan Ablij, Johannes (Jan) Willem van ‘t Wout, Jaap Tamino van Dissel
Аннотация
Введение
Сокращение продолжительности антибиотикотерапии имеет решающее значение для сведения к минимуму развития устойчивости к противомикробным препаратам, побочных эффектов и расходов на здравоохранение. Минимальная эффективная продолжительность антимикробной терапии при инфекциях мочевыводящих путей (ИМП) остается дискутабельной, особенно у пациентов мужского пола, пациентов пожилого возраста или с сопутствующими патологиями. Биомаркеры имеют потенциал для объективного определения оптимального момента прекращения терапии.
Методы
Вторичный анализ рандомизированного плацебо-контролируемого исследования среди пациентов, обратившихся в приемные отделения (ПО) 7 госпиталей и 32 медучреждений первичного звена в Нидерландах. Женщинам и мужчинам в возрасте ≥18 лет с диагнозом «ИМП с фебрильной составляющей» была назначена антибиотикотерапия продолжительностью 7 или 14 дней. Пациенты, которые получали противомикробное лечение более 14 дней, были исключены из рандомизации. Биомаркеры прокальцитонин (ПКТ), средне-региональный proadrenomedullin (MR-proADM), и C-реактивный белок (CPБ) сравнивали в их способности предсказать клиническое лечение или неудачу через 10-18 день после лечения.
Результаты
Обработаны данные в общей сложности 249 пациентов с предполагаемым диагнозом «ИМП с фебрильной составляющей» Частота выздоровления была высока (N=229; 92%) и статистически значимо не различалась между группами рандомизированных и нерандомизированных пациентов (94% и 88% соответственно). Концентрации ПКТ, MR-proADM и СРБ, определяемые на момент поступления, значимо не различаются у выздоровевших пациентов и пациентов с неудовлетворительным результатом лечения независимо от его продолжительности. Концентрации ПКТ коррелировали с бактериемией (τ = 0,33, р < 0,001), наличием озноба (τ = ,25, р < 0,001) и уровнями MR-proADM с продолжительностью пребывания в больнице (τ =0,40, p < 0.001), бактериемия (τ = 0,33, р < 0,001), начальное внутривенное лечение (τ = 0,22, p < 0,001) и время отсрочки (τ =0,21 евро, p < 0,001). Концентрация СРБ имела слабую положительную корреляцию с клиническими проявлениями ИМП.
Заключение
Хотя уровни ПКТ и MR-proADM коррелирует с клиническими характеристиками тяжести заболевания, они не в состоянии спрогнозировать исход лечения пациентов с внебольничной инфекцией мочевыводящих путей, получающих курс антибиотиков на протяжении 7 или 14 дней. СРБ не обладает дополнительными преимуществами ведения больных с ИМП с фебрильной составляющей.
Ключевые слова: инфекции мочевыводящей системы, пиелонефрит, биомаркеры, антибиотикотерапия, продолжительность лечения, контроль антибиотикотерапии.
Введение
Инфекции мочевыводящих путей (ИМП), включая острый пиелонефрит и простатит, – достаточно часто встречающиеся патологии у взрослых пациентов, однако информации об оптимальной продолжительности лечения, особенно мужчин и пациентов пожилого возраста с сопутствующей патологией, по-прежнему недостаточно. Опасность развития бактериальной резистентности заставляет разрабатывать эффективные меры сокращения необходимой длительности лечения антибиотиками.
Проведенное нами ранее исследование FUTIRIST показало, что для безопасного и эффективного лечения внебольничной инфекции мочевыводящих путей с фебрильной составляющей у женщин и пациентов пожилого возраста с тяжелыми сопутствующими заболеваниями достаточен пероральный прием ципрофлоксацина на протяжении 7 дней, вне зависимости от тяжести заболевания на момент начала терапии [1]. Однако у мужчин короткий курс лечения может чаще приводить к неэффективному клиническому исходу по сравнению с 14-дневный курсом перорального приема ципрофлоксацина.
По результатам предыдущих исследований при антибактериальном лечении пациентов с инфекцией дыхательных путей и сепсисом целесообразно ориентироваться на уровень прокальцитонина (ПКТ) [2–4]. Однако о роли ПКТ при инфекциях мочевыводящих путей известно очень мало. Согласно проведенному ранее рандомизированному исследованию в подгруппах с участием пациентов отделения реанимации и интенсивной терапии (ОРИТ), продолжительность антибактериального лечения у 24 больных с ИМП с ориентацией на прокальцитонин был значимо меньше, чем у 18 больных с ИМП из контрольной группы [4]. Дальнейшие исследования в этой области крайне немногочисленны. Могут вызывать интерес и другие биомаркеры, например среднерегиональный проадреномедуллин (MR-proADM), уровень которого согласно имеющимся данным возрастает на ранних стадиях развития полиорганной недостаточности [5], влияет на определение сложной схемы лечения и обладает прогностическим значением для развития риска необходимости перевода в ОРИТ.
Вторичный анализ предшествующего исследования FUTIRIST [1] предполагает, что определение уровня прокальцитонина на день 0 и день 3 способно более точно определить риск неэффективного исхода лечения и необходимость пролонгированного курса антибактериальной терапии, чем уровня MR-proADM или С-реактивного белка.
Методы
Дизайн исследования и выборка
Как было описано выше, произведен вторичный анализ рандомизированного, плацебо-контролируемого исследования, в котором принимали участие пациенты с инфекцией мочевыводящих путей с фебрильной составляющей в приемных отделениях (ПО) 7 госпиталей и 32 медучреждений первичного звена в Нидерландах в период с ноября 2008 года по май 2013 года [1, 9]. В исследование включены взрослые пациенты с вероятной внебольничной ИМП, диагностированной врачом первичного звена или врачом приемного покоя, которые отвечали следующим критериям: лихорадка ≥38,2°С и/или чувство жара с ознобом или дрожью в предшествующие 24 часа, один или более симптомов ИМП (т.e. дизурия, учащенные, императивные позывы к мочеиспусканию, боль над лобком или в промежности, болезненность в области костовертебрального угла или в боку), а также положительный тест на содержание нитратов в моче и/или пиурия (положительный тест на лейкоцитарную эстеразу или >5 лейкоцитов в поле зрения после центрифугирования). Критерии исключения были следующими: известная аллергия на фторхинолоны, беременность или кормление грудью, поликистоз почек, прохождение заместительной почечной терапии или наличие почечного трансплантата. Пациенты с ИМП, включенные в исследование, но не рандомизированные для назначения исследуемой лекарственной схемы терапии, участвовали в этапе наблюдения исследования для оценки результатов [1]. В настоящем исследовании все пациенты участвуют как в этапе наблюдения, так и лечения, кроме тех, у кого отсутствовал исходный образец крови для определения биомаркеров, кто не совершал контрольный визит к врачу на 10–18-й день после окончания лечения, и те, кому понадобился пролонгированный курс приема антибиотиков по поводу бактериального простатита.
Протокол исследования одобрен этическим комитетом, все участники подписали добровольное информированное согласие. Исследование зарегистрировано на ClinicalTrials.gov (NCT00809913; 16 декабря 2008 года) и trialregister.nl (NTR1583; 19 декабря 2008 года).
Материалы и методы
В течение 24–48 часов с момента регистрации медицинский персонал клинического исследования вносил клинические данные и результаты лабораторных тестов в стандартизированные бланки. Решение о том, должно ли лечение проходить амбулаторно или стационарно принимал лечащий врач. На первой неделе амбулаторные больные принимали немаскированный ципрофлоксацин в дозировке 500 мг два раза в сутки. В стационаре в начале лечения врач мог эмпирически назначать внутривенное введение антибиотика в соответствии с местными рекомендациями (во всех задействованных клиниках это ß-лактамный антибиотик ± аминогликозид) - эти пациенты переходили на прием немаскированного ципрофлоксацина при первой возможности. Сразу после получения результатов посева мочи на третий или четвертый день после включения в исследование пациенты в случайном порядке распределялись на группы приема ципрофлоксацина и плацебо два раза в сутки в течение второй недели. Для пациентов, которые не могли быть рандомизированы (например, из-за резистентности к ципрофлоксацину), выбор антибиотика и продолжительность терапии определялись лечащим врачом [1].
Для оценки результатов с пациентами проводили личную встречу на 3–4-й день после начала лечения) и 30-й день (через 10–18 дней от завершения лечения), а также опрос по телефону на 90-й день (через 70–84 дня от завершения лечения). Отбирали образцы плазмы с добавлением EDTA, центрифугировали и хранили при температуре -80°C в течение 2 часов после регистрации пациента. MR-proADM и ПКТ определяли слепым образом по технологии TRACE (Time Resolved Amplified Cryptate Emission: усиленное излучение криптата с временным разрешением) новым методом многослойного сэндвич-анализа (Kryptor Compact Plus Analyzer, BRAHMS, Геннигсдорф, Германия) с нижним пределом чувствительности 0,05 нмоль/л и 0,02 нг/л соответственно. Более подробная информация о рандомизации, исследуемой схеме лечения и проведении исследования опубликована ранее [1, 9].
Оценка результатов
Производилось изучение способности биомаркеров ПКТ и MR-proADM прогнозировать успешный исход терапии, оценка которой происходила во время контрольного визита на 30-й день (10–18-й день после завершения лечения). Критериями выздоровления считалось отсутствие лихорадки и исчезновение симптомов ИМП (либо исчезновение, либо снижение выраженности минимум на 2 пункта по шкале 0–5), без необходимости дополнительного приема антибиотиков (для предотвращения рецидива) [1]. Если пациент на 30-й день не отвечал критериям выздоровления, результат лечения признавался неудовлетворительным. Долгосрочные результаты оценивались на 90-й день.
Статистический анализ
Количественный показатель распределения представлен в виде частот (процентного соотношения), среднего показателя со стандартным отклонением (СО) или в виде медианы с межквартильным интервалом (МКИ), где это уместно. Однофакторный анализ проведен с помощью ANOVA, t-теста Стьюдента или U-теста Манн–Уитни для соответствующих случаев непрерывных переменных, а также Хи-квадрат теста для качественных переменных. Для анализа биомаркеров использовались непараметрические тесты.
Проводился анализ как во всей популяции пациентов, так и в двух подгруппах, выделенных в зависимости от продолжительности лечения. Для оценки корреляции между уровнем биомаркера и клиническими проявлениями использовался коэффициент ранговой корреляции Кендалла. Наконец, площадь под ROC-кривой (AUROC) с 95% доверительным интервалом (ДИ) вычислялась для оценки прогностической способности ПКТ и MR-proADM.
Результаты считались статистически значимыми при p-значении < 0,05. Статический анализ выполнен на программном обеспечении SPSS (SPSS Inc. Чикаго, версия 23.0).
Результаты
Обработаны данные в общей сложности 249 пациентов с предполагаемым диагнозом ИМП (более подробная информация приведена на рисунке 1). Информация об урологическом анамнезе, сопутствующей патологии и симптоматике при поступлении представлена в таблице 1. 165 (66%) пациентов рандомизировали в группы для приема антибиотика в течение 7 (N=85) или 14 (N=80) дней; у оставшихся пациентов длительность лечения определял лечащий врач. Большинство больных (N=175; 70%) поступали через ПО, 73 (29%) принимали антибиотики до момента поступления. Средний возраст участников составил 60 (45–73) лет, преобладали женщины (N=148; 59%).
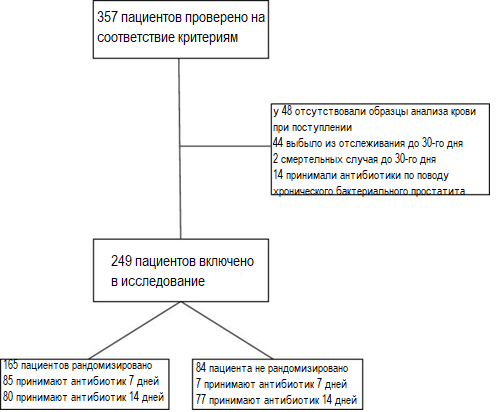 Рисунок 1. Структура выборки
Рисунок 1. Структура выборки
Таблица 1. Исходные характеристики 249 пациентов с инфекцией мочевых путей с фебрильной сотсавляющей
Частота выздоровления была высока (N=229; 92%) и статистически значимо не различалась между группами рандомизированных и нерандомизированных пациентов (94% и 88% соответственно). В общей сложности критериев выздоровления на 30-й день не достигли 20 пациентов, часть из-за сохраняющихся или рецидивирующих симптомов ИМП (N=8), часть из-за дополнительного приема антибиотика по причине рецидива ИМП (N=12). Значимого различия клинических данных пациентов с удовлетворительными и неудовлетворительными исходами лечения не установлено. Кроме того, средняя продолжительность лечения была примерно одинакова (11 дней) в обоих случаях (таблица 2).
Таблица 2. Характеристики пациентов с удовлетворительным и неудовлетворительным результатом лечения
Медиана концентрации биомаркеров в общей выборке пациентов: ПКТ: 40 [0,12–1,54] мкг/мл; MR-proADM: 0,89 [0,63–1,28] нмоль/л; и СРБ: 118 (52-205) мг/л.
Прогноз результата лечения
Общая выборка пациентов
Концентрации ПКТ, MR-proADM и СРБ, определяемые на момент поступления, значимо не различаются у выздоровевших пациентов и пациентов с неудовлетворительным результатом лечения (рисунок 2 и таблица 3). Как указано в таблице 3, уровень биомаркеров, определяемый через 3 дня после лечения также не имеет прогностической значимости. Помимо этого, мы учитывали пороговое значение ПКТ, используемое в других исследованиях, как 0,25 мкг/мл [10, 11] и снижение концентрации ПКТ на 80% [4].
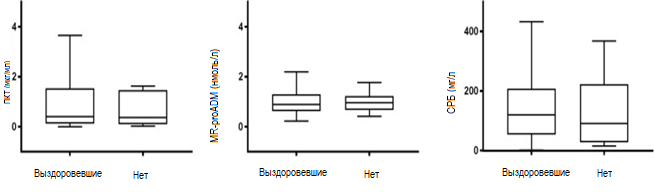 Рисунок 2. Уровень ПКТ, MR-proADM и СРБ на момент поступления у пациентов с удовлетворительным и неудовлетворительным результатом лечения
Рисунок 2. Уровень ПКТ, MR-proADM и СРБ на момент поступления у пациентов с удовлетворительным и неудовлетворительным результатом лечения
Таблица 3. Биомаркеры пациентов с клиническим выздоровлением и неудовлетворительным исходом лечения
Для определения способности биомаркеров прогнозировать результат лечения применялся ROC-анализ. На основе вычисленной площади под кривой «концентрация/время» (AUC) установлено, что ни один из биомаркеров не обладает значимостью в прогнозе удовлетворительного исхода лечения (рисунок 3). Подобный результат получен также у пациентов с подтвержденной посевом ИМП (N=183) и в отношении пациентов с длительным курсом лечения (данные не приведены).
Пациенты с курсом лечения 7 дней
Мы отдельно рассмотрели пациентов, принимающих курс антибиотиков в течение 7 дней, поскольку частота выздоровления у них была ниже, чем у пациентов, принимающих антибиотик в течение 14 дней (89% и 94% соответственно, р=0,21). При этом разницы в уровне ПКТ, MR-proADM и СРБ у больных с удовлетворительным и неудовлетворительным результатом лечения не установлено (Таблица 3)
Корреляция между биомаркерами и клиническими характеристиками
Прокальцитонин
Концентрация ПКТ на момент поступления положительно коррелировала с бактериемией (τ = 0,33, p < 0,001) и наличием озноба (τ = 0,33, p < 0,001). Однако корреляция с необходимостью внутривенного введения препаратов на начальном этапе, длительностью госпитализации, временем исчезновения лихорадки, нахождением в ОРИТ, величиной температуры, частотой сердечных сокращений и спутанностью сознания на момент поступления была слабой, но значимой (τ < 0,20). Помимо этого, концентрация ПКТ увеличивается с возрастом (τ = 0,12, p < 0,01) и не коррелирует с коморбидностью. Медиана концентрации ПКТ, определяемой на 3-й день, продемонстрировала те же результаты, корреляции снижения концентрации ПКТ с клиническими характеристиками не установлено.
Среднерегиональный проадреномедуллин
Уровень MR-proADM на момент поступления положительно коррелировал с длительностью госпитализации (τ = 0,40, p < 0,001), бактериемией (τ = 0,33, p < 0,001), необходимостью внутривенного введения препаратов (τ = 0,22, p < 0,001) и временем исчезновения лихорадки (τ = 0,21, p < 0,001). Установлена слабая, но значимая корреляция с величиной температуры, необходимостью пребывания в ОРИТ, спутанностью сознания на момент поступления и наличием озноба (τ < 0,20). По сравнению с ПКТ MR-proADM более строго коррелирует с возрастом (τ = 0,49, p < 0,001) и слабо коррелирует с наличием сопутствующей патологии (сахарный диабет, патология мочевыводящих путей и хроническая почечная недостаточность). На 3-й день корреляция была аналогичной. Снижение концентрации MR-proADM со дня поступления до 3-го дня коррелирует с наличием бактериемии (τ = 0,22, p < 0,001) и озноба в день поступления (τ = 0,22, p < 0,001).
С-реактивный белок
Концентрация СРБ имеет слабую положительную корреляцию со временем ослабления лихорадки (τ = 0,13, p = 0,02) и слабую негативную корреляцию с величиной температуры (τ = − 0,11, p = 0,04), а также средним артериальным давлением (τ = − 0,13, p = 0,02). Корреляции между уровнем СРБ и другими параметрами, например возрастом или коморбидностью, не установлено.
Обсуждение
В данном исследовании мы дали оценку способности таких биомаркеров, как ПКТ, MR-proADM и CРБ прогнозировать результат неудовлетворительного лечения при рандомизированном разделении пациентов с ИМП с фебрильной составляющей на группы с курсом приема антибиотиков разной продолжительности (т. е. 7 и 14 дней). Мы предполагали, что изменение в концентрации биомаркеров как объективного лабораторного параметра, отражающего течение ИМП с фебрильной составляющей, могло бы помочь врачам определять длительность антибактериальной терапии. Однако в нашем исследовании ни ПКТ, ни MR-proADM, ни СРБ не оказались способны заранее выделить пациентов с высоким риском неудовлетворительного исхода лечения, т. е. тех, кому мог бы быть рекомендован продолжительный курс антибиотика.
Общий показатель эффективности терапии был высок: 94% среди рандомизированных 165 пациентов и 88% среди нерандомизированных 84 пациентов, которые после курса лечения совершенно одинаково оценивались на соответствие критериям выздоровления. Что касается биомаркеров, ПКТ и MR-proADM продемонстрировали значимую корреляцию с такими клиническими характеристиками как лихорадка, артериальное давление и субъективные жалобы, отражающие течение инфекционного заболевания мочевыводящих путей с фебрильной составляющей. Кроме того, динамика концентрации ПКТ и MR-proADM коррелировала с тяжестью заболевания, а именно с наличием бактериемии и необходимостью начала терапии с внутривенного, а не перорального приема антибиотиков. Наконец, изменение уровня ПКТ и MR-proADM в течение первых трех дней коррелировало с признаками улучшения состояния: временем нормализации температуры тела, уменьшением жалоб и длительностью пребывания в стационаре. В отличие от ПКТ и MR-proADM, часто используемый в настоящее время биомаркер СРБ не продемонстрировал корреляции с основными клиническими характеристиками - лихорадкой или бактериемией.
Отобранные нами для исследования биомаркеры рассматриваются сегодня как факторы-предикторы при различных состояниях. Прокальцитонин – гормон-предшественник кальцитонина, его концентрация повышается под воздействием цитокинов в ответ на бактериальную инфекцию [4]. MR-proADM обнаружен во многих тканях, в том числе сердца, сосудов и почек, и обладает как иммуномодулирующим, так и вазодилатирующим действием [2]. Уровень MR-proADM повышается при сепсисе, способствуя гипотензии у таких пациентов. Таким образом, среднерегиональный проадреномедуллин (MR-proADM) является прогностическим фактором осложненного течения заболевания, необходимости пребывания в ОРИТ и риска летального исхода [6, 7].
Алгоритмы лечения на основе определения ПКТ нацелены на решение вопроса о начале и (или) прекращении антибактериальной терапии у пациентов с острым инфекционным процессом дыхательных путей и, прежде всего, у пациентов, находящихся в условиях блока интенсивной терапии [15]. У этой особой группы пациентов определение уровня ПКТ является отличным инструментом контроля назначения антибиотиков [16]. Несмотря на то что в исследованиях по оказанию интенсивной терапии включены пациенты с инфекциями мочевыводящих путей, количество таких пациентов было невелико (например, 7% в исследовании PRORATA, 3% в исследовании SAPS), и эти результаты не могут быть в общем достоверными для больных с внебольничной инфекцией мочевыводящих путей [4, 17].
Повышение концентрации упомянутых биомаркеров – отражение системного воспалительного ответа на бактериальную инвазию. Воспалительный ответ совпадает с острой фазой заболевания, часто сопровождается нарушением жизненных функций, лихорадкой и понижением артериального давления. В клинической практике тяжесть острого заболевания оценивается по данным анамнеза с учетом сопутствующей патологии, выраженности местных и общих симптомов. Очевидно, что более объективно оценить состояние позволяет определение уровня биомаркеров, которые отражают сложность картины заболевания, коррелируют с бактериемией, необходимостью пребывания в ОРИТ, временем исчезновения лихорадки и длительностью госпитализации. Хотя корреляция концентрации ПКТ и MR-proADM с упомянутыми клиническими характеристиками в нашем исследовании подтверждена, они оказались неспособны спрогнозировать успех стандартизированной антибактериальной терапии, независимо от длительности приема препарата – 7 или 14 дней. Предположительной причиной этого можно считать тот факт, что все пациенты лечились минимум 7 дней, после чего частота выздоровления была уже высока (89%). Таким образом, недостаточная прогностическая значимость для схемы терапии вероятнее всего объясняется тем, что исторически эмпирическое лечение основывалось на ожидаемом времени наступления клинического эффекта с учетом индивидуальных различий в тяжести болезни на момент поступления (т. е. в действительности к среднему времени до выздоровления добавлялись несколько дней). В итоге, у исследованных нами пациентов среднее время до исчезновения лихорадки составило 2,0 (МКИ 1-3) дня, при этом рандомизация на группы длительного и короткого курса приема лекарств не проводилось до 7-го дня. Другими словами, можно было бы предположить, что наш метод работы с биомаркерами мог определять схему лечения до одного или нескольких дней после клинического выздоровления, но это оказалось невозможно спустя как минимум 7 дней после начала лечения, при котором превышено время возвращения уровня биомаркера к нормальному значению. Уровень биомаркеров у пациентов с различной тяжестью заболевания при поступлении обычно нормализовался через 7 дней лечения, и почти всегда через 14 дней. Отметим, что резистентность к антибиотикам в проведенном исследовании не учитывалась; пациенты с резистентными к ципрофлоксацину микроорганизмами, вызвавшими ИМП, исключены из рандомизации и получали антибиотик, подобранный на основе результата посевов.
В первоначальном исследовании мы обозначили, что несмотря на менее продолжительный курс лечения в 7 дней у мужчин, различия в частоте между мужчинами и женщинами в необходимости повторного приема антибиотиков по поводу ИМП на протяжении периода наблюдения в 90 дней не выявлено [1].
Ретроспективный анализ с участием мужчин пожилого возраста также показал, что курс лечения длительностью более 7 дней не коррелирует со снижением рецидива ИМП [18]. Согласно нашей работе, рецидивирующее течение ИМП не зависит от возраста и коморбидности больных. Вероятно также, что подгруппе пациентов целесообразно назначить курс короче, чем 7 дней. Теоретически на протяжении осуществляемого лечения есть момент, когда пациент излечивается от острого заболевания и уровень биомаркеров падает ниже определенного значения, оставляя место для еще одного ограничения к продолжительности терапии. Это подтверждает концепцию, что время выздоровления зависит от особенностей организма хозяина, и, следовательно, может отличаться у разных категорий больных. Биомаркеры потенциально могут выступать в качестве объективного метода выявления момента прекращения лечения, независимо от характеристик пациента. К сожалению, как уже упоминалось выше, дизайн нашего исследования не позволяет разобраться в этом вопросе более подробно.
Сильной стороной нашего исследования можно назвать практичность и применимость в ежедневной клинической работе. Мы рандомизировали пациентов в группу с 14-дневным курсом приема антибиотика и группу с курсом приема препаратов, составляющим половину от предыдущего срока, а также набрали к участию достаточное количество субъектов. Мы отбирали последовательный ряд поступивших пациентов с ИМП, независимо от возраста, пола и сопутствующей патологии. Концентрация биомаркеров определялась в день поступления и через 3 дня после начала терапии, отражая различные особенности развития острого инфекционного процесса.
К недостаткам исследования можно отнести дизайн, который подразумевал рандомизацию в срок с 7-го по 14-й день, не позволяя таким образом оценить значимость биомаркеров при более коротком приеме антибиотиков. Это было допущено непреднамеренно, так как период лечения антибиотиками длительностью 14 дней является стандартной практикой при проведении исследований, а его уменьшение до 7 дней уже можно считать большим достижением. Кроме того, наш объем выборки слишком мал для исключения ошибки II типа.
Насколько нам известно, опубликовано только одно исследование подбора схемы лечения на основе определения концентрации биомаркеров [10]. В нем Drozdov et al. рандомизированно разделили пациентов с циститом (N=36) и инфекцией мочевыводящих путей с фебрильной оставляющей (N=84) на группу лечения на основе определения ПКТ и группу стандартной методики ведения. В целом, количество применяемого антибиотика сократилось, при этом частота нежелательных явлений (рецидивы и повторные госпитализации) значимо не отличалась в двух группах. При подгрупповом анализе пациентов с ИМП/пиелонефритом, при ПКТ-ориентированном лечении продолжительность курса антибиотиков была значимо ниже, чем при стандартном подходе (7,5 и 11,0 дней). У больных с бактериемией частота рецидивов (56% и 16%), а также персистирования инфекции после лечения (13% и 6%) была выше в группе с ПКТ-ориентированным лечением, хотя распределение пациентов с бактериемией было неодинаково в обеих группах (45% и 21%), а размер выборки недостаточно высок, чтобы результат признавался значимым. Несмотря на малую выборку и гетерогенность пациентов, исследование Drozdov et al. вносит свой вклад в возможность использования методики определения ПТК для безопасного уменьшения продолжительности приема антибиотиков у пациентов с внебольничной ИМП.
В будущем целесообразно провести интервенционные исследования, чтобы определить, возможно ли благодаря определению концентрации ПКТ выделить особые категории пациентов с ИМП, для лечения которых достаточен прием антибиотиков на протяжении менее 7 дней (т. е. у которых показатели биомаркеров быстро приходят в норму), с целью уменьшить воздействие антибиотиков и ограничить риск возникновения антибиотикорезистентности.
В заключении отметим, что хотя уровень биомаркеров ПКТ и MR-proADM коррелирует с клиническими характеристиками тяжести заболевания, он не в состоянии спрогнозировать исход лечения пациентов с внебольничной инфекцией мочевыводящих путей, получающих курс ципрфлоксацина на протяжении 7 или 14 дней. При вторичном анализе установлено, что СРБ не обладает дополнительными преимуществами ведения больных с ИМП.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0
Janneke Evelyne Stalenhoef, Cees van Nieuwkoop, Darius Cameron Wilson, Willize Elizabeth van der Starre, Tanny J. K. van der Reijden, Nathalie Manon Delfos, Eliane Madeleine Sophie Leyten, Ted Koster, Hans Christiaan Ablij, Johannes (Jan) Willem van ‘t Wout, Jaap Tamino van Dissel
Аннотация
Введение
Сокращение продолжительности антибиотикотерапии имеет решающее значение для сведения к минимуму развития устойчивости к противомикробным препаратам, побочных эффектов и расходов на здравоохранение. Минимальная эффективная продолжительность антимикробной терапии при инфекциях мочевыводящих путей (ИМП) остается дискутабельной, особенно у пациентов мужского пола, пациентов пожилого возраста или с сопутствующими патологиями. Биомаркеры имеют потенциал для объективного определения оптимального момента прекращения терапии.
Методы
Вторичный анализ рандомизированного плацебо-контролируемого исследования среди пациентов, обратившихся в приемные отделения (ПО) 7 госпиталей и 32 медучреждений первичного звена в Нидерландах. Женщинам и мужчинам в возрасте ≥18 лет с диагнозом «ИМП с фебрильной составляющей» была назначена антибиотикотерапия продолжительностью 7 или 14 дней. Пациенты, которые получали противомикробное лечение более 14 дней, были исключены из рандомизации. Биомаркеры прокальцитонин (ПКТ), средне-региональный proadrenomedullin (MR-proADM), и C-реактивный белок (CPБ) сравнивали в их способности предсказать клиническое лечение или неудачу через 10-18 день после лечения.
Результаты
Обработаны данные в общей сложности 249 пациентов с предполагаемым диагнозом «ИМП с фебрильной составляющей» Частота выздоровления была высока (N=229; 92%) и статистически значимо не различалась между группами рандомизированных и нерандомизированных пациентов (94% и 88% соответственно). Концентрации ПКТ, MR-proADM и СРБ, определяемые на момент поступления, значимо не различаются у выздоровевших пациентов и пациентов с неудовлетворительным результатом лечения независимо от его продолжительности. Концентрации ПКТ коррелировали с бактериемией (τ = 0,33, р < 0,001), наличием озноба (τ = ,25, р < 0,001) и уровнями MR-proADM с продолжительностью пребывания в больнице (τ =0,40, p < 0.001), бактериемия (τ = 0,33, р < 0,001), начальное внутривенное лечение (τ = 0,22, p < 0,001) и время отсрочки (τ =0,21 евро, p < 0,001). Концентрация СРБ имела слабую положительную корреляцию с клиническими проявлениями ИМП.
Заключение
Хотя уровни ПКТ и MR-proADM коррелирует с клиническими характеристиками тяжести заболевания, они не в состоянии спрогнозировать исход лечения пациентов с внебольничной инфекцией мочевыводящих путей, получающих курс антибиотиков на протяжении 7 или 14 дней. СРБ не обладает дополнительными преимуществами ведения больных с ИМП с фебрильной составляющей.
Ключевые слова: инфекции мочевыводящей системы, пиелонефрит, биомаркеры, антибиотикотерапия, продолжительность лечения, контроль антибиотикотерапии.
Введение
Инфекции мочевыводящих путей (ИМП), включая острый пиелонефрит и простатит, – достаточно часто встречающиеся патологии у взрослых пациентов, однако информации об оптимальной продолжительности лечения, особенно мужчин и пациентов пожилого возраста с сопутствующей патологией, по-прежнему недостаточно. Опасность развития бактериальной резистентности заставляет разрабатывать эффективные меры сокращения необходимой длительности лечения антибиотиками.
Проведенное нами ранее исследование FUTIRIST показало, что для безопасного и эффективного лечения внебольничной инфекции мочевыводящих путей с фебрильной составляющей у женщин и пациентов пожилого возраста с тяжелыми сопутствующими заболеваниями достаточен пероральный прием ципрофлоксацина на протяжении 7 дней, вне зависимости от тяжести заболевания на момент начала терапии [1]. Однако у мужчин короткий курс лечения может чаще приводить к неэффективному клиническому исходу по сравнению с 14-дневный курсом перорального приема ципрофлоксацина.
По результатам предыдущих исследований при антибактериальном лечении пациентов с инфекцией дыхательных путей и сепсисом целесообразно ориентироваться на уровень прокальцитонина (ПКТ) [2–4]. Однако о роли ПКТ при инфекциях мочевыводящих путей известно очень мало. Согласно проведенному ранее рандомизированному исследованию в подгруппах с участием пациентов отделения реанимации и интенсивной терапии (ОРИТ), продолжительность антибактериального лечения у 24 больных с ИМП с ориентацией на прокальцитонин был значимо меньше, чем у 18 больных с ИМП из контрольной группы [4]. Дальнейшие исследования в этой области крайне немногочисленны. Могут вызывать интерес и другие биомаркеры, например среднерегиональный проадреномедуллин (MR-proADM), уровень которого согласно имеющимся данным возрастает на ранних стадиях развития полиорганной недостаточности [5], влияет на определение сложной схемы лечения и обладает прогностическим значением для развития риска необходимости перевода в ОРИТ.
Вторичный анализ предшествующего исследования FUTIRIST [1] предполагает, что определение уровня прокальцитонина на день 0 и день 3 способно более точно определить риск неэффективного исхода лечения и необходимость пролонгированного курса антибактериальной терапии, чем уровня MR-proADM или С-реактивного белка.
Методы
Дизайн исследования и выборка
Как было описано выше, произведен вторичный анализ рандомизированного, плацебо-контролируемого исследования, в котором принимали участие пациенты с инфекцией мочевыводящих путей с фебрильной составляющей в приемных отделениях (ПО) 7 госпиталей и 32 медучреждений первичного звена в Нидерландах в период с ноября 2008 года по май 2013 года [1, 9]. В исследование включены взрослые пациенты с вероятной внебольничной ИМП, диагностированной врачом первичного звена или врачом приемного покоя, которые отвечали следующим критериям: лихорадка ≥38,2°С и/или чувство жара с ознобом или дрожью в предшествующие 24 часа, один или более симптомов ИМП (т.e. дизурия, учащенные, императивные позывы к мочеиспусканию, боль над лобком или в промежности, болезненность в области костовертебрального угла или в боку), а также положительный тест на содержание нитратов в моче и/или пиурия (положительный тест на лейкоцитарную эстеразу или >5 лейкоцитов в поле зрения после центрифугирования). Критерии исключения были следующими: известная аллергия на фторхинолоны, беременность или кормление грудью, поликистоз почек, прохождение заместительной почечной терапии или наличие почечного трансплантата. Пациенты с ИМП, включенные в исследование, но не рандомизированные для назначения исследуемой лекарственной схемы терапии, участвовали в этапе наблюдения исследования для оценки результатов [1]. В настоящем исследовании все пациенты участвуют как в этапе наблюдения, так и лечения, кроме тех, у кого отсутствовал исходный образец крови для определения биомаркеров, кто не совершал контрольный визит к врачу на 10–18-й день после окончания лечения, и те, кому понадобился пролонгированный курс приема антибиотиков по поводу бактериального простатита.
Протокол исследования одобрен этическим комитетом, все участники подписали добровольное информированное согласие. Исследование зарегистрировано на ClinicalTrials.gov (NCT00809913; 16 декабря 2008 года) и trialregister.nl (NTR1583; 19 декабря 2008 года).
Материалы и методы
В течение 24–48 часов с момента регистрации медицинский персонал клинического исследования вносил клинические данные и результаты лабораторных тестов в стандартизированные бланки. Решение о том, должно ли лечение проходить амбулаторно или стационарно принимал лечащий врач. На первой неделе амбулаторные больные принимали немаскированный ципрофлоксацин в дозировке 500 мг два раза в сутки. В стационаре в начале лечения врач мог эмпирически назначать внутривенное введение антибиотика в соответствии с местными рекомендациями (во всех задействованных клиниках это ß-лактамный антибиотик ± аминогликозид) - эти пациенты переходили на прием немаскированного ципрофлоксацина при первой возможности. Сразу после получения результатов посева мочи на третий или четвертый день после включения в исследование пациенты в случайном порядке распределялись на группы приема ципрофлоксацина и плацебо два раза в сутки в течение второй недели. Для пациентов, которые не могли быть рандомизированы (например, из-за резистентности к ципрофлоксацину), выбор антибиотика и продолжительность терапии определялись лечащим врачом [1].
Для оценки результатов с пациентами проводили личную встречу на 3–4-й день после начала лечения) и 30-й день (через 10–18 дней от завершения лечения), а также опрос по телефону на 90-й день (через 70–84 дня от завершения лечения). Отбирали образцы плазмы с добавлением EDTA, центрифугировали и хранили при температуре -80°C в течение 2 часов после регистрации пациента. MR-proADM и ПКТ определяли слепым образом по технологии TRACE (Time Resolved Amplified Cryptate Emission: усиленное излучение криптата с временным разрешением) новым методом многослойного сэндвич-анализа (Kryptor Compact Plus Analyzer, BRAHMS, Геннигсдорф, Германия) с нижним пределом чувствительности 0,05 нмоль/л и 0,02 нг/л соответственно. Более подробная информация о рандомизации, исследуемой схеме лечения и проведении исследования опубликована ранее [1, 9].
Оценка результатов
Производилось изучение способности биомаркеров ПКТ и MR-proADM прогнозировать успешный исход терапии, оценка которой происходила во время контрольного визита на 30-й день (10–18-й день после завершения лечения). Критериями выздоровления считалось отсутствие лихорадки и исчезновение симптомов ИМП (либо исчезновение, либо снижение выраженности минимум на 2 пункта по шкале 0–5), без необходимости дополнительного приема антибиотиков (для предотвращения рецидива) [1]. Если пациент на 30-й день не отвечал критериям выздоровления, результат лечения признавался неудовлетворительным. Долгосрочные результаты оценивались на 90-й день.
Статистический анализ
Количественный показатель распределения представлен в виде частот (процентного соотношения), среднего показателя со стандартным отклонением (СО) или в виде медианы с межквартильным интервалом (МКИ), где это уместно. Однофакторный анализ проведен с помощью ANOVA, t-теста Стьюдента или U-теста Манн–Уитни для соответствующих случаев непрерывных переменных, а также Хи-квадрат теста для качественных переменных. Для анализа биомаркеров использовались непараметрические тесты.
Проводился анализ как во всей популяции пациентов, так и в двух подгруппах, выделенных в зависимости от продолжительности лечения. Для оценки корреляции между уровнем биомаркера и клиническими проявлениями использовался коэффициент ранговой корреляции Кендалла. Наконец, площадь под ROC-кривой (AUROC) с 95% доверительным интервалом (ДИ) вычислялась для оценки прогностической способности ПКТ и MR-proADM.
Результаты считались статистически значимыми при p-значении < 0,05. Статический анализ выполнен на программном обеспечении SPSS (SPSS Inc. Чикаго, версия 23.0).
Результаты
Обработаны данные в общей сложности 249 пациентов с предполагаемым диагнозом ИМП (более подробная информация приведена на рисунке 1). Информация об урологическом анамнезе, сопутствующей патологии и симптоматике при поступлении представлена в таблице 1. 165 (66%) пациентов рандомизировали в группы для приема антибиотика в течение 7 (N=85) или 14 (N=80) дней; у оставшихся пациентов длительность лечения определял лечащий врач. Большинство больных (N=175; 70%) поступали через ПО, 73 (29%) принимали антибиотики до момента поступления. Средний возраст участников составил 60 (45–73) лет, преобладали женщины (N=148; 59%).
 Рисунок 1. Структура выборки
Рисунок 1. Структура выборкиТаблица 1. Исходные характеристики 249 пациентов с инфекцией мочевых путей с фебрильной сотсавляющей
Частота выздоровления была высока (N=229; 92%) и статистически значимо не различалась между группами рандомизированных и нерандомизированных пациентов (94% и 88% соответственно). В общей сложности критериев выздоровления на 30-й день не достигли 20 пациентов, часть из-за сохраняющихся или рецидивирующих симптомов ИМП (N=8), часть из-за дополнительного приема антибиотика по причине рецидива ИМП (N=12). Значимого различия клинических данных пациентов с удовлетворительными и неудовлетворительными исходами лечения не установлено. Кроме того, средняя продолжительность лечения была примерно одинакова (11 дней) в обоих случаях (таблица 2).
Таблица 2. Характеристики пациентов с удовлетворительным и неудовлетворительным результатом лечения
Медиана концентрации биомаркеров в общей выборке пациентов: ПКТ: 40 [0,12–1,54] мкг/мл; MR-proADM: 0,89 [0,63–1,28] нмоль/л; и СРБ: 118 (52-205) мг/л.
Прогноз результата лечения
Общая выборка пациентов
Концентрации ПКТ, MR-proADM и СРБ, определяемые на момент поступления, значимо не различаются у выздоровевших пациентов и пациентов с неудовлетворительным результатом лечения (рисунок 2 и таблица 3). Как указано в таблице 3, уровень биомаркеров, определяемый через 3 дня после лечения также не имеет прогностической значимости. Помимо этого, мы учитывали пороговое значение ПКТ, используемое в других исследованиях, как 0,25 мкг/мл [10, 11] и снижение концентрации ПКТ на 80% [4].
 Рисунок 2. Уровень ПКТ, MR-proADM и СРБ на момент поступления у пациентов с удовлетворительным и неудовлетворительным результатом лечения
Рисунок 2. Уровень ПКТ, MR-proADM и СРБ на момент поступления у пациентов с удовлетворительным и неудовлетворительным результатом леченияТаблица 3. Биомаркеры пациентов с клиническим выздоровлением и неудовлетворительным исходом лечения
Для определения способности биомаркеров прогнозировать результат лечения применялся ROC-анализ. На основе вычисленной площади под кривой «концентрация/время» (AUC) установлено, что ни один из биомаркеров не обладает значимостью в прогнозе удовлетворительного исхода лечения (рисунок 3). Подобный результат получен также у пациентов с подтвержденной посевом ИМП (N=183) и в отношении пациентов с длительным курсом лечения (данные не приведены).
Пациенты с курсом лечения 7 дней
Мы отдельно рассмотрели пациентов, принимающих курс антибиотиков в течение 7 дней, поскольку частота выздоровления у них была ниже, чем у пациентов, принимающих антибиотик в течение 14 дней (89% и 94% соответственно, р=0,21). При этом разницы в уровне ПКТ, MR-proADM и СРБ у больных с удовлетворительным и неудовлетворительным результатом лечения не установлено (Таблица 3)
Корреляция между биомаркерами и клиническими характеристиками
Прокальцитонин
Концентрация ПКТ на момент поступления положительно коррелировала с бактериемией (τ = 0,33, p < 0,001) и наличием озноба (τ = 0,33, p < 0,001). Однако корреляция с необходимостью внутривенного введения препаратов на начальном этапе, длительностью госпитализации, временем исчезновения лихорадки, нахождением в ОРИТ, величиной температуры, частотой сердечных сокращений и спутанностью сознания на момент поступления была слабой, но значимой (τ < 0,20). Помимо этого, концентрация ПКТ увеличивается с возрастом (τ = 0,12, p < 0,01) и не коррелирует с коморбидностью. Медиана концентрации ПКТ, определяемой на 3-й день, продемонстрировала те же результаты, корреляции снижения концентрации ПКТ с клиническими характеристиками не установлено.
Среднерегиональный проадреномедуллин
Уровень MR-proADM на момент поступления положительно коррелировал с длительностью госпитализации (τ = 0,40, p < 0,001), бактериемией (τ = 0,33, p < 0,001), необходимостью внутривенного введения препаратов (τ = 0,22, p < 0,001) и временем исчезновения лихорадки (τ = 0,21, p < 0,001). Установлена слабая, но значимая корреляция с величиной температуры, необходимостью пребывания в ОРИТ, спутанностью сознания на момент поступления и наличием озноба (τ < 0,20). По сравнению с ПКТ MR-proADM более строго коррелирует с возрастом (τ = 0,49, p < 0,001) и слабо коррелирует с наличием сопутствующей патологии (сахарный диабет, патология мочевыводящих путей и хроническая почечная недостаточность). На 3-й день корреляция была аналогичной. Снижение концентрации MR-proADM со дня поступления до 3-го дня коррелирует с наличием бактериемии (τ = 0,22, p < 0,001) и озноба в день поступления (τ = 0,22, p < 0,001).
С-реактивный белок
Концентрация СРБ имеет слабую положительную корреляцию со временем ослабления лихорадки (τ = 0,13, p = 0,02) и слабую негативную корреляцию с величиной температуры (τ = − 0,11, p = 0,04), а также средним артериальным давлением (τ = − 0,13, p = 0,02). Корреляции между уровнем СРБ и другими параметрами, например возрастом или коморбидностью, не установлено.
Обсуждение
В данном исследовании мы дали оценку способности таких биомаркеров, как ПКТ, MR-proADM и CРБ прогнозировать результат неудовлетворительного лечения при рандомизированном разделении пациентов с ИМП с фебрильной составляющей на группы с курсом приема антибиотиков разной продолжительности (т. е. 7 и 14 дней). Мы предполагали, что изменение в концентрации биомаркеров как объективного лабораторного параметра, отражающего течение ИМП с фебрильной составляющей, могло бы помочь врачам определять длительность антибактериальной терапии. Однако в нашем исследовании ни ПКТ, ни MR-proADM, ни СРБ не оказались способны заранее выделить пациентов с высоким риском неудовлетворительного исхода лечения, т. е. тех, кому мог бы быть рекомендован продолжительный курс антибиотика.
Общий показатель эффективности терапии был высок: 94% среди рандомизированных 165 пациентов и 88% среди нерандомизированных 84 пациентов, которые после курса лечения совершенно одинаково оценивались на соответствие критериям выздоровления. Что касается биомаркеров, ПКТ и MR-proADM продемонстрировали значимую корреляцию с такими клиническими характеристиками как лихорадка, артериальное давление и субъективные жалобы, отражающие течение инфекционного заболевания мочевыводящих путей с фебрильной составляющей. Кроме того, динамика концентрации ПКТ и MR-proADM коррелировала с тяжестью заболевания, а именно с наличием бактериемии и необходимостью начала терапии с внутривенного, а не перорального приема антибиотиков. Наконец, изменение уровня ПКТ и MR-proADM в течение первых трех дней коррелировало с признаками улучшения состояния: временем нормализации температуры тела, уменьшением жалоб и длительностью пребывания в стационаре. В отличие от ПКТ и MR-proADM, часто используемый в настоящее время биомаркер СРБ не продемонстрировал корреляции с основными клиническими характеристиками - лихорадкой или бактериемией.
Отобранные нами для исследования биомаркеры рассматриваются сегодня как факторы-предикторы при различных состояниях. Прокальцитонин – гормон-предшественник кальцитонина, его концентрация повышается под воздействием цитокинов в ответ на бактериальную инфекцию [4]. MR-proADM обнаружен во многих тканях, в том числе сердца, сосудов и почек, и обладает как иммуномодулирующим, так и вазодилатирующим действием [2]. Уровень MR-proADM повышается при сепсисе, способствуя гипотензии у таких пациентов. Таким образом, среднерегиональный проадреномедуллин (MR-proADM) является прогностическим фактором осложненного течения заболевания, необходимости пребывания в ОРИТ и риска летального исхода [6, 7].
Алгоритмы лечения на основе определения ПКТ нацелены на решение вопроса о начале и (или) прекращении антибактериальной терапии у пациентов с острым инфекционным процессом дыхательных путей и, прежде всего, у пациентов, находящихся в условиях блока интенсивной терапии [15]. У этой особой группы пациентов определение уровня ПКТ является отличным инструментом контроля назначения антибиотиков [16]. Несмотря на то что в исследованиях по оказанию интенсивной терапии включены пациенты с инфекциями мочевыводящих путей, количество таких пациентов было невелико (например, 7% в исследовании PRORATA, 3% в исследовании SAPS), и эти результаты не могут быть в общем достоверными для больных с внебольничной инфекцией мочевыводящих путей [4, 17].
Повышение концентрации упомянутых биомаркеров – отражение системного воспалительного ответа на бактериальную инвазию. Воспалительный ответ совпадает с острой фазой заболевания, часто сопровождается нарушением жизненных функций, лихорадкой и понижением артериального давления. В клинической практике тяжесть острого заболевания оценивается по данным анамнеза с учетом сопутствующей патологии, выраженности местных и общих симптомов. Очевидно, что более объективно оценить состояние позволяет определение уровня биомаркеров, которые отражают сложность картины заболевания, коррелируют с бактериемией, необходимостью пребывания в ОРИТ, временем исчезновения лихорадки и длительностью госпитализации. Хотя корреляция концентрации ПКТ и MR-proADM с упомянутыми клиническими характеристиками в нашем исследовании подтверждена, они оказались неспособны спрогнозировать успех стандартизированной антибактериальной терапии, независимо от длительности приема препарата – 7 или 14 дней. Предположительной причиной этого можно считать тот факт, что все пациенты лечились минимум 7 дней, после чего частота выздоровления была уже высока (89%). Таким образом, недостаточная прогностическая значимость для схемы терапии вероятнее всего объясняется тем, что исторически эмпирическое лечение основывалось на ожидаемом времени наступления клинического эффекта с учетом индивидуальных различий в тяжести болезни на момент поступления (т. е. в действительности к среднему времени до выздоровления добавлялись несколько дней). В итоге, у исследованных нами пациентов среднее время до исчезновения лихорадки составило 2,0 (МКИ 1-3) дня, при этом рандомизация на группы длительного и короткого курса приема лекарств не проводилось до 7-го дня. Другими словами, можно было бы предположить, что наш метод работы с биомаркерами мог определять схему лечения до одного или нескольких дней после клинического выздоровления, но это оказалось невозможно спустя как минимум 7 дней после начала лечения, при котором превышено время возвращения уровня биомаркера к нормальному значению. Уровень биомаркеров у пациентов с различной тяжестью заболевания при поступлении обычно нормализовался через 7 дней лечения, и почти всегда через 14 дней. Отметим, что резистентность к антибиотикам в проведенном исследовании не учитывалась; пациенты с резистентными к ципрофлоксацину микроорганизмами, вызвавшими ИМП, исключены из рандомизации и получали антибиотик, подобранный на основе результата посевов.
В первоначальном исследовании мы обозначили, что несмотря на менее продолжительный курс лечения в 7 дней у мужчин, различия в частоте между мужчинами и женщинами в необходимости повторного приема антибиотиков по поводу ИМП на протяжении периода наблюдения в 90 дней не выявлено [1].
Ретроспективный анализ с участием мужчин пожилого возраста также показал, что курс лечения длительностью более 7 дней не коррелирует со снижением рецидива ИМП [18]. Согласно нашей работе, рецидивирующее течение ИМП не зависит от возраста и коморбидности больных. Вероятно также, что подгруппе пациентов целесообразно назначить курс короче, чем 7 дней. Теоретически на протяжении осуществляемого лечения есть момент, когда пациент излечивается от острого заболевания и уровень биомаркеров падает ниже определенного значения, оставляя место для еще одного ограничения к продолжительности терапии. Это подтверждает концепцию, что время выздоровления зависит от особенностей организма хозяина, и, следовательно, может отличаться у разных категорий больных. Биомаркеры потенциально могут выступать в качестве объективного метода выявления момента прекращения лечения, независимо от характеристик пациента. К сожалению, как уже упоминалось выше, дизайн нашего исследования не позволяет разобраться в этом вопросе более подробно.
Сильной стороной нашего исследования можно назвать практичность и применимость в ежедневной клинической работе. Мы рандомизировали пациентов в группу с 14-дневным курсом приема антибиотика и группу с курсом приема препаратов, составляющим половину от предыдущего срока, а также набрали к участию достаточное количество субъектов. Мы отбирали последовательный ряд поступивших пациентов с ИМП, независимо от возраста, пола и сопутствующей патологии. Концентрация биомаркеров определялась в день поступления и через 3 дня после начала терапии, отражая различные особенности развития острого инфекционного процесса.
К недостаткам исследования можно отнести дизайн, который подразумевал рандомизацию в срок с 7-го по 14-й день, не позволяя таким образом оценить значимость биомаркеров при более коротком приеме антибиотиков. Это было допущено непреднамеренно, так как период лечения антибиотиками длительностью 14 дней является стандартной практикой при проведении исследований, а его уменьшение до 7 дней уже можно считать большим достижением. Кроме того, наш объем выборки слишком мал для исключения ошибки II типа.
Насколько нам известно, опубликовано только одно исследование подбора схемы лечения на основе определения концентрации биомаркеров [10]. В нем Drozdov et al. рандомизированно разделили пациентов с циститом (N=36) и инфекцией мочевыводящих путей с фебрильной оставляющей (N=84) на группу лечения на основе определения ПКТ и группу стандартной методики ведения. В целом, количество применяемого антибиотика сократилось, при этом частота нежелательных явлений (рецидивы и повторные госпитализации) значимо не отличалась в двух группах. При подгрупповом анализе пациентов с ИМП/пиелонефритом, при ПКТ-ориентированном лечении продолжительность курса антибиотиков была значимо ниже, чем при стандартном подходе (7,5 и 11,0 дней). У больных с бактериемией частота рецидивов (56% и 16%), а также персистирования инфекции после лечения (13% и 6%) была выше в группе с ПКТ-ориентированным лечением, хотя распределение пациентов с бактериемией было неодинаково в обеих группах (45% и 21%), а размер выборки недостаточно высок, чтобы результат признавался значимым. Несмотря на малую выборку и гетерогенность пациентов, исследование Drozdov et al. вносит свой вклад в возможность использования методики определения ПТК для безопасного уменьшения продолжительности приема антибиотиков у пациентов с внебольничной ИМП.
В будущем целесообразно провести интервенционные исследования, чтобы определить, возможно ли благодаря определению концентрации ПКТ выделить особые категории пациентов с ИМП, для лечения которых достаточен прием антибиотиков на протяжении менее 7 дней (т. е. у которых показатели биомаркеров быстро приходят в норму), с целью уменьшить воздействие антибиотиков и ограничить риск возникновения антибиотикорезистентности.
В заключении отметим, что хотя уровень биомаркеров ПКТ и MR-proADM коррелирует с клиническими характеристиками тяжести заболевания, он не в состоянии спрогнозировать исход лечения пациентов с внебольничной инфекцией мочевыводящих путей, получающих курс ципрфлоксацина на протяжении 7 или 14 дней. При вторичном анализе установлено, что СРБ не обладает дополнительными преимуществами ведения больных с ИМП.
Список использованной литературы
- van Nieuwkoop C, van der Starre WE, Stalenhoef JE, van Aartrijk AM, van der Reijden TJ, Vollaard AM, Delfos NM, van 't Wout JW, Blom JW, Spelt IC et al: Treatment duration of febrile urinary tract infection: a pragmatic randomized, double-blind, placebo-controlled non-inferiority trial in men and women. BMC Med 2017, 15(1):70. [ PMC free article] [ PubMed]
- Christ-Crain M, Morgenthaler NG, Stolz D, Muller C, Bingisser R, Harbarth S, Tamm M, Struck J, Bergmann A, Muller B. Pro-adrenomedullin to predict severity and outcome in community-acquired pneumonia [ISRCTN04176397] Crit Care. 2006;10(3):R96. doi: 10.1186/cc4955. [ PMC free article][ PubMed] [ CrossRef] [ Google Scholar]
- Schuetz P, Muller B, Christ-Crain M, Stolz D, Tamm M, Bouadma L, Luyt CE, Wolff M, Chastre J, Tubach F, et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev. 2012;9 CD007498. [ PubMed]
- Bouadma L, Luyt CE, Tubach F, Cracco C, Alvarez A, Schwebel C, Schortgen F, Lasocki S, Veber B, Dehoux M, et al. Use of procalcitonin to reduce patients' exposure to antibiotics in intensive care units (PRORATA trial): a multicentre randomised controlled trial. Lancet. 2010;375(9713):463–474. doi: 10.1016/S0140-6736(09)61879-1. [ PubMed] [ CrossRef] [ Google Scholar]
- Elke G, Bloos F, Wilson DC, Brunkhorst FM, Briegel J, Reinhart K, Loeffler M, Kluge S, Nierhaus A, Jaschinski U, et al. The use of mid-regional proadrenomedullin to identify disease severity and treatment response to sepsis - a secondary analysis of a large randomised controlled trial. Crit Care. 2018;22(1):79. doi: 10.1186/s13054-018-2001-5. [ PMC free article] [ PubMed] [ CrossRef] [ Google Scholar]
- van der Starre WE, Zunder SM, Vollaard AM, van NC, Stalenhoef JE, Delfos NM, van't Wout JW, Spelt IC, Blom JW, Leyten EM, et al. Prognostic value of pro-adrenomedullin, procalcitonin and C-reactive protein in predicting outcome of febrile urinary tract infection. Clin Microbiol Infect. 2014;20(10):1048–1054. doi: 10.1111/1469-0691.12645. [ PubMed] [ CrossRef] [ Google Scholar]
- Andaluz-Ojeda D, Nguyen HB, Meunier-Beillard N, Cicuendez R, Quenot JP, Calvo D, Dargent A, Zarca E, Andres C, Nogales L, et al. Superior accuracy of mid-regional proadrenomedullin for mortality prediction in sepsis with varying levels of illness severity. Ann Intensive Care. 2017;7(1):15. doi: 10.1186/s13613-017-0238-9. [ PMC free article] [ PubMed] [ CrossRef] [ Google Scholar]
- Stalenhoef JE, van Nieuwkoop C, Wilson DC, van der Starre WE, Delfos NM, Leyten EMS, Koster T, Ablij HC, Willem Van't Wout JJ, van Dissel JT: Biomarker guided triage can reduce hospitalization rate in community acquired febrile urinary tract infection. J Infect. 2018;77(1):18–24. 10.1016/j.jinf.2018.05.007. Epub 2018 May 26 [ PubMed]
- van Nieuwkoop C, van't Wout JW, Assendelft WJ, Elzevier HW, Leyten EM, Koster T, Wattel-Louis GH, Delfos NM, Ablij HC, Kuijper EJ, et al. Treatment duration of febrile urinary tract infection (FUTIRST trial): a randomized placebo-controlled multicenter trial comparing short (7 days) antibiotic treatment with conventional treatment (14 days) BMC Infect Dis. 2009;9:131. doi: 10.1186/1471-2334-9-131. [ PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Drozdov D, Schwarz S, Kutz A, Grolimund E, Rast AC, Steiner D, Regez K, Schild U, Guglielmetti M, Conca A, et al. Procalcitonin and pyuria-based algorithm reduces antibiotic use in urinary tract infections: a randomized controlled trial. BMC Med. 2015;13:104. doi: 10.1186/s12916-015-0347-y. [PMC free article][PubMed] [CrossRef] [Google Scholar]
- Christ-Crain M, Jaccard-Stolz D, Bingisser R, Gencay MM, Huber PR, Tamm M, Muller B. Effect of procalcitonin-guided treatment on antibiotic use and outcome in lower respiratory tract infections: cluster-randomised, single-blinded intervention trial. Lancet. 2004;363(9409):600–607. doi: 10.1016/S0140-6736(04)15591-8. [PubMed] [CrossRef] [Google Scholar]
- van Nieuwkoop C, Bonten TN, van't Wout JW, Kuijper EJ, Groeneveld GH, Becker MJ, Koster T, Wattel-Louis GH, Delfos NM, Ablij HC, et al. Procalcitonin reflects bacteremia and bacterial load in urosepsis syndrome: a prospective observational study. Crit Care. 2010;14(6):R206. doi: 10.1186/cc9328.[PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Park JH, Wee JH, Choi SP, Park KN. Serum procalcitonin level for the prediction of severity in women with acute pyelonephritis in the ED: value of procalcitonin in acute pyelonephritis. Am J Emerg Med. 2013;31(7):1092–1097. doi: 10.1016/j.ajem.2013.04.012. [PubMed] [CrossRef] [Google Scholar]
- Ha YE, Kang CI, Wi YM, Chung DR, Kang ES, Lee NY, Song JH, Peck KR. Diagnostic usefulness of procalcitonin as a marker of bacteremia in patients with acute pyelonephritis. Scand J Clin Lab Invest. 2013;73(5):444–448. doi: 10.3109/00365513.2013.803231. [PubMed] [CrossRef] [Google Scholar]
- Schuetz P, Wirz Y, Sager R, Christ-Crain M, Stolz D, Tamm M, Bouadma L, Luyt CE, Wolff M, Chastre J, et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev. 2017;10:CD007498. [PubMed] [Google Scholar]
- Rhee C. Using Procalcitonin to guide antibiotic therapy. Open forum infectious diseases. 2017, 4(1):ofw249. [PMC free article] [PubMed]
- de Jong E, van Oers JA, Beishuizen A, Vos P, Vermeijden WJ, Haas LE, Loef BG, Dormans T, van Melsen GC, Kluiters YC, et al. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: a randomised, controlled, open-label trial. Lancet Infect Dis. 2016;16(7):819–827. doi: 10.1016/S1473-3099(16)00053-0. [PubMed] [CrossRef] [Google Scholar]
- Drekonja DM, Rector TS, Cutting A, Johnson JR. Urinary tract infection in male veterans: treatment patterns and outcomes. JAMA Intern Med. 2013;173(1):62–68. doi: 10.1001/2013.jamainternmed.829.[PubMed] [CrossRef] [Google Scholar]





