1917
09 Октября 2020
Семинары: биология рака
Том 52, часть 1, октябрь 2018, стр. 9-16
Д. А. Чистяков, В. А. Масоедова, А. В. Гречко, А. А. Мельниченко, А. Н. Орехов
doi.org
Аннотация
Диагностика и лечение локализованного рака предстательной железы является сложной задачей из-за гетерогенности этого заболевания и неодинаковой скорости прогрессирования в различных подгруппах пациентов. Анализ на наличие простат-специфического антигена (ПСА) и его производных, одобренный FDA (Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США), как основной биомаркер рака предстат...
Том 52, часть 1, октябрь 2018, стр. 9-16
Д. А. Чистяков, В. А. Масоедова, А. В. Гречко, А. А. Мельниченко, А. Н. Орехов
doi.org
Аннотация
Диагностика и лечение локализованного рака предстательной железы является сложной задачей из-за гетерогенности этого заболевания и неодинаковой скорости прогрессирования в различных подгруппах пациентов. Анализ на наличие простат-специфического антигена (ПСА) и его производных, одобренный FDA (Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США), как основной биомаркер рака предстат...
Семинары: биология рака
Том 52, часть 1, октябрь 2018, стр. 9-16
Д. А. Чистяков, В. А. Масоедова, А. В. Гречко, А. А. Мельниченко, А. Н. Орехов
doi.org
Аннотация
Диагностика и лечение локализованного рака предстательной железы является сложной задачей из-за гетерогенности этого заболевания и неодинаковой скорости прогрессирования в различных подгруппах пациентов. Анализ на наличие простат-специфического антигена (ПСА) и его производных, одобренный FDA (Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США), как основной биомаркер рака предстательной железы не является достаточно специфичным для диагностики заболевания, особенно когда речь идет о высокой степени его злокачественности (по шкале Глисона ≥ 7). На сегодняшний день был разработан ряд новых биомаркеров, часть которых предназначены для скрининга, в то время как другие могут успешно применяться для стратификации риска, выявления опухолей высокой степени злокачественности и прогнозирования неблагоприятных явлений. Два маркера, такие как проПСА (часть Индекса здоровья предстательной железы (PHI)) и простат-специфический антиген 3 (ПСА3, часть теста ПСА3 Progensa), были недавно одобрены Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США для клинического использования. Другие маркеры пока не одобрены, но доступны в клинических лабораториях, сертифицированных CLIA (Clinical Laboratory Improvement Amendments). В этом обзоре мы рассматриваем применение данных маркеров и их диагностическую и прогностическую ценность в отношении диагностики рака предстательной железы.
Ключевые слова: рак предстательной железы, биомаркеры, диагностика, прогноз, простат-специфический антиген.
1. Введение
Локализованный рак предстательной железы является одним из наиболее распространенных типов рака у мужчин в промышленно развитых странах, и заболеваемость им продолжает расти [1]. В большинстве случаев рак предстательной железы развивается медленно, хотя встречаются и агрессивные, быстропрогрессирующие формы. Разработка эффективных биомаркеров рака предстательной железы имеет важное значение для надлежащего скрининга населения, определения групп высокого риска и обеспечения ранней диагностики групп заболевших с высокой степенью злокачественности опухоли.
Существует несколько типов молекулярных маркеров, которые могут быть использованы для диагностики, оценки риска и прогрессирования рака предстательной железы. Предиктивные маркеры могут быть полезны для оценки клинических исходов лечения. Прогностические маркеры имеют клиническое значение для оценки риска неблагоприятных явлений, вплоть до смерти пациента, рецидива опухоли или ее метастазирования [2].
На сегодняшний день единственным биомаркером, одобренным FDA для выявления и прогнозирования развития рака предстательной железы, является простат-специфический антиген (ПСА) [3]. ПСА представляет собой калликреин – сериновую протеазу, секретируемую эпителиальными клетками предстательной железы, которая в основном участвует в разжижении спермы человека по протеолитическому механизму [4]. Первоначально внедрение ПСА в клиническую практику приводило к увеличению частоты выявления мужчин с ранней стадией рака предстательной железы [5]. Кроме того, были предприняты усилия по разработке стадирования рака предстательной железы на основе определения ПСА и использования этого маркера в прогностических целях [6].
Однако применение ПСА как диагностического и прогностического маркера рака предстательной железы показало серьезные ограничения и несогласованность результатов, так как на самом деле ПСА является не опухоль-специфичным, а орган-специфичным маркером. Эта протеаза в нормальных условиях продуцируется эпителиальными клетками предстательной железы в небольшом количестве и резко увеличивается при прогрессировании от доброкачественной гиперплазии предстательной железы до рака предстательной железы и при дальнейшем развитии злокачественной опухоли [7]. У мужчин старше 60 лет уровень ПСА увеличивается, что снижает чувствительность теста на ПСА при диагностике рака предстательной железы [8]. Кроме того, повышенный уровень ПСА может наблюдаться при остром простатите [9]. Напротив, уровень ПСА может быть снижен у мужчин, которые лечатся специфическими терапевтическими агентами с антиандрогенными эффектами, такими как ингибиторы 5-α редуктазы [10]. Кроме того, соотношение уровня ПСА и степени злокачественности рака предстательной железы довольно условное, что ограничивает его использование для классификации [11]. В совокупности эти недостатки снижают клиническую эффективность определения ПСА в сыворотке крови для скрининга и прогноза развития рака предстательной железы.
Таким образом, поиск новых маркеров рака предстательной железы должен быть нацелен не только на обнаружение диагностически значимых маркеров, но и на оценку риска развития заболевания, и на мониторинг прогрессирования заболевания. В этом обзоре мы рассмотрим ряд новых молекулярных маркеров, которые потенциально могут повысить эффективность скрининга, диагностики и лечения рака предстательной железы.
2. Оценка клинической значимости биомаркеров рака
Разработка новых биомаркеров требует определения их роли и значимости в канцерогенезе предстательной железы. Для проверки потенциальной клинической пользы биомаркера и валидации у пациентов необходимо оценивать его чувствительность, специфичность, площадь под ROC-кривой (AUC), прогнозируемое значение (положительное и отрицательное) и другие параметры [12]. Существует много потенциальных биомаркеров рака, но лишь немногие из них достаточно надежны в отношении истинной аналитической и клинической ценности и соответствуют критериям отбора FDA для клинического использования. Более того, одобрение FDA не является гарантией успешного клинического применения биомаркера, как это было в случае с ПСА, который, однако, все еще широко используется при обычном скрининге рака предстательной железы [13].
Важной предпосылкой для внедрения потенциального биомаркера в клиническую практику является его положительная оценка. Тем не менее, существует множество препятствий, которые могут снизить значимость биомаркера в реальном клиническом применении после валидации. Например, биомаркер может успешно применяться в диагностике рака предстательной железы, но не показывать результаты лечения или не иметь достаточной прогностической точности появления опухоль-ассоциированных неблагоприятных явлений. Такой биомаркер будет характеризоваться высокой эффективностью в сочетании с ограниченной клинической значимостью [14]. Поэтому внедрению биомаркера в широкую клиническую практику должны предшествовать исследования, оценивающие именно эти аспекты. В последние годы были разработаны новые методы теоретической оценки клинической значимости потенциальных биомаркеров с учетом различных факторов, которые влияют на эффективность маркера в реальной практике, - например, компьютерное моделирование. Предсказать положительные эффекты биомаркера или диагностического анализа на клинические решения с помощью спектра теоретических пороговых вероятностей для вмешательств может помочь анализ кривой принятия решений (DCA) [15].
3. Новые диагностические биомаркеры рака предстательной железы
3.1. Индекс здоровья предстательной железы и проПСА
ПроПСА представляет собой неактивный предшественник ПСА, который имеет лидерную последовательность семи аминокислот, называемых (-7) проПСА. У людей калликреины-2 и -4 участвуют в активации ПСА путем расщепления последовательности пролидера [16]. Частичное расщепление последовательности пролидера приводит к образованию нескольких изоформ проПСА, из которых в образцах рака предстательной железы преобладает (-2) проПСА [17]. Одним из инструментов, позволившим улучшить диагностику рака предстательной железы, является индекс здоровья предстательной железы (PHI), который может быть рассчитан как функция отношения (-2) проПСА, свободного ПСА и общего ПСА. Другая форма ПСА неактивна, поскольку протеаза связана с ингибитором, таким как α1-антитрипсин, α1-антихимотрипсин или α2-макроглобулин [18]. Определение PHI включает в себя измерение трех форм ПСА (общего ПСА, свободного ПСА и (-2) проПСА) в сыворотке крови. Эта формула также полезна для дифференциальной диагностики доброкачественной гиперплазии предстательной железы и рака предстательной железы у пациентов с подозрением на рак. Оценка PHI была разработана американской компанией Beckman Coulter Inc. (Brea, CA), подтверждена Catalona и соавт. [19], затем достоверность повторно оценивалась многочисленными многоцентровыми клиническими исследованиями в разных странах [20-24]. Резюме клинических исследований валидации для теста PHI представлено в таблице 1.
Таблица 1. Обзор клинических исследований оценки индекса здоровья предстательной железы (PHI)
Сокращения: AUC - площадь под Roc-кривой; ПРИ - пальцевое ректальное исследование; ERSPC - Европейское рандомизированное исследование по скринингу рака предстательной железы; PROMEtheuS проПСА - Многоцентровое европейское исследование; ПСА - простат-специфический антиген.
В первичном исследовании Catalona и соавт. [19] показали достоверность оценки PHI для выявления рака предстательной железы с оценкой по шкале Глисона 3 + 4 и выше, с AUC 0,703 по результатам биопсии у мужчин с опухолью иной локализации, при значении общего ПСА 2-10 нг/мл. Loeb и соавт., при биопсии у мужчин с общим ПСА 4-10 нг/мл, было получено аналогичное значение AUC (т.е. 0,707) [25], тем самым повторяя значение показателя PHI для выявления стадии болезни по шкале Глисона 3 + 4 и выше. В этом клиническом исследовании была использована AUC 0,707 для определения дифференцировки заболевания по шкале Глисона 3-й и 4-й степени. De la Calle и соавт. [23] использовали AUC 0,815 для определения стадии рака предстательной железы (степень 3 + 4 и выше), что подтверждает результаты Loeb и соавт. [25].
Недавний метаанализ 24 клинических исследований сообщил о диагностических характеристиках показателя PHI для выявления рака предстательной железы следующее: совокупная специфичность 0,34, чувствительность 0,89, AUC 0,76 [26]. Для поздней стадии заболевания тест PHI показал совокупную специфичность 0,34, чувствительность 0,93, AUC 0,82. Эти данные продемонстрировали высокую способность PHI к распознаванию агрессивного рака предстательной железы: недавний метаанализ показал совокупную специфичность 0,17 и чувствительность 0,90 для определения стадии болезни по шкале Глисона 3-й и 4-й степени [27]. У пациентов после радикальной простатэктомии было установлено, что PHI ассоциируется с неблагоприятными характеристиками рака предстательной железы [17]. Кроме того, FDA недавно одобрило проПСА и PHI для клинического применения в качестве диагностического маркера [28].
3.2. Простат-специфический антиген 3 (ПСА3)
Вторым молекулярным маркером для выявления рака предстательной железы, одобренным FDA, является простат-специфический антиген 3 (ПСА3) [29]. ПСА3 представляет собой простат-специфическую некодирующую РНК, которая обладает высокой экспрессией в клетках рака предстательной железы [30]. Было обнаружено, что ПСА3 регулирует выживаемость клеток посредством контроля сигнализации андрогенных рецепторов (АР) и экспрессии кофакторов АР и генов, участвующих в проканцерогенном эпителиально-мезенхимальном переходе [31, 32]. Интересно, что при заболеваниях, не связанных со злокачественной опухолью предстательной железы, таких как доброкачественная гиперплазия предстательной железы, атипическая малая ацинарная пролиферация, простатит и простатическая интраэпителиальная неоплазия, экспрессия ПСА3 отсутствует [33]. Эти особенности делают ПСА3 перспективным для клинического использования.
Тест на основе ПСА3, разработанный Progensa (Мальборо, Массачусетс, США), представляет собой количественное определение РНК ПСА3 и ПСА в анализах мочи у мужчин с повышенным уровнем ПСА в сыворотке крови и отрицательной первичной биопсией предстательной железы. Количественная оценка выполняется с помощью ПЦР с обратной транскрипцией (RT-PCR), которая, в свою очередь, позволяет рассчитать показатель ПСА3 (отношение транскриптов ПСА3 к транскриптам ПСА). Этот показатель может помочь врачам определить необходимость повторной биопсии у мужчин старше 50 лет, которым уже была сделана одна или несколько биопсий [34]. Показатель ПСА3 < 25 указывает на низкий риск индукции рака предстательной железы, в то время как более высокое значение указывает на повышенную вероятность выявления рака предстательной железы при биопсии [35]. На практике многие исследователи используют порог оценки показателя ПСА3 в 35 [36-38]. Было показано, что выбор значения для точки отсчета существенно влияет на специфичность, чувствительность и прогностическую ценность оценки ПСА3: так, установление минимального значения на уровне 20 значительно улучшает диагностическую точность этого маркера, в то время как значение 35 уменьшает количество ненужных образцов, рекомендованных для проведения повторной биопсии [37, 39, 40]. Недавний метаанализ с использованием точки отсчета 20 в сравнении с 35 показал общую чувствительность 0,93 против 0,80, специфичность 0,65 против 0,44, AUC 0,85 против 0,72, положительное прогностическое значение (ППЗ) 1,86 против 1,58, отрицательное прогностическое значение (ОПЗ) 0,81 против 0,43 и отношение шансов диагностики (ОШД) 5,73 против 3,45 [40]. Следовательно, значение точки отсчета 20, по-видимому, имеет большее диагностическое значение по сравнению с 35.
Cui и соавт. [41] обобщили результаты 46 клинических исследований по определению ПСА3 в моче, в которых приняли участие 12 295 пациентов. Диагностическое значение определения ПСА3 было выше, чем определения общего ПСА и его производных, таких как свободный ПСА, процентное значение свободного ПСА, скорость ПСА (отражает скорость увеличения уровня ПСА), отношение свободного ПСА к общему ПСА [42-44]. Использование комбинации ПСА3 с PHI улучшило эффективность отбора пациентов для выполнения первичной биопсии с общей диагностической точностью 0,77 [43, 45]. В совокупности эти данные показывают, что ПСА3 имеет высокую диагностическую эффективность и значимость для выявления пациентов группы высокого риска. Более того, образец мочи для определения ПСА3 можно легко получить после пальцевого ректального исследования (ПРИ). Однако наблюдалось, что этот тест может быть эффективным только при прогнозировании первой повторной биопсии [42].
3.3. Определение TMPRSS2:ERG и mi-PROSTATE
Помимо PHI и оценки ПСА3 разрабатываются другие диагностические тесты, некоторые из которых в настоящее время проходят сертификацию в соответствии с Резолюцией по улучшению работы клинических лабораторий (CLIA). Одним из таких тестов является определение TMPRSS2:ERG на основе экспрессии гибридного гена, специфичного для рака предстательной железы. Наиболее распространенным генетическим изменением при биопсии локализованного первичного рака предстательной железы у 43-50% кавказских мужчин является слияние TMPRSS2:ERG [46-48]. Распространенность этого слияния при метастазировании гормонозависимого рака предстательной железы ниже (около 30%), что может указывать на его участие в переходе рака на стадию инвазии [48]. Ген TMPRSS2 кодирует проонкогенную трансмембранную сериновую протеазу 2, которая регулируется андрогенными гормонами в клетках предстательной железы, однако функция этой протеазы пока неизвестна. Слияние с ERG транскрипционного фактора ETS приводит к независимости андрогенов через нарушение сети передачи сигналов, опосредованной андрогенным рецептором [49]. TMPRSS2:ERG онкоген также может служить медиатором опухолевой прогрессии в метастатической фазе путем повышения регуляции медиатора клеточной миграции плексина B1 [50].
В качестве очередного биомаркера для диагностики рака предстательной железы было предложено обнаружение транскриптов TMPRSS2:ERG в пост-ПРИ анализах мочи. Несколько проспективных наблюдательных исследований показали прогностическую ценность слияния этих генов при раке предстательной железы [51, 52]. Недавний метаанализ 32 исследований показал следующие диагностические характеристики слияния TMPRSS2:ERG: чувствительность пула 0,474, специфичность 0,926, ППЗ 8,94 и ОПЗ 0,49 [53]. Чтобы повысить чувствительность и, следовательно, диагностическую точность, определение TMPRSS2:ERG можно комбинировать с другими маркерами [54]. Например, Мerdan с соавт. [55] сообщил, что одновременное использование оценки ПСА3 (порог 25) и TMPRSS2:ERG (минимальное значение 10) помогло избежать > 50% повторных биопсий.
Медицинским центром при Мичиганском университете была разработана еще одна новая диагностическая система оценки - Mi-PROSTATE. Предлагаемый алгоритм включает совместное использование определения TMPRSS2:ERG в моче, тест Progensa на ПСА3 и сывороточного ПСА для оценки риска развития рака, который потенциально указывает на вероятность развития агрессивного рака. В небольшом исследовании (48 пациентов с ПСА ≥ 10 нг/мл) Salami с соавт. [56] показал, что сочетание этих маркеров является более эффективным (специфичность 0,9, чувствительность 0,8, AUC 0,88) для прогнозирования рака при последующей биопсии по сравнению с определением каждого маркера отдельно. Аналогичным образом добавление ПСА3 и TMPRSS2:ERG к тестовой панели значительно повысило эффективность определения сывороточного ПСА для прогнозирования рака предстательной железы (AUC 0,693 против 0,585 для изолированного ПСА) и рака высокой степени злокачественности (оценка по шкале Глисона > 3 + 3, AUC 0,729 против 0,651 для изолированного ПСА) [57]. Ретроспективное исследование показало, что сочетание клинических и биологических (андрогенного статуса) переменных с генетическими (генотипы rs1447295 и rs6983267), а также диагностических (маркер ПСА3, плотность ПСА и определение TMPRSS2:ERG) могут значительно улучшить выявление локализованного рака предстательной железы [58].
3.4. Онкотайп DX геномный показатель предстательной железы (GPS)
Геномный показатель предстательной железы (GPS) был разработан Genomic Health (Редвуд-Сити, Калифорния, США) и основан на количественной оценке экспрессии 12 генов, влияющих на агрессивность рака предстательной железы и 5 референсных генов [59]. Выбранные для этого геномного теста опухоль-ассоциированные гены участвуют в пролиферации (TPX2), синтезе андрогенов (RAM13C, KLK2, AZGP1, SRD5A2), стромальном ответе (COL1A1, SFRP4, BGN) и клеточной организации (GSTM2, GSN, FLNC, TPM2). Анализ Онкотайп DX был специально разработан для оценки образцов пункционной биопсии предстательной железы и поэтому способен обнаруживать транскрипты РНК с высокой аналитической точностью в очень малых количествах ткани (всего 0,005 нг). Затем данные об экспрессии используются для вычисления GPS. Этот анализ оценивает степень злокачественности опухоли и помогает врачам принять решение о том, придерживаться ли тактики активного наблюдения за пациентом или перейти к немедленному лечению (если GPS выше 20) [60]. Каждое увеличение GPS на 20 пунктов связано с повышением риска высокой степени злокачественности рака в 2,3 раза [61].
Определение GPS имело высокую прогностическую значимость для оценки агрессивности рака и неблагоприятных явлений, таких как рецидив после радикальной простатэктомии, отрицательных патоморфологических результатов при операции и появления метастазов [62].
3.5. Анализ Prolaris
Тест Prolaris представляет собой еще один полигенный геномный анализ, направленный на стратификацию риска рака. Этот тест был разработан Myriad Genomics Inc. (Солт-Лейк-Сити, Юта, США) для исследования фиксированных в формалине и заключенных в парафиновые блоки образцов ткани, полученных при биопсии или простатэктомии. В этом анализе измеряют экспрессию 31 гена, участвующего в прогрессировании клеточного цикла (CCP), а затем нормализуют ее до уровней экспрессии 15 конститутивных генов (генов «домашнего хозяйства») [63]. Cuzick и соавт. впервые показал высокое прогностическое значение оценки CCP для таких исходов рака как летальность [64]. Увеличение показателя CCP на одну единицу было связано с увеличением риска опасности (РО) летального исхода на 2,57 с высоким значением (p = 8,2 × 10-11) [64]. Затем эта корреляция была подтверждена [65, 66] с предположением, что оценка CCP может служить независимым маркером для прогнозирования неблагоприятных явлений, таких как летальный исход при раке предстательной железы.
После анализа всех доступных клинических и патоморфологических данных оценка CCP показала высокую прогностическую точность в предположении результатов простатэктомии, таких как рецидив после хирургического вмешательства [67]. Таким образом, подтвердилось клиническое значение оценки CCP для прогнозирования рецидива рака после простатэктомии (РО 1,47, p = 4,7 × 10-5) и метастазирования (РО 4,9, p = 8,2 × 10-6) [68]. Более того, в нескольких исследованиях была показана значимость этого маркера для повышения выявляемости пациентов, которым рекомендовано активное наблюдение, и избежания ненужных повторных биопсий [69-72].
Внедрение оценки CCP оказало значительное влияние на выбор терапевтической тактики в пользу интервенционной или неинтервенционной терапии в клинической практике. Например, Crawford и соавт. [69] сообщил, что после теста CCP в общей сложности число пациентов, которым было рекомендовано хирургическое лечение и лучевая терапия, сократилось на 49,5% и 29,6%, соответственно, по сравнению с изначальными рекомендациями врача. Таким образом, после теста CCP наблюдалось увеличение числа пациентов, которым рекомендована смена терапии с неинтервенционной на интервенционную, на 23,4% по сравнению с рекомендациями врача до результатов теста [69]. Анализ большой когорты пациентов, не получавших никакой терапиюи n = 1206) с недавно диагностированным раком из проспективного реестра PROCEDE-1000 показал, что использование оценки CCP привело к важным изменениям в решениях врачей [71]. Фактические изменения произошли в стратегии лечения 47,8% пациентов, из которых у 72,1% было уменьшение объема лечения, а у 26,9% - его увеличение [71].
3.6. Подтверждение MDX
Значительной части мужчин с первоначально отрицательной биопсией будет выполнена повторная биопсия при увеличении уровня ПСА. В этой популяции индукция злокачественности в предстательной железе может быть связана с эпигенетическими изменениями (такими как метилирование ДНК) в промоторах различных генов. До настоящего времени в раковых клетках предстательной железы было обнаружено более 50 гиперметилированных локусов [72]. Как правило, гиперметилирование промотора подавляет экспрессию гена. Компания MDx Health (Ирвин, Калифорния, США) разработала анализ для измерения метилирования ДНК в генах-супрессорах опухолей GSTP1, APC и RASSF1 у мужчин с гистологически нормальной биопсией и 90% ОПЗ для оценки риска дальнейшего выявления рака предстательной железы [73]. Экспрессия GSTP1, APC и RASSF1 при раке предстательной железы эпигенетически ингибируется с помощью гиперметилирования промотора [74-76].
По сравнению с другими факторами риска измерение метилирования ДНК в гистопатоморфологически отрицательных биопсиях было наиболее значимым предиктором рака высокой степени злокачественности, приводящего к ОПЗ 96% и AUC 0,762 (при низком уровне метилирования ДНК) [77]. Van Neste с соавт. [77] разработал EpiScore - алгоритм, основанный на плотности метилирования ДНК APC, GSTP1 и RASSF1. Сочетание EpiScore с другими факторами риска (возраст, гистопатология первой отрицательной биопсии) дает возможность с высокой точностью обнаруживать рак высокой степени злокачественности в положительных по ДНК-метилированию, гистологически нормальных биопсиях. Реализация этого алгоритма привела к значительному улучшению стратификации риска пациентов и превосходила алгоритмы прогнозирования текущего риска, такие как ПСА и калькулятор рисков рака предстательной железы (PCPTRC). Использование этого алгоритма может значительно уменьшить количество ненужных повторных биопсий. Однако несмотря на высокую эффективность и клиническую значимость для выявления рака высокой степени злокачественности при гистологически отрицательных биопсиях, необходимы более тщательные исследования, прежде чем он может быть использован в широкой клинической практике.
3.7. Prostarix
Данный тест разработан в лаборатории CLIA в Metabolon Inc. (Моррисвиль, Северная Каролина, США) и проводится в Boswick Laboratories (Орландо, Флорида, США). Prostarix помогает клиницистам принять решение о проведении биопсии у пациентов, относящихся к «серой зоне» (т. е. подозрительное ПРИ и ПСА 2,5-10 нг/мл) (рис. 1). Тест основан на количественном определении четырех метаболитов, ассоциированных со злокачественной опухолью предстательной железы: саркозина, аланина, глицина и глутамата в осадке центрифугированной мочи, взятой после ПРИ, с использованием метода жидкостной хроматографии и масс-спектрометрии. В линии опухолевых клеток NCI-60 активация пути биосинтеза митохондриального глицина и увеличение потребления глицина была связана с повышенной пролиферацией клеток [78]. Саркозин (N-метилглицин) необходим для индукции инвазии клеток рака предстательной железы [79]. Количественные данные о содержании этих аминокислот в моче используются для расчета показателя риска Prostarix (ПРР), который помогает выявлять опухоль-ассоциированные метаболические аномалии. ПРР прогнозирует вероятность положительного результата биопсии. Например, ПРР 55 указывает на 55% вероятность положительного результата биопсии. Используя этот анализ, McDunn с соавт. [80] оценил в общей сложности 509 образцов ткани после простатэктомии (в 331 выявлено наличие опухоли и в 178 ее отсутствие) и определил различные профили метаболитов между раковыми клетками и нормальными клетками ткани предстательной железы. Использование профилирования метаболитов привело к улучшению прогноза 5-летнего рецидивирования (AUC от 0,53 до 0,64) и возможности органосохраняющего лечения (AUC от 0,53 до 0,62). Эти результаты делают метаболические профили перспективными для диагностики рака предстательной железы, однако требуются дополнительные исследования для разработки, а затем проверки новых метаболических маркеров и диагностических анализов.
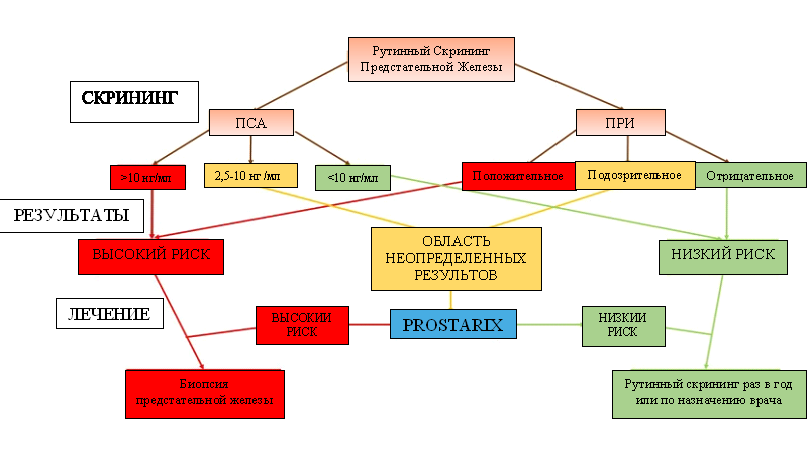 Рисунок 1. Анализ Prostarix используется для принятия решения о назначении биопсии пациентам, находящимся в «серой зоне» (например, подозрительное пальцевое ректальное исследование (ПРИ) и умеренно повышенный сывороточный простат-специфический антиген (ПСА) (2,5-10 нг/мл))
Рисунок 1. Анализ Prostarix используется для принятия решения о назначении биопсии пациентам, находящимся в «серой зоне» (например, подозрительное пальцевое ректальное исследование (ПРИ) и умеренно повышенный сывороточный простат-специфический антиген (ПСА) (2,5-10 нг/мл))
4. Циркулирующие экзосомы и клетки рака предстательной железы
Одним из перспективных потенциальных биомаркеров являются экзосомы, связанные со злокачественной опухолью предстательной железы, которые могут доставлять различные проонкогенные молекулы от одной раковой клетки к другой и от раковых к нормальным клеткам для индуцирования злокачественной трансформации [81]. Exosome Diagnostics Inc. (Кембридж, Массачусетс, США) разработала Intelliscore ExoDx – анализ мочи на содержание экзосом, который представляет собой тест на экзосомальную РНК для оценки экспрессии ERG, ПСА3 и SPDEF (генов, играющих значительную проонкогенную роль) [82]. С помощью этого теста удалось повысить точность диагностики рака предстательной железы высокой степени злокачественности (по шкале Глисона ≥ 7 (3 + 4)) с ОПЗ > 0,9 у мужчин в возрасте ≥ 50 лет с ПСА 2-10 нг/мл, которым была выполнена первичная биопсия [82]. Этот тест может быть эффективен для стратификации риска и для сокращения числа пациентов, которым будет назначена повторная биопсия.
Другим перспективным диагностическим инструментом является определение циркулирующих клеток рака предстательной железы (CPTCs). Эти клетки очень редко обнаруживаются в крови [83], но их наличие можно точно обнаружить различными методами, включая одобренную FDA CellSearch System (Janssen Diagnostics, LLC, Раритан, Нью-Джерси, США) [84]. У людей, не страдающих онкологическими заболеваниями, CPTCs отсутствуют. Было установлено, что CPTCs являются значимыми для стратификации риска рака, оценки выживаемости пациентов, выбора противоопухолевых препаратов и других целей [85].
5. Заключение
В настоящее время наблюдается значительный прогресс в поиске и разработке новых биомаркеров для диагностики рака предстательной железы. Важно отметить, что новые маркеры позволяют не только выявлять рак предстательной железы в первичных биопсиях, но также определять стадию болезни и разрабатывать тактику лечения, например, принимать решение о необходимости выполнения повторной биопсии, что может помочь предотвратить гипердиагностику и избыточное лечение пациентов. В таблице 2 представлены новые современные биомаркеры. Этот пул биомаркеров может использоваться для решения различных диагностических и прогностических задач, таких как первичный скрининг, стратификация риска, прогнозирование неблагоприятных исходов, принятие решений о выполнении повторной биопсии, отбор кандидатов для интенсивной терапии или активного наблюдения. Клинические исследования показали, что объединение нескольких маркеров (анализов) приводит к более точной диагностике и/или прогнозированию рака предстательной железы.
Таблица 2. Резюме недавно разработанных, одобренных FDA биомаркеров и маркеров, предлагаемых для сертификации CLIA для выявления или стратификации риска рака предстательной железы.
Сокращения: APC – аденоматозный полипоз толстой кишки; AUC – область под кривой; ПРИ – пальцевое ректальное исследование; GSTP1-глютатион-S-трансфераза P; ОПЗ - отрицательное; ПСА3 простат-специфический антиген 3; ППВ – положительное прогностическое значение; ПСА - простат-специфический антиген; RASSF1Ras – связывающий домен-содержащий белок 1.
Недавние достижения в оценке экспрессии генов в сочетании с более полным пониманием роли различных генов в злокачественной трансформации клеток дали возможность улучшить методы диагностики и терапии, что может помочь решить общие проблемы при лечении рака предстательной железы: переменную эффективность доступных методов лечения и развитие резистентности к терапии [96]. Исход лечения может улучшить сопоставление отдельных аберраций генов, наблюдаемых в клетках рака предстательной железы, с доступными методами хемо- или иммунотерапии, и их комбинаций. В этой связи приоритетным направлением в разработке новых диагностических инструментов для лечения рака предстательной железы является улучшение генетического анализа образцов биопсии, а также экзосом и циркулирующих раковых клеток.
Работа выполнена при поддержке Российского научного фонда (грант № 14-15-00112). Авторы выражают благодарность доктору Екатерине Ивановой, XPE Pharma & Science, Бельгия за редактирование окончательной версии текста.
Список литературы
Том 52, часть 1, октябрь 2018, стр. 9-16
Д. А. Чистяков, В. А. Масоедова, А. В. Гречко, А. А. Мельниченко, А. Н. Орехов
doi.org
Аннотация
Диагностика и лечение локализованного рака предстательной железы является сложной задачей из-за гетерогенности этого заболевания и неодинаковой скорости прогрессирования в различных подгруппах пациентов. Анализ на наличие простат-специфического антигена (ПСА) и его производных, одобренный FDA (Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США), как основной биомаркер рака предстательной железы не является достаточно специфичным для диагностики заболевания, особенно когда речь идет о высокой степени его злокачественности (по шкале Глисона ≥ 7). На сегодняшний день был разработан ряд новых биомаркеров, часть которых предназначены для скрининга, в то время как другие могут успешно применяться для стратификации риска, выявления опухолей высокой степени злокачественности и прогнозирования неблагоприятных явлений. Два маркера, такие как проПСА (часть Индекса здоровья предстательной железы (PHI)) и простат-специфический антиген 3 (ПСА3, часть теста ПСА3 Progensa), были недавно одобрены Управлением по контролю за качеством пищевых продуктов и лекарственных препаратов США для клинического использования. Другие маркеры пока не одобрены, но доступны в клинических лабораториях, сертифицированных CLIA (Clinical Laboratory Improvement Amendments). В этом обзоре мы рассматриваем применение данных маркеров и их диагностическую и прогностическую ценность в отношении диагностики рака предстательной железы.
Ключевые слова: рак предстательной железы, биомаркеры, диагностика, прогноз, простат-специфический антиген.
1. Введение
Локализованный рак предстательной железы является одним из наиболее распространенных типов рака у мужчин в промышленно развитых странах, и заболеваемость им продолжает расти [1]. В большинстве случаев рак предстательной железы развивается медленно, хотя встречаются и агрессивные, быстропрогрессирующие формы. Разработка эффективных биомаркеров рака предстательной железы имеет важное значение для надлежащего скрининга населения, определения групп высокого риска и обеспечения ранней диагностики групп заболевших с высокой степенью злокачественности опухоли.
Существует несколько типов молекулярных маркеров, которые могут быть использованы для диагностики, оценки риска и прогрессирования рака предстательной железы. Предиктивные маркеры могут быть полезны для оценки клинических исходов лечения. Прогностические маркеры имеют клиническое значение для оценки риска неблагоприятных явлений, вплоть до смерти пациента, рецидива опухоли или ее метастазирования [2].
На сегодняшний день единственным биомаркером, одобренным FDA для выявления и прогнозирования развития рака предстательной железы, является простат-специфический антиген (ПСА) [3]. ПСА представляет собой калликреин – сериновую протеазу, секретируемую эпителиальными клетками предстательной железы, которая в основном участвует в разжижении спермы человека по протеолитическому механизму [4]. Первоначально внедрение ПСА в клиническую практику приводило к увеличению частоты выявления мужчин с ранней стадией рака предстательной железы [5]. Кроме того, были предприняты усилия по разработке стадирования рака предстательной железы на основе определения ПСА и использования этого маркера в прогностических целях [6].
Однако применение ПСА как диагностического и прогностического маркера рака предстательной железы показало серьезные ограничения и несогласованность результатов, так как на самом деле ПСА является не опухоль-специфичным, а орган-специфичным маркером. Эта протеаза в нормальных условиях продуцируется эпителиальными клетками предстательной железы в небольшом количестве и резко увеличивается при прогрессировании от доброкачественной гиперплазии предстательной железы до рака предстательной железы и при дальнейшем развитии злокачественной опухоли [7]. У мужчин старше 60 лет уровень ПСА увеличивается, что снижает чувствительность теста на ПСА при диагностике рака предстательной железы [8]. Кроме того, повышенный уровень ПСА может наблюдаться при остром простатите [9]. Напротив, уровень ПСА может быть снижен у мужчин, которые лечатся специфическими терапевтическими агентами с антиандрогенными эффектами, такими как ингибиторы 5-α редуктазы [10]. Кроме того, соотношение уровня ПСА и степени злокачественности рака предстательной железы довольно условное, что ограничивает его использование для классификации [11]. В совокупности эти недостатки снижают клиническую эффективность определения ПСА в сыворотке крови для скрининга и прогноза развития рака предстательной железы.
Таким образом, поиск новых маркеров рака предстательной железы должен быть нацелен не только на обнаружение диагностически значимых маркеров, но и на оценку риска развития заболевания, и на мониторинг прогрессирования заболевания. В этом обзоре мы рассмотрим ряд новых молекулярных маркеров, которые потенциально могут повысить эффективность скрининга, диагностики и лечения рака предстательной железы.
2. Оценка клинической значимости биомаркеров рака
Разработка новых биомаркеров требует определения их роли и значимости в канцерогенезе предстательной железы. Для проверки потенциальной клинической пользы биомаркера и валидации у пациентов необходимо оценивать его чувствительность, специфичность, площадь под ROC-кривой (AUC), прогнозируемое значение (положительное и отрицательное) и другие параметры [12]. Существует много потенциальных биомаркеров рака, но лишь немногие из них достаточно надежны в отношении истинной аналитической и клинической ценности и соответствуют критериям отбора FDA для клинического использования. Более того, одобрение FDA не является гарантией успешного клинического применения биомаркера, как это было в случае с ПСА, который, однако, все еще широко используется при обычном скрининге рака предстательной железы [13].
Важной предпосылкой для внедрения потенциального биомаркера в клиническую практику является его положительная оценка. Тем не менее, существует множество препятствий, которые могут снизить значимость биомаркера в реальном клиническом применении после валидации. Например, биомаркер может успешно применяться в диагностике рака предстательной железы, но не показывать результаты лечения или не иметь достаточной прогностической точности появления опухоль-ассоциированных неблагоприятных явлений. Такой биомаркер будет характеризоваться высокой эффективностью в сочетании с ограниченной клинической значимостью [14]. Поэтому внедрению биомаркера в широкую клиническую практику должны предшествовать исследования, оценивающие именно эти аспекты. В последние годы были разработаны новые методы теоретической оценки клинической значимости потенциальных биомаркеров с учетом различных факторов, которые влияют на эффективность маркера в реальной практике, - например, компьютерное моделирование. Предсказать положительные эффекты биомаркера или диагностического анализа на клинические решения с помощью спектра теоретических пороговых вероятностей для вмешательств может помочь анализ кривой принятия решений (DCA) [15].
3. Новые диагностические биомаркеры рака предстательной железы
3.1. Индекс здоровья предстательной железы и проПСА
ПроПСА представляет собой неактивный предшественник ПСА, который имеет лидерную последовательность семи аминокислот, называемых (-7) проПСА. У людей калликреины-2 и -4 участвуют в активации ПСА путем расщепления последовательности пролидера [16]. Частичное расщепление последовательности пролидера приводит к образованию нескольких изоформ проПСА, из которых в образцах рака предстательной железы преобладает (-2) проПСА [17]. Одним из инструментов, позволившим улучшить диагностику рака предстательной железы, является индекс здоровья предстательной железы (PHI), который может быть рассчитан как функция отношения (-2) проПСА, свободного ПСА и общего ПСА. Другая форма ПСА неактивна, поскольку протеаза связана с ингибитором, таким как α1-антитрипсин, α1-антихимотрипсин или α2-макроглобулин [18]. Определение PHI включает в себя измерение трех форм ПСА (общего ПСА, свободного ПСА и (-2) проПСА) в сыворотке крови. Эта формула также полезна для дифференциальной диагностики доброкачественной гиперплазии предстательной железы и рака предстательной железы у пациентов с подозрением на рак. Оценка PHI была разработана американской компанией Beckman Coulter Inc. (Brea, CA), подтверждена Catalona и соавт. [19], затем достоверность повторно оценивалась многочисленными многоцентровыми клиническими исследованиями в разных странах [20-24]. Резюме клинических исследований валидации для теста PHI представлено в таблице 1.
Таблица 1. Обзор клинических исследований оценки индекса здоровья предстательной железы (PHI)
| Тип исследования | Структура исследования | Количество пациентов | AUC Рак предстательной железы (любая стадия) | По шкале Глисона ≥ 3 + 4 | Ссылка |
| Проспективный скрининг в Чикаго, Иллинойс | Критерии для биопсии: сывороточный уровень ПСА > 2,5 нг/мл или результат ПРИ | 2034 | 0,77 | - | [86] |
| Наблюдательное проспективное исследование | Участники из Роттердамского отдела исследования ERSPC (группа 1) и Инсбрукского медицинского университета (группа 2) | 405 (1) 351 (2) | 0,75 (1) 0,709 (2) | - | [86] |
| Проспективное многоцентровое исследование (США) | Пациенты без рака предстательной железы в анамнезе, ПСА 2-10 нг/мл, кор-биопсия из шести или более участков и нормальное ПРИ | 892 | 0,703 | 0,724 (Глисон 4 + 3) | [19] |
| Наблюдательное проспективное исследование (Милан, Италия) | Пациенты с запланированной биопсией, общий уровень ПСА 2-10 нг/мл и нормальное ПРИ в другом медицинском учреждении | 268 | 0.83 | 0,81 | [88] |
| Проспективная наблюдательная программа оценки (Милан, Италия) | Пациенты с 1 или 2 предшествующими отрицательными результатами биопсии с подозрением на рак предстательной железы | 222 (71 - рак предстательной железы) | 0,78 | - | [89] |
| Наблюдательное проспективное когортное исследование | Пациенты из пяти европейских центров, после первичной биопсии, сывороточный ПСА 2-10 нг/мл | 646 | 0,712 | 0,672 | [21] |
| Гнездовое исследование случай-контроль | Участники многоцентрового европейского проекта PROMEtheuS, которым назначена биопсия. 15,4% участников относятся к первой группе риска рака предстательной железы | 1026 | 0,76 | - | [90] |
| Ретроспективное многоцентровое исследование (Германия) | Пациенты в возрасте > 50 лет с отрицательным результатом ПРИ, подвергнутые первичной биопсии, ПСА 4-10 нг/мл | 1362 | 0,75 | - | [91] |
| Проспективное многоцентровое исследование (США) | Пациенты без рака предстательной железы в анамнезе, ПСА 2-10 нг/мл, кор-биопсия из шести или более участков и нормальное ПРИ с повторным определением значений ПСА ВОЗ | 892 | 0,704 | - | [20] |
| Наблюдательное проспективное исследование (Наполи, Италия) | Пациенты в возрасте > 50 лет после первичной биопсии, без предшествующей операции, ПСА 2-10 нг/мл | 300 (108 - рак предстательной железы) | 0,77 | - | [43] |
| Многоцентровая внешняя оценка анализа PHI (Европа) | Пациенты после первичной и повторной биопсии в другом медицинском учреждении | 833 (365 - рак предстательной железы) | 0,68 | - | [22] |
| Ретроспективное исследование (Гонконг, Китай) | Пациенты в возрасте > 50 лет с нормальным ПРИ, после первичной биопсии, ПСА 4-10 нг/мл | 231 | 0,792 | - | [92] |
| Наблюдательная проспективная оценка (Шанхай, Китай) | Пациенты после первичной биопсии в другом медицинском учреждении | 636 | 0,88 (все пациенты) 0,73 (ПСА 2–10 мг/мл) 0,81 (ПСА 10,1–20 мг/мл) 0,9 (ПСА > 20 мг/мл) | - | [93] |
| Сравнительное исследование между двумя диагностическими панелями | Пациенты после первичной биопсии, ПСА 3-15 нг/мл (Стокгольм, Швеция) | 531 | 0,704 | 0,711 | [94] |
| Гнездовое исследование случай-контроль | Участники многоцентрового европейского проекта PROMEtheuS в возрасте < 60 лет, которым назначена биопсия | 1036 | 0,77 | - | [95] |
| Проспективная многоцентровая оценка в США | Пациенты с нормальным ПРИ в возрасте ≥ 50 лет, которым назначена биопсия, сывороточный ПСА 4-10 нг/мл | 658 | 0,707 | 0,708 | [25] |
| Ретроспективное многоцентровое исследование (США) | Когорта 1 (первичная) была зарегистрирована в Бостоне, Массачусетс. 20,3% когорты имеют позднюю стадию (по шкале Глисона ≥ 3 + 4). Когорта 2 (валидация) была зарегистрирована в Мичигане. 30,9% когорты имеют позднюю стадию (по шкале Глисона ≥ 3 + 4) рак | 561 (1) 395 (2) | - | 0,815 | [23] |
| Проспективное многоцентровое исследование (Европа) | Пациенты в возрасте ≤ 65 лет, которым запланирована первичная и повторная биопсия, ПСА 1,6-8 нг/мл | 792 | 0,73 (все пациенты) 0,68 (первичная биопсия) 0,78 (повторная биопсия) | 0,72 | [24] |
Сокращения: AUC - площадь под Roc-кривой; ПРИ - пальцевое ректальное исследование; ERSPC - Европейское рандомизированное исследование по скринингу рака предстательной железы; PROMEtheuS проПСА - Многоцентровое европейское исследование; ПСА - простат-специфический антиген.
В первичном исследовании Catalona и соавт. [19] показали достоверность оценки PHI для выявления рака предстательной железы с оценкой по шкале Глисона 3 + 4 и выше, с AUC 0,703 по результатам биопсии у мужчин с опухолью иной локализации, при значении общего ПСА 2-10 нг/мл. Loeb и соавт., при биопсии у мужчин с общим ПСА 4-10 нг/мл, было получено аналогичное значение AUC (т.е. 0,707) [25], тем самым повторяя значение показателя PHI для выявления стадии болезни по шкале Глисона 3 + 4 и выше. В этом клиническом исследовании была использована AUC 0,707 для определения дифференцировки заболевания по шкале Глисона 3-й и 4-й степени. De la Calle и соавт. [23] использовали AUC 0,815 для определения стадии рака предстательной железы (степень 3 + 4 и выше), что подтверждает результаты Loeb и соавт. [25].
Недавний метаанализ 24 клинических исследований сообщил о диагностических характеристиках показателя PHI для выявления рака предстательной железы следующее: совокупная специфичность 0,34, чувствительность 0,89, AUC 0,76 [26]. Для поздней стадии заболевания тест PHI показал совокупную специфичность 0,34, чувствительность 0,93, AUC 0,82. Эти данные продемонстрировали высокую способность PHI к распознаванию агрессивного рака предстательной железы: недавний метаанализ показал совокупную специфичность 0,17 и чувствительность 0,90 для определения стадии болезни по шкале Глисона 3-й и 4-й степени [27]. У пациентов после радикальной простатэктомии было установлено, что PHI ассоциируется с неблагоприятными характеристиками рака предстательной железы [17]. Кроме того, FDA недавно одобрило проПСА и PHI для клинического применения в качестве диагностического маркера [28].
3.2. Простат-специфический антиген 3 (ПСА3)
Вторым молекулярным маркером для выявления рака предстательной железы, одобренным FDA, является простат-специфический антиген 3 (ПСА3) [29]. ПСА3 представляет собой простат-специфическую некодирующую РНК, которая обладает высокой экспрессией в клетках рака предстательной железы [30]. Было обнаружено, что ПСА3 регулирует выживаемость клеток посредством контроля сигнализации андрогенных рецепторов (АР) и экспрессии кофакторов АР и генов, участвующих в проканцерогенном эпителиально-мезенхимальном переходе [31, 32]. Интересно, что при заболеваниях, не связанных со злокачественной опухолью предстательной железы, таких как доброкачественная гиперплазия предстательной железы, атипическая малая ацинарная пролиферация, простатит и простатическая интраэпителиальная неоплазия, экспрессия ПСА3 отсутствует [33]. Эти особенности делают ПСА3 перспективным для клинического использования.
Тест на основе ПСА3, разработанный Progensa (Мальборо, Массачусетс, США), представляет собой количественное определение РНК ПСА3 и ПСА в анализах мочи у мужчин с повышенным уровнем ПСА в сыворотке крови и отрицательной первичной биопсией предстательной железы. Количественная оценка выполняется с помощью ПЦР с обратной транскрипцией (RT-PCR), которая, в свою очередь, позволяет рассчитать показатель ПСА3 (отношение транскриптов ПСА3 к транскриптам ПСА). Этот показатель может помочь врачам определить необходимость повторной биопсии у мужчин старше 50 лет, которым уже была сделана одна или несколько биопсий [34]. Показатель ПСА3 < 25 указывает на низкий риск индукции рака предстательной железы, в то время как более высокое значение указывает на повышенную вероятность выявления рака предстательной железы при биопсии [35]. На практике многие исследователи используют порог оценки показателя ПСА3 в 35 [36-38]. Было показано, что выбор значения для точки отсчета существенно влияет на специфичность, чувствительность и прогностическую ценность оценки ПСА3: так, установление минимального значения на уровне 20 значительно улучшает диагностическую точность этого маркера, в то время как значение 35 уменьшает количество ненужных образцов, рекомендованных для проведения повторной биопсии [37, 39, 40]. Недавний метаанализ с использованием точки отсчета 20 в сравнении с 35 показал общую чувствительность 0,93 против 0,80, специфичность 0,65 против 0,44, AUC 0,85 против 0,72, положительное прогностическое значение (ППЗ) 1,86 против 1,58, отрицательное прогностическое значение (ОПЗ) 0,81 против 0,43 и отношение шансов диагностики (ОШД) 5,73 против 3,45 [40]. Следовательно, значение точки отсчета 20, по-видимому, имеет большее диагностическое значение по сравнению с 35.
Cui и соавт. [41] обобщили результаты 46 клинических исследований по определению ПСА3 в моче, в которых приняли участие 12 295 пациентов. Диагностическое значение определения ПСА3 было выше, чем определения общего ПСА и его производных, таких как свободный ПСА, процентное значение свободного ПСА, скорость ПСА (отражает скорость увеличения уровня ПСА), отношение свободного ПСА к общему ПСА [42-44]. Использование комбинации ПСА3 с PHI улучшило эффективность отбора пациентов для выполнения первичной биопсии с общей диагностической точностью 0,77 [43, 45]. В совокупности эти данные показывают, что ПСА3 имеет высокую диагностическую эффективность и значимость для выявления пациентов группы высокого риска. Более того, образец мочи для определения ПСА3 можно легко получить после пальцевого ректального исследования (ПРИ). Однако наблюдалось, что этот тест может быть эффективным только при прогнозировании первой повторной биопсии [42].
3.3. Определение TMPRSS2:ERG и mi-PROSTATE
Помимо PHI и оценки ПСА3 разрабатываются другие диагностические тесты, некоторые из которых в настоящее время проходят сертификацию в соответствии с Резолюцией по улучшению работы клинических лабораторий (CLIA). Одним из таких тестов является определение TMPRSS2:ERG на основе экспрессии гибридного гена, специфичного для рака предстательной железы. Наиболее распространенным генетическим изменением при биопсии локализованного первичного рака предстательной железы у 43-50% кавказских мужчин является слияние TMPRSS2:ERG [46-48]. Распространенность этого слияния при метастазировании гормонозависимого рака предстательной железы ниже (около 30%), что может указывать на его участие в переходе рака на стадию инвазии [48]. Ген TMPRSS2 кодирует проонкогенную трансмембранную сериновую протеазу 2, которая регулируется андрогенными гормонами в клетках предстательной железы, однако функция этой протеазы пока неизвестна. Слияние с ERG транскрипционного фактора ETS приводит к независимости андрогенов через нарушение сети передачи сигналов, опосредованной андрогенным рецептором [49]. TMPRSS2:ERG онкоген также может служить медиатором опухолевой прогрессии в метастатической фазе путем повышения регуляции медиатора клеточной миграции плексина B1 [50].
В качестве очередного биомаркера для диагностики рака предстательной железы было предложено обнаружение транскриптов TMPRSS2:ERG в пост-ПРИ анализах мочи. Несколько проспективных наблюдательных исследований показали прогностическую ценность слияния этих генов при раке предстательной железы [51, 52]. Недавний метаанализ 32 исследований показал следующие диагностические характеристики слияния TMPRSS2:ERG: чувствительность пула 0,474, специфичность 0,926, ППЗ 8,94 и ОПЗ 0,49 [53]. Чтобы повысить чувствительность и, следовательно, диагностическую точность, определение TMPRSS2:ERG можно комбинировать с другими маркерами [54]. Например, Мerdan с соавт. [55] сообщил, что одновременное использование оценки ПСА3 (порог 25) и TMPRSS2:ERG (минимальное значение 10) помогло избежать > 50% повторных биопсий.
Медицинским центром при Мичиганском университете была разработана еще одна новая диагностическая система оценки - Mi-PROSTATE. Предлагаемый алгоритм включает совместное использование определения TMPRSS2:ERG в моче, тест Progensa на ПСА3 и сывороточного ПСА для оценки риска развития рака, который потенциально указывает на вероятность развития агрессивного рака. В небольшом исследовании (48 пациентов с ПСА ≥ 10 нг/мл) Salami с соавт. [56] показал, что сочетание этих маркеров является более эффективным (специфичность 0,9, чувствительность 0,8, AUC 0,88) для прогнозирования рака при последующей биопсии по сравнению с определением каждого маркера отдельно. Аналогичным образом добавление ПСА3 и TMPRSS2:ERG к тестовой панели значительно повысило эффективность определения сывороточного ПСА для прогнозирования рака предстательной железы (AUC 0,693 против 0,585 для изолированного ПСА) и рака высокой степени злокачественности (оценка по шкале Глисона > 3 + 3, AUC 0,729 против 0,651 для изолированного ПСА) [57]. Ретроспективное исследование показало, что сочетание клинических и биологических (андрогенного статуса) переменных с генетическими (генотипы rs1447295 и rs6983267), а также диагностических (маркер ПСА3, плотность ПСА и определение TMPRSS2:ERG) могут значительно улучшить выявление локализованного рака предстательной железы [58].
3.4. Онкотайп DX геномный показатель предстательной железы (GPS)
Геномный показатель предстательной железы (GPS) был разработан Genomic Health (Редвуд-Сити, Калифорния, США) и основан на количественной оценке экспрессии 12 генов, влияющих на агрессивность рака предстательной железы и 5 референсных генов [59]. Выбранные для этого геномного теста опухоль-ассоциированные гены участвуют в пролиферации (TPX2), синтезе андрогенов (RAM13C, KLK2, AZGP1, SRD5A2), стромальном ответе (COL1A1, SFRP4, BGN) и клеточной организации (GSTM2, GSN, FLNC, TPM2). Анализ Онкотайп DX был специально разработан для оценки образцов пункционной биопсии предстательной железы и поэтому способен обнаруживать транскрипты РНК с высокой аналитической точностью в очень малых количествах ткани (всего 0,005 нг). Затем данные об экспрессии используются для вычисления GPS. Этот анализ оценивает степень злокачественности опухоли и помогает врачам принять решение о том, придерживаться ли тактики активного наблюдения за пациентом или перейти к немедленному лечению (если GPS выше 20) [60]. Каждое увеличение GPS на 20 пунктов связано с повышением риска высокой степени злокачественности рака в 2,3 раза [61].
Определение GPS имело высокую прогностическую значимость для оценки агрессивности рака и неблагоприятных явлений, таких как рецидив после радикальной простатэктомии, отрицательных патоморфологических результатов при операции и появления метастазов [62].
3.5. Анализ Prolaris
Тест Prolaris представляет собой еще один полигенный геномный анализ, направленный на стратификацию риска рака. Этот тест был разработан Myriad Genomics Inc. (Солт-Лейк-Сити, Юта, США) для исследования фиксированных в формалине и заключенных в парафиновые блоки образцов ткани, полученных при биопсии или простатэктомии. В этом анализе измеряют экспрессию 31 гена, участвующего в прогрессировании клеточного цикла (CCP), а затем нормализуют ее до уровней экспрессии 15 конститутивных генов (генов «домашнего хозяйства») [63]. Cuzick и соавт. впервые показал высокое прогностическое значение оценки CCP для таких исходов рака как летальность [64]. Увеличение показателя CCP на одну единицу было связано с увеличением риска опасности (РО) летального исхода на 2,57 с высоким значением (p = 8,2 × 10-11) [64]. Затем эта корреляция была подтверждена [65, 66] с предположением, что оценка CCP может служить независимым маркером для прогнозирования неблагоприятных явлений, таких как летальный исход при раке предстательной железы.
После анализа всех доступных клинических и патоморфологических данных оценка CCP показала высокую прогностическую точность в предположении результатов простатэктомии, таких как рецидив после хирургического вмешательства [67]. Таким образом, подтвердилось клиническое значение оценки CCP для прогнозирования рецидива рака после простатэктомии (РО 1,47, p = 4,7 × 10-5) и метастазирования (РО 4,9, p = 8,2 × 10-6) [68]. Более того, в нескольких исследованиях была показана значимость этого маркера для повышения выявляемости пациентов, которым рекомендовано активное наблюдение, и избежания ненужных повторных биопсий [69-72].
Внедрение оценки CCP оказало значительное влияние на выбор терапевтической тактики в пользу интервенционной или неинтервенционной терапии в клинической практике. Например, Crawford и соавт. [69] сообщил, что после теста CCP в общей сложности число пациентов, которым было рекомендовано хирургическое лечение и лучевая терапия, сократилось на 49,5% и 29,6%, соответственно, по сравнению с изначальными рекомендациями врача. Таким образом, после теста CCP наблюдалось увеличение числа пациентов, которым рекомендована смена терапии с неинтервенционной на интервенционную, на 23,4% по сравнению с рекомендациями врача до результатов теста [69]. Анализ большой когорты пациентов, не получавших никакой терапиюи n = 1206) с недавно диагностированным раком из проспективного реестра PROCEDE-1000 показал, что использование оценки CCP привело к важным изменениям в решениях врачей [71]. Фактические изменения произошли в стратегии лечения 47,8% пациентов, из которых у 72,1% было уменьшение объема лечения, а у 26,9% - его увеличение [71].
3.6. Подтверждение MDX
Значительной части мужчин с первоначально отрицательной биопсией будет выполнена повторная биопсия при увеличении уровня ПСА. В этой популяции индукция злокачественности в предстательной железе может быть связана с эпигенетическими изменениями (такими как метилирование ДНК) в промоторах различных генов. До настоящего времени в раковых клетках предстательной железы было обнаружено более 50 гиперметилированных локусов [72]. Как правило, гиперметилирование промотора подавляет экспрессию гена. Компания MDx Health (Ирвин, Калифорния, США) разработала анализ для измерения метилирования ДНК в генах-супрессорах опухолей GSTP1, APC и RASSF1 у мужчин с гистологически нормальной биопсией и 90% ОПЗ для оценки риска дальнейшего выявления рака предстательной железы [73]. Экспрессия GSTP1, APC и RASSF1 при раке предстательной железы эпигенетически ингибируется с помощью гиперметилирования промотора [74-76].
По сравнению с другими факторами риска измерение метилирования ДНК в гистопатоморфологически отрицательных биопсиях было наиболее значимым предиктором рака высокой степени злокачественности, приводящего к ОПЗ 96% и AUC 0,762 (при низком уровне метилирования ДНК) [77]. Van Neste с соавт. [77] разработал EpiScore - алгоритм, основанный на плотности метилирования ДНК APC, GSTP1 и RASSF1. Сочетание EpiScore с другими факторами риска (возраст, гистопатология первой отрицательной биопсии) дает возможность с высокой точностью обнаруживать рак высокой степени злокачественности в положительных по ДНК-метилированию, гистологически нормальных биопсиях. Реализация этого алгоритма привела к значительному улучшению стратификации риска пациентов и превосходила алгоритмы прогнозирования текущего риска, такие как ПСА и калькулятор рисков рака предстательной железы (PCPTRC). Использование этого алгоритма может значительно уменьшить количество ненужных повторных биопсий. Однако несмотря на высокую эффективность и клиническую значимость для выявления рака высокой степени злокачественности при гистологически отрицательных биопсиях, необходимы более тщательные исследования, прежде чем он может быть использован в широкой клинической практике.
3.7. Prostarix
Данный тест разработан в лаборатории CLIA в Metabolon Inc. (Моррисвиль, Северная Каролина, США) и проводится в Boswick Laboratories (Орландо, Флорида, США). Prostarix помогает клиницистам принять решение о проведении биопсии у пациентов, относящихся к «серой зоне» (т. е. подозрительное ПРИ и ПСА 2,5-10 нг/мл) (рис. 1). Тест основан на количественном определении четырех метаболитов, ассоциированных со злокачественной опухолью предстательной железы: саркозина, аланина, глицина и глутамата в осадке центрифугированной мочи, взятой после ПРИ, с использованием метода жидкостной хроматографии и масс-спектрометрии. В линии опухолевых клеток NCI-60 активация пути биосинтеза митохондриального глицина и увеличение потребления глицина была связана с повышенной пролиферацией клеток [78]. Саркозин (N-метилглицин) необходим для индукции инвазии клеток рака предстательной железы [79]. Количественные данные о содержании этих аминокислот в моче используются для расчета показателя риска Prostarix (ПРР), который помогает выявлять опухоль-ассоциированные метаболические аномалии. ПРР прогнозирует вероятность положительного результата биопсии. Например, ПРР 55 указывает на 55% вероятность положительного результата биопсии. Используя этот анализ, McDunn с соавт. [80] оценил в общей сложности 509 образцов ткани после простатэктомии (в 331 выявлено наличие опухоли и в 178 ее отсутствие) и определил различные профили метаболитов между раковыми клетками и нормальными клетками ткани предстательной железы. Использование профилирования метаболитов привело к улучшению прогноза 5-летнего рецидивирования (AUC от 0,53 до 0,64) и возможности органосохраняющего лечения (AUC от 0,53 до 0,62). Эти результаты делают метаболические профили перспективными для диагностики рака предстательной железы, однако требуются дополнительные исследования для разработки, а затем проверки новых метаболических маркеров и диагностических анализов.
 Рисунок 1. Анализ Prostarix используется для принятия решения о назначении биопсии пациентам, находящимся в «серой зоне» (например, подозрительное пальцевое ректальное исследование (ПРИ) и умеренно повышенный сывороточный простат-специфический антиген (ПСА) (2,5-10 нг/мл))
Рисунок 1. Анализ Prostarix используется для принятия решения о назначении биопсии пациентам, находящимся в «серой зоне» (например, подозрительное пальцевое ректальное исследование (ПРИ) и умеренно повышенный сывороточный простат-специфический антиген (ПСА) (2,5-10 нг/мл))4. Циркулирующие экзосомы и клетки рака предстательной железы
Одним из перспективных потенциальных биомаркеров являются экзосомы, связанные со злокачественной опухолью предстательной железы, которые могут доставлять различные проонкогенные молекулы от одной раковой клетки к другой и от раковых к нормальным клеткам для индуцирования злокачественной трансформации [81]. Exosome Diagnostics Inc. (Кембридж, Массачусетс, США) разработала Intelliscore ExoDx – анализ мочи на содержание экзосом, который представляет собой тест на экзосомальную РНК для оценки экспрессии ERG, ПСА3 и SPDEF (генов, играющих значительную проонкогенную роль) [82]. С помощью этого теста удалось повысить точность диагностики рака предстательной железы высокой степени злокачественности (по шкале Глисона ≥ 7 (3 + 4)) с ОПЗ > 0,9 у мужчин в возрасте ≥ 50 лет с ПСА 2-10 нг/мл, которым была выполнена первичная биопсия [82]. Этот тест может быть эффективен для стратификации риска и для сокращения числа пациентов, которым будет назначена повторная биопсия.
Другим перспективным диагностическим инструментом является определение циркулирующих клеток рака предстательной железы (CPTCs). Эти клетки очень редко обнаруживаются в крови [83], но их наличие можно точно обнаружить различными методами, включая одобренную FDA CellSearch System (Janssen Diagnostics, LLC, Раритан, Нью-Джерси, США) [84]. У людей, не страдающих онкологическими заболеваниями, CPTCs отсутствуют. Было установлено, что CPTCs являются значимыми для стратификации риска рака, оценки выживаемости пациентов, выбора противоопухолевых препаратов и других целей [85].
5. Заключение
В настоящее время наблюдается значительный прогресс в поиске и разработке новых биомаркеров для диагностики рака предстательной железы. Важно отметить, что новые маркеры позволяют не только выявлять рак предстательной железы в первичных биопсиях, но также определять стадию болезни и разрабатывать тактику лечения, например, принимать решение о необходимости выполнения повторной биопсии, что может помочь предотвратить гипердиагностику и избыточное лечение пациентов. В таблице 2 представлены новые современные биомаркеры. Этот пул биомаркеров может использоваться для решения различных диагностических и прогностических задач, таких как первичный скрининг, стратификация риска, прогнозирование неблагоприятных исходов, принятие решений о выполнении повторной биопсии, отбор кандидатов для интенсивной терапии или активного наблюдения. Клинические исследования показали, что объединение нескольких маркеров (анализов) приводит к более точной диагностике и/или прогнозированию рака предстательной железы.
Таблица 2. Резюме недавно разработанных, одобренных FDA биомаркеров и маркеров, предлагаемых для сертификации CLIA для выявления или стратификации риска рака предстательной железы.
| Маркер (анализ) | Состав | Утверждение FDA | Точность | Предпочтительная область применения |
| ПроПСА и Индекс Здоровья Предстательной железы (PHI) | Общий ПСА, свободный ПСА,
(−2)проПСА | + | - Рак предстательной железы (любая степень злокачественности): AUC 0,76, специфичность 0,34, чувствительность 0,89
- рак предстательной железы (высокая степень злокачественности): AUC 0,82, специфичность 0,34, чувствительность 0,93 | - Первичный скрининг
- выявление рака предстательной железы высокой степени злокачественности |
| Оценка ПСА3 | ПСА3, общий ПСА | + | AUC 0,75, специфичность 0,73, чувствительность 0,65, ППЗ 2,23, ОПЗ 0,48 | Принятие решений о необходимости повторной биопсии |
| Определение TMPRSS2:ERG и mi-PROSTATE | TMPRSS2:ERG, ПСА3, общий ПСА (Mi-PROSTATE) | - | - Только TMPRSS2:ERG: специфичность 0,926, чувствительность 0,474, ППЗ 8,94, ОПЗ 0,49 - Mi-PROSTATE: специфичность 0,9, чувствительность 0,8; AUC 0,88 | - TMPRSS2:ERG: принятие решений о необходимости повторной биопсии - Mi-PROSTATE: выявление рака предстательной железы высокой степени злокачественности |
| Онкотайп DX геномный показатель предстательной железы (GPS) | 12 опухоль-ассоциированных генов и 5 референсных генов | - | Не сообщалось | Стратификация риска рака |
| Анализ Prolaris (CCP) | Оценка 31 опухоль-ассоциированного гена, участвующего в прогрессировании клеточного цикла (CCP) и 15 референсных генов | - | Не сообщалось | Стратификация риска рака (особенно прогнозирование летальных исходов) |
| Подтверждение MDX (EpiScore) | Метилирование APC, GSTP1, RASSF1 | - | AUC 0,762, ОПЗ 0,96 | - Принятие решений о необходимости повторной биопсии
- выявление рака предстательной железы высокой степени злокачественности |
| Показатель риска Prostarix | саркозин, аланин, глицин, глутамат | - | AUC 0,64 | Стратификация риска рака у пациентов «серой зоны» (т. е. подозрительное ПРИ и ПСА 2,5-10 нг/мл) |
Сокращения: APC – аденоматозный полипоз толстой кишки; AUC – область под кривой; ПРИ – пальцевое ректальное исследование; GSTP1-глютатион-S-трансфераза P; ОПЗ - отрицательное; ПСА3 простат-специфический антиген 3; ППВ – положительное прогностическое значение; ПСА - простат-специфический антиген; RASSF1Ras – связывающий домен-содержащий белок 1.
Недавние достижения в оценке экспрессии генов в сочетании с более полным пониманием роли различных генов в злокачественной трансформации клеток дали возможность улучшить методы диагностики и терапии, что может помочь решить общие проблемы при лечении рака предстательной железы: переменную эффективность доступных методов лечения и развитие резистентности к терапии [96]. Исход лечения может улучшить сопоставление отдельных аберраций генов, наблюдаемых в клетках рака предстательной железы, с доступными методами хемо- или иммунотерапии, и их комбинаций. В этой связи приоритетным направлением в разработке новых диагностических инструментов для лечения рака предстательной железы является улучшение генетического анализа образцов биопсии, а также экзосом и циркулирующих раковых клеток.
Работа выполнена при поддержке Российского научного фонда (грант № 14-15-00112). Авторы выражают благодарность доктору Екатерине Ивановой, XPE Pharma & Science, Бельгия за редактирование окончательной версии текста.
Список литературы
- R.L. Siegel, K.D. Miller. Jemal Cancer statistics, 2017. CA Cancer J. Clin., 267 (1) (2017), pp. 7-30.
- S. Mallett, et al. Reporting of prognostic studies of tumour markers: a review of published articles in relation to REMARK guidelines. Br. J. Cancer, 102 (1) (2010), pp. 173-180.
- H.G. Rittenhouse, et al. Human Kallikrein 2 (hK2) and prostate-specific antigen (PSA): two closely related, but distinct, kallikreins in the prostate. Crit. Rev. Clin. Lab. Sci., 35 (4) (1998), pp. 275-368.
- C.O. Madu, Y. Lu. Novel diagnostic biomarkers for prostate cancer. J. Cancer, 1 (2010), pp. 150-177.
- S.E. Ilyin, S.M. Belkowski, C.R. Plata-Salamán. Biomarker discovery and validation: technologies and integrative approaches. Trends Biotechnol., 22 (8) (2004), pp. 411-416.
- J. Pannek, A.W. Partin. The role of PSA and percent free PSA for staging and prognosis prediction in clinically localized prostate cancer. Semin. Urol. Oncol., 16 (3) (1998), pp. 100-105.
- W.J. Catalona, et al. Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer: results of a multicenter clinical trial of 6630 men. J. Urol., 197 (2S) (2017), pp. S200-S207.
- T.J. Bassler Jr., et al. Most prostate cancers missed by raising the upper limit of normal prostate-specific antigen for men in their sixties are clinically significant. Urology, 52 (6) (1998), pp. 1064-1069.
- P. Sindhwani, C.M. Wilson. Prostatitis and serum prostate-specific antigen. Curr. Urol. Rep., 6 (4) (2005), pp. 307-312.
- I.M. Zardawi. 5-Alpha reductase inhibitors and PSA screening for prostate cancer. Pathology, 46 (1) (2014), p. 91.
- M.R. Cooperberg, J.M. Broering, P.R. Carrollю Time trends and local variation in primary treatment of localized prostate cancer. J. Clin. Oncol., 28 (7) (2010), pp. 1117-1123.
- U.H. Stenman. Biomarker development, from bench to bedside. Crit. Rev. Clin. Lab. Sci., 53 (2) (2016), pp. 69-86.
- G.J. Kelloff, C.C. Sigman, H.I. Scher. Biomarker development in the context of urologic cancers. Urol. Oncol., 33 (6) (2015), pp. 295-301.
- S. McGrath, et al. Prostate cancer biomarkers: are we hitting the mark? Prostate Int., 4 (4) (2016), pp. 130-135.
- M. Fitzgerald, B.R. Saville, R.J. Lewis. Decision curve analysis. JAMA, 313 (4) (2015), pp. 409-410.
- J. Lövgren, et al. Activation of the zymogen form of prostate-specific antigen by human glandular kallikrein 2. Biochem. Biophys. Res. Commun., 238 (2) (1997), pp. 549-555.
- N. Fossati, et al. Preoperative prostate-specific antigen isoform p2PSA and its derivatives, %p2PSA and prostate health index, predict pathologic outcomes in patients undergoing radical prostatectomy for prostate cancer: results from a multicentric European prospective study. Eur. Urol., 68 (1) (2015), pp. 132-138.
- J.T. Wu, et al. Evaluation of free PSA isoforms, PSA complex formation, and specificity of anti-PSA antibodies by HPLC and PAGE-immunoblotting techniques. J.Clin. Lab. Anal., 9 (1) (1995), pp. 1-14.
- W.J. Catalona, et al. A multicenter study of [−2]pro-prostate specific antigen combined with prostate specific antigen and free prostate specific antigen for prostate cancer detection in the 2.0–10.0 ng/ml prostate specific antigen range. J. Urol., 185 (5) (2011), pp. 1650-1655.
- S. Loeb, et al. Prospective multicenter evaluation of the beckman coulter prostate health index using WHO calibration. J. Urol., 189 (5) (2013), pp. 1702-1706.
- M. Lazzeri, et al. Serum isoform [−2]proPSA derivatives significantly improve prediction of prostate cancer at initial biopsy in a total PSA range of 2–10 ng/ml: a multicentric European study. Eur. Urol., 63 (6) (2013), pp. 986-994.
- G. Lughezzani, et al. Multicenter European external validation of a prostate health index-based nomogram for predicting prostate cancer at extended biopsy. Eur. Urol., 66 (5) (2014), pp. 906-912.
- C. de la Calle, et al. Multicenter evaluation of the prostate health index to detect aggressive prostate cancer in biopsy naïve men. J. Urol., 194 (1) (2015), pp. 65-72.
- M. Boegemann, et al. The percentage of prostate-specific antigen (PSA) isoform [−2]proPSA and the prostate health index improve the diagnostic accuracy for clinically relevant prostate cancer at initial and repeat biopsy compared with total PSA and percentage free PSA in men aged ≤65 years. BJU Int., 117 (1) (2016), pp. 72-79.
- Loeb, et al. The prostate health index selectively identifies clinically significant prostate cancer. J. Urol., 193 (4) (2015), pp. 1163-1169.
- G.I. Russo, et al.A systematic review and meta-analysis of the diagnostic accuracy of prostate health index and 4-kallikrein panel score in predicting overall and high-grade prostate cancer. Clin. Genitourin. Cancer, 15 (4) (2016), pp. 429-439.
- W. Wang, et al. Diagnostic ability of%p2PSA and prostate health index for aggressive prostate cancer: a meta-analysis. Sci. Rep., 4 (2014), p. 5012.
- D.A. Sartori, D.W. ChanBiomarkers in prostate cancer: what’s new? Curr. Opin. Oncol., 26 (3) (2014), pp. 259-264.
- C.G. Rönnau, et al. Noncoding RNAs as novel biomarkers in prostate cancer. Biomed. Res. Int., 2014 (2014), p. 591703.
- A.F. Neves, et al. Combined analysis of multiple mRNA markers by RT-PCR assay for prostate cancer diagnosis. Clin. Biochem., 41 (14–15) (2008), pp. 1191-1198.
- L.B. Ferreira, et al.PCA3 noncoding RNA is involved in the control of prostate-cancer cell survival and modulates androgen receptor signaling. BMC Cancer, 12 (2012), p. 507.
- A.E. Lemos, et al. PCA3 long noncoding RNA modulates the expression of key cancer-related genes in LNCaP prostate cancer cells. Tumour Biol., 37 (8) (2016), pp. 11339-11348.
- J. Deng, et al. Long non-coding RNA as potential biomarker for prostate cancer: is it making a difference? Int. J. Environ. Res. Public Health, 14 (3) (2017), p. E270.
- M.J. Bussemakers, et al. DD3: a new prostate-specific gene, highly overexpressed in prostate cancer. Cancer Res., 59 (23) (1999), pp. 5975-5979.
- M.C. Gittelman, et al. PCA3 molecular urine test as a predictor of repeat prostate biopsy outcome in men with previous negative biopsies: a prospective multicenter clinical study. J. Urol., 190 (1) (2013), pp. 64-69.
- C.G. Ramos, et al. PCA3 sensitivity and specificity for prostate cancer detection in patients with abnormal PSA and/or suspicious digital rectal examination. First Latin American experience. Urol. Oncol., 31 (8) (2013), pp. 1522-1526.
- V. Vlaeminck-Guillem, et al.Urinary PCA3 to predict prostate cancer in a cohort of 1015 patients. Prog. Urol., 25 (16) (2015), pp. 1160-1168.
- Y. Nygård, et al. Prostate cancer antigen-3 (PCA3) and PCA3-based nomograms in the diagnosis of prostate cancer: an external validation of Hansen’s nomogram on a Norwegian cohort. Scand. J. Urol., 49 (1) (2015), pp. 8-15.
- Y. Luo, et al.The PCA3 test for guiding repeat biopsy of prostate cancer and its cut-off score: a systematic review and meta-analysis. Asian J. Androl., 16 (3) (2014), pp. 487-492.
- P. Pepe, et al. PCA3 score and prostate cancer diagnosis at repeated saturation biopsy. Which cut-off: 20 or 35? Int. Braz. J. Urol., 38 (4) (2012), pp. 489-495.
- Y. Cui, et al. Evaluation of prostate cancer antigen 3 for detecting prostate cancer: a systematic review and meta-analysis. Sci. Rep., 6 (2016), p. 25776.
- Auprich, et al.A comparative performance analysis of total prostate-specific antigen, percentage free prostate-specific antigen, prostate-specific antigen velocity and urinary prostate. BJU Int., 109 (11) (2012), pp. 1627-1635.
- M. Ferro, et al. Prostate Health Index (Phi) and Prostate Cancer Antigen 3 (PCA3) significantly improve prostate cancer detection at initial biopsy in a total PSA range of 2–10 ng/ml. PLoS One, 8 (7) (2013), p. e67687.
- R. Merola, et al. PCA3 in prostate cancer and tumor aggressiveness detection on 407 high-risk patients: a National Cancer Institute experience. J. Exp. Clin. Cancer Res., 34 (2015), p. 15.
- S. Perdonà, et al. Prostate health index (phi) and prostate cancer antigen 3 (PCA3) significantly improve diagnostic accuracy in patients undergoing prostate biopsy. Prostate, 73 (3) (2013), pp. 227-235.
- J.M. Mosquera, et al. Prevalence of TMPRSS2-ERG fusion prostate cancer among men undergoing prostate biopsy in the United States. Clin. Cancer Res., 15 (14) (2009), pp. 4706-4711.
- C. Magi-Galluzzi, et al. TMPRSS2-ERG gene fusion prevalence and class are significantly different in prostate cancer of Caucasian, African-American and Japanese patients/ Prostate, 71 (5) (2011), pp. 489-497.
- A. Fleischmann, et al. Prevalence and prognostic significance of TMPRSS2-ERG gene fusion in lymph node positive prostate cancers. Prostate, 74 (16) (2014), pp. 1647-1654.
- J. Yu, et al. An integrated network of androgen receptor, polycomb, and TMPRSS2-ERG gene fusions in prostate cancer progression. Cancer Cell, 17 (5) (2010), pp. 443-454.
- B. Liu, et al. Identification of TMPRSS2-ERG mechanisms in prostate cancer invasiveness: involvement of MMP-9 and plexin B1. Oncol. Rep., 37 (1) (2017), pp. 201-208.
- G.H. Leyten, et al. Prospective multicentre evaluation of PCA3 and TMPRSS2-ERG gene fusions as diagnostic and prognostic urinary biomarkers for prostate cancer. Eur. Urol., 65 (3) (2016), pp. 534-542.
- K.D. Berg. The prognostic and predictive value of TMPRSS2-ERG gene fusion and ERG protein expression in prostate cancer biopsies. Dan. Med. J., 63 (12) (2016), p. B5319.
- Y. Yao, et al. Evaluation of the TMPRSS2:ERG fusion for the detection of prostate cancer: a systematic review and meta-analysis. Tumour Biol., 35 (3) (2014), pp. 2157-2166.
- F. Sanguedolce, et al. Urine TMPRSS2: ERG fusion transcript as a biomarker for prostate cancer: literature review. Clin. Genitourin. Cancer, 14 (2) (2016), pp. 117-121.
- S. Merdan, et al. Assessment of long-term outcomes associated with urinary prostate cancer antigen 3 and TMPRSS2:ERG gene fusion at repeat biopsy. Cancer, 121 (22) (2015), pp. 4071-4079.
- S.S. Salami, et al. Combining urinary detection of TMPRSS2:ERG and PCA3 with serum PSA to predict diagnosis of prostate cancer. Urol. Oncol., 31 (5) (2013), pp. 566-571.
- S.A. Tomlins, et al. Urine TMPRSS2:ERG plus PCA3 for individualized prostate cancer risk assessment. Eur. Urol., 70 (1) (2016), pp. 45-53.
- J.N. Cornu, et al. Urine TMPRSS2:ERG fusion transcript integrated with PCA3 score, genotyping, and biological features are correlated to the results of prostatic biopsies in men at risk of prostate cancer. Prostate, 73 (3) (2013), pp. 242-249.
- H.G. Nguyen, C.J. Welty, M.R. Cooperberg. Diagnostic associations of gene expression signatures in prostate cancer tissue. Curr. Opin. Urol., 25 (1) (2015), pp. 65-70.
- D. Knezevic, et al. Analytical validation of the oncotype DX prostate cancer assay – a clinical RT-PCR assay optimized for prostate needle biopsies. BMC Genom., 14 (2013), p. 690.
- E.A. Klein, et al. A 17-gene assay to predict prostate cancer aggressiveness in the context of Gleason grade heterogeneity, tumor multifocality, and biopsy undersampling. Eur. Urol., 66 (3) (2014), pp. 550-560.
- J. Cullen, et al. A biopsy-based 17-gene genomic prostate score predicts recurrence after radical prostatectomy and adverse surgical pathology in a racially diverse population of men with clinically low- and intermediate-risk prostate cancer. Eur. Urol., 68 (1) (2015), pp. 123-131.
- R. Szulkin, et al. Prediction of individual genetic risk to prostate cancer using a polygenic score. Prostate, 75 (13) (2015), pp. 1467-1474.
- J. Cuzick, et al. Prognostic value of an RNA expression signature derived from cell cycle proliferation genes in patients with prostate cancer: a retrospective study. Lancet Oncol., 12 (3) (2011), pp. 245-255.
- J. Cuzick, et al. Prognostic value of a cell cycle progression signature for prostate cancer death in a conservatively managed needle biopsy cohort. Br. J. Cancer, 106 (6) (2012), pp. 1095-1099.
- J. Cuzick, et al. Validation of an RNA cell cycle progression score for predicting death from prostate cancer in a conservatively managed needle biopsy cohort. Br. J. Cancer, 113 (3) (2015), pp. 382-389.
- M.R. Cooperberg, et al. Validation of a cell-cycle progression gene panel to improve risk stratification in a contemporary prostatectomy cohort. J. Clin. Oncol., 31 (11) (2013), pp. 1428-1434.
- J.T. Bishoff, et al.Prognostic utility of the cell cycle progression score generated from biopsy in men treated with prostatectomy. J. Urol., 192 (2) (2014), pp. 409-414.
- E.D. Crawford, et al. Cell cycle progression score and treatment decisions in prostate cancer: results from an ongoing registry. Med. Res. Opin., 30 (6) (2014), pp. 1025-1031.
- N. Shore, et al. Clinical utility of a biopsy-based cell cycle gene expression assay in localized prostate cancer. Curr. Med. Res. Opin., 30 (4) (2014), pp. 547-553.
- N.D. Shore, et al. Impact of the cell cycle progression test on physician and patient treatment selection for localized prostate cancer. J. Urol., 195 (3) (2016), pp. 612-618.
- J.Y. ParkPromoter hypermethylation as a biomarker in prostate adenocarcinoma. Methods Mol. Biol., 1238 (2015), pp. 607-625.
- B.J. Trock, et al. Evaluation of GSTP1 and APC methylation as indicators for repeat biopsy in a high-risk cohort of men with negative initial prostate biopsies. BJU Int., 110 (1) (2012), pp. 56-62.
- R. Henrique, C. JerónimoMolecular detection of prostate cancer: a role for GSTP1 hypermethylation. Eur. Urol., 46 (5) (2004), pp. 660-669.
- L.B. Hesson, W.N. Cooper, F. Latif. The role of RASSF1A methylation in cancer. Dis. Mark., 23 (1–2) (2007), pp. 73-87.
- Y. Chen, et al. APC gene hypermethylation and prostate cancer: a systematic review and meta-analysis. Eur. J. Human Genet., 21 (9) (2013), pp. 929-935.
- L. Van Neste, et al. Risk score predicts high-grade prostate cancer in DNA-methylation positive, histopathologically negative biopsies. Prostate, 76 (12) (2016), pp. 1078-1087.
- M. Jain, et al. Metabolite profiling identifies a key role for glycine in rapid cancer cell proliferation. Science, 336 (6084) (2012), pp. 1040-1044.
- A.P. Khan, et al. The role of sarcosine metabolism in prostate cancer progression. Neoplasia, 15 (5) (2013), pp. 491-501.
- J.E. McDunn, et al.Metabolomic signatures of aggressive prostate cancer. Prostate, 73 (14) (2013), pp. 1547-1560.
- C.A. Franzen, et al. Urinary exosomes: the potential for biomarker utility, intercellular signaling and therapeutics in urological malignancy. J. Urol., 195 (5) (2016), pp. 1331-1339.
- J. McKiernan, et al. A novel urine exosome gene expression assay to predict high-grade prostate cancer at initial biopsy. JAMA Oncol., 2 (7) (2016), pp. 882-889.
- W.J. Allard, et al. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clin. Cancer Res., 10 (20) (2004), pp. 6897-6904.
- P. Helo, et al. Circulating prostate tumor cells detected by reverse transcription-PCR in men with localized or castration-refractory prostate cancer: concordance with CellSearch assay and association with bone metastases and with survival. Clin. Chem., 55 (4) (2009), pp. 765-773.
- D. Lorente, J. Mateo, J.S. de Bono. Molecular characterization and clinical utility of circulating tumor cells in the treatment of prostate cancer. Am. Soc. Clin. Oncol. Educ. Book, 2014 (2014), pp. e197-e203.
- B.V. Le, et al. [−2]Proenzyme prostate specific antigen is more accurate than total and free prostate specific antigen in differentiating prostate cancer from benign disease in a prospective prostate cancer screening study. J. Urol., 183 (4) (2010), pp. 1355-1359.
- F.H. Jansen, et al. Prostate-specific antigen (PSA) isoform p2PSA in combination with total PSA and free PSA improves diagnostic accuracy in prostate cancer detection. Eur. Urol., 57 (6) (2010), pp. 921-927.
- G. Guazzoni, et al. Preoperative prostate-specific antigen isoform p2PSA and its derivatives, %p2PSA and prostate health index, predict pathologic outcomes in patients undergoing radical prostatectomy for prostate cancer. Eur. Urol., 61 (3) (2012), pp. 455-466.
- M. Lazzeri, et al. Serum index test %[−2]proPSA and Prostate Health Index are more accurate than prostate specific antigen and %fPSA in predicting a positive repeat prostate biopsy. J. Urol., 188 (4) (2012), pp. 1137-1143.
- M. Lazzeri, et al. Clinical performance of serum prostate-specific antigen isoform [−2]proPSA (p2PSA) and its derivatives, %p2PSA and the prostate health index (PHI), in men with a family history of prostate cancer: results from a multicentre European study, the PROMEtheuS project. BJU Int., 112 (3) (2013), pp. 313-321.
- C. Stephan, et al. Multicenter evaluation of [−2]proprostate-specific antigen and the prostate health index for detecting prostate cancer. Clin. Chem., 59 (1) (2013), pp. 306-314.
- C.F. Ng, et al. The Prostate Health Index in predicting initial prostate biopsy outcomes in Asian men with prostate-specific antigen levels of 4–10 ng/ml. Int. Urol. Nephrol., 46 (4) (2014), pp. 711-717.
- R. Na, et al. Performance of serum prostate-specific antigen isoform [−2]proPSA (p2PSA) and the prostate health index (PHI) in a Chinese hospital-based biopsy population. Prostate, 74 (15) (2014), pp. 1569-1575.
- T. Nordström, et al. Comparison between the four-kallikrein panel and prostate health index for predicting prostate cancer. Eur. Urol., 68 (1) (2015), pp. 139-146.
- N. Fossati, et al. Clinical performance of serum isoform [−2]proPSA (p2PSA), and its derivatives %p2PSA and the prostate health index, in men aged <60 years: results from a multicentric European study. BJU Int., 115 (6) (2015), pp. 913-920.
- C. AlbertiProstate cancer immunotherapy: particularly in combination with androgen deprivation or radiation treatment. Customized pharmacogenomic approaches to overcome immunotherapy cancer resistance. G. Chir., 37 (5) (2017), pp. 225-235.





