11638
Написано: 10.09.2021
Редактировалось: 13.09.2021
Авторское право © 2018, Hamid Arazi, Mahbobeh Samadpour, Ehsan Eghbali (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Арази Х., Самадпур М., Эгбали Э.
BMC Women Health 2018 18:202
Аннотация
Введение
Остеопороз представляет собой нарушение костного метаболизма, характеризующееся низкой минеральной плотностью (МПК) и снижением прочности костей, что приводит к более высокому риску переломов. В насто...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Арази Х., Самадпур М., Эгбали Э.
BMC Women Health 2018 18:202
Аннотация
Введение
Остеопороз представляет собой нарушение костного метаболизма, характеризующееся низкой минеральной плотностью (МПК) и снижением прочности костей, что приводит к более высокому риску переломов. В насто...
Авторское право © 2018, Hamid Arazi, Mahbobeh Samadpour, Ehsan Eghbali (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Арази Х., Самадпур М., Эгбали Э.
BMC Women Health 2018 18:202
Аннотация
Введение
Остеопороз представляет собой нарушение костного метаболизма, характеризующееся низкой минеральной плотностью (МПК) и снижением прочности костей, что приводит к более высокому риску переломов. В настоящем исследовании предпринята попытка изучить влияние сочетания тренировок (аэробных и силовых) с потреблением молока на некоторые маркеры МПК у женщин с остеопорозом.
Методы
В рамках исследования сорок женщин с диагнозом «остеопороз» в возрасте от 30 до 45 лет разделены на четыре группы по десять человек: аэробные и силовые тренировки в сочетании с потреблением молока, только тренировки, только потребление молока и контрольная группа. Два вида физических упражнений выполнялись в течение десяти недель по 3 занятия в неделю и включали аэробные (бег при 55–75% максимальной частоты сердечных сокращений (ЧСС)) и силовые нагрузки с отягощениями (два подхода по четыре упражнения в каждом с 10 повторными максимумами (RM, repetition maximum)). Молоко потреблялось два раза в день по 250 мл в день в течение 10 недель. МПК в области тазобедренного сустава и поясничного отдела позвоночника оценены до и после воздействия с помощью двухэнергетической рентгеновской абсорбциометрии (DEXA, dual-energy X-ray absorptiometry), а также по результатам анализа крови, для которого из плечевой вены брали 5 см3 крови для определения уровней 25-гидроксивитамина D (25OH-D) и щелочной фосфатазы (ЩФ, ALP, alkaline phosphatase).
Результаты
Результаты исследования продемонстрировали, что уровни 25OH-D и ЩФ в крови значительно повысились в следующих группах: тренировки в сочетании с потреблением молока, только тренировки, только потребление молока - с наибольшим значением в группе тренировок в сочетании с потреблением молока (P <0,05). МПК шейки правой и левой бедренной кости в группах тренировок в сочетании с потреблением молока и только тренировок значительно увеличилась при наибольшем увеличении показателя в группе тренировок в сочетании с потреблением молока (р <0,05). МПК поясничного отдела позвоночника также значительно увеличилась в группах тренировок в сочетании с потреблением молока и только тренировок (р <0,05).
Выводы
Комбинация тренировок и потребления молока может оказывать более эффективное влияние на МПК у молодых женщин с диагнозом остеопороз по сравнению с отдельным потреблением молока или выполнением только тренировок. Такое лечение может быть использовано как эффективный способ улучшения МПК у молодых женщин с диагностированным остеопорозом.
Ключевые слова
Остеопороз является системным метаболическим заболеванием скелетных костей и характеризуется низкой плотностью и повышенной хрупкостью кости, что приводит к снижению ее прочности и в свою очередь более высокому риску переломов [1, 2]. Всемирная организация здравоохранения (ВОЗ) признает остеопороз четвертым по опасности заболеванием после болезней сердца, рака и диабета [1, 2].
Развитие и увеличение тяжести остеопороза можно объяснить образом жизни и диморфными факторами [3]. Поддержание благоприятного пищевого статуса представляет собой основу профилактики остеопороза. Одной из главных групп пищевых продуктов, способных улучшить состояние костей, являются молочные продукты, представляющие собой богатый источник питательных веществ - белков, кальция, магния и витаминов группы В [4]. Специалисты считают, что молоко — очень важный питательный материал, требующийся для увеличения костной массы. Это один из основных источников кальция и других необходимых организму элементов, включая витамин D, белок, калий и фосфор [5]. Кальций жизненно необходим для МПК, поскольку снижает риск переломов костей у пациентов с диагнозом «остеопороз» [6]. Кроме того, молочные продукты могут увеличить мышечную массу и повысить окисление жиров [7]. Показатели МПК, уровни ЩФ и 25OH-D в сыворотке крови играют важную роль в определении состояния костей. Как биомаркер кости, ЩФ — это фермент, присутствующий в различных тканях организма, включая печень, кости, почки, кишечник и плаценту. В основном она производится в печени и костном мозге. При заболеваниях костей уровень ЩФ повышается вследствие активности остеобластов и варьируется в зависимости от возраста и пола [8]. Витамин D входит в состав пищевых продуктов в виде холекальциферола. Это единственный витамин, синтез которого в организме нуждается в определенном количестве прямых солнечных лучей помимо его получения с ежедневным питанием. Витамин D накапливается в нескольких частях тела, например в коже, стимулирует усвоение кальция из тонкого кишечника, повышает реабсорбцию кальция в дистальных почечных канальцах [6, 7, 8].
Регулярная физическая нагрузка снижает риск возникновения проблем со здоровьем, включая ожирение, болезни сердца, инсульт, рак толстой кишки, диабет и остеопороз [9]. Она считается профилактикой снижения риска остеопороза, падений и переломов. Физические нагрузки, такие как гимнастика и тяжелая атлетика, приводящие к высокой нагрузке на организм и связанные с интенсивным противодействием силе тяжести, оказывают более сильное остеогенное воздействие по сравнению с такими видами деятельности, как плавание и езда на велосипеде, в результате которых потребляется много энергии [10]. Данные свидетельствуют о том, что увеличение нагрузки оказывает более благоприятный эффект по сравнению с повторением упражнений с той же нагрузкой [11].
Физическая активность играет важную роль в развитии и поддержании МПК [12]. Она улучшает прочность костей, создавая периодические механические нагрузки на скелетную систему. Исследования показали, что тип, интенсивность и продолжительность упражнений влияют на МПК. Таким образом, физическая активность необходима для развития и поддержания массы и плотности костей. Пиковое приложение усилий является важным и решающим фактором при анализе механической нагрузки на кости [13, 14].
Механизм остеогенной реакции на нагрузку предполагает, что длительная физическая активность оказывает анаболическое воздействие на кости и улучшает плотность и прочность костей. Результаты экспериментальных исследований показали, что длительный курс физической нагрузки с высокоскоростным тяговым усилием и высоким пиковым усилием оказывал большее влияние на остеогенную ответную реакцию кости по сравнению с упражнениями с высокой повторяемостью и приложением низких усилий [15, 16]. Исследования продемонстрировали положительное влияние длительной тренировки (от шести до 36 месяцев) на увеличение плотности кости, в то время как короткая тренировка (менее шести месяцев) не дает аналогичных результатов [15, 16].
В работе Marques et al. [17] сделан вывод, что восемь месяцев тренировок с отягощениями могут быть более эффективными по сравнению с аэробными упражнениями и способны вызывать благоприятные изменения в МПК и силе мышц. Кроме того, результат Hawley et al. [18] свидетельствуют, что упражнения с отягощениями эффективны для увеличения МПК у здоровых молодых мужчин, но не влияют на МПК у женщин. Соответствующие возрасту упражнения могут привести к улучшению чувства равновесия, гибкости, координации и росту мышц, потому что мышцы поддерживают кости, а также увеличивают кровоснабжение костей и суставов. Все эти факторы в совокупности предотвращают падения и переломы.
Согласно обзорной литературе о диетах и физических упражнениях, пока не ясно, могут ли эти факторы каждый по отдельности увеличивать МПК у молодых женщин с остеопорозом или они будут более эффективны при их использовании в комбинации. Американский колледж спортивной медицины в последние годы сравнивал модели тренировок с одними только аэробными упражнениями или упражнениями с отягощениями. Настоящее исследование направлено на изучение и сравнение преимуществ сочетания физической нагрузки, в том числе аэробных и силовых упражнений с отягощениями с потреблением молока для молодых женщин с остеопорозом, с применением этих подходов по отдельности.
Методы
Участниками исследования стали 40 иранских молодых женщин с диагнозом «остеопороз» в возрасте от 30 до 45 лет. Участники заявили о своем согласии на добровольной основе после ознакомления с объявлениями в медицинских учреждениях и связанных с ними лабораториях в городе Бандар-э-Анзали. Критериями включения являлись отсутствие некоторых заболеваний (патологий щитовидной железы, сахарного диабета), приема определенных лекарств (влияющих на МПК, например, кортикостероидов), отсутствие регулярной физической нагрузки (малоподвижный образ жизни) и потребления молочных продуктов с низким содержанием жира (молока, йогурта, сыра) как источника витамина D. Участники исследования придерживались обычной диеты и мало находились на солнце из-за географических условий проживания, религиозных убеждений и типа одежды. Пищевое потребление кальция оценивали по трехдневному рациону (потребление кальция составляло 300—650 мг в день). Физическая нагрузка участников исследования ограничивалась только повседневной деятельностью (уборка дома, покупка продуктов, стирка и т. д., но не включала подвижные игры/спорт и другие формы активной физической нагрузки). Университетский комитет по этике утвердил данные условия проекта.
Из 150 человек, посещающих центры денситометрии, 40 человек соответствовали критериям исследования; они были случайным образом разделены на четыре группы по десять человек: аэробные и силовые тренировки в сочетании с потреблением молока, только тренировки, только потребление молока и контрольная группа. После ознакомления участников с целями и процедурами исследования они заполняли форму информированного согласия. Затем лаборант выполнил измерения МПК поясничного отдела позвоночника и тазобедренных суставов участников. За два-три дня до начала тренировок и на пятый день менструального цикла после 8—10-часового голодания выполнен забор крови на анализ для определения уровней 25OH-D и ЩФ во всех четырех группах (аэробные и силовые тренировки в сочетании с потреблением молока, только тренировки, только потребление молока и контрольная группа). Начало тренировок и сдача анализа крови скорректированы с учетом пятого дня менструального цикла для каждой женщины. Предварительные и последующие тесты проводились до и после 2,5 месяцев выполнения двух видов тренировок и потребления молока участниками разных групп.
Участники групп потребления молока и тренировок с в сочетании с потреблением молока выпивали по 500 мл молока в сутки в течение 10 недель [14]. Участники этих групп пили молоко перед тренировкой (250 мл) и через час после нее (250 мл). В исследовании использовалось обычное молоко с низким содержанием жира, которое можно купить в магазинах. Питательная ценность 250 мл молока: энергетическая ценность — 113 ккал; белок — 8,0 г; углеводы — 11,5 г; жиры — 3,8 г; кальций — 338 мг; цинк —1,0 мг; йод — 33 мкг; витамин А — 400 мкг; витамин D3 — 6,25 мкг; витамин В2 — 0,33 мг; витамин B12 — 1,30 мкг.
После измерения роста и массы рассчитывался индекс массы тела (ИМТ) путем деления массы (в килограммах) на рост в квадрате (в метрах). Кроме того, для измерения отношения талии к бедрам (WHR, waist to hip ratio) окружность талии разделялась на окружность бедер. Исследователи использовали метод Джексона-Поллока для измерения процентного содержания телесного жира и толщины подкожного жира в трех точках тела: трицепс, позвоночник и бедро, плотность тела определяли для каждого участника исследования [19 ]. Затем, используя уравнение Брозека, рассчитывали процентное содержание телесного жира для каждого участника исследования [20]. Толщина складки кожи измерялась с помощью калиброванных штангенциркулей (модель Lafayette o1127, США) с точностью до 1 мм. Все измерения выполнялись три раза на правой стороне тела, их среднее значение использовалось в качестве основного показателя.
Протокол тренировки
Аэробные и силовые тренировки проводились в группах в течение десяти недель по три занятия в неделю (каждое занятие длилось примерно 90—110 минут). Тренировки начинались с упражнений на растяжку и разминки (10—15 минут) и продолжались аэробными упражнениями (25—40 минут), упражнениями с отягощениями (на различных тренажерах (25—40 минут)) и заканчивались заминкой (успокаивающие упражнения) / упражнениями на растяжку (10—15 минут). Аэробная тренировка включала в себя три подхода по 5 минут, бег с максимальной ЧСС, равной 55—75% целевого уровня (HRmax) (ЧСС во время упражнений постоянно контролировалась мониторами сердечного ритма (Polar, AXN500)). Увеличивались как интенсивность упражнений — постепенно, на основе 5%-го роста HRmax, так и продолжительность тренировок — на три-пять минут каждые две недели (период отдыха составлял примерно три минуты перед каждым подходом). Во время силовых тренировок участники исследования выполняли два вида жима лежа, разгибание ног, отжимания с широким упором и вращения ногами (упражнение «велосипед») с 10RM (участницы исследования занимались на тренажерах с переменным сопротивлением). Для сведения к минимуму усталости упражнения для верхней/нижней части тела производились попеременно, с отдыхом в течение приблизительно одной-двух минут перед каждым подходом. Интенсивность тренировки постепенно увеличивалась каждые две недели еще на 10RM (рис. 1).
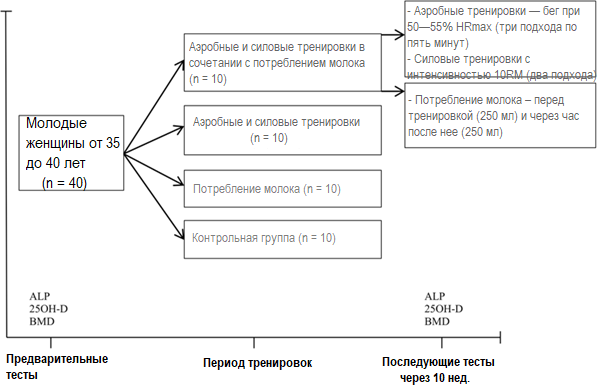 Рисунок 1. Дизайн исследования
Рисунок 1. Дизайн исследования
Сокращения: ALP — щелочная фосфатаза; 25OH-D — 25-гидроксивитамин D; МПК — минеральная плотность кости.
Анализ крови — определение уровней 25OH-D и ЩФ (ALP)
Перед взятием крови на анализ участники исследования воздерживались от приема пищи в течение восьми-десяти часов. Измерение уровней 25OH-D и ALP в сыворотке крови проводили в течение 48 часов до и после тренировки, кровь брали из плечевой вены в положении сидя в количестве 5 см3 (первоначальные измерения скорректированы с учетом пятого дня менструального цикла для каждой женщины). После транспортировки в лабораторию и центрифугирования при 3000 об/мин уровни 25OH-D и ЩФ определяли с использованием различных анализаторов. Уровень 25OH-D измеряли с CV 2 до 3% с помощью устройства для проведения анализа Elisa (модель Danna) и прибора, собранного в Иране из американских деталей, уровень ЩФ — на анализаторе Hitachi (911, Япония) с чувствительностью 3%. В соответствии с определениями Института медицины (IOM — Institute of Medicine), «дефицит» — значение уровня 25OH-D ниже 12 нг/мл (30 нмоль/л), «достаточное потребление» — значение уровня 25OH-D выше 20 нг/мл (50 нмоль/л) [21].
Измерение МПК
МПК измеряли в двух местах - в поясничном отделе позвоночника (L2—L4) и на уровне тазобедренного сустава с помощью прибора DXA (UNIGAMMA PLUS AC 230 В, 50/60 Гц, 400 Вт, США). В анализе оценивалась МПК позвонков от L2 до L4 поясничного отдела позвоночника. МПК шейки бедренной кости измерялась с правой и левой стороны. ВОЗ определяет остеопению и остеопороз на основе значений МПК: остеопения — МПК менее 1 и более 2,5 стандартных отклонений по отношению к средней МПК у молодых людей, а остеопороз — МПК менее 2,5 стандартных отклонений по отношению к средней МПК молодых людей [22].
Статистический анализ
Среднее значение и стандартное отклонение рассчитаны с использованием описательной статистики. Тест Шапиро - Уилка использовался для проверки нормальности распределения данных, в качестве базового выбран однофакторный анализ ANOVA. Однофакторный анализ ковариации (ANCOVA, One-way Analysis of Covariance) применялся для сравнения значений показателей групп после тестирования, потому что некоторые из предварительных тестов были разными в четырех группах, эффекты предварительных тестов корректировались с помощью ANCOVA. В случае значительного F-отношения для парных сравнений использовались специальные апостериорные анализы наименьшей значимой разности (LSD, Least Significant Difference). Для сравнения межгрупповых изменений применялся парный t-критерий. Анализы выполнены с применением программ SPSS 20 и Excel 2010. P ≤ 0,05 считалось уровнем значимости.
Результаты
Основные показатели МПК у участников исследования приведены в таблице 1. В начале исследования не обнаружено статистических различий по возрасту, росту, весу, ИМТ, WHR, количеству жировой ткани и уровню ALP (p> 0,05). Однако уровни 25OH-D, МПК шейки бедренной кости и поясничного отдела позвоночника показали значительные различия (р <0,05) (см. таблица 1). Эффект предварительных испытаний корректировался с помощью ANCOVA.
Таблица 1. Демографические характеристики и некоторые показатели МПК перед началом исследования в группах
Результаты сравнения парных t-критериев показали, что изменения в уровнях 25OH-D и ALP в группе тренировок в сочетании с потреблением молока значительны (25OH-D: p <0,001, p <0,001, p = 0,03; ALP: p <0,001, р <0,001, р = 0,01, соответственно). Изменения значений МПК шейки бедренной кости (правой и левой) и МПК поясничного отдела позвоночника в группе тренировок в сочетании с потреблением молока и только тренировок также значительны (справа: р <0,001, р = 0,01; слева: р <0,001, р <0,001; поясничный отдел позвоночника: р = 0,02, р <0,001; соответственно), хотя в группе только потребления молока существенных изменений не произошло (р = 0,15, р = 0,09, р = 0,10; соответственно) (рисунок 2).
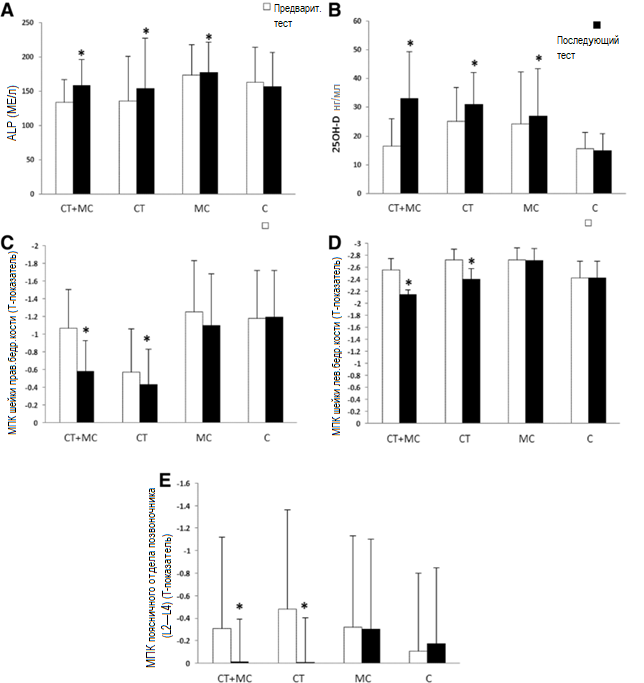
Рисунок 2. Изменения в уровнях ALP (a) и 25OH-D (b), значениях МПК шейки правой (c) и левой (d) бедренной кости, поясничного отдела позвоночника (e) после 10-недельной тренировочной интервенции (среднее значение ± SD)
* отмечены существенные различия между исходными и последующими значениями (p ≤ 0,05).
SD — стандартное отклонение; ИМТ — индекс массы тела; WHR — отношение окружности талии и бедер; ALP — щелочная фосфатаза; 25OH-D — 25-гидроксивитамин D; МПК — минеральная плотность кости; CT + MC (concurrent training-milk consumption) —тренировки в сочетании с потреблением молока; КТ (concurrent training) — только тренировки; MC (milk consumption) — только потребление молока; С — контроль.
Как видно из таблицы 2, результаты апостериорного анализа ANCOVA и LSD продемонстрировали существенные различия в уровне 25OH-D, значениях МПК для шейки правой бедренной кости и поясничного отдела позвоночника в группе тренировок в сочетании с потреблением молока по сравнению с группами только тренировок, только потребления молока и контролем (25OH-D: р = 0,04, р = 0,009, р <0,001; правая бедренная кость: р = 0,001, р = 0,001, р <0,001; поясничный отдел позвоночника: р = 0,01, р <0,001, р <0,001 соответственно). Изменения уровня 25OH-D в группе тренировок в сочетании с потреблением молока значительны по сравнению с контрольной группой, хотя не достигли той же значимости по сравнению с группой потребления молока (р = 0,01, р = 0,49 соответственно). Изменения уровня ALP в группе тренировок в сочетании с потреблением молока оказались значительными по сравнению с контрольной группой (р = 0,03), тогда как в группах только тренировок и потребления молока значительных расхождений не наблюдалось (р = 0,73, р = 0,14 соответственно). Изменения МПК шейки левой бедренной кости в группе тренировок в сочетании с потреблением молока значительны по сравнению с группами потребления молока и контролем (р <0,001, р <0,001 соответственно), в то время как значительных расхождений по сравнению с группой тренировок не было (р = 0,11). Изменения МПК в области левого бедра и поясничного отдела позвоночника в группе в группе тренировок в сочетании с потреблением молока значительны по сравнению с группой потребления молока и контрольной группой (левая бедренная кость: р <0,001, р = 0,006; поясничный отдел позвоночника: р <0,001, р <0,001 соответственно); в то время как изменения в МПК шейки правой бедренной кости и уровне ALP между группами тренировок, потребления молока и контролем незначительны (правое бедро: p = 0,73, p = 0,20; ALP: p = 0,24, p = 0,07 соответственно) (таблица 2).
Таблица 2. Результаты ANCOVA и апостериорного анализа
Обсуждение
В настоящем исследовании изучалось влияние тренировок и потребления молока на некоторые показатели МПК у женщин с остеопорозом. Результаты свидетельствуют о большем влиянии тренировок в сочетании с потреблением молока на МПК молодых женщин с остеопорозом по сравнению с потреблением молока или выполнением тренировок по отдельности.
Нагрузка на опорные поверхности костей и сила деформации, вызванные различными сокращениями мышц во время тренировки, могут в некоторой степени стимулировать костную ткань, поэтому такие механические нагрузки способны улучшить ее прочность и биохимические свойства. Правильные механические напряжения обусловливают формирование кости, увеличение МПК и предотвращают развитие остеопороза [23]. Результаты обзора, проведенного Yuan et al. [23], показали, что физические упражнения повышают МПК, массу, прочность и механические свойства кости. Физическая нагрузка, по-видимому, прямо и косвенно влияет на все костные клетки и многие аспекты ремоделирования кости. Имеются данные, свидетельствующие об активизации с помощью физических упражнений формирования кости путем стимуляции мезенхимальных стволовых клеток, остеогенной дифференцировки и активности остеобластов и остеоцитов; важную роль играет механическая нагрузка, а также сигнальный путь Wnt-катенина и морфогенетических белков костей. Результаты исследований продемонстрировали увеличение остеогенной дифференцировки и образования костной ткани из-за изменений уровней гормонов, таких как паратиреоидный гормон (ПТГ), эстроген и простагландин E2 вследствие физической нагрузки. Конечно, интенсивность и тип физических упражнений имеют индивидуальное влияние на людей [23].
В нескольких исследованиях изучалось воздействие разных видов тренировок на МПК, в то время как основное внимание уделялось отдельному изучению аэробных и силовых упражнений с отягощениями. Только аэробные упражнения слабо воздействуют на МПК взрослых людей. Доказательства эффективности такого типа тренировок для борьбы с возрастной потерей костной массы представляются спорными [24, 25]. Результаты исследования Silverman et al. [26] показали, что после 24 недель тренировок в виде ходьбы плотность шейки бедренной кости увеличилась на 2% у женщин в период постменопаузы. Протокол аэробных тренировок обычно включает в себя ходьбу без боковых и скручивающих движений, что недостаточно для увеличения плотности костей. В идеальном состоянии бег и ходьба могут быть эффективными в ограничении снижения плотности костной ткани у пожилых людей; в любом случае, польза тренировок со средней и высокой интенсивностью остается противоречивой. Аэробные тренировки низкой интенсивности, такие как ходьба, оказывают меньшее давление на тело по сравнению с бегом, поэтому влекут за собой только слабую остеогенную стимуляцию [27]. Alghadir et al. [28] предположили, что аэробные упражнения умеренной интенсивности способны защитить кость и хрящ, регулируя содержание микроэлементов, участвующих в биосинтезе костного матрикса, и ингибировать процесс резорбции кости с помощью соответствующего механизма свободных радикалов. Исследование Wen et al. [29] продемонстрировало пользу краткосрочных групповых занятий степ-аэробикой для метаболизма костей и снижения активность их резорбции.
Результаты работы Mosti et al. [30] показали, что после 12 недель силовых тренировок у женщин в период постменопаузы в группах с диагнозами «остеопения» и «остеопороз» улучшились 1RM и скорость нарастания силы, а плотность костей в поясничном отделе позвоночника и шейке бедра увеличилась на 2,9 и 4,9% соответственно. Уровни в сыворотке крови амино-терминального пропептида коллагена типа 1 (P1NP, type 1 collagen amino-terminal propeptide) / продуктов расщепления коллагена С типа 1 (СТХ, collagen C breakdown products) продемонстрировали незначительную тенденцию к увеличению, что представляет собой стимуляцию образования кости. Результаты исследования Petersen et al. [31] позволяют предположить, что программа физических упражнений с низкой нагрузкой и большим количеством повторений может стать эффективным способом улучшения костной массы у взрослых. В своей работе Watson et al. [32] предположили, что возможно увеличение показателей прочности костей у женщин в период постменопаузы с низкой костной массой после высокоинтенсивных упражнений с отягощениями и динамических тренировок.
Вопреки данным исследованиям, результаты работы Almstedt et al. [18] показали, что 24-недельные тренировки с отягощениями эффективны для увеличения МПК (на 2,7-7,7%) у здоровых молодых мужчин, но для женщин программа тренировок не дала такого результата (изменений МПК на 0,8-1,5%). Singh et al. [33] в своем исследовании женщин во время предменопаузального периода обнаружили, что силовые тренировки в ходе тренировочного курса продолжительностью более девяти месяцев не приводили к значительным изменениям общей МПК костей тела. Nakata et al. [34] пришли к выводу, что тренировки с отягощениями во время потери веса не влияют на МПК у женщин с избыточным весом в период предменопаузы.
Учитывая различие реакций женщин разных возрастов (возможно, из-за ухудшения способности костных клеток принимать физические сигналы или неспособности на них реагировать) и связи эстрогенной недостаточности с повышенной степенью ремоделирования кости [35], сделан вывод о корреляции реакции скелета на тренировки с возрастом. В целом влияние механических нагрузок на остеогенность уменьшается с возрастом, и, по-видимому, происходит постепенное снижение чувствительности кости к химическим и физическим сигналам [36].
Результаты исследований показали положительное влияние аэробных и силовых тренировок в сочетании с потреблением молока на МПК у молодых женщин с остеопорозом по сравнению с потреблением молока или тренировками по отдельности. В соответствии с этим мы можем сослаться на результаты работы Lester et al. [37], в которой изучалось влияние восьми недель аэробной, силовой и обоих видов тренировок на ответную реакцию биомаркеров кости у ранее неактивных молодых женщин. Полученные данные свидетельствуют, что влияние показателей остеогенной активности на биомаркеры костеобразования (костно-специфический уровень ЩФ и остеокальцина) возрастало в группах силовых тренировок и сочетании тренировок с потреблением молока. Тем не менее, биомаркеры резорбции кости (уровни устойчивой к тартрату кислой фосфатазы и дезоксипиридинолина) после курса тренировок снизились в группе силовых тренировок и увеличились в группе сочетания тренировок с потреблением молока. В аэробных и комбинированных группах наблюдались небольшие изменения в объеме кости и МПК [37]. Marques et al. [ 17 ] исследовали эффекты аэробных тренировок и тренировок с отягощениями. По данным результатам, после восьми месяцев тренировок (три занятия в неделю) только группа силовых тренировок продемонстрировала увеличение МПК вертела (2,9%) и всей бедренной кости (1,5%). Исследователи заявили, что участники групп аэробных и силовых тренировок улучшили свой баланс, но не продемонстрировали значительных изменений в уровнях остеопротегерина (OPG, osteoprotegerin) и лиганда рецептора-активатора ядерного фактора каппа-В (RANKL, receptor activator of nuclear factor kappa B ligand) в сыворотке. Основываясь на результатах предыдущих и настоящего исследований, можно утверждать, что сочетание аэробных упражнений и тренировок с отягощениями (два вида тренировок) оказало наибольшее влияние на МПК и может быть более полезным по сравнению с выполнением только одного вида тренировки при профилактике остеопороза у молодых людей.
Кальций является важным питательным веществом и важен для здоровья костей, набора максимальной костной массы, профилактики и лечения остеопороза на протяжении всей жизни [38]. Основные механизмы, участвующие в контроле регенерации кости и гомеостаза кальция, включают изменения в плазменных уровнях ПТГ, кальцитриола, кальция и фосфата, маркеров регенерации кости вследствие гипопаратиреоза и гиперпаратиреоза, почечной недостаточности, ежедневного введения ПТГ 1-34 и ингибирования RANKL [39]. Что касается потребления молока и богатых кальцием продуктов, мы можем сослаться на исследование Dionyssiotis et al. [40], в котором подчеркивается благотворное влияние физической активности и соответствующего потребления кальция на костную массу. Исследователи отметили, что женщины, регулярно выполнявшие упражнения и потреблявшие более 800 мг кальция в день, имели более высокий Т-показатель по сравнению с группами, не принимавшими кальций.
Исследование Laird et al. [41] показало, что высокое потребление йогурта связано с увеличением МПК и высокими показателями выносливости. В этой работе впервые продемонстрировано значительное уменьшение шансов диагностики остеопении или остеопороза у женщин и остеопороза у мужчин при увеличении потребления йогурта. Ученые объясняют эту связь естественным составом йогурта (содержит минеральные вещества и витамины, необходимые для развития плотности костей). Chen et al. [42] обнаружили, что для здоровых женщин в период постменопаузы потребление сухого молока с высоким содержанием кальция для задержки и замедления потери костной массы оказалось эффективнее, чем только добавки кальция в высоких и средних дозах. Добавка, содержащая 300 мг кальция в день, не может затормозить потерю костной массы в поясничном отделе позвоночника и большом вертеле, но прибавление 600-900 мг кальция в день будет полезным. Ikedo et al. [43] исследовали бегуний на длинные дистанции. Ученые выяснили, что прием витамина D и молока с низким содержанием жира в течение шести месяцев улучшали метаболизм костной ткани, поддерживая концентрацию 25OH-D и уменьшая концентрацию ПТГ и воспалительных цитокинов. Rajatanavin et al. [38] утверждают, что добавление кальция в дозе 500 мг в день может снизить ремоделирование костной ткани и уменьшение массы костей у пожилых женщин.
Вопреки этим исследованиям в ходе метаанализа Tai et al. [44] предположили, что увеличение потребления кальция с повседневной пищей или прием пищевых добавок с кальцием вызывает небольшое увеличение МПК и незначительно снижает риск панкреатита. Метаанализ Bolland et al. [45] показал, что потребление кальция не связано с риском перелома костей. Эта же научная группа нашла слабыми и противоречивыми клинические доказательства того, что увеличение потребления кальция из пищевых источников является профилактикой переломов. Результаты исследования Hirota et al. [46] продемонстрировали уменьшение МПК поясничного отдела позвоночника после четырех месяцев диеты по сравнению с исходным значением как в контрольной группе, так и в группе потребления молока. Исследователи предположили, что мышечная масса в группе потребления молока была связана с изменениями МПК поясничного отдела позвоночника, а у участников с наибольшим увеличением мышечной массы не наблюдалось снижения МПК поясничного отдела позвоночника.
Клинические испытания показали, что добавление кальция с витамином D или без него может уменьшить вторичный гиперпаратиреоз, замедлить метаболизм костной ткани, локально увеличить МПК или замедлить потерю костной массы [6, 7, 8]. Благотворное влияние добавок на плотность кости обусловлено уменьшением пространства для ремоделирования кости, что приводит к снижению числа активируемых участков ремоделирования кости и, следовательно, к снижению резорбции кости [47]. Добавки кальция оказывают острое антирезорбтивное действие на кости, регулярно запускающее восстановление костной ткани для поддержания плотности костей или замедления снижения МПК, сохранения толщины коры за счет уменьшения эндокортикальной резорбции и, возможно, снижения скорости увеличения внутрикортикальной пористости и/или улучшения минерализации костей [47]. Исходя из результатов предыдущих и настоящего исследования, представляется, что потребление молока (как богатого источника кальция) может оказывать полезное влияние на костную массу молодых людей и предотвращать развитие остеопороза в ходе старения. Более того, сочетание потребления молока с одновременной тренировкой (аэробной и силовой) может увеличить его потенциал.
Заключение
Результаты настоящего исследования показали, что сочетание тренировки с потреблением молока оказывает на МПК молодых женщин с остеопорозом большее влияние по сравнению с раздельным употреблением молока или тренировкой. Таким образом, можно сделать вывод, что тренировки в комбинации с потреблением молока имеет смысл использовать в качестве эффективного способа повышения МПК у молодых женщин с диагностированным остеопорозом.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Арази Х., Самадпур М., Эгбали Э.
BMC Women Health 2018 18:202
Аннотация
Введение
Остеопороз представляет собой нарушение костного метаболизма, характеризующееся низкой минеральной плотностью (МПК) и снижением прочности костей, что приводит к более высокому риску переломов. В настоящем исследовании предпринята попытка изучить влияние сочетания тренировок (аэробных и силовых) с потреблением молока на некоторые маркеры МПК у женщин с остеопорозом.
Методы
В рамках исследования сорок женщин с диагнозом «остеопороз» в возрасте от 30 до 45 лет разделены на четыре группы по десять человек: аэробные и силовые тренировки в сочетании с потреблением молока, только тренировки, только потребление молока и контрольная группа. Два вида физических упражнений выполнялись в течение десяти недель по 3 занятия в неделю и включали аэробные (бег при 55–75% максимальной частоты сердечных сокращений (ЧСС)) и силовые нагрузки с отягощениями (два подхода по четыре упражнения в каждом с 10 повторными максимумами (RM, repetition maximum)). Молоко потреблялось два раза в день по 250 мл в день в течение 10 недель. МПК в области тазобедренного сустава и поясничного отдела позвоночника оценены до и после воздействия с помощью двухэнергетической рентгеновской абсорбциометрии (DEXA, dual-energy X-ray absorptiometry), а также по результатам анализа крови, для которого из плечевой вены брали 5 см3 крови для определения уровней 25-гидроксивитамина D (25OH-D) и щелочной фосфатазы (ЩФ, ALP, alkaline phosphatase).
Результаты
Результаты исследования продемонстрировали, что уровни 25OH-D и ЩФ в крови значительно повысились в следующих группах: тренировки в сочетании с потреблением молока, только тренировки, только потребление молока - с наибольшим значением в группе тренировок в сочетании с потреблением молока (P <0,05). МПК шейки правой и левой бедренной кости в группах тренировок в сочетании с потреблением молока и только тренировок значительно увеличилась при наибольшем увеличении показателя в группе тренировок в сочетании с потреблением молока (р <0,05). МПК поясничного отдела позвоночника также значительно увеличилась в группах тренировок в сочетании с потреблением молока и только тренировок (р <0,05).
Выводы
Комбинация тренировок и потребления молока может оказывать более эффективное влияние на МПК у молодых женщин с диагнозом остеопороз по сравнению с отдельным потреблением молока или выполнением только тренировок. Такое лечение может быть использовано как эффективный способ улучшения МПК у молодых женщин с диагностированным остеопорозом.
Ключевые слова
- Остеопороз
- Два вида тренировок
- Молоко
- 25-гидроксивитамин D
- Щелочная фосфатаза
Остеопороз является системным метаболическим заболеванием скелетных костей и характеризуется низкой плотностью и повышенной хрупкостью кости, что приводит к снижению ее прочности и в свою очередь более высокому риску переломов [1, 2]. Всемирная организация здравоохранения (ВОЗ) признает остеопороз четвертым по опасности заболеванием после болезней сердца, рака и диабета [1, 2].
Развитие и увеличение тяжести остеопороза можно объяснить образом жизни и диморфными факторами [3]. Поддержание благоприятного пищевого статуса представляет собой основу профилактики остеопороза. Одной из главных групп пищевых продуктов, способных улучшить состояние костей, являются молочные продукты, представляющие собой богатый источник питательных веществ - белков, кальция, магния и витаминов группы В [4]. Специалисты считают, что молоко — очень важный питательный материал, требующийся для увеличения костной массы. Это один из основных источников кальция и других необходимых организму элементов, включая витамин D, белок, калий и фосфор [5]. Кальций жизненно необходим для МПК, поскольку снижает риск переломов костей у пациентов с диагнозом «остеопороз» [6]. Кроме того, молочные продукты могут увеличить мышечную массу и повысить окисление жиров [7]. Показатели МПК, уровни ЩФ и 25OH-D в сыворотке крови играют важную роль в определении состояния костей. Как биомаркер кости, ЩФ — это фермент, присутствующий в различных тканях организма, включая печень, кости, почки, кишечник и плаценту. В основном она производится в печени и костном мозге. При заболеваниях костей уровень ЩФ повышается вследствие активности остеобластов и варьируется в зависимости от возраста и пола [8]. Витамин D входит в состав пищевых продуктов в виде холекальциферола. Это единственный витамин, синтез которого в организме нуждается в определенном количестве прямых солнечных лучей помимо его получения с ежедневным питанием. Витамин D накапливается в нескольких частях тела, например в коже, стимулирует усвоение кальция из тонкого кишечника, повышает реабсорбцию кальция в дистальных почечных канальцах [6, 7, 8].
Регулярная физическая нагрузка снижает риск возникновения проблем со здоровьем, включая ожирение, болезни сердца, инсульт, рак толстой кишки, диабет и остеопороз [9]. Она считается профилактикой снижения риска остеопороза, падений и переломов. Физические нагрузки, такие как гимнастика и тяжелая атлетика, приводящие к высокой нагрузке на организм и связанные с интенсивным противодействием силе тяжести, оказывают более сильное остеогенное воздействие по сравнению с такими видами деятельности, как плавание и езда на велосипеде, в результате которых потребляется много энергии [10]. Данные свидетельствуют о том, что увеличение нагрузки оказывает более благоприятный эффект по сравнению с повторением упражнений с той же нагрузкой [11].
Физическая активность играет важную роль в развитии и поддержании МПК [12]. Она улучшает прочность костей, создавая периодические механические нагрузки на скелетную систему. Исследования показали, что тип, интенсивность и продолжительность упражнений влияют на МПК. Таким образом, физическая активность необходима для развития и поддержания массы и плотности костей. Пиковое приложение усилий является важным и решающим фактором при анализе механической нагрузки на кости [13, 14].
Механизм остеогенной реакции на нагрузку предполагает, что длительная физическая активность оказывает анаболическое воздействие на кости и улучшает плотность и прочность костей. Результаты экспериментальных исследований показали, что длительный курс физической нагрузки с высокоскоростным тяговым усилием и высоким пиковым усилием оказывал большее влияние на остеогенную ответную реакцию кости по сравнению с упражнениями с высокой повторяемостью и приложением низких усилий [15, 16]. Исследования продемонстрировали положительное влияние длительной тренировки (от шести до 36 месяцев) на увеличение плотности кости, в то время как короткая тренировка (менее шести месяцев) не дает аналогичных результатов [15, 16].
В работе Marques et al. [17] сделан вывод, что восемь месяцев тренировок с отягощениями могут быть более эффективными по сравнению с аэробными упражнениями и способны вызывать благоприятные изменения в МПК и силе мышц. Кроме того, результат Hawley et al. [18] свидетельствуют, что упражнения с отягощениями эффективны для увеличения МПК у здоровых молодых мужчин, но не влияют на МПК у женщин. Соответствующие возрасту упражнения могут привести к улучшению чувства равновесия, гибкости, координации и росту мышц, потому что мышцы поддерживают кости, а также увеличивают кровоснабжение костей и суставов. Все эти факторы в совокупности предотвращают падения и переломы.
Согласно обзорной литературе о диетах и физических упражнениях, пока не ясно, могут ли эти факторы каждый по отдельности увеличивать МПК у молодых женщин с остеопорозом или они будут более эффективны при их использовании в комбинации. Американский колледж спортивной медицины в последние годы сравнивал модели тренировок с одними только аэробными упражнениями или упражнениями с отягощениями. Настоящее исследование направлено на изучение и сравнение преимуществ сочетания физической нагрузки, в том числе аэробных и силовых упражнений с отягощениями с потреблением молока для молодых женщин с остеопорозом, с применением этих подходов по отдельности.
Методы
Участниками исследования стали 40 иранских молодых женщин с диагнозом «остеопороз» в возрасте от 30 до 45 лет. Участники заявили о своем согласии на добровольной основе после ознакомления с объявлениями в медицинских учреждениях и связанных с ними лабораториях в городе Бандар-э-Анзали. Критериями включения являлись отсутствие некоторых заболеваний (патологий щитовидной железы, сахарного диабета), приема определенных лекарств (влияющих на МПК, например, кортикостероидов), отсутствие регулярной физической нагрузки (малоподвижный образ жизни) и потребления молочных продуктов с низким содержанием жира (молока, йогурта, сыра) как источника витамина D. Участники исследования придерживались обычной диеты и мало находились на солнце из-за географических условий проживания, религиозных убеждений и типа одежды. Пищевое потребление кальция оценивали по трехдневному рациону (потребление кальция составляло 300—650 мг в день). Физическая нагрузка участников исследования ограничивалась только повседневной деятельностью (уборка дома, покупка продуктов, стирка и т. д., но не включала подвижные игры/спорт и другие формы активной физической нагрузки). Университетский комитет по этике утвердил данные условия проекта.
Из 150 человек, посещающих центры денситометрии, 40 человек соответствовали критериям исследования; они были случайным образом разделены на четыре группы по десять человек: аэробные и силовые тренировки в сочетании с потреблением молока, только тренировки, только потребление молока и контрольная группа. После ознакомления участников с целями и процедурами исследования они заполняли форму информированного согласия. Затем лаборант выполнил измерения МПК поясничного отдела позвоночника и тазобедренных суставов участников. За два-три дня до начала тренировок и на пятый день менструального цикла после 8—10-часового голодания выполнен забор крови на анализ для определения уровней 25OH-D и ЩФ во всех четырех группах (аэробные и силовые тренировки в сочетании с потреблением молока, только тренировки, только потребление молока и контрольная группа). Начало тренировок и сдача анализа крови скорректированы с учетом пятого дня менструального цикла для каждой женщины. Предварительные и последующие тесты проводились до и после 2,5 месяцев выполнения двух видов тренировок и потребления молока участниками разных групп.
Участники групп потребления молока и тренировок с в сочетании с потреблением молока выпивали по 500 мл молока в сутки в течение 10 недель [14]. Участники этих групп пили молоко перед тренировкой (250 мл) и через час после нее (250 мл). В исследовании использовалось обычное молоко с низким содержанием жира, которое можно купить в магазинах. Питательная ценность 250 мл молока: энергетическая ценность — 113 ккал; белок — 8,0 г; углеводы — 11,5 г; жиры — 3,8 г; кальций — 338 мг; цинк —1,0 мг; йод — 33 мкг; витамин А — 400 мкг; витамин D3 — 6,25 мкг; витамин В2 — 0,33 мг; витамин B12 — 1,30 мкг.
После измерения роста и массы рассчитывался индекс массы тела (ИМТ) путем деления массы (в килограммах) на рост в квадрате (в метрах). Кроме того, для измерения отношения талии к бедрам (WHR, waist to hip ratio) окружность талии разделялась на окружность бедер. Исследователи использовали метод Джексона-Поллока для измерения процентного содержания телесного жира и толщины подкожного жира в трех точках тела: трицепс, позвоночник и бедро, плотность тела определяли для каждого участника исследования [19 ]. Затем, используя уравнение Брозека, рассчитывали процентное содержание телесного жира для каждого участника исследования [20]. Толщина складки кожи измерялась с помощью калиброванных штангенциркулей (модель Lafayette o1127, США) с точностью до 1 мм. Все измерения выполнялись три раза на правой стороне тела, их среднее значение использовалось в качестве основного показателя.
Протокол тренировки
Аэробные и силовые тренировки проводились в группах в течение десяти недель по три занятия в неделю (каждое занятие длилось примерно 90—110 минут). Тренировки начинались с упражнений на растяжку и разминки (10—15 минут) и продолжались аэробными упражнениями (25—40 минут), упражнениями с отягощениями (на различных тренажерах (25—40 минут)) и заканчивались заминкой (успокаивающие упражнения) / упражнениями на растяжку (10—15 минут). Аэробная тренировка включала в себя три подхода по 5 минут, бег с максимальной ЧСС, равной 55—75% целевого уровня (HRmax) (ЧСС во время упражнений постоянно контролировалась мониторами сердечного ритма (Polar, AXN500)). Увеличивались как интенсивность упражнений — постепенно, на основе 5%-го роста HRmax, так и продолжительность тренировок — на три-пять минут каждые две недели (период отдыха составлял примерно три минуты перед каждым подходом). Во время силовых тренировок участники исследования выполняли два вида жима лежа, разгибание ног, отжимания с широким упором и вращения ногами (упражнение «велосипед») с 10RM (участницы исследования занимались на тренажерах с переменным сопротивлением). Для сведения к минимуму усталости упражнения для верхней/нижней части тела производились попеременно, с отдыхом в течение приблизительно одной-двух минут перед каждым подходом. Интенсивность тренировки постепенно увеличивалась каждые две недели еще на 10RM (рис. 1).
 Рисунок 1. Дизайн исследования
Рисунок 1. Дизайн исследованияСокращения: ALP — щелочная фосфатаза; 25OH-D — 25-гидроксивитамин D; МПК — минеральная плотность кости.
Анализ крови — определение уровней 25OH-D и ЩФ (ALP)
Перед взятием крови на анализ участники исследования воздерживались от приема пищи в течение восьми-десяти часов. Измерение уровней 25OH-D и ALP в сыворотке крови проводили в течение 48 часов до и после тренировки, кровь брали из плечевой вены в положении сидя в количестве 5 см3 (первоначальные измерения скорректированы с учетом пятого дня менструального цикла для каждой женщины). После транспортировки в лабораторию и центрифугирования при 3000 об/мин уровни 25OH-D и ЩФ определяли с использованием различных анализаторов. Уровень 25OH-D измеряли с CV 2 до 3% с помощью устройства для проведения анализа Elisa (модель Danna) и прибора, собранного в Иране из американских деталей, уровень ЩФ — на анализаторе Hitachi (911, Япония) с чувствительностью 3%. В соответствии с определениями Института медицины (IOM — Institute of Medicine), «дефицит» — значение уровня 25OH-D ниже 12 нг/мл (30 нмоль/л), «достаточное потребление» — значение уровня 25OH-D выше 20 нг/мл (50 нмоль/л) [21].
Измерение МПК
МПК измеряли в двух местах - в поясничном отделе позвоночника (L2—L4) и на уровне тазобедренного сустава с помощью прибора DXA (UNIGAMMA PLUS AC 230 В, 50/60 Гц, 400 Вт, США). В анализе оценивалась МПК позвонков от L2 до L4 поясничного отдела позвоночника. МПК шейки бедренной кости измерялась с правой и левой стороны. ВОЗ определяет остеопению и остеопороз на основе значений МПК: остеопения — МПК менее 1 и более 2,5 стандартных отклонений по отношению к средней МПК у молодых людей, а остеопороз — МПК менее 2,5 стандартных отклонений по отношению к средней МПК молодых людей [22].
Статистический анализ
Среднее значение и стандартное отклонение рассчитаны с использованием описательной статистики. Тест Шапиро - Уилка использовался для проверки нормальности распределения данных, в качестве базового выбран однофакторный анализ ANOVA. Однофакторный анализ ковариации (ANCOVA, One-way Analysis of Covariance) применялся для сравнения значений показателей групп после тестирования, потому что некоторые из предварительных тестов были разными в четырех группах, эффекты предварительных тестов корректировались с помощью ANCOVA. В случае значительного F-отношения для парных сравнений использовались специальные апостериорные анализы наименьшей значимой разности (LSD, Least Significant Difference). Для сравнения межгрупповых изменений применялся парный t-критерий. Анализы выполнены с применением программ SPSS 20 и Excel 2010. P ≤ 0,05 считалось уровнем значимости.
Результаты
Основные показатели МПК у участников исследования приведены в таблице 1. В начале исследования не обнаружено статистических различий по возрасту, росту, весу, ИМТ, WHR, количеству жировой ткани и уровню ALP (p> 0,05). Однако уровни 25OH-D, МПК шейки бедренной кости и поясничного отдела позвоночника показали значительные различия (р <0,05) (см. таблица 1). Эффект предварительных испытаний корректировался с помощью ANCOVA.
Таблица 1. Демографические характеристики и некоторые показатели МПК перед началом исследования в группах
Результаты сравнения парных t-критериев показали, что изменения в уровнях 25OH-D и ALP в группе тренировок в сочетании с потреблением молока значительны (25OH-D: p <0,001, p <0,001, p = 0,03; ALP: p <0,001, р <0,001, р = 0,01, соответственно). Изменения значений МПК шейки бедренной кости (правой и левой) и МПК поясничного отдела позвоночника в группе тренировок в сочетании с потреблением молока и только тренировок также значительны (справа: р <0,001, р = 0,01; слева: р <0,001, р <0,001; поясничный отдел позвоночника: р = 0,02, р <0,001; соответственно), хотя в группе только потребления молока существенных изменений не произошло (р = 0,15, р = 0,09, р = 0,10; соответственно) (рисунок 2).

Рисунок 2. Изменения в уровнях ALP (a) и 25OH-D (b), значениях МПК шейки правой (c) и левой (d) бедренной кости, поясничного отдела позвоночника (e) после 10-недельной тренировочной интервенции (среднее значение ± SD)
* отмечены существенные различия между исходными и последующими значениями (p ≤ 0,05).
SD — стандартное отклонение; ИМТ — индекс массы тела; WHR — отношение окружности талии и бедер; ALP — щелочная фосфатаза; 25OH-D — 25-гидроксивитамин D; МПК — минеральная плотность кости; CT + MC (concurrent training-milk consumption) —тренировки в сочетании с потреблением молока; КТ (concurrent training) — только тренировки; MC (milk consumption) — только потребление молока; С — контроль.
Как видно из таблицы 2, результаты апостериорного анализа ANCOVA и LSD продемонстрировали существенные различия в уровне 25OH-D, значениях МПК для шейки правой бедренной кости и поясничного отдела позвоночника в группе тренировок в сочетании с потреблением молока по сравнению с группами только тренировок, только потребления молока и контролем (25OH-D: р = 0,04, р = 0,009, р <0,001; правая бедренная кость: р = 0,001, р = 0,001, р <0,001; поясничный отдел позвоночника: р = 0,01, р <0,001, р <0,001 соответственно). Изменения уровня 25OH-D в группе тренировок в сочетании с потреблением молока значительны по сравнению с контрольной группой, хотя не достигли той же значимости по сравнению с группой потребления молока (р = 0,01, р = 0,49 соответственно). Изменения уровня ALP в группе тренировок в сочетании с потреблением молока оказались значительными по сравнению с контрольной группой (р = 0,03), тогда как в группах только тренировок и потребления молока значительных расхождений не наблюдалось (р = 0,73, р = 0,14 соответственно). Изменения МПК шейки левой бедренной кости в группе тренировок в сочетании с потреблением молока значительны по сравнению с группами потребления молока и контролем (р <0,001, р <0,001 соответственно), в то время как значительных расхождений по сравнению с группой тренировок не было (р = 0,11). Изменения МПК в области левого бедра и поясничного отдела позвоночника в группе в группе тренировок в сочетании с потреблением молока значительны по сравнению с группой потребления молока и контрольной группой (левая бедренная кость: р <0,001, р = 0,006; поясничный отдел позвоночника: р <0,001, р <0,001 соответственно); в то время как изменения в МПК шейки правой бедренной кости и уровне ALP между группами тренировок, потребления молока и контролем незначительны (правое бедро: p = 0,73, p = 0,20; ALP: p = 0,24, p = 0,07 соответственно) (таблица 2).
Таблица 2. Результаты ANCOVA и апостериорного анализа
Обсуждение
В настоящем исследовании изучалось влияние тренировок и потребления молока на некоторые показатели МПК у женщин с остеопорозом. Результаты свидетельствуют о большем влиянии тренировок в сочетании с потреблением молока на МПК молодых женщин с остеопорозом по сравнению с потреблением молока или выполнением тренировок по отдельности.
Нагрузка на опорные поверхности костей и сила деформации, вызванные различными сокращениями мышц во время тренировки, могут в некоторой степени стимулировать костную ткань, поэтому такие механические нагрузки способны улучшить ее прочность и биохимические свойства. Правильные механические напряжения обусловливают формирование кости, увеличение МПК и предотвращают развитие остеопороза [23]. Результаты обзора, проведенного Yuan et al. [23], показали, что физические упражнения повышают МПК, массу, прочность и механические свойства кости. Физическая нагрузка, по-видимому, прямо и косвенно влияет на все костные клетки и многие аспекты ремоделирования кости. Имеются данные, свидетельствующие об активизации с помощью физических упражнений формирования кости путем стимуляции мезенхимальных стволовых клеток, остеогенной дифференцировки и активности остеобластов и остеоцитов; важную роль играет механическая нагрузка, а также сигнальный путь Wnt-катенина и морфогенетических белков костей. Результаты исследований продемонстрировали увеличение остеогенной дифференцировки и образования костной ткани из-за изменений уровней гормонов, таких как паратиреоидный гормон (ПТГ), эстроген и простагландин E2 вследствие физической нагрузки. Конечно, интенсивность и тип физических упражнений имеют индивидуальное влияние на людей [23].
В нескольких исследованиях изучалось воздействие разных видов тренировок на МПК, в то время как основное внимание уделялось отдельному изучению аэробных и силовых упражнений с отягощениями. Только аэробные упражнения слабо воздействуют на МПК взрослых людей. Доказательства эффективности такого типа тренировок для борьбы с возрастной потерей костной массы представляются спорными [24, 25]. Результаты исследования Silverman et al. [26] показали, что после 24 недель тренировок в виде ходьбы плотность шейки бедренной кости увеличилась на 2% у женщин в период постменопаузы. Протокол аэробных тренировок обычно включает в себя ходьбу без боковых и скручивающих движений, что недостаточно для увеличения плотности костей. В идеальном состоянии бег и ходьба могут быть эффективными в ограничении снижения плотности костной ткани у пожилых людей; в любом случае, польза тренировок со средней и высокой интенсивностью остается противоречивой. Аэробные тренировки низкой интенсивности, такие как ходьба, оказывают меньшее давление на тело по сравнению с бегом, поэтому влекут за собой только слабую остеогенную стимуляцию [27]. Alghadir et al. [28] предположили, что аэробные упражнения умеренной интенсивности способны защитить кость и хрящ, регулируя содержание микроэлементов, участвующих в биосинтезе костного матрикса, и ингибировать процесс резорбции кости с помощью соответствующего механизма свободных радикалов. Исследование Wen et al. [29] продемонстрировало пользу краткосрочных групповых занятий степ-аэробикой для метаболизма костей и снижения активность их резорбции.
Результаты работы Mosti et al. [30] показали, что после 12 недель силовых тренировок у женщин в период постменопаузы в группах с диагнозами «остеопения» и «остеопороз» улучшились 1RM и скорость нарастания силы, а плотность костей в поясничном отделе позвоночника и шейке бедра увеличилась на 2,9 и 4,9% соответственно. Уровни в сыворотке крови амино-терминального пропептида коллагена типа 1 (P1NP, type 1 collagen amino-terminal propeptide) / продуктов расщепления коллагена С типа 1 (СТХ, collagen C breakdown products) продемонстрировали незначительную тенденцию к увеличению, что представляет собой стимуляцию образования кости. Результаты исследования Petersen et al. [31] позволяют предположить, что программа физических упражнений с низкой нагрузкой и большим количеством повторений может стать эффективным способом улучшения костной массы у взрослых. В своей работе Watson et al. [32] предположили, что возможно увеличение показателей прочности костей у женщин в период постменопаузы с низкой костной массой после высокоинтенсивных упражнений с отягощениями и динамических тренировок.
Вопреки данным исследованиям, результаты работы Almstedt et al. [18] показали, что 24-недельные тренировки с отягощениями эффективны для увеличения МПК (на 2,7-7,7%) у здоровых молодых мужчин, но для женщин программа тренировок не дала такого результата (изменений МПК на 0,8-1,5%). Singh et al. [33] в своем исследовании женщин во время предменопаузального периода обнаружили, что силовые тренировки в ходе тренировочного курса продолжительностью более девяти месяцев не приводили к значительным изменениям общей МПК костей тела. Nakata et al. [34] пришли к выводу, что тренировки с отягощениями во время потери веса не влияют на МПК у женщин с избыточным весом в период предменопаузы.
Учитывая различие реакций женщин разных возрастов (возможно, из-за ухудшения способности костных клеток принимать физические сигналы или неспособности на них реагировать) и связи эстрогенной недостаточности с повышенной степенью ремоделирования кости [35], сделан вывод о корреляции реакции скелета на тренировки с возрастом. В целом влияние механических нагрузок на остеогенность уменьшается с возрастом, и, по-видимому, происходит постепенное снижение чувствительности кости к химическим и физическим сигналам [36].
Результаты исследований показали положительное влияние аэробных и силовых тренировок в сочетании с потреблением молока на МПК у молодых женщин с остеопорозом по сравнению с потреблением молока или тренировками по отдельности. В соответствии с этим мы можем сослаться на результаты работы Lester et al. [37], в которой изучалось влияние восьми недель аэробной, силовой и обоих видов тренировок на ответную реакцию биомаркеров кости у ранее неактивных молодых женщин. Полученные данные свидетельствуют, что влияние показателей остеогенной активности на биомаркеры костеобразования (костно-специфический уровень ЩФ и остеокальцина) возрастало в группах силовых тренировок и сочетании тренировок с потреблением молока. Тем не менее, биомаркеры резорбции кости (уровни устойчивой к тартрату кислой фосфатазы и дезоксипиридинолина) после курса тренировок снизились в группе силовых тренировок и увеличились в группе сочетания тренировок с потреблением молока. В аэробных и комбинированных группах наблюдались небольшие изменения в объеме кости и МПК [37]. Marques et al. [ 17 ] исследовали эффекты аэробных тренировок и тренировок с отягощениями. По данным результатам, после восьми месяцев тренировок (три занятия в неделю) только группа силовых тренировок продемонстрировала увеличение МПК вертела (2,9%) и всей бедренной кости (1,5%). Исследователи заявили, что участники групп аэробных и силовых тренировок улучшили свой баланс, но не продемонстрировали значительных изменений в уровнях остеопротегерина (OPG, osteoprotegerin) и лиганда рецептора-активатора ядерного фактора каппа-В (RANKL, receptor activator of nuclear factor kappa B ligand) в сыворотке. Основываясь на результатах предыдущих и настоящего исследований, можно утверждать, что сочетание аэробных упражнений и тренировок с отягощениями (два вида тренировок) оказало наибольшее влияние на МПК и может быть более полезным по сравнению с выполнением только одного вида тренировки при профилактике остеопороза у молодых людей.
Кальций является важным питательным веществом и важен для здоровья костей, набора максимальной костной массы, профилактики и лечения остеопороза на протяжении всей жизни [38]. Основные механизмы, участвующие в контроле регенерации кости и гомеостаза кальция, включают изменения в плазменных уровнях ПТГ, кальцитриола, кальция и фосфата, маркеров регенерации кости вследствие гипопаратиреоза и гиперпаратиреоза, почечной недостаточности, ежедневного введения ПТГ 1-34 и ингибирования RANKL [39]. Что касается потребления молока и богатых кальцием продуктов, мы можем сослаться на исследование Dionyssiotis et al. [40], в котором подчеркивается благотворное влияние физической активности и соответствующего потребления кальция на костную массу. Исследователи отметили, что женщины, регулярно выполнявшие упражнения и потреблявшие более 800 мг кальция в день, имели более высокий Т-показатель по сравнению с группами, не принимавшими кальций.
Исследование Laird et al. [41] показало, что высокое потребление йогурта связано с увеличением МПК и высокими показателями выносливости. В этой работе впервые продемонстрировано значительное уменьшение шансов диагностики остеопении или остеопороза у женщин и остеопороза у мужчин при увеличении потребления йогурта. Ученые объясняют эту связь естественным составом йогурта (содержит минеральные вещества и витамины, необходимые для развития плотности костей). Chen et al. [42] обнаружили, что для здоровых женщин в период постменопаузы потребление сухого молока с высоким содержанием кальция для задержки и замедления потери костной массы оказалось эффективнее, чем только добавки кальция в высоких и средних дозах. Добавка, содержащая 300 мг кальция в день, не может затормозить потерю костной массы в поясничном отделе позвоночника и большом вертеле, но прибавление 600-900 мг кальция в день будет полезным. Ikedo et al. [43] исследовали бегуний на длинные дистанции. Ученые выяснили, что прием витамина D и молока с низким содержанием жира в течение шести месяцев улучшали метаболизм костной ткани, поддерживая концентрацию 25OH-D и уменьшая концентрацию ПТГ и воспалительных цитокинов. Rajatanavin et al. [38] утверждают, что добавление кальция в дозе 500 мг в день может снизить ремоделирование костной ткани и уменьшение массы костей у пожилых женщин.
Вопреки этим исследованиям в ходе метаанализа Tai et al. [44] предположили, что увеличение потребления кальция с повседневной пищей или прием пищевых добавок с кальцием вызывает небольшое увеличение МПК и незначительно снижает риск панкреатита. Метаанализ Bolland et al. [45] показал, что потребление кальция не связано с риском перелома костей. Эта же научная группа нашла слабыми и противоречивыми клинические доказательства того, что увеличение потребления кальция из пищевых источников является профилактикой переломов. Результаты исследования Hirota et al. [46] продемонстрировали уменьшение МПК поясничного отдела позвоночника после четырех месяцев диеты по сравнению с исходным значением как в контрольной группе, так и в группе потребления молока. Исследователи предположили, что мышечная масса в группе потребления молока была связана с изменениями МПК поясничного отдела позвоночника, а у участников с наибольшим увеличением мышечной массы не наблюдалось снижения МПК поясничного отдела позвоночника.
Клинические испытания показали, что добавление кальция с витамином D или без него может уменьшить вторичный гиперпаратиреоз, замедлить метаболизм костной ткани, локально увеличить МПК или замедлить потерю костной массы [6, 7, 8]. Благотворное влияние добавок на плотность кости обусловлено уменьшением пространства для ремоделирования кости, что приводит к снижению числа активируемых участков ремоделирования кости и, следовательно, к снижению резорбции кости [47]. Добавки кальция оказывают острое антирезорбтивное действие на кости, регулярно запускающее восстановление костной ткани для поддержания плотности костей или замедления снижения МПК, сохранения толщины коры за счет уменьшения эндокортикальной резорбции и, возможно, снижения скорости увеличения внутрикортикальной пористости и/или улучшения минерализации костей [47]. Исходя из результатов предыдущих и настоящего исследования, представляется, что потребление молока (как богатого источника кальция) может оказывать полезное влияние на костную массу молодых людей и предотвращать развитие остеопороза в ходе старения. Более того, сочетание потребления молока с одновременной тренировкой (аэробной и силовой) может увеличить его потенциал.
Заключение
Результаты настоящего исследования показали, что сочетание тренировки с потреблением молока оказывает на МПК молодых женщин с остеопорозом большее влияние по сравнению с раздельным употреблением молока или тренировкой. Таким образом, можно сделать вывод, что тренировки в комбинации с потреблением молока имеет смысл использовать в качестве эффективного способа повышения МПК у молодых женщин с диагностированным остеопорозом.
Список использованной литературы
- Kumar A, Mittal S, Orito S, Ishitani K, Ohta H. Impact of dietary intake, education, and physical activity on bone mineral density among north Indian women. J Bone Min Metab. 2010;28(2):192–201. ViewArticleGoogle Scholar
- El Hage R, Baddoura R. Anthropometric predictors of geometric indices of hip bone strength in a group of Lebanese postmenopausal women. J Clin Densitom. 2012;15(2):191–7.View ArticleGoogle Scholar
- Sambrook PC. Cooper. Osteoporosis Lancet. 2006;367:2010–8.View ArticleGoogle Scholar
- Prentice AM. Dairy products in global public health. Am J Clin Nutr. 2014;99(5):1212–6.View ArticleGoogle Scholar
- Heaney RP. Calcium, dairy products and osteoporosis. J Am Coll Nutr. 2000;19:83S–99S.View ArticleGoogle Scholar
- Zhu K, Devine A, Dick IM, Wilson SG, Prince RL. Effects of calcium and vitamin D supplementation on hip bone mineral density and calcium-related analytes in elderly ambulatory Australian women: a five-year randomized controlled trial. J Clin Endocrinol Metab. 2008;93:743–9.View ArticleGoogle Scholar
- Jackson RD, LaCroix AZ, Gass M, Wallace RB, Robbins J, Lewis CE, Bonds DE. Calcium plus vitamin D supplementation and the risk of fractures. N Engl J Med. 2006;354:669–83.View ArticleGoogle Scholar
- Daly RM, Bass S, Nowson C. Long-term effects of calciumvitamin-D3-fortified milk on bone geometry and strength in older men. Bone. 2006;39:946–53.View ArticleGoogle Scholar
- Maurel DB, Boisseau N, Ingrand I, Dolleans E, Benhamou CL, Jaffre C. Combined effects of chronic alcohol consumption and physical activity on bone health: study in a rat model. Eur J Appl Physiol. 2011;111(12):2931–40.View ArticleGoogle Scholar
- Nichols JF, Rauh MJ, Barrack MT, Barkai HS. Bone mineral density in female high school athletes: interactions of menstrual function and type of mechanical loading. Bone. 2007;41(3):371–7.View ArticleGoogle Scholar
- Novotny SA, Warren GL, Hamrick MW. Aging and the muscle-bone relationship. Physiology. 2015;30(1):8–16.View ArticleGoogle Scholar
- Polidoulis I, Beyene J, Cheung AM. The effect of exercise on PQCT parameters of bone structure & strength in postmenopausal women-a systematic review & meta-analysis of randomized controlled trials. Osteoporos Int. 2012;23:39–51.View ArticleGoogle Scholar
- Bemben DA, Bemben MG. Dose-response effect of 40 week of resistance training on bone mineral density in older adults. International osteoporosis foundation & national foundation. 2011;22:179–86.Google Scholar
- White KM, Bauer SJ, Hartz KK, Baldridge M. Changes in body composition with yogurt consumption during resistance training in women. Int J Sport Nutr. 2009;19(1):18.Google Scholar
- Warden SJ, Fuchs RK, Turner CH. Steps for targeting exercise towards the skeleton to increase bone strength. Eur Medicophys. 2004;40:223.Google Scholar
- Kemmler W, Engelke K, Lauber D, Weineck J, Hensen J, Kalender WA. Exercise effects on fitness and bone mineral density in early postmenopausal women: 1-year EFOPS results. Med Sci Sports Exerc. 2002;34:2115.View ArticleGoogle Scholar
- Marques EA, Wanderley F, Machado L, Sousa F, Viana JL, Moreira-Gonçalves D, Carvalho J. Effects of resistance and aerobic exercise on physical function, bone mineral density, OPG and RANKL in older women. Exp Gerontol. 2011;46(7):524–32.View ArticleGoogle Scholar
- Almstedt HC, Canepa JA, Ramirez DA, Shoepe TC. Changes in bone mineral density in response to 24 weeks of resistance training in college-age men and women. J Strength Cond Res. 2011;25(4):1098–103.View ArticleGoogle Scholar
- Jackson AS, Pollock ML. Generalized equations for predicting body density of men. Br J Nutr. 1978;40(03):497–504.View ArticleGoogle Scholar
- Brozek J, Grande F, Anderson JT, Keys A. Densitometric analysis of body composition: revision of some quantitative assumptions. Ann N Y Acad Sci. 1963;110:113–40.View ArticleGoogle Scholar
- IOM (Institute of Medicine). Dietary reference intakes for calcium and vitamin D. Washington, DC: National Academies Press; 2011.Google Scholar
- WHO. Scientific Group on Prevention, Management of Osteoporosis, & World Health Organization. In: Prevention and management of osteoporosis: report of a WHO scientific Group World Health Organization, vol. 921; 2003.Google Scholar
- Yuan Y, Chen X, Zhang L, Wu J, Guo J, Zou D, Zou J. The roles of exercise in bone remodeling and in prevention and treatment of osteoporosis. Prog Biophys Mol Biol. 2016;122(2):122–30.View ArticleGoogle Scholar
- Bonaiuti D, Shea B, Iovine R, Negrini S, Welch V, Kemper HH, Cranney A. Exercise for preventing and treating osteoporosis in postmenopausal women. Cochrane Libr. 2002.Google Scholar
- Brooke-Wavell K, Jones PR, Hardman AE, Tsuritan Yamada Y. Commencing, continuing and stopping brisk walking: effects on bone mineral density, quantitative ultrasound of bone and markers of bone metabolism in postmenopausal women. Osteoporos Int. 2001;12:581–7.View ArticleGoogle Scholar
- Silverman NE, Nicklas BJ, Ryan AS. Addition of aerobic exercise to a weight loss programme increases BMD, with an associated reduction in inflammation in overweight postmenopausal women. Calcif Tissue Int. 2009;84:257–65.View ArticleGoogle Scholar
- Liu PY, Brummel-Smith K, Ilich JZ. Aerobic exercise and whole-body vibration in offsetting bone loss in older adults. J Aging Res. 2011;2011:379674.View ArticleGoogle Scholar
- Alghadir AH, Gabr SA, Al-Eisa ES, Alghadir MH. Correlation between bone mineral density and serum trace elements in response to supervised aerobic training in older adults. Clin Interv Aging. 2016;11:265.PubMedPubMed CentralGoogle Scholar
- Wen HJ, Huang TH, Li TL, Chong PN, Ang BS. Effects of short-term step aerobics exercise on bone metabolism and functional fitness in postmenopausal women with low bone mass. Osteoporos Int. 2017;28(2):539–47.View ArticleGoogle Scholar
- Mosti MP, Kaehler N, Stunes AK, Hoff J, Syversen U. Maximal strength training in postmenopausal women with osteoporosis or osteopenia. J Strength Cond Res. 2013;27(10):2879–86.View ArticleGoogle Scholar
- Petersen BA, Hastings B, Gottschall JS. Low load, high repetition resistance training program increases bone mineral density in untrained adults. J Sport Med Phys Fit. 2017;57(1–2):70–6.Google Scholar
- Watson SL, Weeks BK, Weis LJ, Harding AT, Horan SA, Beck BR. High-intensity resistance and impact training improves bone mineral density and physical function in postmenopausal women with osteopenia and osteoporosis: the LIFTMOR randomized controlled trial. J Bone Miner Res. 2017;33(2):211–20.View ArticleGoogle Scholar
- Singh JA, Schmitz KH, Petit MA. Effect of resistance exercise on bone mineral density in premenopausal women. Joint Bone Spine. 2009;76:273–80.View ArticleGoogle Scholar
- Nakata Y, Ohkawara K, Lee DJ, Okura T, Tanaka K. Effects of additional resistance training during diet-induced weight loss on bone mineral density in overweight premenopausal women. J Bone Miner Metab. 2008;26:172–7.View ArticleGoogle Scholar
- Lanyon L, Skerry T. Postmenopausal osteoporosis as a failure of bone's adaptation to functional loading: a hypothesis. J Bone Miner Res. 2001;16:1937–47.View ArticleGoogle Scholar
- Rubin CT, Bain SD, McLeod KJ. Suppression of the osteogenic response in the aging skeleton. Calcif Tissue Int. 1992;50:306–13.View ArticleGoogle Scholar
- Lester ME, Urso ML, Evans RK, Pierce JR, Spiering BA, Maresh CM, Nindl BC. Influence of exercise mode and osteogenic index on bone biomarker responses during short-term physical training. Bone. 2009;45(4):768–76.View ArticleGoogle Scholar
- Rajatanavin R, Chailurkit L, Saetung S, Thakkinstian A, Nimitphong H. The efficacy of calcium supplementation alone in elderly Thai women over a 2-year period: a randomized controlled trial. Osteoporos Int. 2013;24(11):2871–7.View ArticleGoogle Scholar
- Peterson MC, Riggs MM. A physiologically based mathematical model of integrated calcium homeostasis and bone remodeling. Bone. 2010;46(1):49–63.View ArticleGoogle Scholar
- Dionyssiotis Y, Paspati I, Trovas G, Galanos A, Lyritis GP. Association of physical exercise and calcium intake with bone mass measured by quantitative ultrasound. BMC Wom Health. 2010;10(1):1.View ArticleGoogle Scholar
- Laird E, Molloy AM, McNulty H, Ward M, McCarroll K, Hoey L, Casey MC. Greater yogurt consumption is associated with increased bone mineral density and physical function in older adults. Osteoporos Int. 2017:1–11.Google Scholar
- Chen Y, Xiao Y, Xie B, Zhang Q, Ma X, Li N, Zhang Q. Effect of milk powder supplementation with different calcium contents on bone mineral density of postmenopausal women in northern China: a randomized controlled double-blind trial. Calcif Tissue Int. 2016;98(1):60–6.View ArticleGoogle Scholar
- Ikedo A, Arimitsu T, Kurihara T, Ebi K, Fujita S. The effect of ongoing vitamin D and low-fat milk intake on bone metabolism in female high-school endurance runners. J Clin Med Res. 2017;10(1):13–21.PubMedPubMed CentralGoogle Scholar
- Tai V, Leung W, Grey A, Reid IR, Bolland MJ. Calcium intake and bone mineral density: systematic review and meta-analysis. Br Med J. 2015;351:h4183.View ArticleGoogle Scholar
- Bolland MJ, Leung W, Tai V, Bastin S, Gamble GD, Grey A, Reid IR. Calcium intake and risk of fracture: systematic review. Br Med J. 2015;351:h4580.View ArticleGoogle Scholar
- Hirota T, Kawasaki I, Hirota K. Effects of high calcium and vitamin D diets on changes in body fat, lean mass, and bone mineral density by self-controlled dieting for 4 months in young Asian women. In: Nutritional influences on bone health. Springer London; 2011. p. 73–9.View ArticleGoogle Scholar
- Daly RM, Kukuljan S. Independent and combined effects of exercise and calcium on bone structural and material properties in older adults. In: Nutritional influences on bone health. London: Springer; 2011. p. 51–8.View ArticleGoogle Scholar





