3311
25 Мая 2020
Автор: Pradeep Reddy Marri, Debra A. Stern, Anne L. Wright, Dean Billheimer, Fernando D. Martinez Тусон, Аризона
Источник: www.sciencedirect.com
Опубликовано: Февраль 2013
Предпосылки для проведения исследования: становится все более очевидным, что микробная колонизация дыхательных путей может играть определенную роль в патогенезе бронхиальной астмы.
Цель: наша цель состояла в том, чтобы описать характеристики и сравнить микробиом индуцированной мокроты у взрослых пациентов с бронхиальной астмой и без бронхиальной астмы.
Методы: образцы индуцированной мокроты взя...
Источник: www.sciencedirect.com
Опубликовано: Февраль 2013
Предпосылки для проведения исследования: становится все более очевидным, что микробная колонизация дыхательных путей может играть определенную роль в патогенезе бронхиальной астмы.
Цель: наша цель состояла в том, чтобы описать характеристики и сравнить микробиом индуцированной мокроты у взрослых пациентов с бронхиальной астмой и без бронхиальной астмы.
Методы: образцы индуцированной мокроты взя...
Автор: Pradeep Reddy Marri, Debra A. Stern, Anne L. Wright, Dean Billheimer, Fernando D. Martinez Тусон, Аризона
Источник: www.sciencedirect.com
Опубликовано: Февраль 2013
Предпосылки для проведения исследования: становится все более очевидным, что микробная колонизация дыхательных путей может играть определенную роль в патогенезе бронхиальной астмы.
Цель: наша цель состояла в том, чтобы описать характеристики и сравнить микробиом индуцированной мокроты у взрослых пациентов с бронхиальной астмой и без бронхиальной астмы.
Методы: образцы индуцированной мокроты взяли у 10 участников без бронхиальной астмы и у 10 участников с активной бронхиальной астмой легкой степени (8 из 10 участников не принимали ингаляционные кортикостероиды). Из супернатантов мокроты выделяли общую ДНК и амплифицировали с помощью праймеров, специфичных к гипервариабельному сегменту V6 бактериальной 16s рРНК. Образцам присваивали штрих-коды, после чего объединяли эквимолярные концентрации 20 образцов и секвенировали с помощью секвенатора 454 GS FLX. Последовательности относили к бактериальным таксонам путем их сопоставления с последовательностями 16s рРНК из Проекта базы данных рибосом.
Результаты: все образцы мокроты содержали 5 основных типов бактерий: фирмикуты, протеобактерии, актинобактерии, фузобактерии и бактероидеты; первые три типа составляли более 90 % общих последовательностей. У участников с бронхиальной астмой наблюдалась более высокая доля протеобактерий (37 % в сравнении с 15 %, р < 0,001).
Фирмикуты (47 % в сравнении с 63 %, р = 0,17) и актинобактерии (10 % в сравнении с 14 %, р = 0,36), напротив, обнаруживались в большем количестве в образцах, взятых у участников без бронхиальной астмы, хотя эти различия не были статистически значимыми. После иерархической кластеризации было получено два значимых кластера: один из них содержал преимущественно образцы, взятые у участников с бронхиальной астмой, а другой — преимущественно образцы, взятые у участников без бронхиальной астмы. Кроме того, в образцах, взятых у участников с бронхиальной астмой, наблюдалось большее разнообразие бактерий, чем в образцах, взятых у участников без бронхиальной астмы.
Выводы: у участников с легкой формой бронхиальной астмы отмечен измененный микробный состав в дыхательных путях, сходный с таковым, наблюдаемым у участников с более тяжелой формой бронхиальной астмы (J Allergy Clin Immunol 2013;131:346 52).
Ключевые слова: бронхиальная астма, микробиом, протеобактерии, метагеномика, мокрота
Основная часть
Бронхиальная астма является хроническим заболеванием дыхательных путей, однако генетические факторы и факторы окружающей среды, которые определяют развитие заболевания, не совсем понятны. Несколько наборов данных свидетельствуют о том, что в патогенезе бронхиальной астмы может играть определенную роль микробная колонизация дыхательных путей. Имеются случаи выделения Mycoplasma pneumoniae и Chlamydophila pneumoniae у участников с обострениями бронхиальной астмы.1,2 Это указывает на то, что для лечения таких обострений можно применять макролиды и подобные соединения, и в клиническом исследовании кетолидов были получены многообещающие результаты.3 В отчете, при составлении которого использовалась большая база данных участников в штате Теннесси, был сделан вывод о том, что у участников с бронхиальной астмой вероятность развития инвазивной пневмококковой пневмонии как минимум в два раза выше, чем у участников из контрольной группы.4 Bisgaard и соавт.5 сообщили, что новорожденные, у которых в возрасте 1 месяц произошла колонизация верхних дыхательных путей Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis или комбинацией этих микроорганизмов подвержены повышенному риску развития рецидивирующего бронхообструктивного синдрома (свистящее дыхание) и бронхиальной астмы в более позднем возрасте. В большинстве этих исследований микробиологические агенты выявляли с помощью «целенаправленной» ПЦР или путем культивирования конкретных микроорганизмов, поэтому исследования отражали лишь небольшую часть существующих таксонов. Описание всего микробного разнообразия в дыхательных путях позволит получить представление о той роли, которую микробиом играет в патогенезе бронхиальной астмы. Метагеномика позволяет изучить микробы в их естественном экологическом состоянии и дает независимые от культуры оценки микробного разнообразия.6 Метагеномные подходы успешно использовали для демонстрации влияния микробиома на несколько аспектов здоровья человека, например, на ожирение, сахарный диабет и воспалительные заболевания кишечника.7-10 В ходе двух недавно проведенных исследований метагеномные подходы использовали для характеристики микробных сообществ в дыхательных путях при бронхиальной астмой и в отсутствии бронхиальной астмы, присутствовавших в образцах бронхиального секрета. Используя ПЦР и секвенирование по Сенгеру, Hilty и соавт.11 установили, что в дыхательных путях участников с бронхиальной астмой и без бронхиальной астмы присутствуют около 120 различных групп бактерий, при этом протеобактерии наблюдаются в большем количестве в образцах бронхиального секрета, полученных у участников с бронхиальной астмой, а бактероидеты — в образцах бронхиального секрета, полученных у участников без бронхиальной астмы. В более позднем исследовании, в котором использовался метод PhyloChip, у участников с бронхиальной астмой наблюдалась более высокая бактериальная нагрузка, чем у участников из контрольной группы. У участников с бронхиальной астмой в данном исследовании также было выявлено большее количество протеобактерий.12 Однако все участники с бронхиальной астмой, у которых брали образцы в обоих исследованиях, принимали ингаляционные кортикостероиды, и влияние кортикостероидов на микробиом установить не удалось.
Насколько нам известно, ни в одном из исследований не были всесторонне охарактеризованы бактериальные сообщества в индуцированной мокроте участников с бронхиальной астмой и без бронхиальной астмы. Мы использовали высокопроизводительное 454-секвенирование на образцах индуцированной мокроты, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Восемь из 10 участников с бронхиальной астмой не принимали кортикостероиды на момент включения в исследование, а 2 из 10 принимали их нечасто.
МЕТОДЫ: Участники и образцы мокроты
В рамках данного исследования были получены образцы индуцированной мокроты у 10 участников с активной бронхиальной астмой, диагностированной врачом, и у 10 участников без бронхиальной астмы. Сбор образцов проводили в рамках продолжающегося исследования дыхательной системы у детей в г. Тусон в неселективной когорте лиц, родившихся в одном и том же году; в настоящее время участники данного исследования являются взрослыми людьми, которым немного больше 30 лет.13 Информацию по бронхиальной астме, бронхообструктивному синдрому (свистящее дыхание), бронхиту и курению брали из анкет, заполнявшихся участниками в возрасте 26 лет. Спирометрию выполняли в соответствии со стандартами Американского общества специалистов в области торакальной медицины, и никто из участников не пользовался бронходилататором в течение 6 часов, предшествующих проведению теста. После исходной спирометрии участники принимали альбутерол в фиксированной дозе, в виде двух ингаляций (180 мкг), используя ингалятор отмеренных доз и удерживающее устройство для карманной камеры Аэрочамбер («Монаган Медикал Корп.», г. Платтсбург, штат Нью-Йорк), и через 15 минут им проводили повторную спирометрию после введения бронходилататора. Проводили провокационные пробы с метахолином согласно протоколу, описанному Yan и соавт.14, и рассчитывали угол наклона кривой зависимости «доза-ответ» в соответствии с описанием, приведенным в работе Stein и соавт.15 Кожные пробы на сенсибилизацию к местным аэроаллергенам выполняли согласно описанию, приведенному ранее.16 Этническую принадлежность/расу определяли на основании информации, указанной родителями при рождении.
Сбор и обработка индуцированной мокроты
Индуцированную мокроту у каждого участника собирали после ингаляции 3 % физраствора в течение двух минут. Затем участник выплевывал слюну, два раза глубоко вдыхал физраствор и откашливал мокроту в отдельный стаканчик. Процедуру повторяли 6 раз; в общей сложности процесс занимал 12 минут. В течение процедуры отслеживали пиковую скорость. Перед индукцией мокроты ротовую полость промывали солевым раствором, чтобы свести к минимуму риск контаминации микробами из полости рта. В течение часа после сбора мокроты проводили подсчет клеток, добавляли в мокроту два объема дитиотреитола и энергично перемешивали образец на шейкере для планшетов в течение 15–20 минут для растворения слизи. Мокроту центрифугировали, супернатант мокроты собирали и хранили при температуре -70 °С. Аликвоту супернатанта использовали для выделения бактериальной ДНК.
Выделение и секвенирование ДНК
Из аликвоты супернатанта объемом 200 мл выделяли общую ДНК с помощью набора для выделения ДНК от компании «Киаген» («Киаген», Хильден, Германия) в соответствии с рекомендациями производителя. Бактериальную ДНК амплифицировали с помощью праймеров 967F и 1046R, специфичных к гипервариабельному сегменту V6 бактериальной 16s рРНК. Каждый прямой праймер имел последовательность адаптера и последовательность штрих-кода, которые позволяли идентифицировать образцы после секвенирования. Объединяли эквимолярные концентрации 20 образцов и секвенировали с помощью секвенатора 454 GS FLX, используя химию титана («454 Лайф Сайенсиз», Брэнфорд, Коннектикут), в соответствии с рекомендациями производителя.
Статистический анализ данных: Идентификация сообществ бактерий
После секвенирования считанные фрагменты предварительно обрабатывали, чтобы отбросить все фрагменты, не соответствующие штрих-кодам или последовательностям праймеров. В обеих последовательностях допускалось одно несоответствие. Вкратце, после фильтрации фрагментов низкого качества и удаления фрагментов, не соответствующих последовательностям штрих-кодов, каждый считанный фрагмент сопоставляли со всеми остальными фрагментами, которые были считаны в этом образце, чтобы выявить уникальные фрагменты. Уникальные фрагменты, считанные в каждом образце, кластеризовали в группы сходных последовательностей. Каждая группа отражала последовательность 16s рРНК того или иного вида/рода бактерий и представляла собой так называемую операбельную таксономическую единицу (ОТЕ). Все анализы проводили с помощью линейки 454-секвенирования из выпуска 10 Проекта базы данных рибосом (Проект базы данных рибосом, Ист-Лансинг, Мичиган).17 Последовательности относили к бактериальным таксонам путем их сопоставления с последовательностями 16s рРНК из Проекта базы данных рибосом (RDP), используя классификатор RDP.18 Для дальнейшего анализа использовали только те последовательности, которые можно было отнести к той или иной группе бактерий с достоверностью не менее 50 %. ОТЕ для каждого образца получали путем кластеризации последовательностей из отдельных образцов на генетическом расстоянии 0,03. Оценку видового богатства по Чао19 для каждого образца выполняли в программе Mothur.20 Для расчета индекса разнообразия Шеннона — математической меры, часто применяемой для характеристики видового разнообразия в том или ином сообществе, — использовали долю родов бактерий в каждом образце. Индекс Шеннона учитывает разнообразие и равномерность распределения видов бактерий, присутствующих в образцах, взятых у участников с бронхиальной астмой и без бронхиальной астмы.21 Иерархическую кластеризацию выполняли с использованием статистическом программном R-пакета pvclust22 (www.r-project.org), а подтверждение каждой ветви получали путем проведения бутстрэп-анализа с 10 000 повторностей (описание методов pvclust и бутстрэппинга приведено в разделе «Методы» электронного репозитория настоящей статьи на сайте www.jacionline.org).
Заявление об этике
Исследования, указанные в настоящем документе, одобрены Экспертным советом организации Аризонского университета, и у каждого участника было получено письменное информированное согласие.
РЕЗУЛЬТАТЫ
Характеристики участников исследования приведены в таблице I.15 Все участники входили в лонгитюдное исследование естественного развития бронхиальной астмы в неселективной когорте лиц, родившихся в одном и том же году,13 поэтому наличие бронхиальной астмы в анамнезе можно было подтвердить на основании имеющихся данных. Данные по применению ингаляционных лекарственных средств для лечения бронхиальной астмы или бронхообструктивного синдрома (свистящее дыхание) за последний год приведены в таблице II. Ни один из участников не сообщил о применении пероральных препаратов для лечения бронхиальной астмы за последний год. При проведении провокационных проб с метахолином угол наклона кривой зависимости «доза-ответ» у большинства участников с бронхиальной астмой составлял менее десятого процентиля от этого показателя в контрольной подгруппе здоровых участников без бронхиальной астмы и атопических нарушений (6/7). Данному критерию соответствовали только два участника без бронхиальной астмы (2/10, р = 0,008).
Средняя доля плоских клеток в образцах мокроты составила 34,8 % (СО 25,4 %). Образцам мокроты присваивали штрих-коды, после чего эквимолярные концентрации 20 образцов объединяли в один прогон секвенирования. После фильтрации считанных фрагментов низкого качества и удаления считанных фрагментов, не соответствующих последовательностям штрих-кодов, осталось около 800 000 фрагментов; в общей сложности на каждый образец приходилось в среднем 40 000 ± 11 245 (СО) фрагментов (таблица III). По результатам сопоставления каждого фрагмента, считанного в отдельном образце, со всеми остальными фрагментами, считанными в этом образце, было идентифицировано от 3919 до 10 608 уникальных фрагментов на образец. Кластеризация уникальных фрагментов, считанных в отдельных образцах, при подлинности 97 % показала присутствие в среднем 1500 ОТЕ и как минимум у одного участника было обнаружено 2264 ОТЕ. Согласно оценкам видового богатства по Чао, в настоящем исследовании было отражено 75–80 % от расчетного разнообразия бактерий в образцах мокроты, а для отражения полного разнообразия необходимо дополнительное секвенирование (см. рисунок E1 в электронном репозитории настоящей статьи на сайте www.jacionline.org).
ТАБЛИЦА I. Фенотипические характеристики участников исследования
 М — монголоидная раса; БД — бронходилататор; Л — латиноамериканского происхождения; Ж — женский пол; ФЖЕЛ — форсированная жизненная емкость легких; М — мужской пол; Н/О — не определено; НЛ — не латиноамериканского происхождения; Е — европеоидная раса.
М — монголоидная раса; БД — бронходилататор; Л — латиноамериканского происхождения; Ж — женский пол; ФЖЕЛ — форсированная жизненная емкость легких; М — мужской пол; Н/О — не определено; НЛ — не латиноамериканского происхождения; Е — европеоидная раса.
*Положительные реакции на один или несколько из 7 местных аэроаллергенов по результатам кожной пробы на аллергии в возрасте 26 лет.
†Времена года, в которые выполнялся сбор образцов индуцированной мокроты, определены следующим образом: зима (З; декабрь, январь и февраль), весна (В; март, апрель и май), лето (Л; июнь, июль и август) и осень (О; сентябрь, октябрь и ноябрь).
‡Наименьший угол наклона кривой зависимости «доза-ответ» (DRS) при проведении провокационных проб с метахолином согласно определению, приведенному в работе Stein и соавт.15, на основании данных, полученных у участников в возрасте 16, 22 и 25 лет.
§Этническая принадлежность отца неизвестна.
ǁСчиталось, что у участника имеется повышенная чувствительность бронхов, если при проведении провокационных проб с метахолином было получено значение угла наклона кривой зависимости «доза-ответ», составляющее менее десятого процентиля от этого показателя в контрольной подгруппе здоровых участников без бронхиальной астмы и атопических нарушений.
¶У участника А9 наблюдалась повышенная чувствительность к метахолину и были отмечены астмоподобные симптомы. Результаты спирометрии указывали на необратимое ограничение воздушного потока легкой степени.
ТАБЛИЦА II. Применение ингаляционных лекарственных средств для лечения бронхиальной астмы или бронхообструктивного синдрома за последний год: Частота (время от времени, не менее одного раза в неделю или ежедневно) и длительность применения в месяцах
 Ни один из участников не сообщил о применении пероральных препаратов для лечения бронхиальной астмы за последний год.
Ни один из участников не сообщил о применении пероральных препаратов для лечения бронхиальной астмы за последний год.
д/о — данные отсутствуют.
*Участники A2, A3, A7 и A8 не сообщали о применении лекарственных средств для лечения бронхиальной астмы или бронхообструктивного синдрома в течение года, предшествующего сбору образцов мокроты.
Бактериальные линии в каждом образце идентифицировали путем сопоставления последовательностей V6 с последовательностями бактериальной 16s рРНК из выпуска 10 Проекта базы данных рибосом. Все образцы мокроты содержали 5 основных типов бактерий: фирмикуты, протеобактерии, актинобактерии, фузобактерии и бактероидеты; первые три типа составляли более 90 % общих последовательностей как у участников с бронхиальной астмой, так и у участников без бронхиальной астмы (рисунок 1). У участников с бронхиальной астмой и без бронхиальной астмы были обнаружены различия в содержании протеобактерий и фирмикутов. У участников с бронхиальной астмой наблюдалась более высокая доля протеобактерий (37 % и 15 %, р < 0,001), особенно гамма-протеобактерий (р < 0,05, U-критерий Манна-Уитни). Фирмикуты (47 % и 63 %, р = 0,17) и актинобактерии (10 % и 14 %, р = 0,36), напротив, обнаруживались в большем количестве в образцах, полученных у участников без бронхиальной астмы, хотя выявленные различия не были статистически значимыми. Фирмикуты — грамположительные бактерии, которые в основном образуют эндоспоры и содержат некоторые известные патогенные бактерии, в числе которых виды Bacillus, Staphylococcus и Streptococcus. Бактероидеты — группа грамотрицательных бактерий, не образующих споры, которые широко присутствуют в окружающей среде.
После иерархической кластеризации (методом полной связи с евклидовой метрикой) всех образцов на основе парных значений R2 для состава сообществ бактерий было получено два значимых кластера: один содержал большинство образцов, полученных у участников с бронхиальной астмой (8 с бронхиальной астмой и 1 без бронхиальной астмы), а другой преимущественно состоял из образцов, полученных у участников без бронхиальной астмы (2 с бронхиальной астмой и 7 без бронхиальной астмы, рисунок 2).
ТАБЛИЦА III. Характеристики последовательностей в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы.
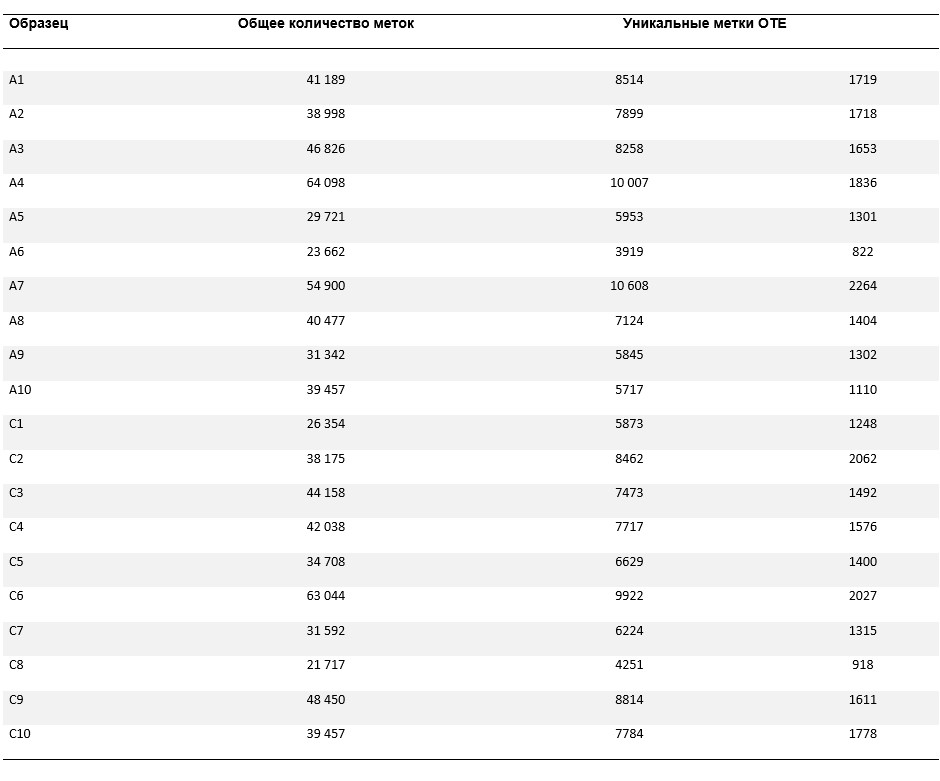 A1–A10 — участники с бронхиальной астмой; C1–C10 — участники без бронхиальной астмы.
A1–A10 — участники с бронхиальной астмой; C1–C10 — участники без бронхиальной астмы.
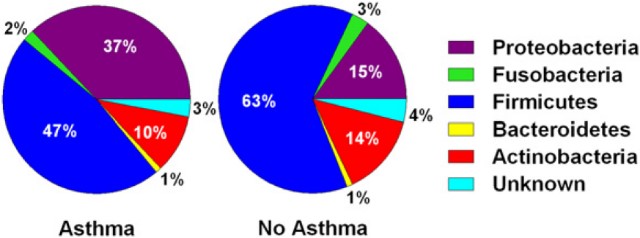
РИСУНОК 1. Медианные процентные значения содержания типов бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы, рассчитанные с использованием классификатора RDP, версия 2.1. На круговых диаграммах показано распределение микроорганизмов у участников с бронхиальной астмой и без бронхиальной астмы.
Это дополнительно указывает на сходство в составе микроорганизмов в образцах, связанное с наличием или отсутствием данного заболевания. Два образца, полученные у участников без бронхиальной астмы, не были включены ни в один из кластеров. Мы провели повторный анализ, но на этот раз только у участников с бронхиальной астмой и без бронхиальной астмы, имеющих атопические нарушения (см. рисунок E2 в электронном репозитории настоящей статьи на сайте www.jacionline.org). Полученные результаты были очень схожи с теми, что приведены на рисунке 2.
Только 60 % считанных фрагментов можно было отнести к тому или иному семейству бактерий с уровнем достоверности не менее 50 %. На основании этих отнесений образцы, представленные пятью типами бактерий, были распределены в 107 семейств бактерий. Были отмечены различия в относительном содержании 15 из 107 семейств бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы (рисунок 3). В образцах, полученных у участников с бронхиальной астмой, Enterobacteriaceae и Neisseriaceae встречались чаще, чем в образцах, полученных у участников без бронхиальной астмы, хотя выявленные различия не были статистически значимыми. Moraxellaceae и Pasteurellaceae, к которым принадлежат Moraxella catarrhalis и Haemophilus influenzae, также обнаруживались в большем количестве в образцах, полученных у участников с бронхиальной астмой. Prevotellaceae — семейство бактерий, принадлежащее к бактероидетам, — также наблюдалось в большем количестве в образцах, полученных у участников с бронхиальной астмой. Однако данное наблюдение отчасти могло быть связано с 10-кратным повышением содержания бактероидетов в образце, полученном у одного участника с бронхиальной астмой (№ A7).
При сравнении чистых считанных последовательностей с базой данных RDP и учитывая только те из них, которые можно было отнести к тому или иному роду бактерий с уровнем достоверности не менее 50 %, мы смогли отнести к определенному роду бактерий около половины последовательностей и идентифицировать в общей сложности 320 различных групп бактерий. Согласно индексу разнообразия Шеннона, основанному на процентном содержании родов бактерий, образцы, полученные у участников с бронхиальной астмой, были связаны со значительно большим разнообразием бактерий по сравнению с образцами, полученными у участников без бронхиальной астмы (р < 0,05, t-критерий для независимых образцов; рисунок 4).
ОБСУЖДЕНИЕ
В данном исследовании мы впервые использовали технологию высокопроизводительного 454-секвенирования для получения оценки разнообразия бактерий в индуцированной мокроте. Нами было установлено, что, как и в двух предыдущих исследованиях, в ходе которых для получения образцов из дыхательных путей использовали инвазивные методы, различия в составе сообществ бактерий связаны с наличием активной бронхиальной астмы, и в индуцированной мокроте участников с бронхиальной астмой наблюдается более высокое содержание протеобактерий, чем в образцах участников без бронхиальной астмы.
Мы также обнаружили, что в образцах, полученных у участников с бронхиальной астмой, наблюдалось большее разнообразие бактерий согласно индексу Шеннона, чем в образцах, полученных у участников без бронхиальной астмы. Это подтверждает результаты ранее проведенного исследования, в котором в образцах, полученных у участников с бронхиальной астмой, наблюдалось повышение бактериальной нагрузки и разнообразия бактерий.12 Однако результаты нашего исследования указывают на присутствие более 2000 различных бактериальных таксонов, что представляет собой значительное повышение разнообразия бактерий в мокроте по сравнению с предыдущими оценками, основанными на образцах из дыхательных путей участников с бронхиальной астмой.11 Кроме того, в нашем исследовании наблюдалось несколько большее количество семейств бактерий, чем в недавно проведенном анализе образцов, полученных у участников с бронхиальной астмой, с использованием метода PhyloChip.12 Дополнительное разнообразие в нашем исследовании может быть обусловлено использованием более чувствительной технологии высокопроизводительного 454-секвенирования или указывать на присутствие дополнительных микробных сообществ из полости рта. То, что нам удалось точно идентифицировать роды бактерий только в половине последовательностей, позволяет предположить, что многие бактерии, обнаруженные в мокроте, являются новыми (или нераспространенными) и еще не охарактеризованы. Для того чтобы полностью охарактеризовать микробы в мокроте с целью понимания их роли в течении бронхиальной астмы, необходимо провести дополнительное секвенирование.
В нашем исследовании в образцах мокроты, полученных у участников с бронхиальной астмой, была отмечена статистически значимо более высокая доля протеобактерий. Эти результаты согласуются с данными предыдущих исследований микробиома, выполненных с использованием образцов из бронхов, в ходе которых также наблюдалось повышение содержания протеобактерий в образцах, полученных у участников с бронхиальной астмой.11,12 Повышенное содержание Moraxellaceae и Pasteurellaceae (к которым принадлежат Moraxella catarrhalis и Haemophilus influenzae соответственно) в образцах, полученных у участников с бронхиальной астмой, свидетельствует о том, что эти бактерии играют определенную роль в развитии бронхиальной астмы.5 Однако высокое содержание фирмикутов в образцах, полученных у участников без бронхиальной астмы, противоречат данным исследования, проведенного Hilty и соавт.,11 в ходе которого в образцах, полученных у участников без бронхиальной астмы, наблюдалось высокое содержание бактероидетов. Бактероидеты составляли от 10 до 20 % бактерий, обнаруженных в ходе их исследования. Однако в нашем исследовании бактероидеты составляли всего 1–2 % от общего состава сообществ бактерий; исключением был один образец, полученный у участника с бронхиальной астмой.
 РИСУНОК 2. Иерархическая кластеризация образцов, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Зеленые и синие прямоугольники обозначают кластеры участников с бронхиальной астмой и без бронхиальной астмы соответственно. A1–A10 — образцы, полученные у участников с бронхиальной астмой; C1–C10 — образцы, полученные у участников без бронхиальной астмы. Числа на ветвях указывает на степень подтверждения кластера по результатам бутстрэп-анализа.
РИСУНОК 2. Иерархическая кластеризация образцов, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Зеленые и синие прямоугольники обозначают кластеры участников с бронхиальной астмой и без бронхиальной астмы соответственно. A1–A10 — образцы, полученные у участников с бронхиальной астмой; C1–C10 — образцы, полученные у участников без бронхиальной астмы. Числа на ветвях указывает на степень подтверждения кластера по результатам бутстрэп-анализа.
Поскольку известно, что человеческий микробиом отличается у разных участников и популяций,8 наблюдаемые различия в составе бактероидетов может быть связано с различиями в популяциях, в которых были получены образцы. Образцы, использованные в нашем исследовании, были собраны в смешанной популяции США, а образцы, использованные в исследовании Hilty и соавт.11, — в популяции ирландцев.
Важным преимуществом нашего исследования является то, в отличие от двух предыдущих исследований микробиома дыхательных путей у больных бронхиальной астмой, мы не набирали участников из сторонних клиник, в которых лечат больных с более тяжелой формой бронхиальной астмы.11,12 Следовательно, участники с бронхиальной астмой, включенные в оба предыдущих исследования, принимали ингаляционные кортикостероиды в средних и высоких дозах, в некоторых случаях в течение длительных периодов времени, тогда как участники из контрольной группы никогда не принимали кортикостероиды. Как известно, кортикостероиды обладают мощным иммуносупрессивным действием,23 поэтому в данных исследованиях нельзя было исключать возможность того, что наблюдаемые различия могли быть связаны с терапией, которую получали участники, а не с наличием или отсутствием заболевания. В нашем исследовании участники с бронхиальной астмой и участники из контрольной группы, напротив, входили в лонгитюдное обсервационное исследование бронхиальной астмы, основанное на неселективной популяции новорожденных, которые были включены в исследование в начале 80-х годов.13
Таким образом, наличие (или отсутствие) бронхиальной астмы в анамнезе можно было подтвердить на основании имеющихся данных. У большинства участников была легкая форма заболевания, и они не принимали ингаляционные кортикостероиды, даже если эти препараты были назначены врачом. Кроме того, когда мы ограничили анализ только участниками, имеющими атопические нарушения, мы не обнаружили заметного изменения результатов. Это указывает на то, что различия в аллергической сенсибилизации у участников из групп «случай» и «контроль» не могут объяснить полученные нами результаты.
Несмотря на то, что мы применяли строгую процедуру сбора образцов и просили участников промывать полость рта перед индуцированием мокроты, мы признаем, что в наши образцы могли проникать микробы из полости рта. Однако мы полагаем, что это могло случиться с образцами, полученными у любых участников вне зависимости от наличия или отсутствия бронхиальной астмы. Этот вывод подтверждается тем фактом, что состав сообществ бактерий в индуцированной мокроте, образцы которой были получены в рамках настоящего исследования, имел выраженные различия в сравнении со слюной (примерно равное содержание бактероидетов, фирмикутов и протеобактерий 24), ротоглоткой (преобладали фирмикуты) и ноздрями (примерно равное содержание актинобактерий и фирмикутов25). Кроме того, несмотря на то, что в двух предыдущих исследованиях микробиоты дыхательных путей, в ходе которых использовали инвазивные методы, были предприняты меры для предотвращения контаминации,11,12 остается вероятность того, что микробные сообщества, идентифицированные в этих исследованиях, могли, по крайней мере частично, непреднамеренно попасть из полости носа, рта или глотки. Вызывает интерес тот факт, что, согласно последним данным, в здоровых легких содержится не отдельный микробиом, а низкие уровни последовательностей бактерий, в целом неотличимых от микрофлоры верхних дыхательных путей.26 Следовательно, представляется возможным, что стойкие изменения микробных сообществ в образцах мокроты и нижних дыхательных путей, наблюдаемые у участников с бронхиальной астмой в нашем исследовании и полученные в предыдущих исследованиях, могут быть отражением изменений, происходящих во всех дыхательных путях, а не в конкретных отделах. Таким образом, избыточное содержание протеобактерий и повышенное микробное разнообразие, которое мы наблюдали в мокроте участников с бронхиальной астмой, согласуется с результатами, недавно полученными в исследованиях образцов из нижних дыхательных путей.11,12
 РИСУНОК 3. Относительное содержание 15 семейств бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Значение 0 указывает на сходное процентное содержание семейства бактерий у участников с бронхиальной астмой и без бронхиальной астмы. Положительное значение указывает на более высокое процентное содержание семейства бактерий у участников с бронхиальной астмой, а отрицательное значение — на более высокое процентное содержание у участников без бронхиальной астмы. Например, содержание Enterobacteriaceae примерно на 4 % выше у участников с бронхиальной астмой.
РИСУНОК 3. Относительное содержание 15 семейств бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Значение 0 указывает на сходное процентное содержание семейства бактерий у участников с бронхиальной астмой и без бронхиальной астмы. Положительное значение указывает на более высокое процентное содержание семейства бактерий у участников с бронхиальной астмой, а отрицательное значение — на более высокое процентное содержание у участников без бронхиальной астмы. Например, содержание Enterobacteriaceae примерно на 4 % выше у участников с бронхиальной астмой.
 РИСУНОК 4. Разнообразие бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы, на основании родов бактерий. Индекс Шеннона — это математическая мера, часто применяемая для характеристики видового разнообразия в том или ином сообществе. Данный индекс учитывает разнообразие и равномерность распределения видов бактерий, присутствующих в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы.
РИСУНОК 4. Разнообразие бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы, на основании родов бактерий. Индекс Шеннона — это математическая мера, часто применяемая для характеристики видового разнообразия в том или ином сообществе. Данный индекс учитывает разнообразие и равномерность распределения видов бактерий, присутствующих в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы.
Кроме того, полученные нами результаты свидетельствуют о том, что нарушения в составе микроорганизмов в дыхательных путях не связаны с лечением ингаляционными кортикостероидами и наличием атопических нарушений, а также присутствуют не только при тяжелой бронхиальной астме, но и при заболевании более легкой степени, и могут быть отличительным признаком бронхиальной астмы. Полученные нами данные не позволяют нам определить, являются ли эти нарушения в составе микроорганизмов следствием течения болезни или каким-то образом участвуют в ее патогенезе.
Мы благодарим Penelope Graves и Sujatha Panyala за помощь в подготовке образцов ДНК для секвенирования.
Клиническая значимость: у молодых взрослых людей с легкой формой бронхиальной астмы наблюдаются изменения в составе микробиоты индуцированной мокроты по сравнению с теми, кто не страдает бронхиальной астмой, и данные изменения могут быть значимыми в отношении патогенеза и лечения бронхиальной астмы.
СПИСОК ЛИТЕРАТУРЫ
Источник: www.sciencedirect.com
Опубликовано: Февраль 2013
Предпосылки для проведения исследования: становится все более очевидным, что микробная колонизация дыхательных путей может играть определенную роль в патогенезе бронхиальной астмы.
Цель: наша цель состояла в том, чтобы описать характеристики и сравнить микробиом индуцированной мокроты у взрослых пациентов с бронхиальной астмой и без бронхиальной астмы.
Методы: образцы индуцированной мокроты взяли у 10 участников без бронхиальной астмы и у 10 участников с активной бронхиальной астмой легкой степени (8 из 10 участников не принимали ингаляционные кортикостероиды). Из супернатантов мокроты выделяли общую ДНК и амплифицировали с помощью праймеров, специфичных к гипервариабельному сегменту V6 бактериальной 16s рРНК. Образцам присваивали штрих-коды, после чего объединяли эквимолярные концентрации 20 образцов и секвенировали с помощью секвенатора 454 GS FLX. Последовательности относили к бактериальным таксонам путем их сопоставления с последовательностями 16s рРНК из Проекта базы данных рибосом.
Результаты: все образцы мокроты содержали 5 основных типов бактерий: фирмикуты, протеобактерии, актинобактерии, фузобактерии и бактероидеты; первые три типа составляли более 90 % общих последовательностей. У участников с бронхиальной астмой наблюдалась более высокая доля протеобактерий (37 % в сравнении с 15 %, р < 0,001).
Фирмикуты (47 % в сравнении с 63 %, р = 0,17) и актинобактерии (10 % в сравнении с 14 %, р = 0,36), напротив, обнаруживались в большем количестве в образцах, взятых у участников без бронхиальной астмы, хотя эти различия не были статистически значимыми. После иерархической кластеризации было получено два значимых кластера: один из них содержал преимущественно образцы, взятые у участников с бронхиальной астмой, а другой — преимущественно образцы, взятые у участников без бронхиальной астмы. Кроме того, в образцах, взятых у участников с бронхиальной астмой, наблюдалось большее разнообразие бактерий, чем в образцах, взятых у участников без бронхиальной астмы.
Выводы: у участников с легкой формой бронхиальной астмы отмечен измененный микробный состав в дыхательных путях, сходный с таковым, наблюдаемым у участников с более тяжелой формой бронхиальной астмы (J Allergy Clin Immunol 2013;131:346 52).
Ключевые слова: бронхиальная астма, микробиом, протеобактерии, метагеномика, мокрота
Основная часть
Бронхиальная астма является хроническим заболеванием дыхательных путей, однако генетические факторы и факторы окружающей среды, которые определяют развитие заболевания, не совсем понятны. Несколько наборов данных свидетельствуют о том, что в патогенезе бронхиальной астмы может играть определенную роль микробная колонизация дыхательных путей. Имеются случаи выделения Mycoplasma pneumoniae и Chlamydophila pneumoniae у участников с обострениями бронхиальной астмы.1,2 Это указывает на то, что для лечения таких обострений можно применять макролиды и подобные соединения, и в клиническом исследовании кетолидов были получены многообещающие результаты.3 В отчете, при составлении которого использовалась большая база данных участников в штате Теннесси, был сделан вывод о том, что у участников с бронхиальной астмой вероятность развития инвазивной пневмококковой пневмонии как минимум в два раза выше, чем у участников из контрольной группы.4 Bisgaard и соавт.5 сообщили, что новорожденные, у которых в возрасте 1 месяц произошла колонизация верхних дыхательных путей Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis или комбинацией этих микроорганизмов подвержены повышенному риску развития рецидивирующего бронхообструктивного синдрома (свистящее дыхание) и бронхиальной астмы в более позднем возрасте. В большинстве этих исследований микробиологические агенты выявляли с помощью «целенаправленной» ПЦР или путем культивирования конкретных микроорганизмов, поэтому исследования отражали лишь небольшую часть существующих таксонов. Описание всего микробного разнообразия в дыхательных путях позволит получить представление о той роли, которую микробиом играет в патогенезе бронхиальной астмы. Метагеномика позволяет изучить микробы в их естественном экологическом состоянии и дает независимые от культуры оценки микробного разнообразия.6 Метагеномные подходы успешно использовали для демонстрации влияния микробиома на несколько аспектов здоровья человека, например, на ожирение, сахарный диабет и воспалительные заболевания кишечника.7-10 В ходе двух недавно проведенных исследований метагеномные подходы использовали для характеристики микробных сообществ в дыхательных путях при бронхиальной астмой и в отсутствии бронхиальной астмы, присутствовавших в образцах бронхиального секрета. Используя ПЦР и секвенирование по Сенгеру, Hilty и соавт.11 установили, что в дыхательных путях участников с бронхиальной астмой и без бронхиальной астмы присутствуют около 120 различных групп бактерий, при этом протеобактерии наблюдаются в большем количестве в образцах бронхиального секрета, полученных у участников с бронхиальной астмой, а бактероидеты — в образцах бронхиального секрета, полученных у участников без бронхиальной астмы. В более позднем исследовании, в котором использовался метод PhyloChip, у участников с бронхиальной астмой наблюдалась более высокая бактериальная нагрузка, чем у участников из контрольной группы. У участников с бронхиальной астмой в данном исследовании также было выявлено большее количество протеобактерий.12 Однако все участники с бронхиальной астмой, у которых брали образцы в обоих исследованиях, принимали ингаляционные кортикостероиды, и влияние кортикостероидов на микробиом установить не удалось.
Насколько нам известно, ни в одном из исследований не были всесторонне охарактеризованы бактериальные сообщества в индуцированной мокроте участников с бронхиальной астмой и без бронхиальной астмы. Мы использовали высокопроизводительное 454-секвенирование на образцах индуцированной мокроты, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Восемь из 10 участников с бронхиальной астмой не принимали кортикостероиды на момент включения в исследование, а 2 из 10 принимали их нечасто.
МЕТОДЫ: Участники и образцы мокроты
В рамках данного исследования были получены образцы индуцированной мокроты у 10 участников с активной бронхиальной астмой, диагностированной врачом, и у 10 участников без бронхиальной астмы. Сбор образцов проводили в рамках продолжающегося исследования дыхательной системы у детей в г. Тусон в неселективной когорте лиц, родившихся в одном и том же году; в настоящее время участники данного исследования являются взрослыми людьми, которым немного больше 30 лет.13 Информацию по бронхиальной астме, бронхообструктивному синдрому (свистящее дыхание), бронхиту и курению брали из анкет, заполнявшихся участниками в возрасте 26 лет. Спирометрию выполняли в соответствии со стандартами Американского общества специалистов в области торакальной медицины, и никто из участников не пользовался бронходилататором в течение 6 часов, предшествующих проведению теста. После исходной спирометрии участники принимали альбутерол в фиксированной дозе, в виде двух ингаляций (180 мкг), используя ингалятор отмеренных доз и удерживающее устройство для карманной камеры Аэрочамбер («Монаган Медикал Корп.», г. Платтсбург, штат Нью-Йорк), и через 15 минут им проводили повторную спирометрию после введения бронходилататора. Проводили провокационные пробы с метахолином согласно протоколу, описанному Yan и соавт.14, и рассчитывали угол наклона кривой зависимости «доза-ответ» в соответствии с описанием, приведенным в работе Stein и соавт.15 Кожные пробы на сенсибилизацию к местным аэроаллергенам выполняли согласно описанию, приведенному ранее.16 Этническую принадлежность/расу определяли на основании информации, указанной родителями при рождении.
Сбор и обработка индуцированной мокроты
Индуцированную мокроту у каждого участника собирали после ингаляции 3 % физраствора в течение двух минут. Затем участник выплевывал слюну, два раза глубоко вдыхал физраствор и откашливал мокроту в отдельный стаканчик. Процедуру повторяли 6 раз; в общей сложности процесс занимал 12 минут. В течение процедуры отслеживали пиковую скорость. Перед индукцией мокроты ротовую полость промывали солевым раствором, чтобы свести к минимуму риск контаминации микробами из полости рта. В течение часа после сбора мокроты проводили подсчет клеток, добавляли в мокроту два объема дитиотреитола и энергично перемешивали образец на шейкере для планшетов в течение 15–20 минут для растворения слизи. Мокроту центрифугировали, супернатант мокроты собирали и хранили при температуре -70 °С. Аликвоту супернатанта использовали для выделения бактериальной ДНК.
Выделение и секвенирование ДНК
Из аликвоты супернатанта объемом 200 мл выделяли общую ДНК с помощью набора для выделения ДНК от компании «Киаген» («Киаген», Хильден, Германия) в соответствии с рекомендациями производителя. Бактериальную ДНК амплифицировали с помощью праймеров 967F и 1046R, специфичных к гипервариабельному сегменту V6 бактериальной 16s рРНК. Каждый прямой праймер имел последовательность адаптера и последовательность штрих-кода, которые позволяли идентифицировать образцы после секвенирования. Объединяли эквимолярные концентрации 20 образцов и секвенировали с помощью секвенатора 454 GS FLX, используя химию титана («454 Лайф Сайенсиз», Брэнфорд, Коннектикут), в соответствии с рекомендациями производителя.
Статистический анализ данных: Идентификация сообществ бактерий
После секвенирования считанные фрагменты предварительно обрабатывали, чтобы отбросить все фрагменты, не соответствующие штрих-кодам или последовательностям праймеров. В обеих последовательностях допускалось одно несоответствие. Вкратце, после фильтрации фрагментов низкого качества и удаления фрагментов, не соответствующих последовательностям штрих-кодов, каждый считанный фрагмент сопоставляли со всеми остальными фрагментами, которые были считаны в этом образце, чтобы выявить уникальные фрагменты. Уникальные фрагменты, считанные в каждом образце, кластеризовали в группы сходных последовательностей. Каждая группа отражала последовательность 16s рРНК того или иного вида/рода бактерий и представляла собой так называемую операбельную таксономическую единицу (ОТЕ). Все анализы проводили с помощью линейки 454-секвенирования из выпуска 10 Проекта базы данных рибосом (Проект базы данных рибосом, Ист-Лансинг, Мичиган).17 Последовательности относили к бактериальным таксонам путем их сопоставления с последовательностями 16s рРНК из Проекта базы данных рибосом (RDP), используя классификатор RDP.18 Для дальнейшего анализа использовали только те последовательности, которые можно было отнести к той или иной группе бактерий с достоверностью не менее 50 %. ОТЕ для каждого образца получали путем кластеризации последовательностей из отдельных образцов на генетическом расстоянии 0,03. Оценку видового богатства по Чао19 для каждого образца выполняли в программе Mothur.20 Для расчета индекса разнообразия Шеннона — математической меры, часто применяемой для характеристики видового разнообразия в том или ином сообществе, — использовали долю родов бактерий в каждом образце. Индекс Шеннона учитывает разнообразие и равномерность распределения видов бактерий, присутствующих в образцах, взятых у участников с бронхиальной астмой и без бронхиальной астмы.21 Иерархическую кластеризацию выполняли с использованием статистическом программном R-пакета pvclust22 (www.r-project.org), а подтверждение каждой ветви получали путем проведения бутстрэп-анализа с 10 000 повторностей (описание методов pvclust и бутстрэппинга приведено в разделе «Методы» электронного репозитория настоящей статьи на сайте www.jacionline.org).
Заявление об этике
Исследования, указанные в настоящем документе, одобрены Экспертным советом организации Аризонского университета, и у каждого участника было получено письменное информированное согласие.
РЕЗУЛЬТАТЫ
Характеристики участников исследования приведены в таблице I.15 Все участники входили в лонгитюдное исследование естественного развития бронхиальной астмы в неселективной когорте лиц, родившихся в одном и том же году,13 поэтому наличие бронхиальной астмы в анамнезе можно было подтвердить на основании имеющихся данных. Данные по применению ингаляционных лекарственных средств для лечения бронхиальной астмы или бронхообструктивного синдрома (свистящее дыхание) за последний год приведены в таблице II. Ни один из участников не сообщил о применении пероральных препаратов для лечения бронхиальной астмы за последний год. При проведении провокационных проб с метахолином угол наклона кривой зависимости «доза-ответ» у большинства участников с бронхиальной астмой составлял менее десятого процентиля от этого показателя в контрольной подгруппе здоровых участников без бронхиальной астмы и атопических нарушений (6/7). Данному критерию соответствовали только два участника без бронхиальной астмы (2/10, р = 0,008).
Средняя доля плоских клеток в образцах мокроты составила 34,8 % (СО 25,4 %). Образцам мокроты присваивали штрих-коды, после чего эквимолярные концентрации 20 образцов объединяли в один прогон секвенирования. После фильтрации считанных фрагментов низкого качества и удаления считанных фрагментов, не соответствующих последовательностям штрих-кодов, осталось около 800 000 фрагментов; в общей сложности на каждый образец приходилось в среднем 40 000 ± 11 245 (СО) фрагментов (таблица III). По результатам сопоставления каждого фрагмента, считанного в отдельном образце, со всеми остальными фрагментами, считанными в этом образце, было идентифицировано от 3919 до 10 608 уникальных фрагментов на образец. Кластеризация уникальных фрагментов, считанных в отдельных образцах, при подлинности 97 % показала присутствие в среднем 1500 ОТЕ и как минимум у одного участника было обнаружено 2264 ОТЕ. Согласно оценкам видового богатства по Чао, в настоящем исследовании было отражено 75–80 % от расчетного разнообразия бактерий в образцах мокроты, а для отражения полного разнообразия необходимо дополнительное секвенирование (см. рисунок E1 в электронном репозитории настоящей статьи на сайте www.jacionline.org).
ТАБЛИЦА I. Фенотипические характеристики участников исследования
*Положительные реакции на один или несколько из 7 местных аэроаллергенов по результатам кожной пробы на аллергии в возрасте 26 лет.
†Времена года, в которые выполнялся сбор образцов индуцированной мокроты, определены следующим образом: зима (З; декабрь, январь и февраль), весна (В; март, апрель и май), лето (Л; июнь, июль и август) и осень (О; сентябрь, октябрь и ноябрь).
‡Наименьший угол наклона кривой зависимости «доза-ответ» (DRS) при проведении провокационных проб с метахолином согласно определению, приведенному в работе Stein и соавт.15, на основании данных, полученных у участников в возрасте 16, 22 и 25 лет.
§Этническая принадлежность отца неизвестна.
ǁСчиталось, что у участника имеется повышенная чувствительность бронхов, если при проведении провокационных проб с метахолином было получено значение угла наклона кривой зависимости «доза-ответ», составляющее менее десятого процентиля от этого показателя в контрольной подгруппе здоровых участников без бронхиальной астмы и атопических нарушений.
¶У участника А9 наблюдалась повышенная чувствительность к метахолину и были отмечены астмоподобные симптомы. Результаты спирометрии указывали на необратимое ограничение воздушного потока легкой степени.
ТАБЛИЦА II. Применение ингаляционных лекарственных средств для лечения бронхиальной астмы или бронхообструктивного синдрома за последний год: Частота (время от времени, не менее одного раза в неделю или ежедневно) и длительность применения в месяцах
д/о — данные отсутствуют.
*Участники A2, A3, A7 и A8 не сообщали о применении лекарственных средств для лечения бронхиальной астмы или бронхообструктивного синдрома в течение года, предшествующего сбору образцов мокроты.
Бактериальные линии в каждом образце идентифицировали путем сопоставления последовательностей V6 с последовательностями бактериальной 16s рРНК из выпуска 10 Проекта базы данных рибосом. Все образцы мокроты содержали 5 основных типов бактерий: фирмикуты, протеобактерии, актинобактерии, фузобактерии и бактероидеты; первые три типа составляли более 90 % общих последовательностей как у участников с бронхиальной астмой, так и у участников без бронхиальной астмы (рисунок 1). У участников с бронхиальной астмой и без бронхиальной астмы были обнаружены различия в содержании протеобактерий и фирмикутов. У участников с бронхиальной астмой наблюдалась более высокая доля протеобактерий (37 % и 15 %, р < 0,001), особенно гамма-протеобактерий (р < 0,05, U-критерий Манна-Уитни). Фирмикуты (47 % и 63 %, р = 0,17) и актинобактерии (10 % и 14 %, р = 0,36), напротив, обнаруживались в большем количестве в образцах, полученных у участников без бронхиальной астмы, хотя выявленные различия не были статистически значимыми. Фирмикуты — грамположительные бактерии, которые в основном образуют эндоспоры и содержат некоторые известные патогенные бактерии, в числе которых виды Bacillus, Staphylococcus и Streptococcus. Бактероидеты — группа грамотрицательных бактерий, не образующих споры, которые широко присутствуют в окружающей среде.
После иерархической кластеризации (методом полной связи с евклидовой метрикой) всех образцов на основе парных значений R2 для состава сообществ бактерий было получено два значимых кластера: один содержал большинство образцов, полученных у участников с бронхиальной астмой (8 с бронхиальной астмой и 1 без бронхиальной астмы), а другой преимущественно состоял из образцов, полученных у участников без бронхиальной астмы (2 с бронхиальной астмой и 7 без бронхиальной астмы, рисунок 2).
ТАБЛИЦА III. Характеристики последовательностей в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы.

РИСУНОК 1. Медианные процентные значения содержания типов бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы, рассчитанные с использованием классификатора RDP, версия 2.1. На круговых диаграммах показано распределение микроорганизмов у участников с бронхиальной астмой и без бронхиальной астмы.
Это дополнительно указывает на сходство в составе микроорганизмов в образцах, связанное с наличием или отсутствием данного заболевания. Два образца, полученные у участников без бронхиальной астмы, не были включены ни в один из кластеров. Мы провели повторный анализ, но на этот раз только у участников с бронхиальной астмой и без бронхиальной астмы, имеющих атопические нарушения (см. рисунок E2 в электронном репозитории настоящей статьи на сайте www.jacionline.org). Полученные результаты были очень схожи с теми, что приведены на рисунке 2.
Только 60 % считанных фрагментов можно было отнести к тому или иному семейству бактерий с уровнем достоверности не менее 50 %. На основании этих отнесений образцы, представленные пятью типами бактерий, были распределены в 107 семейств бактерий. Были отмечены различия в относительном содержании 15 из 107 семейств бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы (рисунок 3). В образцах, полученных у участников с бронхиальной астмой, Enterobacteriaceae и Neisseriaceae встречались чаще, чем в образцах, полученных у участников без бронхиальной астмы, хотя выявленные различия не были статистически значимыми. Moraxellaceae и Pasteurellaceae, к которым принадлежат Moraxella catarrhalis и Haemophilus influenzae, также обнаруживались в большем количестве в образцах, полученных у участников с бронхиальной астмой. Prevotellaceae — семейство бактерий, принадлежащее к бактероидетам, — также наблюдалось в большем количестве в образцах, полученных у участников с бронхиальной астмой. Однако данное наблюдение отчасти могло быть связано с 10-кратным повышением содержания бактероидетов в образце, полученном у одного участника с бронхиальной астмой (№ A7).
При сравнении чистых считанных последовательностей с базой данных RDP и учитывая только те из них, которые можно было отнести к тому или иному роду бактерий с уровнем достоверности не менее 50 %, мы смогли отнести к определенному роду бактерий около половины последовательностей и идентифицировать в общей сложности 320 различных групп бактерий. Согласно индексу разнообразия Шеннона, основанному на процентном содержании родов бактерий, образцы, полученные у участников с бронхиальной астмой, были связаны со значительно большим разнообразием бактерий по сравнению с образцами, полученными у участников без бронхиальной астмы (р < 0,05, t-критерий для независимых образцов; рисунок 4).
ОБСУЖДЕНИЕ
В данном исследовании мы впервые использовали технологию высокопроизводительного 454-секвенирования для получения оценки разнообразия бактерий в индуцированной мокроте. Нами было установлено, что, как и в двух предыдущих исследованиях, в ходе которых для получения образцов из дыхательных путей использовали инвазивные методы, различия в составе сообществ бактерий связаны с наличием активной бронхиальной астмы, и в индуцированной мокроте участников с бронхиальной астмой наблюдается более высокое содержание протеобактерий, чем в образцах участников без бронхиальной астмы.
Мы также обнаружили, что в образцах, полученных у участников с бронхиальной астмой, наблюдалось большее разнообразие бактерий согласно индексу Шеннона, чем в образцах, полученных у участников без бронхиальной астмы. Это подтверждает результаты ранее проведенного исследования, в котором в образцах, полученных у участников с бронхиальной астмой, наблюдалось повышение бактериальной нагрузки и разнообразия бактерий.12 Однако результаты нашего исследования указывают на присутствие более 2000 различных бактериальных таксонов, что представляет собой значительное повышение разнообразия бактерий в мокроте по сравнению с предыдущими оценками, основанными на образцах из дыхательных путей участников с бронхиальной астмой.11 Кроме того, в нашем исследовании наблюдалось несколько большее количество семейств бактерий, чем в недавно проведенном анализе образцов, полученных у участников с бронхиальной астмой, с использованием метода PhyloChip.12 Дополнительное разнообразие в нашем исследовании может быть обусловлено использованием более чувствительной технологии высокопроизводительного 454-секвенирования или указывать на присутствие дополнительных микробных сообществ из полости рта. То, что нам удалось точно идентифицировать роды бактерий только в половине последовательностей, позволяет предположить, что многие бактерии, обнаруженные в мокроте, являются новыми (или нераспространенными) и еще не охарактеризованы. Для того чтобы полностью охарактеризовать микробы в мокроте с целью понимания их роли в течении бронхиальной астмы, необходимо провести дополнительное секвенирование.
В нашем исследовании в образцах мокроты, полученных у участников с бронхиальной астмой, была отмечена статистически значимо более высокая доля протеобактерий. Эти результаты согласуются с данными предыдущих исследований микробиома, выполненных с использованием образцов из бронхов, в ходе которых также наблюдалось повышение содержания протеобактерий в образцах, полученных у участников с бронхиальной астмой.11,12 Повышенное содержание Moraxellaceae и Pasteurellaceae (к которым принадлежат Moraxella catarrhalis и Haemophilus influenzae соответственно) в образцах, полученных у участников с бронхиальной астмой, свидетельствует о том, что эти бактерии играют определенную роль в развитии бронхиальной астмы.5 Однако высокое содержание фирмикутов в образцах, полученных у участников без бронхиальной астмы, противоречат данным исследования, проведенного Hilty и соавт.,11 в ходе которого в образцах, полученных у участников без бронхиальной астмы, наблюдалось высокое содержание бактероидетов. Бактероидеты составляли от 10 до 20 % бактерий, обнаруженных в ходе их исследования. Однако в нашем исследовании бактероидеты составляли всего 1–2 % от общего состава сообществ бактерий; исключением был один образец, полученный у участника с бронхиальной астмой.
 РИСУНОК 2. Иерархическая кластеризация образцов, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Зеленые и синие прямоугольники обозначают кластеры участников с бронхиальной астмой и без бронхиальной астмы соответственно. A1–A10 — образцы, полученные у участников с бронхиальной астмой; C1–C10 — образцы, полученные у участников без бронхиальной астмы. Числа на ветвях указывает на степень подтверждения кластера по результатам бутстрэп-анализа.
РИСУНОК 2. Иерархическая кластеризация образцов, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Зеленые и синие прямоугольники обозначают кластеры участников с бронхиальной астмой и без бронхиальной астмы соответственно. A1–A10 — образцы, полученные у участников с бронхиальной астмой; C1–C10 — образцы, полученные у участников без бронхиальной астмы. Числа на ветвях указывает на степень подтверждения кластера по результатам бутстрэп-анализа.Поскольку известно, что человеческий микробиом отличается у разных участников и популяций,8 наблюдаемые различия в составе бактероидетов может быть связано с различиями в популяциях, в которых были получены образцы. Образцы, использованные в нашем исследовании, были собраны в смешанной популяции США, а образцы, использованные в исследовании Hilty и соавт.11, — в популяции ирландцев.
Важным преимуществом нашего исследования является то, в отличие от двух предыдущих исследований микробиома дыхательных путей у больных бронхиальной астмой, мы не набирали участников из сторонних клиник, в которых лечат больных с более тяжелой формой бронхиальной астмы.11,12 Следовательно, участники с бронхиальной астмой, включенные в оба предыдущих исследования, принимали ингаляционные кортикостероиды в средних и высоких дозах, в некоторых случаях в течение длительных периодов времени, тогда как участники из контрольной группы никогда не принимали кортикостероиды. Как известно, кортикостероиды обладают мощным иммуносупрессивным действием,23 поэтому в данных исследованиях нельзя было исключать возможность того, что наблюдаемые различия могли быть связаны с терапией, которую получали участники, а не с наличием или отсутствием заболевания. В нашем исследовании участники с бронхиальной астмой и участники из контрольной группы, напротив, входили в лонгитюдное обсервационное исследование бронхиальной астмы, основанное на неселективной популяции новорожденных, которые были включены в исследование в начале 80-х годов.13
Таким образом, наличие (или отсутствие) бронхиальной астмы в анамнезе можно было подтвердить на основании имеющихся данных. У большинства участников была легкая форма заболевания, и они не принимали ингаляционные кортикостероиды, даже если эти препараты были назначены врачом. Кроме того, когда мы ограничили анализ только участниками, имеющими атопические нарушения, мы не обнаружили заметного изменения результатов. Это указывает на то, что различия в аллергической сенсибилизации у участников из групп «случай» и «контроль» не могут объяснить полученные нами результаты.
Несмотря на то, что мы применяли строгую процедуру сбора образцов и просили участников промывать полость рта перед индуцированием мокроты, мы признаем, что в наши образцы могли проникать микробы из полости рта. Однако мы полагаем, что это могло случиться с образцами, полученными у любых участников вне зависимости от наличия или отсутствия бронхиальной астмы. Этот вывод подтверждается тем фактом, что состав сообществ бактерий в индуцированной мокроте, образцы которой были получены в рамках настоящего исследования, имел выраженные различия в сравнении со слюной (примерно равное содержание бактероидетов, фирмикутов и протеобактерий 24), ротоглоткой (преобладали фирмикуты) и ноздрями (примерно равное содержание актинобактерий и фирмикутов25). Кроме того, несмотря на то, что в двух предыдущих исследованиях микробиоты дыхательных путей, в ходе которых использовали инвазивные методы, были предприняты меры для предотвращения контаминации,11,12 остается вероятность того, что микробные сообщества, идентифицированные в этих исследованиях, могли, по крайней мере частично, непреднамеренно попасть из полости носа, рта или глотки. Вызывает интерес тот факт, что, согласно последним данным, в здоровых легких содержится не отдельный микробиом, а низкие уровни последовательностей бактерий, в целом неотличимых от микрофлоры верхних дыхательных путей.26 Следовательно, представляется возможным, что стойкие изменения микробных сообществ в образцах мокроты и нижних дыхательных путей, наблюдаемые у участников с бронхиальной астмой в нашем исследовании и полученные в предыдущих исследованиях, могут быть отражением изменений, происходящих во всех дыхательных путях, а не в конкретных отделах. Таким образом, избыточное содержание протеобактерий и повышенное микробное разнообразие, которое мы наблюдали в мокроте участников с бронхиальной астмой, согласуется с результатами, недавно полученными в исследованиях образцов из нижних дыхательных путей.11,12
 РИСУНОК 3. Относительное содержание 15 семейств бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Значение 0 указывает на сходное процентное содержание семейства бактерий у участников с бронхиальной астмой и без бронхиальной астмы. Положительное значение указывает на более высокое процентное содержание семейства бактерий у участников с бронхиальной астмой, а отрицательное значение — на более высокое процентное содержание у участников без бронхиальной астмы. Например, содержание Enterobacteriaceae примерно на 4 % выше у участников с бронхиальной астмой.
РИСУНОК 3. Относительное содержание 15 семейств бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы. Значение 0 указывает на сходное процентное содержание семейства бактерий у участников с бронхиальной астмой и без бронхиальной астмы. Положительное значение указывает на более высокое процентное содержание семейства бактерий у участников с бронхиальной астмой, а отрицательное значение — на более высокое процентное содержание у участников без бронхиальной астмы. Например, содержание Enterobacteriaceae примерно на 4 % выше у участников с бронхиальной астмой. РИСУНОК 4. Разнообразие бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы, на основании родов бактерий. Индекс Шеннона — это математическая мера, часто применяемая для характеристики видового разнообразия в том или ином сообществе. Данный индекс учитывает разнообразие и равномерность распределения видов бактерий, присутствующих в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы.
РИСУНОК 4. Разнообразие бактерий в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы, на основании родов бактерий. Индекс Шеннона — это математическая мера, часто применяемая для характеристики видового разнообразия в том или ином сообществе. Данный индекс учитывает разнообразие и равномерность распределения видов бактерий, присутствующих в образцах, полученных у участников с бронхиальной астмой и без бронхиальной астмы.Кроме того, полученные нами результаты свидетельствуют о том, что нарушения в составе микроорганизмов в дыхательных путях не связаны с лечением ингаляционными кортикостероидами и наличием атопических нарушений, а также присутствуют не только при тяжелой бронхиальной астме, но и при заболевании более легкой степени, и могут быть отличительным признаком бронхиальной астмы. Полученные нами данные не позволяют нам определить, являются ли эти нарушения в составе микроорганизмов следствием течения болезни или каким-то образом участвуют в ее патогенезе.
Мы благодарим Penelope Graves и Sujatha Panyala за помощь в подготовке образцов ДНК для секвенирования.
Клиническая значимость: у молодых взрослых людей с легкой формой бронхиальной астмы наблюдаются изменения в составе микробиоты индуцированной мокроты по сравнению с теми, кто не страдает бронхиальной астмой, и данные изменения могут быть значимыми в отношении патогенеза и лечения бронхиальной астмы.
СПИСОК ЛИТЕРАТУРЫ
- Martin RJ. Infections and asthma. Clin Chest Med 2006;27:87-98.vi.
- Maffey AF, Barrero PR, Venialgo C, Fernandez F, Fuse VA, Saia M, et al. Viruses and atypical bacteria associated with asthma exacerbations in hospitalized children. Pediatr Pulmonol 2010;45:619-25.
- Johnston SL, Blasi F, Black PN, Martin RJ, Farrell DJ, Nieman RB. The effect of telithromycin in acute exacerbations of asthma. N Engl J Med 2006;354: 1589-600.
- Talbot TR, Hartert TV, Mitchel E, Halasa NB, Arbogast PG, Poehling KA, et al. Asthma as a risk factor for invasive pneumococcal disease. N Engl J Med 2005; 352:2082-90.
- Bisgaard H, Hermansen MN, Buchvald F, Loland L, Halkjaer LB, Bonnelykke K, et al. Childhood asthma after bacterial colonization of the airway in neonates. N Engl J Med 2007;357:1487-95.
- Hugenholtz P, Tyson GW. Microbiology: metagenomics. Nature 2008;455: 481-3.
- Gill SR, Pop M, Deboy RT, Eckburg PB, Turnbaugh PJ, Samuel BS, et al. Meta- genomic analysis of the human distal gut microbiome. Science 2006;312:1355-9.
- Turnbaugh PJ, Hamady M, Yatsunenko T, Cantarel BL, Duncan A, Ley RE, et al. A core gut microbiome in obese and lean twins. Nature 2009;457: 480-4.
- Wen L, Ley RE, Volchkov PY, Stranges PB, Avanesyan L, Stonebraker AC, et al. Innate immunity and intestinal microbiota in the development of Type 1 diabetes. Nature 2008;455:1109-13.
- Willing BP, Dicksved J, Halfvarson J, Andersson AF, Lucio M, Zheng Z, et al. A pyrosequencing study in twins shows that gastrointestinal microbial profiles vary with inflammatory bowel disease phenotypes. Gastroenterology 2010;139: 1844-54.e1.
- Hilty M, Burke C, Pedro H, Cardenas P, Bush A, Bossley C, et al. Disordered microbial communities in asthmatic airways. PLoS One 2010;5:e8578.
- Huang YJ, Nelson CE, Brodie EL, Desantis TZ, Baek MS, Liu J, et al. Airway microbiota and bronchial hyperresponsiveness in patients with suboptimally controlled asthma. J Allergy Clin Immunol 2011;127:372-81, e1-3.
- Taussig LM, Wright AL, Holberg CJ, Halonen M, Morgan WJ, Martinez FD. Tucson Children's Respiratory Study: 1980 to present. J Allergy Clin Immunol 2003;111:661-76.
- Yan K, Salome C, Woolcock AJ. Rapid method for measurement of bronchial responsiveness. Thorax 1983;38:760-5.
- Stein RT, Holberg CJ, Morgan WJ, Wright AL, Lombardi E, Taussig L, et al. Peak flow variability, methacholine responsiveness and atopy as markers for detecting different wheezing phenotypes in childhood. Thorax 1997;52:946-52.
- Stern DA, Lohman IC, Wright AL, Taussig LM, Martinez FD, Halonen M. Dynamic changes in sensitization to specific aeroallergens in children raised in a desert environment. Clin Exp Allergy 2004;34:1563-669.
- Cole JR, Wang Q, Cardenas E, Fish J, Chai B, Farris RJ, et al. The Ribosomal Database Project: improved alignments and new tools for rRNA analysis. Nucleic Acids Res 2009;37:D141-5.
- Wang Q, Garrity GM, Tiedje JM, Cole JR. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy. Appl Environ Microbiol 2007
- Chao A. Nonparametric estimation of the number of classes in a population. Scand J Stat 1984;11:265-70.
- Schloss PD, Westcott SL, Ryabin T, Hall JR, Hartmann M, Hollister EB, et al. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities. Appl Environ Microbiol 2009; 75:7537-41.
- Chao A, Shen TJ. Nonparametric estimation of Shannon's index of diversity when there are unseen species in sample. Environ Ecol Stat 2003;10:429-43.
- Suzuki R, Shimodaira H. Pvclust: an R package for assessing the uncertainty in hierarchical clustering. Bioinformatics 2006;22:1540-2.
- Gedalia A, Shetty AK. Chronic steroid and immunosuppressant therapy in children. Pediatr Rev 2004;25:425-34.
- Lazarevic V, Whiteson K, Huse S, Hernandez D, Farinelli L, Osteras M, et al. Metagenomic study of the oral microbiota by Illumina high-throughput sequencing. J Microbiol Methods 2009;79:266-71.
- Lemon KP, Klepac-Ceraj V, Schiffer HK, Brodie EL, Lynch SV, Kolter R. Comparative analyses of the bacterial microbiota of the human nostril and oropharynx. MBio 2010;1.
- Charlson ES, Bittinger K, Haas AR, Fitzgerald AS, Frank I, Yadav A, et al. Topographical continuity of bacterial populations in the healthy human respiratory tract. Am J Respir Crit Care Med 2011;184:957-63.





