4561
04 Июня 2020
Авторы: Andrea Gramegna, Stefano Aliberti, Marco Confalonieri, Angelo Corsico, Luca Richeldi, Carlo Vancheri, Francesco Blasi. Multidiscip Respir Med. 2018; 13: 39.
Опубликовано: 8 октября 2018 года. Doi: 10.1186 / s40248-018-0153-4
Эта статья распространяется на условиях международной лицензии Creative Commons Attribution 4.0
Опубликовано: 8 октября 2018 года. Doi: 10.1186 / s40248-018-0153-4
Эта статья распространяется на условиях международной лицензии Creative Commons Attribution 4.0
- Кафедра патофизиологии и трансплантации Миланского университета; Отделение внутренней медицины, отделение дыхательных путей и центр муковисцидоза у взрослых, Fondazione IRCCS Ca 'Granda Ospedale Maggiore Policlinico, Милан, Италия
- Отделение медицин...
Авторы: Andrea Gramegna, Stefano Aliberti, Marco Confalonieri, Angelo Corsico, Luca Richeldi, Carlo Vancheri, Francesco Blasi. Multidiscip Respir Med. 2018; 13: 39.
Опубликовано: 8 октября 2018 года. Doi: 10.1186 / s40248-018-0153-4
Эта статья распространяется на условиях международной лицензии Creative Commons Attribution 4.0
Введение
Европейское респираторное общество (European Respiratory Society) недавно опубликовало важное заявление, в котором рассматриваются имеющиеся данные о диагностике и лечении заболеваний легких, связанных с дефицитом альфа-1-антитрипсина (дефицит А1АТ, ДААТ). Некоторые вопросы по данной теме все еще остаются нерешенными и подлежат интерпретации в соответствии с различными стандартными процедурами и требованиями систем здравоохранения разных стран. Цель настоящего комментария состоит в том, чтобы предложить решение большинства этих спорных вопросов на примере перспективы лечения респираторных болезней в Италии.
Основное содержание
Клинический спектр заболеваний легких, обусловленных ДААТ, может включать различные проявления, поэтому традиционную парадигму для молодого пациента с эмфизематозом следует считать недостаточно информативной. Ориентация на надлежащее обследование только пациентов с хронической обструктивной болезнью легких (ХОБЛ) может рассматриваться как ограниченный подход, приводящий к недооценке реальной распространенности заболевания. В нескольких работах было высказано предположение о связи между ДААТ и другими хроническими респираторными заболеваниями, такими как астма и бронхоэктатическая болезнь. Поэтому для изучения различных фенотипов пациентов с ДААТ необходима более глубокая оценка клинических, рентгенологических, микробиологических и функциональных переменных. Кроме того, новое направление трансляционных исследований ДААТ нужно сфокусировать на разработке персонализированных схем лечения с учетом клинического профиля пациента и его потребностей.
Выводы
В последние годы ДААТ расценивается как общий механизм воспалительного дисбаланса и повреждения тканей в различных условиях. Дальнейшие исследования постепенно указывают на эту новую парадигму, расширяя базу доказательств роли А1АТ в качестве мощного иммуномодулирующего и противовоспалительного препарата при заболеваниях, отличных от эмфиземы легких.
Основная часть
Введение
Дефицит альфа-1-антитрипсина (ДААТ) является наиболее распространенным наследственным заболеванием у взрослых [1]. Существует несколько мутаций гена SERPINA1, кодирующего А1АТ, представляющий собой наиболее распространенный ингибитор протеазы, которые способны вызывать заболевание. Несмотря на свое название, основная биологическая роль А1АТ заключается в ингибировании нейтрофильной эластазы (НЭ), протеолитического фермента, нацеленного на эластин и другие компоненты базальной мембраны и матрицы [2]. Дефицит A1AT наследуется как аутосомно-доминантное заболевание, к настоящему времени было описано более 100 генетических вариантов, и гомозиготный генотип Z-аллели (PI*ZZ) определяет подавляющее большинство клинически подтвержденных тяжелых дефицитов [3]. Тяжелый дефицит A1AT представляет собой полиорганное расстройство, которое может быть связано с большим спектром заболеваний легких со снижением объема фиксированного выдоха за 1 с (ОФВ1), ухудшением переноса газов. Несмотря на отсутствие всеобъемлющего объяснения клинического течения болезни, у пациентов с дефицитом A1AT растет смертность, особенно при курении и сильном снижении ОФВ1 [4, 5, 6]. За последние годы в нескольких рандомизированных клинических исследованиях сообщалось о заместительной (аугментационной) терапии с использованием внутривенного очищенного концентрата А1АТ человека для улучшения его уровня в крови и снижения ОФВ1 или, как недавно описано, уменьшения плотности легких у пациентов с тяжелой формой ДААТ [1, 7, 8, 9].
В 2017 году Европейское респираторное общество (ЕРО) опубликовало обновленное заявление о диагностике и лечении легочных заболеваний при дефиците A1AT [10]. Документ был разработан целевой группой, включающей экспертов по ведению пациентов с дефицитом A1AT, фундаментальных и клинических исследователей и одного методиста. Предыдущее заявление Американского торакального общества (АТО)/ЕРО 2003 года использовалось в качестве отправной точки [1]. Участники дискуссии рассмотрели наиболее актуальные вопросы диагностики, клинического ведения и лечения заболеваний легких у пациентов с дефицитом A1AT путем формулирования априорных вопросов, на которые отвечали, используя всесторонний поиск литературы. Поиск был ограничен когортами с тяжелым дефицитом A1AT (т. е. гомозиготным Z или нулевым генотипом и Z/нулевым генотипом). Подход в соответствии с Системой градации качества анализа, разработки и оценки рекомендаций (GRADE — Grade of Recommendation, Assessment, Development and Evaluation) к определению уровня рекомендаций в соответствии с качеством доказательств не был принят. Сводка отчетов ЕРО представлена в таблице 1.
Таблица 1.
Краткое изложение положений Европейского респираторного общества о диагностике, клиническом ведении и лечении заболеваний легких при дефиците альфа1-антитрипсина [10]
Цель настоящего комментария состоит в том, чтобы предложить ответ на большинство спорных вопросов, касающихся болезни легких, связанной с ДААТ. При представлении этих аргументов будут рассмотрены три основные темы: 1) ограниченность существующего определения заболевания легких при дефиците A1AT; 2) необходимость более широкого тестирования пациентов и повышения осведомленности о ДААТ среди врачей, специализирующихся на хронических респираторных заболеваниях; 3) новая парадигма и перспективы будущих исследованиях ДААТ.
Гетерогенность признаков заболевания легких, ассоциированного с ДААТ
В попытке дать определение ассоциированного с ДААТ заболевания легких, целевая научная группа связала высокую степень гетерогенности клинических признаков болезни с поражениями легких при ДААТ. Однако в своих рассуждениях авторы опирались на классический фенотип пациента с манифестацией ХОБЛ в более молодом возрасте, когда с большей вероятностью происходит развитие панлобулярной эмфиземы с базальной локализацией, чем у обычных пациентов с ХОБЛ [10]. Данный факт, по мнению авторов настоящего комментария, имеет решающее значение.
Картина поражения легких при ДААТ может включать как эмфизему с тяжелыми функциональными нарушениями и рентгенологическими свидетельствами заболевания, так и различные картины состояния легких вплоть до нормальной компьютерно-томографической картины грудной клетки [11]. В ходе исследования серии пациентов с генотипом PI*ZZ Gishen проанализировал 165 рентгенограмм грудной клетки и сообщил о симптомах эмфиземы только у 20% пациентов, в то время как 15% выглядели совершенно здоровыми [12]. В популяции из 378 пациентов с тяжелым ДААТ (генотип PI*ZZ) DeMeo et al. продемонстрировали, что вариабельность показателей ОФВ1 была огромной и не имела отношения к курению или молодому возрасту. Таким образом, у некоторых курильщиков сохранялась функция легких, в то время как у отдельных некурящих пациентов наблюдалось снижение показателей ОФВ1 [13]. Подобные данные свидетельствуют о том, что ни показатели ОФВ1, ни рентгенологическое обследование грудной клетки не достаточны для того, чтобы усилить клиническое подозрение на ДААТ в повседневной практике. Как следствие, большинство пациентов с тяжелой формой ДААТ остаются не идентифицированными, и выявление случаев заболевания только среди пациентов с ХОБЛ является неудовлетворительным. Кроме того, была описана необычная связь между наиболее распространенными дефектными аллелями при ДААТ и идиопатическим легочным фиброзом (ИЛФ) или сочетанием эмфиземы и фиброза лёгких (СЭФЛ) [14, 15].
Ориентация на соответствующее тестирование только пациентов с классической клинической картиной ДААТ может рассматриваться как ограниченный подход, приводящий к недооценке реальной распространенности заболевания. Ввиду чрезвычайного разнообразия этого состояния, парадигма чисто эмфизематозных пациентов постепенно изменилась благодаря пониманию того, что клинический спектр заболевания легких при ДААТ может включать различные фенотипы (рисунок 1).
 Рисунок 1.
Рисунок 1.
ДААТ можно интерпретировать как общий механизм с различными клиническими проявлениями и частым совпадением клинических картин различных хронических респираторных заболеваний
ДААТ и астма
В рассматриваемом обзоре изучались связь и совпадение клинических признаков ДААТ и астмы [16]. После первых описаний пациентов с ДААТ Makino и Black сообщили о серии пациентов с эмфизематозным фенотипом с клиническими особенностями в виде реактивности дыхательных путей и одышки [17, 18]. В последующие годы несколько публикаций ранжировали распространенность астмы в популяции пациентов с ДААТ от 4 до 34% [19, 20, 21, 22]. По данным реестра пациентов с ДААТ Национального института болезней сердца, легких и крови (NHLBI — National Heart, Lung and Blood Institute), сети из 37 медицинских центров в США и Канаде с общим числом пациентов, составляющим 1219, у 55% пациентов описана значительная реакция на бронходилатацию, в то время как сопутствующие астма и респираторная аллергия были отмечены в 31% и 23% случаев соответственно [23, 24]. Исходя из этого, в 1997 году ВОЗ рекомендовала проводить скрининг всех пациентов с ХОБЛ и приобретённой астмой на предмет ДААТ [25]. В недавнем исследовании, проведённом на базе Исследовательского реестра Фонда альфа-1, включающего 500 пациентов с тяжелой легочной недостаточностью, было подтверждено, что клинические проявления неконтролируемой астмы или астмы с фиксированной обструкцией дыхательных путей часто встречаются при ДААТ; однако среди 34% участников, проходящих аллергологическую оценку, только у 5% был диагностирован ДААТ [26].
Хотя в современной литературе имеются противоречивые мнения о распространенности аллелей, обуславливающих ДААТ, в популяции астматиков, ДААТ зарегистрирован у 2,4% пациентов с плохо контролируемой астмой, причем 10,5% были носителями мутации, обусловливающей дефицит [27, 28]. Данный факт способствовал пониманию того, что сам ДААТ может предрасполагать к гиперреактивности дыхательных путей и участвовать в патофизиологии астмы. Хотя лежащий в основе процесса биологический механизм не понятен, данные фундаментальных исследований позволяют предположить, что ААТ также обладает иммуномодулирующими функциями и может влиять на эозинофильные клетки [29].
Наконец, у пациентов с ДААТ и сопутствующей астмой прогнозы хуже. Ответ на бронходилатацию связан с большим снижением ОФВ1 и менее благоприятными клиническими исходами [13, 24, 30]. С точки зрения клинициста, улучшение диагностики в этой популяции имеет основополагающее значение для оптимизации клинического ведения пациентов, поэтому необходимы дальнейшие клинические испытания для изучения реакции пациентов на доступное лечение.
ДААТ и бронхоэктатическая болезнь
В нескольких сообщениях высказывается предположение о связи ДААТ и бронхоэктатической болезни [21, 31, 32]. Чтобы оценить распространенность и клиническое влияние бронхоэктатической болезни в этой популяции, Parr и Stockley провели ретроспективное исследование 74 пациентов с тяжелой формой ДААТ, прошедших обследование методом компьютерной томографии высокого разрешения (КТВР) в период 1995–2002 годы. Они выявили неожиданно высокую распространенность бронхоэктатических изменений почти у всех пациентов (70/74 пациента, 94,6%) без учета клинических проявлений. В соответствии с такими критерии клинически значимого бронхоэктатическая болезнь, как хронический кашель с продукцией мокроты в сочетании с расширением бронхов по крайней мере в четырех сегментах, бронхоэктатическая болезнь отмечался у 27% исследуемой популяции [33].
Концепция ассоциации бронхоэктатической болезни и ДААТ также подтверждается данными, полученными в результате проведения крупной целевой программы скрининга по выявлению ДААТ в Германии. Greulich et al. проанализировали 18638 наборов для тестирования и выявили 1835 пациентов с тяжелой формой ДААТ (9,82% протестированной популяции). Наряду с эмфиземой и ХОБЛ бронхоэктатическая болезнь является сильным предиктором генотипа PI*ZZ, что предполагает проведение скрининга в этой новой популяции [34].
С другой стороны, среди врачей, занимающихся лечением бронхоэктатической болезнью, её причиной был признан ДААТ и высказано предположение о наличии причинно-следственной связи. Общее происхождение заболеваний дыхательных путей при ДААТ может быть объяснено дисбалансом между нейтрофильным воспалением и ингибиторами протеаз, что приводит к повреждению соединительной ткани бронхов [35]. Кроме того, было показано, что ААТ действует как противовоспалительный медиатор путем ингибирования уровней TNF-α и IL-1β в культурах мононуклеарных клеток [36]. Тем не менее, вопрос о том, является ли причиной бронхоэктаза основной механизм развития заболевания или он представляет собой результат рецидивирующей респираторной инфекции, все еще остается предметом дискуссий.
В 2015 году Loni et al. провели обширный анализ семи когорт взрослых амбулаторных пациентов с бронхоэктатической болезнью, предварительно набранных для исследования в период между 2009 и 2013 годами в разных странах Европы [37]. Все пациенты прошли этиологическое обследование в соответствии с рекомендациями Британского торакального общества, включая количественный анализ уровня ААТ в плазме у пациентов с рентгенологическими эмфизематозными изменениями. ДААТ был идентифицирован как причина развития бронхоэктатической болезни у 8 (0,6%) популяции. Эти данные согласуются с результатами, полученными в ходе всестороннего анализа, проведенного для выявления опубликованных работ, в которых описана лежащая в основе заболевания этиология в когортах, данные по которым были опубликованы; ДААТ был идентифицирован как причина бронхоэктатической болезни у 36 (0,4%) из 8608 пациентов [38]. Подавляющее большинство этих пациентов были из Европы (n = 23) и Северной Америки (n = 12), что свидетельствует о том, что только в части исследований, проведенных в развитых странах, выполнялось какое-либо тестирование на ДААТ.
За последнее десятилетие были созданы различные национальные и международные реестры для оценки реальных характеристик пациентов с различными респираторными заболеваниями, включая бронхоэктатическую болезнь, тяжелую астму и инфекцию, вызванную нетуберкулезными микобактериями (НТМБ) [39] [40]. Первые данные из Итальянского реестра взрослых пациентов с бронхоэктатической болезнью (IRIDE — Italian Registry on Adult Bronchiectasis) были представлены на 2-й Всемирной конференции по бронхоэктатической болезни. Из 522 взрослых пациентов с бронхоэктатической болезнью (к маю 2017 года) диагноз «ДААТ» был установлен менее 1%.
Хотя этот объем данных подтверждает роль ДААТ как основной этиологии бронхоэктатической болезни, можно предположить, что у большинства пациентов никогда не проводилось определение уровня ААТ. В 2014 году Итальянское респираторное общество (IRS (Italian Respiratory Society) /SIP (Società Italiana di Pneumologia)) провело национальный аудит взрослых пациентов с бронхоэктатической болезнью, посещающих клиники специализированной медицинской помощи в Италии [41]. В ходе аудита была проанализирована приверженность врачей стандартам качества, предложенным Британским торакальным обществом. На сегодняшний день это единственная проверка стандартов качества диагностики бронхоэктатической болезни в Италии. Что касается этиологического скрининга бронхоэктатической болезни, только 8,2% пациентов были обследованы на ДААТ. В результате можно предположить, что оценка распространенности ДААТ в популяции пациентов с бронхоэктатической болезнью является неудовлетворительной.
Примечательно, что как в европейском анализе, так и в итальянском отчете среди трех наиболее распространенных причин бронхоэктатической болезни указана ХОБЛ — 15% и 7,8% популяции соответственно [37] www.world-bronchiectasis-conference.org. Ассоциация ХОБЛ и бронхоэктатической болезни может представлять собой отдельный фенотип у пациентов с хроническими респираторными инфекциями, более тяжелым паттерном воспаления дыхательных путей и частыми обострениями болезней легких [42]. Однако вопрос о том, сосуществуют ли ХОБЛ и бронхоэктатическая болезнь как две независимые болезни или одна является причиной другой, до сих пор остается без ответа.
ДААТ и НТМБ
Нетуберкулезные микобактерии (НТМБ) представляют собой большое количество патогенных и непатогенных видов микобактерий, отличных от бактериального комплекса M. tubercolosis. Недавние сообщения продемонстрировали возрастающую роль НТМБ для пациентов с такими респираторными заболеваниями, как бронхоэктатическая болезнь и ХОБЛ [43, 44, 45]. Однако восприимчивость к развитию легочной болезни, обусловленной НТМБ, у пациентов различна, поэтому ДААТ постулирован как потенциальный предрасполагающий фактор. В когорте из 100 пациентов с болезнью легких, обусловленной инфекцией НТМБ, генетические варианты ААТ были зарегистрированы в 27% случаев, что в 1,6 раза превышает предполагаемую распространенность в общей популяции. У большинства из этих пациентов была выявлена гетерозиготность Pi*MS и Pi*MZ и отсутствие признаков эмфиземы легких. Кроме того, также было продемонстрировано, что ААТ снижает фагоцитоз M. abscessus макрофагами человека, что не позволяет обеспечить идеальную внутриклеточную среду для НТМБ [46]. Таким образом, принимая во внимание плейотропные противовоспалительные и иммуномодулирующие эффекты ААТ, его дефицит может повысить уязвимость пациента перед НТМБ как непосредственно, так и посредством развития бронхоэктатической болезни.
Клинические последствия: роль и преимущества скрининга
Поскольку большинство пациентов с ДААТ все еще не выявлены, а установка правильного диагноза часто несвоевременна, ведётся обсуждение структурированных программ проведения анализов на содержание ААТ. В заявлении ЕРО рассмотрены роль и преимущества скрининга на ДААТ и обобщены имеющиеся данные (см. таблицу 1). В прошлом большая часть популяционного скрининга взрослых была ограничена конкретными группами, например, донорами крови, в результате чего оценка распространенности дефицита смещалась в зависимости от выбора пациентов [10]. Более точную оценку дали программы, включающие случайные выборки населения [41, 42]. Обширный популяционный скрининг был проведен в Ирландии среди 3000 пациентов, который выявил 42 носителя генотипа ZZ, 44 — SZ и 430 — MZ, оценка распространенности оказалась выше, чем считалось ранее [47]. Другие данные получены в Польше, где был проведён скрининг среди 859 взрослых пациентов (средний возраст 49,5 лет, диапазон 20–90 лет) с результирующими частотами генотипов PI*S и PI*Z, равными 17,5 и 10,5 на 1000 человек соответственно. Таким образом, предполагаемая распространенность ДААТ была достаточно высокой, чтобы рассмотреть возможность реализации крупномасштабной программы скрининга [48]. Тем не менее, в заявлении ЕРО сообщается, что ни в одном РКИ не были исследованы действенность и эффективность программ скрининга по выявлению ДААТ, поэтому доказательства этого подхода в настоящее время скудны [10].
Представленный набор данных был оценен по-разному в каждом существующем руководстве по диагностике хронического респираторного заболевания, которое может быть ассоциировано с ДААТ. Хотя ДААТ тесно связан с развитием ХОБЛ, в документе «Глобальная инициатива по диагностике и лечению хронической обструктивной болезни легких» (GOLD — The Global Initiative for Chronic Obstructive Lung Disease), изданном в 2018 году, ДААТ упомянут только в двух случаях. Во-первых, как известный генетический фактор риска развития ХОБЛ и пример взаимодействия гена и окружающей среды; во-вторых, в качестве шага при оценке ХОБЛ в соответствии с рекомендациями ВОЗ для проведения однократного скрининга у всех пациентов с диагнозом ХОБЛ, особенно в районах с высокой распространенностью ДААТ [49]. Напротив, в документе «Глобальная инициатива по лечению и профилактике астмы» (GINA — Global Initiative for Asthma Management and Prevention) есть только одно упоминание ДААТ как возможного дифференциального диагноза у пациента с подозрением на астму при наличии в семейном анамнезе эмфиземы, начавшейся в возрасте между 12 и 39 годами. Примечательно, что в этом документе нет указаний на обследование на предмет ДААТ пациентов с астмой [50].
Сценарий относительно бронхоэктатической болезни более сложный, так как до недавнего времени международных руководящих принципов не существовало. В нескольких национальных руководствах не рекомендуется проводить обычное тестирование на ДААТ, если только рентгенологические исследования не предполагают базальную эмфизему [51, 52]. В остальном, рекомендации Португальского пульмонологического общества включали количественный анализ на уровни ААТ в минимальный пакет этиологического скрининга для всех пациентов с бронхоэктатической болезнью [53]. В 2017 году ЕРО опубликовало первые международные стандарты лечения бронхоэктатической болезни у взрослых пациентов [54]. Стандарты предлагают проводить тестирование на ДААТ только при наличии базальной эмфиземы или ранней обструкции дыхательных путей. Подробное резюме рекомендаций по тестированию на ДААТ в различных документах приведено в таблице 2.
Таблица 2.
Полное резюме показаний для тестирования на ДААТ в документах, регламентирующих клиническое ведение хронических респираторных заболеваний
Отсутствие общих принципов проведения анализов на содержание ААТ при диагностике заболеваний дыхательных путей требует дальнейшего рассмотрения. Выявление ДААТ имеет фундаментальное значение с учетом клинических, социальных и психологических последствий в целевой группе населения. Во-первых, ДААТ представляет собой системное заболевание с внереспираторными клиническими проявлениями, на которое может оказать благотворное влияние проведение специфического лечения, положительно влияющего на клинические исходы и качество жизни пациентов. Пациенты с ДААТ должны иметь доступ к справочным центрам, которые способны предоставить лучший стандарт медицинской помощи и способствовать созданию сети клинических данных. Кроме того, пациенты, с редкими заболеваниями могут получить пользу от бесплатной медицинской помощи или надлежащего медицинского страхования в разных юрисдикциях. С психологической точки зрения ДААТ является как генетическим заболеванием с повышенным риском для заболевших детей, так и хроническим состоянием, которое может повлиять на планирование семьи и жизненные приоритеты пациентов. В связи с этим пациентам с ДААТ должны быть предоставлены надлежащие генетические консультации и поддержка.
Различные перспективы определения ДААТ и показания для заместительной терапии
Определение ДААТ может вызывать некоторые споры среди врачей в области респираторной помощи. Возможны три различных сценария: 1) дефицит как состояние с более низкими, чем обычно, уровнями ААТ в крови; 2) дефицит в результате мутаций, влияющих на ген SERPINA; 3) дефицит как показание для заместительной терапии при ДААТ.
ДААТ как состояние со сниженным уровнем ААТ в крови. Это определение ориентировано на количественное измерение уровней ААТ в крови и представляет собой наиболее широкую интерпретацию статуса недостаточности. В настоящее время нефелометрия и иммунотурбидиметрический анализ являются наиболее широко используемыми методами, поэтому в заявлении ЕРО приведён полный перечень лабораторных методов, применяемых в ведущих лабораториях по всей Европе [10].
ДААТ как результат генетического заболевания
Как следует из заявления ЕРО, аномальные результаты количественных измерений уровней ААТ в крови должны подтверждаться качественным тестом, выявляющим мутации гена SERPINA в обеих копиях гена [7]. Нормальный аллель, обозначенный как М, присутствует у 85–90% населения, в то время как распространенные дефектные аллели обозначаются как S и Z [1]. В результате наиболее распространенные генотипы являются результатом сочетания этих аллельных форм: гомозиготный генотип Pi*MM (дикий тип), гетерозиготные Pi*MZ и Pi*MS и полудефицитный или дефицитные генотипы Pi*SZ, Pi*SS и Pi*ZZ. Помимо дефицитных аллелей S и Z, было описано около 50 других необычных мутаций, включая нулевой аллель и другие редкие варианты [55].
ДААТ как показание к заместительной терапии
Внутривенное введение ингибитора альфа-1-протеиназы, приготовленного из объединенной человеческой плазмы здоровых доноров, имеет биохимическую цель — поднять и поддерживать уровни ААТ в сыворотке выше защитного порога, а также клинические цели — замедлить прогрессирование эмфиземы, уменьшить количество обострений и увеличить продолжительность и качество жизни [56, 57].
До настоящего времени заместительная терапия была одобрена только для коммерческого применения у взрослых пациентов с тяжелой эмфиземой легких, связанной с ДААТ, поэтому ряд препаратов ААТ в настоящее время доступны на различных рынках [56].
Доказательства пользы заместительной терапии (например, замедление уменьшения ОФВ1, снижение смертности) сильнее в случаях с пациентами с умеренной обструктивной легочной недостаточностью (например, прогнозируемый ОФВ1 = 35–60%), чем у людей с тяжелым нарушением дыхания [57].
Значение для будущих исследований
Принимая во внимание совокупность данных, свидетельствующих о роли ДААТ как причины развития бронхоэктатической болезни, следует применять более глубокую оценку клинических, рентгенологических, микробиологических и функциональных переменных для изучения различных фенотипов у пациентов с ДААТ. Идентификация отдельного фенотипа бронхоэктатической болезни может быть полезна для лучшего понимания патофизиологии ДААТ, а также для улучшения индивидуального подхода к подгруппам пациентов, которым пойдет на пользу целенаправленное лечение. Таким образом, необходимо новое поколение РКИ для проверки эффективности заместительной терапии с внутривенным введением ААТ у пациентов с сочетанием бронхоэктатической болезни и тяжелой формы ДААТ. В то же время требуют изучения новые конечные точки для мониторинга прогрессирования заболеваний легких и реакции на терапию в этой популяции.
Кроме того, на основе соотношения риска и пользы на данном этапе необходимо принимать решение о начале проведения постоянной заместительной терапии, поскольку разрушение ткани легких при эмфиземе необратимо, поэтому новое направление трансляционных исследований ДААТ должно быть сфокусировано на разработке персонализированных схем лечения с учетом клинического профиля и потребностей пациента [58]. Следовательно, необходимо срочно исследовать новую роль заместительной терапии для пациентов с гетерозиготными генотипами (PI*MZ, PI*MS), особенно при наличии других хронических респираторных состояний, таких как астма или бронхоэктатическая болезнь. Обоснование состоит в том, что антипротеазная активность, осуществляемая ААТ, хотя и присутствует в нормальных количествах, в конечном итоге снижается у пациентов с хроническими воспалительными заболеваниями, такими как бронхоэктатическая болезнь, из-за превосходящей воспалительной нагрузки НЭ [2]. Такое состояние может привести к функциональной недостаточности ААТ (рисунок 2). Данный факт поддерживает идею индивидуального подхода к заместительной терапии, основанной не только на генотипе пациента, но и на тщательной оценке ожидаемых преимуществ, рисков и санитарных затрат.
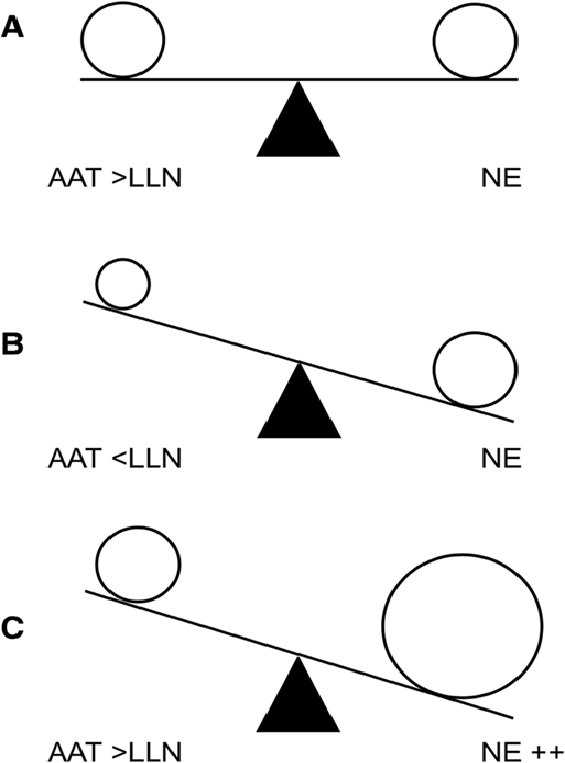
Рисунок 2.
Баланс протеазы/антипротеазы у здоровых людей (а), пациентов с ДААТ (b) и пациентов с бронхоэктатической болезнью (c).
Сокращения: AAT — дефицит альфа-1 антитрипсина; NE — нейтрофильная эластаза; LLN — нижний предел нормы
Применение терапии с применением ААТ для пациентов с генотипами, отличными от PI*ZZ, насчитывает десятилетия и уже изучалось при кистозном фиброзе (КФ) (муковисцидозе), генетическом системном заболевании, характеризующемся обширным нейтрофильным воспалением на поверхности эпителия легких. В 2007 году Griese et al. провели проспективное неконтролируемое исследование 4-недельного ингаляционного введения AААТ1AT группе из 52 пациентов с КФ. Основным результатом данного исследования было снижение активности НЭ, наряду с изменением содержания нейтрофилов и провоспалительных цитокинов в мокроте. Хотя результаты измерения легочной функции были противоречивы, авторы обнаружили значительное снижение уровней всех воспалительных маркеров, измеренных во время лечения [59]. Аналогичным образом, в двух других исследованиях было показано снижение активности эластазы у пациентов с КФ после ингаляционного лечения ААТ [60, 61]. Однако корреляция с клиническими исходами потребует проведения многолетних многоцентровых исследований.
Выводы
В последние годы ДААТ интерпретировали как распространенный механизм воспалительного дисбаланса и повреждения тканей как при хронических респираторных заболеваниях, так и заболеваниях вне дыхательных путей. Окончательная клиническая картина, следовательно, будет складываться из сложного и в основном неизвестного взаимодействия между наследственностью и факторами окружающей среды. Дальнейшие исследования постепенно указывают на новую парадигму, расширяя базу доказательств роли заместительной терапии с применением ААТ как мощного иммуномодулирующего и противовоспалительного препарата для состояний, отличных от эмфиземы легких (таблица 3).
Таблица 3.
Список клинических исследований последнего десятилетия, проверяющих безопасность и эффективность применения ААТ в условиях, отличных от тяжелого ДААТ (по данным Clinicaltrials.gov, последний доступ 15 июля 2018 г.)
A1AT — альфа-1 антитрипсин, КФ — кистозный фиброз, РТПХ — реакция «трансплантат против хозяина», ВИЧ — вирус иммунодефицита человека.
Список использованной литературы
Опубликовано: 8 октября 2018 года. Doi: 10.1186 / s40248-018-0153-4
Эта статья распространяется на условиях международной лицензии Creative Commons Attribution 4.0
- Кафедра патофизиологии и трансплантации Миланского университета; Отделение внутренней медицины, отделение дыхательных путей и центр муковисцидоза у взрослых, Fondazione IRCCS Ca 'Granda Ospedale Maggiore Policlinico, Милан, Италия
- Отделение медицинских наук, Отделение респираторных заболеваний, Университетская клиника Каттинара, Триест, Италия
- Отделение внутренней медицины и терапии, отдел респираторных заболеваний, Фонд IRCCS Policlinico San Matteo, Университет Павии, Павия, Италия
- Университет Каттолики дель Сакро Куоре, Фонд поликлиники Университета Агостино Джемелли IRCCS, Рим, Италия
- Региональный справочный центр по редким заболеваниям легких, Департамент клинической и экспериментальной медицины, Университет Катании, Университетская клиника Поликлиника «Г. Родолико », Катания, Италия
Введение
Европейское респираторное общество (European Respiratory Society) недавно опубликовало важное заявление, в котором рассматриваются имеющиеся данные о диагностике и лечении заболеваний легких, связанных с дефицитом альфа-1-антитрипсина (дефицит А1АТ, ДААТ). Некоторые вопросы по данной теме все еще остаются нерешенными и подлежат интерпретации в соответствии с различными стандартными процедурами и требованиями систем здравоохранения разных стран. Цель настоящего комментария состоит в том, чтобы предложить решение большинства этих спорных вопросов на примере перспективы лечения респираторных болезней в Италии.
Основное содержание
Клинический спектр заболеваний легких, обусловленных ДААТ, может включать различные проявления, поэтому традиционную парадигму для молодого пациента с эмфизематозом следует считать недостаточно информативной. Ориентация на надлежащее обследование только пациентов с хронической обструктивной болезнью легких (ХОБЛ) может рассматриваться как ограниченный подход, приводящий к недооценке реальной распространенности заболевания. В нескольких работах было высказано предположение о связи между ДААТ и другими хроническими респираторными заболеваниями, такими как астма и бронхоэктатическая болезнь. Поэтому для изучения различных фенотипов пациентов с ДААТ необходима более глубокая оценка клинических, рентгенологических, микробиологических и функциональных переменных. Кроме того, новое направление трансляционных исследований ДААТ нужно сфокусировать на разработке персонализированных схем лечения с учетом клинического профиля пациента и его потребностей.
Выводы
В последние годы ДААТ расценивается как общий механизм воспалительного дисбаланса и повреждения тканей в различных условиях. Дальнейшие исследования постепенно указывают на эту новую парадигму, расширяя базу доказательств роли А1АТ в качестве мощного иммуномодулирующего и противовоспалительного препарата при заболеваниях, отличных от эмфиземы легких.
Основная часть
Введение
Дефицит альфа-1-антитрипсина (ДААТ) является наиболее распространенным наследственным заболеванием у взрослых [1]. Существует несколько мутаций гена SERPINA1, кодирующего А1АТ, представляющий собой наиболее распространенный ингибитор протеазы, которые способны вызывать заболевание. Несмотря на свое название, основная биологическая роль А1АТ заключается в ингибировании нейтрофильной эластазы (НЭ), протеолитического фермента, нацеленного на эластин и другие компоненты базальной мембраны и матрицы [2]. Дефицит A1AT наследуется как аутосомно-доминантное заболевание, к настоящему времени было описано более 100 генетических вариантов, и гомозиготный генотип Z-аллели (PI*ZZ) определяет подавляющее большинство клинически подтвержденных тяжелых дефицитов [3]. Тяжелый дефицит A1AT представляет собой полиорганное расстройство, которое может быть связано с большим спектром заболеваний легких со снижением объема фиксированного выдоха за 1 с (ОФВ1), ухудшением переноса газов. Несмотря на отсутствие всеобъемлющего объяснения клинического течения болезни, у пациентов с дефицитом A1AT растет смертность, особенно при курении и сильном снижении ОФВ1 [4, 5, 6]. За последние годы в нескольких рандомизированных клинических исследованиях сообщалось о заместительной (аугментационной) терапии с использованием внутривенного очищенного концентрата А1АТ человека для улучшения его уровня в крови и снижения ОФВ1 или, как недавно описано, уменьшения плотности легких у пациентов с тяжелой формой ДААТ [1, 7, 8, 9].
В 2017 году Европейское респираторное общество (ЕРО) опубликовало обновленное заявление о диагностике и лечении легочных заболеваний при дефиците A1AT [10]. Документ был разработан целевой группой, включающей экспертов по ведению пациентов с дефицитом A1AT, фундаментальных и клинических исследователей и одного методиста. Предыдущее заявление Американского торакального общества (АТО)/ЕРО 2003 года использовалось в качестве отправной точки [1]. Участники дискуссии рассмотрели наиболее актуальные вопросы диагностики, клинического ведения и лечения заболеваний легких у пациентов с дефицитом A1AT путем формулирования априорных вопросов, на которые отвечали, используя всесторонний поиск литературы. Поиск был ограничен когортами с тяжелым дефицитом A1AT (т. е. гомозиготным Z или нулевым генотипом и Z/нулевым генотипом). Подход в соответствии с Системой градации качества анализа, разработки и оценки рекомендаций (GRADE — Grade of Recommendation, Assessment, Development and Evaluation) к определению уровня рекомендаций в соответствии с качеством доказательств не был принят. Сводка отчетов ЕРО представлена в таблице 1.
Таблица 1.
Краткое изложение положений Европейского респираторного общества о диагностике, клиническом ведении и лечении заболеваний легких при дефиците альфа1-антитрипсина [10]
| Дефицит A1AT и болезнь легких |
|
|
|
|
|
|
|
| Лабораторная диагностика и иерархия тестов |
|
|
|
|
|
|
|
|
|
|
|
| Прогрессирование заболевания легких при ДААТ |
|
|
|
|
|
|
|
| Риск развития заболевания легких у гетерозиготных пациентов |
|
|
|
|
|
| Роль и преимущества скрининга |
|
|
|
|
|
|
|
| Заместительная терапия при дефиците A1AT |
|
|
|
|
|
| Хирургическое уменьшение объема легких при дефиците А1АТ |
|
|
|
| Трансплантация легких при эмфиземе, связанной с ДААТ |
|
|
|
|
|
|
|
| Новые направления исследований ДААТ |
|
|
|
|
Цель настоящего комментария состоит в том, чтобы предложить ответ на большинство спорных вопросов, касающихся болезни легких, связанной с ДААТ. При представлении этих аргументов будут рассмотрены три основные темы: 1) ограниченность существующего определения заболевания легких при дефиците A1AT; 2) необходимость более широкого тестирования пациентов и повышения осведомленности о ДААТ среди врачей, специализирующихся на хронических респираторных заболеваниях; 3) новая парадигма и перспективы будущих исследованиях ДААТ.
Гетерогенность признаков заболевания легких, ассоциированного с ДААТ
В попытке дать определение ассоциированного с ДААТ заболевания легких, целевая научная группа связала высокую степень гетерогенности клинических признаков болезни с поражениями легких при ДААТ. Однако в своих рассуждениях авторы опирались на классический фенотип пациента с манифестацией ХОБЛ в более молодом возрасте, когда с большей вероятностью происходит развитие панлобулярной эмфиземы с базальной локализацией, чем у обычных пациентов с ХОБЛ [10]. Данный факт, по мнению авторов настоящего комментария, имеет решающее значение.
Картина поражения легких при ДААТ может включать как эмфизему с тяжелыми функциональными нарушениями и рентгенологическими свидетельствами заболевания, так и различные картины состояния легких вплоть до нормальной компьютерно-томографической картины грудной клетки [11]. В ходе исследования серии пациентов с генотипом PI*ZZ Gishen проанализировал 165 рентгенограмм грудной клетки и сообщил о симптомах эмфиземы только у 20% пациентов, в то время как 15% выглядели совершенно здоровыми [12]. В популяции из 378 пациентов с тяжелым ДААТ (генотип PI*ZZ) DeMeo et al. продемонстрировали, что вариабельность показателей ОФВ1 была огромной и не имела отношения к курению или молодому возрасту. Таким образом, у некоторых курильщиков сохранялась функция легких, в то время как у отдельных некурящих пациентов наблюдалось снижение показателей ОФВ1 [13]. Подобные данные свидетельствуют о том, что ни показатели ОФВ1, ни рентгенологическое обследование грудной клетки не достаточны для того, чтобы усилить клиническое подозрение на ДААТ в повседневной практике. Как следствие, большинство пациентов с тяжелой формой ДААТ остаются не идентифицированными, и выявление случаев заболевания только среди пациентов с ХОБЛ является неудовлетворительным. Кроме того, была описана необычная связь между наиболее распространенными дефектными аллелями при ДААТ и идиопатическим легочным фиброзом (ИЛФ) или сочетанием эмфиземы и фиброза лёгких (СЭФЛ) [14, 15].
Ориентация на соответствующее тестирование только пациентов с классической клинической картиной ДААТ может рассматриваться как ограниченный подход, приводящий к недооценке реальной распространенности заболевания. Ввиду чрезвычайного разнообразия этого состояния, парадигма чисто эмфизематозных пациентов постепенно изменилась благодаря пониманию того, что клинический спектр заболевания легких при ДААТ может включать различные фенотипы (рисунок 1).
 Рисунок 1.
Рисунок 1.ДААТ можно интерпретировать как общий механизм с различными клиническими проявлениями и частым совпадением клинических картин различных хронических респираторных заболеваний
ДААТ и астма
В рассматриваемом обзоре изучались связь и совпадение клинических признаков ДААТ и астмы [16]. После первых описаний пациентов с ДААТ Makino и Black сообщили о серии пациентов с эмфизематозным фенотипом с клиническими особенностями в виде реактивности дыхательных путей и одышки [17, 18]. В последующие годы несколько публикаций ранжировали распространенность астмы в популяции пациентов с ДААТ от 4 до 34% [19, 20, 21, 22]. По данным реестра пациентов с ДААТ Национального института болезней сердца, легких и крови (NHLBI — National Heart, Lung and Blood Institute), сети из 37 медицинских центров в США и Канаде с общим числом пациентов, составляющим 1219, у 55% пациентов описана значительная реакция на бронходилатацию, в то время как сопутствующие астма и респираторная аллергия были отмечены в 31% и 23% случаев соответственно [23, 24]. Исходя из этого, в 1997 году ВОЗ рекомендовала проводить скрининг всех пациентов с ХОБЛ и приобретённой астмой на предмет ДААТ [25]. В недавнем исследовании, проведённом на базе Исследовательского реестра Фонда альфа-1, включающего 500 пациентов с тяжелой легочной недостаточностью, было подтверждено, что клинические проявления неконтролируемой астмы или астмы с фиксированной обструкцией дыхательных путей часто встречаются при ДААТ; однако среди 34% участников, проходящих аллергологическую оценку, только у 5% был диагностирован ДААТ [26].
Хотя в современной литературе имеются противоречивые мнения о распространенности аллелей, обуславливающих ДААТ, в популяции астматиков, ДААТ зарегистрирован у 2,4% пациентов с плохо контролируемой астмой, причем 10,5% были носителями мутации, обусловливающей дефицит [27, 28]. Данный факт способствовал пониманию того, что сам ДААТ может предрасполагать к гиперреактивности дыхательных путей и участвовать в патофизиологии астмы. Хотя лежащий в основе процесса биологический механизм не понятен, данные фундаментальных исследований позволяют предположить, что ААТ также обладает иммуномодулирующими функциями и может влиять на эозинофильные клетки [29].
Наконец, у пациентов с ДААТ и сопутствующей астмой прогнозы хуже. Ответ на бронходилатацию связан с большим снижением ОФВ1 и менее благоприятными клиническими исходами [13, 24, 30]. С точки зрения клинициста, улучшение диагностики в этой популяции имеет основополагающее значение для оптимизации клинического ведения пациентов, поэтому необходимы дальнейшие клинические испытания для изучения реакции пациентов на доступное лечение.
ДААТ и бронхоэктатическая болезнь
В нескольких сообщениях высказывается предположение о связи ДААТ и бронхоэктатической болезни [21, 31, 32]. Чтобы оценить распространенность и клиническое влияние бронхоэктатической болезни в этой популяции, Parr и Stockley провели ретроспективное исследование 74 пациентов с тяжелой формой ДААТ, прошедших обследование методом компьютерной томографии высокого разрешения (КТВР) в период 1995–2002 годы. Они выявили неожиданно высокую распространенность бронхоэктатических изменений почти у всех пациентов (70/74 пациента, 94,6%) без учета клинических проявлений. В соответствии с такими критерии клинически значимого бронхоэктатическая болезнь, как хронический кашель с продукцией мокроты в сочетании с расширением бронхов по крайней мере в четырех сегментах, бронхоэктатическая болезнь отмечался у 27% исследуемой популяции [33].
Концепция ассоциации бронхоэктатической болезни и ДААТ также подтверждается данными, полученными в результате проведения крупной целевой программы скрининга по выявлению ДААТ в Германии. Greulich et al. проанализировали 18638 наборов для тестирования и выявили 1835 пациентов с тяжелой формой ДААТ (9,82% протестированной популяции). Наряду с эмфиземой и ХОБЛ бронхоэктатическая болезнь является сильным предиктором генотипа PI*ZZ, что предполагает проведение скрининга в этой новой популяции [34].
С другой стороны, среди врачей, занимающихся лечением бронхоэктатической болезнью, её причиной был признан ДААТ и высказано предположение о наличии причинно-следственной связи. Общее происхождение заболеваний дыхательных путей при ДААТ может быть объяснено дисбалансом между нейтрофильным воспалением и ингибиторами протеаз, что приводит к повреждению соединительной ткани бронхов [35]. Кроме того, было показано, что ААТ действует как противовоспалительный медиатор путем ингибирования уровней TNF-α и IL-1β в культурах мононуклеарных клеток [36]. Тем не менее, вопрос о том, является ли причиной бронхоэктаза основной механизм развития заболевания или он представляет собой результат рецидивирующей респираторной инфекции, все еще остается предметом дискуссий.
В 2015 году Loni et al. провели обширный анализ семи когорт взрослых амбулаторных пациентов с бронхоэктатической болезнью, предварительно набранных для исследования в период между 2009 и 2013 годами в разных странах Европы [37]. Все пациенты прошли этиологическое обследование в соответствии с рекомендациями Британского торакального общества, включая количественный анализ уровня ААТ в плазме у пациентов с рентгенологическими эмфизематозными изменениями. ДААТ был идентифицирован как причина развития бронхоэктатической болезни у 8 (0,6%) популяции. Эти данные согласуются с результатами, полученными в ходе всестороннего анализа, проведенного для выявления опубликованных работ, в которых описана лежащая в основе заболевания этиология в когортах, данные по которым были опубликованы; ДААТ был идентифицирован как причина бронхоэктатической болезни у 36 (0,4%) из 8608 пациентов [38]. Подавляющее большинство этих пациентов были из Европы (n = 23) и Северной Америки (n = 12), что свидетельствует о том, что только в части исследований, проведенных в развитых странах, выполнялось какое-либо тестирование на ДААТ.
За последнее десятилетие были созданы различные национальные и международные реестры для оценки реальных характеристик пациентов с различными респираторными заболеваниями, включая бронхоэктатическую болезнь, тяжелую астму и инфекцию, вызванную нетуберкулезными микобактериями (НТМБ) [39] [40]. Первые данные из Итальянского реестра взрослых пациентов с бронхоэктатической болезнью (IRIDE — Italian Registry on Adult Bronchiectasis) были представлены на 2-й Всемирной конференции по бронхоэктатической болезни. Из 522 взрослых пациентов с бронхоэктатической болезнью (к маю 2017 года) диагноз «ДААТ» был установлен менее 1%.
Хотя этот объем данных подтверждает роль ДААТ как основной этиологии бронхоэктатической болезни, можно предположить, что у большинства пациентов никогда не проводилось определение уровня ААТ. В 2014 году Итальянское респираторное общество (IRS (Italian Respiratory Society) /SIP (Società Italiana di Pneumologia)) провело национальный аудит взрослых пациентов с бронхоэктатической болезнью, посещающих клиники специализированной медицинской помощи в Италии [41]. В ходе аудита была проанализирована приверженность врачей стандартам качества, предложенным Британским торакальным обществом. На сегодняшний день это единственная проверка стандартов качества диагностики бронхоэктатической болезни в Италии. Что касается этиологического скрининга бронхоэктатической болезни, только 8,2% пациентов были обследованы на ДААТ. В результате можно предположить, что оценка распространенности ДААТ в популяции пациентов с бронхоэктатической болезнью является неудовлетворительной.
Примечательно, что как в европейском анализе, так и в итальянском отчете среди трех наиболее распространенных причин бронхоэктатической болезни указана ХОБЛ — 15% и 7,8% популяции соответственно [37] www.world-bronchiectasis-conference.org. Ассоциация ХОБЛ и бронхоэктатической болезни может представлять собой отдельный фенотип у пациентов с хроническими респираторными инфекциями, более тяжелым паттерном воспаления дыхательных путей и частыми обострениями болезней легких [42]. Однако вопрос о том, сосуществуют ли ХОБЛ и бронхоэктатическая болезнь как две независимые болезни или одна является причиной другой, до сих пор остается без ответа.
ДААТ и НТМБ
Нетуберкулезные микобактерии (НТМБ) представляют собой большое количество патогенных и непатогенных видов микобактерий, отличных от бактериального комплекса M. tubercolosis. Недавние сообщения продемонстрировали возрастающую роль НТМБ для пациентов с такими респираторными заболеваниями, как бронхоэктатическая болезнь и ХОБЛ [43, 44, 45]. Однако восприимчивость к развитию легочной болезни, обусловленной НТМБ, у пациентов различна, поэтому ДААТ постулирован как потенциальный предрасполагающий фактор. В когорте из 100 пациентов с болезнью легких, обусловленной инфекцией НТМБ, генетические варианты ААТ были зарегистрированы в 27% случаев, что в 1,6 раза превышает предполагаемую распространенность в общей популяции. У большинства из этих пациентов была выявлена гетерозиготность Pi*MS и Pi*MZ и отсутствие признаков эмфиземы легких. Кроме того, также было продемонстрировано, что ААТ снижает фагоцитоз M. abscessus макрофагами человека, что не позволяет обеспечить идеальную внутриклеточную среду для НТМБ [46]. Таким образом, принимая во внимание плейотропные противовоспалительные и иммуномодулирующие эффекты ААТ, его дефицит может повысить уязвимость пациента перед НТМБ как непосредственно, так и посредством развития бронхоэктатической болезни.
Клинические последствия: роль и преимущества скрининга
Поскольку большинство пациентов с ДААТ все еще не выявлены, а установка правильного диагноза часто несвоевременна, ведётся обсуждение структурированных программ проведения анализов на содержание ААТ. В заявлении ЕРО рассмотрены роль и преимущества скрининга на ДААТ и обобщены имеющиеся данные (см. таблицу 1). В прошлом большая часть популяционного скрининга взрослых была ограничена конкретными группами, например, донорами крови, в результате чего оценка распространенности дефицита смещалась в зависимости от выбора пациентов [10]. Более точную оценку дали программы, включающие случайные выборки населения [41, 42]. Обширный популяционный скрининг был проведен в Ирландии среди 3000 пациентов, который выявил 42 носителя генотипа ZZ, 44 — SZ и 430 — MZ, оценка распространенности оказалась выше, чем считалось ранее [47]. Другие данные получены в Польше, где был проведён скрининг среди 859 взрослых пациентов (средний возраст 49,5 лет, диапазон 20–90 лет) с результирующими частотами генотипов PI*S и PI*Z, равными 17,5 и 10,5 на 1000 человек соответственно. Таким образом, предполагаемая распространенность ДААТ была достаточно высокой, чтобы рассмотреть возможность реализации крупномасштабной программы скрининга [48]. Тем не менее, в заявлении ЕРО сообщается, что ни в одном РКИ не были исследованы действенность и эффективность программ скрининга по выявлению ДААТ, поэтому доказательства этого подхода в настоящее время скудны [10].
Представленный набор данных был оценен по-разному в каждом существующем руководстве по диагностике хронического респираторного заболевания, которое может быть ассоциировано с ДААТ. Хотя ДААТ тесно связан с развитием ХОБЛ, в документе «Глобальная инициатива по диагностике и лечению хронической обструктивной болезни легких» (GOLD — The Global Initiative for Chronic Obstructive Lung Disease), изданном в 2018 году, ДААТ упомянут только в двух случаях. Во-первых, как известный генетический фактор риска развития ХОБЛ и пример взаимодействия гена и окружающей среды; во-вторых, в качестве шага при оценке ХОБЛ в соответствии с рекомендациями ВОЗ для проведения однократного скрининга у всех пациентов с диагнозом ХОБЛ, особенно в районах с высокой распространенностью ДААТ [49]. Напротив, в документе «Глобальная инициатива по лечению и профилактике астмы» (GINA — Global Initiative for Asthma Management and Prevention) есть только одно упоминание ДААТ как возможного дифференциального диагноза у пациента с подозрением на астму при наличии в семейном анамнезе эмфиземы, начавшейся в возрасте между 12 и 39 годами. Примечательно, что в этом документе нет указаний на обследование на предмет ДААТ пациентов с астмой [50].
Сценарий относительно бронхоэктатической болезни более сложный, так как до недавнего времени международных руководящих принципов не существовало. В нескольких национальных руководствах не рекомендуется проводить обычное тестирование на ДААТ, если только рентгенологические исследования не предполагают базальную эмфизему [51, 52]. В остальном, рекомендации Португальского пульмонологического общества включали количественный анализ на уровни ААТ в минимальный пакет этиологического скрининга для всех пациентов с бронхоэктатической болезнью [53]. В 2017 году ЕРО опубликовало первые международные стандарты лечения бронхоэктатической болезни у взрослых пациентов [54]. Стандарты предлагают проводить тестирование на ДААТ только при наличии базальной эмфиземы или ранней обструкции дыхательных путей. Подробное резюме рекомендаций по тестированию на ДААТ в различных документах приведено в таблице 2.
Таблица 2.
Полное резюме показаний для тестирования на ДААТ в документах, регламентирующих клиническое ведение хронических респираторных заболеваний
| Документ | Болезнь | Показания к тестированию на ДААТ |
| Глобальная стратегия профилактики, диагностики и лечения ХОБЛ, 2018 год [49] | ХОБЛ | Все пациенты с диагнозом ХОБЛ, особенно в районах с высокой распространенностью ДААТ |
| Глобальная стратегия лечения и профилактики астмы, 2018 год [50] | Астма | Нет показаний для тестирования ДААТ |
| Европейское респираторное общество, 2017 год [54] | бронхоэктатическая болезнь | Пациенты с базальной эмфиземой или ранним возникновением нарушений дыхательной деятельности |
| Исследовательская группа по бронхоэктатической болезни Португальского пульмонологического общества, 2018 год [53] | бронхоэктатическая болезнь | Все пациенты с диагнозом «бронхоэктатическая болезнь» |
| Торакальное общество Австралии и Новой Зеландии, 2015 год [62] | бронхоэктатическая болезнь | Нет показаний для тестирования на ДААТ |
| Британское торакальное общество, 2010 [51] | бронхоэктатическая болезнь | Пациенты с базальной эмфиземой. |
| Норматив Испанского общества пульмонологов и торакальных хирургов (SEPAR— Spanish Society of Pulmonology and Thoracic Surgery), 2008 [52] | бронхоэктатическая болезнь | Пациенты с эмфиземой и/ или заболеваниями печени |
Отсутствие общих принципов проведения анализов на содержание ААТ при диагностике заболеваний дыхательных путей требует дальнейшего рассмотрения. Выявление ДААТ имеет фундаментальное значение с учетом клинических, социальных и психологических последствий в целевой группе населения. Во-первых, ДААТ представляет собой системное заболевание с внереспираторными клиническими проявлениями, на которое может оказать благотворное влияние проведение специфического лечения, положительно влияющего на клинические исходы и качество жизни пациентов. Пациенты с ДААТ должны иметь доступ к справочным центрам, которые способны предоставить лучший стандарт медицинской помощи и способствовать созданию сети клинических данных. Кроме того, пациенты, с редкими заболеваниями могут получить пользу от бесплатной медицинской помощи или надлежащего медицинского страхования в разных юрисдикциях. С психологической точки зрения ДААТ является как генетическим заболеванием с повышенным риском для заболевших детей, так и хроническим состоянием, которое может повлиять на планирование семьи и жизненные приоритеты пациентов. В связи с этим пациентам с ДААТ должны быть предоставлены надлежащие генетические консультации и поддержка.
Различные перспективы определения ДААТ и показания для заместительной терапии
Определение ДААТ может вызывать некоторые споры среди врачей в области респираторной помощи. Возможны три различных сценария: 1) дефицит как состояние с более низкими, чем обычно, уровнями ААТ в крови; 2) дефицит в результате мутаций, влияющих на ген SERPINA; 3) дефицит как показание для заместительной терапии при ДААТ.
ДААТ как состояние со сниженным уровнем ААТ в крови. Это определение ориентировано на количественное измерение уровней ААТ в крови и представляет собой наиболее широкую интерпретацию статуса недостаточности. В настоящее время нефелометрия и иммунотурбидиметрический анализ являются наиболее широко используемыми методами, поэтому в заявлении ЕРО приведён полный перечень лабораторных методов, применяемых в ведущих лабораториях по всей Европе [10].
ДААТ как результат генетического заболевания
Как следует из заявления ЕРО, аномальные результаты количественных измерений уровней ААТ в крови должны подтверждаться качественным тестом, выявляющим мутации гена SERPINA в обеих копиях гена [7]. Нормальный аллель, обозначенный как М, присутствует у 85–90% населения, в то время как распространенные дефектные аллели обозначаются как S и Z [1]. В результате наиболее распространенные генотипы являются результатом сочетания этих аллельных форм: гомозиготный генотип Pi*MM (дикий тип), гетерозиготные Pi*MZ и Pi*MS и полудефицитный или дефицитные генотипы Pi*SZ, Pi*SS и Pi*ZZ. Помимо дефицитных аллелей S и Z, было описано около 50 других необычных мутаций, включая нулевой аллель и другие редкие варианты [55].
ДААТ как показание к заместительной терапии
Внутривенное введение ингибитора альфа-1-протеиназы, приготовленного из объединенной человеческой плазмы здоровых доноров, имеет биохимическую цель — поднять и поддерживать уровни ААТ в сыворотке выше защитного порога, а также клинические цели — замедлить прогрессирование эмфиземы, уменьшить количество обострений и увеличить продолжительность и качество жизни [56, 57].
До настоящего времени заместительная терапия была одобрена только для коммерческого применения у взрослых пациентов с тяжелой эмфиземой легких, связанной с ДААТ, поэтому ряд препаратов ААТ в настоящее время доступны на различных рынках [56].
Доказательства пользы заместительной терапии (например, замедление уменьшения ОФВ1, снижение смертности) сильнее в случаях с пациентами с умеренной обструктивной легочной недостаточностью (например, прогнозируемый ОФВ1 = 35–60%), чем у людей с тяжелым нарушением дыхания [57].
Значение для будущих исследований
Принимая во внимание совокупность данных, свидетельствующих о роли ДААТ как причины развития бронхоэктатической болезни, следует применять более глубокую оценку клинических, рентгенологических, микробиологических и функциональных переменных для изучения различных фенотипов у пациентов с ДААТ. Идентификация отдельного фенотипа бронхоэктатической болезни может быть полезна для лучшего понимания патофизиологии ДААТ, а также для улучшения индивидуального подхода к подгруппам пациентов, которым пойдет на пользу целенаправленное лечение. Таким образом, необходимо новое поколение РКИ для проверки эффективности заместительной терапии с внутривенным введением ААТ у пациентов с сочетанием бронхоэктатической болезни и тяжелой формы ДААТ. В то же время требуют изучения новые конечные точки для мониторинга прогрессирования заболеваний легких и реакции на терапию в этой популяции.
Кроме того, на основе соотношения риска и пользы на данном этапе необходимо принимать решение о начале проведения постоянной заместительной терапии, поскольку разрушение ткани легких при эмфиземе необратимо, поэтому новое направление трансляционных исследований ДААТ должно быть сфокусировано на разработке персонализированных схем лечения с учетом клинического профиля и потребностей пациента [58]. Следовательно, необходимо срочно исследовать новую роль заместительной терапии для пациентов с гетерозиготными генотипами (PI*MZ, PI*MS), особенно при наличии других хронических респираторных состояний, таких как астма или бронхоэктатическая болезнь. Обоснование состоит в том, что антипротеазная активность, осуществляемая ААТ, хотя и присутствует в нормальных количествах, в конечном итоге снижается у пациентов с хроническими воспалительными заболеваниями, такими как бронхоэктатическая болезнь, из-за превосходящей воспалительной нагрузки НЭ [2]. Такое состояние может привести к функциональной недостаточности ААТ (рисунок 2). Данный факт поддерживает идею индивидуального подхода к заместительной терапии, основанной не только на генотипе пациента, но и на тщательной оценке ожидаемых преимуществ, рисков и санитарных затрат.

Рисунок 2.
Баланс протеазы/антипротеазы у здоровых людей (а), пациентов с ДААТ (b) и пациентов с бронхоэктатической болезнью (c).
Сокращения: AAT — дефицит альфа-1 антитрипсина; NE — нейтрофильная эластаза; LLN — нижний предел нормы
Применение терапии с применением ААТ для пациентов с генотипами, отличными от PI*ZZ, насчитывает десятилетия и уже изучалось при кистозном фиброзе (КФ) (муковисцидозе), генетическом системном заболевании, характеризующемся обширным нейтрофильным воспалением на поверхности эпителия легких. В 2007 году Griese et al. провели проспективное неконтролируемое исследование 4-недельного ингаляционного введения AААТ1AT группе из 52 пациентов с КФ. Основным результатом данного исследования было снижение активности НЭ, наряду с изменением содержания нейтрофилов и провоспалительных цитокинов в мокроте. Хотя результаты измерения легочной функции были противоречивы, авторы обнаружили значительное снижение уровней всех воспалительных маркеров, измеренных во время лечения [59]. Аналогичным образом, в двух других исследованиях было показано снижение активности эластазы у пациентов с КФ после ингаляционного лечения ААТ [60, 61]. Однако корреляция с клиническими исходами потребует проведения многолетних многоцентровых исследований.
Выводы
В последние годы ДААТ интерпретировали как распространенный механизм воспалительного дисбаланса и повреждения тканей как при хронических респираторных заболеваниях, так и заболеваниях вне дыхательных путей. Окончательная клиническая картина, следовательно, будет складываться из сложного и в основном неизвестного взаимодействия между наследственностью и факторами окружающей среды. Дальнейшие исследования постепенно указывают на новую парадигму, расширяя базу доказательств роли заместительной терапии с применением ААТ как мощного иммуномодулирующего и противовоспалительного препарата для состояний, отличных от эмфиземы легких (таблица 3).
Таблица 3.
Список клинических исследований последнего десятилетия, проверяющих безопасность и эффективность применения ААТ в условиях, отличных от тяжелого ДААТ (по данным Clinicaltrials.gov, последний доступ 15 июля 2018 г.)
| Название исследования | Состояние | Фаза | Дата начала | Статус |
| Пилотное исследование для подтверждения механизма действия ААТ для предупреждения острой стероид-резистентной РТПХ | РТПХ | 2 | 2018 | Набор пациентов |
| Многоцентровое исследование влияния ААТ на приживление трансплантата островковых клеток поджелудочной железы и срока его службы после трансплантации почки | Сахарный диабет первого типа | 2 | 2017 | Набор пациентов |
| Противовоспалительная терапия для улучшения исходов у пациентов с хроническим панкреатитом, перенесших тотальную панкреатэктомию | Хронический панкреатит. Сахарный диабет первого типа | 4 | 2016 | Набор пациентов |
| ААТ повышает выживаемость аутотрансплантата островковых клеток поджелудочной железы | Хронический панкреатит | 1-2 | 2016 | Набор пациентов |
| Фаза 2/3 клинического исследования для оценки безопасности и эффективности применения ААТ в качестве дополнительной биофармакотерапии по сравнению с обычным лечением стероидами пациентов с острой РТПХ при меньшем поражении желудочно-кишечного тракта | РТПХ | 2-3 | 2016 | Завершено досрочно |
| Исследование для подтверждения концепции, оценивающее безопасность и эффективность лечения ААТ человека при первой трансплантации легкого | Отторжение легкого при трансплантации | 2 | 2015 | В процессе, набор пациентов завершён |
| Улучшение показателя успеха одного донора при клинической пересадке островков с применением ААТ | Сахарный диабет первого типа | 1-2 | 2015 | В процессе, набор пациентов завершён |
| Многоцентровое рандомизированное плацебо-контролируемое исследование для оценки безопасности и эффективности применения ААТ, полученного из плазмы крови человека, для пациентов с впервые выявленным сахарным диабетом первого типа | Сахарный диабет первого типа | 2 | 2014 | Завершено досрочно |
| Однократное введение ААТ для уменьшения повреждения органов и послеоперационных кровотечений у пациентов, перенесших кардиохирургическое вмешательство с использованием аппарата искусственного кровообращения | Системная воспалительная реакция после кардиохирургии | 1-2 | 2014 | Неизвестен |
| Пилотное исследование ААТ: новый метод лечения приступов нейромиелита зрительного нерва | Нейромиелит зрительного нерва | 1 | 2014 | Неизвестен |
| Долгосрочная безопасность, переносимость и эффективность применения ААТ для лечения диабета первого типа | Сахарный диабет первого типа | 2 | 2013 | Завершено |
| Применение ААТ для подавления острого воспалительного ответа при остром инфаркте миокарда с подъемом сегмента ST | Острый инфаркт миокарда | 1-2 | 2013 | Завершено |
| Фаза 2 исследования для оценки эффективности и безопасности применения ААТ человека для лечения впервые выявленного диабета первого типа | Сахарный диабет первого типа | 2 | 2013 | Завершено |
| Влияние аэрозольной терапии проластином на плотность бактерий в дыхательных путях пациентов с КФ | Кистозный фиброз | 2 | 2013 | Завершено досрочно |
| Применение ААА для лечения пациентов с острой РТПХ | РТПХ | 1-2 | 2012 | Завершено |
| Безопасность и переносимость применения ингаляционного ААТ один раз в день для пациентов с кистозным фиброзом | Кистозный фиброз | 2 | 2012 | Завершено |
| Безопасность и эффективность применения ААТ при заболевании ВИЧ | ВИЧ-инфекция | 2-3 | 2012 | Завершено досрочно |
| Пилотное исследование применения ААТ при острой РТПХ, не поддающейся лечению стероидами | РТПХ | 2 | 2012 | В процессе, набор пациентов завершён |
| Влияние ААТ на прогрессирование диабета первого типа у пациентов с детектируемым уровнем С-пептида | Сахарный диабет первого типа | 1 | 2011 | Завершено |
| Исследование для подтверждения концепции безопасности, переносимости и эффективности внутривенного введения ААТ при диабете первого типа. | Сахарный диабет первого типа | 1-2 | 2011 | Завершено |
| Безопасность и эффективность ингаляционного введения ААТ для профилактики синдрома облитерирующего бронхиолита у реципиентов при трансплантации легких | Отторжение легкого при трансплантации | 2 | 2011 | Неизвестный |
| Исследование безопасности и переносимости ингаляционного раствора ААТ пациентами с кистозным фиброзом | Кистозный фиброз | 1 | 2011 | Завершено |
| Влияние внутривенного введения ААТ на сохранение функции бета-клеток при впервые выявленном сахарном диабете первого типа | Сахарный диабет первого типа | 2 | 2010 | Прекращено |
A1AT — альфа-1 антитрипсин, КФ — кистозный фиброз, РТПХ — реакция «трансплантат против хозяина», ВИЧ — вирус иммунодефицита человека.
Список использованной литературы
- American Thoracic Society; European Respiratory Society. American Thoracic Society/European Respiratory Society statement: standards for the diagnosis and management of individuals with alpha-1 antitrypsin deficiency. Am J Respir Crit Care Med. 2003;168(7):818–900.
- Gramegna A, Amati F, Terranova L, Sotgiu G, Tarsia P, Miglietta D, et al. Neutrophil elastase in bronchiectasis. Respir Res. 2017;18(1):211.
- Stoller JK, Aboussouan LS. A review of α1-antitrypsin deficiency. Am J Respir Crit Care Med. 2012;185(3):246–59.
- Seersholm N, Dirksen A, Kok-Jensen A. Airways obstruction and two-year survival in patients with severe alpha1 antitrypsin deficiency. Eur Respir J. 1994;7:1985–7.
- Wu MC, Eriksson S. Lung function, smoking and survival in severe alpha-1 antitrypsin deficiency, pi*ZZ. J Clin Epidemiol. 1988;41:1157–65.
- Evald T, Dirksen A, Keittelmann S, , Viskum K, Kok-Jensen A. Decline in pulmonary function in patients with alpha 1-antitrypsin deficiency. Lung 1990;168 Suppl:579–585.
- Dirksen A, Piitulainen E, Parr DG, Deng C, Wencker M, Shaker SB, et al. Exploring the role of CT densitometry: a randomised study of augmentation therapy in alpha-1 antitrypsin deficiency. Eur Respir J. 2009;33:1345–53.
- Stockley R, Parr DG, Piitulainen E, Stolk J, Stoel BC, Dirksen A, et al. Therapeutic efficacy of alpha-1 antitrypsin augmentation therapy on the loss of lung tissue: an integrated analysis of 2 randomised clinical trials using computed tomography densitometry. Respir Res. 2010;11(136).
- Chapman KR, Burdon JG, Piitulainen E, Sandhaus RA, Seersholm N, Stocks JM, et al. Intravenous augmentation treatment and lung density in severe α1 antitrypsin deficiency (RAPID): a randomised, double-blind, placebo-controlled trial. Lancet. 2015;386:360–8.
- Miravitlles M, Dirksen A, Ferrarotti I, Koblizek V, Lange P, Mahadeva R, et al. European Respiratory Society statement: diagnosis and treatment of pulmonary disease in α1-antitrypsin deficiency. Eur Respir J. 2017;50:1700610.
- Silverman EK, Sandhaus RA. Clinical practice. Alpha1-antitrypsin deficiency. N Engl J Med. 2009;360(26):2749–57.
- Gishen P, Saunders AJ, Tobin MJ, Hutchison DC. Alpha 1-antitrypsin deficiency: the radiological features of pulmonary emphysema in subjects of pi type Z and pi type SZ: a survey by the British thoracic association. Clin Radiol. 1982;33(4):371–7.
- Demeo DL, Sandhaus RA, Barker AF, Brantly ML, Eden E, McElvaney NG, et al. Determinants of airflow obstruction in severe alpha-1-antitrypsin deficiency. Thorax. 2007;62(9):806–13.
- Calabrò A, Torricelli E, Rosi E, et al. Idiopathic pulmonary fibrosis associated with ALpha-1 antitrypsin deficiency: concomitant finding or real association? SM J Case Rep. 2017;3(8):1075.
- Cottin V, Nunes H, Brillet PY, Delaval P, Devouassoux G, Tillie-Leblond I, et al. Combined pulmonary fibrosis and emphysema: a distinct underrecognised entity. Eur Respir J. 2005;4:586–93.
- Siri D, Farah H, Hogarth DK. Distinguishing alpha1-antitrypsin deficiency from asthma. Ann Allergy Asthma Immunol. 2013;111(6):458–64.
- Makino S, Chosy L, Valdivia E, Reed CE. Emphysema with hereditary alpha-1 antitrypsin deficiency masquerading as asthma. J Allergy. 1970l;46(1):40–8.
- Black LF, Hyatt RE, Stubbs SE. Mechanism of expiratory airflow limitation in chronic obstructive pulmonary disease associated with 1 -antitrypsin deficiency. Am Rev Respir Dis. 1972;105(6):891–9.
- Tobin MJ, Cook PJL, Hutchison DCS. Alpha1- antitrypsin deficiency: the clinical and physiological features of pulmonary emphysema in subjects homozygous for pi type Z. Br J Dis Chest. 1983;77:14–27 34.
- Janus ED, Phillips NT, Carrell RW. Smoking lung function, and alpha-i-antitrypsin deficiency. Lancet. 1985;1:152–4.
- Larsson C. Natural history and life expectancy in severe alpha,-antitrypsin deficiency. PiZ Acta Med Scand. 1978;204:345–51.
- Eriksson S. Studies in alpha-i-antitrypsin deficiency. Acta Med Scand. 1965;177:1–85.
- McElvaney NG, Stoller JK, Buist AS, Prakash UB, Brantly ML, Schluchter MD, et al. Baseline characteristics of enrollees in the National Heart, lung and blood institute registry of alpha 1-antitrypsin deficiency. Alpha 1-antitrypsin deficiency registry study group. Chest. 1997;111(2):394–403.
- [No authors listed]. Survival and FEV1 decline in individuals with severe deficiency of alpha1-antitrypsin. The Alpha-1-Antitrypsin Deficiency Registry Study Group. Am J Respir Crit Care Med. 1998;158(1):49–59.
- [No authors listed]. Alpha 1-antitrypsin deficiency: memorandum from a WHO meeting. Bull World Health Organ 1997;75(5):397–415.
- Kelbel T, Morris D, Walker D, Henao MP, Craig T. The Allergist’s role in detection of severe Alpha-1 antitrypsin deficiency. J Allergy Clin Immunol Pract. 2017;5(5):1302–6.
- Miravitlles M, Vilà S, Torrella M, Balcells E, Rodríguez-Frías F, de la Roza C, et al. Influence of deficient alpha1-anti-trypsin phenotypes on clinical characteristics and severity of asthma in adults. Respir Med. 2002;96(3):186–92.
- Eden E. Asthma and COPD in alpha-1 antitrypsin deficiency. Evidence for the Dutch hypothesis COPD. 2010;7(5):366–74.
- Cosio MG, Bazzan E, Rigobello C, Tinè M, Turato G, Baraldo S, et al. Alpha-1 antitrypsin deficiency: beyond the protease/Antiprotease paradigm. Ann Am Thorac Soc. 2016;13(Suppl 4):S305–10.
- Dowson LJ, Guest PJ, Stockley RA. Longitudinal changes in physiological, radiological, and health status measurements in alpha(1)-antitrypsin deficiency and factors associated with decline. Am J Respir Crit Care Med. 2001;164(10 Pt 1):1805–9.
- Fallat RJ. Reactive airways disease and alpha-1 antitrypsin deficiency. In: Crystal RG, editor. Alpha 1-antitrypsin deficiency: biology, pathogenesis, clinical manifestations, therapy. New York: Marcel Dekker; 1996. p. 259–79.
- Stockley RA. The multiple facets of alpha-1-antitrypsin. Ann Transl Med. 2015;3(10):130.
- Parr DG, Guest PG, Reynolds JH, Dowson LJ, Stockley RA. Prevalence and impact of bronchiectasis in alpha-1 antitrypsin deficiency. Am J Respir Crit Care Med. 2007;176:1215–21.
- Greulich T, Nell C, Herr C, Vogelmeier C, Kotke V, Wiedmann S, et al. Results from a large targeted screening program for alpha-1-antitrypsin deficiency: 2003–2015. Orphanet J Rare Dis. 2016;11(1):75.
- Strange C. Airway disease in alpha-1 antitrypsin deficiency. COPD. 2013;10(Suppl 1):68–73.
- Aggarwal N, Delgado BM, Salipalli S, Matamala N, Rademacher J, Schwerk N,, et al. Why do some adults with PiMZ α1-antitrypsin develop bronchiectasis? [corrected]. ERJ Open Res. 2016;2(2).Go
- Lonni S, Chalmers JD, Goeminne PC, McDonnell MJ, Dimakou K, De Soyza A, et al. Etiology of non-cystic fibrosis bronchiectasis in adults and its correlation to disease severity. Ann Am Thorac Soc. 2015;12(12):1764–70.
- Gao YH, Guan WJ, Liu SX, Wang L, Cui JJ, Chen RC, et al. Aetiology of bronchiectasis in adults: a systematic literature review. Respirology. 2016;21(8):1376–83.
- Chalmers JD, Aliberti S, Polverino E, Vendrell M, Crichton M, Loebinger M, et al. The EMBARC European bronchiectasis registry: protocol for an international observational study. ERJ Open Research. 2016;2(1):00081–2015.
- Rademacher J, de Roux A, Ringshausen FC. PROGNOSIS - the PROspective German NOn-CF BronchiectaSIS patient registry. Pneumologie. 2015;69(7):391–3.
- Aliberti S, Hill AT, Mantero M, Battaglia S, Centanni S, Lo Cicero S, et al. SIP bronchiectasis audit working group. Quality standards for the management of bronchiectasis in Italy: a national audit. Eur Respir J. 2016;48(1):244–8.
- Blasi F, Chalmers J, Aliberti S. COPD and bronchiectasis: phenotype, Endotype or co-morbidity? COPD. 2014;6:603–4.
- Faverio P, Stainer A, Bonaiti G, Zucchetti SC, Simonetta E, Lapadula G, et al. Characterizing Non-Tuberculous Mycobacteria Infection in Bronchiectasis. Int J Mol Sci. 2016;17(11).
- Mirsaeidi M, Farshidpour M, Ebrahimi G, Aliberti S, Falkinham JO 3rd. Management of nontuberculous mycobacterial infection in the elderly. Eur J Intern Med. 2014;25(4):356–63.
- Bonaiti G, Pesci A, Marruchella A, Lapadula G, Gori A, Aliberti S. Nontuberculous mycobacteria in noncystic fibrosis bronchiectasis. Biomed Res Int. 2015;2015:197950.
- Chan ED, Kaminska AM, Gill W, Chmura K, Feldman NE, Bai X, et al. Alpha-1-antitrypsin (AAT) anomalies are associated with lung disease due to rapidly growing mycobacteria and AAT inhibits Mycobacterium abscessus infection of macrophages. Scand J Infect Dis. 2007;39(8):690–6.
- Carroll TP, O’Connor CA, Floyd O, McPartlin J, Kelleher DP, O'Brien G, et al. The prevalence of alpha-1 antitrypsin deficiency in Ireland. Respir Res. 2011;12:91.
- Kaczor MP, Sanak M, Libura-Twardowska M, Szczeklik A. The prevalence of alpha1-antitrypsin deficiency in a representative population sample from Poland. Respir Med. 2007;101:2520–5.
- Global strategy for prevention, diagnosis and management of COPD, 2018 report; goldcopd.org
- Global strategy for asthma management and prevention, 2018 update; ginasthma.org
- Pasteur MC, Bilton D. Hill AT on behalf of the British Thoracic Society bronchiectasis (non-CF) guideline group British Thoracic Society guideline for non-CF bronchiectasis. Thorax. 2010;65:i1–i58.
- Vendrell M, de Gracia J, Olveira C, Martínez MA, Girón R, Máiz L, et al. Diagnosis and treatment of bronchiectasis. Spanish Society of Pneumology and Thoracic Surgery. Arch Bronconeumol. 2008;44(11):629–40.
- Pulmonology Portuguese Society Bronchiectasis Study Group. Recommendations for aetiological diagnosis of bronchiectasis. Rev Port Pneumol (2006). 2016;22(4):222–35.
- Polverino E, Goeminne PC, McDonnell MJ, Aliberti S, Marshall SE, Loebinger MR, et al. European Respiratory Society guidelines for the management of adult bronchiectasis. Eur Respir J. 2017;50:1700629.
- Blanco I, Bueno P, Diego I, Pérez-Holanda S, Casas-Maldonado F, Esquinas C, et al. Alpha-1 antitrypsin pi*Z gene frequency and pi*ZZ genotype numbers worldwide: an update. Int J Chron Obstruct Pulmon Dis. 2017;12:561–9.
- Hatipoğlu U, Stoller JK. α1-antitrypsin deficiency. Clin Chest Med. 2016;37(3):487–504.
- Teschler H. Long-term experience in the treatment of α1-antitrypsin deficiency: 25 years of augmentation therapy. Eur Respir Rev. 2015;24(135):46–51.
- Stockley RA, Miravitlles M, Vogelmeier C, Alpha One International Registry (A.I.R.). Augmentation therapy for alpha-1 antitrypsin deficiency: towards a personalised approach. Orphanet Journal of Rare Disease. 2013;8:149.
- Griese M, Latzin P, Kappler M, Weckerle K, Heinzlmaier T, Bernhardt T, et al. O1-antitrypsin inhalation reduces airway inflammation in cystic fibrosis patients. Eur Respir J. 2007;29:240–50.
- McElvaney N, Hubbard R, Birrer P, Chernick MS, Caplan DB, Frank MM, et al. Aerosol alpha-1 antitrypsin treatment for cystic fibrosis. Lancet. 1991;337:392–4.
- Martin SL, Downey D, Bilton D, Keogan MT, Edgar J, Elborn JS, et al. Safety and efficacy of recombinant alpha(1)-antitrypsin therapy in cystic fibrosis. Pediatric Pulmonol. 2006;41:177–83.
- Chang AB, Bell SC, Torzillo PJ, King PT, Maguire GP, Byrnes CA, et al. Chronic suppurative lung disease and bronchiectasis in children and adults in Australia and new Zealand Thoracic Society of Australia and new Zealand guidelines. Med J Aust. 2015;202(3):130.





