10009
23 Августа 2021
Авторское право © 2019, Makiko Seki, Masaru Nakayama, Teppei Sakoh, Ryota Yoshitomi, Akiko Fukui, Eisuke Katafuchi, Susumu Tsuda, Toshiaki Nakano, Kazuhiko Tsuruya, Takanari Kitazono (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Макико Секи, Масару Накаяма, Теппей Сако, Рёта Ёситоми, Акико Фукуи, Эйсукэ Катафути, Сусуму Цуда, Тосиаки Накано, Кадзухико Цуруя, Таканари Китазоно...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Макико Секи, Масару Накаяма, Теппей Сако, Рёта Ёситоми, Акико Фукуи, Эйсукэ Катафути, Сусуму Цуда, Тосиаки Накано, Кадзухико Цуруя, Таканари Китазоно...
Авторское право © 2019, Makiko Seki, Masaru Nakayama, Teppei Sakoh, Ryota Yoshitomi, Akiko Fukui, Eisuke Katafuchi, Susumu Tsuda, Toshiaki Nakano, Kazuhiko Tsuruya, Takanari Kitazono (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Макико Секи, Масару Накаяма, Теппей Сако, Рёта Ёситоми, Акико Фукуи, Эйсукэ Катафути, Сусуму Цуда, Тосиаки Накано, Кадзухико Цуруя, Таканари Китазоно
Аннотация
Введение
Азот мочевины крови (АМК (BUN, blood urea nitrogen)) – одно из веществ, определяющих осмоляльность сыворотки крови (cSosm). Одно из предыдущих исследований показало, что АМК и cSosm по-отдельности связаны с развитием хронической болезни почек (ХБП) у пациентов с сохраняющейся почечной функцией. На более поздних стадиях ХБП наблюдается одновременное увеличение осмоляльности и уровня азота. Однако пока непонятно, связаны ли эти показатели с ренальными исходами у пациентов со средней и тяжелой степенью дисфункции почек. Целью данного исследования являлось выяснить, существует ли взаимосвязь между уровнем АМК или cSosm и прогрессированием заболевания у пациентов на поздних стадиях ХБП.
Методы
В данном ретроспективном исследовании участвовало 459 пациентов, страдавших ХБП (стадии 3-5). Комбинированной конечной точкой являлись терминальная стадия почечной недостаточности (ТСПН) или смерть пациента; только ТСПН рассматривали как альтернативный исход. Для оценки факторов риска неблагоприятного исхода использовалась модель пропорциональных рисков Кокса. Были внесены поправки для более точной оценки ковариант, включая расчетную скорость клубочковой фильтрации (рСКФ). Значение cSosm (мОсм/кг) вычисляли по формуле:
(2 × натрий) + (АМК/2,8) + (глюкоза/18).
Результаты
По окончании периода наблюдения, длившегося в среднем 25,8 месяцев, достижение конечных точек почечных показателей наблюдали у 210 пациентов. Мультивариантная регрессионная модель Кокса определила отношения рисков (ОР) (HR) [95% доверительный интервал (ДИ)] наступления комбинированного ренального исхода во втором, третьем и четвертом квартилях значений уровня АМК, в которых значение ОР составило 1,36 (0,72–2,58), 1,87 (0,95–3,66), и 2,66 (1,23–5,76) (P для тенденции < 0,01) соответственно, по сравнению с первым квартилем значений уровня АМК. И наоборот, в расчете на неблагоприятный исход по этой модели, значение ОР (95% ДИ) во втором, третьем и четвертом квартилях значений уровня cSosm, по сравнению с первым квартилем, составило 1,13 (0,69–1,87), 0,95 (0,58–1,55), и 1,26 (0,78–2,03) соответственно (P для тенденции = 0,39). К тому же, что касается исхода, при котором наблюдается исключительно ТСПН, высокие квартильные показатели уровня АМК отражали значительный риск такого исхода, при этом значения уровня cSosm с данным исходом ассоциированы не были.
Вывод
Высокий уровень мочевины и низкая осмоляльность были ассоциированы с неблагоприятными исходами, независимо от скорости клубочковой фильтрации (eGFR), то есть уровень АМК может быть использован в качестве предиктора прогрессирования почечных заболеваний.
Введение
Мочевина – первичный метаболит, образующийся в результате обмена белка, поступающего с пищей и белков из тканей организма. Она хорошо отфильтровывается в почечных клубочках, но не секретируется, а реабсорбируется почечными канальцами [1]. Азот мочевины крови (АМК) отражает содержание азотного компонент мочевины в сыворотке крови. Уровень АМК обратно пропорционален ухудшению функции почек [2], на него могут влиять внепочечные факторы, такие как потребление белков, желудочные и кишечные кровотечения, различные катаболические состояния, недостаточное питание, сердечная недостаточность, обезвоживание, прием глюкокортикоидов, а также синтез мочевины в печени [3].
В обычных физиологических условиях мочевина расщепляется до цианата, который быстро преобразуется в изоцианат. Изоцианат представляет собой химически активный электрофил, для которого характерна высокая аффинность к нуклеофильным группам, например, первичным аминам [4]. Карбамиляция признана спонтанной посттрансляционной модификацией аминокислот и белков при участии цианата, ведущих к биохимическим изменениям. Также было показано, что мочевина способна оказывать как прямое токсическое действие на различные ткани, такие как кишечный эпителий, стенки сосудов, бета-клетки поджелудочной железы и адипоциты, так и непрямое – путем карбамиляции [5, 6]. Следует отметить, что уровень АМК коррелирует с летальностью пациентов, страдающих сердечной недостаточностью [7, 8].
Экспериментальные исследования показали, что выделение вазопрессина и активация альдозоредуктазного-фруктокиназного пути, вызванные повышением осмоляльности сыворотки, могут быть ассоциированы с повреждением почечной ткани [9, 10]. АМК является одним из соединений, которые влияют на измеряемые уровни осмоляльности сыворотки (cSosm). Поэтому у пациентов с последними стадиями хронической болезни почек (ХБП) наблюдается одновременный рост уровней cSosm и АМК. Кроме того, недавнее исследование показало, что высокие уровни АМК и cSosm независимо связаны с развитием ХБП, определяемой как снижение расчетной скорости клубочковой фильтрации (рСКФ) до < 60 мл/мин./1,73 м2 у пациентов с сохраняющейся почечной функцией (средняя скорость – 86,7 мл/мин./1,73 м2) [11]. Однако пока нет ответа на вопрос, являются ли повышенные уровни АМК и cSosm факторами риска прогрессирования заболевания для пациентов со средней и тяжелой формами ХБП. Таким образом, главная цель исследования – определить, существует ли взаимосвязь между уровнем АМК или cSosm с неблагоприятными ренальными исходами у пациентов с ХБП (3-5-я стадия) вне зависимости от значений рСКФ. Кроме того, одно из предыдущих исследований показало, что рСКФ и уровень креатинина в сыворотке крови были ассоциированы с прогрессированием заболевания почек у пациентов с ХБП [12]. Таким образом, мы также определяли, существует ли связь между уровнем АМК и прогрессированием ХБП вне зависимости от другого маркера функции почек – уровня креатинина в сыворотке крови.
Методы
Пациенты и дизайн исследования
С июня 2009 по декабрь 2017 года 682 японских пациента с ХБП 3-5-й стадии в разное время поступили в Государственное учреждение здравоохранения Медицинский центр префектуры Кюсю для прохождения обследования по вопросам ХБП. На рисунке 1 изображена схема процесса набора пациентов для исследования. Чтобы минимизировать влияние экстраренальных факторов на уровень АМК, пациенты, принимавшие кортикостероиды в дозах более 5 мг/сут., или пациенты с язвенной болезнью желудка в стадии обострения или с геморрагическим гастритом, циррозом печени либо с показателями фракции выброса левого желудочка менее 40%, были исключены из исследования. Было обследовано 459 пациентов. После выписки было продолжено плановое наблюдение пациентов на базе нашей клиники в течение шести месяцев. Сбор данных продолжался вплоть до июля 2018 года. Комбинированная конечная точка почечных показателей представляла собой развитие терминальной стадии хронической почечной недостаточности (ТСПН) или смерть, в зависимости от того, какое из этих двух событий наступало первым; также в качестве альтернативного исхода было введено наступление только ТСПН. ТСПН определяли как нарушение функции почек, требовавшее проведения заместительной терапии, например поддерживающего гемодиализа либо перитонеального диализа, либо пересадки почки. В случаях, когда пациенты демонстрировали постепенное ухудшение во время наблюдения и нуждались в заместительной почечной терапии, у них диагностировали ТСПН и им назначали заместительную терапию. Период до наступления ТСПН определяли как отрезок времени от первичного обследования до дня проведения первой процедуры диализа либо процедуры пересадки почки. Иногда смерть наступала раньше ТСПН. Информация, касающаяся смерти пациентов, и порядок цензурирования пациентов описаны в нашей предыдущей публикации [13]. Всего было цензурировано 69 пациентов; с 63 пациентами был утрачен контакт для последующего наблюдения, шестерым требовался поддерживающий гемодиализ из-за резкого ухудшения функции почек, вызванного инфекционными заболеваниями или застойной сердечной недостаточностью. В итоге, до июля 2018 года полностью прошли наблюдение 390 пациентов.
 Рисунок 1. Схема включения пациентов в исследование
Рисунок 1. Схема включения пациентов в исследование
ХБП – хроническая болезнь почек; рСКФ – расчетная скорость клубочковой фильтрации; ФВЛЖ – фракция выброса левого желудочка.
Клинические и биохимические оценки
Забор крови проводили у каждого пациента ранним утром, натощак (голодание в течение ночи). Также измеряли дневные показатели протеинурии. Значение рСКФ (мл/мин./1,73м2) рассчитывали по новому уравнению, разработанному для японских пациентов: 194 × уровень сывороточного креатинина− 1.094 × возраст− 0.287 × 0.739 (для женщин) [14]. Осмоляльность (мОсм/кг) вычисляли по формуле: (2 × натрий) + (АМК/2,8) + (глюкоза/18) [15].
Клинические обследования при поступлении и определение гипертензии, сахарного диабета, курения и дислипидемии описаны в предыдущей работе [13]. Для оценки диаметра левого предсердия и фракции выброса левого желудочка было проведено эхокардиографическое исследование.
Статистический анализ
Данные, полученные в течение длительных периодов, выражены в виде среднего значения ± SD (standart deviation, среднеквадратическое отклонение) или медианы (интерквартильный размах), в зависимости от разброса. Значения уровней АМК участников были разделены на квартили. Категориальные данные сравнивали по квартилям значений АМК с применением критерия хи-квадрат, а также критерий Фишера для групп, насчитывавших менее пяти участников в каждой ячейке. Дисперсионный анализ (ANOVA) применяли для сравнения непрерывных переменных с приблизительно нормальным распределением; а также применяли критерий Караскела-Уоллеса для сравнения непрерывных переменных с асимметричным распределением. Значения ровней cSosm участников также были распределены по квартилям. Для выявления связи между двумя непрерывными переменными применяли коэффициент ранговой корреляции Спирмена.
Модель пропорциональных рисков Кокса применяли для определения наличия связи cSosm или АМК с ренальными исходами. Модели Кокса также применяли для оценки взаимосвязи между высшим квартилем значений каждой переменной по ренальными исходам и низшим квартилем в качестве категории для сравнения. Для каждой переменной рассчитывали отношение рисков (ОР) и доверительный интервал в 95% (ДИ). Также, проводили стратификационный анализ для вычисления уточненных ОР наступления комбинированных ренальных исходов при увеличении уровня АМК на каждые 10 мг/дл в подгруппах, распределенных по исходным показателям. Для качественной оценки любых нелинейных связей между комбинированными ренальными исходами и уровнями АМК с поправкой на возраст, пол, заболевание сахарным диабетом, курение, показатели дислипидемии, систолическое кровяное давление, прием иммуносупрессантов и диуретиков, индекс массы тела, уровень С-реактивного белка, показатели дневной протеинурии, гемоглобин, рСКФ, сывороточный уровень фосфора и альбумина применяли интерполяцию кубическими сплайнами. В качестве узловых точек были выбраны 5-й, 35-й, 65-й и 95-й процентили уровня АМК, медианное значение АМК (18 мг/дл) в группе сравнения (первый квартиль) был выбран в качестве референса для построения графиков сплайнов. Кривые выживаемости строили с применением метода Каплана-Мейера и оценивали с применением логрангового критерия. Коллинеарность ковариат вычисляли путем измерения фактора увеличения дисперсии (ФУВ) и значения допуска по всем ковариатам. Также была исследована взаимосвязь между уровнем cSosm и исходами путем поочередного исключения каждой переменной в порядке убывания ФУВ. Все статистические анализы проводились с использованием программного обеспечения STATA ver. 14 (Stata Corp., College Station, TX, USA). Значения P < 0,05 считали указывающими на статистическую значимость.
Результат
В Таблице 1 приведены исходные клинические показатели пациентов, согласно квартилям значений уровня АМК. Значение медианы возраста 459 пациентов составило 72,6 лет (диапазон от 30 до 94 лет). Значение медианы рСКФ для всех пациентов составило 22,6 мл/мин./1,73 м2 (от 8,1 до 59,3 мл/мин./1,73 м2). Из 459 пациентов 161 (35%), 178 (39%) и 120 (26%) были классифицированы как страдающие от ХБП 2-й, 4-й и 5-й стадии соответственно. Основными причинами развития заболевания почек были хронический гломерулонефрит (21%, 95 пациентов), гипертонический нефросклероз (35%, 161 пациент), диабетическая нефропатия (27%, 124 пациента), другие факторы (15%, 68 пациентов), а также неизвестные причины (2%, 11 пациентов). Число пациентов, принимающих диуретики и AST-120, возрастало в верхних квартилях значений уровня АМК. AST-120, представляющий собой пероральный кишечный сферический угольный адсорбент, согласно имеющейся информации, снижает сывороточный уровень индоксил-сульфата и замедляет угасание функции почек [16]. На фоне возрастания уровня АМК отмечалось повышение дневной протеинурии и уровня фосфора в крови, а также снижение уровня гемоглобина и рСКФ. При повышении уровня АМК также возрастали и уровни cSosm. Отмечены статистически значимые отличия величины диаметра левого предсердия в квартилях значений уровня АМК, при этом значимых изменений ВФЛЖ не наблюдалось. Кроме того, значения cSosm прямо коррелировали с уровнем АМК (r = 0,657, P < 0,01) и содержанием натрия в сыворотке (r = 0,541, P < 0,01), но не коррелировали с уровнем глюкозы в крови натощак (r = 0,008, P = 0,87).
Таблица 1. Исходные клинические показатели пациентов в соответствии с квартилями значений уровня АМК
Средняя продолжительность периода наблюдения составила 25,8 месяцев (от 1,2 до 95,8 месяцев). К концу наблюдения 210 пациентов достигли комбинированной конечной точки почечных показателей, 35 пациентов скончались до наступления ТСПН. Причинами смерти стали инфекционные заболевания (в 9 случаях), синдром внезапной смерти (в 7 случаях), уремия (в 5 случаях), злокачественные новообразования (в 4 случаях), болезни сердца (в 5 случаях), другие заболевания (в 5 случаях) и неустановленные факторы (в 2 случаях).
Анализ методом Каплана-Мейера показал высокую частоту симптомов почечных событий в верхних квартилях значений уровней АМК (Рисунок 2). В Таблице 2 приведены значения ОР наступления комбинированных ренальных исходов в соответствии с квартилями значений уровней АМК и cSosm. В мультивариантной модели (3) в более высоких квартилях значений уровня АМК риск наступления неблагоприятного ренального исхода был существенно выше по сравнению с самыми низкими квартилями. Напротив, в самых высоких квартилях значений уровней cSosm в Модели 3 не было выявлено значимого увеличения риска наступления неблагоприятных ренальных исходов в сравнении с самыми низкими квартилями значений уровней сSosm. Сплайн-анализ взаимосвязи между АМК и риском наступления неблагоприятных ренальных исходов показывает, что с увеличением уровня АМК непрерывно возрастала вероятность наступления таких исходов (Рисунок 3).
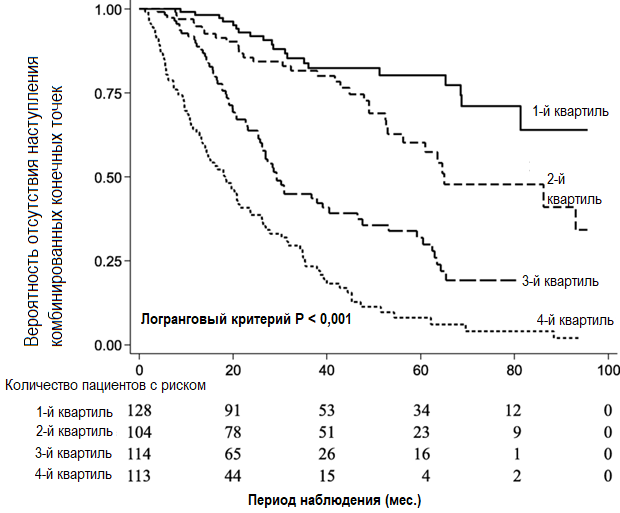 Рисунок 2. Кривые Каплана-Майера, отражающие отсутствие наступления неблагоприятных ренальных исходов у пациентов, распределенных по группам в соответствии с квартилями значений уровней АМК. Сравнение проведено с применением логрангового теста. АМК – азот мочевины крови.
Рисунок 2. Кривые Каплана-Майера, отражающие отсутствие наступления неблагоприятных ренальных исходов у пациентов, распределенных по группам в соответствии с квартилями значений уровней АМК. Сравнение проведено с применением логрангового теста. АМК – азот мочевины крови.
Таблица 2. Отношения рисков наступления комбинированных конечных точек (наступление ТСПН или смерти), ассоциированных с уровнями АМК или cSosm
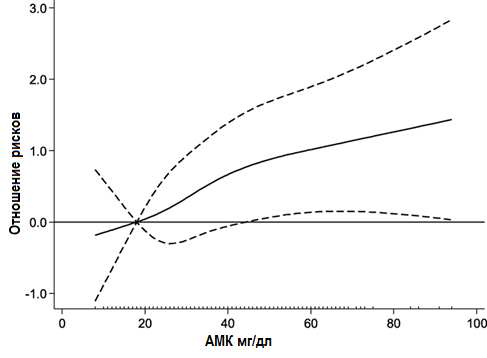 Рисунок 3. Отношение рисков для наступления комбинированных ренальных исходов в зависимости от уровня АМК. Сплошная линия отражает отношение рисков, пунктирные – доверительный интервал (95%). АМК – азот мочевины крови.
Рисунок 3. Отношение рисков для наступления комбинированных ренальных исходов в зависимости от уровня АМК. Сплошная линия отражает отношение рисков, пунктирные – доверительный интервал (95%). АМК – азот мочевины крови.
На рисунке 4 обобщены данные по скорректированным отношениям рисков в подгруппах, разделенных в соответствии с демографическими и клиническими характеристиками. У всех пациентов повышение уровня АМК на каждые 10 мг/дл было ассоциировано с увеличением риска наступления неблагоприятных комбинированных ренальных исходов (ОР 1,23; 95% ДИ, 1,04-1,45). У мужчин повышенный уровень АМК был ассоциирован со значительным риском наступления неблагоприятных комбинированных ренальных исходов. У пациентов с более высокими значениями рСКФ и уровня протеинурии и более низким значением уровня альбумина в сыворотке риск наступления неблагоприятных ренальных исходов значимо возрастал по мере увеличения уровня АМК. Кроме того, у пациентов, принимавших диуретики, на фоне повышения уровня АМК был выявлен повышенный риск наступления неблагоприятных ренальных исходов. Значимых взаимосвязей для ренальных исходов между уровнем АМК и другими базовыми клиническими характеристиками, за исключением применения диуретиков (P =0,02), обнаружено не было (P для взаимодействия 0,06–0,88).
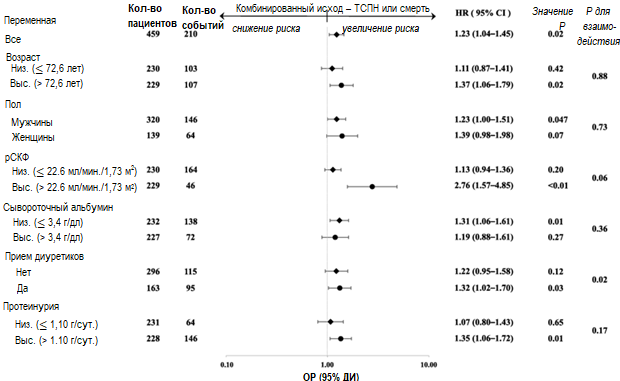 Рисунок 4. Значения скорректированных отношений рисков и доверительных интервалов (95%) наступления комбинированных ренальных исходов при увеличении уровня АМК на каждые 10 мг/дл в подгруппах, разделенных по значениям исходных показателей. Корректировки проводили по тем же ковариатам, что и для Модели 3 в Таблице 2
Рисунок 4. Значения скорректированных отношений рисков и доверительных интервалов (95%) наступления комбинированных ренальных исходов при увеличении уровня АМК на каждые 10 мг/дл в подгруппах, разделенных по значениям исходных показателей. Корректировки проводили по тем же ковариатам, что и для Модели 3 в Таблице 2
ТСПН – терминальная стадия почечной недостаточности; АМК – азот мочевины крови; рСКФ – расчетная скорость клубочковой фильтрации.
Также была исследована связь между уровнями АМКи cSosm и прогрессированием болезни до наступления ТСПН (почечные события, n = 173) (Таблица 3). В полностью скорректированной модели (Модель 3) в сравнении с первым квартилем значений уровня АМК в четвертом квартиле значений уровня АМК было выявлено значительное повышение риска наступления комбинированного исхода, в то время как для высоких квартилей значений уровня cSosm не было выявлено значимого повышения риска наступления таких исходов.
Таблица 3. Отношения рисков наступления ТСПН, ассоциированной с уровнями АМК и cSosm
При проведении анализов исключение трех переменных (дневная протеинурия, уровень альбумина в сыворотке и уровень гемоглобина) не выявило взаимосвязи между наступлением исходов и более высокими уровнями cSosm. Значимая взаимосвязь была обнаружена после четвертой переменной (значение рСКФ).
Анализ чувствительности
Для оценки объективности полученных данных, представленных в Таблице 2, был проведен анализ чувствительности; его результаты приведены в Таблице 4. В мультивариантную модель в качестве одной из ковариат вместо значения рСКФ мы ввели значение уровня креатинина в сыворотке. Более высокие квартили значений уровня АМК, в отличие от квартилей значений уровня cSosm, были независимо ассоциированы с комбинированными неблагоприятными ренальными исходами. Эти данные аналогичны данным, приведенным в Таблице 2.
Таблица 4. Отношения рисков наступления комбинированных исходов (ТСПН или смерть), ассоциированных с уровнями АМК и cSosm (анализ чувствительности)
Обсуждение
В настоящем исследовании было показано, что высокий уровень АМК в крови ассоциирован с неблагоприятными ренальными исходами, независимо от показателя рСКФ, у пациентов со средней и тяжелой формами ХПН. Недавние исследования подтвердили, что уровни и АМК, и cSosm являются независимыми факторами риска возникновения ХБП у пациентов с сохраненной функцией почек [11]. В данном исследовании многофакторный регрессионный анализ Кокса (Модель 3) не выявил значимой взаимосвязи между уровнями cSosm и наступлением неблагоприятных ренальных исходов. Полученные данные позволяют предположить, что абсолютный уровень АМК в большей степени, чем уровни cSosm, обладает прогностической силой в отношении прогрессирования заболевания почек. И наоборот, в исследованной нами когорте высокие уровни АМК были значимо связаны с наступлением неблагоприятных исходов среди пациентов с более высокими (в отличие от группы с более низкими показателями) значениями рСКФ, хотя значимой связи для наступления неблагоприятных ренальных исходов между уровнями АМК и рСКФ обнаружено не было (Рисунок 4). Полученные данные могут предполагать, что влияние уровня АМК на прогрессирование ХБП более выражено на ранних стадиях заболевания.
Также, был проведен анализ чувствительности (Таблица 4). Его результаты схожи с результатами, представленными в Таблице 2. Эти данные подтверждают устойчивость полученных нами результатов. Таким образом, уровень АМК может быть связан с наступлением ренальных исходов независимо от состояния функции почек.
Природа патофизиологического механизма, обуславливающего зависимость неблагоприятных ренальных исходов от уровня АМК, на данный момент остается невыясненной. Однако было рассмотрено несколько гипотез относительно этой взаимосвязи. На фоне ХБП снижение почечной функции, характеризующееся хроническим повышением уровня АМК , представляет собой патологическое состояние, которое способствует образованию изоцианата [17]. Было отмечено, что по сравнению со здоровыми людьми, у которых уровень цианата в крови не превышал 45 нмоль/л, у пациентов с ХБП, еще не прошедших процедуру диализа, он достигал 141 нмоль/л [18]. Соответственно, по мере снижения функции почек, сопровождающегося накоплением мочевины в организме, усиливается процесс карбамилирования белков. Согласно Berg et al., концентрация карбамилированного альбумина в крови пациентов с ХБП (3-й и 4-й стадии) и ТСПН примерно в 2 раза выше, чем у неуремических пациентов. Кроме того, положительная корреляция между уровнями АМК и карбамилированного альбумина была более выражена у пациентов с ХБП, которые не проходили диализ, чем у людей с ТСПН. На основании этих данных можно предположить, что «гиперкарбамилирование» наблюдается на всех стадиях ХБП как до начала гемодиализа, так и после него [19]. Кроме того, сообщалось, что уровень карбамилированных белков связан с показателями смертности от всех причин, а также от сердечно-сосудистых заболеваний среди пациентов с ТСПН [19, 20, 21]. Следует отметить, что, как сообщается, карбамилированные белки вызывают повреждения клеток почечных канальцев и перитубулярный фиброз в почках амфибий [22], усиливать пролиферацию мезангиальных клеток, а также синтез в них коллагенов I и IV типов [23]. К сожалению, в ходе данного исследования не было возможности оценить содержание карбамилированных белков. Тем не менее, на основе приведенных данных можно предположить, что риск наступления неблагоприятных ренальных исходов, связанных с повышенным уровнем АМК, в настоящем исследовании может быть обусловлен опосредованным токсическим действием мочевины через карбамилирование.
Установлено, что концентрации мочевины, типичные для ХБП, непосредственно повышают уровень активных форм кислорода (АФК) и окислительного стресса в адипоцитах [24], бета-клетках поджелудочной железы и клетках эндотелия аорты [26]. D’Apolito et al. продемонстрировали, что продукция АФК в адипоцитах, индуцируемая мочевиной, приводит к возникновению инсулинорезистентности [24]. По данным Koppe et al., мочевина усиливает окислительный стресс и способствует ацилированию О-связанного N-глюкозамина белков, приводя к возникновению нарушений секреции инсулина [25]. В ходе недавнего масштабного когортного исследования было установлено, что повышенные уровни АМК были связаны с увеличением риска развития сахарного диабета; ОР (95% ДИ) наступления неблагоприятных исходов у пациентов с уровнем АМК более 25 мг/дл составило 1,23 (1,21–1,25) по сравнению пациентами, у которых уровень АМК в крови не превышал 25 мг/дл [27]. Эти данные могут служить подтверждением результатов, полученных D’Apolito et al. [24] и Koppe et al. [25] в ходе экспериментов. Кроме того, окислительный стресс постоянно усиливается, коррелируя с нарушением функции почек у пациентов с ХБП [28, 29]. Предыдущие исследования предполагают, что окислительный стресс может быть связан с патогенезом и прогрессированием заболеваний почек. Уровень 8-гидроксидеоксигуанозина в моче предположительно может служить маркером для прогнозирования развития диабетической нефропатии у пациентов с диабетом [30].Также было высказано предположение, что в патогенезе гломерулонефрита может играть важную роль малондиальдегид [31] и что конечные продукты окисления белков связаны с патогенезом и развитием IgA-нефропатии [32]. Однако остается невыясненным, способствует ли индуцируемый мочевиной окислительный стресс развитию болезни почек непосредственно.
Образование мочевины прямо пропорционально ежедневному употреблению белка, поэтому ограничение поступления белка с пищей ведет к снижению продукции мочевины [33]. Проведено большое количество исследований эффективности тактики ограничения потребления белка на фоне прогрессирования болезней почек. Однако результаты были неоднозначными. Крупнейшее рандомизированное контролируемое исследование «Изменение диеты при заболеваниях почек» (Modification of Diet in Renal Disease) продемонстрировало, что диета с очень низким потреблением белка (очень малобелковая диета, ОМБД) с обогащением кетокислот способствует замедлению развития ХБП по сравнению с диетой с низким потреблением белков (малобелковая диета, МБД), но полученные данные не были статистически значимыми [34]. В 2000-е годы было проведено два метаанализа, согласно которым соблюдение МБД значительно уменьшает риск наступления неблагоприятных ренальных исходов у недиабетических пациентов [35] в отличие от пациентов с диабетом [36]. В ходе недавно проведенного метанализа было изучено влияние ОМБД и МБД на различные критерии исходов у пациентов с ХБП [37]. У пациентов, придерживавшихся ОМБД, было отмечено значительное снижение риска прогрессирования ТСПН по сравнению с теми, кто соблюдал более высокобелковую диету. К тому же риск прогрессирования ТСПН у пациентов, соблюдавших ОМБД, был значимо ниже, чем у соблюдавших МБД. Garneata et al. отмечают, что соблюдение вегетарианского варианта ОМБД с обогащением кетоаналогами может отсрочивать процедуру диализа по сравнению с МБД, и что придерживавшиеся ОМБД пациенты демонстрировали улучшение метаболических показателей, в частности, снижение содержания мочевины в крови по сравнению с пациентами, соблюдавшими МБД [38]. В настоящем исследовании мы не оценивали уровни потребления белка с пищей или АМК каждого пациента после выписки. Поэтому мы не можем оценить, оказывал ли уровень потребления белка с пищей после выписки влияние на изменения уровней АМК или наступление неблагоприятных ренальных исходов, или степень уровней АМК связана со степенью прогрессирования ХБП.
Недостатки исследования
У этого исследования имеются некоторые недостатки. Во-первых, в данную когорту были набраны пациенты, поступившие в единственный региональный медицинский центр. В результате размер выборки в настоящем исследовании оказался относительно небольшим; она включала пожилых людей, при этом количество пациентов мужского пола более чем вдвое превышало количество пациентов женского пола. Поэтому есть вероятность возникновения систематической ошибки отбора. По данным анализа стратифицированных данных (Рисунок 4) более высокие уровни АМК оказались независимо связаны с наступлением неблагоприятных ренальных исходов только у пациентов мужского пола, у пациентов женского пола такой связи выявлено не было. Кроме того, статистически значимую взаимосвязь наблюдали только в группе более старшего возраста. Во-вторых, мы не оценивали содержание уремических токсинов, таких как индоксил сульфат и п-крезил-сульфат, имеющих отношение к развитию заболевания [39, 40]. В-третьих, не было проведено оценки потребления пациентами белка до их поступления в больницу, как и степени обезвоживания в момент поступления, а эти факторы могли повлиять на исходные показатели уровня АМК. Одно из предыдущих исследований показало, что диаметр левого предсердия может служить маркером степени обезвоживания у пациентов на период диализа [41]. Мы измеряли диаметр левого предсердия у каждого пациента, и его значения были слегка повышены в более высоких квартилях значений уровня АМК (Таблица 1). Это свидетельствует о том, что более высокие значения уровней АМК не отражают снижения объема жидкости в организме. В-четвертых, период наблюдения в настоящем исследовании был относительно непродолжительным. Наконец, необходимо учитывать, что единичное измерение уровня АМК не обеспечивает точности прогноза ренального исхода.
Выводы
Высокие показатели уровня АМК были определены как факторы риска прогрессирования заболеваний почек у пациентов со степенью тяжести ХБП от умеренной до тяжелой, вне зависимости от показателей рСКФ. Хотя уровни cSosm росли вместе с уровнями АМК, эти факторы не были независимо связаны с наступлением неблагоприятных исходов. Кроме того, на основании результатов анализа чувствительности предполагается, что уровни АМК ассоциированы с наступлением неблагоприятных ренальных исходов независимо от текущего состояния функции почек. Результаты настоящего исследования предполагают, что измерение уровней АМК может быть полезно для прогнозирования наступления ренальных исходов.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Макико Секи, Масару Накаяма, Теппей Сако, Рёта Ёситоми, Акико Фукуи, Эйсукэ Катафути, Сусуму Цуда, Тосиаки Накано, Кадзухико Цуруя, Таканари Китазоно
Аннотация
Введение
Азот мочевины крови (АМК (BUN, blood urea nitrogen)) – одно из веществ, определяющих осмоляльность сыворотки крови (cSosm). Одно из предыдущих исследований показало, что АМК и cSosm по-отдельности связаны с развитием хронической болезни почек (ХБП) у пациентов с сохраняющейся почечной функцией. На более поздних стадиях ХБП наблюдается одновременное увеличение осмоляльности и уровня азота. Однако пока непонятно, связаны ли эти показатели с ренальными исходами у пациентов со средней и тяжелой степенью дисфункции почек. Целью данного исследования являлось выяснить, существует ли взаимосвязь между уровнем АМК или cSosm и прогрессированием заболевания у пациентов на поздних стадиях ХБП.
Методы
В данном ретроспективном исследовании участвовало 459 пациентов, страдавших ХБП (стадии 3-5). Комбинированной конечной точкой являлись терминальная стадия почечной недостаточности (ТСПН) или смерть пациента; только ТСПН рассматривали как альтернативный исход. Для оценки факторов риска неблагоприятного исхода использовалась модель пропорциональных рисков Кокса. Были внесены поправки для более точной оценки ковариант, включая расчетную скорость клубочковой фильтрации (рСКФ). Значение cSosm (мОсм/кг) вычисляли по формуле:
(2 × натрий) + (АМК/2,8) + (глюкоза/18).
Результаты
По окончании периода наблюдения, длившегося в среднем 25,8 месяцев, достижение конечных точек почечных показателей наблюдали у 210 пациентов. Мультивариантная регрессионная модель Кокса определила отношения рисков (ОР) (HR) [95% доверительный интервал (ДИ)] наступления комбинированного ренального исхода во втором, третьем и четвертом квартилях значений уровня АМК, в которых значение ОР составило 1,36 (0,72–2,58), 1,87 (0,95–3,66), и 2,66 (1,23–5,76) (P для тенденции < 0,01) соответственно, по сравнению с первым квартилем значений уровня АМК. И наоборот, в расчете на неблагоприятный исход по этой модели, значение ОР (95% ДИ) во втором, третьем и четвертом квартилях значений уровня cSosm, по сравнению с первым квартилем, составило 1,13 (0,69–1,87), 0,95 (0,58–1,55), и 1,26 (0,78–2,03) соответственно (P для тенденции = 0,39). К тому же, что касается исхода, при котором наблюдается исключительно ТСПН, высокие квартильные показатели уровня АМК отражали значительный риск такого исхода, при этом значения уровня cSosm с данным исходом ассоциированы не были.
Вывод
Высокий уровень мочевины и низкая осмоляльность были ассоциированы с неблагоприятными исходами, независимо от скорости клубочковой фильтрации (eGFR), то есть уровень АМК может быть использован в качестве предиктора прогрессирования почечных заболеваний.
Введение
Мочевина – первичный метаболит, образующийся в результате обмена белка, поступающего с пищей и белков из тканей организма. Она хорошо отфильтровывается в почечных клубочках, но не секретируется, а реабсорбируется почечными канальцами [1]. Азот мочевины крови (АМК) отражает содержание азотного компонент мочевины в сыворотке крови. Уровень АМК обратно пропорционален ухудшению функции почек [2], на него могут влиять внепочечные факторы, такие как потребление белков, желудочные и кишечные кровотечения, различные катаболические состояния, недостаточное питание, сердечная недостаточность, обезвоживание, прием глюкокортикоидов, а также синтез мочевины в печени [3].
В обычных физиологических условиях мочевина расщепляется до цианата, который быстро преобразуется в изоцианат. Изоцианат представляет собой химически активный электрофил, для которого характерна высокая аффинность к нуклеофильным группам, например, первичным аминам [4]. Карбамиляция признана спонтанной посттрансляционной модификацией аминокислот и белков при участии цианата, ведущих к биохимическим изменениям. Также было показано, что мочевина способна оказывать как прямое токсическое действие на различные ткани, такие как кишечный эпителий, стенки сосудов, бета-клетки поджелудочной железы и адипоциты, так и непрямое – путем карбамиляции [5, 6]. Следует отметить, что уровень АМК коррелирует с летальностью пациентов, страдающих сердечной недостаточностью [7, 8].
Экспериментальные исследования показали, что выделение вазопрессина и активация альдозоредуктазного-фруктокиназного пути, вызванные повышением осмоляльности сыворотки, могут быть ассоциированы с повреждением почечной ткани [9, 10]. АМК является одним из соединений, которые влияют на измеряемые уровни осмоляльности сыворотки (cSosm). Поэтому у пациентов с последними стадиями хронической болезни почек (ХБП) наблюдается одновременный рост уровней cSosm и АМК. Кроме того, недавнее исследование показало, что высокие уровни АМК и cSosm независимо связаны с развитием ХБП, определяемой как снижение расчетной скорости клубочковой фильтрации (рСКФ) до < 60 мл/мин./1,73 м2 у пациентов с сохраняющейся почечной функцией (средняя скорость – 86,7 мл/мин./1,73 м2) [11]. Однако пока нет ответа на вопрос, являются ли повышенные уровни АМК и cSosm факторами риска прогрессирования заболевания для пациентов со средней и тяжелой формами ХБП. Таким образом, главная цель исследования – определить, существует ли взаимосвязь между уровнем АМК или cSosm с неблагоприятными ренальными исходами у пациентов с ХБП (3-5-я стадия) вне зависимости от значений рСКФ. Кроме того, одно из предыдущих исследований показало, что рСКФ и уровень креатинина в сыворотке крови были ассоциированы с прогрессированием заболевания почек у пациентов с ХБП [12]. Таким образом, мы также определяли, существует ли связь между уровнем АМК и прогрессированием ХБП вне зависимости от другого маркера функции почек – уровня креатинина в сыворотке крови.
Методы
Пациенты и дизайн исследования
С июня 2009 по декабрь 2017 года 682 японских пациента с ХБП 3-5-й стадии в разное время поступили в Государственное учреждение здравоохранения Медицинский центр префектуры Кюсю для прохождения обследования по вопросам ХБП. На рисунке 1 изображена схема процесса набора пациентов для исследования. Чтобы минимизировать влияние экстраренальных факторов на уровень АМК, пациенты, принимавшие кортикостероиды в дозах более 5 мг/сут., или пациенты с язвенной болезнью желудка в стадии обострения или с геморрагическим гастритом, циррозом печени либо с показателями фракции выброса левого желудочка менее 40%, были исключены из исследования. Было обследовано 459 пациентов. После выписки было продолжено плановое наблюдение пациентов на базе нашей клиники в течение шести месяцев. Сбор данных продолжался вплоть до июля 2018 года. Комбинированная конечная точка почечных показателей представляла собой развитие терминальной стадии хронической почечной недостаточности (ТСПН) или смерть, в зависимости от того, какое из этих двух событий наступало первым; также в качестве альтернативного исхода было введено наступление только ТСПН. ТСПН определяли как нарушение функции почек, требовавшее проведения заместительной терапии, например поддерживающего гемодиализа либо перитонеального диализа, либо пересадки почки. В случаях, когда пациенты демонстрировали постепенное ухудшение во время наблюдения и нуждались в заместительной почечной терапии, у них диагностировали ТСПН и им назначали заместительную терапию. Период до наступления ТСПН определяли как отрезок времени от первичного обследования до дня проведения первой процедуры диализа либо процедуры пересадки почки. Иногда смерть наступала раньше ТСПН. Информация, касающаяся смерти пациентов, и порядок цензурирования пациентов описаны в нашей предыдущей публикации [13]. Всего было цензурировано 69 пациентов; с 63 пациентами был утрачен контакт для последующего наблюдения, шестерым требовался поддерживающий гемодиализ из-за резкого ухудшения функции почек, вызванного инфекционными заболеваниями или застойной сердечной недостаточностью. В итоге, до июля 2018 года полностью прошли наблюдение 390 пациентов.
 Рисунок 1. Схема включения пациентов в исследование
Рисунок 1. Схема включения пациентов в исследованиеХБП – хроническая болезнь почек; рСКФ – расчетная скорость клубочковой фильтрации; ФВЛЖ – фракция выброса левого желудочка.
Клинические и биохимические оценки
Забор крови проводили у каждого пациента ранним утром, натощак (голодание в течение ночи). Также измеряли дневные показатели протеинурии. Значение рСКФ (мл/мин./1,73м2) рассчитывали по новому уравнению, разработанному для японских пациентов: 194 × уровень сывороточного креатинина− 1.094 × возраст− 0.287 × 0.739 (для женщин) [14]. Осмоляльность (мОсм/кг) вычисляли по формуле: (2 × натрий) + (АМК/2,8) + (глюкоза/18) [15].
Клинические обследования при поступлении и определение гипертензии, сахарного диабета, курения и дислипидемии описаны в предыдущей работе [13]. Для оценки диаметра левого предсердия и фракции выброса левого желудочка было проведено эхокардиографическое исследование.
Статистический анализ
Данные, полученные в течение длительных периодов, выражены в виде среднего значения ± SD (standart deviation, среднеквадратическое отклонение) или медианы (интерквартильный размах), в зависимости от разброса. Значения уровней АМК участников были разделены на квартили. Категориальные данные сравнивали по квартилям значений АМК с применением критерия хи-квадрат, а также критерий Фишера для групп, насчитывавших менее пяти участников в каждой ячейке. Дисперсионный анализ (ANOVA) применяли для сравнения непрерывных переменных с приблизительно нормальным распределением; а также применяли критерий Караскела-Уоллеса для сравнения непрерывных переменных с асимметричным распределением. Значения ровней cSosm участников также были распределены по квартилям. Для выявления связи между двумя непрерывными переменными применяли коэффициент ранговой корреляции Спирмена.
Модель пропорциональных рисков Кокса применяли для определения наличия связи cSosm или АМК с ренальными исходами. Модели Кокса также применяли для оценки взаимосвязи между высшим квартилем значений каждой переменной по ренальными исходам и низшим квартилем в качестве категории для сравнения. Для каждой переменной рассчитывали отношение рисков (ОР) и доверительный интервал в 95% (ДИ). Также, проводили стратификационный анализ для вычисления уточненных ОР наступления комбинированных ренальных исходов при увеличении уровня АМК на каждые 10 мг/дл в подгруппах, распределенных по исходным показателям. Для качественной оценки любых нелинейных связей между комбинированными ренальными исходами и уровнями АМК с поправкой на возраст, пол, заболевание сахарным диабетом, курение, показатели дислипидемии, систолическое кровяное давление, прием иммуносупрессантов и диуретиков, индекс массы тела, уровень С-реактивного белка, показатели дневной протеинурии, гемоглобин, рСКФ, сывороточный уровень фосфора и альбумина применяли интерполяцию кубическими сплайнами. В качестве узловых точек были выбраны 5-й, 35-й, 65-й и 95-й процентили уровня АМК, медианное значение АМК (18 мг/дл) в группе сравнения (первый квартиль) был выбран в качестве референса для построения графиков сплайнов. Кривые выживаемости строили с применением метода Каплана-Мейера и оценивали с применением логрангового критерия. Коллинеарность ковариат вычисляли путем измерения фактора увеличения дисперсии (ФУВ) и значения допуска по всем ковариатам. Также была исследована взаимосвязь между уровнем cSosm и исходами путем поочередного исключения каждой переменной в порядке убывания ФУВ. Все статистические анализы проводились с использованием программного обеспечения STATA ver. 14 (Stata Corp., College Station, TX, USA). Значения P < 0,05 считали указывающими на статистическую значимость.
Результат
В Таблице 1 приведены исходные клинические показатели пациентов, согласно квартилям значений уровня АМК. Значение медианы возраста 459 пациентов составило 72,6 лет (диапазон от 30 до 94 лет). Значение медианы рСКФ для всех пациентов составило 22,6 мл/мин./1,73 м2 (от 8,1 до 59,3 мл/мин./1,73 м2). Из 459 пациентов 161 (35%), 178 (39%) и 120 (26%) были классифицированы как страдающие от ХБП 2-й, 4-й и 5-й стадии соответственно. Основными причинами развития заболевания почек были хронический гломерулонефрит (21%, 95 пациентов), гипертонический нефросклероз (35%, 161 пациент), диабетическая нефропатия (27%, 124 пациента), другие факторы (15%, 68 пациентов), а также неизвестные причины (2%, 11 пациентов). Число пациентов, принимающих диуретики и AST-120, возрастало в верхних квартилях значений уровня АМК. AST-120, представляющий собой пероральный кишечный сферический угольный адсорбент, согласно имеющейся информации, снижает сывороточный уровень индоксил-сульфата и замедляет угасание функции почек [16]. На фоне возрастания уровня АМК отмечалось повышение дневной протеинурии и уровня фосфора в крови, а также снижение уровня гемоглобина и рСКФ. При повышении уровня АМК также возрастали и уровни cSosm. Отмечены статистически значимые отличия величины диаметра левого предсердия в квартилях значений уровня АМК, при этом значимых изменений ВФЛЖ не наблюдалось. Кроме того, значения cSosm прямо коррелировали с уровнем АМК (r = 0,657, P < 0,01) и содержанием натрия в сыворотке (r = 0,541, P < 0,01), но не коррелировали с уровнем глюкозы в крови натощак (r = 0,008, P = 0,87).
Таблица 1. Исходные клинические показатели пациентов в соответствии с квартилями значений уровня АМК
Средняя продолжительность периода наблюдения составила 25,8 месяцев (от 1,2 до 95,8 месяцев). К концу наблюдения 210 пациентов достигли комбинированной конечной точки почечных показателей, 35 пациентов скончались до наступления ТСПН. Причинами смерти стали инфекционные заболевания (в 9 случаях), синдром внезапной смерти (в 7 случаях), уремия (в 5 случаях), злокачественные новообразования (в 4 случаях), болезни сердца (в 5 случаях), другие заболевания (в 5 случаях) и неустановленные факторы (в 2 случаях).
Анализ методом Каплана-Мейера показал высокую частоту симптомов почечных событий в верхних квартилях значений уровней АМК (Рисунок 2). В Таблице 2 приведены значения ОР наступления комбинированных ренальных исходов в соответствии с квартилями значений уровней АМК и cSosm. В мультивариантной модели (3) в более высоких квартилях значений уровня АМК риск наступления неблагоприятного ренального исхода был существенно выше по сравнению с самыми низкими квартилями. Напротив, в самых высоких квартилях значений уровней cSosm в Модели 3 не было выявлено значимого увеличения риска наступления неблагоприятных ренальных исходов в сравнении с самыми низкими квартилями значений уровней сSosm. Сплайн-анализ взаимосвязи между АМК и риском наступления неблагоприятных ренальных исходов показывает, что с увеличением уровня АМК непрерывно возрастала вероятность наступления таких исходов (Рисунок 3).
 Рисунок 2. Кривые Каплана-Майера, отражающие отсутствие наступления неблагоприятных ренальных исходов у пациентов, распределенных по группам в соответствии с квартилями значений уровней АМК. Сравнение проведено с применением логрангового теста. АМК – азот мочевины крови.
Рисунок 2. Кривые Каплана-Майера, отражающие отсутствие наступления неблагоприятных ренальных исходов у пациентов, распределенных по группам в соответствии с квартилями значений уровней АМК. Сравнение проведено с применением логрангового теста. АМК – азот мочевины крови.Таблица 2. Отношения рисков наступления комбинированных конечных точек (наступление ТСПН или смерти), ассоциированных с уровнями АМК или cSosm
 Рисунок 3. Отношение рисков для наступления комбинированных ренальных исходов в зависимости от уровня АМК. Сплошная линия отражает отношение рисков, пунктирные – доверительный интервал (95%). АМК – азот мочевины крови.
Рисунок 3. Отношение рисков для наступления комбинированных ренальных исходов в зависимости от уровня АМК. Сплошная линия отражает отношение рисков, пунктирные – доверительный интервал (95%). АМК – азот мочевины крови.На рисунке 4 обобщены данные по скорректированным отношениям рисков в подгруппах, разделенных в соответствии с демографическими и клиническими характеристиками. У всех пациентов повышение уровня АМК на каждые 10 мг/дл было ассоциировано с увеличением риска наступления неблагоприятных комбинированных ренальных исходов (ОР 1,23; 95% ДИ, 1,04-1,45). У мужчин повышенный уровень АМК был ассоциирован со значительным риском наступления неблагоприятных комбинированных ренальных исходов. У пациентов с более высокими значениями рСКФ и уровня протеинурии и более низким значением уровня альбумина в сыворотке риск наступления неблагоприятных ренальных исходов значимо возрастал по мере увеличения уровня АМК. Кроме того, у пациентов, принимавших диуретики, на фоне повышения уровня АМК был выявлен повышенный риск наступления неблагоприятных ренальных исходов. Значимых взаимосвязей для ренальных исходов между уровнем АМК и другими базовыми клиническими характеристиками, за исключением применения диуретиков (P =0,02), обнаружено не было (P для взаимодействия 0,06–0,88).
 Рисунок 4. Значения скорректированных отношений рисков и доверительных интервалов (95%) наступления комбинированных ренальных исходов при увеличении уровня АМК на каждые 10 мг/дл в подгруппах, разделенных по значениям исходных показателей. Корректировки проводили по тем же ковариатам, что и для Модели 3 в Таблице 2
Рисунок 4. Значения скорректированных отношений рисков и доверительных интервалов (95%) наступления комбинированных ренальных исходов при увеличении уровня АМК на каждые 10 мг/дл в подгруппах, разделенных по значениям исходных показателей. Корректировки проводили по тем же ковариатам, что и для Модели 3 в Таблице 2ТСПН – терминальная стадия почечной недостаточности; АМК – азот мочевины крови; рСКФ – расчетная скорость клубочковой фильтрации.
Также была исследована связь между уровнями АМКи cSosm и прогрессированием болезни до наступления ТСПН (почечные события, n = 173) (Таблица 3). В полностью скорректированной модели (Модель 3) в сравнении с первым квартилем значений уровня АМК в четвертом квартиле значений уровня АМК было выявлено значительное повышение риска наступления комбинированного исхода, в то время как для высоких квартилей значений уровня cSosm не было выявлено значимого повышения риска наступления таких исходов.
Таблица 3. Отношения рисков наступления ТСПН, ассоциированной с уровнями АМК и cSosm
При проведении анализов исключение трех переменных (дневная протеинурия, уровень альбумина в сыворотке и уровень гемоглобина) не выявило взаимосвязи между наступлением исходов и более высокими уровнями cSosm. Значимая взаимосвязь была обнаружена после четвертой переменной (значение рСКФ).
Анализ чувствительности
Для оценки объективности полученных данных, представленных в Таблице 2, был проведен анализ чувствительности; его результаты приведены в Таблице 4. В мультивариантную модель в качестве одной из ковариат вместо значения рСКФ мы ввели значение уровня креатинина в сыворотке. Более высокие квартили значений уровня АМК, в отличие от квартилей значений уровня cSosm, были независимо ассоциированы с комбинированными неблагоприятными ренальными исходами. Эти данные аналогичны данным, приведенным в Таблице 2.
Таблица 4. Отношения рисков наступления комбинированных исходов (ТСПН или смерть), ассоциированных с уровнями АМК и cSosm (анализ чувствительности)
Обсуждение
В настоящем исследовании было показано, что высокий уровень АМК в крови ассоциирован с неблагоприятными ренальными исходами, независимо от показателя рСКФ, у пациентов со средней и тяжелой формами ХПН. Недавние исследования подтвердили, что уровни и АМК, и cSosm являются независимыми факторами риска возникновения ХБП у пациентов с сохраненной функцией почек [11]. В данном исследовании многофакторный регрессионный анализ Кокса (Модель 3) не выявил значимой взаимосвязи между уровнями cSosm и наступлением неблагоприятных ренальных исходов. Полученные данные позволяют предположить, что абсолютный уровень АМК в большей степени, чем уровни cSosm, обладает прогностической силой в отношении прогрессирования заболевания почек. И наоборот, в исследованной нами когорте высокие уровни АМК были значимо связаны с наступлением неблагоприятных исходов среди пациентов с более высокими (в отличие от группы с более низкими показателями) значениями рСКФ, хотя значимой связи для наступления неблагоприятных ренальных исходов между уровнями АМК и рСКФ обнаружено не было (Рисунок 4). Полученные данные могут предполагать, что влияние уровня АМК на прогрессирование ХБП более выражено на ранних стадиях заболевания.
Также, был проведен анализ чувствительности (Таблица 4). Его результаты схожи с результатами, представленными в Таблице 2. Эти данные подтверждают устойчивость полученных нами результатов. Таким образом, уровень АМК может быть связан с наступлением ренальных исходов независимо от состояния функции почек.
Природа патофизиологического механизма, обуславливающего зависимость неблагоприятных ренальных исходов от уровня АМК, на данный момент остается невыясненной. Однако было рассмотрено несколько гипотез относительно этой взаимосвязи. На фоне ХБП снижение почечной функции, характеризующееся хроническим повышением уровня АМК , представляет собой патологическое состояние, которое способствует образованию изоцианата [17]. Было отмечено, что по сравнению со здоровыми людьми, у которых уровень цианата в крови не превышал 45 нмоль/л, у пациентов с ХБП, еще не прошедших процедуру диализа, он достигал 141 нмоль/л [18]. Соответственно, по мере снижения функции почек, сопровождающегося накоплением мочевины в организме, усиливается процесс карбамилирования белков. Согласно Berg et al., концентрация карбамилированного альбумина в крови пациентов с ХБП (3-й и 4-й стадии) и ТСПН примерно в 2 раза выше, чем у неуремических пациентов. Кроме того, положительная корреляция между уровнями АМК и карбамилированного альбумина была более выражена у пациентов с ХБП, которые не проходили диализ, чем у людей с ТСПН. На основании этих данных можно предположить, что «гиперкарбамилирование» наблюдается на всех стадиях ХБП как до начала гемодиализа, так и после него [19]. Кроме того, сообщалось, что уровень карбамилированных белков связан с показателями смертности от всех причин, а также от сердечно-сосудистых заболеваний среди пациентов с ТСПН [19, 20, 21]. Следует отметить, что, как сообщается, карбамилированные белки вызывают повреждения клеток почечных канальцев и перитубулярный фиброз в почках амфибий [22], усиливать пролиферацию мезангиальных клеток, а также синтез в них коллагенов I и IV типов [23]. К сожалению, в ходе данного исследования не было возможности оценить содержание карбамилированных белков. Тем не менее, на основе приведенных данных можно предположить, что риск наступления неблагоприятных ренальных исходов, связанных с повышенным уровнем АМК, в настоящем исследовании может быть обусловлен опосредованным токсическим действием мочевины через карбамилирование.
Установлено, что концентрации мочевины, типичные для ХБП, непосредственно повышают уровень активных форм кислорода (АФК) и окислительного стресса в адипоцитах [24], бета-клетках поджелудочной железы и клетках эндотелия аорты [26]. D’Apolito et al. продемонстрировали, что продукция АФК в адипоцитах, индуцируемая мочевиной, приводит к возникновению инсулинорезистентности [24]. По данным Koppe et al., мочевина усиливает окислительный стресс и способствует ацилированию О-связанного N-глюкозамина белков, приводя к возникновению нарушений секреции инсулина [25]. В ходе недавнего масштабного когортного исследования было установлено, что повышенные уровни АМК были связаны с увеличением риска развития сахарного диабета; ОР (95% ДИ) наступления неблагоприятных исходов у пациентов с уровнем АМК более 25 мг/дл составило 1,23 (1,21–1,25) по сравнению пациентами, у которых уровень АМК в крови не превышал 25 мг/дл [27]. Эти данные могут служить подтверждением результатов, полученных D’Apolito et al. [24] и Koppe et al. [25] в ходе экспериментов. Кроме того, окислительный стресс постоянно усиливается, коррелируя с нарушением функции почек у пациентов с ХБП [28, 29]. Предыдущие исследования предполагают, что окислительный стресс может быть связан с патогенезом и прогрессированием заболеваний почек. Уровень 8-гидроксидеоксигуанозина в моче предположительно может служить маркером для прогнозирования развития диабетической нефропатии у пациентов с диабетом [30].Также было высказано предположение, что в патогенезе гломерулонефрита может играть важную роль малондиальдегид [31] и что конечные продукты окисления белков связаны с патогенезом и развитием IgA-нефропатии [32]. Однако остается невыясненным, способствует ли индуцируемый мочевиной окислительный стресс развитию болезни почек непосредственно.
Образование мочевины прямо пропорционально ежедневному употреблению белка, поэтому ограничение поступления белка с пищей ведет к снижению продукции мочевины [33]. Проведено большое количество исследований эффективности тактики ограничения потребления белка на фоне прогрессирования болезней почек. Однако результаты были неоднозначными. Крупнейшее рандомизированное контролируемое исследование «Изменение диеты при заболеваниях почек» (Modification of Diet in Renal Disease) продемонстрировало, что диета с очень низким потреблением белка (очень малобелковая диета, ОМБД) с обогащением кетокислот способствует замедлению развития ХБП по сравнению с диетой с низким потреблением белков (малобелковая диета, МБД), но полученные данные не были статистически значимыми [34]. В 2000-е годы было проведено два метаанализа, согласно которым соблюдение МБД значительно уменьшает риск наступления неблагоприятных ренальных исходов у недиабетических пациентов [35] в отличие от пациентов с диабетом [36]. В ходе недавно проведенного метанализа было изучено влияние ОМБД и МБД на различные критерии исходов у пациентов с ХБП [37]. У пациентов, придерживавшихся ОМБД, было отмечено значительное снижение риска прогрессирования ТСПН по сравнению с теми, кто соблюдал более высокобелковую диету. К тому же риск прогрессирования ТСПН у пациентов, соблюдавших ОМБД, был значимо ниже, чем у соблюдавших МБД. Garneata et al. отмечают, что соблюдение вегетарианского варианта ОМБД с обогащением кетоаналогами может отсрочивать процедуру диализа по сравнению с МБД, и что придерживавшиеся ОМБД пациенты демонстрировали улучшение метаболических показателей, в частности, снижение содержания мочевины в крови по сравнению с пациентами, соблюдавшими МБД [38]. В настоящем исследовании мы не оценивали уровни потребления белка с пищей или АМК каждого пациента после выписки. Поэтому мы не можем оценить, оказывал ли уровень потребления белка с пищей после выписки влияние на изменения уровней АМК или наступление неблагоприятных ренальных исходов, или степень уровней АМК связана со степенью прогрессирования ХБП.
Недостатки исследования
У этого исследования имеются некоторые недостатки. Во-первых, в данную когорту были набраны пациенты, поступившие в единственный региональный медицинский центр. В результате размер выборки в настоящем исследовании оказался относительно небольшим; она включала пожилых людей, при этом количество пациентов мужского пола более чем вдвое превышало количество пациентов женского пола. Поэтому есть вероятность возникновения систематической ошибки отбора. По данным анализа стратифицированных данных (Рисунок 4) более высокие уровни АМК оказались независимо связаны с наступлением неблагоприятных ренальных исходов только у пациентов мужского пола, у пациентов женского пола такой связи выявлено не было. Кроме того, статистически значимую взаимосвязь наблюдали только в группе более старшего возраста. Во-вторых, мы не оценивали содержание уремических токсинов, таких как индоксил сульфат и п-крезил-сульфат, имеющих отношение к развитию заболевания [39, 40]. В-третьих, не было проведено оценки потребления пациентами белка до их поступления в больницу, как и степени обезвоживания в момент поступления, а эти факторы могли повлиять на исходные показатели уровня АМК. Одно из предыдущих исследований показало, что диаметр левого предсердия может служить маркером степени обезвоживания у пациентов на период диализа [41]. Мы измеряли диаметр левого предсердия у каждого пациента, и его значения были слегка повышены в более высоких квартилях значений уровня АМК (Таблица 1). Это свидетельствует о том, что более высокие значения уровней АМК не отражают снижения объема жидкости в организме. В-четвертых, период наблюдения в настоящем исследовании был относительно непродолжительным. Наконец, необходимо учитывать, что единичное измерение уровня АМК не обеспечивает точности прогноза ренального исхода.
Выводы
Высокие показатели уровня АМК были определены как факторы риска прогрессирования заболеваний почек у пациентов со степенью тяжести ХБП от умеренной до тяжелой, вне зависимости от показателей рСКФ. Хотя уровни cSosm росли вместе с уровнями АМК, эти факторы не были независимо связаны с наступлением неблагоприятных исходов. Кроме того, на основании результатов анализа чувствительности предполагается, что уровни АМК ассоциированы с наступлением неблагоприятных ренальных исходов независимо от текущего состояния функции почек. Результаты настоящего исследования предполагают, что измерение уровней АМК может быть полезно для прогнозирования наступления ренальных исходов.
Список использованной литературы
- Berl T, Schrier RW. Disorders of water metabolism. Chapter 1. In: Schrier RW, editor. Renal and electrolyte disorders. 6th ed. Philadelphia: Lippincott Williams and Wilkins; 2002. p. 1–63. Google Scholar
- Dossetor JB. Creatininemia versus uremia. The relative significance of blood urea nitrogen and serum creatinine concentrations in azotemia. Ann Intern Med. 1966;65:1287–99. View ArticleGoogle Scholar
- Hosten AO. BUN and creatinine. In: Walker HK, Hall WD, Hurst JW, editors. Clinical methods: the history, physical, and laboratory examinations. 3rd ed. Boston: Butterworths; 1990. p. 874–8. Google Scholar
- Kalim S, Karumanchi SA, Thadhani RI, Berg AH. Protein carbamylation in kidney disease: pathogenesis and clinical implications. Am J Kidney Dis. 2014;64:793–803. View ArticleGoogle Scholar
- Lau WL, Vaziri ND. Urea, a true uremic toxin: the empire strikes back. Clin Sci (Lond). 2017;131:3–12. View ArticleGoogle Scholar
- Vanholder R, Gryp T, Glorieux G. Urea and chronic kidney disease: the comeback of the century? (in uraemia research). Nephrol Dial Transplant. 2018;33:4–12. View ArticleGoogle Scholar
- Cauthen CA, Lipinski MJ, Abbate A, Appleton D, Nusca A, Varma A, et al. Relation of blood urea nitrogen to long-term mortality in patients with heart failure. Am J Cardiol. 2008;101:1643–7. View ArticleGoogle Scholar
- Matsushita K, Kwak L, Hyun N, Bessel M, Agarwal SK, Loehr LR, et al. Community burden and prognostic impact of reduced kidney function among patients hospitalized with acute decompensated heart failure: the atherosclerosis risk in communities (ARIC) study community surveillance. PLoS One. 2017;12:e0181373. View ArticleGoogle Scholar
- Bouby N, Bachmann S, Bichet D, Bankir L. Effect of water intake on the progression of chronic renal failure in the 5/6 nephrectomized rat. Am J Phys. 1990;258:F973–9. Google Scholar
- Cirillo P, Gersch MS, Mu W, Scherer PM, Kim KM, Gesualdo L, et al. Ketohexokinase-dependent metabolism of fructose induces proinflammatory mediators in proximal tubular cells. J Am Soc Nephrol. 2009;20:545–53. View ArticleGoogle Scholar
- Kuwabara M, Hisatome I, Roncal-Jimenez CA, Niwa K, Andres-Hernando A, Jensen T, et al. Increased serum sodium and serum Osmolarity are independent risk factors for developing chronic kidney disease; 5 year cohort study. PLoS One. 2017;12:e0169137. View ArticleGoogle Scholar
- Inaguma D, Imai E, Takeuchi A, Ohashi Y, Watanabe T, Nitta K, et al. Chronic kidney disease Japan cohort study group. Risk factors for CKD progression in Japanese patients: findings from the Chronic Kidney Disease Japan Cohort (CKD-JAC) study. Clin Exp Nephrol. 2017;21:446–56. View ArticleGoogle Scholar
- Katafuchi E, Nakayama M, Tanaka S, Sakoh T, Yoshitomi R, Fukui A, et al. Comparison of Prognostic Values of Daytime and Night-Time Systolic Blood Pressures on Renal Outcomes in Patients With Chronic Kidney Disease. Circ J. 2017;81:1454–62. View ArticleGoogle Scholar
- Matsuo S, Imai E, Horio M, Yasuda Y, Tomita K, Nitta K, et al. Collaborators developing the Japanese equation for estimated GFR. Revised equations for estimated GFR from serum creatinine in Japan. Am J Kidney Dis. 2009;53:982–92. View ArticleGoogle Scholar
- Bhagat CI, Garcia-Webb P, Fletcher E, Beilby JP. Calculated vs measured plasma osmolalities revisited. Clin Chem. 1984;30:1703–5. PubMedGoogle Scholar
- Schulman G, Vanholder R, Niwa T. AST-120 for the management of progression of chronic kidney disease. Int J Nephrol Renovasc Dis. 2014;7:49–56. View ArticleGoogle Scholar
- Jaisson S, Pietrement C, Gillery P. Carbamylation-derived products: bioactive compounds and potential biomarkers in chronic renal failure and atherosclerosis. Clin Chem. 2011;57:1499–505. View ArticleGoogle Scholar
- Nilsson L, Lundquist P, Kågedal B, Larsson R. Plasma cyanate concentrations in chronic renal failure. Clin Chem. 1996;42:482–3. PubMedGoogle Scholar
- Berg AH, Drechsler C, Wenger J, Buccafusca R, Hod T, Kalim S, et al. Carbamylation of serum albumin as a risk factor for mortality in patients with kidney failure. Sci Transl Med. 2013;5:175ra29. View ArticleGoogle Scholar
- Drechsler C, Kalim S, Wenger JB, Suntharalingam P, Hod T, Thadhani RI, et al. Protein carbamylation is associated with heart failure and mortality in diabetic patients with end-stage renal disease. Kidney Int. 2015;87:1201–8. View ArticleGoogle Scholar
- Koeth RA, Kalantar-Zadeh K, Wang Z, Fu X, Tang WH, Hazen SL. Protein carbamylation predicts mortality in ESRD. J Am Soc Nephrol. 2013;24:853–61. View ArticleGoogle Scholar
- Gross ML, Piecha G, Bierhaus A, Hanke W, Henle T, Schirmacher P, et al. Glycated and carbamylated albumin are more "nephrotoxic" than unmodified albumin in the amphibian kidney. Am J Physiol Renal Physiol. 2011;301:F476–85. View ArticleGoogle Scholar
- Shaykh M, Pegoraro AA, Mo W, Arruda JA, Dunea G, Singh AK. Carbamylated proteins activate glomerular mesangial cells and stimulate collagen deposition. J Lab Clin Med. 1999;133:302–8. View ArticleGoogle Scholar
- D'Apolito M, Du X, Zong H, Catucci A, Maiuri L, Trivisano T, et al. Urea-induced ROS generation causes insulin resistance in mice with chronic renal failure. J Clin Invest. 2010;120:203–13. View ArticleGoogle Scholar
- Koppe L, Nyam E, Vivot K, Manning Fox JE, Dai XQ, et al. Urea impairs β cell glycolysis and insulin secretion in chronic kidney disease. J Clin Invest. 2016;126:3598–612. View ArticleGoogle Scholar
- D'Apolito M, Du X, Pisanelli D, Pettoello-Mantovani M, Campanozzi A, Giacco F, et al. Urea-induced ROS cause endothelial dysfunction in chronic renal failure. Atherosclerosis. 2015;239:393–400.View ArticleGoogle Scholar
- Xie Y, Bowe B, Li T, Xian H, Yan Y, Al-Aly Z. Higher blood urea nitrogen is associated with increased risk of incident diabetes mellitus. Kidney Int. 2018;93:741–52.View ArticleGoogle Scholar
- Dounousi E, Papavasiliou E, Makedou A, Ioannou K, Katopodis KP, Tselepis A, et al. Oxidative stress is progressively enhanced with advancing stages of CKD. Am J Kidney Dis. 2006;48:752–60.View ArticleGoogle Scholar
- Terawaki H, Yoshimura K, Hasegawa T, Matsuyama Y, Negawa T, Yamada K, et al. Oxidative stress is enhanced in correlation with renal dysfunction: examination with the redox state of albumin. Kidney Int. 2004;66:1988–93.View ArticleGoogle Scholar
- Hinokio Y, Suzuki S, Hirai M, Suzuki C, Suzuki M, Toyota T. Urinary excretion of 8-oxo-7,8-dihydro-2'-deoxyguanosine as a predictor of the development of diabetic nephropathy. Diabetologia. 2002;45:877–82.View ArticleGoogle Scholar
- Kuo HT, Kuo MC, Chiu YW, Chang JM, Guh JY, Chen HC. Increased glomerular and extracellular malondialdehyde levels in patients and rats with focal segmental glomerulosclerosis. Eur J Clin Investig. 2005;35:245–50.View ArticleGoogle Scholar
- Descamps-Latscha B, Witko-Sarsat V, Nguyen-Khoa T, Nguyen AT, Gausson V, Mothu N, et al. Early prediction of IgA nephropathy progression: proteinuria and AOPP are strong prognostic markers. Kidney Int. 2004;66:1606–12.View ArticleGoogle Scholar
- Weiner ID, Mitch WE, Sands JM. Urea and Ammonia metabolism and the control of renal nitrogen excretion. Clin J Am Soc Nephrol. 2015;10:1444–58.View ArticleGoogle Scholar
- Klahr S, Levey AS, Beck GJ, Caggiula AW, Hunsicker L, Kusek JW, et al. The effects of dietary protein restriction and blood-pressure control on the progression of chronic renal disease. Modification of Diet in Renal Disease Study Group. N Engl J Med. 1994;330:877–84.View ArticleGoogle Scholar
- Fouque D, Laville MM. Low protein diets for chronic kidney disease in non diabetic adults. Cochrane Database Syst Rev. 2009:CD001892.Google Scholar
- Robertson L, Waugh N, Robertson A. Protein restriction for diabetic renal disease. Cochrane Database Syst Rev. 2007:CD002181.Google Scholar
- Rhee CM, Ahmadi SF, Kovesdy CP, Kalantar-Zadeh K. Low-protein diet for conservative management of chronic kidney disease: a systematic review and meta-analysis of controlled trials. J Cachexia Sarcopenia Muscle. 2018;9:235–42.View ArticleGoogle Scholar
- Garneata L, Stancu A, Dragomir D, Stefan G, Mircescu G. Ketoanalogue-supplemented vegetarian very low-protein diet and CKD progression. J Am Soc Nephrol. 2016;27:2164–76.View ArticleGoogle Scholar
- Wu IW, Hsu KH, Lee CC, Sun CY, Hsu HJ, Tsai CJ, et al. p-Cresyl sulphate and indoxyl sulphate predict progression of chronic kidney disease. Nephrol Dial Transplant. 2011;26:938–47.View ArticleGoogle Scholar
- Lin CJ, Liu HL, Pan CF, Chuang CK, Jayakumar T, Wang TJ, et al. Indoxyl sulfate predicts cardiovascular disease and renal function deterioration in advanced chronic kidney disease. Arch Med Res. 2012;43:451–6.View ArticleGoogle Scholar
- Agarwal R, Bouldin JM, Light RP, Garg A. Inferior vena cava diameter and left atrial diameter measure volume but not dry weight. Clin J Am Soc Nephrol. 2011;6:1066–72.View ArticleGoogle Scholar





