10498
07 Сентября 2020
Nutrients. 2019 Feb; 11(2): 383.
Опубликовано онлайн 13 февраля 2019 г.
Irene Capelli, Giuseppe Cianciolo, Lorenzo Gasperoni, Fulvia Zappulo, Francesco Tondolo, Maria Cappuccilli, Gaetano La Manna
Patients affected by chronic kidney disease (CKD) or end-stage renal disease (ESRD) experience a huge cardiovascular risk and cardiovascular events represent the leading causes of death. Since traditional risk factors cannot fully explain such increased cardiovascular risk, interest in non-traditional risk factors, such as hyperhomocysteinemia and folic acid and vitamin B12 metabolism impairmen...
Опубликовано онлайн 13 февраля 2019 г.
Irene Capelli, Giuseppe Cianciolo, Lorenzo Gasperoni, Fulvia Zappulo, Francesco Tondolo, Maria Cappuccilli, Gaetano La Manna
Patients affected by chronic kidney disease (CKD) or end-stage renal disease (ESRD) experience a huge cardiovascular risk and cardiovascular events represent the leading causes of death. Since traditional risk factors cannot fully explain such increased cardiovascular risk, interest in non-traditional risk factors, such as hyperhomocysteinemia and folic acid and vitamin B12 metabolism impairmen...
Nutrients. 2019 Feb; 11(2): 383.
Опубликовано онлайн 13 февраля 2019 г.
Irene Capelli, Giuseppe Cianciolo, Lorenzo Gasperoni, Fulvia Zappulo, Francesco Tondolo, Maria Cappuccilli, Gaetano La Manna
Patients affected by chronic kidney disease (CKD) or end-stage renal disease (ESRD) experience a huge cardiovascular risk and cardiovascular events represent the leading causes of death. Since traditional risk factors cannot fully explain such increased cardiovascular risk, interest in non-traditional risk factors, such as hyperhomocysteinemia and folic acid and vitamin B12 metabolism impairment, is growing. Although elevated homocysteine blood levels are often seen in patients with CKD and ESRD, whether hyperhomocysteinemia represents a reliable cardiovascular and mortality risk marker or a therapeutic target in this population is still unclear. In addition, folic acid and vitamin B12 could not only be mere cofactors in the homocysteine metabolism; they may have a direct action in determining tissue damage and cardiovascular risk. The purpose of this review was to highlight homocysteine, folic acid and vitamin B12 metabolism impairment in CKD and ESRD and to summarize available evidences on hyperhomocysteinemia, folic acid and vitamin B12 as cardiovascular risk markers, therapeutic target and risk factors for CKD progression.
Keywords: cardiovascular disease, chronic kidney disease, end-stage renal disease, hyperhomocysteinemia, folic acid, vitamin B12
Введение
Продолжительность жизни больных с хронической болезнью почек (ХБП) и терминальной стадией почечной недостаточности (ТСПН) меньше, чем у лиц с ненарушенной функцией почек, прежде всего, вследствие увеличения смертности от сердечно-сосудистых событий [1]. При хроническом гемодиализе риск преждевременной смерти в 10–50 раз превышает таковой среди населения в целом, и основной причиной летального исхода у этой категории пациентов являются сердечно-сосудистые заболевания (ССЗ) [2, 3]. Впрочем, развитие сердечно-сосудистых событий возможно и на ранних стадиях ХБП [4].
Согласно рандомизированным клиническим исследованиям (РКИ), у данной категории больных традиционные факторы риска по Фрамингемской шкале (артериальная гипертензия, дислипидемия и сахарный диабет) являются незначительными факторами сердечно-сосудистого риска. Таким образом, все большее внимание уделяется нетрадиционным факторам сердечно-сосудистого риска, включающим окислительный стресс, эндотелиальную дисфункцию, хроническое воспаление, кальцификацию сосудов, как проявление минеральных и костных нарушений при хронической болезни почек (МКН-ХБП), а также гипергомоцистеинемию [5].
«Гомоцистеиновая гипотеза» получила распространение после того, как было установлено, что пациенты с очень высоким уровнем гомоцистеина в крови ввиду врожденных нарушений метаболизма гомоцистеина подвержены более агрессивному течению атеросклероза. Поэтому на протяжении нескольких лет проводятся исследования с целью выявления возможной связи между повышением (даже незначительным) уровня гомоцистеина и сердечно-сосудистым риском и смертностью. Результаты научных работ неоднозначны [6, 7].
Хотя у больных с ХБП и ТСПН повышен уровень гомоцистеина, до сих пор остается неясным, насколько гипергомоцистеинемию можно считать фактором риска сердечно-сосудистых заболеваний и смертности у таких пациентов. Данный вопрос требует проведения дальнейших исследований [8-12].
Кроме того, высокий показатель распространенности повышенного уровня гомоцистеина в крови у пациентов с ХБП привлекает внимание ученых к гипергомоцистеинемии как фактору риска прогрессирующего течения ХБП [13, 14].
Значение фолиевой кислоты и витамина В12 хорошо известно, поскольку они являются не только основными кофакторами метаболизма гомоцистеина, но и нарушение их гомеостаза может непосредственно повышать сердечно-сосудистый риск и приводить к прогрессирующему течению ХБП [11, 15].
Целью данного обзора является обобщение данных о фолиевой кислоте, витамине В12 и метаболизме гомоцистеина у пациентов с ХБП, а также анализ опубликованных данных о дефиците фолиевой кислоты и витамина В12 как маркере сердечно-сосудистого риска и терапевтической мишени у пациентов с ХБП и ТСПН.
Витамины группы В и метаболизм гомоцистеина
Витамины группы В, в частности витамин В9 (фолат) и В12 (кобаламин) – водорастворимые витамины, обеспечивающие нормальную функцию клетки: они являются источником углерода для синтеза пуринов, пиримидинов и нуклеопротеинов, а также играют ведущую роль в эритропоэзе [16].
Фолиевая кислота является производным полиглутамата, который расщепляется в кишечнике до моноглутамата и затем проникает в кровь через эпителий слизистой кишечника при участии специфических транспортеров. Циркулирующая форма фолиевой кислоты носит название 5-метилтетрагидрофолат (5- MTHF) [17].
Витамин В12, поступает в организм в составе кобаламина, который образует комплекс с гаптокоррином слюны. Резкое высвобождение витамина из кобаламина происходит в двенадцатиперстной кишке под воздействием панкреатических протеаз. Затем кобаламин связывается с желудочным мукопротеидом, секретируемым париетальными клетками стенки желудка: когда образовавшийся комплекс поступает в дистальный отдел подвздошной кишки, он путем эндоцитоза проникает в энтероцит под воздействием кубилина. На следующем этапе кобаламин попадает в плазму с помощью транспортного белка транскобаламина [16]. В12 проходит через клубочковый фильтр, хотя потеря его с мочой незначительна вследствие реабсорбции в проксимальных канальцах.
В тканях-мишенях кобаламин метаболизируется в две активные формы: аденозилкобаламин в митохондриях и метилкобаламин в цитозоле. Метилкобаламин представляет собой метил-транспортирующий кофактор энзим-метионин-синтетазы, которая обеспечивает реметилирование гомоцистеина и его переход в метионин [17].
Гомоцистеин – тиолсодержащая аминокислота, не участвующая в синтезе протеинов и являющаяся звеном метаболизма метионина. Уровень гомоцистеина в плазме зависит от ряда факторов, таких как генетические изменения в белках, участвующих в метаболизме метионина, или дефицит витамина В12, витамина В6 и фолиевой кислоты [18].
Метионин переходит в S-аденозилметионин (SAM), а затем конвертируется в S-аденозилгомоцистеин (SAH) посредством химической реакции, катализатором которой является метионинсинтетазредуктаза (MTRR). SAM – один из важнейших доноров метильной группы, который образуется в митохондриях и является кофактором мутазы, известной как метилмалонил КоА мутаза. Этот фермент превращает метилмалонил КоА в сукцинил КоА, что является ключевым звеном в катаболизме различного вида аминокислот и жирных кислот. Для этих процессов также необходим пиридоксин (витамин В6) в качестве кофактора [18].
Гомоцистеин – конечный продукт гидролиза SAH при его распаде на гомоцистеин и аденозин. Метаболизм гомоцистеина осуществляется двумя путями: реметилирование и транссульфурация (рис. 1А). При реметилировании метионин образуется в результате реакции, катализатором которой выступает метионин-синтаза (MTS), для которой в качестве кофакторов необходимы фолат и витамин В12. Поскольку фолат не является биологически активной формой, происходит его превращение в тетрагидрофолат, а затем в метилентетрагидрофолат (MTHF) под воздействием фермента метилентетрагидрофолат-редуктазы (MTHFR) [19].

Рисунок 1. Метаболизм гомоцистеина в норме (А) и при заболевании почек (В).
CSE: цистатионин-гамма-лиаза; CBS: цистатионин-бета-синтаза
Другой путь метаболизма гомоцистеина осуществляется посредством транссульфурации. В начале, под воздействием цистатионин-бета-синтазы (СBS), гомоцистеин связывается с серином, образуя цистатионин, который гидролизируется до цистеина и α-кетобутирата под воздействием цистатионин-γ-лиазы (СТН). У человека CBS образуется в печени, почках, мышцах, головном мозге и яичниках, а на ранних стадиях эмбриогенеза - в нервной и сердечной ткани [20].
Атом серы в составе сульфана или гидросульфида (H2S) может участвовать в В12-зависимом переносе метильной группы [21, 22]. Нарушение метилирования ведет к снижению метилирования протеинов и ДНК, что в конечном счете приводит к нарушению пролиферации мышечных клеток и повышению перекисного окисления липидов [23]. Сера – побочный продукт перехода гомоцистеина в цистеин под действием CBS и цистатионин-гамма-лиазы (CSE). H2S – ангиогенный агент с антиоксидантными и вазорелаксирующими свойствами. Кроме того, H2S выступает в качестве эндогенного газового медиатора, подобно оксиду азота (NO) и монооксиду углерода [24], который участвует в ряде физиологических процессов, в частности расслабляет гладкомышечные клетки сосудистой стенки, ингибирует их пролиферацию и снижает артериальное давление [25]. По данным Li et al., нарушение метаболизма H2S может привести к развитию ассоциированного с уремией прогрессирующего атеросклероза у пациентов с ХБП и диабетической нефропатией [26]. У больных с ХБП и ТСПН отмечается пониженный уровень H2S в плазме, что может объясняться снижением количества CBS и CSE вследствие гипергомоцистеинемии (рис. 1В). Оказывают ли еще какие-либо факторы влияние на данное состояние, пока неизвестно [21].
В крови гомоцистеин может определяться в восстановленной и окисленной форме: более 90% общего гомоцистеина плазмы окислено и связано с протеинами, оставшийся же окисленный гомоцистеин циркулирует в форме дисульфида. Только 2% от общего содержания гомоцистеина представляет собой свободную восстановленную форму [27].
Нормальный уровень гомоцистеина плазмы < 10 ммоль/л, значение > 10, но менее < 16 ммоль/л считается легкой степенью гипергомоцистеинемии, при значении > 100 ммоль/л диагностируется тяжелая степень [28].
Гомоцистеин выводится почками в незначительной степени, поскольку в норме через фильтрационный барьер проходит только несвязанная с протеином форма, большая часть которой затем реабсорбируется в канальцах и окисляется до диоксида углерода и сульфата в клетках почек [25].
Кроме того, в почках гомоцистеин транссульфируется в наибольшей степени, и нарушение этого процесса больше всего влияет на повышение уровня гомоцистеина в плазме [18].
Метаболизм гомоцистеина, фолиевой кислоты и витамина В12 при ХБП
У пациентов с ХБП и ТСПН наблюдаются повышенный уровень гомоцистеина по сравнению с населением в целом [8, 29]. Считается, что гипергомоцистеинемия у таких больных спровоцирована нарушением метаболизма гомоцистеина в почках в большей степени, чем снижением скорости клубочковой фильтрации. В действительности, хотя гомоцистеин способен проходить фильтрационной барьер ввиду малой массы молекулы, в крови он циркулирует в основном в протеин-связанной форме (порядка 90% общего объема) [27]. При этом болезнь почек может влиять на метаболические пути транссульфурации и реметилирования. Исследования стабильных изотопов у больных ХБП с сахарным диабетом и без него показали снижение метаболического клиренса гомоцистеина, обусловленное нарушением обоих путей метаболизма [30].
Различные нарушения метаболизма, такие как ацидоз, системное воспаление, сбой гормональной регуляции в сочетании с коморбидностью и комбинированной лекарственной терапией могут стать причиной нарушения пищеварения у пациентов с ХБП и ТСПН и, следовательно, дефицита фолиевой кислоты и витамина В12. Кроме того, отягощающими факторами часто являются такие состояния, как анорексия, гастропарез, снижение перистальтики кишечника или диарея, повышенная проницаемость слизистой оболочки желудочно-кишечного тракта и нарушение микрофлоры кишечника [31, 32].
У пациентов с уремией нарушается метаболизм фолиевой кислоты. Органические и неорганические анионы, чей клиренс снижается при ХБП, ингибируют мембранный транспорт 5-MTHF, ухудшая внедрение в нуклеиновые кислоты и белки. Данные свидетельствуют о том, что при уремии транспорт фолатов снижается, следовательно, даже при их нормальном уровне в плазме интенсивность поглощения фолатов тканями может быть снижена [33]. Действительно, концентрация фолата в плазме не отражает достоверно его содержание в тканях, а скорее свидетельствует о поступлении витамина с пищей за прошедший период времени. Более точный показатель содержания фолатов в организме – их концентрация в эритроцитах. Среди выборки из 112 диализных пациентов Bamonti et al. обнаружили, что уровень фолата плазмы был в пределах нормальных значений только у 37% пациентов, несмотря на то, что его уровень в эритроцитах оказался в пределах нормы в 80% случаев [34].
В ходе некоторых исследований обнаружена взаимосвязь между низкой концентрацией витамина В12 в плазме и высоким индексом массы тела (ИМТ), инсулинорезистентностью, сахарным диабетом 2-го типа, дислипидемией и сердечно-сосудистыми заболеваниями (ССЗ) [35]. В крови витамин В12 преимущественно связан с белком. Около 20% циркулирующего В12 образует комплекс с транскобаламином – это биологически активная форма, которая поступает в клетки. Хотя у пациентов с ХБП уровень транскобаламина повышен, захват тканями витамина В12 понижен [36]. Кроме того, у больных с уремией функциональная недостаточность витамина В12 может быть обусловлена высокой потерей транскобаламина с мочой и снижением его реабсорбции в проксимальных канальцах. Это приводит к «парадоксальному» росту уровня гомоцистеина в клетках на фоне нормального содержания общего В12 [37].
С другой стороны, передозировка В12 способна усугубить течение ХБП. Цианокобаламин, наиболее распространенная форма В12 при медикаментозном лечении, действительно переходит в активный метилкобаламин, выделяя небольшое количество цианидов, чей клиренс снижен ввиду ХБП [34]. В норме метилкобаламин способствует выведению цианидов путем превращения в цианокобаламин. Однако при ХБП сниженный клиренс цианидов препятствует переходу цианокобаламина в активную форму и, следовательно, терапия становится менее эффективной [38].
Оптимальный уровень В12 при ХБП еще предстоит установить. Последующие метаболиты, такие как метилмалоновая кислота и гомоцистеин, возможно, более точно отражают насыщение организма витамином В12 у пациентов с уремией [35].
Гомоцистеин-ассоциированное повреждение тканей
Негативное влияние гипергомоцистеинемии на сердечно-сосудистую систему пациентов с ХБП и ТСПН связано с прогрессирующим течением атеросклероза на фоне уже имеющегося высокого риска поражения сосудов, обусловленного уремическим синдромом. Одним из возможных механизмов является индукция локального окислительного стресса с образованием активных форм кислорода (АФК) за счет тиоловой группы, которая быстро подвергается самоокислению в присутствии кислорода и иона металла. К тому же, гипергомоцистеинемия способствует повышению активности никотинамидадениндинуклеотидфосфат(НАДФ)-оксидазы, что еще больше усиливает образование АФК. Также при гомоцистеинемии нарушается метаболизм оксида азота в клетках эндотелия (включая выделение синтазы оксида азота, место ее выделения, активацию и активность), что наряду с АФК-ассоциированным локальным микровоспалением, ведет к эндотелиальной дисфункции [39].
В культурах клеток эндотелия при гипергомоцистеинемии повышалась продукция моноцитарного хемотаксического протеина -1 (МХП-1) и интерлейкина-8 (ИЛ-8), приводя к адгезии моноцитов на эндотелии [40]. Взаимосвязь между гомоцистеином и факторами воспаления, по-видимому, обеспечивает активированный фактор транскрипции NF-κB (ядерный фактор «каппа-би») [41].
Помимо этого, гипергомоцистеинемия способствует пролиферации гладкомышечных клеток сосудов (ГМКС) за счет стимуляции синтеза молекул адгезии, хемокинов и ГМКС митогенов, приводя к ряду взаимодействий между тромбоцитами, факторами свертываемости и липидами [42], и возможно, к опосредованному фагоцитарными рецепторами поглощению макрофагами окисленных липопротеинов низкой плотности (ЛПНП), запуская процесс образования пенистых клеток и атеросклеротической бляшки [43-46]. Гипергомоцистеинемия также предопределяет ремоделирование сосудов, что включает в себя активацию металлопротеиназы и индукцию синтеза коллагена, за счет чего снижается эластичность сосудов [47].
Аналогичным образом повышенный уровень гомоцистеина в крови может обуславливать эндотелиальный ретикулярный стресс с усилением апоптоза эндотелиальных клеток и воспаления вследствие процесса, запускаемого образованием АФК и активацией NF-κB [48-50]. Известно, что эндотелиоциты очень чувствительны к гипергомоцистеинемии, потому что не синтезируют ни CBS – первый фермент обратной транссульфурации в печени, ни бетаин-гомоцистеин-метилтрансферазу (ВНМТ), которая катализирует дополнительное метилирование в ткани печени, используя бетаин как субстрат [51].
Наконец, N-гомоцистеиниляция протеинов является одним из процессов, ответственных за токсичные свойства гомоцистеина, поскольку она нарушает их функцию и структуру. В случае с ЛПНП гомоцистеиниляция запускает процессы агрегации, аккумуляции холестерола и формирование пенистых клеток. В N-гомоцистеиниляции участвует также фибронектин: эта реакция усиливает ремоделирование внеклеточного матрикса, приводя в дальнейшем к склерозированию [52].
Описано специфическое влияние гипергомоцистеинемии на ткань почки. Гомоцистеин может воздействовать непосредственно на клетки клубочка, запуская процесс склерозирования, а также приводить к поражению почки за счет снижения уровня аденозина в плазме и тканях. Снижение концентрации аденозина плазмы способствует пролиферации ГМКС, усиливая артериальный и гломерулярный склероз. В опытах на крысах на фоне гипергомоцистеинемии вследствие дефицита фолата в пище при окислительном стрессе наблюдался гломерулярный склероз, разрастание мезанглия, дисфункция подоцитов и фиброз. После лечения «Апоцинином», ингибитором НАДФ-оксидазы, состояние клубочков заметно улучшилось [53].
Недостаточность фолиевой кислоты и витамина В12 и повреждение тканей
Фолиевая кислота и витамин В12 продемонстрировали возможность непосредственного влияния на сердечно-сосудистые исходы посредством механизмов, не связанных с уровнем гомоцистеина, но при этом не выявленных [54].
Фолиевая кислота положительно влияет на функции эндотелия без снижения уровня гомоцистеина, что дает альтернативное объяснение ее воздействию на эндотелий, которое, вероятно, обусловлено ее противовоспалительными, антиоксидантными и антиапоптозными свойствами [55-57]. На экспериментальных моделях было показано, что фолиевая кислота улучшает эндотелиальную функцию за счет снижения уровня окислительного стресса и увеличения периода полувыведения NO [17]. Фолиевая кислота, циркулирующая в форме 5-MTHF, способствует резкому улучшению NO-ассоциированного функционирования эндотелиоцитов и снижает образование супероксидазы. Кроме того, 5-MTHF предотвращает окисление ВН4 (тетрагидробиоптерина), усиливая ферментное связывание eNOS (эндотелиальной NO-синтазы), запускающее образование NO. Поскольку 5-MTHF является восстановленной формой фолиевой кислоты и не требует для дальнейшего превращения дигидрофолат-редуктазы, некоторые непосредственные эффекты могут объяснятся окислительно-восстановительными механизмами, не задействованными при пероральном приеме фолиевой кислоты с целью повышения ее концентрации в плазме [58, 59].
Doshi et al. исследовали непосредственное влияние фолиевой кислоты на эндотелиальную функцию у пациентов с коронарной болезнью сердца (КБС), измеряя значение поток-опосредованного расширения (FMD) до и после приема фолиевой кислоты. FMD увеличивалось на протяжении 2 часов параллельно с концентрацией фолиевой кислоты в плазме, при этом уровень гомоцистеина существенно не менялся. Приведенные данные свидетельствуют о том, что фолиевая кислота быстро и благотворно влияет на функцию эндотелия посредством механизма, практически не связанного с метаболизмом гомоцистеина [60]. По результатам работ других авторов, при приеме пациентами с КБС больших доз фолиевой кислоты (5 мг/сут.) функция эндотелия улучшается вне зависимости от уровня гомоцистеина [60-63]. Раннее было описано, что прием 5-MTHF увеличивает выживаемость в отличие от фолиевой кислоты, при этом концентрация гомоцистеина не играет значимой роли [11]. В недавней публикации Pan et al. приводятся данные о том, что при приеме фолиевой кислоты замедляется развитие атеросклероза за счет подавления дедифференциации ГМКС у мышей с недостаточным количеством рецепторов для ЛПВП, получавших корм с высоким содержанием жиров [64].
Что касается витамина В12, у пациентов с хроническим воспалением, например, находящихся на хроническом диализе, снижен синтез транскобаламина II вследствие сниженного поглощения циркулирующего витамина В12 периферическими тканями. Это может привести к повышенному синтезу транскобаламина I и III и последующему накоплению В12 в крови [65-68]. Таким образом, при воспалительных синдромах, несмотря на высокую концентрацию В12 в плазме, в тканях-мишенях сохраняется его дефицит, вероятно приводя к гипергомоцистеинемии и высокому сердечно-сосудистому риску [69].
Касательно анемии, за исключением тех случаев, когда у больных с ХБП и ТСПН наблюдается значительное снижение уровня фолата, дополнительный прием фолиевой кислоты не будет оказывать положительного эффекта ни на эритропоэз, ни на восприимчивость к рекомбинантному человеческому эритропоэтину (рчЭПО). При этом диагностировать фолатную недостаточность у таких пациентов можно только на основании значительного увеличения среднего объема эритроцита или гиперсегментации полиморфноядерных лейкоцитов, особенно у больных с нарушением питания, злоупотреблением алкоголем или сниженной восприимчивостью к рчЭПО. Определение концентрации циркулирующего в плазме фолата не отражает в полной мере его содержания в тканях. Более точную картину дает его содержание в эритроцитах – если это значение низкое, больной нуждается в приеме фолата [70].
У пациентов с ХБП недостаточность фолатов и витамина В12 может выступать в качестве фактора, влияющего на ренальную анемию и сниженную восприимчивость к рчЭПО-терапии. По этой причине до сих пор ведутся дискуссии о необходимости и возможности проведения такой терапии [71].
На рис. 2 показаны пути развития атеросклероза и воспаления под влиянием гипергомоцистеинемии у пациентов с ХБП.
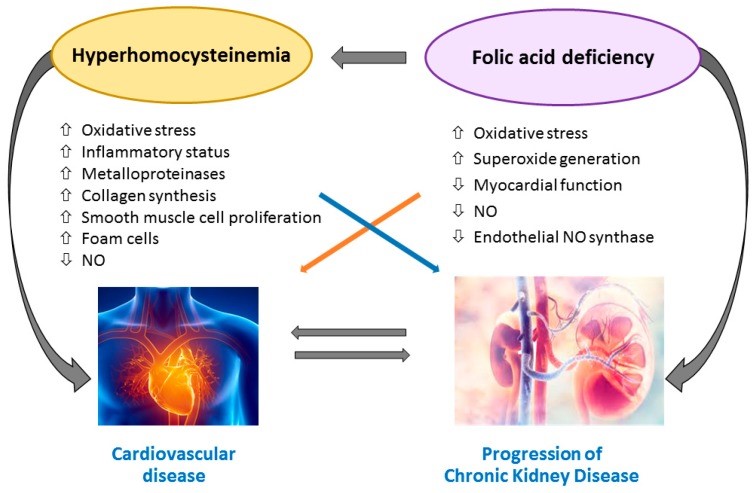
Рисунок 2. Развитие атеросклероза и воспаления, индуцированного гипергомоцистеинемией у пациентов с хронической болезнью почек (ХБП). Условные обозначения: NO, оксид азота
Полиморфизм гена MTHFR
MTHFR играет ведущую роль в метаболизме фолата и гомоцистеина, катализирует переход 5,10–метенилтетрагидрофолата в 5- MTHF, основную циркулирующую форму фолата [72]. Описано несколько видов полиморфизма гена MTHFR, некоторые из которых, по-видимому, влияют на индивидуальную предрасположенность к заболеваниям, ассоциированным с нарушением метаболизма гомоцистеина, например, инфаркт миокарда, инсульт, нейродегенеративные заболевания, аутоиммунные заболевания, онкология, сахарный диабет, врожденные пороки развития и болезни почек [73].
Наиболее характерным является функциональный полиморфизм одиночных нуклеотидов в положении 677, (MTHFR 677 С > T), в положении 1298 (MTHFR 1298 A > С), в положении 1317 (MTHFR 1317 T > С) и в положении 1793 (MTHFR 1793 G > A) [74].
Хотя в ряде исследований связь между генотипом MTHFR 677 C > T и долгосрочным почечным исходом не обнаружена [75], тем не менее, полиморфизм MTHFR 677 C > T сопряжен с повышением сердечно-сосудистого риска у больных с ТСПН [76]. В исследовании Trovato et al., проведенном в 2015 г. с участием 630 мужчин белой расы из Италии, выявлена низкая частота встречаемости полиморфизма MTHFR 677 C > T и A1298 A > C у больных с ТСПН, находящихся на хроническом гемодиализе, что предполагает наличие протективного свойства этих вариантов генов в отношении функции почек [77].
Несмотря на то, что основная функция фермента MTHFR – регуляция способности 5-MTHF к реметилированию гомоцистеина, влияние функциональных вариантов MTHFR-генов не может ограничиваться только повышенным уровнем гомоцистеина. В то время как прием фолата доказательно снижает уровень гомоцистеина в общей популяции, у пациентов с ТСПН наблюдается резистентность даже к высоким дозам фолата [78]. У больных, находящихся на гемодиализе, данные об эффекте приема фолата и витамина В12 противоречивы, возможно вследствие полиморфизма MTHFR-генов [79].
В недавнем проспективном исследовании с выборкой из 132 пациентов, находящихся на гемодиализе, Anchour et al. изучали способность фолиевой кислоты снижать уровень гомоцистеина с учетом полиморфизма MTHFR. Авторы установили, что генотип MTHFR 677 С > T влияет на восприимчивость к витаминам группы В, что соответствует результатами предыдущих исследований [79-86]. В сущности, одновременный прием В12 и фолата оказался эффективным только у лиц, гомозиготных по С-аллелю, а снижение уровня гомоцистеина оказалось наиболее значимым при генотипе ТТ [84].
Согласно другим публикациям, снижение концентрации гомоцистеина наиболее выражено у носителей генотипа СС, чем у носителей СТ и ТТ [82]. В дополнительном исследовании CSPTT (Китайское исследование по первичной профилактике инсульта) сравнивалась эффективность комбинированного назначения ингибиторов ангиотензинпревращающего фермента (АПФ) и фолиевой кислоты с монотерапией АПФ для снижения риска нарушения функционирования почки у пациентов с артериальной гипертензией без обогащения рациона фолиевой кислотой. Из 15104 участников 7545 принимали эналаприл в дозировке 10 мг и фолиевую кислоту в дозировке 0,8 мг, при этом наименьшие показатели гомоцистеина плазмы наблюдались у ТТ-гомозиготных лиц с полиморфизмом 677 C > T, по сравнению с другими генотипами (СС/СТ) [87].
Подводя итог вышесказанному, отметим, что большинство полученных данных свидетельствуют о вероятном участии полиморфизма генов MTHFR в регулировании восприимчивости к терапии витамином В12 и фолиевой кислотой для снижения уровня гомоцистеина и сердечно-сосудистого риска у диализных пациентов с ХБП и ТСПН. Однако является ли это основанием для рутинных исследований, остается предметом для дискуссии.
Роль фолиевой кислоты, витамина В12 и гомоцистеина в качестве маркеров сердечно-сосудистого риска
Несмотря на то, что гипергомоцистеинемия на протяжении многих лет считалась фактором сердечно-сосудистого риска, в последние годы ее связь с ССЗ и смертностью находится под сомнением, а литературные данные по этому вопросу противоречивы [7, 89, 90]. Эпидемиологические исследования и исследования методом случай-контроль в большинстве своем подтверждают наличие зависимости между повышенной концентрацией гомоцистеина в плазме и высокой частотой возникновения ССЗ и инсульта, в то время как проспективные, рандомизированные и плацебо-контролируемые исследования такой связи не выявляют [7].
Кроме того, все еще существуют разногласия в отношении необходимости проведения рутинного исследования гипергомоцистеинемии и ее лечения в общей популяции [7].
У пациентов с ХБП и ТСПН, несмотря на повышенный уровень гомоцистеина (в общей популяции в среднем около 10-15 ммоль/л, при уремии 25-35 ммоль/л), его значение как фактора риска сердечно-сосудистых событий и смертности по-прежнему не определено - многочисленные ретроспективные и интервенционные исследования предоставляют противоречивые результаты [8-12].
Согласно данным метаанализа, включающего ретроспективные исследования, проспективные наблюдательные и интервенционные исследования (всего 5123 участника), повышенная концентрация гомоцистеина в крови считается фактором риска как ССЗ, так и смертности у пациентов с ТСПН, не принимающих фолиевую кислоту [10].
По данным проспективных исследований, включенных в метаанализ, у пациентов с ТСПН, не принимающих фолиевую кислоту, повышение концентрации гомоцистеина на 5 ммоль/л увеличивает риск общей смертности на 7% и риск возникновения сердечно-сосудистых событий на 9% [10]. Напротив, в проспективном когортном исследовании с участием 341 диализного пациента установить взаимосвязь между исходным уровнем гомоцистеина, полиморфизмом MTHFR и смертностью не удалось [11].
Можно предположить, что в основе упомянутых разногласий лежит неоднородность выборки, временное несоответствие между конкурентными факторами риска и влиянием общих осложнений, таких как воспаление и белково-энергетическая недостаточность (БЭН), которые могли бы влиять на циркулирующие формы гомоцистеина и оказывать влияние на неблагоприятные исходы [9].
Отмечена также отрицательная корреляция между уровнем гомоцистеина и сердечно-сосудистыми исходами у пациентов с поздними стадиями ХБП и находящимися на гемодиализе, создающая феномен под названием «обратная эпидемиология», который включает в себя и другие факторы риска, в частности индекс массы тела (ИМТ), холестерин сыворотки крови и артериальное давление [91]. Некоторые данные свидетельствуют о том, что БЭН и воспаления могут подтвердить наличие обратной связи между уровнем гомоцистеина и клиническими исходами ХБП и ТСПН [34-37]. Точнее говоря, двумя исследованиями подтверждено, что у пациентов с крайне низкой концентрацией гомоцистеина плазмы наблюдались наиболее неблагоприятные исходы, что выражалось в высокой частоте госпитализации и смертности [92, 93].
Вышеизложенные данные ставят под сомнение роль гомоцистеина как фактора сердечно-сосудистого риска и смертности у пациентов с ХБП и ТСПН, наталкивая на мысль о том, что помимо повышенного уровня гомоцистеина, дополнительно задействованы и другие механизмы. Принимая во внимание, что одной из важнейших мишеней гипергомоцистеинемии является ДНК-метилтрансфераза, можно предположить, что в повреждении тканей, обусловленном гипергомоцистеинемией, задействованы эпигенетические процессы [12].
Не так давно Sohoo et al. провели ретроспективное исследование с большой когортой больных, находящихся на гемодиализе, с целью изучения взаимосвязи между исходным уровнем фолиевой кислоты и В12 и общей смертностью по итогам пятилетнего периода наблюдения (9517 пациентов в группе с фолиевой кислотой и 12 968 пациентов в группе с В12). По результатам данного исследования, более высокий уровень В12 (550 пг/мл) был связан с более высоким риском смертности при корректировке на социально-демографические и лабораторные показатели, в то время как низкая концентрация фолата (< 6,2 нг/мл) сама по себе оказалась сопряжена с более высокой общей смертностью. Авторы подчеркивают, что дополнительная корректировка на нарушение питания, воспалительный процесс и другие клинические и лабораторные показатели сводит к нулю взаимосвязь между уровнем фолата и общей смертностью [15].
В предыдущей публикации приведены данные об улучшении показателей выживаемости пациентов на гемодиализе, принимавших 5-MTHF, по сравнению фолиевой кислотой, несмотря на отсутствие значимой разницы в уровнях гомоцистеина в обеих группах, что позволяет поднять вопрос о том, не обладает ли 5-MTHF какими-либо особыми свойствами, помимо способности снижать концентрацию гомоцистеина. Текущие выводы о том, что повышение уровня СРБ связано со смертностью, позволяют предположить, что эффект обусловлен снижением воспалительной активности [11]. Следовательно, возникает вопрос, имеет ли снижение гомоцистеина какие-либо преимущества, и на сколько гомоцистеин действительно влияет на риск развития сердечно-сосудистых событий (таблица 1).
Таблица 1. Ретроспективные и проспективные обсервационные исследования, посвященные гипергомоцистеинемии и недостаточности фолиевой кислоты / витамина В12 у пациентов с ХБП и терминальной стадией почечной недостаточности (ТСПН)
Условные обозначения: ССЗ - сердечно-сосудистое заболевание; ИМ - инфаркт миокарда; ГЛЖ - гипертрофия левого желудочка; ДЛЖ - дисфункция левого желудочка; ГГц - гипергомоцистеинемия; ГД - гемодиализ; ПД - перитонеальный диализ; ХБП - хроническая болезнь почек; ХВРП - хроническое состояние воспаления – нарушение питания.
Влияние приема фолиевой кислоты и витамина В12 на риск ССЗ и смертности у пациентов с ХБП и ТСПН
Говоря о приеме фолиевой кислоты и витамина В12, следует отметить, что влияние этих витаминов на снижении смертности и предотвращение развития ТСПН до сих пор не установлено.
Кроме того, для этой категории пациентов до сих не определены эффективные дозировки фолиевой кислоты и В12. Им назначают от 2,5 до 5 мг фолиевой кислоты три раза в неделю до более чем 15 мг/сутки. Доказано, что одновременное внутривенное введение витаминов группы В более эффективно снижает уровень гомоцистеина в крови и способствует процессу реметилирования у пациентов с ТСПН [116].
На основании одногодичного плацебо-контролируемого открытого рандомизированного исследования с выборкой из 81 пациента, находящихся на хроническом гемодиализе, Righetti et al. сделали вывод об отсутствии положительного эффекта приема фолиевой кислоты на показатель выживаемости по сравнению с плацебо, при этом нормальный уровень гомоцистеина был достигнут только у 12% больных [117]. В мультицентровом исследовании Wrone et al. с участием 510 пациентов, находящихся на хроническом диализе, которые были случайным образом разделены на группы приема 1, 5 и 15 мг/день фолиевой кислоты, разницы в показателях смертности и сердечно-сосудистых событий не обнаружено [76].
В двойном слепом плацебо-контролируемом исследовании ASFAST (Исследование сердечно-сосудистой заболеваемости и смертности у пациентов с атеросклерозом при приеме фолиевой кислоты) с рандомизированной выборкой из 315 пациентов с ХБП, находящихся на диализе (с рСКФ < 25 мл/мин.) больные принимали фолиевую кислоту в дозировке 15 мг/день, либо плацебо. По итогам среднего периода наблюдения, составившего 3,6 года, влияние терапии с назначением фолиевой кислоты на общую смертность, сердечно-сосудистую смертность и прогрессирование атеромы (увеличения толщины интима-медиа сонной артерии) не выявлено [118].
Исследование HOST (Гомоцистеинемия при заболевании почек и терминальной стадии почечной недостаточности) – это двойное слепое плацебо-контролируемое исследование с участием 2056 пациентов с поздней стадией ХБП или ТСПН на почечно-заместительной терапии и с повышенным уровнем гомоцистеина в крови, которые случайным образом разделены на группы с комбинированной терапией фолиевой кислотой, витамином В12 и пиридоксином или плацебо. По итогам среднего периода наблюдения, который составил 3,2 года, отмечено значительное снижение уровня гомоцистеина, но основная конечная точка (снижение общей смертности) и вторичные конечные точки (снижение сердечно-сосудистой смертности, частоты ампутаций и тромбозов сосудистого доступа) не были достигнуты. Возможным объяснением таких отрицательных результатов может быть высокая сердечно-сосудистая коморбидность и субоптимальное соблюдение режима лечения. Кроме того, пациенты с ХБП и ТСПН составляли единую популяцию, то есть эти две категории больных не оценивались по отдельности. Несоответствие результатов данного исследования ранее опубликованным эпидемиологическим данным может служить отражением лимитирующих факторов обсервационных исследований [119].
В недавно проведенном мультицентровом исследовании Heinz et al. участвовали 650 пациентов, находящихся на хроническом гемодиализе, случайным образом разделенных на группы приема 5 мг фолиевой кислоты, 50 мкг витамина В12 и 20 мг витамина В6 в сравнении с плацебо, три раза в неделю (в день после диализа) в течение 2 лет. Разница в показателях общей смертности, летальных и нелетальных сердечно-сосудистых событий между двумя группами не установлена. С другой стороны, по результатам апостериорного анализа, выявлено значительное снижение частоты нестабильной стенокардии и манипуляций по васкуляризации [120].
В метаанализе Heinz et al., включавшем пять интервенционных исследований с участием в общей сложности 1642 пациентов на хроническом диализе, принимавших фолиевую кислоту, витамин В12 и витамин В6, выявлено значительное снижение риска возникновения ССЗ, но не смертности [10]. В другом метаанализе с участием 3866 пациентов с ТСПН и прогрессирующей ХБП (клиренс креатинина < 30 мл/мин.) оценивалась связь между приемом фолиевой кислоты (в сочетании с витаминами В6 и В12 или без него) и ССЗ. Прием фолиевой кислоты снижал сердечно-сосудистый риск на 15% у пациентов с ТСПН, особенно при продолжительности приема более 24 месяцев и с минимальным потреблением злаков [121].
Ji et al. провели масштабный метаанализ, состоящий из 14 РКИ (54 913 участников), в котором наблюдалось снижение частоты инсультов в результате снижения уровня гомоцистеина на фоне приема фолиевой кислоты, витаминов В12 и В6. Снижение частоты инсультов наблюдалось также в подгруппе с ХБП [122]. Согласно метаанализу, состоящему из 10 исследований, гомоцистеин-снижающая терапия не связана со значительным снижением риска сердечно-сосудистых событий, инсультов и общей смертности у пациентов с ХБП. Следует обратить внимание на то, что по сравнению с предыдущим метаанализом, в данном исследовании участвовало большое количество пациентов с сахарным диабетом и РКИ были проведены в районах с высоким потреблением злаков местным населением [123]. Совсем недавно был проведен метаанализ из шести исследований (включая вышеупомянутые) с участием 2452 больных, находящихся на хроническом диализе, в ходе которого не обнаружена существенная разница между смертностью и частотой сердечно-сосудистых событий среди пациентов, получавших гомоцистеин-снижающие препараты [124].
Наконец, многочисленные апостериорные анализы свидетельствуют о том, что влияние приема фолиевой кислоты и витамина В12 на сердечно-сосудистый риск зависит от ряда факторов, таких как возраст, исходная концентрация гомоцистеина, потребление фолиевой кислоты со злаками, уровень В12, функция почек, сопутствующие заболевания и прием лекарств.
В таблице 2 представлены сводные данные интервенционного исследования, посвященного влиянию приема фолиевой кислоты и витамина В12 на риск ССЗ, смертность и прогрессирующее течение ХБП.
Таблица 2. Исследование взаимосвязи между приемом фолиевой кислоты и витамина В12 и риском ССЗ, смертностью и прогрессирующим течением ХБП
Условные обозначения: ХБП - хроническая болезнь почек; ССЗ - сердечно-сосудистое заболевание; рСКФ - расчетная скорость клубочковой фильтрации; РКИ - рандомизированное клиническое исследование.
Насколько известно, публикации проспективных исследований, посвященных изучению влияния витамина В12 на сердечно-сосудистые и почечные исходы у пациентов с ХБП и ТСПН отсутствуют.
Подводя итог, следует отметить, что, хотя доступные в настоящее время исследования указывают на снижение гомоцистеина на фоне проводимой терапии (фолиевой кислотой, витамином В12 и витамином В6), в большинстве случаев положительное влияние на показатели смертности и частоту сердечно-сосудистых событий среди пациентов с ХБП и ТСПН не выявлено. Более того, положительный эффект может зависеть от противовоспалительных и сосудистых защитных эффектов.
Фолиевая кислота и витамин В12: влияние на прогрессирование ХБП
Что касается взаимосвязи между потреблением фолиевой кислоты, витамина В12 и прогрессирующим течением ХБП, проведенные интервенционные исследования свидетельствуют об отсутствии очевидного положительного эффекта, и даже о наличии отрицательного влияния на состояние почек [15]. При этом, согласно обсервационным исследованиям, существует корреляция между гипергомоцистеинемией и риском развития и прогрессированием ХБП [129].
CSPTT (Китайское исследование по первичной профилактике инсульта) представляет собой масштабное РКИ (20 702 пациента), в котором участвовали взрослые пациенты с артериальной гипертензией, без инсульта или инфаркта миокарда в анамнезе, с установленным генотипом MTHFR и известным исходным уровнем фолата. Целью данного исследования была оценка эффекта приема фолиевой кислоты у пациентов из Азии, не употребляющих фолиевую кислоту с продуктами питания. Авторы выяснили, что комбинированная терапия ингибиторами АПФ в сочетании с фолиевой кислотой снижает риск инсульта в сравнении с монотерапией ингибиторами АПФ. Кроме того, у лиц с генотипами MTHFR СС и СТ, наблюдался наиболее высокий риск инсульта и наиболее эффективный ответ на потребление фолиевой кислоты, в то время как при генотипе ТТ для достижения приемлемых результатов требовались наиболее высокие дозировки фолиевой кислоты [80].
В почечном подисследовании CSPPT (Китайское исследование по первичной профилактике инсульта) сравнивалась эффективность комбинированной терапии эналаприлом в сочетании с фолиевой кислотой и монотерапии эналаприлом для снижения риска нарушения функции почки в масштабной выборке больных с гипертензией (15 104 пациента). В исследовании участвовали больные с рСКФ более 30 мл/мин., которые были случайным образом разделены на группы приема эналаприла, 10 мг и фолиевой кислоты, 0,8 мг и только эналаприла, 10 мг. По итогам четырехлетнего наблюдения в группе приема эналаприла и фолиевой кислоты наблюдалось снижение риска прогрессирующего течения ХБП на 21% и замедление снижения рСКФ на 10%. Кроме того, авторы провели подгрупповой анализ сравнения пациентов с ХБП (рСКФ < 60 мл/мин. или наличие протеинурии) и без нее на начальном этапе. Выяснилось, что наличие ХБП является сильнейшим модификатором эффекта терапии [85]. Более того, наибольшее снижение уровня гомоцистеина наблюдалось у ТТ-гомозигот при типе полиморфизма MTHFR 677 C>T, а при генотипах СС/СТ показатель снижения не был таким значительным. Наконец, в ходе эксплораторного анализа подгрупп, целью которого являлась оценка влияния терапевтического эффекта на основные исходы в различных подгруппах у пациентов с ХБП, выявлено, что снижение риска прогрессирования ХБП наиболее выражено у больных с сахарном диабетом [87]. Это исследование стало первым, доказывающим ренопротективный эффект назначения фолиевой кислоты у пациентов, не получавших ее с пищей. В предыдущих исследованиях отмечалось отсутствие эффекта или негативное влияние приема фолиевой кислоты и витамина В12 [15, 118].
Согласно вышеупомянутому исследованию HOST, лечение большими дозами фолиевой кислоты, витамином В6 и витамином В12 оказалось неэффективным с точки зрения увеличения бездиализного периода у пациентов с прогрессирующей ХБП [15].
В двойном слепом РКИ – DIVINe (Витаминотерапия у диабетических пациентов и регрессирование нефропатии) – участвовали 238 пациентов с диабетическим поражением почки, которые были случайным образом разделены на группы приема 2,5 мг фолиевой кислоты в сочетании с 25 мг витамина В6 и 1 мг витамина В12 или плацебо (средняя рСКФ составляла 64 мл/мин. в исследуемой группе и 58 мл/мин. в группе плацебо). По итогам 2,6-летнего периода наблюдения [125] прием фолиевой кислоты, витаминов В6 и В12 ведет к большему снижению СКФ и росту частоты сердечно-сосудистых событий по сравнению с плацебо. Причин для таких исключительных результатов может быть несколько. Прежде всего, исходный уровень фолиевой кислоты отличался от показателей других исследований (7,7 нг/мл в CSPPT, 15 и 16,5 нг/мл в DIVINe и HOST, соответственно), поэтому можно предполагать, что положительный эффект от приема фолиевой кислоты наиболее выражен у тех пациентов, у которых уровень ее в крови был изначально ниже. Кроме того, может иметь значение дозировка витамина В, о чем свидетельствует более высокий уровень фолата в крови (2000 нг/мл) в исследовании HOST по сравнению с CSPTT (23 нг/мл). На основании этого можно судить о вероятной токсичности неметаболизированной фолиевой кислоты при ее накоплении в кровяном русле [85]. Наконец, степень тяжести ХБП в исследованиях была различной. Действительно, в исследовании HOST участвовали пациенты с прогрессирующей ХБП и большим количеством сопутствующих заболеваний, что, безусловно, могло повлиять на результаты исследования в отношении почечных исходов. Результаты CSPTT подисследования, свидетельствующие об эффективности терапии фолиевой кислотой в отношении замедления прогрессирующего поражения почки, могут быть обусловлены особенностью выборки пациентов, у которых была диагностирована начальная или умеренно выраженная стадия ХБП. Кроме того, только в CSPPT исследовании участвовали пациенты, не потребляющие фолиевую кислоту с продуктами питания, в то время как два других исследования проводились в странах с разработанными программами употребления фолиевой кислоты с пищей.
Стоит также отметить недавнее исследование с участием 630 пациентов белой расы из Италии, где зафиксирована низкая частота полиморфизма MTHFR 677 C > T и A1298 A > C у больных, находящихся на гемодиализе, по сравнению с теми пациентами, у кого диагностировано легкое или умеренное нарушение функции почки. Этот факт может свидетельствовать о протективных свойствах указанных генотипов [39].
Подводя итоги, следует отметить, что представленные результаты исследований влияния гомоцистеин-снижающей терапии на развитие ХБП противоречивы, и, следовательно, необходимо проведение дальнейших исследований с гомогенной выборкой и прогрессирующим течением ХБП в качестве основной первичной конечной точки. Пока не получены новые подтверждающие данные, представляется целесообразным лечение пациентов с дефицитом фолиевой кислоты с целью снижения риска дальнейшего развития ХБП, при этом избегая токсичных проявлений при ее накоплении.
Прием фолиевой кислоты и витамина В12 пациентами с пересаженной почкой
У пациентов с пересаженной почкой на сердечно-сосудистый риск может оказывать влияние ряд специфических факторов, таких как длительная история гемодиализа, иммуносупрессия, хроническое воспаление и метаболические нарушения [130].
После пересадки почки часто наблюдается некоторое снижение уровня гомоцистеина в крови; однако, как правило, гипергомоцистеинемия все же сохраняется [131-133]. Установлено, что концентрация гомоцистеина может снижаться в дальнейшем на фоне приема пациентами больших доз витаминов группы В [134]. В исследовании FAVORIT (Фолиевая кислота для снижения риска сосудистых исходов при трансплантации) изучалось влияние прима фолиевой кислоты на сердечно-сосудистый риск и смертность. Реципиенты донорской почки в стабильном состоянии были случайным образом разделены на группы ежедневного приема мультивитаминных комплексов с большим содержанием фолиевой кислоты (5,0 мг), витамина В12 (1,0 мг) и витамина В6 (50 мг) или плацебо. Исследование было прекращено досрочно, так как промежуточный анализ не выявил разницы между группами по частоте сердечно-сосудистых событий, общей смертности, необходимости начала диализной терапии несмотря на снижение уровня гомоцистеина крови [135].
Недавно проведенное долговременное дополнительное исследование FAVORIT показало, что прием больших доз витаминов группы В ведет к умеренному улучшению когнитивных функций у пациентов с изначально высоким их уровнем. Необходимо отметить, что практически ни у кого из участников исследования не отмечалось дефицита фолатов или В12, поэтому говорить об улучшении когнитивной функции на фоне приема фолата и В12 у пациентов с низким содержанием витаминов группы В пока не актуально [136].
Выводы
На сегодняшний день убедительные данные, доказывающие, что гипергомоцистеинемия, нарушения обмена фолиевой кислоты и витамина В12 являются надежными маркерами сердечно-сосудистой патологии и риска смертности у пациентов с ХБП и ТСПН, отсутствуют. Более того, эти факторы нельзя назвать терапевтическими мишенями для снижения сердечно-сосудистого риска и дальнейшего развития ХБП.
Пока не получены данные подтверждающих исследований, считается целесообразным применение фолиевой кислоты в виде монотерапии или в сочетании с витамином В12 в качестве адьювантного лечения пациентов с ХБП.
На ранних стадиях ХБП, когда не рекомендовано ограничение потребления калия и фосфора в пище, фолиевая кислота может поступать в организм с продуктами питания, являющимися природными источниками фолатов. При прогрессирующей ХБП и проведении гемодиализа фолиевая кислота может назначаться в виде фармакологических препаратов под контролем ее концентрации.
Источники
Опубликовано онлайн 13 февраля 2019 г.
Irene Capelli, Giuseppe Cianciolo, Lorenzo Gasperoni, Fulvia Zappulo, Francesco Tondolo, Maria Cappuccilli, Gaetano La Manna
Patients affected by chronic kidney disease (CKD) or end-stage renal disease (ESRD) experience a huge cardiovascular risk and cardiovascular events represent the leading causes of death. Since traditional risk factors cannot fully explain such increased cardiovascular risk, interest in non-traditional risk factors, such as hyperhomocysteinemia and folic acid and vitamin B12 metabolism impairment, is growing. Although elevated homocysteine blood levels are often seen in patients with CKD and ESRD, whether hyperhomocysteinemia represents a reliable cardiovascular and mortality risk marker or a therapeutic target in this population is still unclear. In addition, folic acid and vitamin B12 could not only be mere cofactors in the homocysteine metabolism; they may have a direct action in determining tissue damage and cardiovascular risk. The purpose of this review was to highlight homocysteine, folic acid and vitamin B12 metabolism impairment in CKD and ESRD and to summarize available evidences on hyperhomocysteinemia, folic acid and vitamin B12 as cardiovascular risk markers, therapeutic target and risk factors for CKD progression.
Keywords: cardiovascular disease, chronic kidney disease, end-stage renal disease, hyperhomocysteinemia, folic acid, vitamin B12
Введение
Продолжительность жизни больных с хронической болезнью почек (ХБП) и терминальной стадией почечной недостаточности (ТСПН) меньше, чем у лиц с ненарушенной функцией почек, прежде всего, вследствие увеличения смертности от сердечно-сосудистых событий [1]. При хроническом гемодиализе риск преждевременной смерти в 10–50 раз превышает таковой среди населения в целом, и основной причиной летального исхода у этой категории пациентов являются сердечно-сосудистые заболевания (ССЗ) [2, 3]. Впрочем, развитие сердечно-сосудистых событий возможно и на ранних стадиях ХБП [4].
Согласно рандомизированным клиническим исследованиям (РКИ), у данной категории больных традиционные факторы риска по Фрамингемской шкале (артериальная гипертензия, дислипидемия и сахарный диабет) являются незначительными факторами сердечно-сосудистого риска. Таким образом, все большее внимание уделяется нетрадиционным факторам сердечно-сосудистого риска, включающим окислительный стресс, эндотелиальную дисфункцию, хроническое воспаление, кальцификацию сосудов, как проявление минеральных и костных нарушений при хронической болезни почек (МКН-ХБП), а также гипергомоцистеинемию [5].
«Гомоцистеиновая гипотеза» получила распространение после того, как было установлено, что пациенты с очень высоким уровнем гомоцистеина в крови ввиду врожденных нарушений метаболизма гомоцистеина подвержены более агрессивному течению атеросклероза. Поэтому на протяжении нескольких лет проводятся исследования с целью выявления возможной связи между повышением (даже незначительным) уровня гомоцистеина и сердечно-сосудистым риском и смертностью. Результаты научных работ неоднозначны [6, 7].
Хотя у больных с ХБП и ТСПН повышен уровень гомоцистеина, до сих пор остается неясным, насколько гипергомоцистеинемию можно считать фактором риска сердечно-сосудистых заболеваний и смертности у таких пациентов. Данный вопрос требует проведения дальнейших исследований [8-12].
Кроме того, высокий показатель распространенности повышенного уровня гомоцистеина в крови у пациентов с ХБП привлекает внимание ученых к гипергомоцистеинемии как фактору риска прогрессирующего течения ХБП [13, 14].
Значение фолиевой кислоты и витамина В12 хорошо известно, поскольку они являются не только основными кофакторами метаболизма гомоцистеина, но и нарушение их гомеостаза может непосредственно повышать сердечно-сосудистый риск и приводить к прогрессирующему течению ХБП [11, 15].
Целью данного обзора является обобщение данных о фолиевой кислоте, витамине В12 и метаболизме гомоцистеина у пациентов с ХБП, а также анализ опубликованных данных о дефиците фолиевой кислоты и витамина В12 как маркере сердечно-сосудистого риска и терапевтической мишени у пациентов с ХБП и ТСПН.
Витамины группы В и метаболизм гомоцистеина
Витамины группы В, в частности витамин В9 (фолат) и В12 (кобаламин) – водорастворимые витамины, обеспечивающие нормальную функцию клетки: они являются источником углерода для синтеза пуринов, пиримидинов и нуклеопротеинов, а также играют ведущую роль в эритропоэзе [16].
Фолиевая кислота является производным полиглутамата, который расщепляется в кишечнике до моноглутамата и затем проникает в кровь через эпителий слизистой кишечника при участии специфических транспортеров. Циркулирующая форма фолиевой кислоты носит название 5-метилтетрагидрофолат (5- MTHF) [17].
Витамин В12, поступает в организм в составе кобаламина, который образует комплекс с гаптокоррином слюны. Резкое высвобождение витамина из кобаламина происходит в двенадцатиперстной кишке под воздействием панкреатических протеаз. Затем кобаламин связывается с желудочным мукопротеидом, секретируемым париетальными клетками стенки желудка: когда образовавшийся комплекс поступает в дистальный отдел подвздошной кишки, он путем эндоцитоза проникает в энтероцит под воздействием кубилина. На следующем этапе кобаламин попадает в плазму с помощью транспортного белка транскобаламина [16]. В12 проходит через клубочковый фильтр, хотя потеря его с мочой незначительна вследствие реабсорбции в проксимальных канальцах.
В тканях-мишенях кобаламин метаболизируется в две активные формы: аденозилкобаламин в митохондриях и метилкобаламин в цитозоле. Метилкобаламин представляет собой метил-транспортирующий кофактор энзим-метионин-синтетазы, которая обеспечивает реметилирование гомоцистеина и его переход в метионин [17].
Гомоцистеин – тиолсодержащая аминокислота, не участвующая в синтезе протеинов и являющаяся звеном метаболизма метионина. Уровень гомоцистеина в плазме зависит от ряда факторов, таких как генетические изменения в белках, участвующих в метаболизме метионина, или дефицит витамина В12, витамина В6 и фолиевой кислоты [18].
Метионин переходит в S-аденозилметионин (SAM), а затем конвертируется в S-аденозилгомоцистеин (SAH) посредством химической реакции, катализатором которой является метионинсинтетазредуктаза (MTRR). SAM – один из важнейших доноров метильной группы, который образуется в митохондриях и является кофактором мутазы, известной как метилмалонил КоА мутаза. Этот фермент превращает метилмалонил КоА в сукцинил КоА, что является ключевым звеном в катаболизме различного вида аминокислот и жирных кислот. Для этих процессов также необходим пиридоксин (витамин В6) в качестве кофактора [18].
Гомоцистеин – конечный продукт гидролиза SAH при его распаде на гомоцистеин и аденозин. Метаболизм гомоцистеина осуществляется двумя путями: реметилирование и транссульфурация (рис. 1А). При реметилировании метионин образуется в результате реакции, катализатором которой выступает метионин-синтаза (MTS), для которой в качестве кофакторов необходимы фолат и витамин В12. Поскольку фолат не является биологически активной формой, происходит его превращение в тетрагидрофолат, а затем в метилентетрагидрофолат (MTHF) под воздействием фермента метилентетрагидрофолат-редуктазы (MTHFR) [19].

Рисунок 1. Метаболизм гомоцистеина в норме (А) и при заболевании почек (В).
CSE: цистатионин-гамма-лиаза; CBS: цистатионин-бета-синтаза
| A. Physiological conditions | А. Нормальная физиология |
| Pyruvate + H2S | Пируват + H2S |
| Serine + H2S | Серин + H2S |
| Cysteine | Цистеин |
| α - ketobutyrate | α – кетобутират |
| Homocysteine | Гомоцистеин |
| Vit B6 | Вит. В6 |
| Transsulfuration pathway | Транссульфурация |
| CSE | CSE |
| Cystathionine | Цистатионин |
| CBS | CBS |
| Serine | Серин |
| Homoserine | Гомосерин |
| S-adenosyl homocysteine (SAH) | S-аденозилгомоцистеин (SAH) |
| Methionine synthase reductase (MTRR) | Метионинсинтетаз-редуктаза |
| S-adenosyl methionine (SAM) | S-аденозилметионин (SAM) |
| Methionine | Метионин |
| Methionine synthase | Метионин-синтаза |
| Vit B12 | Вит. В12 |
| 5,10 – methenyltetrahydrofolate | 5,10-метенилтетрагидрофолат |
| MTHF reductase | MTHF-редуктаза |
| 5- methenyltetrahydrofolate (5-MTHF) | 5- метенилтетрагидрофолат (5-MTHF) |
| Tetrahydrofolate (THF) | Тетрагидрофолат (THF) |
| Folic acid | Фолиевая кислота |
| B. Renal disease | Б. Болезнь почек |
Другой путь метаболизма гомоцистеина осуществляется посредством транссульфурации. В начале, под воздействием цистатионин-бета-синтазы (СBS), гомоцистеин связывается с серином, образуя цистатионин, который гидролизируется до цистеина и α-кетобутирата под воздействием цистатионин-γ-лиазы (СТН). У человека CBS образуется в печени, почках, мышцах, головном мозге и яичниках, а на ранних стадиях эмбриогенеза - в нервной и сердечной ткани [20].
Атом серы в составе сульфана или гидросульфида (H2S) может участвовать в В12-зависимом переносе метильной группы [21, 22]. Нарушение метилирования ведет к снижению метилирования протеинов и ДНК, что в конечном счете приводит к нарушению пролиферации мышечных клеток и повышению перекисного окисления липидов [23]. Сера – побочный продукт перехода гомоцистеина в цистеин под действием CBS и цистатионин-гамма-лиазы (CSE). H2S – ангиогенный агент с антиоксидантными и вазорелаксирующими свойствами. Кроме того, H2S выступает в качестве эндогенного газового медиатора, подобно оксиду азота (NO) и монооксиду углерода [24], который участвует в ряде физиологических процессов, в частности расслабляет гладкомышечные клетки сосудистой стенки, ингибирует их пролиферацию и снижает артериальное давление [25]. По данным Li et al., нарушение метаболизма H2S может привести к развитию ассоциированного с уремией прогрессирующего атеросклероза у пациентов с ХБП и диабетической нефропатией [26]. У больных с ХБП и ТСПН отмечается пониженный уровень H2S в плазме, что может объясняться снижением количества CBS и CSE вследствие гипергомоцистеинемии (рис. 1В). Оказывают ли еще какие-либо факторы влияние на данное состояние, пока неизвестно [21].
В крови гомоцистеин может определяться в восстановленной и окисленной форме: более 90% общего гомоцистеина плазмы окислено и связано с протеинами, оставшийся же окисленный гомоцистеин циркулирует в форме дисульфида. Только 2% от общего содержания гомоцистеина представляет собой свободную восстановленную форму [27].
Нормальный уровень гомоцистеина плазмы < 10 ммоль/л, значение > 10, но менее < 16 ммоль/л считается легкой степенью гипергомоцистеинемии, при значении > 100 ммоль/л диагностируется тяжелая степень [28].
Гомоцистеин выводится почками в незначительной степени, поскольку в норме через фильтрационный барьер проходит только несвязанная с протеином форма, большая часть которой затем реабсорбируется в канальцах и окисляется до диоксида углерода и сульфата в клетках почек [25].
Кроме того, в почках гомоцистеин транссульфируется в наибольшей степени, и нарушение этого процесса больше всего влияет на повышение уровня гомоцистеина в плазме [18].
Метаболизм гомоцистеина, фолиевой кислоты и витамина В12 при ХБП
У пациентов с ХБП и ТСПН наблюдаются повышенный уровень гомоцистеина по сравнению с населением в целом [8, 29]. Считается, что гипергомоцистеинемия у таких больных спровоцирована нарушением метаболизма гомоцистеина в почках в большей степени, чем снижением скорости клубочковой фильтрации. В действительности, хотя гомоцистеин способен проходить фильтрационной барьер ввиду малой массы молекулы, в крови он циркулирует в основном в протеин-связанной форме (порядка 90% общего объема) [27]. При этом болезнь почек может влиять на метаболические пути транссульфурации и реметилирования. Исследования стабильных изотопов у больных ХБП с сахарным диабетом и без него показали снижение метаболического клиренса гомоцистеина, обусловленное нарушением обоих путей метаболизма [30].
Различные нарушения метаболизма, такие как ацидоз, системное воспаление, сбой гормональной регуляции в сочетании с коморбидностью и комбинированной лекарственной терапией могут стать причиной нарушения пищеварения у пациентов с ХБП и ТСПН и, следовательно, дефицита фолиевой кислоты и витамина В12. Кроме того, отягощающими факторами часто являются такие состояния, как анорексия, гастропарез, снижение перистальтики кишечника или диарея, повышенная проницаемость слизистой оболочки желудочно-кишечного тракта и нарушение микрофлоры кишечника [31, 32].
У пациентов с уремией нарушается метаболизм фолиевой кислоты. Органические и неорганические анионы, чей клиренс снижается при ХБП, ингибируют мембранный транспорт 5-MTHF, ухудшая внедрение в нуклеиновые кислоты и белки. Данные свидетельствуют о том, что при уремии транспорт фолатов снижается, следовательно, даже при их нормальном уровне в плазме интенсивность поглощения фолатов тканями может быть снижена [33]. Действительно, концентрация фолата в плазме не отражает достоверно его содержание в тканях, а скорее свидетельствует о поступлении витамина с пищей за прошедший период времени. Более точный показатель содержания фолатов в организме – их концентрация в эритроцитах. Среди выборки из 112 диализных пациентов Bamonti et al. обнаружили, что уровень фолата плазмы был в пределах нормальных значений только у 37% пациентов, несмотря на то, что его уровень в эритроцитах оказался в пределах нормы в 80% случаев [34].
В ходе некоторых исследований обнаружена взаимосвязь между низкой концентрацией витамина В12 в плазме и высоким индексом массы тела (ИМТ), инсулинорезистентностью, сахарным диабетом 2-го типа, дислипидемией и сердечно-сосудистыми заболеваниями (ССЗ) [35]. В крови витамин В12 преимущественно связан с белком. Около 20% циркулирующего В12 образует комплекс с транскобаламином – это биологически активная форма, которая поступает в клетки. Хотя у пациентов с ХБП уровень транскобаламина повышен, захват тканями витамина В12 понижен [36]. Кроме того, у больных с уремией функциональная недостаточность витамина В12 может быть обусловлена высокой потерей транскобаламина с мочой и снижением его реабсорбции в проксимальных канальцах. Это приводит к «парадоксальному» росту уровня гомоцистеина в клетках на фоне нормального содержания общего В12 [37].
С другой стороны, передозировка В12 способна усугубить течение ХБП. Цианокобаламин, наиболее распространенная форма В12 при медикаментозном лечении, действительно переходит в активный метилкобаламин, выделяя небольшое количество цианидов, чей клиренс снижен ввиду ХБП [34]. В норме метилкобаламин способствует выведению цианидов путем превращения в цианокобаламин. Однако при ХБП сниженный клиренс цианидов препятствует переходу цианокобаламина в активную форму и, следовательно, терапия становится менее эффективной [38].
Оптимальный уровень В12 при ХБП еще предстоит установить. Последующие метаболиты, такие как метилмалоновая кислота и гомоцистеин, возможно, более точно отражают насыщение организма витамином В12 у пациентов с уремией [35].
Гомоцистеин-ассоциированное повреждение тканей
Негативное влияние гипергомоцистеинемии на сердечно-сосудистую систему пациентов с ХБП и ТСПН связано с прогрессирующим течением атеросклероза на фоне уже имеющегося высокого риска поражения сосудов, обусловленного уремическим синдромом. Одним из возможных механизмов является индукция локального окислительного стресса с образованием активных форм кислорода (АФК) за счет тиоловой группы, которая быстро подвергается самоокислению в присутствии кислорода и иона металла. К тому же, гипергомоцистеинемия способствует повышению активности никотинамидадениндинуклеотидфосфат(НАДФ)-оксидазы, что еще больше усиливает образование АФК. Также при гомоцистеинемии нарушается метаболизм оксида азота в клетках эндотелия (включая выделение синтазы оксида азота, место ее выделения, активацию и активность), что наряду с АФК-ассоциированным локальным микровоспалением, ведет к эндотелиальной дисфункции [39].
В культурах клеток эндотелия при гипергомоцистеинемии повышалась продукция моноцитарного хемотаксического протеина -1 (МХП-1) и интерлейкина-8 (ИЛ-8), приводя к адгезии моноцитов на эндотелии [40]. Взаимосвязь между гомоцистеином и факторами воспаления, по-видимому, обеспечивает активированный фактор транскрипции NF-κB (ядерный фактор «каппа-би») [41].
Помимо этого, гипергомоцистеинемия способствует пролиферации гладкомышечных клеток сосудов (ГМКС) за счет стимуляции синтеза молекул адгезии, хемокинов и ГМКС митогенов, приводя к ряду взаимодействий между тромбоцитами, факторами свертываемости и липидами [42], и возможно, к опосредованному фагоцитарными рецепторами поглощению макрофагами окисленных липопротеинов низкой плотности (ЛПНП), запуская процесс образования пенистых клеток и атеросклеротической бляшки [43-46]. Гипергомоцистеинемия также предопределяет ремоделирование сосудов, что включает в себя активацию металлопротеиназы и индукцию синтеза коллагена, за счет чего снижается эластичность сосудов [47].
Аналогичным образом повышенный уровень гомоцистеина в крови может обуславливать эндотелиальный ретикулярный стресс с усилением апоптоза эндотелиальных клеток и воспаления вследствие процесса, запускаемого образованием АФК и активацией NF-κB [48-50]. Известно, что эндотелиоциты очень чувствительны к гипергомоцистеинемии, потому что не синтезируют ни CBS – первый фермент обратной транссульфурации в печени, ни бетаин-гомоцистеин-метилтрансферазу (ВНМТ), которая катализирует дополнительное метилирование в ткани печени, используя бетаин как субстрат [51].
Наконец, N-гомоцистеиниляция протеинов является одним из процессов, ответственных за токсичные свойства гомоцистеина, поскольку она нарушает их функцию и структуру. В случае с ЛПНП гомоцистеиниляция запускает процессы агрегации, аккумуляции холестерола и формирование пенистых клеток. В N-гомоцистеиниляции участвует также фибронектин: эта реакция усиливает ремоделирование внеклеточного матрикса, приводя в дальнейшем к склерозированию [52].
Описано специфическое влияние гипергомоцистеинемии на ткань почки. Гомоцистеин может воздействовать непосредственно на клетки клубочка, запуская процесс склерозирования, а также приводить к поражению почки за счет снижения уровня аденозина в плазме и тканях. Снижение концентрации аденозина плазмы способствует пролиферации ГМКС, усиливая артериальный и гломерулярный склероз. В опытах на крысах на фоне гипергомоцистеинемии вследствие дефицита фолата в пище при окислительном стрессе наблюдался гломерулярный склероз, разрастание мезанглия, дисфункция подоцитов и фиброз. После лечения «Апоцинином», ингибитором НАДФ-оксидазы, состояние клубочков заметно улучшилось [53].
Недостаточность фолиевой кислоты и витамина В12 и повреждение тканей
Фолиевая кислота и витамин В12 продемонстрировали возможность непосредственного влияния на сердечно-сосудистые исходы посредством механизмов, не связанных с уровнем гомоцистеина, но при этом не выявленных [54].
Фолиевая кислота положительно влияет на функции эндотелия без снижения уровня гомоцистеина, что дает альтернативное объяснение ее воздействию на эндотелий, которое, вероятно, обусловлено ее противовоспалительными, антиоксидантными и антиапоптозными свойствами [55-57]. На экспериментальных моделях было показано, что фолиевая кислота улучшает эндотелиальную функцию за счет снижения уровня окислительного стресса и увеличения периода полувыведения NO [17]. Фолиевая кислота, циркулирующая в форме 5-MTHF, способствует резкому улучшению NO-ассоциированного функционирования эндотелиоцитов и снижает образование супероксидазы. Кроме того, 5-MTHF предотвращает окисление ВН4 (тетрагидробиоптерина), усиливая ферментное связывание eNOS (эндотелиальной NO-синтазы), запускающее образование NO. Поскольку 5-MTHF является восстановленной формой фолиевой кислоты и не требует для дальнейшего превращения дигидрофолат-редуктазы, некоторые непосредственные эффекты могут объяснятся окислительно-восстановительными механизмами, не задействованными при пероральном приеме фолиевой кислоты с целью повышения ее концентрации в плазме [58, 59].
Doshi et al. исследовали непосредственное влияние фолиевой кислоты на эндотелиальную функцию у пациентов с коронарной болезнью сердца (КБС), измеряя значение поток-опосредованного расширения (FMD) до и после приема фолиевой кислоты. FMD увеличивалось на протяжении 2 часов параллельно с концентрацией фолиевой кислоты в плазме, при этом уровень гомоцистеина существенно не менялся. Приведенные данные свидетельствуют о том, что фолиевая кислота быстро и благотворно влияет на функцию эндотелия посредством механизма, практически не связанного с метаболизмом гомоцистеина [60]. По результатам работ других авторов, при приеме пациентами с КБС больших доз фолиевой кислоты (5 мг/сут.) функция эндотелия улучшается вне зависимости от уровня гомоцистеина [60-63]. Раннее было описано, что прием 5-MTHF увеличивает выживаемость в отличие от фолиевой кислоты, при этом концентрация гомоцистеина не играет значимой роли [11]. В недавней публикации Pan et al. приводятся данные о том, что при приеме фолиевой кислоты замедляется развитие атеросклероза за счет подавления дедифференциации ГМКС у мышей с недостаточным количеством рецепторов для ЛПВП, получавших корм с высоким содержанием жиров [64].
Что касается витамина В12, у пациентов с хроническим воспалением, например, находящихся на хроническом диализе, снижен синтез транскобаламина II вследствие сниженного поглощения циркулирующего витамина В12 периферическими тканями. Это может привести к повышенному синтезу транскобаламина I и III и последующему накоплению В12 в крови [65-68]. Таким образом, при воспалительных синдромах, несмотря на высокую концентрацию В12 в плазме, в тканях-мишенях сохраняется его дефицит, вероятно приводя к гипергомоцистеинемии и высокому сердечно-сосудистому риску [69].
Касательно анемии, за исключением тех случаев, когда у больных с ХБП и ТСПН наблюдается значительное снижение уровня фолата, дополнительный прием фолиевой кислоты не будет оказывать положительного эффекта ни на эритропоэз, ни на восприимчивость к рекомбинантному человеческому эритропоэтину (рчЭПО). При этом диагностировать фолатную недостаточность у таких пациентов можно только на основании значительного увеличения среднего объема эритроцита или гиперсегментации полиморфноядерных лейкоцитов, особенно у больных с нарушением питания, злоупотреблением алкоголем или сниженной восприимчивостью к рчЭПО. Определение концентрации циркулирующего в плазме фолата не отражает в полной мере его содержания в тканях. Более точную картину дает его содержание в эритроцитах – если это значение низкое, больной нуждается в приеме фолата [70].
У пациентов с ХБП недостаточность фолатов и витамина В12 может выступать в качестве фактора, влияющего на ренальную анемию и сниженную восприимчивость к рчЭПО-терапии. По этой причине до сих пор ведутся дискуссии о необходимости и возможности проведения такой терапии [71].
На рис. 2 показаны пути развития атеросклероза и воспаления под влиянием гипергомоцистеинемии у пациентов с ХБП.

Рисунок 2. Развитие атеросклероза и воспаления, индуцированного гипергомоцистеинемией у пациентов с хронической болезнью почек (ХБП). Условные обозначения: NO, оксид азота
| Hyperhomocysteinemia | Гипергомоцистеинемия |
| Folic acid deficiency | Недостаточность фолиевой кислоты |
| Oxidative stress | Окислительный стресс |
| Inflammatory status | Воспалительный статус |
| Metalloproteinases | Металлопротеиназа |
| Collagen synthesis | Синтез коллагена |
| Smooth muscles cell proliferation | Пролиферация гладкомышечных клеток |
| Foam cells | Пенистые клетки |
| NO | NO |
| Superoxide generation | Выработка супероксида |
| Myocardial function | Функция миокарда |
| Endothelial NO synthase | Эндотелиальная NO-синтетаза |
| Cardiovascular disease | Сердечно-сосудистое заболевание |
| Progression Chronic Kidney Disease | Прогрессирование хронической болезни почек |
Полиморфизм гена MTHFR
MTHFR играет ведущую роль в метаболизме фолата и гомоцистеина, катализирует переход 5,10–метенилтетрагидрофолата в 5- MTHF, основную циркулирующую форму фолата [72]. Описано несколько видов полиморфизма гена MTHFR, некоторые из которых, по-видимому, влияют на индивидуальную предрасположенность к заболеваниям, ассоциированным с нарушением метаболизма гомоцистеина, например, инфаркт миокарда, инсульт, нейродегенеративные заболевания, аутоиммунные заболевания, онкология, сахарный диабет, врожденные пороки развития и болезни почек [73].
Наиболее характерным является функциональный полиморфизм одиночных нуклеотидов в положении 677, (MTHFR 677 С > T), в положении 1298 (MTHFR 1298 A > С), в положении 1317 (MTHFR 1317 T > С) и в положении 1793 (MTHFR 1793 G > A) [74].
Хотя в ряде исследований связь между генотипом MTHFR 677 C > T и долгосрочным почечным исходом не обнаружена [75], тем не менее, полиморфизм MTHFR 677 C > T сопряжен с повышением сердечно-сосудистого риска у больных с ТСПН [76]. В исследовании Trovato et al., проведенном в 2015 г. с участием 630 мужчин белой расы из Италии, выявлена низкая частота встречаемости полиморфизма MTHFR 677 C > T и A1298 A > C у больных с ТСПН, находящихся на хроническом гемодиализе, что предполагает наличие протективного свойства этих вариантов генов в отношении функции почек [77].
Несмотря на то, что основная функция фермента MTHFR – регуляция способности 5-MTHF к реметилированию гомоцистеина, влияние функциональных вариантов MTHFR-генов не может ограничиваться только повышенным уровнем гомоцистеина. В то время как прием фолата доказательно снижает уровень гомоцистеина в общей популяции, у пациентов с ТСПН наблюдается резистентность даже к высоким дозам фолата [78]. У больных, находящихся на гемодиализе, данные об эффекте приема фолата и витамина В12 противоречивы, возможно вследствие полиморфизма MTHFR-генов [79].
В недавнем проспективном исследовании с выборкой из 132 пациентов, находящихся на гемодиализе, Anchour et al. изучали способность фолиевой кислоты снижать уровень гомоцистеина с учетом полиморфизма MTHFR. Авторы установили, что генотип MTHFR 677 С > T влияет на восприимчивость к витаминам группы В, что соответствует результатами предыдущих исследований [79-86]. В сущности, одновременный прием В12 и фолата оказался эффективным только у лиц, гомозиготных по С-аллелю, а снижение уровня гомоцистеина оказалось наиболее значимым при генотипе ТТ [84].
Согласно другим публикациям, снижение концентрации гомоцистеина наиболее выражено у носителей генотипа СС, чем у носителей СТ и ТТ [82]. В дополнительном исследовании CSPTT (Китайское исследование по первичной профилактике инсульта) сравнивалась эффективность комбинированного назначения ингибиторов ангиотензинпревращающего фермента (АПФ) и фолиевой кислоты с монотерапией АПФ для снижения риска нарушения функционирования почки у пациентов с артериальной гипертензией без обогащения рациона фолиевой кислотой. Из 15104 участников 7545 принимали эналаприл в дозировке 10 мг и фолиевую кислоту в дозировке 0,8 мг, при этом наименьшие показатели гомоцистеина плазмы наблюдались у ТТ-гомозиготных лиц с полиморфизмом 677 C > T, по сравнению с другими генотипами (СС/СТ) [87].
Подводя итог вышесказанному, отметим, что большинство полученных данных свидетельствуют о вероятном участии полиморфизма генов MTHFR в регулировании восприимчивости к терапии витамином В12 и фолиевой кислотой для снижения уровня гомоцистеина и сердечно-сосудистого риска у диализных пациентов с ХБП и ТСПН. Однако является ли это основанием для рутинных исследований, остается предметом для дискуссии.
Роль фолиевой кислоты, витамина В12 и гомоцистеина в качестве маркеров сердечно-сосудистого риска
Несмотря на то, что гипергомоцистеинемия на протяжении многих лет считалась фактором сердечно-сосудистого риска, в последние годы ее связь с ССЗ и смертностью находится под сомнением, а литературные данные по этому вопросу противоречивы [7, 89, 90]. Эпидемиологические исследования и исследования методом случай-контроль в большинстве своем подтверждают наличие зависимости между повышенной концентрацией гомоцистеина в плазме и высокой частотой возникновения ССЗ и инсульта, в то время как проспективные, рандомизированные и плацебо-контролируемые исследования такой связи не выявляют [7].
Кроме того, все еще существуют разногласия в отношении необходимости проведения рутинного исследования гипергомоцистеинемии и ее лечения в общей популяции [7].
У пациентов с ХБП и ТСПН, несмотря на повышенный уровень гомоцистеина (в общей популяции в среднем около 10-15 ммоль/л, при уремии 25-35 ммоль/л), его значение как фактора риска сердечно-сосудистых событий и смертности по-прежнему не определено - многочисленные ретроспективные и интервенционные исследования предоставляют противоречивые результаты [8-12].
Согласно данным метаанализа, включающего ретроспективные исследования, проспективные наблюдательные и интервенционные исследования (всего 5123 участника), повышенная концентрация гомоцистеина в крови считается фактором риска как ССЗ, так и смертности у пациентов с ТСПН, не принимающих фолиевую кислоту [10].
По данным проспективных исследований, включенных в метаанализ, у пациентов с ТСПН, не принимающих фолиевую кислоту, повышение концентрации гомоцистеина на 5 ммоль/л увеличивает риск общей смертности на 7% и риск возникновения сердечно-сосудистых событий на 9% [10]. Напротив, в проспективном когортном исследовании с участием 341 диализного пациента установить взаимосвязь между исходным уровнем гомоцистеина, полиморфизмом MTHFR и смертностью не удалось [11].
Можно предположить, что в основе упомянутых разногласий лежит неоднородность выборки, временное несоответствие между конкурентными факторами риска и влиянием общих осложнений, таких как воспаление и белково-энергетическая недостаточность (БЭН), которые могли бы влиять на циркулирующие формы гомоцистеина и оказывать влияние на неблагоприятные исходы [9].
Отмечена также отрицательная корреляция между уровнем гомоцистеина и сердечно-сосудистыми исходами у пациентов с поздними стадиями ХБП и находящимися на гемодиализе, создающая феномен под названием «обратная эпидемиология», который включает в себя и другие факторы риска, в частности индекс массы тела (ИМТ), холестерин сыворотки крови и артериальное давление [91]. Некоторые данные свидетельствуют о том, что БЭН и воспаления могут подтвердить наличие обратной связи между уровнем гомоцистеина и клиническими исходами ХБП и ТСПН [34-37]. Точнее говоря, двумя исследованиями подтверждено, что у пациентов с крайне низкой концентрацией гомоцистеина плазмы наблюдались наиболее неблагоприятные исходы, что выражалось в высокой частоте госпитализации и смертности [92, 93].
Вышеизложенные данные ставят под сомнение роль гомоцистеина как фактора сердечно-сосудистого риска и смертности у пациентов с ХБП и ТСПН, наталкивая на мысль о том, что помимо повышенного уровня гомоцистеина, дополнительно задействованы и другие механизмы. Принимая во внимание, что одной из важнейших мишеней гипергомоцистеинемии является ДНК-метилтрансфераза, можно предположить, что в повреждении тканей, обусловленном гипергомоцистеинемией, задействованы эпигенетические процессы [12].
Не так давно Sohoo et al. провели ретроспективное исследование с большой когортой больных, находящихся на гемодиализе, с целью изучения взаимосвязи между исходным уровнем фолиевой кислоты и В12 и общей смертностью по итогам пятилетнего периода наблюдения (9517 пациентов в группе с фолиевой кислотой и 12 968 пациентов в группе с В12). По результатам данного исследования, более высокий уровень В12 (550 пг/мл) был связан с более высоким риском смертности при корректировке на социально-демографические и лабораторные показатели, в то время как низкая концентрация фолата (< 6,2 нг/мл) сама по себе оказалась сопряжена с более высокой общей смертностью. Авторы подчеркивают, что дополнительная корректировка на нарушение питания, воспалительный процесс и другие клинические и лабораторные показатели сводит к нулю взаимосвязь между уровнем фолата и общей смертностью [15].
В предыдущей публикации приведены данные об улучшении показателей выживаемости пациентов на гемодиализе, принимавших 5-MTHF, по сравнению фолиевой кислотой, несмотря на отсутствие значимой разницы в уровнях гомоцистеина в обеих группах, что позволяет поднять вопрос о том, не обладает ли 5-MTHF какими-либо особыми свойствами, помимо способности снижать концентрацию гомоцистеина. Текущие выводы о том, что повышение уровня СРБ связано со смертностью, позволяют предположить, что эффект обусловлен снижением воспалительной активности [11]. Следовательно, возникает вопрос, имеет ли снижение гомоцистеина какие-либо преимущества, и на сколько гомоцистеин действительно влияет на риск развития сердечно-сосудистых событий (таблица 1).
Таблица 1. Ретроспективные и проспективные обсервационные исследования, посвященные гипергомоцистеинемии и недостаточности фолиевой кислоты / витамина В12 у пациентов с ХБП и терминальной стадией почечной недостаточности (ТСПН)
| Исследование | Дизайн | Кол-во участников, n | Событие Определение/Исход | Результат |
| Soohoo et al., 2017 [15] | Ретроспективное | 9517 (группа приема фолата), 12 968 (группа приема B12) ГД | Смертность | Низкий уровень фолиевой кислоты определяет смертность |
| Ye et al., 2016 [94] | Метод «поперечного среза» | 1042 ХБП стадии 1–5 | ССЗ | ГГц ассоциирована с тяжестью ССЗ, ГЛЖ, ДЛЖ |
| Anan et al., 2006 [95] | Ретроспективное случай-контроль | 44 ГД | Бессимптомный ишемический инсульт | ГГц определяет исход |
| Ducloux et al., 2006 [92] | Проспективное обсервационное | 459 ГД | Смертность и ССЗ с летальным исходом | ГГц определяет исход только у пациентов с ХВРП |
| Nair et al., 2005 [96] | Ретроспективное случай-контроль | 146 ГД | ИМ, хирургическое вмешательство на сердце | ГГц не определяет риск ССЗ |
| London et al., 2004 [97] | Проспективное обсервационное | 78 ГД | Смертность | ГГц не определяет исход |
| Kalantar-Zadeh et al., [98] | Проспективное обсервационное | 367 ГД | Смертность | Низкий уровень ГГц определяет смертность |
| Buccianti et al., 2004 [99] | Проспективное обсервационное | 77 ГД | ССЗ с летальным исходом | ГГц определяет исход |
| Bayиs et al., 2003 [1000] | Проспективное обсервационное | 94 ГД | Смертность, ССЗ с летальным исходом | ГГц не определяет исход |
| Mallamaci et al., 2002 [101] | Проспективное обсервационное | 175 ГД | Смертность, ССЗ с летальным исходом | ГГц определяет исход |
| Ducloux et al., 2002 [102] | Проспективное обсервационное | 240 ПД | ССЗ с летальным исходом и без | ГГц не определяет исход |
| Haraki et al., 2001 (ретроспективная часть) [103] | Ретроспективное случай-контроль | 43 ГД/ПД | Заболевание коронарных, церебральных и периферических сосудов | ГГц является фактором риска ССЗ |
| Haraki et al., 2001 (проспективная часть) [103] | Проспективное обсервационное | 55 ГД/ПД | ССЗ с летальным исходом и без него | ГГц определяет исход |
| Wrone et al., 2001 [104] | Ретроспективное случай-контроль | 459 ГД/ПД | ИМ, инсульт, ТИП, эндартерэктомия сонной артерии | ГГц не определяет риск ССЗ |
| Dierkes et al., 2000 [105] | Проспективное обсервационное | 102 ГД | Смертность, ССЗ с/без летального исхода | ГГц определяет исход |
| Suliman et al., 2000 [106] | Ретроспективное случай-контроль | 117 ГД | Заболевание коронарных, церебральных и периферических сосудов | ГГц не определяет риск ССЗ |
| Kunz et al., 1999 [107] | Ретроспективное случай-контроль | 63 ГД | Заболевание коронарных, церебральных и периферических сосудов | ГГц является фактором сердечно-сосудистого риска |
| Manns et al., 1999 [108] | Ретроспективное случай-контроль | 218 ГД | Заболевание коронарных, церебральных и периферических сосудов | ГГц является фактором сердечно-сосудистого риска только у мужчин |
| Sirrs et al., 1999 [109] | Проспективное обсервационное | 88 ГД | Смертность и сердечно-сосудистые события | Низкие уровни ГГц определяют смертность |
| Moustapha et al., 1998 [110] | Проспективное обсервационное | 167 ГД/ПД | Смертность и сердечно-сосудистые события | ГГц определяет исход |
| Vychytil et al., 1998 [111] | Ретроспективное случай-контроль | 154 ПД | Заболевание коронарных, церебральных и периферических сосудов | ГГц не определяет риск ССЗ |
| Bostom et al., 1997 [112] | Проспективное обсервационное | 73 ГД/ПД | Сердечно-сосудистые события | ГГц определяет исход |
| Robinson et al., 1996 [113] | Ретроспективное случай-контроль | 176 ГД/ПД | Заболевание коронарных, церебральных и периферических сосудов | ГГц является фактором сердечно-сосудистого риска |
| Bachmann et al., 1995 [114] | Ретроспективное случай-контроль | 45 ГД | Заболевание коронарных, церебральных и периферических сосудов | ГГц является фактором сердечно-сосудистого риска |
| Bostom et al., 1995 [115] | Ретроспективное случай-контроль | 24 ГД/ПД | Заболевание коронарных, церебральных и периферических сосудов | ГГц не определяет риск ССЗ |
Условные обозначения: ССЗ - сердечно-сосудистое заболевание; ИМ - инфаркт миокарда; ГЛЖ - гипертрофия левого желудочка; ДЛЖ - дисфункция левого желудочка; ГГц - гипергомоцистеинемия; ГД - гемодиализ; ПД - перитонеальный диализ; ХБП - хроническая болезнь почек; ХВРП - хроническое состояние воспаления – нарушение питания.
Влияние приема фолиевой кислоты и витамина В12 на риск ССЗ и смертности у пациентов с ХБП и ТСПН
Говоря о приеме фолиевой кислоты и витамина В12, следует отметить, что влияние этих витаминов на снижении смертности и предотвращение развития ТСПН до сих пор не установлено.
Кроме того, для этой категории пациентов до сих не определены эффективные дозировки фолиевой кислоты и В12. Им назначают от 2,5 до 5 мг фолиевой кислоты три раза в неделю до более чем 15 мг/сутки. Доказано, что одновременное внутривенное введение витаминов группы В более эффективно снижает уровень гомоцистеина в крови и способствует процессу реметилирования у пациентов с ТСПН [116].
На основании одногодичного плацебо-контролируемого открытого рандомизированного исследования с выборкой из 81 пациента, находящихся на хроническом гемодиализе, Righetti et al. сделали вывод об отсутствии положительного эффекта приема фолиевой кислоты на показатель выживаемости по сравнению с плацебо, при этом нормальный уровень гомоцистеина был достигнут только у 12% больных [117]. В мультицентровом исследовании Wrone et al. с участием 510 пациентов, находящихся на хроническом диализе, которые были случайным образом разделены на группы приема 1, 5 и 15 мг/день фолиевой кислоты, разницы в показателях смертности и сердечно-сосудистых событий не обнаружено [76].
В двойном слепом плацебо-контролируемом исследовании ASFAST (Исследование сердечно-сосудистой заболеваемости и смертности у пациентов с атеросклерозом при приеме фолиевой кислоты) с рандомизированной выборкой из 315 пациентов с ХБП, находящихся на диализе (с рСКФ < 25 мл/мин.) больные принимали фолиевую кислоту в дозировке 15 мг/день, либо плацебо. По итогам среднего периода наблюдения, составившего 3,6 года, влияние терапии с назначением фолиевой кислоты на общую смертность, сердечно-сосудистую смертность и прогрессирование атеромы (увеличения толщины интима-медиа сонной артерии) не выявлено [118].
Исследование HOST (Гомоцистеинемия при заболевании почек и терминальной стадии почечной недостаточности) – это двойное слепое плацебо-контролируемое исследование с участием 2056 пациентов с поздней стадией ХБП или ТСПН на почечно-заместительной терапии и с повышенным уровнем гомоцистеина в крови, которые случайным образом разделены на группы с комбинированной терапией фолиевой кислотой, витамином В12 и пиридоксином или плацебо. По итогам среднего периода наблюдения, который составил 3,2 года, отмечено значительное снижение уровня гомоцистеина, но основная конечная точка (снижение общей смертности) и вторичные конечные точки (снижение сердечно-сосудистой смертности, частоты ампутаций и тромбозов сосудистого доступа) не были достигнуты. Возможным объяснением таких отрицательных результатов может быть высокая сердечно-сосудистая коморбидность и субоптимальное соблюдение режима лечения. Кроме того, пациенты с ХБП и ТСПН составляли единую популяцию, то есть эти две категории больных не оценивались по отдельности. Несоответствие результатов данного исследования ранее опубликованным эпидемиологическим данным может служить отражением лимитирующих факторов обсервационных исследований [119].
В недавно проведенном мультицентровом исследовании Heinz et al. участвовали 650 пациентов, находящихся на хроническом гемодиализе, случайным образом разделенных на группы приема 5 мг фолиевой кислоты, 50 мкг витамина В12 и 20 мг витамина В6 в сравнении с плацебо, три раза в неделю (в день после диализа) в течение 2 лет. Разница в показателях общей смертности, летальных и нелетальных сердечно-сосудистых событий между двумя группами не установлена. С другой стороны, по результатам апостериорного анализа, выявлено значительное снижение частоты нестабильной стенокардии и манипуляций по васкуляризации [120].
В метаанализе Heinz et al., включавшем пять интервенционных исследований с участием в общей сложности 1642 пациентов на хроническом диализе, принимавших фолиевую кислоту, витамин В12 и витамин В6, выявлено значительное снижение риска возникновения ССЗ, но не смертности [10]. В другом метаанализе с участием 3866 пациентов с ТСПН и прогрессирующей ХБП (клиренс креатинина < 30 мл/мин.) оценивалась связь между приемом фолиевой кислоты (в сочетании с витаминами В6 и В12 или без него) и ССЗ. Прием фолиевой кислоты снижал сердечно-сосудистый риск на 15% у пациентов с ТСПН, особенно при продолжительности приема более 24 месяцев и с минимальным потреблением злаков [121].
Ji et al. провели масштабный метаанализ, состоящий из 14 РКИ (54 913 участников), в котором наблюдалось снижение частоты инсультов в результате снижения уровня гомоцистеина на фоне приема фолиевой кислоты, витаминов В12 и В6. Снижение частоты инсультов наблюдалось также в подгруппе с ХБП [122]. Согласно метаанализу, состоящему из 10 исследований, гомоцистеин-снижающая терапия не связана со значительным снижением риска сердечно-сосудистых событий, инсультов и общей смертности у пациентов с ХБП. Следует обратить внимание на то, что по сравнению с предыдущим метаанализом, в данном исследовании участвовало большое количество пациентов с сахарным диабетом и РКИ были проведены в районах с высоким потреблением злаков местным населением [123]. Совсем недавно был проведен метаанализ из шести исследований (включая вышеупомянутые) с участием 2452 больных, находящихся на хроническом диализе, в ходе которого не обнаружена существенная разница между смертностью и частотой сердечно-сосудистых событий среди пациентов, получавших гомоцистеин-снижающие препараты [124].
Наконец, многочисленные апостериорные анализы свидетельствуют о том, что влияние приема фолиевой кислоты и витамина В12 на сердечно-сосудистый риск зависит от ряда факторов, таких как возраст, исходная концентрация гомоцистеина, потребление фолиевой кислоты со злаками, уровень В12, функция почек, сопутствующие заболевания и прием лекарств.
В таблице 2 представлены сводные данные интервенционного исследования, посвященного влиянию приема фолиевой кислоты и витамина В12 на риск ССЗ, смертность и прогрессирующее течение ХБП.
Таблица 2. Исследование взаимосвязи между приемом фолиевой кислоты и витамина В12 и риском ССЗ, смертностью и прогрессирующим течением ХБП
| Исследование | Дизайн | Количество участников, n | Конечная точка | Период наблюдения, годы | Результаты |
| Xu et al., 2016 [87] | Двойное слепое РКИ: эналаприл, 10 мг в сравнении с эналаприл, 10 мг в сочетании с фолиевой кислотой | 15 104 (рСКФ ≥ 30 мл/мин.). Без потребления продуктов с содержанием фолиевой кислоты | Прогрессирующее течение ХБП | 4,4 | Эналаприл в сочетании с фолиевой кислотой замедляет прогрессирование ХБП |
| House et al., 2010 [125] | Двойное слепое РКИ: фолиевая кислота, 2,5 мг + витамин В6, 25 мг + витамин В12, 1 мг в сравнении с плацебо | 238 (диабетическая нефропатия с рСКФ > 30 мл/мин.). Потребление продуктов с содержанием фолиевой кислоты | Прогрессирующее течение ХБП | 2,6 | В исследуемой группе наблюдалось более значительное снижение СКФ и высокая частота сердечно-сосудистых событий |
| Heinz et al., 2010 [120] | Двойное слепое РКИ: фолиевая кислота, 5 мг, витамин В12, 50 мкг, витамин В6, 20 мг в сравнении с плацебо, 3 раза в неделю | 650 пациентов, находящихся на гемодиализе | Общая смертность, сердечно-сосудистые события | 2 | Разница не выявлена |
| Mann et al., 2008 [126] | Двойное слепое РКИ: фолиевая кислота, 2,5 мг + витамин В6, 50 мг + витамин В12, 1 мг в сравнении с плацебо | 619 ХБП (рСКФ < 60 мл/мин.) | Общая смертность, сердечно-сосудистые события | 5 | Разница не выявлена |
| Cianciolo et al., 2008 [11] | Открытое рандомизированное исследование: 5-MTHF внутривенно 3 раза в неделю, в сравнении с фолиевой кислотой, 5 мг перорально ежедневно | 314 пациентов, находящихся на гемодиализе | Общая смертность | 4,5 | В группе 5-MTHF риск смертности меньше (независимо от уровня гомоцистеина) |
| Jamison et al., 2007 [119] | Двойное слепое РКИ (HOST): фолиевая кислота, 40 мг + витамин В6, 100 мг + витамин В12, 2 мг в сравнении с плацебо | 2056 пациентов с ХБП (рСКФ ≤ 30) или находящихся на гемодиализе (потребление продуктов с фолиевой кислотой) | Общая смертность, прогрессирующее течение ХБП | 3,2 | Разница не выявлена |
| Vianna et al., 2007 [127] | Двойное слепое РКИ: фолиевая кислота, 5 мг в сравнении с плацебо | 97 пациентов, находящихся на гемодиализе | Сердечно-сосудистые события | 2 | Разница не выявлена |
| Zoungas et al., 2006 [118] | Двойное слепое РКИ (ASFAST): фолиевая кислота, 15 мг в сравнении с плацебо | 315 пациентов с ХБП (рСКФ < 25 мл/мин.), находящихся на гемодиализе или перитонеальном диализе | Сердечно-сосудистые события и смертность | 3,6 | Разница не выявлена |
| Righetti et al., 2006 [128] | Открытое проспективное исследование: фолиевая кислота, 5 мг в сравнении с отсутствием терапии | 114 пациентов, находящихся на гемодиализе | Сердечно-сосудистые события | 2,4 | Прием фолиевой кислоты снижает частоту сердечно-сосудистых событий |
| Wrone et al., 2004 [76] | Трехгрупповое двойное слепое РКИ: фолиевая кислота, 1 мг, 5 мг или 15 мг | 510 пациентов, находящихся на гемодиализе | Сердечно-сосудистые события и смертность | 2 | Разница не выявлена |
| Righetti et al., 2003 [117] | Плацебо-контролируемое, открытое РКИ: фолиевая кислота, 5 мг, 15 мг, 25 мг или плацебо | 81 пациент, находящийся на гемодиализе | Сердечно-сосудистая смертность | 1 | Разница не выявлена |
Условные обозначения: ХБП - хроническая болезнь почек; ССЗ - сердечно-сосудистое заболевание; рСКФ - расчетная скорость клубочковой фильтрации; РКИ - рандомизированное клиническое исследование.
Насколько известно, публикации проспективных исследований, посвященных изучению влияния витамина В12 на сердечно-сосудистые и почечные исходы у пациентов с ХБП и ТСПН отсутствуют.
Подводя итог, следует отметить, что, хотя доступные в настоящее время исследования указывают на снижение гомоцистеина на фоне проводимой терапии (фолиевой кислотой, витамином В12 и витамином В6), в большинстве случаев положительное влияние на показатели смертности и частоту сердечно-сосудистых событий среди пациентов с ХБП и ТСПН не выявлено. Более того, положительный эффект может зависеть от противовоспалительных и сосудистых защитных эффектов.
Фолиевая кислота и витамин В12: влияние на прогрессирование ХБП
Что касается взаимосвязи между потреблением фолиевой кислоты, витамина В12 и прогрессирующим течением ХБП, проведенные интервенционные исследования свидетельствуют об отсутствии очевидного положительного эффекта, и даже о наличии отрицательного влияния на состояние почек [15]. При этом, согласно обсервационным исследованиям, существует корреляция между гипергомоцистеинемией и риском развития и прогрессированием ХБП [129].
CSPTT (Китайское исследование по первичной профилактике инсульта) представляет собой масштабное РКИ (20 702 пациента), в котором участвовали взрослые пациенты с артериальной гипертензией, без инсульта или инфаркта миокарда в анамнезе, с установленным генотипом MTHFR и известным исходным уровнем фолата. Целью данного исследования была оценка эффекта приема фолиевой кислоты у пациентов из Азии, не употребляющих фолиевую кислоту с продуктами питания. Авторы выяснили, что комбинированная терапия ингибиторами АПФ в сочетании с фолиевой кислотой снижает риск инсульта в сравнении с монотерапией ингибиторами АПФ. Кроме того, у лиц с генотипами MTHFR СС и СТ, наблюдался наиболее высокий риск инсульта и наиболее эффективный ответ на потребление фолиевой кислоты, в то время как при генотипе ТТ для достижения приемлемых результатов требовались наиболее высокие дозировки фолиевой кислоты [80].
В почечном подисследовании CSPPT (Китайское исследование по первичной профилактике инсульта) сравнивалась эффективность комбинированной терапии эналаприлом в сочетании с фолиевой кислотой и монотерапии эналаприлом для снижения риска нарушения функции почки в масштабной выборке больных с гипертензией (15 104 пациента). В исследовании участвовали больные с рСКФ более 30 мл/мин., которые были случайным образом разделены на группы приема эналаприла, 10 мг и фолиевой кислоты, 0,8 мг и только эналаприла, 10 мг. По итогам четырехлетнего наблюдения в группе приема эналаприла и фолиевой кислоты наблюдалось снижение риска прогрессирующего течения ХБП на 21% и замедление снижения рСКФ на 10%. Кроме того, авторы провели подгрупповой анализ сравнения пациентов с ХБП (рСКФ < 60 мл/мин. или наличие протеинурии) и без нее на начальном этапе. Выяснилось, что наличие ХБП является сильнейшим модификатором эффекта терапии [85]. Более того, наибольшее снижение уровня гомоцистеина наблюдалось у ТТ-гомозигот при типе полиморфизма MTHFR 677 C>T, а при генотипах СС/СТ показатель снижения не был таким значительным. Наконец, в ходе эксплораторного анализа подгрупп, целью которого являлась оценка влияния терапевтического эффекта на основные исходы в различных подгруппах у пациентов с ХБП, выявлено, что снижение риска прогрессирования ХБП наиболее выражено у больных с сахарном диабетом [87]. Это исследование стало первым, доказывающим ренопротективный эффект назначения фолиевой кислоты у пациентов, не получавших ее с пищей. В предыдущих исследованиях отмечалось отсутствие эффекта или негативное влияние приема фолиевой кислоты и витамина В12 [15, 118].
Согласно вышеупомянутому исследованию HOST, лечение большими дозами фолиевой кислоты, витамином В6 и витамином В12 оказалось неэффективным с точки зрения увеличения бездиализного периода у пациентов с прогрессирующей ХБП [15].
В двойном слепом РКИ – DIVINe (Витаминотерапия у диабетических пациентов и регрессирование нефропатии) – участвовали 238 пациентов с диабетическим поражением почки, которые были случайным образом разделены на группы приема 2,5 мг фолиевой кислоты в сочетании с 25 мг витамина В6 и 1 мг витамина В12 или плацебо (средняя рСКФ составляла 64 мл/мин. в исследуемой группе и 58 мл/мин. в группе плацебо). По итогам 2,6-летнего периода наблюдения [125] прием фолиевой кислоты, витаминов В6 и В12 ведет к большему снижению СКФ и росту частоты сердечно-сосудистых событий по сравнению с плацебо. Причин для таких исключительных результатов может быть несколько. Прежде всего, исходный уровень фолиевой кислоты отличался от показателей других исследований (7,7 нг/мл в CSPPT, 15 и 16,5 нг/мл в DIVINe и HOST, соответственно), поэтому можно предполагать, что положительный эффект от приема фолиевой кислоты наиболее выражен у тех пациентов, у которых уровень ее в крови был изначально ниже. Кроме того, может иметь значение дозировка витамина В, о чем свидетельствует более высокий уровень фолата в крови (2000 нг/мл) в исследовании HOST по сравнению с CSPTT (23 нг/мл). На основании этого можно судить о вероятной токсичности неметаболизированной фолиевой кислоты при ее накоплении в кровяном русле [85]. Наконец, степень тяжести ХБП в исследованиях была различной. Действительно, в исследовании HOST участвовали пациенты с прогрессирующей ХБП и большим количеством сопутствующих заболеваний, что, безусловно, могло повлиять на результаты исследования в отношении почечных исходов. Результаты CSPTT подисследования, свидетельствующие об эффективности терапии фолиевой кислотой в отношении замедления прогрессирующего поражения почки, могут быть обусловлены особенностью выборки пациентов, у которых была диагностирована начальная или умеренно выраженная стадия ХБП. Кроме того, только в CSPPT исследовании участвовали пациенты, не потребляющие фолиевую кислоту с продуктами питания, в то время как два других исследования проводились в странах с разработанными программами употребления фолиевой кислоты с пищей.
Стоит также отметить недавнее исследование с участием 630 пациентов белой расы из Италии, где зафиксирована низкая частота полиморфизма MTHFR 677 C > T и A1298 A > C у больных, находящихся на гемодиализе, по сравнению с теми пациентами, у кого диагностировано легкое или умеренное нарушение функции почки. Этот факт может свидетельствовать о протективных свойствах указанных генотипов [39].
Подводя итоги, следует отметить, что представленные результаты исследований влияния гомоцистеин-снижающей терапии на развитие ХБП противоречивы, и, следовательно, необходимо проведение дальнейших исследований с гомогенной выборкой и прогрессирующим течением ХБП в качестве основной первичной конечной точки. Пока не получены новые подтверждающие данные, представляется целесообразным лечение пациентов с дефицитом фолиевой кислоты с целью снижения риска дальнейшего развития ХБП, при этом избегая токсичных проявлений при ее накоплении.
Прием фолиевой кислоты и витамина В12 пациентами с пересаженной почкой
У пациентов с пересаженной почкой на сердечно-сосудистый риск может оказывать влияние ряд специфических факторов, таких как длительная история гемодиализа, иммуносупрессия, хроническое воспаление и метаболические нарушения [130].
После пересадки почки часто наблюдается некоторое снижение уровня гомоцистеина в крови; однако, как правило, гипергомоцистеинемия все же сохраняется [131-133]. Установлено, что концентрация гомоцистеина может снижаться в дальнейшем на фоне приема пациентами больших доз витаминов группы В [134]. В исследовании FAVORIT (Фолиевая кислота для снижения риска сосудистых исходов при трансплантации) изучалось влияние прима фолиевой кислоты на сердечно-сосудистый риск и смертность. Реципиенты донорской почки в стабильном состоянии были случайным образом разделены на группы ежедневного приема мультивитаминных комплексов с большим содержанием фолиевой кислоты (5,0 мг), витамина В12 (1,0 мг) и витамина В6 (50 мг) или плацебо. Исследование было прекращено досрочно, так как промежуточный анализ не выявил разницы между группами по частоте сердечно-сосудистых событий, общей смертности, необходимости начала диализной терапии несмотря на снижение уровня гомоцистеина крови [135].
Недавно проведенное долговременное дополнительное исследование FAVORIT показало, что прием больших доз витаминов группы В ведет к умеренному улучшению когнитивных функций у пациентов с изначально высоким их уровнем. Необходимо отметить, что практически ни у кого из участников исследования не отмечалось дефицита фолатов или В12, поэтому говорить об улучшении когнитивной функции на фоне приема фолата и В12 у пациентов с низким содержанием витаминов группы В пока не актуально [136].
Выводы
На сегодняшний день убедительные данные, доказывающие, что гипергомоцистеинемия, нарушения обмена фолиевой кислоты и витамина В12 являются надежными маркерами сердечно-сосудистой патологии и риска смертности у пациентов с ХБП и ТСПН, отсутствуют. Более того, эти факторы нельзя назвать терапевтическими мишенями для снижения сердечно-сосудистого риска и дальнейшего развития ХБП.
Пока не получены данные подтверждающих исследований, считается целесообразным применение фолиевой кислоты в виде монотерапии или в сочетании с витамином В12 в качестве адьювантного лечения пациентов с ХБП.
На ранних стадиях ХБП, когда не рекомендовано ограничение потребления калия и фосфора в пище, фолиевая кислота может поступать в организм с продуктами питания, являющимися природными источниками фолатов. При прогрессирующей ХБП и проведении гемодиализа фолиевая кислота может назначаться в виде фармакологических препаратов под контролем ее концентрации.
Источники
- Go A.S., Chertow G.M., Fan D., McCulloch C.E., Hsu C.Y. Chronic kidney disease and the risks of death, cardiovascular events, and hospitalization. N. Engl. J. Med. 2004;351:1296–1305. doi: 10.1056/NEJMoa041031.
- Foley R.N., Parfrey P.S., Sarnak M.J. Epidemiology of cardiovascular disease in chronic renal disease.J. Am. Soc. Nephrol. 1998;9:S16–S23. doi: 10.1053/ajkd.1998.v32.pm9820470.
- Jha V., Garcia-Garcia G., Iseki K., Li Z., Naicker S., Plattner B., Saran R., Wang A.Y., Yang C.W. Chronic kidney disease: Global dimension and perspectives. Lancet. 2013;382:260–272. doi: 10.1016/S0140-6736(13)60687-X.
- McCullough P.A., Steigerwalt S., Tolia K., Chen S.C., Li S., Norris K.C., Whaley-Connell A., KEEP Investigators Cardiovascular disease in chronic kidney disease: Data from the Kidney Early Evaluation Program (KEEP) Curr. Diab. Rep. 2011;11:47–55. doi: 10.1007/s11892-010-0162-y.
- Ekdahl K., Soveri I., Hilborn J., Fellström B., Nilsson B. Cardiovascular disease in hemodialysis: Role of the intravascular innate immune system. Nat. Rev. Nephrol. 2017;13:285–296. doi: 10.1038/nrneph.2017.17.
- McCully K.S. Homocysteine and vascular disease. Nat. Med. 1996;2:386–389. doi: 10.1038/nm0496-386.
- Chrysant S.G., Chrysant G.S. The current status of homocysteine as a risk factor for cardiovascular disease: A mini review. Expert. Rev. Cardiovasc. Ther. 2018;16:559–565. doi: 10.1080/14779072.2018.1497974.
- Robinson K. Renal disease, homocysteine, and cardiovascular complications. Circulation. 2004;109:294–295. doi: 10.1161/01.CIR.0000114133.99074.96.
- Suliman M.E., Lindholm B., Barany P., Qureshi A.R., Stenvinkel P. Homocysteine-lowering is not a primary target for cardiovascular disease prevention in chronic kidney disease patients. Semin. Dial. 2007;20:523–529. doi: 10.1111/j.1525-139X.2007.00336.x.
- Heinz J., Kropf S., Luley C., Dierkes J. Homocysteine as a risk factor for cardiovascular disease in patients treated by dialysis: A meta-analysis. Am. J. Kidney Dis. 2009;54:478–489. doi: 10.1053/j.ajkd.2009.01.266.
- Cianciolo G., La Manna G., Colì L., Donati G., D’Addio F., Persici E., Comai G., Wratten M., Dormi A., Mantovani V., et al. 5-methyltetrahydrofolate administration is associated with prolonged survival and reduced inflammation in ESRD patients. Am. J. Nephrol. 2008;28:941–948. doi: 10.1159/000142363.
- Cianciolo G., De Pascalis A., Di Lullo L., Ronco C., Zannini C., La Manna G. Folic Acid and Homocysteine in Chronic Kidney Disease and Cardiovascular Disease Progression: Which Comes First? Cardiorenal. Med. 2017;7:255–266. doi: 10.1159/000471813.
- Marti F., Vollenweider P., Marques-Vidal P.M., Mooser V., Waeber G., Paccaud F., Bochud M. Hyperhomocysteinemia is independently associated with albuminuria in the population-based CoLaus study. MC Public Health. 2011;11. doi: 10.1186/1471-2458-11-733.
- Ponte B., Pruijm M., Marques-Vidal P., Martin P.Y., Burnier M., Paccaud F., Waeber G., Vollenweider P., Bochud M. Determinants and burden of chronic kidney disease in the population-based CoLaus study: A cross-sectional analysis. Nephrol. Dial. Transpl. 2013;28:2329–2339. doi: 10.1093/ndt/gft206.
- Soohoo M., Ahmadi S.F., Qader H., Streja E., Obi Y., Moradi H., Rhee C.M., Kim T.H., Kovesdy C.P., Kalantar-Zadeh K. Association of serum vitamin B12 and folate with mortality in incident hemodialysis patients. Nephrol. Dial. Transpl. 2017;32:1024–1032. doi: 10.1093/ndt/gfw090.
- Kang S.S., Wong P.W.K., Malinow M.R. Hyperhomocyst(e)inemia as a risk factor for occlusive vascular disease. Annu. Rev. Nutr. 1992;12:279–298. doi: 10.1146/annurev.nu.12.070192.001431.
- Randaccio L., Geremia S., Demitri N., Wuerges J. Vitamin B12: Unique metalorganic compounds and the most complex vitamins. Molecules. 2010;15:3228–3259. doi: 10.3390/molecules15053228.
- Long Y., Nie J. Homocysteine in Renal Injury. Kidney Dis. 2016;2:80–87. doi: 10.1159/000444900.
- Van Guldener C., Stam F., Stehouwer C.D. Hyperhomocysteinaemia in chronic kidney disease: Focus on transmethylation. Clin. Chem. Lab. Med. 2005;43:1026–1031. doi: 10.1515/CCLM.2005.180.
- Jacobsen D.W. Homocysteine and vitamins in cardiovascular disease. Clin. Chem. 1998;44:1833–1843.
- Cianciolo G., Cappuccilli M., La Manna G. The Hydrogen Sulfide-Vitamin B12-Folic Acid Axis: An Intriguing Issue in Chronic Kidney Disease. A Comment on Toohey JI: “Possible Involvement of Hydrosulfide in B12-Dependent Methyl Group Transfer” Molecules. 2017;22:1216. doi: 10.3390/molecules22071216.
- Toohey J.I. Possible Involvement of Hydrosulfide in B12-Dependent Methyl Group Transfer. Molecules. 2017;22:582. doi: 10.3390/molecules22040582.
- Welch G.N., Loscalzo J. Homocysteine and atherothrombosis. N. Engl. J. Med. 1998;338:1042–1050. doi: 10.1056/NEJM199804093381507.
- Wang R. Two’s company, three’s a crowd: Can H2S be the third endogenous gaseous transmitter? FASEB J. 2002;16:1792–1798. doi: 10.1096/fj.02-0211hyp.
- Perna A.F., Sepe I., Lanza D., Capasso R., Di Marino V., De Santo N.G., Ingrosso D. The gasotransmitter hydrogen sulfide in hemodialysis patients. J. Nephrol. 2010;23:S92–S96.
- Li H., Feng S.J., Zhang G.Z., Wang S.X. Correlation of lower concentrations of hydrogen sulfide with atherosclerosis in chronic hemodialysis patients with diabetic nephropathy. Blood Purif. 2014;38:188–194. doi: 10.1159/000368883.
- Van Guldener C., Stehouwer C.D. Homocysteine metabolism in renal disease. Clin. Chem. Lab. Med. 2003;41:1412–1417. doi: 10.1515/CCLM.2003.217.
- Perna A.F., Ingrosso D., Satta E., Lombardi C., Acanfora F., De Santo N.G. Homocysteine metabolism in renal failure. Curr. Opin. Clin. Nutr. Metab. Care. 2004;7:53–57. doi: 10.1097/00075197-200401000-00010.
- Langan R.C., Goodbred A.J. Vitamin B12 Deficiency: Recognition and Management. Am. Fam. Physician. 2017;96:384–389.
- Brattström L., Wilcken D.E. Homocysteine and cardiovascular disease: Cause or effect? Am. J. Clin. Nutr. 2000;72:315–323. doi: 10.1093/ajcn/72.2.315.
- Van Guldener C., Kulik W., Berger R., Dijkstra D.A., Jakobs C., Reijngoud D.J., Donker A.J., Stehouwer C.D., De Meer K. Homocysteine and methionine metabolism in ESRD: A stable isotope study. Kidney Int. 1999;56:1064–1071. doi: 10.1046/j.1523-1755.1999.00624.x.
- Rowland I., Gibson G., Heinken A., Scott K., Swann J., Thiele I., Tuohy K. Gut microbiota functions: Metabolism of nutrients and other food components. Eur. J. Nutr. 2018;57:1–24. doi: 10.1007/s00394-017-1445-8.
- Zha Y., Qian Q. Protein Nutrition and Malnutrition in CKD and ESRD. Nutrients. 2017;27:208. doi: 10.3390/nu9030208.
- Jennette J.C., Goldman I.D. Inhibition of the membrane transport of folate by anions retained in uremia. J. Lab. Clin. Med. 1975;86:834–843.
- Bamonti-Catena F., Buccianti G., Porcella A., Valenti G., Como G., Finazzi S., Maiolo A.T. Folate measurements in patients on regular hemodialysis treatment. Am. J. Kidney Dis. 1999;33:492–497. doi: 10.1016/S0272-6386(99)70186-1.
- McMahon G.M., Hwang S.J., Tanner R.M., Jacques P.F., Selhub J., Muntner P., Fox C.S. The association between vitamin B12, albuminuria and reduced kidney function: An observational cohort study. BMC Nephrol. 2015;16. doi: 10.1186/1471-2369-16-7.
- Ermens A.A., Vlasveld L.T., Lindemans J. Significance of elevated cobalamin (vitamin B12) levels in blood. Clin. Biochem. 2003;36:585–590. doi: 10.1016/j.clinbiochem.2003.08.004.
- Andres E., Serraj K., Zhu J., Vermorken A.J. The pathophysiology of elevated vitamin B12 in clinical practice. QJM. 2013;106:505–515. doi: 10.1093/qjmed/hct051.
- Koyama K., Yoshida A., Takeda A., Morozumi K., Fujinami T., Tanaka N. Abnormal cyanide metabolism in uraemic patients. Nephrol. Dial. Transpl. 1997;12:1622–1628. doi: 10.1093/ndt/12.8.1622.
- Poddar R., Sivasubramanian N., DiBello P.M., Robinson K., Jacobsen D.W. Homocysteine induces expression and secretion of monocyte chemoattractant protein-1 and interleukin-8 in human aortic endothelial cells: Implications for vascular disease. Circulation. 2001;103:2717–2723. doi: 10.1161/01.CIR.103.22.2717.
- Zhao J., Chen H., Liu N., Chen J., Gu Y., Chen J., Yang K. Role of Hyperhomocysteinemia and Hyperuricemia in Pathogenesis of Atherosclerosis. J. Stroke Cerebrovasc. Dis. 2017;26:2695–2699. doi: 10.1016/j.jstrokecerebrovasdis.2016.10.012.
- Au-Yeung K.K., Woo C.W., Sung F.L., Yip J.C., Siow Y.L., O K. Hyperhomocysteinemia activates nuclear factor-kappaB in endothelial cells via oxidative stress. Circ. Res. 2004;94:28–36. doi: 10.1161/01.RES.0000108264.67601.2C.
- Li H., Lewis A., Brodsky S., Rieger R., Iden C., Goligorsky M.S. Homocysteine induces 3-hydroxy-3-methylglutaryl coenzyme a reductase in vascular endothelial cells: A mechanism for development of atherosclerosis? Circulation. 2002;105:1037–1043. doi: 10.1161/hc0902.104713.
- Pecoits-Filho R., Lindholm B., Stenvinkel P. The malnutrition, inflammation, and atherosclerosis (MIA) syndrome – the heart of the matter. Nephrol. Dial. Transpl. 2002;17:28–31. doi: 10.1093/ndt/17.suppl_11.28.
- Colì L., Donati G., Cappuccili M.L., Cianciolo G., Comai G., Cuna V., Carretta E., La Manna G., Stefoni S. Role of the hemodialysis vascular access type in inflammation status and monocyte activation. Int. J. Art. Organs. 2011;34:481–488. doi: 10.5301/IJAO.2011.8466.
- Tsai J.C., Perrella M.A., Yoshizumi M., Hsieh C.M., Haber E., Schlegel R., Lee M.E. Promotion of vascular smooth muscle cell growth by homocysteine: A link to atherosclerosis. Proc. Natl. Acad. Sci. USA. 1994;91:6369–6373. doi: 10.1073/pnas.91.14.6369.
- Bottiger A.K., Hurtig-Wennlof A., Sjostrom M., Yngve A., Nilsson T.K. Association of total plasma homocysteine with methylenetetrahydrofolate reductase genotypes 677C>T, 1298A>C, and 1793G>A and the corresponding haplotypes in Swedish children and adolescents. Int. J. Mol. Med. 2007;19:659–665. doi: 10.3892/ijmm.19.4.659.
- Sen U., Mishra P.K., Tyagi N., Tyagi S.C. Homocysteine to hydrogen sulfide or hypertension. Cell Biochem. Biophys. 2010;57:49–58. doi: 10.1007/s12013-010-9079-y.
- Zhang C., Cai Y., Adachi M.T., Oshiro S., Aso T., Kaufman R.J., Kitajima S. Homocysteine induces programmed cell death in human vascular endothelial cells through activation of the unfolded protein response. J. Biol. Chem. 2001;276:35867–53874. doi: 10.1074/jbc.M100747200.
- Baydas G., Reiter R.J., Akbulut M., Tuzcu M., Tamer S. Melatonin inhibits neural apoptosis induced by homocysteine in hippocampus of rats via inhibition of cytochrome c translocation and caspase-3 activation and by regulating pro- and antiapoptotic protein levels. Neuroscience. 2005;135:879–886. doi: 10.1016/j.neuroscience.2005.05.048.
- Zhang K., Kaufman R. From endoplasmic-reticulum stress to the inflammatory response. Nature. 2008;454:455–462. doi: 10.1038/nature07203.
- Finkelstein J.D. Methionine metabolism in mammals. J. Nutr. Biochem. 1990;1:228–237. doi: 10.1016/0955-2863(90)90070-2.
- Perna A.F., Ingrosso D., Violetti E., Luciano M.G., Sepe I., Lanza D., Capasso R., Ascione E., Raiola I., Lombardi C., et al. Hyperhomocysteinemia in uremia—A red flag in a disrupted circuit. Semin. Dial. 2009;22:351–356. doi: 10.1111/j.1525-139X.2009.00579.x.
- Deussen A., Pexa A., Loncar R., Stehr S.N. Effects of homocysteine on vascular and tissue adenosine: A stake in homocysteine pathogenicity? Clin. Chem. Lab. Med. 2005;43:1007–1010. doi: 10.1515/CCLM.2005.176.
- Solini A., Santini E., Ferrannini E. Effect of short-term folic acid supplementation on insulin sensitivity and inflammatory markers in overweight subjects. Int. J. Obes. (Lond). 2006;30:1197–1202. doi: 10.1038/sj.ijo.0803265.
- Bhattacharjee A., Prasad S.K., Pal S., Maji B., Syamal A.K., Mukherjee S. Synergistic protective effect of folic acid and vitamin B12 against nicotine-induced oxidative stress and apoptosis in pancreatic islets of the rat. Pharm. Biol. 2016;54:433–444. doi: 10.3109/13880209.2015.1043561.
- Wu T.G., Li W.H., Lin Z.Q., Wang L.X. Effects of folic acid on cardiac myocyte apoptosis in rats with streptozotocin-induced diabetes mellitus. Cardiovasc. Drugs Ther. 2008;22:299–304. doi: 10.1007/s10557-008-6109-8.
- Verhaar M.C., Stroes E., Rabelink T.J. Folates and cardiovascular disease. Arterioscler. Thromb. Vasc. Biol. 2002;22:6–13. doi: 10.1161/hq0102.102190.
- Antoniades C., Shirodaria C., Warrick N., Cai S., de Bono J., Lee J., Leeson P., Neubauer S., Ratnatunga C., Pillai R., et al. 5-Methyltetrahydrofolate Rapidly Improves Endothelial Function and Decreases Superoxide Production in Human Vessels Effects on Vascular Tetrahydrobiopterin Availability and Endothelial Nitric Oxide Synthase Coupling. Circulation. 2006;114:1193–1201. doi: 10.1161/CIRCULATIONAHA.106.612325.
- Doshi S.N., McDowell I.F., Moat S.J., Payne N., Durrant H.J., Lewis M.J., Goodfellow J. Folic Acid Improves Endothelial Function in Coronary Artery Disease via Mechanisms Largely Independent of Homocysteine Lowering. Circulation. 2002;105:22–26. doi: 10.1161/hc0102.101388.
- Title L.M., Cummings P.M., Giddens K., Genest J.J., Jr., Nassar B.A. Effect of folic acid and antioxidant vitamins on endothelial dysfunction in patients with coronary artery disease. J. Am. Coll. Cardiol. 2000;36:758–765. doi: 10.1016/S0735-1097(00)00809-3.
- Chambers J.C., Ueland P.M., Obeid O.A., Wrigley J., Refsum H., Kooner J.S. Improved vascular endothelial function after oral B vitamins: An effect mediated through reduced concentrations of free plasma homocysteine. Circulation. 2000;102:2479–2483. doi: 10.1161/01.CIR.102.20.2479.
- Doshi S.N., McDowell I.F., Moat S.J., Lang D., Newcombe R.G., Kredan M.B., Lewis M.J., Goodfellow J. Folate improves endothelial function in coronary artery disease: An effect mediated by reduction of intracellular superoxide? Arterioscler. Thromb. Vasc. Biol. 2001;21:1196–1202. doi: 10.1161/hq0701.092000.
- Pan S., Liu H., Gao F., Luo H., Lin H., Meng L., Jiang C., Guo Y., Chi J., Guo H. Folic acid delays development of atherosclerosis in lowdensity lipoprotein receptor-deficient mice. J. Cell Mol. Med. 2018;22:3183–3191. doi: 10.1111/jcmm.13599.
- Park J., Ahmadi S.F., Streja E., Molnar M.Z., Flegal K.M., Gillen D., Kovesdy C.P., Kalantar-Zadeh K. Obesity paradox in end-stage kidney disease patients. Prog. Cardiovasc. Dis. 2014;56:415–425. doi: 10.1016/j.pcad.2013.10.005.
- Obi Y., Qader H., Kovesdy C.P., Kalantar-Zadeh K. Latest consensus and update on proteinenergy wasting in chronic kidney disease. Curr. Opin. Clin. Nutr. Metab. Care. 2015;18:254–262. doi: 10.1097/MCO.0000000000000171.
- Salles N., Herrmann F., Sakbani K., Rapin C.H., Sieber C. High vitamin B12 level: A strong predictor of mortality in elderly inpatients. J. Am. Geriatr. Soc. 2005;53:917–918. doi: 10.1111/j.1532-5415.2005.53278_7.x.
- Seetharam B., Li N. Transcobalamin II and its cell surface receptor. Vitam. Horm. 2000;59:337–366.
- Sviri S., Khalaila R., Daher S., Bayya A., Linton D.M., Stav I., van Heerden P.V. Increased Vitamin B12 levels are associated with mortality in critically ill medical patients. Clin. Nutr. 2012;31:53–59. doi: 10.1016/j.clnu.2011.08.010.
- Bamgbola O.F. Pattern of resistance to erythropoietin-stimulating agents in chronic kidney disease. Kidney Int. 2011;80:464–474. doi: 10.1038/ki.2011.179.
- Saifan C., Samarneh M., Shtaynberg N., Nasr R., El-Charabaty E., El-Sayegh S. Treatment of confirmed B12 deficiency in hemodialysis patients improves Epogen requirements. Int. J. Nephrol. Renovasc. Dis. 2013;6:89–93. doi: 10.2147/IJNRD.S44660.
- Brustolin S., Giugliani R., Félix T.M. Genetics of homocysteinemetabolism and associated disorders. Braz. J. Med. Biol. Res. 2010;43:1–7. doi: 10.1590/S0100-879X2009007500021.
- Homberger A., Linnebank M., Winter C., Willenbring H., Marquardt T., Harms E., Koch H.G. Genomic structure and transcript variants of the human methylenetetrahydrofolate reductase gene. Eur. J. Hum. Genet. 2000;8:725–729. doi: 10.1038/sj.ejhg.5200522.
- Cristalli C.P., Zannini C., Comai G., Baraldi O., Cuna V., Cappuccilli M., Mantovani V., Natali N., Cianciolo G., La Manna G. Methylenetetrahydrofolate reductase, MTHFR, polymorphisms and predisposition to different multifactorial disorders. Genes Genomics. 2017;39:689–699. doi: 10.1007/s13258-017-0552-5.
- Rady P.L., Szucs S., Grady J., Hudnall S.D., Kellner L.H., Nitowsky H., Tyring S.K., Matalon R.K. Genetic polymorphisms of methylenetetrahydrofolate reductase (MTHFR) and methionine synthase reductase (MTRR) in ethnic populations in Texas; a report of a novel MTHFR polymorphic site, G1793A. Am. J. Med. Genet. 2002;107:162–168. doi: 10.1002/ajmg.10122.
- Wrone E.M., Hornberger J.M., Zehnder J.L., McCann L.M., Coplon N.S., Fortmann S.P. Randomized trial of folic acid for prevention of cardiovascular events in end-stage renal disease. J. Am. Soc. Nephrol. 2004;15:420–426. doi: 10.1097/01.ASN.0000110181.64655.6C.
- Trovato F.M., Catalano D., Ragusa A., Martines G.F., Pirri C., Buccheri M.A., Di Nora C., Trovato G.M. Relationship of MTHFR gene polymorphisms with renal and cardiac disease Send to World. J. Nephrol. 2015;4:127–137.
- Bostom A.G., Shemin D., Lapane K.L., Hume A.L., Yoburn D., Nadeau M.R., Bendich A., Selhub J., Rosenberg I.H. High-dose-B vitamin treatment of hyperhomocysteinemia in dialysis patients. Kidney Int. 1996;49:147–152. doi: 10.1038/ki.1996.19.
- Achour O., Elmtaoua S., Zellama D., Omezzine A., Moussa A., Rejeb J., Boumaiza I., Bouacida L., Rejeb N.B., Achour A., et al. The C677T MTHFR genotypes influence the efficacy of B9 and B12 vitamins supplementation to lowering plasma total homocysteine in hemodialysis. J. Nephrol. 2016;29:691–698. doi: 10.1007/s40620-015-0235-8.
- Huo Y., Li J., Qin X., Huang Y., Wang X., Gottesman R.F., Tang G., Wang B., Chen D., He M., et al. Efficacy of Folic Acid Therapy in Primary Prevention of Stroke among Adults with Hypertension in China: The CSPPT randomized clinical trial. JAMA. 2015;313:1325–1335. doi: 10.1001/jama.2015.2274.
- Bostom A.G., Shemin D., Bagley P., Massy Z.A., Zanabli A., Christopher K., Spiegel P., Jacques P.F., Dworkin L., Selhub J. Controlled comparison of L-5- methyltetrahydrofolate versus folic acid for the treatment of hyperhomocysteinemia in hemodialysis patients. Circulation. 2000;101:2829–2832. doi: 10.1161/01.CIR.101.24.2829.
- Dierkes J., Domröse U., Ambrosch A., Schneede J., Guttormsen A.B., Neumann K.H., Luley C. Supplementation with vitamin B12 decreases homocystein and methylmalonic acid but also serum folate in patients with end stage renal disease. Metabolism. 1999;48:631–635. doi: 10.1016/S0026-0495(99)90062-8.
- Pastore A., De Angelis S., Casciani S., Ruggia R., Di Giovamberardino G., Noce A., Splendiani G., Cortese C., Federici G., Dessì M. Effects of folic acid before and after vitamin B12 on plasma homocysteine concentrations in hemodialysis patients with known MTHFR genotypes. Clin. Chem. 2006;52:145–148. doi: 10.1373/clinchem.2005.056119.
- Tremblay R., Bonnardeaux A., Geadah D., Busque L., Lebrun M., Ouimet D., Leblanc M. Hyperhomocysteinemia in hemodialysis patients: Effects of 12-month supplementation with hydrosoluble vitamins. Kidney Int. 2000;58:851–858. doi: 10.1046/j.1523-1755.2000.00234.x.
- Obeid R., Kuhlmann M.K., Köhler H., Herrmann W. Response of homocysteine, cystathionine, and methylmalonic acid to vitamin treatment in dialysis patients. Clin. Chem. 2005;51:196–201. doi: 10.1373/clinchem.2004.041210.
- Malinow M.R., Nieto F.J., Kruger W.D., Duell P.B., Hess D.L., Gluckman R.A., Block P.C., Holzgang C.R., Anderson P.H., Seltzer D., et al. The effects of folic acid supplementation on plasma total homocysteine are modulated by multivitamin use and methylenetetrahydrofolate reductase genotypes. Arterioscler. Thromb. Vasc. Biol. 1997;17:1157–1162. doi: 10.1161/01.ATV.17.6.1157.
- Xu X., Qin X., Li Y., Sun D., Wang J., Liang M., Wang B., Huo Y., Hou F.F., Investigators of the Renal Substudy of the China Stroke Primary Prevention Trial (CSPPT) Efficacy of folic acid therapy on the progression of chronic kidney disease: The Renal Substudy of the China Stroke Primary Prevention Trial. JAMA Intern. Med. 2016;176:1443–1450. doi: 10.1001/jamainternmed.2016.4687.
- Hickey S.E., Curry C.J., Toriello H.V. ACMG Practice Guideline: Lack of evidence for MTHFR polymorphism testing. Genet Med. 2013;15:153–156. doi: 10.1038/gim.2012.165.
- Wald D.S., Law M., Morris J.K. Homocysteine and cardiovascular disease: Evidence on causality from a metaanalysis. BMJ. 2002;325:1202. doi: 10.1136/bmj.325.7374.1202.
- Homocysteine Studies Collaboration Homocysteine and risk of ischemic heart disease and stroke: A meta-analysis. JAMA. 2002;288:2015–2022. doi: 10.1001/jama.288.16.2015.
- Kalantar-Zadeh K., Block G., Humphreys M.H., Kopple J.D. Reverse epidemiology of cardiovascular risk factors in maintenance dialysis patients. Kidney Int. 2003;63:793–808. doi: 10.1046/j.1523-1755.2003.00803.x.
- Ducloux D., Klein A., Kazory A., Devillard N., Chalopin J.M. Impact of malnutrition-inflammation on the association between homocysteine and mortality. Kidney Int. 2006;69:331–335. doi: 10.1038/sj.ki.5000096.
- Suliman M., Stenvinkel P., Qureshi A.R., Kalantar-Zadeh K., Bárány P., Heimbürger O., Vonesh E.F., Lindholm B. The reverse epidemiology of plasma total homocysteine as a mortality risk factor is related to the impact of wasting and inflammation. Nephrol. Dial. Transpl. 2007;22:209–217. doi: 10.1093/ndt/gfl510.
- Ye Z., Zhang Q., Li Y., Wang C., Zhang J., Ma X., Peng H., Lou T. High Prevalence of Hyperhomocysteinemia and Its Association with Target Organ Damage in Chinese Patients with Chronic Kidney Disease. Nutrients. 2016;8:645. doi: 10.3390/nu8100645.
- Anan F., Takahashi N., Shimomura T., Imagawa M., Yufu K., Nawata T., Nakagawa M., Yonemochi H., Eshima N., Saikawa T., et al. Hyperhomocysteinemia is a significant risk factor for silent cerebral infarction in patients with chronic renal failure undergoing hemodialysis. Metabolism. 2006;55:656–661. doi: 10.1016/j.metabol.2005.12.007.
- Nair A.P., Nemirovsky D., Kim M., Geer E.B., Farkouh M.E., Winston J., Halperin J.L., Robbins M.J. Elevated homocysteine levels in patients with end-stage renal disease. Mt. Sinai. J. Med. 2005;72:365–373.
- London G.M., Pannier B., Agharazii M., Guerin A.P., Verbeke F.H., Marchais S.J. Forearm reactive hyperemia and mortality in end-stage renal disease. Kidney Int. 2004;65:700–704. doi: 10.1111/j.1523-1755.2004.00434.x.
- Kalantar-Zadeh K., Block G., Humphreys M.H., McAllister C.J., Kopple J.D. A low rather than a high, total plasma homocysteine is an indicator of poor outcome in hemodialysis patients. J. Am. Soc. Nephrol. 2004;15:442–453. doi: 10.1097/01.ASN.0000107564.60018.51.
- Buccianti G., Baragetti I., Bamonti F., Furiani S., Dorighet V., Patrosso C. Plasma homocysteine levels and cardiovascular mortality in patients with end-stage renal disease. J. Nephrol. 2004;17:405–410.
- Bayés B., Pastor M.C., Bonal J., Juncà J., Hernandez J.M., Riutort N., Foraster A., Romero R. Homocysteine, C-reactive protein, lipid peroxidation and mortality in haemodialysis patients. Nephrol. Dial. Transpl. 2003;18:106–112. doi: 10.1093/ndt/18.1.106.
- Mallamaci F., Zoccali C., Tripepi G., Fermo I., Benedetto F.A., Cataliotti A., Bellanuova I., Malatino L.S., Soldarini A., CREED Investigators Hyperhomocysteinemia predicts cardiovascular outcomes in hemodialysis patients. Kidney Int. 2002;61:609–614. doi: 10.1046/j.1523-1755.2002.00144.x.
- Ducloux D., Bresson-Vautrin C., Kribs M., Abdelfatah A., Chalopin J.M. C-reactive protein and cardiovascular disease in peritoneal dialysis patients. Kidney Int. 2002;62:1417–1422. doi: 10.1111/j.1523-1755.2002.kid562.x.
- Haraki T., Takegoshi T., Kitoh C., Kajinami K., Wakasugi T., Hirai J., Shimada T., Kawashiri M., Inazu A., Koizumi J., et al. Hyperhomocysteinemia, diabetes mellitus, and carotid atherosclerosis independently increase atherosclerotic vascular disease outcome in Japanese patients with end-stage renal disease. Clin. Nephrol. 2001;56:132–139.
- Wrone E.M., Zehnder J.L., Hornberger J.M., McCann L.M., Coplon N.S., Fortmann S.P. An MTHFR variant, homocysteine, and cardiovascular comorbidity in renal disease. Kidney Int. 2001;60:1106–1113. doi: 10.1046/j.1523-1755.2001.0600031106.x.
- Dierkes J., Domröse U., Westphal S., Ambrosch A., Bosselmann H.P., Neumann K.H., Luley C. Cardiac troponin T predicts mortality in patients with end-stage renal disease. Circulation. 2000;102:1964–1969. doi: 10.1161/01.CIR.102.16.1964.
- Suliman M.E., Qureshi A.R., Bárány P., Stenvinkel P., Filho J.C., Anderstam B., Heimbürger O., Lindholm B., Bergström J. Hyperhomocysteinemia, nutritional status, and cardiovascular disease in hemodialysis patients. Kidney Int. 2000;57:1727–1735. doi: 10.1046/j.1523-1755.2000.00018.x.
- Kunz K., Petitjean P., Lisri M., Chantrel F., Koehl C., Wiesel M.L., Cazenave J.P., Moulin B., Hannedouche T.P. Cardiovascular morbidity and endothelial dysfunction in chronic haemodialysis patients: Is homocyst(e)ine the missing link? Nephrol. Dial. Transpl. 1999;14:1934–1942. doi: 10.1093/ndt/14.8.1934.
- Manns B.J., Burgess E.D., Hyndman M.E., Parsons H.G., Schaefer J.P., Scott-Douglas N.W. Hyperhomocyst(e)inemia and the prevalence of atherosclerotic vascular disease in patients with end-stage renal disease. Am. J. Kidney Dis. 1999;34:669–677. doi: 10.1016/S0272-6386(99)70392-6.
- Sirrs S., Duncan L., Djurdjev O., Nussbaumer G., Ganz G., Frohlich J., Levin A. Homocyst(e)ine and vascular access complications in haemodialysis patients: Insights into a complex metabolic relationship. Nephrol. Dial. Transpl. 1999;14:738–743. doi: 10.1093/ndt/14.3.738.
- Moustapha A., Naso A., Nahlawi M., Gupta A., Arheart K.L., Jacobsen D.W., Robinson K., Dennis V.W. Prospective study of hyperhomocysteinemia as an adverse cardiovascular risk factor in end-stage renal disease. Circulation. 1998;97:138–141. doi: 10.1161/01.CIR.97.2.138.
- Vychytil A., Födinger M., Wölfl G., Enzenberger B., Auinger M., Prischl F., Buxbaum M., Wiesholzer M., Mannhalter C., Hörl W.H., et al. Major determinants of hyperhomocysteinemia in peritoneal dialysis patients. Kidney Int. 1998;53:1775–1782. doi: 10.1046/j.1523-1755.1998.00918.x.
- Bostom A.G., Shemin D., Verhoef P., Nadeau M.R., Jacques P.F., Selhub J., Dworkin L., Rosenberg I.H. Elevated fasting total plasma homocysteine levels and cardiovascular disease outcomes in maintenance dialysis patients. A. prospective study. Arterioscler. Thromb. Vasc. Biol. 1997;17:2554–2558. doi: 10.1161/01.ATV.17.11.2554.
- Robinson K., Gupta A., Dennis V., Arheart K., Chaudhary D., Green R., Vigo P., Mayer E.L., Selhub J., Kutner M., et al. Hyperhomocysteinemia confers an independent increased risk of atherosclerosis in end-stage renal disease and is closely linked to plasma folate and pyridoxine concentrations. Circulation. 1996;94:2743–2748. doi: 10.1161/01.CIR.94.11.2743.
- Bachmann J., Tepel M., Raidt H., Riezler R., Graefe U., Langer K., Zidek W. Hyperhomocysteinemia and the risk for vascular disease in hemodialysis patients. J. Am. Soc. Nephrol. 1995;6:121–125.
- Bostom A.G., Shemin D., Lapane K.L., Miller J.W., Sutherland P., Nadeau M., Seyoum E., Hartman W., Prior R., Wilson P.W., et al. Hyperhomocysteinemia and traditional cardiovascular disease risk factors in end-stage renal disease patients on dialysis: A case-control study. Atherosclerosis. 1995;114:93–103. doi: 10.1016/0021-9150(94)05470-4.
- Wu C.C., Zheng C.M., Lin Y.F., Lo L., Liao M.T., Lu K.C. Role of homocysteine in end-stage renal disease. Clin. Biochem. 2012;45:1286–1294. doi: 10.1016/j.clinbiochem.2012.05.031.
- Righetti M., Ferrario G.M., Milani S., Serbelloni P., La Rosa L., Uccellini M., Sessa A. Effects of folic acid treatment on homocysteine levels and vascular disease in hemodialysis patients. Med. Sci. Monit. 2003;9:19–24.
- Zoungas S., McGrath B.P., Branley P., Kerr P.G., Muske C., Wolfe R., Atkins R.C., Nicholls K., Fraenkel M., Hutchison B.G., et al. Cardiovascular Morbidity and Mortality in the Atherosclerosis and Folic Acid Supplementation Trial (ASFAST) in Chronic Renal Failure. J. Am. Coll. Cardiol. 2006;47:1108–1116. doi: 10.1016/j.jacc.2005.10.064.
- Jamison R.L., Hartigan P., Kaufman J.S., Goldfarb D.S., Warren S.R., Guarino P.D., Gaziano J.M., Veterans Affairs Site Investigators Effect of Homocysteine Lowering on Mortality and Vascular Disease in Advanced Chronic Kidney Disease and End-stage Renal Disease. JAMA. 2007;298:1163–1170. doi: 10.1001/jama.298.10.1163.
- Heinz J., Kropf S., Domröse U., Westphal S., Borucki K., Luley C., Neumann K.H., Dierkes J. B Vitamins and the Risk of Total Mortality and Cardiovascular Disease in End-Stage Renal Disease Results of a Randomized Controlled Trial. Circulation. 2010;121:1432–1438. doi: 10.1161/CIRCULATIONAHA.109.904672.
- Qin X., Huo Y., Langman C.B., Hou F., Chen Y., Matossian D., Xu X., Wang X. Folic acid therapy and cardiovascular disease in ESRD or advanced chronic kidney disease: A meta-analysis. Clin. J. Am. Soc. Nephrol. 2011;6:482–488. doi: 10.2215/CJN.05310610.
- Ji Y., Tan S., Xu Y., Chandra A., Shi C., Song B., Qin J., Gao Y. Vitamin B supplementation, homocysteine levels, and the risk of cerebrovascular disease: A meta-analysis. Neurology. 2013;81:1298–1307. doi: 10.1212/WNL.0b013e3182a823cc.
- Pan Y., Guo L.L., Cai L.L., Zhu X.J., Shu J.L., Liu X.L., Jin H.M. Homocysteine-lowering therapy does not lead to reduction in cardiovascular outcomes in chronic kidney disease patients: A meta-analysis of randomised, controlled trials. Br. J. Nutr. 2012;108:400–407. doi: 10.1017/S0007114511007033.
- Nigwekar S.U., Kang A., Zoungas S., Cass A., Gallagher M.P., Kulshrestha S., Navaneethan S.D., Perkovic V., Strippoli G.F.M., Jardine M.J. Interventions for lowering plasma homocysteine levels in dialysis patients. Cochrane Database Syst. Rev. 2016 doi: 10.1002/14651858.CD004683.pub4.
- House A.A., Eliasziw M., Cattran D.C., Churchill D.N., Oliver M.J., Fine A., Dresser G.K., Spence J.D. Effect of B-vitamin therapy on progression of diabetic nephropathy: A randomized controlled trial. JAMA. 2010;303:1603–1609. doi: 10.1001/jama.2010.490.
- Mann J.F., Sheridan P., McQueen M.J., Held C., Arnold J.M., Fodor G., Yusuf S., Lonn E.M. HOPE-2 investigators. Homocysteine lowering with folic acid and B vitamins in people with chronic kidney disease—results of the renal Hope-2 study. Nephrol. Dial. Transpl. 2008;23:645–653. doi: 10.1093/ndt/gfm485.
- Vianna A.C., Mocelin A.J., Matsuo T., Morais-Filho D., Largura A., Delfino V.A., Soares A.E., Matni A.M. Uremic hyperhomocysteinemia: A randomized trial of folate treatment for the prevention of cardiovascular events. Hemodial. Int. 2007;11:210–216. doi: 10.1111/j.1542-4758.2007.00171.x.
- Righetti M., Serbelloni P., Milani S., Ferrario G. Homocysteine-lowering vitamin B treatment decreases cardiovascular events in hemodialysis patients. Blood Purif. 2006;24:379–386. doi: 10.1159/000093680.
- Xie D., Yuan Y., Guo J., Yang S., Xu X., Wang Q., Li Y., Qin X., Tang G., Huo Y., et al. Hyperhomocysteinemia predicts renal function decline: A prospective study in hypertensive adults. Sci. Rep. 2015;5:16268. doi: 10.1038/srep16268.
- La Manna G., Cappuccilli M.L., Cianciolo G., Conte D., Comai G., Carretta E., Scolari M.P., Stefoni S. Cardiovascular disease in kidney transplant recipients. The prognostic value of inflammatory cytokine genotypes. Transplantation. 2010;89:1001–1008. doi: 10.1097/TP.0b013e3181ce243f.
- Friedman A.N., Rosenberg I.H., Selhub J., Levey A.S., Bostom A.G. Hyperhomocysteinemia in renal transplant recipients. Am. J. Transpl. 2002;2:308–313. doi: 10.1034/j.1600-6143.2002.20404.x.
- Bostom A.G., Gohh R.Y., Liaugaudas G., Beaulieu A.J., Han H., Jacques P.F., Dworkin L., Rosenberg I.H., Selhub J. Prevalence of mild fasting hyperhomocysteinemia in renal transplant versus coronary artery disease patients after fortification of cereal grain flour with folic acid. Atherosclerosis. 1999;145:221–224. doi: 10.1016/S0021-9150(99)00023-4.
- Bostom A.G., Gohh R.Y., Beaulieu A.J., Nadeau M.R., Hume A.L., Jacques P.F., Selhub J., Rosenberg I.H. Treatment of hyperhomocysteinemia in renal transplant recipients. A randomized placebo-controlled trial. Ann. Intern. Med. 1997;127:1089–1092. doi: 10.7326/0003-4819-127-12-199712150-00006.
- Beaulieu A.J., Gohh R.Y., Han H., Hakas D., Jacques P.F., Selhub J., Bostom A.G. Enhanced reduction of fasting total homocysteine levels with supraphysiological versus standard multivitamin dose folic acid supplementation in renal transplant recipients. Arterioscler. Thromb. Vasc. Biol. 1999;19:2918–2921. doi: 10.1161/01.ATV.19.12.2918.
- Bostom A.G., Carpenter M.A., Kusek J.W., Levey A.S., Hunsicker L., Pfeffer M.A., Selhub J., Jacques P.F., Cole E., Gravens-Mueller L., et al. Homocysteine-lowering and cardiovascular disease outcomes in kidney transplant recipients: Primary results from the Folic Acid for Vascular Outcome Reduction in Transplantation trial. Circulation. 2011;123:1763–1770. doi: 10.1161/CIRCULATIONAHA.110.000588.
- Scott T.M., Rogers G., Weiner D.E., Livingston K., Selhub J., Jacques P.F., Rosenberg I.H., Troen A.M. B-Vitamin Therapy for Kidney Transplant Recipients Lowers Homocysteine and Improves Selective Cognitive Outcomes in the Randomized FAVORIT Ancillary Cognitive Trial. J. Prev. Alzheimers Dis. 2017;4:174–182. doi: 10.14283/jpad.2017.15.





