79
02 Июля 2021
Авторское право © 2018,Aleksandra Starzyńska-Kubicka, Agnieszka Perkowska-Ptasińska, Barbara Górnicka (DOI: doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Aleksandra Starzyńska-Kubicka, Agnieszka Perkowska-Ptasińska, Barbara Górnicka
Pol J Pathol 2018; 69 (3): 209-218
Введение
Мембранозный гломерулонефрит (МГН) представляет собой один из наиболее распространенных видов хронического гломерулонефрита в мире. Морфологически МГН пр...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Aleksandra Starzyńska-Kubicka, Agnieszka Perkowska-Ptasińska, Barbara Górnicka
Pol J Pathol 2018; 69 (3): 209-218
Введение
Мембранозный гломерулонефрит (МГН) представляет собой один из наиболее распространенных видов хронического гломерулонефрита в мире. Морфологически МГН пр...
Авторское право © 2018,Aleksandra Starzyńska-Kubicka, Agnieszka Perkowska-Ptasińska, Barbara Górnicka (DOI: doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Aleksandra Starzyńska-Kubicka, Agnieszka Perkowska-Ptasińska, Barbara Górnicka
Pol J Pathol 2018; 69 (3): 209-218
Введение
Мембранозный гломерулонефрит (МГН) представляет собой один из наиболее распространенных видов хронического гломерулонефрита в мире. Морфологически МГН проявляется прогрессирующим диффузным утолщением клубочковой базальной мембраны (КБМ), вызванным накоплением иммунных комплексов в субэпителиальной области клубочковых капилляров. Основным клиническим симптомом МГН является значительная протеинурия [1]. Мембранозный гломерулонефрит может быть проявлением первичной почечной аутоиммунной реакции или развиваться как следствие различных системных процессов. Настоящий обзор сфокусирован на патогенезе, морфологии и клинических ассоциациях этой относительно распространенной гломерулопатии.
Эпидемиология
Мембранозный гломерулонефрит — один из наиболее распространенных видов гломерулонефрита (ГН), который поражает взрослую популяцию во всем мире, занимает второе место после IgA-нефропатии (IgAН) и третье — в Европе и Японии после IgAN и фокально-сегментарного гломерулосклероза (ФСГС) [1, 2, 3, 4, 5] независимо от этнической принадлежности [6]. В США распространенность МГН следует за ФСГС, но предшествует IgAН [6]. Интересно, что исследования разных стран неизменно показывают, что МГН является наиболее распространенным типом ГН у пожилых людей [1, 2, 3, 4, 5, 7].
Согласно нескольким исследованиям, заболеваемость МГН оставалась стабильной в течение многих лет [6, 8], варьируясь от 4,0 на 1 млн населения/год в Чешской Республике [3] до 10,8 на 1 млн населения/год в Великобритании [2]. Хотя некоторые исследователи объясняют рост заболеваемости [2, 3] общим увеличением количества биопсий почек, проводимых каждый год [2, 3], и изменениями в политике назначения биопсии, особенно пожилым пациентам [3, 8], поскольку заболеваемость мембранозным гломерулонефритом увеличивается с возрастом [3]. Пиковая частота МГН приходится примерно на 60 лет (55–64 года), а пиковая относительная частота — примерно на 70 лет (65–74) [4]. Средний возраст пациентов с гистопатологическим диагнозом МГН составляет около 50 лет [3, 4]. В Европе среди пациентов с МГН преобладают мужчины (соотношение мужчин и женщин составляет от 1,4:1 до 2:1) [1, 3, 4]. В Азии соотношение мужчин и женщин варьирует от 2:1 (Корея) [7] до отсутствия различий между полами в Японии [5].
Мембранозный гломерулонефрит не является нозологической единицей, а представляет собой распространенный гистопатологический паттерн повреждения клубочков. Чаще всего (в 70–80% случаев) он возникает как проявление локальной аутоиммунной реакции (идиопатический, или первичный, МГН [пМГН]), но также может быть следствием различных инфекционных, системных аутоиммунных, связанных с лекарственной токсичностью или опухолевых процессов - в этих случаях он определяется как вторичный МГН (вМГН).
Патогенез мембранозного гломерулонефрита
Мембранозный гломерулонефрит не был отдельным объектом исследований до 1956 года, когда Jones опубликовал свой новый метод окрашивания, который позволил рассмотреть КБМ с большей контрастностью и, соответственно, детализацией. С применением последовательного окрашивания йодной кислотой красителями и метенамин-серебром, он смог визуализировать «положительно окрашиваемые серебром палочковидные» отростки КБМ, которые впоследствии были описаны как «шипы» [9]. В то время уже было высказано подозрение об иммунологической природе этой гломерулопатии, которая была частично подтверждена в 1957 г. выявлением отложений гамма-глобулинов в клубочках, пораженных МГН [10]. Однако последовательность событий, приводящих к формированию отложений в клубочках и протеинурии, а также сам антиген, оставались неизвестными.
Много сведений о патофизиологии МГН было получено в 1959 году, когда Heymann создал животную модель МГН, используя гомогенаты коры почки крысы. Модель существует в двух формах: активный и пассивный нефрит Хеймана (экспериментальный аутоиммунный нефрит у крыс) - АНХ и ПНХ. В активной модели введение щеточной каемки проксимальных извитых канальцев вызывает выработку аутологичных антител к почечному антигену собственной иммунной системой животного. При ПНХ мембранозный гломерулонефрит развивается после введения антисыворотки против щеточной каемки, производимой другим животным, и состоит из двух фаз: начальной гетерологичной фазы, в течение которой введенные антитела связываются с подоцитарными антигенами, и последующей аутологической фазы, когда происходит образование собственных антител животного против введенных. При нефрите Хеймана иммунологическая реакция направлена против антигенного комплекса (антигенный комплекс при нефрите Хеймана (HNAC — Heymann nephritis antigenic complex)). Основным антигеном HNAC является мегалин - гликопротеин, экспрессируемый как на клетках щеточной каемки проксимальных извитых канальцев, так и в ямках на подошвах ножек (отростков) подоцитов [11]. Показано, что эти ямки являются начальной точкой формирования иммунного комплекса (ИК) в моделях АНХ и ПНХ. Сформированные ИК быстро попадают в субэпителиальное пространство, где накапливаются в наружной светлой пластинке (lamina rara externa) клубочковой базальной мембраны (КБМ) до тех пор, пока не заслонят фильтрационную щель [11]. Отложение ИК запускает активацию комплемента, которая опосредует дальнейшее повреждение подоцитов и протеинурию. Хотя модель нефрита Хеймана значительно обогатила понимание происхождения и развития МГН, остальная часть головоломки, а именно конкретный антиген (антигены), участвующий в развитии пМГН у людей, оставалась неизвестной в течение многих лет.
В 1980-х годах возник интерес к роли электрического заряда антигена в патогенезе ГН, потому что из-за своего полианионного состава стенка клубочка представляет собой барьер, селективный не только по размеру, но и по заряду. Border et al. [12] проанализировали результаты инъекций различных форм бычьего сывороточного альбумина (БСА) кроликам и обнаружили, что следующие поражения значительно различаются: положительно заряженный БСА почти исключительно вызывал субэпителиальные отложения ИК, сопровождаемые протеинурией, в то время как отрицательно заряженный и нативный БСА имели тенденцию вызывать мезангиальные отложения и гиперцеллюлярность (многоклеточность) [12]. Дальнейшие эксперименты показали, что ИК формировались in situ вторично по отношению к связыванию положительно заряженного БСА с подоцитарной базальной мембраной [13]. Эти экспериментальные данные были подтверждены в 2011 году при исследовании случаев мембранозного гломерулонефрита в раннем детском возрасте, связанного с субэпителиальным образованием ИК in situ, содержащих положительно заряженный БСА и анти-БСА IgG-антитела [14].
В 2002 г. Debiec et al. опубликовали отчет о случае антенатального МГН, вызванного антителами против нейтральной эндопептидазы (НЭП), производимыми матерью с дефицитом НЭП [15, 16]. НЭП является цинк-зависимой металлопептидазой, присутствующей на клеточной поверхности многих органов человека и кролика, в том числе на базальной мембране подоцитов [16]. Обнаружено, что дефицит НЭП становится отражением функционального нокаута кодирующего гена НЭП, связанного с его аутосомно-рецессивной усеченной мутацией [17]. Дефицит НЭП у матери приводит к ее иммунизации против НЭП плода с последующим формированием ИК in situ в субэпителиальной области клубочковых капилляров новорожденного [15, 16]. Было установлено, что тяжесть почечной недостаточности у новорожденных зависит от титра антител против НЭП, а также от их подкласса [18].
В 2009 году Beck et al. опубликовали свое прорывное открытие гликопротеина 185 кДа, который был связан антителами, присутствующими в сыворотке пациентов с пМГН [19]. Их работа стала огромным шагом вперед в понимании патогенеза МГН, потому что они не только обнаружили целевой белок, но также смогли идентифицировать его как рецептор фосфолипазы А2 М-типа (PLA2R — phospholipase A2 receptor) и провели детальный анализ циркулирующих антител. Результаты, полученные Beck et al., открыли путь для исследований новых диагностических и прогностических инструментов для МГН. За последнее десятилетие в мире было проведено много работ, посвященных aPLA2R-АТ (анти-PLA2R-антителам) и их мишеням-антигенам [19, 20, 21, 22, 23].
Титры aPLA2R-АТ определены как прогностический фактор и ранний предиктор ремиссии, поскольку изменения уровней aPLA2R-АТ предшествуют соответствующим изменениям активности МГН (определяемой по уровню альбуминемии и потере белка в моче) [20] независимо от того, возникают они спонтанно или связаны с иммуносупрессивным лечением [20]. Некоторые пациенты, которые продуцируют низкие количества антител, могут быть серонегативными, пока не наступит насыщение антителами сайтов связывания PLA2R на подоцитах, и только тогда становятся серопозитивным [24]. Поскольку отсутствие aPLA2R-АТ в сыворотке пациентов с МГН не исключает диагноз «PLAR-связанный МГН» [22], дополнительным методом, позволяющим его распознавать, является определение наличия антигена PLA2R в клубочковых отложениях [22, 23, 25]. Обнаружено, что окрашивание тканей на PLA2R особенно полезно в случае отсроченного отбора проб сыворотки [22]; оно также обеспечило возможность проведения ретроспективной диагностики МГН, ассоциированного с PLA2R [22], особенно потому, что подготовка ткани (заморозка или заливка в парафин) не оказывает значительного влияния на результаты окрашивания [23]. Серологические и гистологические методы обнаружения aPLA2R-АТ и PLA2R антигенов являются полезными прогностическими и диагностическими инструментами, которые помогают дифференцировать пМГН и вМГН. Однако их корреляция с пМГН все еще оспаривается: в некоторых исследованиях сообщается о почти 100% специфичности [25, 26], а в других документируется присутствие aPLA2R-АТ в некоторых случаях МГН, связанных с вирусами гепатита В и С, саркоидозом и новообразованиями [19, 22, 27, 28]. Поэтому термин «PLAR-связанный МГН» кажется более подходящим.
В 2014 году Tomas et al. [29] обнаружили белок 7A, содержащий домены тромбоспондина типа 1 (THSD7A — thrombospondin Type-1 Domain-Containing 7A), трансмембранный белок, экспрессируемый в ножках подоцитов [29]. Распространенность анти-THSDA7-антител (a-THSD7A-АТ) встречается примерно у 10% a-PLA2R-АТ-отрицательных пациентов с пМГН [29, 30] и 2,5—5% всех пациентов с пМГН в европейских и американских когортах [29]. В японском исследовании сообщалось о гораздо более высокой распространенности (9,1% пациентов с пМГН) [31]. Хотя в первоначальных исследованиях говорилось о взаимоисключаемости [29, 30] этих антител, в 2016 году описаны первые два случая двойной положительной реакции (сопутствующее присутствие a-THSD7A-АТ и a-PLA2R-АТ) [30]. Выявлено некоторое сходство антител против PLA2R и THSD7A: IgG4 является доминирующим/ко-доминирующим подклассом [29, 30, 31], а уровень антител, по-видимому, коррелирует с прогрессированием заболевания [29]. Тот факт, что (в отличие от PLA2R) THSDA7 также экспрессируется на мышиных подоцитах, использован в серии экспериментов, которые выявили связывание мышиных THSD7A человеческими антителами из сыворотки пациентов с МГН, обусловленным THSD7A, а инъекция этой сыворотки мышам сопровождается развитием протеинурии [32]. Эти наблюдения доказали связь между подоцит-направленными аутоантителами и развитием МГН [32]. Пациенты с МГН, обусловленным THSD7A, демонстрируют типичные клинические проявления вместе с обычной гистоморфологией МГН [29, 30, 32] и незначительно отличаются по основным клиническим характеристикам (возраст, уровни белка в моче, сывороточных альбумина и креатинина) от пациентов с МГН, обусловленным PLA2R [29, 31], за исключением пола: МГН, обусловленный THSD7A, более распространен у пациентов женского пола [29].
Помимо случаев, когда МГН является проявлением локальной гломерулярной аутоиммунной реакции, болезнь может быть следствием наличия субэпителиальных ИК-содержащих антигенов, которые не являются компонентом клубочков. Вторичный МГН составляет около 30% случаев заболевания МГН [33] и сам по себе представляет очень гетерогенную группу ГН. Среди основных причин его возникновения волчаночный нефрит (класс V ВОЗ) [34], прием различных лекарств, таких как НПВП [35], пеницилламин [36, 37] и соли золота [36], вирус гепатита В [38] и другие инфекции [39, 40], саркоидоз [27], трансплантация гемопоэтических стволовых клеток [41] и различные злокачественные новообразования [42, 43]. Связь этих агентов и условий с развитием МГН в значительной степени основана на наблюдении за их устранением, которое приводит к снижению протеинурии.
Связь между МГН и злокачественными новообразованиями кажется особенно важной. Впервые она описана Lee et al. в 1965 г. [44] и с тех пор было опубликовано много исследований, подтверждающих это явление [43, 45, 46]. Распространенность злокачественных новообразований у пациентов с МГН колеблется от 5 до 20%, особенно у лиц старше 65 лет [43, 44, 47, 48]. Пациенты с МГН имеют риск развития злокачественных новообразований в 2–12 раз выше, чем другие представители популяции в целом после поправки на возраст и пол [42]. Механизм этой многообещающей взаимосвязи остается неясным. С самого начала исследователи подозревали, что поражения почек при МГН, связанного со злокачественными новообразованиями, — результат иммунного ответа хозяина на новообразование [44], но найти прямую связь оказалось непросто, поскольку существует несколько факторов, которые могут вводить в заблуждение [49]. Возможно, существует систематическая ошибка выявления заболеваний, обусловленная проведением более тщательного скрининга на наличие злокачественных новообразований среди пациентов с МГН [49]. Кроме того, как МГН, так и злокачественные новообразования, обычно встречаются у пожилых пациентов [49], а пожилой возраст является единственным значимым фактором риска возникновения связанного с новообразованиями МГН [42, 43, 45, 46, 47]. Наконец, прием алкилирующих агентов при лечении МГН, таких как циклофосфамид, также может увеличить риск развития последующего злокачественного новообразования [47]. Наиболее распространенной карциномой, заболеваемость которой коррелирует с МГН, является рак легких [42, 47, 49], но также сообщалось о множестве раковых опухолей другой локализации (например, предстательной железы, молочной железы, желудочно-кишечного тракта) [42, 43, 44, 49]. Хотя МГН на самом деле представляет собой наиболее часто встречающийся тип ГН, ассоциированный с солидными опухолями [44, 49], опубликованы результаты о его связи с гематологическими злокачественными новообразованиями [43, 49].
Одним из редких своеобразных типов МГН является мембранозноподобная гломерулопатия с замаскированным IgG-κ. Это тип МГН имеет типичную морфологию, выявляемую при световой микроскопии и ЭM, является отрицательным по Ig и другим иммуноглобулинам с легкими цепями, что определяется во время стандартного иммунофлуоресцентного анализа замороженной ткани. Только использование фиксированной формалином обработанной проназой парафинированной ткани позволяет обнаруживать отложения IgG с расщепленными легким κ-цепями. Этиология этого заболевания неизвестна, но в большинстве случаев болезнь наблюдалась у молодых пациентов, в основном у женщин с аутоиммунными расстройствами [50].
Генетические факторы
С целью поиска причинных факторов пМГН также были проведены генетические исследования, сфокусированные на генах, связанных с воспалительным процессом [51, 52], аутоиммунности [43, 54, 55] и PLA2R [53, 54, 55]. Показано, что ген TNF-α (провоспалительного цитокина) ассоциирован с повышенной восприимчивостью к МГН [51]; зафиксирована корреляция между аллелем высокого риска гена STAT4 (транскрипционный фактор, участвующий в воспалении) и более высокой частотой почечной недостаточности у пациентов с МГН [52]. Эти данные подтверждают роль воспалительного ответа и клеточного повреждения в патогенезе МГН. Полногеномный поиск ассоциаций (GWAS — Genome-wide association studies) однонуклеотидных полиморфизмов (SNP — single-nucleotide polymorphisms), проведенный в крупных европейских [53], а также китайских [54] и индийских [55] группах пациентов с пМГН, идентифицировал два геномных локуса, HLA-DQA1 и PLA2R1, связанных с более высоким риском развития МГН.
Морфологическая картина мембранозного гломерулонефрита
Мембранозный гломерулонефрит представляет собой хронический гломерулонефрит, обусловленный наличием иммунных комплексов (ИК) в субэпителиальной области клубочковой базальной мембраны (КБМ), вызывающих диффузное утолщение КБМ, сопровождающееся сглаживанием ножек вышележащих подоцитов. Морфологические изменения в клубочках отражают структурные реакции КБМ на отложения ИК, которые Ehrenreich and Churg [56] разделили на четыре стадии на основании данных электронной микроскопии. Описание этих стадий было позже расширено, чтобы включить характеристики поражения, визуализированные с помощью световой микроскопии и иммуноморфологического анализа. Начальная стадия развития МГН ограничивается накоплением IgG-содержащих ИК на внешней стороне КБМ, что может быть выявлено с помощью иммунофлуоресценции и электронной микроскопии (рисунок 1, 2). Эти отложения являются мелкозернистыми, рассредоточенными и, по-видимому, не вызывают каких-либо изменений в соседних областях КБМ за исключением, возможно, небольших очаговых впадин, которые представлены не всегда. Эти ранние (стадия I) поражения не распознаются при световой микроскопии [57]. На второй стадии отложения становятся более крупными и разделяются отростками КБМ (рисунок 3), которые видны при световой микроскопии с помощью окрашивания метенамин-серебром по Джонсу (JMS — Jones methenamine silver) в виде окрашенных серебром «шипов» на внешней стороне КБМ (рисунок 4). На протяжении дальнейших стадий МГН отложения полностью включаются в утолщенную КБМ (рисунок 5). Со временем отложения претерпевают резорбцию, что приводит к изменчивости их электронной плотности и вакуолизированному виду, приобретаемым КБМ при окрашивании JMS (рисунок 6, 7).
В ходе развития МГН происходит изменение внешнего вида отложений, заметное при иммуноморфологической визуализации: сначала мелкозернистая и однородная структура становится более крупнозернистой (рисунок 8). Отложения состоят в основном из IgG и C3; наиболее ярко они окрашиваются на начальной стадии, затем интенсивность окрашивания постепенно снижается. В случае ремиссий (спонтанных или обусловленных лечением) наблюдается уменьшение количества субэпителиальных отложений, а сохраняющиеся становятся более яркими, что является признаком их исчезновения. Повторные биопсии почки у пациентов с частичным прекращением протеинурии дополнительно показывают регресс аномалий, наблюдаемых в структуре подоцитов [58].
В некоторых случаях (от 10,4 до 51,9% [59] со средним значением 23,7%) МГН осложняется наложением вторичного фокально-сегментарного гломерулосклероза (ВФСГС). Фокально-сегментарный гломерулосклероз, как правило, наблюдается на более поздних стадиях (III и IV) [60] и тогда же начинает коррелировать с атрофией канальцев и интерстициальным фиброзом [60]. Наложение ВФСГС при МГН рассматривают в качестве реакции рубцевания в ответ на повреждение, вызванное отложениями иммунных комплексов [59, 60].
Наличие тубулоинтерстициальных поражений в форме воспалительной инфильтрации, интерстициального фиброза (ИФ) и канальцевой атрофии (КА) считается негативным прогностическим фактором, который коррелирует с худшим исходом для пациента, большим снижением расчетной скорости клубочковой фильтрации (рСКФ) и более быстрым прогрессированием до терминальной стадии почечной недостаточности (ТСПН) [61]. Плотность клубочков (ПК), определяемая как отношение числа несклеротических клубочков к площади области биопсии почечной коры, может быть более ранним предиктором исхода почечной болезни при МГН, так как низкая ПК была связана с большим риском снижения или прогрессирования снижения рСКФ до ТСПН [62].
Однако ПК является неспецифическим маркером, поскольку потеря нефрона и последующая гиперфильтрация связаны с худшим прогнозом при многих других заболеваниях клубочков [62].
Другие паттерны, такие как окрашивание «фулл хаус» на иммуноглобулины (то есть положительное окрашивание на пять основных маркеров при биопсии почки: IgM, IgG, IgA, C3 и C1q), наличие мезангиальных или субэндотелиальных отложений иммунных комплексов, гломерулярных воспалительных инфильтратов, фибриноидного некроза и формирование серпа (полулуния) в клубочковой капсуле, не характерны для МГН.
Клиническая картина, естественная динамика и прогноз при мембранозном гломерулонефрите
Основным клиническим проявлением МГН во всех возрастных группах является протеинурия нефротического диапазона (ПНД) [1], что делает МГН второй причиной нефротического синдрома (НС) во всей взрослой популяции [3, 5] и первой у пациентов в возрасте старше 65 лет [1, 4, 7]. Приблизительно 73% взрослых пациентов с МГН имеют нефротический синдром [1]. Средний уровень протеинурии во время обследования по поводу МГН составляет от 3,9 до 9,1 г/день [63, 64]. Около 25–30% пациентов с МГН имеют субнефротическую протеинурию. Может иметь место микроскопическая гематурия, но макроскопическая гематурия почти никогда не возникает. Другие клинические проявления МГН, такие как бессимптомные нарушения мочеиспускания, также возможны, но встречаются гораздо реже [1].
Во время проявления МГН почечная функция в основном сохраняется при средних значениях рСКФ около 75 мл/мин/1,73 м2 [63], примерно у 30% пациентов наблюдается некоторая степень почечной недостаточности.
Мембранозный гломерулонефрит обычно считается нефропатией с относительно хорошим прогнозом, причем около 30% пациентов испытывают спонтанную ремиссию. У пациентов, не проходивших лечения, риск развития терминальной стадии почечной недостаточности составляет приблизительно 14% через 5 лет, 35% через 10 лет и 41% через 15 лет [65]. Инструмент, наиболее часто используемый для прогнозирования исхода МГН, — это клиническая шкала оценки риска Торонто (Toronto Risk Score). Расчет риска основан на средней по времени протеинурии (самый длительный шестимесячный период протеинурии), клиренсе креатинина при диагностике и снижении концентрации креатинина за шесть месяцев [66]. Кроме того, несколько факторов, не включенных в формулу клинической оценки риска Торонто, были использованы при прогнозировании МГН - экскреция с мочой β2- и α1-микроглобулинов, а также титры a-PLA2R-АТ в сыворотке [67].
Классы IgG при мембранозном гломерулонефрите
При пМГН доминирующим подклассом IgG в субэпителиальных ИК является IgG4 [23]. Исследования, посвященные распределению подклассов IgG по различным стадиям пМГН, показывают, что на ранней стадии доминирует IgG1, тогда как IgG4 является наиболее распространенным подклассом на поздней стадии развития гломерулопатии. Также было задокументировано, что среди редких случаев пМГН с распределением сегментных отложений преобладали IgG1 и IgG3, тогда как в глобальном масштабе для этой гломерулопатии IgG4 был основным представленным подклассом [46, 68, 69, 70, 71]. В частности, присутствие IgG4 также признано негативным прогностическим фактором; показано, что IgG4 коррелирует с более высокими уровнями ингибитора активатора плазминогена типа I (PAI1 — plasminogen activator inhibitor type I), а более высокие уровни PAI1 приводят к более тяжелому фиброзу [72].
Происхождение протеинурии и активации системы комплемента при мембранозном гломерулонефрите
Основной причиной протеинурии при МГН является повреждение подоцитов [73]. У этих клеток есть несколько функций, включая формирование фильтрационной щели и сборку КБМ, в которой участвуют десятки различных белков. Один из механизмов, ответственных за протеинурию, — нарушение функциональной связи между цитоскелетом подоцитов и конструкцией фильтрационной щели [74]. Такое нарушение может быть вызвано ИК-индуцированной активацией комплемента, при которой сублитические количества мембраноатакующего комплекса (МАК) C5-9 вызывают диссоциацию нефрина из цитоскелета подоцитов, потерю целостности фильтрационной щели и раннюю потерю белка [75, 76, 77]. Последующее увеличение актина и снижение экспрессии альфа-интегрина в подоцитах приводит к утоньшению ножек с дальнейшим усилением протеинурии [78]. Помимо прямого повреждения подоцитов, комплекс C5b-9 может также оказывать повреждающее воздействие посредством индуцирования продукции активных форм кислорода (АФК) с последующим повреждением липидов подоцитов, мембранных белков и компонентов КБМ, таким образом изменяя структуру клеточных мембран, необходимых подоцитам для поддержания проницаемости клубочков.
Собранные до сих пор данные об участии системы комплемента в развитии МГН по-прежнему являются несогласованными. C3 и C5b-9 повсеместно присутствуют в субэпителиальных отложениях, и, как уже упоминалось, IgG4, по-видимому, является доминирующим/ко-доминирующим подклассом при МГН, ассоциированным с PLA2R [23, 79]. В отличие от других подклассов IgG, IgG4 не активирует классическую систему комплемента, которая указывает на альтернативные или лектиновый пути в качестве основных операторов образования комплекса C5-9 при пМГН. Это явление выражается в отрицательной корреляции между окрашиванием IgG4 и C1q в клубочках пациентов с МГН, хотя небольшие примеси других подклассов IgG (особенно IgG1) могут вызывать некоторое количество отложений C1q [80]. Отложение C3c (короткоживущего продукта распада C3), компонента лектинового и альтернативного путей, наблюдали почти во всех случаях МГН [68]. С другой стороны, имеются сообщения об отложении C4d, возникающих в результате работы классического или лектинового путей в 100% случаев МГН. Приведенные выше результаты указывают на то, что лектиновый путь является оператором развития МГН, возможно, при совместном функционировании двух других путей [81]. Высказано предположение, что IgG1 может доминировать на ранней стадии развития МГН, вызывая первоначальную активацию классического пути, который впоследствии может быть заменен доминированием IgG4 с усилением альтернативных или лектиновых путей [68]. Также было показано, что у пациентов с пМГН с генетическим и функциональным дефицитом лектинового пути, вероятно, альтернативный путь становится активируемым функциональным путем [82]. В свою очередь активация классического пути, для которого характерно отложение C1q, более тесно связана с вМГН, чем с пМГН [80].
Следует отметить, что активация комплемента стимулирует применение защитных механизмов, направленных против комплемент-зависимой цитотоксичности, таких как транспорт мембраноатакующего комплекса (МАК) (посредством эндо- и последующего экзоцитоза) через подоциты в пространство Боумена-Шумлянского [83, 84]. Интересно, что протеинурия при МГН может также возникать посредством прямой модификации биологии подоцитов самими антителами, без сборки комплекса C5b-9 [85, 86].
Дополнительным механизмом, предложенным в качестве оператора при возникновении протеинурии, является вызванная повреждением подоцитов экспрессия матриксной металлопротеиназы-9 (ММР-9), которая, как полагают, запускает деградацию коллагена IV и изменяет состав КБМ. B7-1 (CD80) — молекула, которая в норме экспрессируется на B-клетках и других антигенпрезентирующих клетках и, по-видимому, играет роль в передаче сигналов об угрозе повреждения клубочков [87], он экспрессируется в подоцитах в различных стрессовых условиях. Также показано, что он вносит вклад в патогенез протеинурии путем изменения цитоскелета подоцитов, что, в свою очередь, приводит к нарушению фильтрационной щели [87]. Другим компонентом КБМ, подавление которого может играть роль в развитии протеинурии, является нефронектин [74].
Лечение
Лечение пМГН всегда было сложным, в основном из-за его переменного клинического течения, которое трудно предсказать, так как одна треть пациентов с МГН достигает спонтанной ремиссии [88], в то время как приблизительно у 15% больных через 10 лет развивается терминальная стадия болезни почек [89]. Общий уровень сохранения функции почек довольно высок, он достигает 86% через 10 лет [89], но нефротический синдром (НС), который является основной клинической особенностью МГН, связан со значительной частотой возникновения осложнений (истощение, повышение восприимчивости к инфекциям, сердечно-сосудистые нарушения, гиперкоагуляция и т. д.) [90, 91, 92]. Надежных показателей спонтанной ремиссии нет [92].
В 2012 году организация «Заболевание почек: улучшение глобальных результатов лечения» (KDIGO — Kidney Disease: Improving Global Outcomes) выпустила руководство по лечению пМГН, в котором предложена стратегия ограничительной терапии: проведение иммуносупрессии предусмотрено для пациентов с НС, у которых либо не наблюдается улучшения после шести месяцев поддерживающей терапии (изменения диеты, уменьшения потери белка через снижение клубочкового фильтрационного давления), проявляющих выраженные симптомы НС, приводящие к недееспособности, или со снижающейся почечной функцией [90, 93, 94, 95]. Очевидно, что пациенты с ремиссией протеинурии менее склонны к прогрессированию ТСПН [88, 90], но даже частичная ремиссия (ЧР) улучшает прогноз [88]. Несмотря на то что после ЧР чаще наблюдаются рецидивы [96], все же имеет смысл пробовать применять иммуносупрессию, так как даже после рецидива вторая ремиссия протеинурии остается хорошим прогностическим фактором [96].
Стандартным методом иммуносупрессивного лечения пМГН является модифицированный режим Понтичелли: введение глюкокортикоидов (ГК) и алкилирующих агентов (AA), чередующихся ежемесячно в течение полугода [91]. Альтернативные варианты лечения включают ингибиторы кальциневрина (ИКН), микофеноловую кислоту (МФК), ритуксимаб, АКТГ и плазмаферез [91].
Мембранозный гломерулонефрит и трансплантация почки
Диагноз «мембранозный гломерулонефрит» появлялся несколько раз в контексте трансплантации почек, поскольку он может быть причиной ТСПН, приводящей к необходимости пересадки почек, но он также может возникать в трансплантате как рецидивирующее заболевание (первичное или вторичное), заболевание, возникшее de novo, [97] или, крайне редко, иметь донорское происхождение [98].
Около 3% всех пациентов, перенесших трансплантацию почки, достигают ТСПН вследствие МГН [99]. Общая распространенность МГН в почечных трансплантатах варьируется от 1 до 5% [99, 100] в различных исследованиях и, по-видимому, растет [100]. Четкое различие между рецидивирующим MГН (пМГН) и МГН de novo (dnМГН) невозможно установить, потому что это требует предтрансплантационной диагностики причины ТСПН в нативной почке, что не всегда доступно [97]. Различные подходы к биопсии до и после трансплантации (например, биопсия по протоколу или биопсия в соответствии с клиническими рекомендациями) приводят к различным данным о распространенности пМГН и dnМГН, описанным разными авторами [97, 101].
De novo развивающийся МГН часто сопровождается морфологическими признаками отторжения трансплантата [102, 103]. Результатом этого факта является интересная концепция, впервые представлен Ponticelli and Glassock [102]: вследствие аллоиммунного повреждения подоцитов происходит воздействие на подоцитарные криптантигены, которые становятся триггером dnМГН [103].
Заключение и выводы
Мембранозный гломерулонефрит является одним из наиболее распространенных видов гломерулопатии, диагностируемым на основании биопсии почки. Он отражает определенный патомеханизм повреждения клубочков и не должен рассматриваться как нозологическая единица. Распознавание мембранозного гломерулонефрита предполагает реализацию широкого спектра диагностических инструментов, как клинических, так и морфологических, с целью определения природы МГН. Решения о лечении следует принимать индивидуально в зависимости от происхождения МГН и его клинических ассоциаций.
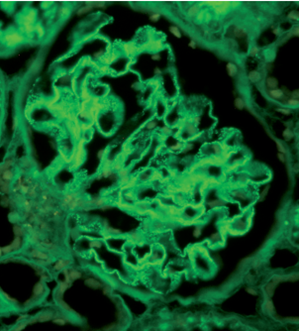 Рисунок 1. Мелкозернистые отложения IgG вдоль КБМ. Иммунофлуоресценция
Рисунок 1. Мелкозернистые отложения IgG вдоль КБМ. Иммунофлуоресценция
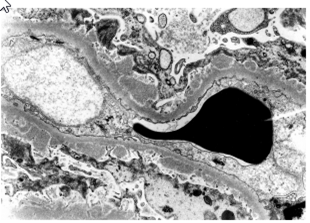 Рисунок 2. Мембранозный гломерулонефрит первой стадии с мелкими субэпителиальными электронно-плотными отложениями. Электронная микроскопия
Рисунок 2. Мембранозный гломерулонефрит первой стадии с мелкими субэпителиальными электронно-плотными отложениями. Электронная микроскопия
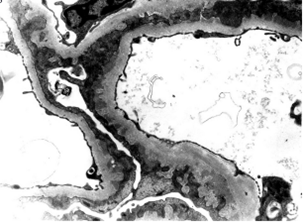 Рисунок 3. Мембранозный гломерулонефрит второй стадии, отмеченный наличием субэпителиальных электронно-плотных отложений, разделенных проекциями КБМ. Электронная микроскопия
Рисунок 3. Мембранозный гломерулонефрит второй стадии, отмеченный наличием субэпителиальных электронно-плотных отложений, разделенных проекциями КБМ. Электронная микроскопия
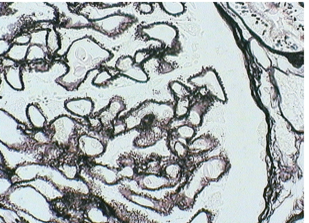 Рисунок 4. Окрашенные серебром шипы на внешней стороне КБМ. Окрашивание JMS
Рисунок 4. Окрашенные серебром шипы на внешней стороне КБМ. Окрашивание JMS
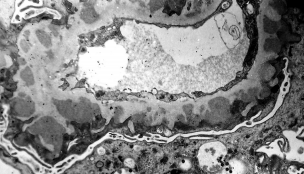 Рисунок 5. Мембранозный гломерулонефрит третьей стадии с субэпителиальными и внутримембранными отложениями. Электронная микроскопия
Рисунок 5. Мембранозный гломерулонефрит третьей стадии с субэпителиальными и внутримембранными отложениями. Электронная микроскопия
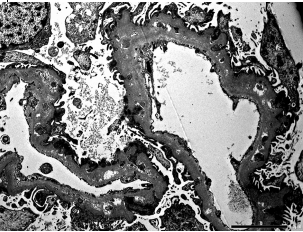 Рисунок 6. Мембранозный гломерулонефрит четвертой стадии. Электронно-прозрачные области представляют собой внутримембранные отложения в фазе ремиссии. Электронная микроскопия
Рисунок 6. Мембранозный гломерулонефрит четвертой стадии. Электронно-прозрачные области представляют собой внутримембранные отложения в фазе ремиссии. Электронная микроскопия
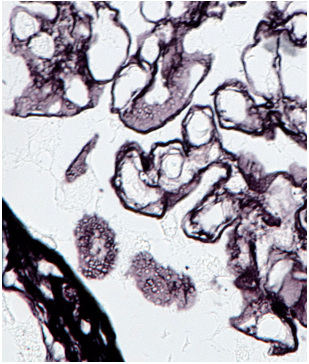 Рисунок 7. Двойной контур некоторых клубочковых капилляров, вакуолизированный вид косого среза КБМ. Окрашивание JMS
Рисунок 7. Двойной контур некоторых клубочковых капилляров, вакуолизированный вид косого среза КБМ. Окрашивание JMS
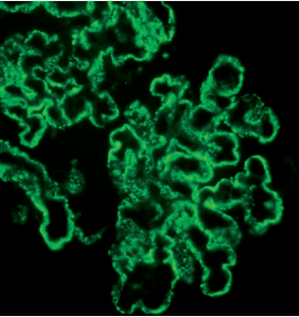 Рисунок 8. Крупные гранулированные отложения IgG вдоль КБМ. Иммунофлуоресценция
Рисунок 8. Крупные гранулированные отложения IgG вдоль КБМ. Иммунофлуоресценция
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Aleksandra Starzyńska-Kubicka, Agnieszka Perkowska-Ptasińska, Barbara Górnicka
Pol J Pathol 2018; 69 (3): 209-218
Введение
Мембранозный гломерулонефрит (МГН) представляет собой один из наиболее распространенных видов хронического гломерулонефрита в мире. Морфологически МГН проявляется прогрессирующим диффузным утолщением клубочковой базальной мембраны (КБМ), вызванным накоплением иммунных комплексов в субэпителиальной области клубочковых капилляров. Основным клиническим симптомом МГН является значительная протеинурия [1]. Мембранозный гломерулонефрит может быть проявлением первичной почечной аутоиммунной реакции или развиваться как следствие различных системных процессов. Настоящий обзор сфокусирован на патогенезе, морфологии и клинических ассоциациях этой относительно распространенной гломерулопатии.
Эпидемиология
Мембранозный гломерулонефрит — один из наиболее распространенных видов гломерулонефрита (ГН), который поражает взрослую популяцию во всем мире, занимает второе место после IgA-нефропатии (IgAН) и третье — в Европе и Японии после IgAN и фокально-сегментарного гломерулосклероза (ФСГС) [1, 2, 3, 4, 5] независимо от этнической принадлежности [6]. В США распространенность МГН следует за ФСГС, но предшествует IgAН [6]. Интересно, что исследования разных стран неизменно показывают, что МГН является наиболее распространенным типом ГН у пожилых людей [1, 2, 3, 4, 5, 7].
Согласно нескольким исследованиям, заболеваемость МГН оставалась стабильной в течение многих лет [6, 8], варьируясь от 4,0 на 1 млн населения/год в Чешской Республике [3] до 10,8 на 1 млн населения/год в Великобритании [2]. Хотя некоторые исследователи объясняют рост заболеваемости [2, 3] общим увеличением количества биопсий почек, проводимых каждый год [2, 3], и изменениями в политике назначения биопсии, особенно пожилым пациентам [3, 8], поскольку заболеваемость мембранозным гломерулонефритом увеличивается с возрастом [3]. Пиковая частота МГН приходится примерно на 60 лет (55–64 года), а пиковая относительная частота — примерно на 70 лет (65–74) [4]. Средний возраст пациентов с гистопатологическим диагнозом МГН составляет около 50 лет [3, 4]. В Европе среди пациентов с МГН преобладают мужчины (соотношение мужчин и женщин составляет от 1,4:1 до 2:1) [1, 3, 4]. В Азии соотношение мужчин и женщин варьирует от 2:1 (Корея) [7] до отсутствия различий между полами в Японии [5].
Мембранозный гломерулонефрит не является нозологической единицей, а представляет собой распространенный гистопатологический паттерн повреждения клубочков. Чаще всего (в 70–80% случаев) он возникает как проявление локальной аутоиммунной реакции (идиопатический, или первичный, МГН [пМГН]), но также может быть следствием различных инфекционных, системных аутоиммунных, связанных с лекарственной токсичностью или опухолевых процессов - в этих случаях он определяется как вторичный МГН (вМГН).
Патогенез мембранозного гломерулонефрита
Мембранозный гломерулонефрит не был отдельным объектом исследований до 1956 года, когда Jones опубликовал свой новый метод окрашивания, который позволил рассмотреть КБМ с большей контрастностью и, соответственно, детализацией. С применением последовательного окрашивания йодной кислотой красителями и метенамин-серебром, он смог визуализировать «положительно окрашиваемые серебром палочковидные» отростки КБМ, которые впоследствии были описаны как «шипы» [9]. В то время уже было высказано подозрение об иммунологической природе этой гломерулопатии, которая была частично подтверждена в 1957 г. выявлением отложений гамма-глобулинов в клубочках, пораженных МГН [10]. Однако последовательность событий, приводящих к формированию отложений в клубочках и протеинурии, а также сам антиген, оставались неизвестными.
Много сведений о патофизиологии МГН было получено в 1959 году, когда Heymann создал животную модель МГН, используя гомогенаты коры почки крысы. Модель существует в двух формах: активный и пассивный нефрит Хеймана (экспериментальный аутоиммунный нефрит у крыс) - АНХ и ПНХ. В активной модели введение щеточной каемки проксимальных извитых канальцев вызывает выработку аутологичных антител к почечному антигену собственной иммунной системой животного. При ПНХ мембранозный гломерулонефрит развивается после введения антисыворотки против щеточной каемки, производимой другим животным, и состоит из двух фаз: начальной гетерологичной фазы, в течение которой введенные антитела связываются с подоцитарными антигенами, и последующей аутологической фазы, когда происходит образование собственных антител животного против введенных. При нефрите Хеймана иммунологическая реакция направлена против антигенного комплекса (антигенный комплекс при нефрите Хеймана (HNAC — Heymann nephritis antigenic complex)). Основным антигеном HNAC является мегалин - гликопротеин, экспрессируемый как на клетках щеточной каемки проксимальных извитых канальцев, так и в ямках на подошвах ножек (отростков) подоцитов [11]. Показано, что эти ямки являются начальной точкой формирования иммунного комплекса (ИК) в моделях АНХ и ПНХ. Сформированные ИК быстро попадают в субэпителиальное пространство, где накапливаются в наружной светлой пластинке (lamina rara externa) клубочковой базальной мембраны (КБМ) до тех пор, пока не заслонят фильтрационную щель [11]. Отложение ИК запускает активацию комплемента, которая опосредует дальнейшее повреждение подоцитов и протеинурию. Хотя модель нефрита Хеймана значительно обогатила понимание происхождения и развития МГН, остальная часть головоломки, а именно конкретный антиген (антигены), участвующий в развитии пМГН у людей, оставалась неизвестной в течение многих лет.
В 1980-х годах возник интерес к роли электрического заряда антигена в патогенезе ГН, потому что из-за своего полианионного состава стенка клубочка представляет собой барьер, селективный не только по размеру, но и по заряду. Border et al. [12] проанализировали результаты инъекций различных форм бычьего сывороточного альбумина (БСА) кроликам и обнаружили, что следующие поражения значительно различаются: положительно заряженный БСА почти исключительно вызывал субэпителиальные отложения ИК, сопровождаемые протеинурией, в то время как отрицательно заряженный и нативный БСА имели тенденцию вызывать мезангиальные отложения и гиперцеллюлярность (многоклеточность) [12]. Дальнейшие эксперименты показали, что ИК формировались in situ вторично по отношению к связыванию положительно заряженного БСА с подоцитарной базальной мембраной [13]. Эти экспериментальные данные были подтверждены в 2011 году при исследовании случаев мембранозного гломерулонефрита в раннем детском возрасте, связанного с субэпителиальным образованием ИК in situ, содержащих положительно заряженный БСА и анти-БСА IgG-антитела [14].
В 2002 г. Debiec et al. опубликовали отчет о случае антенатального МГН, вызванного антителами против нейтральной эндопептидазы (НЭП), производимыми матерью с дефицитом НЭП [15, 16]. НЭП является цинк-зависимой металлопептидазой, присутствующей на клеточной поверхности многих органов человека и кролика, в том числе на базальной мембране подоцитов [16]. Обнаружено, что дефицит НЭП становится отражением функционального нокаута кодирующего гена НЭП, связанного с его аутосомно-рецессивной усеченной мутацией [17]. Дефицит НЭП у матери приводит к ее иммунизации против НЭП плода с последующим формированием ИК in situ в субэпителиальной области клубочковых капилляров новорожденного [15, 16]. Было установлено, что тяжесть почечной недостаточности у новорожденных зависит от титра антител против НЭП, а также от их подкласса [18].
В 2009 году Beck et al. опубликовали свое прорывное открытие гликопротеина 185 кДа, который был связан антителами, присутствующими в сыворотке пациентов с пМГН [19]. Их работа стала огромным шагом вперед в понимании патогенеза МГН, потому что они не только обнаружили целевой белок, но также смогли идентифицировать его как рецептор фосфолипазы А2 М-типа (PLA2R — phospholipase A2 receptor) и провели детальный анализ циркулирующих антител. Результаты, полученные Beck et al., открыли путь для исследований новых диагностических и прогностических инструментов для МГН. За последнее десятилетие в мире было проведено много работ, посвященных aPLA2R-АТ (анти-PLA2R-антителам) и их мишеням-антигенам [19, 20, 21, 22, 23].
Титры aPLA2R-АТ определены как прогностический фактор и ранний предиктор ремиссии, поскольку изменения уровней aPLA2R-АТ предшествуют соответствующим изменениям активности МГН (определяемой по уровню альбуминемии и потере белка в моче) [20] независимо от того, возникают они спонтанно или связаны с иммуносупрессивным лечением [20]. Некоторые пациенты, которые продуцируют низкие количества антител, могут быть серонегативными, пока не наступит насыщение антителами сайтов связывания PLA2R на подоцитах, и только тогда становятся серопозитивным [24]. Поскольку отсутствие aPLA2R-АТ в сыворотке пациентов с МГН не исключает диагноз «PLAR-связанный МГН» [22], дополнительным методом, позволяющим его распознавать, является определение наличия антигена PLA2R в клубочковых отложениях [22, 23, 25]. Обнаружено, что окрашивание тканей на PLA2R особенно полезно в случае отсроченного отбора проб сыворотки [22]; оно также обеспечило возможность проведения ретроспективной диагностики МГН, ассоциированного с PLA2R [22], особенно потому, что подготовка ткани (заморозка или заливка в парафин) не оказывает значительного влияния на результаты окрашивания [23]. Серологические и гистологические методы обнаружения aPLA2R-АТ и PLA2R антигенов являются полезными прогностическими и диагностическими инструментами, которые помогают дифференцировать пМГН и вМГН. Однако их корреляция с пМГН все еще оспаривается: в некоторых исследованиях сообщается о почти 100% специфичности [25, 26], а в других документируется присутствие aPLA2R-АТ в некоторых случаях МГН, связанных с вирусами гепатита В и С, саркоидозом и новообразованиями [19, 22, 27, 28]. Поэтому термин «PLAR-связанный МГН» кажется более подходящим.
В 2014 году Tomas et al. [29] обнаружили белок 7A, содержащий домены тромбоспондина типа 1 (THSD7A — thrombospondin Type-1 Domain-Containing 7A), трансмембранный белок, экспрессируемый в ножках подоцитов [29]. Распространенность анти-THSDA7-антител (a-THSD7A-АТ) встречается примерно у 10% a-PLA2R-АТ-отрицательных пациентов с пМГН [29, 30] и 2,5—5% всех пациентов с пМГН в европейских и американских когортах [29]. В японском исследовании сообщалось о гораздо более высокой распространенности (9,1% пациентов с пМГН) [31]. Хотя в первоначальных исследованиях говорилось о взаимоисключаемости [29, 30] этих антител, в 2016 году описаны первые два случая двойной положительной реакции (сопутствующее присутствие a-THSD7A-АТ и a-PLA2R-АТ) [30]. Выявлено некоторое сходство антител против PLA2R и THSD7A: IgG4 является доминирующим/ко-доминирующим подклассом [29, 30, 31], а уровень антител, по-видимому, коррелирует с прогрессированием заболевания [29]. Тот факт, что (в отличие от PLA2R) THSDA7 также экспрессируется на мышиных подоцитах, использован в серии экспериментов, которые выявили связывание мышиных THSD7A человеческими антителами из сыворотки пациентов с МГН, обусловленным THSD7A, а инъекция этой сыворотки мышам сопровождается развитием протеинурии [32]. Эти наблюдения доказали связь между подоцит-направленными аутоантителами и развитием МГН [32]. Пациенты с МГН, обусловленным THSD7A, демонстрируют типичные клинические проявления вместе с обычной гистоморфологией МГН [29, 30, 32] и незначительно отличаются по основным клиническим характеристикам (возраст, уровни белка в моче, сывороточных альбумина и креатинина) от пациентов с МГН, обусловленным PLA2R [29, 31], за исключением пола: МГН, обусловленный THSD7A, более распространен у пациентов женского пола [29].
Помимо случаев, когда МГН является проявлением локальной гломерулярной аутоиммунной реакции, болезнь может быть следствием наличия субэпителиальных ИК-содержащих антигенов, которые не являются компонентом клубочков. Вторичный МГН составляет около 30% случаев заболевания МГН [33] и сам по себе представляет очень гетерогенную группу ГН. Среди основных причин его возникновения волчаночный нефрит (класс V ВОЗ) [34], прием различных лекарств, таких как НПВП [35], пеницилламин [36, 37] и соли золота [36], вирус гепатита В [38] и другие инфекции [39, 40], саркоидоз [27], трансплантация гемопоэтических стволовых клеток [41] и различные злокачественные новообразования [42, 43]. Связь этих агентов и условий с развитием МГН в значительной степени основана на наблюдении за их устранением, которое приводит к снижению протеинурии.
Связь между МГН и злокачественными новообразованиями кажется особенно важной. Впервые она описана Lee et al. в 1965 г. [44] и с тех пор было опубликовано много исследований, подтверждающих это явление [43, 45, 46]. Распространенность злокачественных новообразований у пациентов с МГН колеблется от 5 до 20%, особенно у лиц старше 65 лет [43, 44, 47, 48]. Пациенты с МГН имеют риск развития злокачественных новообразований в 2–12 раз выше, чем другие представители популяции в целом после поправки на возраст и пол [42]. Механизм этой многообещающей взаимосвязи остается неясным. С самого начала исследователи подозревали, что поражения почек при МГН, связанного со злокачественными новообразованиями, — результат иммунного ответа хозяина на новообразование [44], но найти прямую связь оказалось непросто, поскольку существует несколько факторов, которые могут вводить в заблуждение [49]. Возможно, существует систематическая ошибка выявления заболеваний, обусловленная проведением более тщательного скрининга на наличие злокачественных новообразований среди пациентов с МГН [49]. Кроме того, как МГН, так и злокачественные новообразования, обычно встречаются у пожилых пациентов [49], а пожилой возраст является единственным значимым фактором риска возникновения связанного с новообразованиями МГН [42, 43, 45, 46, 47]. Наконец, прием алкилирующих агентов при лечении МГН, таких как циклофосфамид, также может увеличить риск развития последующего злокачественного новообразования [47]. Наиболее распространенной карциномой, заболеваемость которой коррелирует с МГН, является рак легких [42, 47, 49], но также сообщалось о множестве раковых опухолей другой локализации (например, предстательной железы, молочной железы, желудочно-кишечного тракта) [42, 43, 44, 49]. Хотя МГН на самом деле представляет собой наиболее часто встречающийся тип ГН, ассоциированный с солидными опухолями [44, 49], опубликованы результаты о его связи с гематологическими злокачественными новообразованиями [43, 49].
Одним из редких своеобразных типов МГН является мембранозноподобная гломерулопатия с замаскированным IgG-κ. Это тип МГН имеет типичную морфологию, выявляемую при световой микроскопии и ЭM, является отрицательным по Ig и другим иммуноглобулинам с легкими цепями, что определяется во время стандартного иммунофлуоресцентного анализа замороженной ткани. Только использование фиксированной формалином обработанной проназой парафинированной ткани позволяет обнаруживать отложения IgG с расщепленными легким κ-цепями. Этиология этого заболевания неизвестна, но в большинстве случаев болезнь наблюдалась у молодых пациентов, в основном у женщин с аутоиммунными расстройствами [50].
Генетические факторы
С целью поиска причинных факторов пМГН также были проведены генетические исследования, сфокусированные на генах, связанных с воспалительным процессом [51, 52], аутоиммунности [43, 54, 55] и PLA2R [53, 54, 55]. Показано, что ген TNF-α (провоспалительного цитокина) ассоциирован с повышенной восприимчивостью к МГН [51]; зафиксирована корреляция между аллелем высокого риска гена STAT4 (транскрипционный фактор, участвующий в воспалении) и более высокой частотой почечной недостаточности у пациентов с МГН [52]. Эти данные подтверждают роль воспалительного ответа и клеточного повреждения в патогенезе МГН. Полногеномный поиск ассоциаций (GWAS — Genome-wide association studies) однонуклеотидных полиморфизмов (SNP — single-nucleotide polymorphisms), проведенный в крупных европейских [53], а также китайских [54] и индийских [55] группах пациентов с пМГН, идентифицировал два геномных локуса, HLA-DQA1 и PLA2R1, связанных с более высоким риском развития МГН.
Морфологическая картина мембранозного гломерулонефрита
Мембранозный гломерулонефрит представляет собой хронический гломерулонефрит, обусловленный наличием иммунных комплексов (ИК) в субэпителиальной области клубочковой базальной мембраны (КБМ), вызывающих диффузное утолщение КБМ, сопровождающееся сглаживанием ножек вышележащих подоцитов. Морфологические изменения в клубочках отражают структурные реакции КБМ на отложения ИК, которые Ehrenreich and Churg [56] разделили на четыре стадии на основании данных электронной микроскопии. Описание этих стадий было позже расширено, чтобы включить характеристики поражения, визуализированные с помощью световой микроскопии и иммуноморфологического анализа. Начальная стадия развития МГН ограничивается накоплением IgG-содержащих ИК на внешней стороне КБМ, что может быть выявлено с помощью иммунофлуоресценции и электронной микроскопии (рисунок 1, 2). Эти отложения являются мелкозернистыми, рассредоточенными и, по-видимому, не вызывают каких-либо изменений в соседних областях КБМ за исключением, возможно, небольших очаговых впадин, которые представлены не всегда. Эти ранние (стадия I) поражения не распознаются при световой микроскопии [57]. На второй стадии отложения становятся более крупными и разделяются отростками КБМ (рисунок 3), которые видны при световой микроскопии с помощью окрашивания метенамин-серебром по Джонсу (JMS — Jones methenamine silver) в виде окрашенных серебром «шипов» на внешней стороне КБМ (рисунок 4). На протяжении дальнейших стадий МГН отложения полностью включаются в утолщенную КБМ (рисунок 5). Со временем отложения претерпевают резорбцию, что приводит к изменчивости их электронной плотности и вакуолизированному виду, приобретаемым КБМ при окрашивании JMS (рисунок 6, 7).
В ходе развития МГН происходит изменение внешнего вида отложений, заметное при иммуноморфологической визуализации: сначала мелкозернистая и однородная структура становится более крупнозернистой (рисунок 8). Отложения состоят в основном из IgG и C3; наиболее ярко они окрашиваются на начальной стадии, затем интенсивность окрашивания постепенно снижается. В случае ремиссий (спонтанных или обусловленных лечением) наблюдается уменьшение количества субэпителиальных отложений, а сохраняющиеся становятся более яркими, что является признаком их исчезновения. Повторные биопсии почки у пациентов с частичным прекращением протеинурии дополнительно показывают регресс аномалий, наблюдаемых в структуре подоцитов [58].
В некоторых случаях (от 10,4 до 51,9% [59] со средним значением 23,7%) МГН осложняется наложением вторичного фокально-сегментарного гломерулосклероза (ВФСГС). Фокально-сегментарный гломерулосклероз, как правило, наблюдается на более поздних стадиях (III и IV) [60] и тогда же начинает коррелировать с атрофией канальцев и интерстициальным фиброзом [60]. Наложение ВФСГС при МГН рассматривают в качестве реакции рубцевания в ответ на повреждение, вызванное отложениями иммунных комплексов [59, 60].
Наличие тубулоинтерстициальных поражений в форме воспалительной инфильтрации, интерстициального фиброза (ИФ) и канальцевой атрофии (КА) считается негативным прогностическим фактором, который коррелирует с худшим исходом для пациента, большим снижением расчетной скорости клубочковой фильтрации (рСКФ) и более быстрым прогрессированием до терминальной стадии почечной недостаточности (ТСПН) [61]. Плотность клубочков (ПК), определяемая как отношение числа несклеротических клубочков к площади области биопсии почечной коры, может быть более ранним предиктором исхода почечной болезни при МГН, так как низкая ПК была связана с большим риском снижения или прогрессирования снижения рСКФ до ТСПН [62].
Однако ПК является неспецифическим маркером, поскольку потеря нефрона и последующая гиперфильтрация связаны с худшим прогнозом при многих других заболеваниях клубочков [62].
Другие паттерны, такие как окрашивание «фулл хаус» на иммуноглобулины (то есть положительное окрашивание на пять основных маркеров при биопсии почки: IgM, IgG, IgA, C3 и C1q), наличие мезангиальных или субэндотелиальных отложений иммунных комплексов, гломерулярных воспалительных инфильтратов, фибриноидного некроза и формирование серпа (полулуния) в клубочковой капсуле, не характерны для МГН.
Клиническая картина, естественная динамика и прогноз при мембранозном гломерулонефрите
Основным клиническим проявлением МГН во всех возрастных группах является протеинурия нефротического диапазона (ПНД) [1], что делает МГН второй причиной нефротического синдрома (НС) во всей взрослой популяции [3, 5] и первой у пациентов в возрасте старше 65 лет [1, 4, 7]. Приблизительно 73% взрослых пациентов с МГН имеют нефротический синдром [1]. Средний уровень протеинурии во время обследования по поводу МГН составляет от 3,9 до 9,1 г/день [63, 64]. Около 25–30% пациентов с МГН имеют субнефротическую протеинурию. Может иметь место микроскопическая гематурия, но макроскопическая гематурия почти никогда не возникает. Другие клинические проявления МГН, такие как бессимптомные нарушения мочеиспускания, также возможны, но встречаются гораздо реже [1].
Во время проявления МГН почечная функция в основном сохраняется при средних значениях рСКФ около 75 мл/мин/1,73 м2 [63], примерно у 30% пациентов наблюдается некоторая степень почечной недостаточности.
Мембранозный гломерулонефрит обычно считается нефропатией с относительно хорошим прогнозом, причем около 30% пациентов испытывают спонтанную ремиссию. У пациентов, не проходивших лечения, риск развития терминальной стадии почечной недостаточности составляет приблизительно 14% через 5 лет, 35% через 10 лет и 41% через 15 лет [65]. Инструмент, наиболее часто используемый для прогнозирования исхода МГН, — это клиническая шкала оценки риска Торонто (Toronto Risk Score). Расчет риска основан на средней по времени протеинурии (самый длительный шестимесячный период протеинурии), клиренсе креатинина при диагностике и снижении концентрации креатинина за шесть месяцев [66]. Кроме того, несколько факторов, не включенных в формулу клинической оценки риска Торонто, были использованы при прогнозировании МГН - экскреция с мочой β2- и α1-микроглобулинов, а также титры a-PLA2R-АТ в сыворотке [67].
Классы IgG при мембранозном гломерулонефрите
При пМГН доминирующим подклассом IgG в субэпителиальных ИК является IgG4 [23]. Исследования, посвященные распределению подклассов IgG по различным стадиям пМГН, показывают, что на ранней стадии доминирует IgG1, тогда как IgG4 является наиболее распространенным подклассом на поздней стадии развития гломерулопатии. Также было задокументировано, что среди редких случаев пМГН с распределением сегментных отложений преобладали IgG1 и IgG3, тогда как в глобальном масштабе для этой гломерулопатии IgG4 был основным представленным подклассом [46, 68, 69, 70, 71]. В частности, присутствие IgG4 также признано негативным прогностическим фактором; показано, что IgG4 коррелирует с более высокими уровнями ингибитора активатора плазминогена типа I (PAI1 — plasminogen activator inhibitor type I), а более высокие уровни PAI1 приводят к более тяжелому фиброзу [72].
Происхождение протеинурии и активации системы комплемента при мембранозном гломерулонефрите
Основной причиной протеинурии при МГН является повреждение подоцитов [73]. У этих клеток есть несколько функций, включая формирование фильтрационной щели и сборку КБМ, в которой участвуют десятки различных белков. Один из механизмов, ответственных за протеинурию, — нарушение функциональной связи между цитоскелетом подоцитов и конструкцией фильтрационной щели [74]. Такое нарушение может быть вызвано ИК-индуцированной активацией комплемента, при которой сублитические количества мембраноатакующего комплекса (МАК) C5-9 вызывают диссоциацию нефрина из цитоскелета подоцитов, потерю целостности фильтрационной щели и раннюю потерю белка [75, 76, 77]. Последующее увеличение актина и снижение экспрессии альфа-интегрина в подоцитах приводит к утоньшению ножек с дальнейшим усилением протеинурии [78]. Помимо прямого повреждения подоцитов, комплекс C5b-9 может также оказывать повреждающее воздействие посредством индуцирования продукции активных форм кислорода (АФК) с последующим повреждением липидов подоцитов, мембранных белков и компонентов КБМ, таким образом изменяя структуру клеточных мембран, необходимых подоцитам для поддержания проницаемости клубочков.
Собранные до сих пор данные об участии системы комплемента в развитии МГН по-прежнему являются несогласованными. C3 и C5b-9 повсеместно присутствуют в субэпителиальных отложениях, и, как уже упоминалось, IgG4, по-видимому, является доминирующим/ко-доминирующим подклассом при МГН, ассоциированным с PLA2R [23, 79]. В отличие от других подклассов IgG, IgG4 не активирует классическую систему комплемента, которая указывает на альтернативные или лектиновый пути в качестве основных операторов образования комплекса C5-9 при пМГН. Это явление выражается в отрицательной корреляции между окрашиванием IgG4 и C1q в клубочках пациентов с МГН, хотя небольшие примеси других подклассов IgG (особенно IgG1) могут вызывать некоторое количество отложений C1q [80]. Отложение C3c (короткоживущего продукта распада C3), компонента лектинового и альтернативного путей, наблюдали почти во всех случаях МГН [68]. С другой стороны, имеются сообщения об отложении C4d, возникающих в результате работы классического или лектинового путей в 100% случаев МГН. Приведенные выше результаты указывают на то, что лектиновый путь является оператором развития МГН, возможно, при совместном функционировании двух других путей [81]. Высказано предположение, что IgG1 может доминировать на ранней стадии развития МГН, вызывая первоначальную активацию классического пути, который впоследствии может быть заменен доминированием IgG4 с усилением альтернативных или лектиновых путей [68]. Также было показано, что у пациентов с пМГН с генетическим и функциональным дефицитом лектинового пути, вероятно, альтернативный путь становится активируемым функциональным путем [82]. В свою очередь активация классического пути, для которого характерно отложение C1q, более тесно связана с вМГН, чем с пМГН [80].
Следует отметить, что активация комплемента стимулирует применение защитных механизмов, направленных против комплемент-зависимой цитотоксичности, таких как транспорт мембраноатакующего комплекса (МАК) (посредством эндо- и последующего экзоцитоза) через подоциты в пространство Боумена-Шумлянского [83, 84]. Интересно, что протеинурия при МГН может также возникать посредством прямой модификации биологии подоцитов самими антителами, без сборки комплекса C5b-9 [85, 86].
Дополнительным механизмом, предложенным в качестве оператора при возникновении протеинурии, является вызванная повреждением подоцитов экспрессия матриксной металлопротеиназы-9 (ММР-9), которая, как полагают, запускает деградацию коллагена IV и изменяет состав КБМ. B7-1 (CD80) — молекула, которая в норме экспрессируется на B-клетках и других антигенпрезентирующих клетках и, по-видимому, играет роль в передаче сигналов об угрозе повреждения клубочков [87], он экспрессируется в подоцитах в различных стрессовых условиях. Также показано, что он вносит вклад в патогенез протеинурии путем изменения цитоскелета подоцитов, что, в свою очередь, приводит к нарушению фильтрационной щели [87]. Другим компонентом КБМ, подавление которого может играть роль в развитии протеинурии, является нефронектин [74].
Лечение
Лечение пМГН всегда было сложным, в основном из-за его переменного клинического течения, которое трудно предсказать, так как одна треть пациентов с МГН достигает спонтанной ремиссии [88], в то время как приблизительно у 15% больных через 10 лет развивается терминальная стадия болезни почек [89]. Общий уровень сохранения функции почек довольно высок, он достигает 86% через 10 лет [89], но нефротический синдром (НС), который является основной клинической особенностью МГН, связан со значительной частотой возникновения осложнений (истощение, повышение восприимчивости к инфекциям, сердечно-сосудистые нарушения, гиперкоагуляция и т. д.) [90, 91, 92]. Надежных показателей спонтанной ремиссии нет [92].
В 2012 году организация «Заболевание почек: улучшение глобальных результатов лечения» (KDIGO — Kidney Disease: Improving Global Outcomes) выпустила руководство по лечению пМГН, в котором предложена стратегия ограничительной терапии: проведение иммуносупрессии предусмотрено для пациентов с НС, у которых либо не наблюдается улучшения после шести месяцев поддерживающей терапии (изменения диеты, уменьшения потери белка через снижение клубочкового фильтрационного давления), проявляющих выраженные симптомы НС, приводящие к недееспособности, или со снижающейся почечной функцией [90, 93, 94, 95]. Очевидно, что пациенты с ремиссией протеинурии менее склонны к прогрессированию ТСПН [88, 90], но даже частичная ремиссия (ЧР) улучшает прогноз [88]. Несмотря на то что после ЧР чаще наблюдаются рецидивы [96], все же имеет смысл пробовать применять иммуносупрессию, так как даже после рецидива вторая ремиссия протеинурии остается хорошим прогностическим фактором [96].
Стандартным методом иммуносупрессивного лечения пМГН является модифицированный режим Понтичелли: введение глюкокортикоидов (ГК) и алкилирующих агентов (AA), чередующихся ежемесячно в течение полугода [91]. Альтернативные варианты лечения включают ингибиторы кальциневрина (ИКН), микофеноловую кислоту (МФК), ритуксимаб, АКТГ и плазмаферез [91].
Мембранозный гломерулонефрит и трансплантация почки
Диагноз «мембранозный гломерулонефрит» появлялся несколько раз в контексте трансплантации почек, поскольку он может быть причиной ТСПН, приводящей к необходимости пересадки почек, но он также может возникать в трансплантате как рецидивирующее заболевание (первичное или вторичное), заболевание, возникшее de novo, [97] или, крайне редко, иметь донорское происхождение [98].
Около 3% всех пациентов, перенесших трансплантацию почки, достигают ТСПН вследствие МГН [99]. Общая распространенность МГН в почечных трансплантатах варьируется от 1 до 5% [99, 100] в различных исследованиях и, по-видимому, растет [100]. Четкое различие между рецидивирующим MГН (пМГН) и МГН de novo (dnМГН) невозможно установить, потому что это требует предтрансплантационной диагностики причины ТСПН в нативной почке, что не всегда доступно [97]. Различные подходы к биопсии до и после трансплантации (например, биопсия по протоколу или биопсия в соответствии с клиническими рекомендациями) приводят к различным данным о распространенности пМГН и dnМГН, описанным разными авторами [97, 101].
De novo развивающийся МГН часто сопровождается морфологическими признаками отторжения трансплантата [102, 103]. Результатом этого факта является интересная концепция, впервые представлен Ponticelli and Glassock [102]: вследствие аллоиммунного повреждения подоцитов происходит воздействие на подоцитарные криптантигены, которые становятся триггером dnМГН [103].
Заключение и выводы
Мембранозный гломерулонефрит является одним из наиболее распространенных видов гломерулопатии, диагностируемым на основании биопсии почки. Он отражает определенный патомеханизм повреждения клубочков и не должен рассматриваться как нозологическая единица. Распознавание мембранозного гломерулонефрита предполагает реализацию широкого спектра диагностических инструментов, как клинических, так и морфологических, с целью определения природы МГН. Решения о лечении следует принимать индивидуально в зависимости от происхождения МГН и его клинических ассоциаций.
 Рисунок 1. Мелкозернистые отложения IgG вдоль КБМ. Иммунофлуоресценция
Рисунок 1. Мелкозернистые отложения IgG вдоль КБМ. Иммунофлуоресценция Рисунок 2. Мембранозный гломерулонефрит первой стадии с мелкими субэпителиальными электронно-плотными отложениями. Электронная микроскопия
Рисунок 2. Мембранозный гломерулонефрит первой стадии с мелкими субэпителиальными электронно-плотными отложениями. Электронная микроскопия Рисунок 3. Мембранозный гломерулонефрит второй стадии, отмеченный наличием субэпителиальных электронно-плотных отложений, разделенных проекциями КБМ. Электронная микроскопия
Рисунок 3. Мембранозный гломерулонефрит второй стадии, отмеченный наличием субэпителиальных электронно-плотных отложений, разделенных проекциями КБМ. Электронная микроскопия Рисунок 4. Окрашенные серебром шипы на внешней стороне КБМ. Окрашивание JMS
Рисунок 4. Окрашенные серебром шипы на внешней стороне КБМ. Окрашивание JMS Рисунок 5. Мембранозный гломерулонефрит третьей стадии с субэпителиальными и внутримембранными отложениями. Электронная микроскопия
Рисунок 5. Мембранозный гломерулонефрит третьей стадии с субэпителиальными и внутримембранными отложениями. Электронная микроскопия Рисунок 6. Мембранозный гломерулонефрит четвертой стадии. Электронно-прозрачные области представляют собой внутримембранные отложения в фазе ремиссии. Электронная микроскопия
Рисунок 6. Мембранозный гломерулонефрит четвертой стадии. Электронно-прозрачные области представляют собой внутримембранные отложения в фазе ремиссии. Электронная микроскопия Рисунок 7. Двойной контур некоторых клубочковых капилляров, вакуолизированный вид косого среза КБМ. Окрашивание JMS
Рисунок 7. Двойной контур некоторых клубочковых капилляров, вакуолизированный вид косого среза КБМ. Окрашивание JMS Рисунок 8. Крупные гранулированные отложения IgG вдоль КБМ. Иммунофлуоресценция
Рисунок 8. Крупные гранулированные отложения IgG вдоль КБМ. ИммунофлуоресценцияСписок использованной литературы
- Perkowska-Ptasinska A, Bartczak A, Wagrowska-Danilewicz M, et al. Clinicopathologic correlations of renal pathology in the adult population of Poland. Nephrol Dial Transplant 2017; 32 (suppl 2): ii209-ii218.
- Hanko JB, Mullan RN, O’Rourke DM, et al. The changing pattern of adult primary glomerular disease. Nephrol Dial Transplant 2009; 24: 3050-3054.
- Maixnerova D, Jancova E, Skibova J, et al. Nationwide biopsy survey of renal diseases in the Czech Republic during the years 1994-2011. J Nephrol 2015; 28: 39-49.
- Perkowska-Ptasinska A, Deborska-Materkowska D, Bartczak A, et al. Kidney disease in the elderly: biopsy based data from 14 renal centers in Poland. BMC Nephrol 2016; 17: 194.
- Nationwide and Long-Term Survey of Primary Glomerulonephritis in Japan as Observed in 1,850 Biopsied Cases. Nephron 1999; 82: 205-213.
- Sim JJ, Batech M, Hever A, et al. Distribution of Biopsy-Proven Presumed Primary Glomerulonephropathies in 2000-2011 Among a Racially and Ethnically Diverse US Population. Am J Kidney Dis 2016; 68: 533-544.
- Choi IJ, Jeong HJ, Han DS, et al. An analysis of 4,514 cases of renal biopsy in Korea. Yonsei Med J 2001; 42: 247-254.
- McGrogan A, Franssen CF, de Vries CS. The incidence of primary glomerulonephritis worldwide: a systematic review of the literature. Nephrol Dial Transplant 2011; 26: 414-430.
- Jones DB. Nephrotic glomerulonephritis. Am J Pathol 1957; 33: 313-329.
- Mellors RC, Ortega LG, Holman HR. Role of gamma globulins in pathogenesis of renal lesions in systemic lupus erythematosus and chronic membranous glomerulonephritis, with an observation on the lupus erythematosus cell reaction. J Exp Med 1957; 106: 191-202.
- Farquhar MG, Saito A, Kerjaschki D, et al. The Heymann nephritis antigenic complex: megalin (gp330) and RAP. J Am Soc Nephrol 1995; 6: 35-47.
- Border WA, Ward HJ, Kamil ES, et al. Induction of membranous nephropathy in rabbits by administration of an exogenous cationic antigen. J Clin Invest 1982; 69: 451-461.
- Koyama A, Inage H, Kobayashi M, et al. Effect of chemical cationization of antigen on glomerular localization of immune complexes in active models of serum sickness nephritis in rabbits. Immunology 1986; 58: 529-534.
- Debiec H, Lefeu F, Kemper MJ, et al. Early-childhood membranous nephropathy due to cationic bovine serum albumin. N Engl J Med 2011; 364: 2101-2110.
- Debiec H, Guigonis V, Mougenot B, et al. Antenatal membranous glomerulonephritis due to anti-neutral endopeptidase antibodies. N Engl J Med 2002; 346: 2053-2060.
- Debiec H, Guigonis V, Mougenot B, et al. Antenatal membranous glomerulonephritis with vascular injury induced by anti-neutral endopeptidase antibodies: toward new concepts in the pathogenesis of glomerular diseases. J Am Soc Nephrol 2003; 14 Suppl 1: S27-S32.
- Debiec H, Nauta J, Coulet F, et al. Role of truncating mutations in MME gene in fetomaternal alloimmunisation and antenatal glomerulopathies. Lancet 2004; 364: 1252-1259.
- Vivarelli M, Emma F, Pellé T, et al. Genetic homogeneity but IgG subclass-dependent clinical variability of alloimmune membranous nephropathy with anti-neutral endopeptidase antibodies. Kidney Int 2015; 87: 602-609.
- Beck LH Jr, Bonegio RG, Lambeau G, et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Engl J Med 2009; 361: 11-21.
- Beck LH Jr, Fervenza FC, Beck DM, et al. Rituximab-induced depletion of anti-PLA2R autoantibodies predicts response in membranous nephropathy. J Am Soc Nephrol 2011; 22: 1543-1550.
- Timmermans SA, Abdul Hamid MA, Cohen Tervaert JW, et al. Anti-PLA2R Antibodies as a Prognostic Factor in PLA2R-Related Membranous Nephropathy. Am J Nephrol 2015; 42: 70-77.
- Svobodova B, Honsova E, Ronco P, et al. Kidney biopsy is a sensitive tool for retrospective diagnosis of PLA2R-related membranous nephropathy. Nephrol Dial Transplant 2013; 28: 1839-1844.
- Hara S, Goto S, Kamiura N, et al. Reappraisal of PLA2R1 in membranous nephropathy: immunostaining method influence and association with IgG4-dominant phenotype. Virchows Arch 2015; 467: 87-94.
- Cattran DC, Brenchley PE. Membranous nephropathy: integrating basic science into improved clinical management. Kidney Int 2017; 91: 566-574.
- Dai H, Zhang H, He Y. Diagnostic accuracy of PLA2R autoantibodies and glomerular staining for the differentiation of idiopathic and secondary membranous nephropathy: an updated meta-analysis. Sci Rep 2015; 5: 8803.
- Du Y, Li J, He F, et al. The diagnosis accuracy of PLA2R-AB in the diagnosis of idiopathic membranous nephropathy: a meta-analysis. PLoS One 2014; 9: e104936.
- Stehlé T, Audard V, Ronco P, et al. Phospholipase A2 receptor and sarcoidosis-associated membranous nephropathy. Nephrol Dial Transplant 2015; 30: 1047-1050.
- Xie Q, Li Y, Xue J, et al. Renal phospholipase A2 receptor in hepatitis B virus-associated membranous nephropathy. Am J Nephrol 2015; 41: 345-353.
- Tomas NM, Beck LH Jr, Meyer-Schwesinger C, et al. Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy. N Engl J Med 2014; 371: 2277-2287.
- Larsen CP, Cossey LN, Beck LH. THSD7A staining of membranous glomerulopathy in clinical practice reveals cases with dual autoantibody positivity. Mod Pathol 2016; 29: 421-426.
- Iwakura T, Ohashi N, Kato A, et al. Prevalence of Enhanced Granular Expression of Thrombospondin Type-1 Domain-Containing 7A in the Glomeruli of Japanese Patients with Idiopathic Membranous Nephropathy. PLoS One 2015; 10: e0138841.
- Tomas NM, Hoxha E, Reinicke AT, et al. Autoantibodies against thrombospondin type 1 domain-containing 7A induce membranous nephropathy. J Clin Invest 2016; 126: 2519-2532.
- Abe S, Amagasaki Y, Konishi K, et al. Idiopathic membranous glomerulonephritis: aspects of geographical differences. J Clin Pathol 1986; 39: 1193-1198.
- Donadio JV Jr, Burgess JH, Holley KE. Membranous lupus nephropathy: a clinicopathologic study. Medicine (Baltimore) 1977; 56: 527-536.
- Nawaz FA, Larsen CP, Troxell ML. Membranous nephropathy and nonsteroidal anti-inflammatory agents. Am J Kidney Dis 2013; 62: 1012-1017.
- Makino H, Yoshinaga Y, Yamasaki Y, et al. Renal involvement in rheumatoid arthritis: analysis of renal biopsy specimens from 100 patients. Mod Rheumatol 2002; 12: 148-154.
- Hall CL, Jawad S, Harrison PR, et al. Natural course of penicillamine nephropathy: a long term study of 33 patients. Br Med J (Clin Res Ed) 1988; 296: 1083-1086
- Lai KN, Li PK, Lui SF et al. Membranous nephropathy related to hepatitis B virus in adults. N Engl J Med 1991; 324: 1457-1463.
- Ozkok A, Yildiz A. Hepatitis C virus associated glomerulopathies. World J Gastroenterol 2014; 20: 7544-7554.
- Araújo Sde A, Giordano LF, Rosa AA, et al. Membranous glomerulonephritis secondary to syphilis. Braz J Infect Dis 2015; 19: 442-443.
- Hiramatsu R, Ubara Y, Sawa N, et al. Clinicopathological analysis of allogeneic hematopoietic stem cell transplantation-related membranous glomerulonephritis. Hum Pathol 2016; 50: 187-194.
- Lefaucheur C, Stengel B, Nochy D, et al. Membranous nephropathy and cancer: Epidemiologic evidence and determinants of high-risk cancer association. Kidney Int 2006; 70: 1510-1517.
- Leeaphorn N, Kue-A-Pai P, Thamcharoen N, et al. Prevalence of cancer in membranous nephropathy: a systematic review and meta-analysis of observational studies. Am J Nephrol 2014; 40: 29-35.
- Lee JC, Yamauchi H, Hopper J Jr. The association of cancer and the nephrotic syndrome. Ann Intern Med 1966; 64: 41-51.
- Qu Z, Liu G, Li J, et al. Absence of glomerular IgG4 deposition in patients with membranous nephropathy may indicate malignancy. Nephrol Dial Transplant 2012; 27: 1931-1937.
- Lönnbro-Widgren J, Ebefors K, Mölne J, et al. Glomerular IgG subclasses in idiopathic and malignancy-associated membranous nephropathy. Clin Kidney J 2015; 8: 433-439.
- Alnasrallah B, Collins JF, Zwi LJ. Malignancy in membranous nephropathy: evaluation of incidence. Int J Nephrol 2017; 2017: 8409829.
- Murtas C, Ghiggeri GM. Membranous glomerulonephritis: histological and serological features to differentiate cancer-related and non-related forms. J Nephrol 2016; 29: 469-478.
- Pani A, Porta C, Cosmai L, et al. Glomerular diseases and cancer: evaluation of underlying malignancy. J Nephrol 2016; 29: 143-152.
- Larsen CP, Ambuzs JM, Bonsib SM, et al. Membranous-like glomerulopathy with masked IgG kappa deposits. Kidney Int 2014; 86: 154-161.
- Bantis C, Heering PJ, Aker S, et al. Tumor necrosis factor-alpha gene G-308A polymorphism is a risk factor for the development of membranous glomerulonephritis. Am J Nephrol 2006; 26: 12-15.
- Chen SY, Chen CH, Huang YC, et al. Association of STAT4 polymorphisms with susceptibility to primary membranous glomerulonephritis and renal failure. Clin Chim Acta 2011; 412: 1899-904.
- Stanescu HC, Arcos-Burgos M, Medlar A, et al. Risk HLA-DQA1 and PLA(2)R1 alleles in idiopathic membranous nephropathy. N Engl J Med 2011; 364: 616-626.
- Lv J, Hou W, Zhou X, et al. Interaction between PLA2R1 and HLA-DQA1 variants associates with anti-PLA2R antibodies and membranous nephropathy. J Am Soc Nephrol 2013; 24: 1323-1329.
- Ramachandran R, Kumar V, Kumar A, et al. PLA2R antibodies, glomerular PLA2R deposits and variations in PLA2R1 and HLA-DQA1 genes in primary membranous nephropathy in South Asians. Nephrol Dial Transplant 2016; 31: 1486-1493.
- Churg J, Ehrenreich T. Membranous nephropathy. Perspect Nephrol Hypertens 1973; 1 Pt 1: 443-448.
- Paraskevakou H, Kavantzas N, Pavlopoulos PM, et al. Membranous glomerulonephritis: a morphometric study. Pathol Res Pract 2000; 196: 141-144.
- Ruggenenti P, Cravedi P, Sghirlanzoni MC, et al. Effects of rituximab on morphofunctional abnormalities of membranous glomerulopathy. Clin J Am Soc Nephrol 2008; 3: 1652-1659.
- Morita M, Mii A, Shimizu A, et al. Glomerular endothelial cell injury and focal segmental glomerulosclerosis lesion in idiopathic membranous nephropathy. PLoS One 2015; 10: e0116700.
- Gu QH, Cui Z, Huang J, et al. Patients With Combined Membranous Nephropathy and Focal Segmental Glomerulosclerosis Have Comparable Clinical and Autoantibody Profiles With Primary Membranous Nephropathy: A Retrospective Observational Study. Medicine (Baltimore) 2016; 95: e3786.
- Mariani LH, Martini S, Barisoni L, et al. Interstitial fibrosis scored on whole-slide digital imaging of kidney biopsies is a predictor of outcome in proteinuric glomerulopathies. Nephrol Dial Transplant 2018; 33: 310-318.
- Tsuboi N, Kawamura T, Miyazaki Y, et al. Low glomerular density is a risk factor for progression in idiopathic membranous nephropathy. Nephrol Dial Transplant 2011; 26: 3555-3560.
- Sprangers B, Bomback AS, Cohen SD, et al. Idiopathic membranous nephropathy: clinical and histologic prognostic features and treatment patterns over time at a tertiary referral center. Am J Nephrol 2012; 36: 78-89.
- Yokoyama H, Taguchi T, Sugiyama H, et al. Membranous nephropathy in Japan: analysis of the Japan Renal Biopsy Registry (J-RBR). Clin Exp Nephrol 2012; 16: 557-63.
- Hogan SL, Muller KE, Jennette JC, et al. A review of therapeutic studies of idiopathic membranous glomerulopathy. Am J Kidney Dis 1995; 25: 862-875.
- Cattran DC, Pei Y, Greenwood CM, et al. Validation of a predictive model of idiopathic membranous nephropathy: its clinical and research implications. Kidney Int 1997; 51: 901-907.
- Hoxha E, Thiele I, Zahner G, et al. Phospholipase A2 receptor autoantibodies and clinical outcome in patients with primary membranous nephropathy. J Am Soc Nephrol 2014; 25: 1357-1366.
- Segawa Y, Hisano S, Matsushita M, et al. IgG subclasses and complement pathway in segmental and global membranous nephropathy. Pediatr Nephrol 2010; 25: 1091-1099.
- Kuroki A, Shibata T, Honda H, et al. Glomerular and serum IgG subclasses in diffuse proliferative lupus nephritis, membranous lupus nephritis, and idiopathic membranous nephropathy. Intern Med 2002; 41: 936-942.
- Kearney N, Podolak J, Matsumura L, et al. Patterns of IgG subclass deposits in membranous glomerulonephritis in renal allografts. Transplant Proc 2011; 43: 3743-3746.
- Ohtani H, Wakui H, Komatsuda A, et al. Distribution of glomerular IgG subclass deposits in malignancy-associated membranous nephropathy. Nephrol Dial Transplant 2004; 19: 574-579.
- Ma LJ, Fogo AB. PAI-1 and kidney fibrosis. Front Biosci (Landmark Ed) 2009; 14: 2028-2041.
- Scharpé J, Maes B, Van Damme B. The podocyte: from bench to bedside. Acta Clin Belg 2005; 60: 86-93.
- Müller-Deile J, Dannenberg J, Schroder P, et al. Podocytes regulate the glomerular basement membrane protein nephronectin by means of miR-378a-3p in glomerular diseases. Kidney Int 2017; 92: 836-849.
- Saran AM, Yuan H, Takeuchi E, et al. Complement mediates nephrin redistribution and actin dissociation in experimental membranous nephropathy. Kidney Int 2003; 64: 2072-2078.
- Cunningham PN, Quigg RJ. Contrasting roles of complement activation and its regulation in membranous nephropathy. J Am Soc Nephrol 2005; 16: 1214-1222.
- Nangaku M, Shankland SJ, Couser WG. Cellular response to injury in membranous nephropathy. J Am Soc Nephrol 2005; 16: 1195-1204.
- Nosaka H, Tamura Y, Kojima K, et al. Podocyte foot process effacement in very early phase of passive Heymann nephritis is not a prerequisite for proteinuria. J Nephrol 2009; 22: 484-490.
- Yang Y, Wang C, Jin L, et al. IgG4 anti-phospholipase A2 receptor might activate lectin and alternative complement pathway meanwhile in idiopathic membranous nephropathy: an inspiration from a cross-sectional study. Immunol Res 2016; 64: 919-930.
- Vidarsson G, Dekkers G, Rispens T. IgG subclasses and allotypes: from structure to effector functions. Front Immunol 2014; 5: 520.
- Lhotta K, Würzner R, König P. Glomerular deposition of mannose-binding lectin in human glomerulonephritis. Nephrol Dial Transplant 1999; 14: 881-886.
- Bally S, Debiec H, Ponard D, et al. Phospholipase A2 Receptor-Related Membranous Nephropathy and Mannan-Binding Lectin Deficiency. J Am Soc Nephrol 2016; 27: 3539-3544.
- Tegla CA, Cudrici C, Patel S, et al. Membrane attack by complement: the assembly and biology of terminal complement complexes. Immunol Res 2011; 51: 45-60.
- Bohana-Kashtan O, Ziporen L, Donin N, et al. Cell signals transduced by complement. Mol Immunol 2004; 41: 583-597.
- Spicer ST, Tran GT, Killingsworth MC, et al. Induction of passive Heymann nephritis in complement component 6-deficient PVG rats. J Immunol 2007; 179: 172-178.
- Leenaerts PL, Hall BM, Van Damme BJ, et al. Active Heymann nephritis in complement component C6 deficient rats. Kidney Int 1995; 47: 1604-1614.
- Reiser J, von Gersdorff G, Loos M, et al. Induction of B7-1 in podocytes is associated with nephrotic syndrome. J Clin Invest 2004; 113: 1390-1397.
- Polanco N, Gutiérrez E, Covarsí A, et al. Spontaneous remission of nephrotic syndrome in idiopathic membranous nephropathy. J Am Soc Nephrol 2010; 21: 697-704.
- van den Brand JA, van Dijk PR, Hofstra JM, et al. Long-term outcomes in idiopathic membranous nephropathy using a restrictive treatment strategy. J Am Soc Nephrol 2014; 25: 150-158.
- Ponticelli C. Prognosis and treatment of membranous nephropathy. Kidney Int 1986; 29: 927-940.
- van de Logt AE, Hofstra JM, Wetzels JF. Pharmacological treatment of primary membranous nephropathy in 2016. Expert Rev Clin Pharmacol 2016; 9: 1463-1478.
- Cattran D, Brenchley P. Membranous nephropathy: thinking through the therapeutic options. Nephrol Dial Transplant 2017; 32 (suppl. 1): i22-i29.
- Kidney Disease: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO Clinical Practice Guideline for Glomerulonephritis 2012.
- Alfaadhel T, Cattran D. Management of Membranous Nephropathy in Western Countries. Kidney Dis (Basel) 2015; 1: 126-137.
- Barbour SJ, Greenwald A, Djurdjev O, et al. Disease-specific risk of venous thromboembolic events is increased in idiopathic glomerulonephritis. Kidney Int 2012; 81: 190-195.
- du Buf-Vereijken PW, Wetzels JF. Efficacy of a second course of immunosuppressive therapy in patients with membranous nephropathy and persistent or relapsing disease activity. Nephrol Dial Transplant 2004; 19: 2036-2043.
- Golgert WA, Appel GB, Hariharan S. Recurrent glomerulonephritis after renal transplantation: an unsolved problem. Clin J Am Soc Nephrol 2008; 3: 800-807.
- Mirza MK, Kim L, Kadambi PV, et al. Membranous nephropathy transplanted in the donor kidney: observations of resolving glomerulopathy in serial allograft biopsies. Nephrol Dial Transplant 2014; 29: 2343-2347.
- Aline-Fardin A, Rifle G, Martin L, et al. Recurent and de novo membranous glomerulopathy after kidney transplantation. Transplant Proc 2009; 41: 669-671.
- Pippias M, Stel VS, Aresté-Fosalba N, et al. Long-term Kidney Transplant Outcomes in Primary Glomerulonephritis: Analysis From the ERA-EDTA Registry. Transplantation 2016; 100: 1955-1962.
- Ponticelli C, Glassock RJ. De novo membranous nephropathy (MN) in kidney allografts. A peculiar form of alloimmune disease? Transpl Int 2012; 25: 1205-10.
- Wen J, Xie K, Zhang M et al. HLA-DR, and not PLA2R, is expressed on the podocytes in kidney allografts in de novo membranous nephropathy. Medicine (Baltimore) 2016; 95: e4809.





