5309
06 Августа 2021
Авторское право © 2019, Maciej Drozdz, André Weigert, Fatima Silva, João Frazão, Abdulkareem Alsuwaida, Mahesh Krishnan, Werner Kleophas, Szymon Brzosko, Fredrik K. Johansson, Stefan H. Jacobson (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Мацей Дроздз, Андре Вайгерт, Фатима Сильва, Жуан Фразан, Абдулкарим Алсувайда, Махеш Кришнан, Вернер Клеофас, Шимон Бжоско, Фредрик К. Йоханссон,...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Мацей Дроздз, Андре Вайгерт, Фатима Сильва, Жуан Фразан, Абдулкарим Алсувайда, Махеш Кришнан, Вернер Клеофас, Шимон Бжоско, Фредрик К. Йоханссон,...
Авторское право © 2019, Maciej Drozdz, André Weigert, Fatima Silva, João Frazão, Abdulkareem Alsuwaida, Mahesh Krishnan, Werner Kleophas, Szymon Brzosko, Fredrik K. Johansson, Stefan H. Jacobson (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Мацей Дроздз, Андре Вайгерт, Фатима Сильва, Жуан Фразан, Абдулкарим Алсувайда, Махеш Кришнан, Вернер Клеофас, Шимон Бжоско, Фредрик К. Йоханссон, Стефан Х. Якобсон
Аннотация
Введение
В настоящее время оптимального алгоритма лечения пациентов с анемией, развившейся как следствие гемодиализа препаратами на основе железа и стимуляторами эритропоэза, не выработано. Необходимый уровень гемоглобина может быть достигнут путем регулярных внутривенных инъекций железа с меньшей дозой препаратов, стимулирующих эритропоэз (ПСЭ), или с меньшим количеством железа при более высоких дозах стимуляторов. Терапия с использованием стимуляторов при анемии может привести к серьезным осложнениям с образованием тромбов в венах и артериях, в то время как данные об осложнениях, возникших в результате лечения внутривенного введения железа, немногочисленны.
Методы
Всего в исследовании участвовало 1247 пациентов, проходящих процедуру поддерживающего гемодиализа в 12 диализных центрах Португалии (n = 730 человек) и Польши (n = 517 человек). Проведен анализ результатов применения практики KDIGO, направленной на поиск методов лечения, по-разному применяющихся в различных странах. Например, в Польше доза и частота инъекций железа оказалась на 35–72% выше по сравнению с Португалией (p < 0,001) в течение трех месяцев. Стимуляторы использовались на 61% чаще в Португалии (5034 МЕ против 3133 МЕ (с учетом поправок)/нед., p <0,001).
Результат
Средняя концентрация гемоглобина одинакова у пациентов из обеих стран 11,0/11,0 г/дл), доля пациентов c анемией, участвовавших в исследовании по KDIGO, составила 69,5% среди поляков и 65,8% среди португальцев (NS). Насыщение ферритином и трансферрином > 20% и > 50% соответственно, значительно выше у пациентов из Польши (88,8 и 14,6%) по сравнению с пациентами из Португалии (76,3 и 5,7% соответственно, p < 0,001). В Польше выявлено гораздо больше пациентов с показателем ферритина более 800 мкг/л (35,6%) по сравнению с Португалией (15,8%, р<0,001). Индекс резистентности к стимуляторам (ИРС) заметно выше у пациентов, лечившихся в Португалии (р<0,001). Корреляционный анализ выявил неопределенности в показаниях к лечению в моделях, не предполагающих поправок. Множественные и логистический регрессионные анализы показали, что при уровне ферритина, отвечающего стандарту KDIGO, то есть в пределах 200–800 мкг/л, вероятность достижения оптимального уровня гемоглобина заметно возрастает. Ежегодное увеличение смертности в Польше составило 16%, в Португалии – 13% (NS). Различий в смертности в зависимости от причинного фактора не выявлено.
Выводы
Прием большего объема железа внутривенно в рамках планового клинического гемодиализа не оказывает выраженного вредного воздействия. При этом для получения неопровержимых доказательств безопасности метода необходимо провести крупное рандомизированное исследование.
Введение
Анемия, наблюдающаяся у пациентов, проходящих процедуру гемодиализа, значительно ухудшает качество жизни. Некоторые исследования показали, что тяжелая анемия способствует развитию левосторонней желудочковой гипертрофии, сердечно-сосудистых заболеваний, трансфузионных инфекций, требующих госпитализации и способных привести к летальному исходу [1, 2]. Лечение анемии у пациентов, проходящих гемодиализ, сводилось к применению препаратов, стимулирующих эритропоэз (ПСЭ), и лекарственных средств на основе железа. При этом на фоне опасений по поводу безопасности применения больших доз ПСЭ для достижения заметных уровней гемоглобина, подтвердившихся в ходе клинических исследований, таких как NHS [3], CREATE [4], CHOIR [5, 6] and TREAT [7], интерес к терапии с внутривенным введением железа возрос [8, 9].
Многие пациенты с гемодиализом имеют отрицательный баланс железа из-за плохого аппетита, ограниченной с точки зрения содержания железа диеты, недостатка всасывания, а также потери данного элемента из-за пищеварительных расстройств. Потеря крови, связанная с гемодиализом и заборами для анализов, заметно различается в зависимости от времени проведения анализов и особенностей пациентов, а также вследствие антикоагулянтной и антиагрегантной терапии [10, 11].
В текущей клинической практике сывороточный уровень железа, ферритина и насыщение трансферрином (НТ) оцениваются как маркеры метаболизма железа. Однако эти показатели далеки от оптимальных, так как на них может влиять недостаток питания и воспалительный процесс: и то, и другое характерно для пациентов с гемодиализом [12, 13]. Прием железа часто требуется для восстановления и увеличения концентрации гемоглобина, а также для уравновешивания ответа на лечение ПСЭ. Однако высказаны опасения, связанные с безопасностью и вероятностью передозировки железа, что потенциально может привести к оксидативному стрессу, обострению сердечно-сосудистых заболеваний и инфекций, а также гиперчувствительности [12, 13].
Лечение пациентов гемодиализа ПСЭ может привести к различным побочным явлениям, например инсульту, венозной тромбоэмболической болезни [16], при этом некоторые пациенты не демонстрируют адекватного ответа на терапию ВСЭ [17, 18].
Данные о внутривенном лечении железом в комбинации с ПСЭ довольно ограничены, и влияние железа на исход заболеваний не доказано.
Клиническая рекомендация KDIGO (улучшение мировых показателей) по лечению анемии [19] предполагает более широкое применение терапии железом на период гемодиализа, в том числе повышенное насыщение трансферрином и прием ферритина, во время которых терапия железом должна возобновляться или прекращаться. С момента публикации рекомендации во многих странах в большей мере изменился порядок лечения анемии со значительным снижением уровня гемоглобина, уменьшением доз ПСЭ и увеличением дозы VI-валентного железа [8, 9]. Данные исследования результатов диализа и клинического подхода (Dialysis Outcomes and Practice Patterns Study, DOPPS) выявили тенденцию к увеличению концентрации ферритина в сыворотке крови в последние годы. Например, количество пациентов с гемодиализом, у которых уровень ферритина в крови превышал 800 нг/мл, приблизилось к 40%. Похожие тенденции наблюдаются и в странах Европы [8].
В ходе многоцентрового исследования, проведенного в Европе, сравнивались клинические методы и стратегии, направленные на достижение показателей KDIGO при лечении почечной анемии. Данное когортное исследование группы пациентов с гемодиализом проводилось в 12 центрах DaVita в Португалии и Польше в рамках программы повышения качества лечения. Проведен сравнительный анализ среднегодовых показателей смерти по странам и исследовательским центрам.
Методы
В исследовании участвовало 1247 пациентов, проходивших гемодиализ в центрах DaVita Португалии (пять диализных центров, n=730, средний возраст – 69 ± 14 лет (SD), 40% пациентов – женщины) и центрах Da Vita в Польше (семь диализных центров, n = 517, средний возраст – 67 ± 15 лет, 47% – женщины). В ходе исследования анализировалась степень достижения результатов лечения почечной анемии по KDIGO и вырабатывались методы лечения, различавшиеся в двух странах в зависимости от местных традиций и социально-экономических факторов (Таблица 1 и Таблица 2). Когорта включает всех пациентов с гемодиализом, лечившихся во всех центрах Da Vita Португалии и Польши, и таким образом отражает реальную картину по результатам диализа и клинического подхода в двух странах Европы, до этого не участвовавших в DOPPS-анализах.
Таблица 1. Демографический и лабораторный профиль
Таблица 2. Особенности пациентов
Демографические данные и информация по процедурам собирались в течение одного и того же месяца в обеих странах. Ежемесячные дозы железа регистрировались в течение трех месяцев в обоих регионах. Анализ крови проводился ежемесячно или раз в три месяца в соответствии с международными клиническими рекомендациями (европейские современные клинические рекомендации, KDIGO). Результаты оценивались главным медицинским специалистом страны и ежемесячно обсуждались с главным медицинским специалистом Евросоюза.
Чаще всего причины развития терминальной почечной недостаточности (ТПН) как в Португалии (42%), так и в Польше (35%) обозначались как «неизвестно» или «другое». Сахарный диабет, нефросклероз и гломерулонефрит – причины развития ТПН у 30%, 10% и 11% пациентов в Португалии соответственно; в Польше ТПН вызвана этими заболеваниями у 25%, 13% и 20% пациентов соответственно (p < 0,001).
Все анализы проводились в местных лабораториях в рамках одобренных и рекомендуемых практик. Измерялся уровень остаточного гормона паращитовидных желез (ГПЩЖ) spKt/V = Kt/V в однокамерной модели. Поправочный коэффициент дозы дарбэпоэтина к эпоэтину составил 250. Индекс резистентности к препаратам, стимулирующим эритропоэз, определялся делением скорректированной по массе тела дозы ПСЭ на уровень гемоглобина [IU/кг/(г/дл)].
Исследование одобрено Стокгольмским этическим комитетом Каролинского института (Стокгольм, Швеция). Клинические и лабораторные данные предоставлялись каждой страной без идентифицирующей информации, статистические анализы проводились SHJ и FHJ на факультете клинических наук Каролинского института (Стокгольм, Швеция).
Статистические анализы
Статистические анализы проводились с помощью программы IBM SPSS Statistics версии 25 на Кафедре медицинской статистики Каролинского института (Стокгольм, Швеция). Все показатели являются средними, сравнения по странам проводились на основе t-критерия Стьюдента и критерия Хи-квадрат. В ходе корреляционных исследований применялся коэффициент корреляции Пирсона, множественный регрессионный и логистический регрессионный анализы на основе независимых переменных. Результаты представлены как соотношение неравенства с дополнительной величиной р и бета-коэффициента с величиной р. Поскольку данные о летальных исходах на момент исследования неизвестны, определить отношения моментных рисков с помощью регрессионного анализа Кокса невозможно. Статистически значимой величиной считалось p< 0,05.
Результаты
Демографические и лабораторные профили
На Таблицах 1 и 2 показаны средние демографические и клинические (SD) показатели и категориальные данные (%) по всем пациентам, в том числе с распределением по конкретным странам. Пациенты, проходившие гемодиализ в учреждениях Португалии, по сравнению с пациентами из Польши старше (69 по сравнению с 67 годами), дольше находились на диализе (66 по сравнению с 53 месяцами), имели меньший вес и ИМТ (Таблица 1). Высокий индекс коморбидности Чарлсона (7–12 или более 12) гораздо чаще наблюдался у пациентов, лечившихся в учреждениях Португалии, нежели в Польше (p < 0,001, Таблица 2). Уровень альбумина в сыворотке крови был 40 (3) г/л и 41 (4) г/л у португальских и польских пациентов соответственно (NS), но пациентов с концентрацией альбумина ≥35 г/л выявлено намного больше в Португалии (95%), а не в Польше (82%, p < 0,001, Таблица 2). Содержание серы в сыворотке крови заметно выше (p < 0,001), и количество пациентов с концентрацией фосфора ≤5,5 мг/дл значительно ниже (p < 0,001) в Польше по сравнению с Португалией, однако существенных различий по содержанию остаточных ГПЩЖ нет (Таблица 1 и Таблица 2).
Назначение гемодиализа
Практически всем пациентам, лечившимся на территории Португалии, назначена гемодиафильтрация (ГДФ), в то время как в Польше 91% пациентов проходили стандартную процедуру гемодиализа (с использованием мембран со 100-процентной гидравлической проницаемостью) и 9% проходили ГДФ (p <0,001, Таблица 2). Артериовенозная фистула (АВФ) применялась у 77% пациентов из Португалии и у 76% пациентов из Польши (NS, Таблица 2). Коэффициент spKt/V > 1,2 и ОМР ≥ 70% достигнут у почти всех пациентов, но чаще у пациентов из Португалии (p = 0,003 и p <0,001 соответственно, Таблица 2). Средняя продолжительность лечения в неделю составила 724 (53 минуты) в Португалии и 737 (55 минут) в Польше (p < 0,001), назначенная скорость тока крови (Qb) и соответствующий объем очищенной крови за процедуру значительно выше у пациентов из Португалии, чем у пациентов из Польши (p <0,001 для обоих сравнений, Таблица 1 и Таблица 2).
Почечная анемия
Средний уровень гемоглобина у пациентов, лечившихся в Португалии и Польше, одинаков (11,0 (1,3) г/дл), количество пациентов, лечившихся от почечной анемии и достигших целевых показателей по KDIGO (гемоглобин 10–12 г/дл), также примерно равно (66% и 70% соответственно, Таблицы 1, 2 и Рисунок 1). ПСЭ принимали 78,3% португальских и 73,7 польских пациентов (NS, Таблица 2). Недельная доза ПСЭ, скорректированная для эпоэтина/дарбэпоэтина (× 250) заметно выше 5154 (6077) U у пациентов из Португалии, чем у пациентов из Польши (3133 (3068) U, p<0,001). Прием также осуществлялся по-разному: португальцам назначались большие дозы железа (Таблица 2). Назначение ПСЭ в обеих странах осуществлялось примерно одинаково. Средняя доза ПСЭ составила 6,23 IU/кг/(г/дл); при этом португальцы принимали заметно более высокие дозы (7,53) по сравнению с пациентами из Польши (4,42; p < 0,001). Множественный регрессионный анализ индекса ПСЭ c поправкой возраста методом пошагового исключения, период пребывания на диализе, коэффициент Kt/V, сывороточный уровень альбумина, индекс коморбидности Чарльсона и географический признак (Польша или Португалия) показали сильную зависимость изменений по ПСЭ от страны (бета-величина − 3,462, p <0,001).
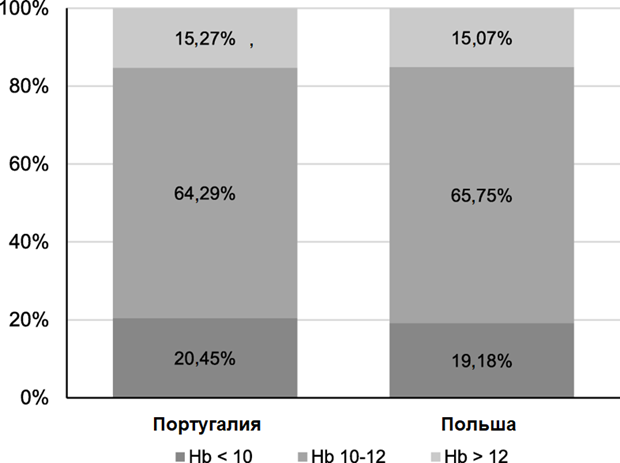 Рисунок 1. Соотношение высоких, нормальных и пониженных показателей гемоглобина по KDIGO у пациентов из Португалии и Польши
Рисунок 1. Соотношение высоких, нормальных и пониженных показателей гемоглобина по KDIGO у пациентов из Португалии и Польши
В диализных центрах Польши в течение трех месяцев внутривенное введение железа применялось на 35–72% чаще по сравнению с Португалией (p <0,001, Таблица 1). НТФ, доли пациентов с НТФ ≥20% и > 50% заметно выше (p <0,001 по всем трем сравнениям) в Польше (Таблицы 1, 2 и Рисунок 2), чем в Португалии. Уровень ферритина, а также процентная доля пациентов с уровнем ферритина в сыворотке крови > 800 мкг/л значительно выше (p <0,001 для обоих сравнений) среди пациентов, лечившихся в Польше (Таблицы 1, 2 и Рисунок 2).
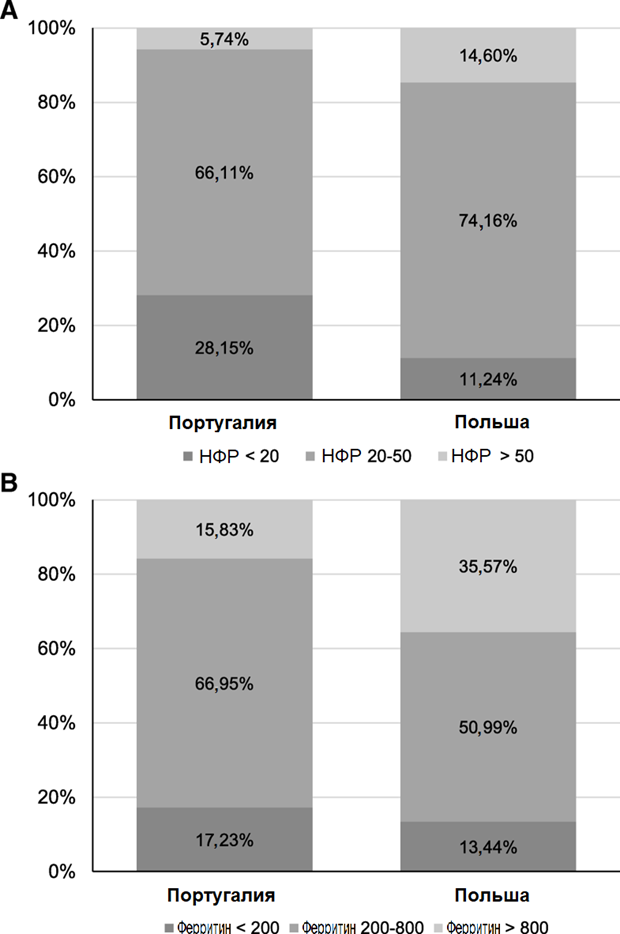 Рисунок 2. Соотношение высоких, нормальных и низких достигнутых показателей НТФ по KDIGO (a) и ферритина (b) у пациентов, лечившихся в диализных центрах Польши и Португалии
Рисунок 2. Соотношение высоких, нормальных и низких достигнутых показателей НТФ по KDIGO (a) и ферритина (b) у пациентов, лечившихся в диализных центрах Польши и Португалии
Также в ходе исследования проанализирована степень достижения назначенных показателей по гемоглобину в зависимости от пола у всех 1247 пациентов (у 70% женщин и 65% мужчин показатели гемоглобина – в пределах назначенной нормы, NS), а также в зависимости от страны проживания (в Португалии показатели женщин и мужчин – 70% и 63% (NS), в Польше – 71% и 68% соответственно).
По инструментам гемодиализа, у 68% пациентов, которым вводились АВФ, уровень гемоглобина составил 10 и 12 г/дл, по сравнению с пациентами, которым вводился центральный венозный катетер (ЦВК, NS). По странам 68% и 69% пациентов с АВФ из Польши и Португалии соответственно достигли назначенных показателей гемоглобина по KDIGO (NS). Среди группы пациентов, которым вводились ЦВК, доля пациентов с уровнем гемоглобина в 10–12 г/дл намного выше у поляков (74%), чем у португальцев (48%, p < 0,001).
Корреляционный множественный и логистический регрессионный анализ
Корреляционный анализ (Таблица 3) показал значительные отрицательные соотношения между уровнем гемоглобина и ферритина у всех пациентов (коэффициент корреляции Пирсона, r =-0,13, p <0,01), в частности – португальцев (r = − 0,22, p <0,01). У пациентов из Польши подобных показателей не отмечено (NS). Также не выявлено значимых соотношений между уровнем гемоглобина и НФР среди пациентов в зависимости от страны. Получены значимые отрицательные соотношения между уровнем гемоглобина и исправленными недельными дозами ПСЭ (эпоэтин/дарбэпоэтин) по всем пациентам (r = − 0,27, p <0,01) в целом, и по пациентам из Португалии (r = − 0,25, p <0,01) и Польши по отдельности (r = − 0,38, p <0,01). В совокупности на основе этих выводов нельзя выработать однозначных рекомендаций по выбору метода лечения. Ферритин является маркером системных воспалительных процессов, и пациентам, у которых наблюдается гиперчувствительность к ПСЭ, например, вследствие недоедания или воспалительных заболеваний, часто назначают повышенные дозы ПСЭ для достижения целевых показателей.
Таблица 3. Анализ соотношений (r = коэффициент Пирсона) между достигнутыми показателями гемоглобина и ферритина, НФР и недельной дозы ПСЭ в группе в целом, а также в Португалии и Польше по отдельности
Множественный регрессионный анализ (Таблица 4) уровня гемоглобина (величина бета) с учетом возраста, пола, ИМТ, НФР, уровня ферритина, альбумина и ГПЩЖ, показал, что ферритин оказывает наиболее мощное влияние на гемоглобин, и коэффициент воздействия на его уровень составил 0,004 (p <0,001). Последующий логистический регрессионный анализ показал, что для достижения уровня ферритина в 200–800 мкг/л и целевого уровня гемоглобина (10–12 г/дл) соотношение неравенства должно составлять 1,521 (p < 0,001). Эта взаимосвязь оказалась более выраженной среди пациентов из Португалии (коэффициент неравенства – 1,865, p <0,001, Таблица 4) и менее выраженной у пациентов из Польши. Таким образом, достижение целевого показателя ферритина по KDIGO в 200–800 мкг/л значительно увеличивает шансы на получение целевых показателей гемоглобина.
Таблица 4. Множественный (a) и логистический (b) регрессионный анализ влияния лечения на уровень гемоглобина г/дл и назначенный целевой показатель гемоглобина в 10–12 г/дл
Смертность
Проанализированы общие годовые показатели смертности в зависимости от причины смерти в каждой из стран по отдельности и во всех диализных центрах в совокупности. В Польше общий показатель смертности составил 16%, в Португалии – 13%. Существенных различий в годовых показателях смертности в диализных центрах конкретной страны не выявлено. Также отсутствуют различия в годовых показателях смертности в зависимости от причины смерти (сердечно-сосудистые, цереброваскулярные, инфекционные и онкологические заболевания) между двумя странами (Рисунок 3).
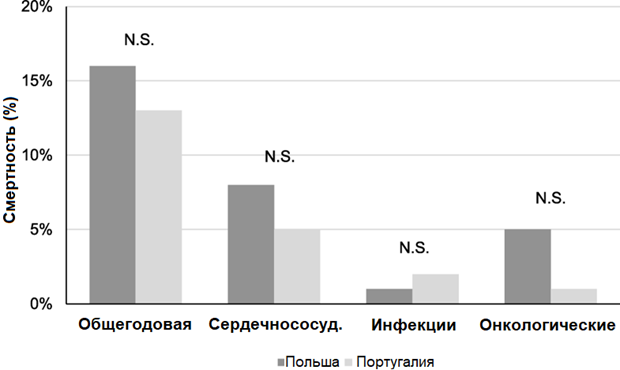 Рисунок 3. Общий уровень смертности в зависимости от причин (%) среди пациентов из Португалии и Польши
Рисунок 3. Общий уровень смертности в зависимости от причин (%) среди пациентов из Португалии и Польши
Обсуждение
Наиболее важное открытие, сделанное в ходе этого крупного многоцентрового перекрестного исследования с участием пациентов, лечившихся в 12 диализных центрах Португалии и Польши, состоит в том, что показатели по KDIGO у пациентов, страдавших почечной анемией, достигнуты в обеих странах, однако разными методами и стратегиями лечения. Показатели уровня гемоглобина в двух странах схожи, доля пациентов, добившихся назначенных по KDIGO показателей, составила 69,5% (Польша) и 65,8% (Португалия). Назначенные месячные дозы железа оказались на 35–72% выше в Польше, чем в Португалии (p <0,001). Уровень ферритина и НФР, а также доля пациентов с НФР > 20% и > 50% значительно выше в Польше (88,8% и 14,6%) по сравнению с Португалией (76,3 и 5,7% соответственно). Среди пациентов из Польши доля пациентов, у кого уровень ферритина составил > 800 мкг/л, была значительно выше (35,6%) аналогичного показателя у Португалии (15,8%). И наоборот, назначенные дозы ПСЭ в Португалии оказались намного выше (5154 U), чем в Польше (3133 U). Множественный и логистический регрессионные анализы показали, что достижение назначенных по KDIGO показателей ферритина в 200–800 мкг/л значительно увеличивает шансы на достижение целевых показателей гемоглобина. Можно сделать вывод, что выбор метода лечения почечной анемии во многом определяется клинической практикой и социально-экономическими факторами.
В настоящее время алгоритмов лечения анемии путем гемодиализа с применением железа и ПСЭ не существует. Многие специалисты считают, что для достижения рекомендуемых на международном уровне показателей гемоглобина не следует назначать слишком высокие дозы ПСЭ или железа, особенно пациентам, у которых имеются сопутствующие заболевания. Исследование выявило различия в клинических подходах, а также демографических особенностях пациентов, лечившихся в клиниках Польши и Португалии. Средний возраст португальцев был выше, и лечение гемодиализом длилось дольше, при этом среди них было больше пациентов, страдавших сахарным диабетом и показывавших высокий индекс коморбидности Чарлсона. Все это свидетельствовало о более высоких показателях коморбидности по сравнению с пациентами Польши. Несмотря на это, среди португальцев было намного больше пациентов с уровнем альбумина > 35 г/л, и ЦВК применялись реже, чем в Польше.
В ходе исследования оптимальных методов лечения почечной анемии (ORAMA), опубликованного десять лет назад [20], предварительно оценена роль рекомендаций в достижении результатов лечения почечной анемии [21]. Результаты выявили высокий уровень гемоглобина у пациентов гемодиализа из Западной Европы по сравнению с пациентами из Восточной Европы. Хотя данные свидетельствуют о низких показателях гемоглобина у жителей Восточной Европы, информация давно не обновлялась.
Некоторые ые исследования показали, что анемия у пациентов, лечащихся гемодиализом, повышает риск цереброваскулярных и сердечно-сосудистых заболеваний, госпитализаций и летального исхода [1, 2, 22]. Однако учитывая, что почечная анемия нередко является маркером коморбидности, причинно-следственных связей в настоящее время не установлено. Имеются опасения по поводу безопасности применения высоких доз ПСЭ при лечении ХБП [5, 6, 7]. Исследование TREAT доказало высокий риск развития сердечно-сосудистых заболеваний среди пациентов, принимающих ПСЭ при высоком уровне гемоглобина [7]. Расширение группы с высоким целевым показателем гемоглобина не оказало влияния на первичную статистику сердечно-сосудистых заболеваний, однако отмечен большой риск развития венозных и артериальных тромбоэмболических заболеваний и инсульта, не связанного со средним уровнем артериального давления. Недавно проведенное крупное когортное исследование пациентов из Испании выявило соотношение дозировки ПСЭ и смертности: высокие дозы ПСЭ коррелировали с высокой смертностью несмотря на поправки c учетом возможных факторов, усугубляющих течение заболевания, в том числе гемоглобина и предикторов, связанных со сверхчувствительностью к ПСЭ [23]. В ходе настоящего исследования установлено, что пациенты из Португалии принимали более высокие дозы ПСЭ, однако общая годовая смертность, а также смертность в зависимости от причин, оказались сопоставимыми – 13% в Португалии и 16 % в Польше.
Во время исследования оба метода лечения – увеличение доз ПСЭ (+65%) при небольших дозах железа или увеличение дозы железа (+35%-72% в течение месяца) при небольших дозах ПСЭ – привели к достижению уровня гемоглобина, назначенного по рекомендациям KDIGO, у большинства пациентов. Гиперчувствительность к ПСЭ – частое явление при гемодиализе, наблюдается примерно у 10% пациентов, лечащихся от заболеваний почек с применением ПСЭ [24]. Недостаток железа, инфекции/воспаление и неправильное проведение диализа – наиболее частые причины гиперчувствительности [24]. В ходе настоящего исследования показатели рисков среди пациентов из Португалии оказались выше данных пациентов из Польши. Недавнее крупное ое исследование показало, что пациенты, лечившиеся ГДФ, меньше подвержены рискам, однако в нем участвовали лишь те, кому эритропоэтин вводился внутривенно [25]. В ходе исследования использовались ПСЭ одного типа, однако в Португалии чаще практиковалось внутривенное введение ПСЭ. Влияние способа введения ПСЭ на требования дозировки и чувствительность много изучалось, однако к общему выводу прийти не удалось. Недавнее исследование 24 957 пациентов, лечившихся гемодиализом с 2011 по 2014 годы, не выявило различий между эффектами от подкожного и внутривенного введения железа несмотря на увеличение доли пациентов, получающих железо подкожно [23]. Позднее установлена взаимосвязь между высокими дозами железа и увеличением числа госпитализаций и смертности, при этом тип инъекций на статистику осложнений и смертность влияния не оказал [26].
Ученые согласны, что терапия железом показана людям, страдающим недостатком железа, и она способствует повышению уровня гемоглобина, снижает необходимость ПСЭ-терапии и позволяет скорректировать более щадящим образом лечение ПСЭ [27]. И НФР, и ферритин имеют свои недостатки с точки зрения оценки уровня железа и выбора стратегии дальнейшего лечения железом. Уровни НФР и ферритина считаются показателями недостатка железа и назначаются в больших дозах пациентам, лечащимся гемодиализом, чем остальным пациентам, из-за воспалительных явлений. [28]. Возникает немало споров по поводу безопасности и эффективности внутривенного введения железа, особенно для пациентов с повышенным уровнем ферритина в сыворотке крови. Железосвязывающие белки могут перестать справляться с нагрузкой, что может привести к высвобождению свободных атомов железа в кровеносной системе и/или привести к образованию отложений. Ранние исследования показали, что инъекции железа у пациентов, лечащихся гемодиализом, приводят к временному усилению окислительного стресса, выражающегося в появлении в плазме крови пероксидов липидов и измененных в результате окисления белков [15]. В настоящее время трудно судить о «безопасном» ферритиновом потолке для сыворотки крови, однако по KDIGO НФР не должно превышать 30%, а сывороточный уровень ферритина – 500 нг/мл на период терапии железом [19].
Крупных контролируемых клинических исследований влияния агрессивной железотерапии на результаты до настоящего времени не проводилось, выводы ых исследований оказались неоднозначными. В исследовании Miskulin et al. [29] участвовало 14 078 пациентов из США, лечившихся диализом с 2003 по 2008 гг. Оно не выявило взаимосвязи между общей смертностью, смертностью в результате сердечно-сосудистых и инфекционных заболеваний и внутривенным введением ≤1050 мг железа в течение трех месяцев, либо 2100 мг в течение шести месяцев. Также в ходе исследования [30] группы не выявлено устойчивой взаимосвязи между внутривенным введением железа и риском госпитализаций, как в общем плане, так и в результате сердечно-сосудистых и инфекционных заболеваний, даже среди пациентов, получающих более 2100 мг железа в течение шести месяцев. Новое многоцентровое ое исследование безопасности внутривенного введения железа, проведенное с участием отдельных пациентов, показало отсутствие взаимосвязи между постепенным увеличением доз железа и смертностью после учета факторов, способных усугубить течение болезни [31]. Недавний системный обзор и метаанализ семи отдельно взятых контролируемых испытаний и 15 обсервационных исследований, охватывающих более 140 000 пациентов, лечившихся гемодиализом, не выявил увеличения риска развития инфекционных, сердечно-сосудистых заболеваний, госпитализации или летального исхода в результате увеличения доз вводимого железа [32]. В совокупности эти выводы свидетельствуют о том, что назначение высоких внутривенных доз железа в рамках планового лечения анемии у пациентов на период гемодиализа не оказывает существенного вреда, хотя для подтверждения этих выводов потребуются дополнительные рандомизированные исследования.
Преимуществом данной работы является то, что в нем участвовали все пациенты, проходившие гемодиализ в центрах Da Vita в двух странах Европы, ранее не входивших в программу DOPPS, что позволило получить «реальную картину» в области лечения почечной анемии в Западной и Восточной Европе. Такие анализы позволяют оценить существующие парадигмы в сфере здравоохранения и дают основу для разработки новых подходов к лечению. Однако в исследовании есть некоторые ограничения. Во-первых, это обсервационное перекрестное исследование опиралось на имевшиеся данные, поэтому не позволило оценить влияние изменений в дозировке при внутривенном введении железа или ПСЭ на уровень ферритина. Во-вторых, из-за отсутствия индивидуальных данных пациентов невозможно оценить риски госпитализации и смертность. В-третьих, отсутствуют данные о накоплении железа в течение длительного времени по каждому пациенту. Отдельным пациентам можно назначать как низкие, так и высокие дозы железа или ПСЭ в зависимости от результатов ежемесячных лабораторных анализов, например уровня гемоглобина, НФР и ферритина.
Выводы
В ходе международного многоцентрового исследования проанализированы клинические практики и методы лечения почечной анемии с участием 1247 пациентов, лечившихся гемодиализом в 12 диализных центрах, расположенных в двух странах Европы, ранее не участвовавших в глобальной программе DOPPS. Назначенные по KDIGO результаты лечения достигнуты и у пациентов из Португалии, и из Польши, но различными методами. Поскольку уровень смертности во всех центрах оказался одинаковым, сделан вывод о том, что увеличение внутривенных доз железа в рамках обычного курса лечения не оказывает вредного влияния на организм. Для получения неопровержимых доказательств безопасности железа необходимы более тщательные рандомизированные контролируемые исследования.
Список используемой литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Мацей Дроздз, Андре Вайгерт, Фатима Сильва, Жуан Фразан, Абдулкарим Алсувайда, Махеш Кришнан, Вернер Клеофас, Шимон Бжоско, Фредрик К. Йоханссон, Стефан Х. Якобсон
Аннотация
Введение
В настоящее время оптимального алгоритма лечения пациентов с анемией, развившейся как следствие гемодиализа препаратами на основе железа и стимуляторами эритропоэза, не выработано. Необходимый уровень гемоглобина может быть достигнут путем регулярных внутривенных инъекций железа с меньшей дозой препаратов, стимулирующих эритропоэз (ПСЭ), или с меньшим количеством железа при более высоких дозах стимуляторов. Терапия с использованием стимуляторов при анемии может привести к серьезным осложнениям с образованием тромбов в венах и артериях, в то время как данные об осложнениях, возникших в результате лечения внутривенного введения железа, немногочисленны.
Методы
Всего в исследовании участвовало 1247 пациентов, проходящих процедуру поддерживающего гемодиализа в 12 диализных центрах Португалии (n = 730 человек) и Польши (n = 517 человек). Проведен анализ результатов применения практики KDIGO, направленной на поиск методов лечения, по-разному применяющихся в различных странах. Например, в Польше доза и частота инъекций железа оказалась на 35–72% выше по сравнению с Португалией (p < 0,001) в течение трех месяцев. Стимуляторы использовались на 61% чаще в Португалии (5034 МЕ против 3133 МЕ (с учетом поправок)/нед., p <0,001).
Результат
Средняя концентрация гемоглобина одинакова у пациентов из обеих стран 11,0/11,0 г/дл), доля пациентов c анемией, участвовавших в исследовании по KDIGO, составила 69,5% среди поляков и 65,8% среди португальцев (NS). Насыщение ферритином и трансферрином > 20% и > 50% соответственно, значительно выше у пациентов из Польши (88,8 и 14,6%) по сравнению с пациентами из Португалии (76,3 и 5,7% соответственно, p < 0,001). В Польше выявлено гораздо больше пациентов с показателем ферритина более 800 мкг/л (35,6%) по сравнению с Португалией (15,8%, р<0,001). Индекс резистентности к стимуляторам (ИРС) заметно выше у пациентов, лечившихся в Португалии (р<0,001). Корреляционный анализ выявил неопределенности в показаниях к лечению в моделях, не предполагающих поправок. Множественные и логистический регрессионные анализы показали, что при уровне ферритина, отвечающего стандарту KDIGO, то есть в пределах 200–800 мкг/л, вероятность достижения оптимального уровня гемоглобина заметно возрастает. Ежегодное увеличение смертности в Польше составило 16%, в Португалии – 13% (NS). Различий в смертности в зависимости от причинного фактора не выявлено.
Выводы
Прием большего объема железа внутривенно в рамках планового клинического гемодиализа не оказывает выраженного вредного воздействия. При этом для получения неопровержимых доказательств безопасности метода необходимо провести крупное рандомизированное исследование.
Введение
Анемия, наблюдающаяся у пациентов, проходящих процедуру гемодиализа, значительно ухудшает качество жизни. Некоторые исследования показали, что тяжелая анемия способствует развитию левосторонней желудочковой гипертрофии, сердечно-сосудистых заболеваний, трансфузионных инфекций, требующих госпитализации и способных привести к летальному исходу [1, 2]. Лечение анемии у пациентов, проходящих гемодиализ, сводилось к применению препаратов, стимулирующих эритропоэз (ПСЭ), и лекарственных средств на основе железа. При этом на фоне опасений по поводу безопасности применения больших доз ПСЭ для достижения заметных уровней гемоглобина, подтвердившихся в ходе клинических исследований, таких как NHS [3], CREATE [4], CHOIR [5, 6] and TREAT [7], интерес к терапии с внутривенным введением железа возрос [8, 9].
Многие пациенты с гемодиализом имеют отрицательный баланс железа из-за плохого аппетита, ограниченной с точки зрения содержания железа диеты, недостатка всасывания, а также потери данного элемента из-за пищеварительных расстройств. Потеря крови, связанная с гемодиализом и заборами для анализов, заметно различается в зависимости от времени проведения анализов и особенностей пациентов, а также вследствие антикоагулянтной и антиагрегантной терапии [10, 11].
В текущей клинической практике сывороточный уровень железа, ферритина и насыщение трансферрином (НТ) оцениваются как маркеры метаболизма железа. Однако эти показатели далеки от оптимальных, так как на них может влиять недостаток питания и воспалительный процесс: и то, и другое характерно для пациентов с гемодиализом [12, 13]. Прием железа часто требуется для восстановления и увеличения концентрации гемоглобина, а также для уравновешивания ответа на лечение ПСЭ. Однако высказаны опасения, связанные с безопасностью и вероятностью передозировки железа, что потенциально может привести к оксидативному стрессу, обострению сердечно-сосудистых заболеваний и инфекций, а также гиперчувствительности [12, 13].
Лечение пациентов гемодиализа ПСЭ может привести к различным побочным явлениям, например инсульту, венозной тромбоэмболической болезни [16], при этом некоторые пациенты не демонстрируют адекватного ответа на терапию ВСЭ [17, 18].
Данные о внутривенном лечении железом в комбинации с ПСЭ довольно ограничены, и влияние железа на исход заболеваний не доказано.
Клиническая рекомендация KDIGO (улучшение мировых показателей) по лечению анемии [19] предполагает более широкое применение терапии железом на период гемодиализа, в том числе повышенное насыщение трансферрином и прием ферритина, во время которых терапия железом должна возобновляться или прекращаться. С момента публикации рекомендации во многих странах в большей мере изменился порядок лечения анемии со значительным снижением уровня гемоглобина, уменьшением доз ПСЭ и увеличением дозы VI-валентного железа [8, 9]. Данные исследования результатов диализа и клинического подхода (Dialysis Outcomes and Practice Patterns Study, DOPPS) выявили тенденцию к увеличению концентрации ферритина в сыворотке крови в последние годы. Например, количество пациентов с гемодиализом, у которых уровень ферритина в крови превышал 800 нг/мл, приблизилось к 40%. Похожие тенденции наблюдаются и в странах Европы [8].
В ходе многоцентрового исследования, проведенного в Европе, сравнивались клинические методы и стратегии, направленные на достижение показателей KDIGO при лечении почечной анемии. Данное когортное исследование группы пациентов с гемодиализом проводилось в 12 центрах DaVita в Португалии и Польше в рамках программы повышения качества лечения. Проведен сравнительный анализ среднегодовых показателей смерти по странам и исследовательским центрам.
Методы
В исследовании участвовало 1247 пациентов, проходивших гемодиализ в центрах DaVita Португалии (пять диализных центров, n=730, средний возраст – 69 ± 14 лет (SD), 40% пациентов – женщины) и центрах Da Vita в Польше (семь диализных центров, n = 517, средний возраст – 67 ± 15 лет, 47% – женщины). В ходе исследования анализировалась степень достижения результатов лечения почечной анемии по KDIGO и вырабатывались методы лечения, различавшиеся в двух странах в зависимости от местных традиций и социально-экономических факторов (Таблица 1 и Таблица 2). Когорта включает всех пациентов с гемодиализом, лечившихся во всех центрах Da Vita Португалии и Польши, и таким образом отражает реальную картину по результатам диализа и клинического подхода в двух странах Европы, до этого не участвовавших в DOPPS-анализах.
Таблица 1. Демографический и лабораторный профиль
Таблица 2. Особенности пациентов
Демографические данные и информация по процедурам собирались в течение одного и того же месяца в обеих странах. Ежемесячные дозы железа регистрировались в течение трех месяцев в обоих регионах. Анализ крови проводился ежемесячно или раз в три месяца в соответствии с международными клиническими рекомендациями (европейские современные клинические рекомендации, KDIGO). Результаты оценивались главным медицинским специалистом страны и ежемесячно обсуждались с главным медицинским специалистом Евросоюза.
Чаще всего причины развития терминальной почечной недостаточности (ТПН) как в Португалии (42%), так и в Польше (35%) обозначались как «неизвестно» или «другое». Сахарный диабет, нефросклероз и гломерулонефрит – причины развития ТПН у 30%, 10% и 11% пациентов в Португалии соответственно; в Польше ТПН вызвана этими заболеваниями у 25%, 13% и 20% пациентов соответственно (p < 0,001).
Все анализы проводились в местных лабораториях в рамках одобренных и рекомендуемых практик. Измерялся уровень остаточного гормона паращитовидных желез (ГПЩЖ) spKt/V = Kt/V в однокамерной модели. Поправочный коэффициент дозы дарбэпоэтина к эпоэтину составил 250. Индекс резистентности к препаратам, стимулирующим эритропоэз, определялся делением скорректированной по массе тела дозы ПСЭ на уровень гемоглобина [IU/кг/(г/дл)].
Исследование одобрено Стокгольмским этическим комитетом Каролинского института (Стокгольм, Швеция). Клинические и лабораторные данные предоставлялись каждой страной без идентифицирующей информации, статистические анализы проводились SHJ и FHJ на факультете клинических наук Каролинского института (Стокгольм, Швеция).
Статистические анализы
Статистические анализы проводились с помощью программы IBM SPSS Statistics версии 25 на Кафедре медицинской статистики Каролинского института (Стокгольм, Швеция). Все показатели являются средними, сравнения по странам проводились на основе t-критерия Стьюдента и критерия Хи-квадрат. В ходе корреляционных исследований применялся коэффициент корреляции Пирсона, множественный регрессионный и логистический регрессионный анализы на основе независимых переменных. Результаты представлены как соотношение неравенства с дополнительной величиной р и бета-коэффициента с величиной р. Поскольку данные о летальных исходах на момент исследования неизвестны, определить отношения моментных рисков с помощью регрессионного анализа Кокса невозможно. Статистически значимой величиной считалось p< 0,05.
Результаты
Демографические и лабораторные профили
На Таблицах 1 и 2 показаны средние демографические и клинические (SD) показатели и категориальные данные (%) по всем пациентам, в том числе с распределением по конкретным странам. Пациенты, проходившие гемодиализ в учреждениях Португалии, по сравнению с пациентами из Польши старше (69 по сравнению с 67 годами), дольше находились на диализе (66 по сравнению с 53 месяцами), имели меньший вес и ИМТ (Таблица 1). Высокий индекс коморбидности Чарлсона (7–12 или более 12) гораздо чаще наблюдался у пациентов, лечившихся в учреждениях Португалии, нежели в Польше (p < 0,001, Таблица 2). Уровень альбумина в сыворотке крови был 40 (3) г/л и 41 (4) г/л у португальских и польских пациентов соответственно (NS), но пациентов с концентрацией альбумина ≥35 г/л выявлено намного больше в Португалии (95%), а не в Польше (82%, p < 0,001, Таблица 2). Содержание серы в сыворотке крови заметно выше (p < 0,001), и количество пациентов с концентрацией фосфора ≤5,5 мг/дл значительно ниже (p < 0,001) в Польше по сравнению с Португалией, однако существенных различий по содержанию остаточных ГПЩЖ нет (Таблица 1 и Таблица 2).
Назначение гемодиализа
Практически всем пациентам, лечившимся на территории Португалии, назначена гемодиафильтрация (ГДФ), в то время как в Польше 91% пациентов проходили стандартную процедуру гемодиализа (с использованием мембран со 100-процентной гидравлической проницаемостью) и 9% проходили ГДФ (p <0,001, Таблица 2). Артериовенозная фистула (АВФ) применялась у 77% пациентов из Португалии и у 76% пациентов из Польши (NS, Таблица 2). Коэффициент spKt/V > 1,2 и ОМР ≥ 70% достигнут у почти всех пациентов, но чаще у пациентов из Португалии (p = 0,003 и p <0,001 соответственно, Таблица 2). Средняя продолжительность лечения в неделю составила 724 (53 минуты) в Португалии и 737 (55 минут) в Польше (p < 0,001), назначенная скорость тока крови (Qb) и соответствующий объем очищенной крови за процедуру значительно выше у пациентов из Португалии, чем у пациентов из Польши (p <0,001 для обоих сравнений, Таблица 1 и Таблица 2).
Почечная анемия
Средний уровень гемоглобина у пациентов, лечившихся в Португалии и Польше, одинаков (11,0 (1,3) г/дл), количество пациентов, лечившихся от почечной анемии и достигших целевых показателей по KDIGO (гемоглобин 10–12 г/дл), также примерно равно (66% и 70% соответственно, Таблицы 1, 2 и Рисунок 1). ПСЭ принимали 78,3% португальских и 73,7 польских пациентов (NS, Таблица 2). Недельная доза ПСЭ, скорректированная для эпоэтина/дарбэпоэтина (× 250) заметно выше 5154 (6077) U у пациентов из Португалии, чем у пациентов из Польши (3133 (3068) U, p<0,001). Прием также осуществлялся по-разному: португальцам назначались большие дозы железа (Таблица 2). Назначение ПСЭ в обеих странах осуществлялось примерно одинаково. Средняя доза ПСЭ составила 6,23 IU/кг/(г/дл); при этом португальцы принимали заметно более высокие дозы (7,53) по сравнению с пациентами из Польши (4,42; p < 0,001). Множественный регрессионный анализ индекса ПСЭ c поправкой возраста методом пошагового исключения, период пребывания на диализе, коэффициент Kt/V, сывороточный уровень альбумина, индекс коморбидности Чарльсона и географический признак (Польша или Португалия) показали сильную зависимость изменений по ПСЭ от страны (бета-величина − 3,462, p <0,001).
 Рисунок 1. Соотношение высоких, нормальных и пониженных показателей гемоглобина по KDIGO у пациентов из Португалии и Польши
Рисунок 1. Соотношение высоких, нормальных и пониженных показателей гемоглобина по KDIGO у пациентов из Португалии и ПольшиВ диализных центрах Польши в течение трех месяцев внутривенное введение железа применялось на 35–72% чаще по сравнению с Португалией (p <0,001, Таблица 1). НТФ, доли пациентов с НТФ ≥20% и > 50% заметно выше (p <0,001 по всем трем сравнениям) в Польше (Таблицы 1, 2 и Рисунок 2), чем в Португалии. Уровень ферритина, а также процентная доля пациентов с уровнем ферритина в сыворотке крови > 800 мкг/л значительно выше (p <0,001 для обоих сравнений) среди пациентов, лечившихся в Польше (Таблицы 1, 2 и Рисунок 2).
 Рисунок 2. Соотношение высоких, нормальных и низких достигнутых показателей НТФ по KDIGO (a) и ферритина (b) у пациентов, лечившихся в диализных центрах Польши и Португалии
Рисунок 2. Соотношение высоких, нормальных и низких достигнутых показателей НТФ по KDIGO (a) и ферритина (b) у пациентов, лечившихся в диализных центрах Польши и ПортугалииТакже в ходе исследования проанализирована степень достижения назначенных показателей по гемоглобину в зависимости от пола у всех 1247 пациентов (у 70% женщин и 65% мужчин показатели гемоглобина – в пределах назначенной нормы, NS), а также в зависимости от страны проживания (в Португалии показатели женщин и мужчин – 70% и 63% (NS), в Польше – 71% и 68% соответственно).
По инструментам гемодиализа, у 68% пациентов, которым вводились АВФ, уровень гемоглобина составил 10 и 12 г/дл, по сравнению с пациентами, которым вводился центральный венозный катетер (ЦВК, NS). По странам 68% и 69% пациентов с АВФ из Польши и Португалии соответственно достигли назначенных показателей гемоглобина по KDIGO (NS). Среди группы пациентов, которым вводились ЦВК, доля пациентов с уровнем гемоглобина в 10–12 г/дл намного выше у поляков (74%), чем у португальцев (48%, p < 0,001).
Корреляционный множественный и логистический регрессионный анализ
Корреляционный анализ (Таблица 3) показал значительные отрицательные соотношения между уровнем гемоглобина и ферритина у всех пациентов (коэффициент корреляции Пирсона, r =-0,13, p <0,01), в частности – португальцев (r = − 0,22, p <0,01). У пациентов из Польши подобных показателей не отмечено (NS). Также не выявлено значимых соотношений между уровнем гемоглобина и НФР среди пациентов в зависимости от страны. Получены значимые отрицательные соотношения между уровнем гемоглобина и исправленными недельными дозами ПСЭ (эпоэтин/дарбэпоэтин) по всем пациентам (r = − 0,27, p <0,01) в целом, и по пациентам из Португалии (r = − 0,25, p <0,01) и Польши по отдельности (r = − 0,38, p <0,01). В совокупности на основе этих выводов нельзя выработать однозначных рекомендаций по выбору метода лечения. Ферритин является маркером системных воспалительных процессов, и пациентам, у которых наблюдается гиперчувствительность к ПСЭ, например, вследствие недоедания или воспалительных заболеваний, часто назначают повышенные дозы ПСЭ для достижения целевых показателей.
Таблица 3. Анализ соотношений (r = коэффициент Пирсона) между достигнутыми показателями гемоглобина и ферритина, НФР и недельной дозы ПСЭ в группе в целом, а также в Португалии и Польше по отдельности
Множественный регрессионный анализ (Таблица 4) уровня гемоглобина (величина бета) с учетом возраста, пола, ИМТ, НФР, уровня ферритина, альбумина и ГПЩЖ, показал, что ферритин оказывает наиболее мощное влияние на гемоглобин, и коэффициент воздействия на его уровень составил 0,004 (p <0,001). Последующий логистический регрессионный анализ показал, что для достижения уровня ферритина в 200–800 мкг/л и целевого уровня гемоглобина (10–12 г/дл) соотношение неравенства должно составлять 1,521 (p < 0,001). Эта взаимосвязь оказалась более выраженной среди пациентов из Португалии (коэффициент неравенства – 1,865, p <0,001, Таблица 4) и менее выраженной у пациентов из Польши. Таким образом, достижение целевого показателя ферритина по KDIGO в 200–800 мкг/л значительно увеличивает шансы на получение целевых показателей гемоглобина.
Таблица 4. Множественный (a) и логистический (b) регрессионный анализ влияния лечения на уровень гемоглобина г/дл и назначенный целевой показатель гемоглобина в 10–12 г/дл
Смертность
Проанализированы общие годовые показатели смертности в зависимости от причины смерти в каждой из стран по отдельности и во всех диализных центрах в совокупности. В Польше общий показатель смертности составил 16%, в Португалии – 13%. Существенных различий в годовых показателях смертности в диализных центрах конкретной страны не выявлено. Также отсутствуют различия в годовых показателях смертности в зависимости от причины смерти (сердечно-сосудистые, цереброваскулярные, инфекционные и онкологические заболевания) между двумя странами (Рисунок 3).
 Рисунок 3. Общий уровень смертности в зависимости от причин (%) среди пациентов из Португалии и Польши
Рисунок 3. Общий уровень смертности в зависимости от причин (%) среди пациентов из Португалии и ПольшиОбсуждение
Наиболее важное открытие, сделанное в ходе этого крупного многоцентрового перекрестного исследования с участием пациентов, лечившихся в 12 диализных центрах Португалии и Польши, состоит в том, что показатели по KDIGO у пациентов, страдавших почечной анемией, достигнуты в обеих странах, однако разными методами и стратегиями лечения. Показатели уровня гемоглобина в двух странах схожи, доля пациентов, добившихся назначенных по KDIGO показателей, составила 69,5% (Польша) и 65,8% (Португалия). Назначенные месячные дозы железа оказались на 35–72% выше в Польше, чем в Португалии (p <0,001). Уровень ферритина и НФР, а также доля пациентов с НФР > 20% и > 50% значительно выше в Польше (88,8% и 14,6%) по сравнению с Португалией (76,3 и 5,7% соответственно). Среди пациентов из Польши доля пациентов, у кого уровень ферритина составил > 800 мкг/л, была значительно выше (35,6%) аналогичного показателя у Португалии (15,8%). И наоборот, назначенные дозы ПСЭ в Португалии оказались намного выше (5154 U), чем в Польше (3133 U). Множественный и логистический регрессионные анализы показали, что достижение назначенных по KDIGO показателей ферритина в 200–800 мкг/л значительно увеличивает шансы на достижение целевых показателей гемоглобина. Можно сделать вывод, что выбор метода лечения почечной анемии во многом определяется клинической практикой и социально-экономическими факторами.
В настоящее время алгоритмов лечения анемии путем гемодиализа с применением железа и ПСЭ не существует. Многие специалисты считают, что для достижения рекомендуемых на международном уровне показателей гемоглобина не следует назначать слишком высокие дозы ПСЭ или железа, особенно пациентам, у которых имеются сопутствующие заболевания. Исследование выявило различия в клинических подходах, а также демографических особенностях пациентов, лечившихся в клиниках Польши и Португалии. Средний возраст португальцев был выше, и лечение гемодиализом длилось дольше, при этом среди них было больше пациентов, страдавших сахарным диабетом и показывавших высокий индекс коморбидности Чарлсона. Все это свидетельствовало о более высоких показателях коморбидности по сравнению с пациентами Польши. Несмотря на это, среди португальцев было намного больше пациентов с уровнем альбумина > 35 г/л, и ЦВК применялись реже, чем в Польше.
В ходе исследования оптимальных методов лечения почечной анемии (ORAMA), опубликованного десять лет назад [20], предварительно оценена роль рекомендаций в достижении результатов лечения почечной анемии [21]. Результаты выявили высокий уровень гемоглобина у пациентов гемодиализа из Западной Европы по сравнению с пациентами из Восточной Европы. Хотя данные свидетельствуют о низких показателях гемоглобина у жителей Восточной Европы, информация давно не обновлялась.
Некоторые ые исследования показали, что анемия у пациентов, лечащихся гемодиализом, повышает риск цереброваскулярных и сердечно-сосудистых заболеваний, госпитализаций и летального исхода [1, 2, 22]. Однако учитывая, что почечная анемия нередко является маркером коморбидности, причинно-следственных связей в настоящее время не установлено. Имеются опасения по поводу безопасности применения высоких доз ПСЭ при лечении ХБП [5, 6, 7]. Исследование TREAT доказало высокий риск развития сердечно-сосудистых заболеваний среди пациентов, принимающих ПСЭ при высоком уровне гемоглобина [7]. Расширение группы с высоким целевым показателем гемоглобина не оказало влияния на первичную статистику сердечно-сосудистых заболеваний, однако отмечен большой риск развития венозных и артериальных тромбоэмболических заболеваний и инсульта, не связанного со средним уровнем артериального давления. Недавно проведенное крупное когортное исследование пациентов из Испании выявило соотношение дозировки ПСЭ и смертности: высокие дозы ПСЭ коррелировали с высокой смертностью несмотря на поправки c учетом возможных факторов, усугубляющих течение заболевания, в том числе гемоглобина и предикторов, связанных со сверхчувствительностью к ПСЭ [23]. В ходе настоящего исследования установлено, что пациенты из Португалии принимали более высокие дозы ПСЭ, однако общая годовая смертность, а также смертность в зависимости от причин, оказались сопоставимыми – 13% в Португалии и 16 % в Польше.
Во время исследования оба метода лечения – увеличение доз ПСЭ (+65%) при небольших дозах железа или увеличение дозы железа (+35%-72% в течение месяца) при небольших дозах ПСЭ – привели к достижению уровня гемоглобина, назначенного по рекомендациям KDIGO, у большинства пациентов. Гиперчувствительность к ПСЭ – частое явление при гемодиализе, наблюдается примерно у 10% пациентов, лечащихся от заболеваний почек с применением ПСЭ [24]. Недостаток железа, инфекции/воспаление и неправильное проведение диализа – наиболее частые причины гиперчувствительности [24]. В ходе настоящего исследования показатели рисков среди пациентов из Португалии оказались выше данных пациентов из Польши. Недавнее крупное ое исследование показало, что пациенты, лечившиеся ГДФ, меньше подвержены рискам, однако в нем участвовали лишь те, кому эритропоэтин вводился внутривенно [25]. В ходе исследования использовались ПСЭ одного типа, однако в Португалии чаще практиковалось внутривенное введение ПСЭ. Влияние способа введения ПСЭ на требования дозировки и чувствительность много изучалось, однако к общему выводу прийти не удалось. Недавнее исследование 24 957 пациентов, лечившихся гемодиализом с 2011 по 2014 годы, не выявило различий между эффектами от подкожного и внутривенного введения железа несмотря на увеличение доли пациентов, получающих железо подкожно [23]. Позднее установлена взаимосвязь между высокими дозами железа и увеличением числа госпитализаций и смертности, при этом тип инъекций на статистику осложнений и смертность влияния не оказал [26].
Ученые согласны, что терапия железом показана людям, страдающим недостатком железа, и она способствует повышению уровня гемоглобина, снижает необходимость ПСЭ-терапии и позволяет скорректировать более щадящим образом лечение ПСЭ [27]. И НФР, и ферритин имеют свои недостатки с точки зрения оценки уровня железа и выбора стратегии дальнейшего лечения железом. Уровни НФР и ферритина считаются показателями недостатка железа и назначаются в больших дозах пациентам, лечащимся гемодиализом, чем остальным пациентам, из-за воспалительных явлений. [28]. Возникает немало споров по поводу безопасности и эффективности внутривенного введения железа, особенно для пациентов с повышенным уровнем ферритина в сыворотке крови. Железосвязывающие белки могут перестать справляться с нагрузкой, что может привести к высвобождению свободных атомов железа в кровеносной системе и/или привести к образованию отложений. Ранние исследования показали, что инъекции железа у пациентов, лечащихся гемодиализом, приводят к временному усилению окислительного стресса, выражающегося в появлении в плазме крови пероксидов липидов и измененных в результате окисления белков [15]. В настоящее время трудно судить о «безопасном» ферритиновом потолке для сыворотки крови, однако по KDIGO НФР не должно превышать 30%, а сывороточный уровень ферритина – 500 нг/мл на период терапии железом [19].
Крупных контролируемых клинических исследований влияния агрессивной железотерапии на результаты до настоящего времени не проводилось, выводы ых исследований оказались неоднозначными. В исследовании Miskulin et al. [29] участвовало 14 078 пациентов из США, лечившихся диализом с 2003 по 2008 гг. Оно не выявило взаимосвязи между общей смертностью, смертностью в результате сердечно-сосудистых и инфекционных заболеваний и внутривенным введением ≤1050 мг железа в течение трех месяцев, либо 2100 мг в течение шести месяцев. Также в ходе исследования [30] группы не выявлено устойчивой взаимосвязи между внутривенным введением железа и риском госпитализаций, как в общем плане, так и в результате сердечно-сосудистых и инфекционных заболеваний, даже среди пациентов, получающих более 2100 мг железа в течение шести месяцев. Новое многоцентровое ое исследование безопасности внутривенного введения железа, проведенное с участием отдельных пациентов, показало отсутствие взаимосвязи между постепенным увеличением доз железа и смертностью после учета факторов, способных усугубить течение болезни [31]. Недавний системный обзор и метаанализ семи отдельно взятых контролируемых испытаний и 15 обсервационных исследований, охватывающих более 140 000 пациентов, лечившихся гемодиализом, не выявил увеличения риска развития инфекционных, сердечно-сосудистых заболеваний, госпитализации или летального исхода в результате увеличения доз вводимого железа [32]. В совокупности эти выводы свидетельствуют о том, что назначение высоких внутривенных доз железа в рамках планового лечения анемии у пациентов на период гемодиализа не оказывает существенного вреда, хотя для подтверждения этих выводов потребуются дополнительные рандомизированные исследования.
Преимуществом данной работы является то, что в нем участвовали все пациенты, проходившие гемодиализ в центрах Da Vita в двух странах Европы, ранее не входивших в программу DOPPS, что позволило получить «реальную картину» в области лечения почечной анемии в Западной и Восточной Европе. Такие анализы позволяют оценить существующие парадигмы в сфере здравоохранения и дают основу для разработки новых подходов к лечению. Однако в исследовании есть некоторые ограничения. Во-первых, это обсервационное перекрестное исследование опиралось на имевшиеся данные, поэтому не позволило оценить влияние изменений в дозировке при внутривенном введении железа или ПСЭ на уровень ферритина. Во-вторых, из-за отсутствия индивидуальных данных пациентов невозможно оценить риски госпитализации и смертность. В-третьих, отсутствуют данные о накоплении железа в течение длительного времени по каждому пациенту. Отдельным пациентам можно назначать как низкие, так и высокие дозы железа или ПСЭ в зависимости от результатов ежемесячных лабораторных анализов, например уровня гемоглобина, НФР и ферритина.
Выводы
В ходе международного многоцентрового исследования проанализированы клинические практики и методы лечения почечной анемии с участием 1247 пациентов, лечившихся гемодиализом в 12 диализных центрах, расположенных в двух странах Европы, ранее не участвовавших в глобальной программе DOPPS. Назначенные по KDIGO результаты лечения достигнуты и у пациентов из Португалии, и из Польши, но различными методами. Поскольку уровень смертности во всех центрах оказался одинаковым, сделан вывод о том, что увеличение внутривенных доз железа в рамках обычного курса лечения не оказывает вредного влияния на организм. Для получения неопровержимых доказательств безопасности железа необходимы более тщательные рандомизированные контролируемые исследования.
Список используемой литературы
- Volkova N, Arab L. Evidence-based systematic literature review of hemoglobin/hematocrit and all-cause mortality in dialysis patients. Am J Kidney Dis. 2006;47:24–36. View ArticleGoogle Scholar
- Locatelli F, de Francisco A, Deray G, Fliser D, Armstrong G, Dougherty FC, Ehrhard P. Mortality and cardiovascular morbidity associated with haemoglobin levels: a pooled analysis of randomised controlled trials. Nephron Clin Pract. 2014;128:323–32. View ArticleGoogle Scholar
- Besarab A, Bolton WK, Browne JK, Egrie JC, Nissenson AR, Okamoto DM, Schwab SJ, Goodkin DA. The effects of normal as compared with low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoetin. N Engl J Med. 1998;339:584–90. View ArticleGoogle Scholar
- Drueke TB, Locatelli F, Clyne N, Eckardt KU, Macdougall IC, Tsakiris D, Burger HU, Scherhag A. Normalization of hemoglobin level in patients with chronic kidney disease and anemia. N Engl J Med. 2006;355:2071–84. View ArticleGoogle Scholar
- Singh AK, Szczech L, Tang KL, Barnhart H, Sapp S, Wolfson M, Reddan D. Correction of anemia with epoetin alfa in chronic kidney disease. N Engl J Med. 2006;355:2085–98. View ArticleGoogle Scholar
- Szczech LA, Barnhart HX, Inrig JK, Reddan DN, Sapp S, Califf RM, Patel UD, Singh AK. Secondary analysis of the CHOIR trial epoetin-alpha dose and achieved hemoglobin outcomes. Kidney Int. 2008;74:791–8. View ArticleGoogle Scholar
- Pfeffer MA, Burdmann EA, Chen CY, Cooper ME, de Zeeuw D, Eckardt KU, Feyzi JM, Ivanovich P, Kewalramani R, Levey AS, et al. A trial of darbepoetin alfa in type 2 diabetes and chronic kidney disease. N Engl J Med. 2009;361:2019–32. View ArticleGoogle Scholar
- Karaboyas A, Zee J, Morgenstern H, Nolen JG, Hakim R, Kalantar-Zadeh K, Zager P, Pisoni RL, Port FK, Robinson BM. Understanding the recent increase in ferritin levels in United States Dialysis patients: potential impact of changes in intravenous Iron and erythropoiesis-stimulating agent dosing. Clin J Am Soc Nephrol. 2015;10:1814–21. View ArticleGoogle Scholar
- Hasegawa T, Bragg-Gresham JL, Pisoni RL, Robinson BM, Fukuhara S, Akiba T, Saito A, Kurokawa K, Akizawa T. Changes in anemia management and hemoglobin levels following revision of a bundling policy to incorporate recombinant human erythropoietin. Kidney Int. 2011;79:340–6. View ArticleGoogle Scholar
- Nangaku M, Eckardt KU. Pathogenesis of renal anemia. Semin Nephrol. 2006;26:261–8. View ArticleGoogle Scholar
- Flint S, Taylor E, Beavis J, Becker GJ, Pedagogos E. Increased iron requirement in hemodialysis patients on antiplatelet agents or warfarin. Nephron Clin Pract. 2009;113:c38–45. View ArticleGoogle Scholar
- Fishbane S, Kowalski EA, Imbriano LJ, Maesaka JK. The evaluation of iron status in hemodialysis patients. J Am Soc Nephrol. 1996;7:2654–7. PubMedGoogle Scholar
- Kalantar-Zadeh K, Hoffken B, Wunsch H, Fink H, Kleiner M, Luft FC. Diagnosis of iron deficiency anemia in renal failure patients during the post-erythropoietin era. Am J Kidney Dis. 1995;26:292–9. View ArticleGoogle Scholar
- Rampton D, Folkersen J, Fishbane S, Hedenus M, Howaldt S, Locatelli F, Patni S, Szebeni J, Weiss G. Hypersensitivity reactions to intravenous iron: guidance for risk minimization and management. Haematologica. 2014;99:1671–6. View ArticleGoogle Scholar
- Tovbin D, Mazor D, Vorobiov M, Chaimovitz C, Meyerstein N. Induction of protein oxidation by intravenous iron in hemodialysis patients: role of inflammation. Am J Kidney Dis. 2002;40:1005–12. View ArticleGoogle Scholar
- Lee YK, Koo JR, Kim JK, Park II, Joo MH, Yoon JW, Noh JW, Vaziri ND. Effect of route of EPO administration on hemodialysis arteriovenous vascular access failure: a randomized controlled trial. Am J Kidney Dis. 2009;53:815–22. View ArticleGoogle Scholar
- Kalantar-Zadeh K, Lee GH, Miller JE, Streja E, Jing J, Robertson JA, Kovesdy CP. Predictors of hyporesponsiveness to erythropoiesis-stimulating agents in hemodialysis patients. Am J Kidney Dis. 2009;53:823–34. View ArticleGoogle Scholar
- Rossert J, Gassmann-Mayer C, Frei D, McClellan W. Prevalence and predictors of epoetin hyporesponsiveness in chronic kidney disease patients. Nephrol Dial Transplant. 2007;22:794–800. View ArticleGoogle Scholar
- Kidney Disease. Improving global outcomes Anemia work group. KDIGO clinical practice guideline for anemia in chronic kidney disease. Kidney Int Suppl. 2012;2:279–335. View ArticleGoogle Scholar
- Wiecek A, Covic A, Locatelli F, Macdougall IC. Renal anemia: comparing current eastern and Western European management practice (ORAMA). Ren Fail. 2008;30:267–76. View ArticleGoogle Scholar
- European survey on anemia management (ESAM). Nephrol Dial Transplant. 1999;14:1–76. View ArticleGoogle Scholar
- Foley RN, Parfrey PS, Harnett JD, Kent GM, Murray DC, Barre PE. The impact of anemia on cardiomyopathy, morbidity, and and mortality in end-stage renal disease. Am J Kidney Dis. 1996;28:53–61. View ArticleGoogle Scholar
- Perez-Garcia R, Varas J, Cives A, Martin-Malo A, Aljama P, Ramos R, Pascual J, Stuard S, Canaud B, Merello JI. Increased mortality in haemodialysis patients administered high doses of erythropoiesis-stimulating agents: a propensity score-matched analysis. Nephrol Dial Transplant. 2017;33(4):690–9.View ArticleGoogle Scholar
- van der Putten K, Braam B, Jie KE, Gaillard CA. Mechanisms of disease: erythropoietin resistance in patients with both heart and kidney failure. Nat Clin Pract Nephrol. 2008;4:47–57.View ArticleGoogle Scholar
- Marcelli D, Bayh I, Merello JI, Ponce P, Heaton A, Kircelli F, Chazot C, Di Benedetto A, Marelli C, Ladanyi E, et al. Dynamics of the erythropoiesis stimulating agent resistance index in incident hemodiafiltration and high-flux hemodialysis patients. Kidney Int. 2016;90:192–202.View ArticleGoogle Scholar
- Biggar P, Kim GH. Treatment of renal anemia: erythropoiesis stimulating agents and beyond. Kidney Res Clin Pract. 2017;36:209–23.View ArticleGoogle Scholar
- Michels WM, Jaar BG, Ephraim PL, Liu Y, Miskulin DC, Tangri N, Crews DC, Scialla JJ, Shafi T, Sozio SM, et al. Intravenous iron administration strategies and anemia management in hemodialysis patients. Nephrol Dial Transplant. 2017;32:173–81.PubMedGoogle Scholar
- Stancu S, Barsan L, Stanciu A, Mircescu G. Can the response to iron therapy be predicted in anemic nondialysis patients with chronic kidney disease? Clin J Am Soc Nephrol. 2010;5:409–16.View ArticleGoogle Scholar
- Miskulin DC, Tangri N, Bandeen-Roche K, Zhou J, McDermott A, Meyer KB, Ephraim PL, Michels WM, Jaar BG, Crews DC, et al. Intravenous iron exposure and mortality in patients on hemodialysis. Clin J Am Soc Nephrol. 2014;9:1930–9.View ArticleGoogle Scholar
- Tangri N, Miskulin DC, Zhou J, Bandeen-Roche K, Michels WM, Ephraim PL, McDermott A, Crews DC, Scialla JJ, Sozio SM, et al. Effect of intravenous iron use on hospitalizations in patients undergoing hemodialysis: a comparative effectiveness analysis from the DEcIDE-ESRD study. Nephrol Dial Transplant. 2015;30:667–75.View ArticleGoogle Scholar
- Varas J, Ramos R, Aljama P, Perez-Garcia R, Moreso F, Pinedo M, Ignacio Merello J, Stuard S, Canaud B, Martin-Malo A. Relationships between iron dose, hospitalizations and mortality in incident haemodialysis patients: a propensity-score matched approach. Nephrol Dial Transplant. 2018;33:160–70.View ArticleGoogle Scholar
- Hougen I, Collister D, Bourrier M, Ferguson T, Hochheim L, Komenda P, Rigatto C, Tangri N. Safety of intravenous Iron in Dialysis: a systematic review and meta-analysis. Clin J Am Soc Nephrol. 2018;13:457–67.View ArticleGoogle Scholar





