5367
01 Июля 2021
Авторское право © 2019, Philipp Russ, Martin Russwurm, Birgit Kortus-Goetze, Joachim Hoyer — связаться с автором, SahanaKamalanabhaiah (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Филипп Русс, Мартин Руссвурм, Биргит Кортус-Гетце, Иоахим Хойер, Сахана Камаланабхайя
Аннотация
Введение
Кальцифилаксия является опасным для жизни осложнением у почечных больных, поэтому большо...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Филипп Русс, Мартин Руссвурм, Биргит Кортус-Гетце, Иоахим Хойер, Сахана Камаланабхайя
Аннотация
Введение
Кальцифилаксия является опасным для жизни осложнением у почечных больных, поэтому большо...
Авторское право © 2019, Philipp Russ, Martin Russwurm, Birgit Kortus-Goetze, Joachim Hoyer — связаться с автором, SahanaKamalanabhaiah (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Филипп Русс, Мартин Руссвурм, Биргит Кортус-Гетце, Иоахим Хойер, Сахана Камаланабхайя
Аннотация
Введение
Кальцифилаксия является опасным для жизни осложнением у почечных больных, поэтому большое значение приобретает выявление сопутствующих факторов этого заболевания. Из-за вариабельности клинической картины определение таких факторов может быть затруднено в тех случаях, когда постановка диагноза «кальцифилаксия» основана только на клинических признаках. Целью настоящего исследования стало охарактеризовать ассоциированные факторы только у пациентов с кальцифилаксией, подтвержденной гистоморфологическими исследованиями в дополнение к клинической картине.
Методы
В ретроспективном исследовании, проведенном в одном медицинском центре, проанализированы данные 15 пациентов, собранные в течение 8 лет в период с 2008 по 2016 годы. В исследование были включены только пациенты с клиническими особенностями и гистоморфологическим подтверждением кальцифилаксии. Критериями для постановки диагноза «кальцифилаксия» на основании гистологических исследований были гиперплазия интимы, микротромбия или кальцификация медии, выявленная окрашиванием по фон Косса.
Результаты
Средний возраст пациентов составлял 64,8 года. Девять пациентов (60%) были женского пола; 12 (80%) страдали ожирением с индексом массы тела (ИМТ) более 30 кг/м2; у трех пациентов (20%) не было почечных заболеваний; 12 (80%) страдали от ХБП четвертой или пятой степени, а у 10 (66,7%) была терминальная стадия почечной недостаточности (ТСПН). Одногодичная летальность во всей когорте составила 73,3%.
Информация о приеме лекарств: большинство пациентов (n = 13 (86,7%)) получали антагонисты витамина К (АВК); 10 (66,7%) — витамин D; шестеро (40%) —добавки кальция перорально; пятеро (33,3%) проходили лечение кортикостероидами; 12 (80%) принимали ингибиторы протонной помпы (ИПП); у 13 (86,7%) пациентов был клинически подтвержденный гиперпаратиреоз. Десять (66,7%) пациентов во время диагностики имели гипоальбуминемию.
Выводы
Оценка доказанной результатами биопсии кальцифилаксии показывает, что в особенности лечение антагонистами витамина К и дисфункция печени являются наиболее важными сопутствующими факторами развития кальцифилаксии. Поскольку прогрессирование и развитие кальцифилаксии представляют собой скорее хронические, чем острые процессы, раннее назначение пероральных антикоагулянтов прямого действия (ПАПД) вместо АВК может оказывать благоприятное действие и снизить частоту возникновения кальцифилаксии.
Введение
Кальцифилаксия, также известная как кальцифицирующаяся уремическая артериолопатия (КУА), представляет собой редкое заболевание, связанное с хронической болезнью почек (ХБП). Кристаллы осаждаются в мелких кожных кровеносных сосудах, по-видимому, из-за дисбаланса сывороточных уровней кальция и фосфатов [1], а также из-за нарушений, связанных с модуляторами обмена веществ, таких как паратиреоидный гормон [2]. Возникающая в результате периваскулярная кальцификация вызывает болезненную облитерацию сосудов, изъязвления и некроз. Уровень одногодичной летальности колеблется от 50 до 70% [1, 3], и в основном смертность обусловлена инфекционными осложнениями или сепсисом. Пациенты, страдающие терминальной стадией почечной недостаточности (ТСПН), в подавляющем большинстве случаев подвержены кальцифилаксии, однако она также возникает у пациентов с умеренно сниженной или даже нормальной функцией почек [4]. При предполагаемой частоте развития ТСПН ниже 1% [5] проспективные клинические испытания трудно проводить из-за редкости заболевания.
Перед постановкой диагноза «кальцифилаксия» необходимо рассмотреть несколько других факторов, таких как заболевание периферических артерий, васкулит, фенпрокумон- или гепарин-индуцированный некроз кожи, криоглобулинемия и синдромы холестериновой эмболии. Лабораторные исследования, показывающие патологические уровни паратиреоидного гормона, кальция и фосфата в сыворотке крови являются типичными, но не определяющими критериями заболевания. Кроме того, вторичный гиперпаратиреоз и нарушенный гомеостаз кальция и фосфатов представляют собой частые сопутствующие патологии у пациентов с ТСПН. Стандартным критерием для постановки диагноза «кальцифилаксия» являются положительные результаты биопсии кожи с четко определенными диагностическими показателями, такими как наличие кальцификации медии при окрашивании по фон Косса, гиперплазия интимы, микротромбия, изъязвление эпидермиса или внесосудистая кальцификация мягких тканей [6]. Тем не менее, в большинстве исследований доля подтвержденных результатами биопсии случаев кальцифилаксии остается низкой, а постановку диагноза зачастую проводят на основании клинических и лабораторных признаков [7]. С другой стороны, отсутствие биопсии, вероятно, приводит к учету при постановке диагноза язвенных поражений, обусловленных не кальцифилаксией. Поэтому мы провели исследование факторов, ассоциированных с кальцифилаксией, включающее только пациентов с этим диагнозом, подтвержденным результатами биопсии.
Основная цель состояла в том, чтобы оценить сопутствующие факторы, которые могут способствовать либо вспышке заболеваемости, либо обострению течения кальцифилаксии, для более глубокого понимания этиологии этого заболевания. Для этого в университетской больнице Марбурга (Германия) были собраны данные о лабораторных показателях, эпидемиологии и уровнях выживаемости у пациентов, страдающих кальцифилаксией, подтвержденной результатами биопсии. Кроме того, при изучении факторов, влияющих на метаболизм кальция и кальцификацию, особое внимание было уделено лечению пациентов.
Методы
Проведен ретроспективный анализ пациентов Университетской клиники г. Марбург, которые найдены по коду Международной классификации болезней (МКБ) для кальцифилаксии (E83.50) в системе документооборота клиник «Орбис» (AGFA®). Период сбора информации о пациентах включал 2005–2016 годы. С помощью данного метода было выявлено 20 пациентов.
В исследование были включены только пациенты с четкой клинической картиной кальцифилаксии и положительными результатами гистологических исследований. Отдельные гистологические данные о кальцифилаксии включали положительное на кальцификацию медии окрашивание по фон Косса, или, по крайней мере, одно из вторичных изменений, таких как гиперплазия интимы, микротромбия или кальцификация мягких тканей [6]. Следовательно, в соответствии с результатами дерматогистологических исследований у всех включенных в исследование пациентов наблюдалась гистологическая картина, соответствующая кальцифилаксии. Пациенты с клиническими признаками, но без дерматогистологических доказательств или при отсутствии биопсии были исключены из исследования.
Данные об эпидемиологии, сопутствующих патологиях, назначенных препаратах и лечении до постановки диагноза, лабораторных параметрах, а также выживаемости были взяты из электронных медицинских карт пациентов. Анализ данных проводили с применением описательной статистики.
Результаты
Эпидемиология и сопутствующие патологии пациентов
Все 15 пациентов-европеоидов имели диагноз «кальцифилаксия», подтвержденный результатами биопсии. В таблице 1 обобщены демографические данные пациентов и сопутствующие патологии. На момент постановки диагноза средний возраст пациентов составлял 64,8 года (SD = 15,4 года) с возрастным диапазоном 20–80 лет. Девять пациентов (60%) были женского пола. Ни у одного пациента значение ИМТ не было ниже 25 кг/м2. В соответствии с Международной классификацией ожирения у взрослых три пациента имели предожирение (ИМТ = 25,00–29,99 кг/м2), трое — ожирение первого класса (ИМТ = 30,00–34,99 кг/м2), двое — ожирение второго класса (ИМТ = 35,00–39,99 кг/м2) и семь пациентов — ожирение третьего класса (ИМТ = 40 кг/м2 или выше). Поражения проксимальных участков тела наблюдались в большинстве случаев (11, 73,3%), однако у четырех (26,7%) пациентов имелись только поражения дистальных частей тела. В таблице 1 представлены сопутствующие патологии пациентов до постановки диагноза «кальцифилаксия». У трех пациентов (20%) не было заболеваний почек. У 12 (80%) пациентов при первичном обследовании выявлены патологические лабораторные показатели почечной функции, такие как уровни креатинина и мочевины, скорость клубочковой фильтрации и параметры мочеиспускания, или диагностирована нефропатия, подтвержденная результатами биопсии. Эти пациенты могут быть классифицированы как имеющие ХБП четвертой–пятой стадии. До постановки диагноза у 10 пациентов была ТСПН, троим проводился диализ в течение последних 6 месяцев. В ходе исследования у всех пациентов измеряли уровни ПТГ. Гиперпаратиреоз был определен как превышение верхнего предела нормы уровня ПТГ для применявшегося анализа (выше 65 нг/л). У 13 пациентов (86,7%) был выявлен гиперпаратиреоз (медиана значений уровня ПТГ = 157 нг/л; межквартильный размах = 73–241 нг/л). Все случаи гиперпаратиреоза носили вторичный характер. Семь (46,7%) пациентов имели сопутствующий диабет второго типа и двое (13,3%) — заболевания печени. Одногодичная летальность составила 73,3%.
Таблица 1.Демографические данные и сопутствующие патологии участников исследования
Лабораторные показатели на момент постановки диагноза
В таблице 2 обобщены лабораторные показатели, ассоциированные с нарушениями гомеостаза у пациентов с ХБП и идентифицированные как потенциальные сопутствующие факторы развития кальцифилаксии. У большинства пациентов (9 из 15, 60%) наблюдался повышенный уровень фосфатов в сыворотке крови. 46,7% всех пациентов получали фосфат-связывающие препараты. Хотя десять пациентов перорально принимали витамин D и шесть — кальций, сывороточный уровень кальция был низким у семи пациентов. Только у одного пациента был повышен уровень кальция в сыворотке, у всех остальных (46,7%) он находился в пределах нормы. Однако после коррекции содержания кальция в сыворотке крови у семи пациентов (46,7%) была выявлена гиперкальциемия (> 2,58 ммоль/л). На момент постановки диагноза у десяти пациентов зафиксирована гипоальбуминемия. У 13 пациентов во время прогрессирования заболевания снижались сывороточные уровни альбумина. Кроме того, был исследован уровень псевдохолинэстеразы (ПХЭ) в качестве маркера ее синтеза в печени. Данные были доступны только для десяти (66,7%) пациентов, но все уровни ПХЭ в сыворотке были снижены. Уровень щелочной фосфатазы был повышен у шести (40%) пациентов.
Таблица 2. Лабораторные показатели пациентов, страдающих кальцифилаксией
Результаты гистологических исследований
Mochel et al. [6] изучали гистологические признаки кальцифилаксии, в том числе такие гистологические показатели, как микротромбия, гиперплазия интимы, изъязвление эпидермиса и внесосудистая кальцификация мягких тканей. У всех пациентов были выявлены определяющие кальцифилаксию гистологические признаки. У двух третей пациентов была выявлена кальцификация медии мелких и средних сосудов кожи, положительно окрашиваемая по фон Косса. У одной трети кальцификация отсутствовала, но наблюдались вторичные гистологические изменения, связанные с кальцифилаксией, такие как гиперплазия интимы, микротромбия или внесосудистая кальцификация мягких тканей (таблица 3 ).
Таблица 3. Результаты гистологических исследований участников исследования
Прием лекарств во время диагностики
В таблице 4 обобщены конкретные лекарства, принимаемые пациентами. На рис. 1 (прием препаратов на момент постановки диагноза) показано часто наблюдаемое сопутствующее медикаментозное лечение у пациентов с кальцифилаксией, как это было установлено различными авторами [8, 9]. 13 (86,7%) пациентов принимали антагонист витамина K из-за мерцательной аритмии. Две трети (10 пациентов, 66,7%) получали витамин D, шестеро (40%) —добавки кальция для перорального приема. Одна треть (пять пациентов, 33,3%) принимали системные кортикостероиды.
Таблица 4. Лекарственные препараты, назначенные участникам исследования, страдающим кальцифилаксией, подтвержденной результатами биопсии
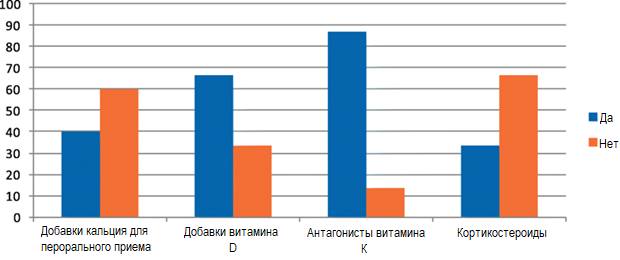 Рисунок 1. Прием лекарств во время диагностики
Рисунок 1. Прием лекарств во время диагностики
Известно, что ИПП вызывают статистически значимое различие в общих уровнях кальция и паратиреоидного гормона (ПТГ) в сыворотке [10], поэтому принимаемые пациентом лекарства представляют определенный интерес. В настоящем исследовании участвовали 12 (80%) пациентов, принимающих ИПП.
Аналогичным образом предполагается, что прием добавок железа оказывает отрицательное влияние на развитие кальцифилаксии [11, 12]. В исследуемой группе пять пациентов получали ферритин внутривенно (33,3%). Статины, в свою очередь, имеют антикальцифицирующие, антитромботические и противовоспалительные свойства, поэтому их назначают пациентам с кальцифилаксией [13]. В исследуемой группе семь (46,7%) пациентов принимали статины.
Обсуждение
В настоящем ретроспективном анализе сделана попытка выявить несколько взаимодействующих факторов, которые могут быть связаны со вспышкой кальцифилаксии. Создается впечатление отсутствия единого, специфического набора факторов, которые приводят к этому заболеванию. Однако в исследовании выявлены факторы, которые казались наиболее распространенными и клинически значимыми. Конечно, отдельные факторы также различаются по своей значимости.
Мы можем подтвердить, что помимо вторичного гиперпаратиреоза, ожирение и принадлежность к женскому полу представляются основными сопутствующими факторами. Кроме того, лечение с помощью АВК является важным фактором, связанным с кальцифилаксией, присутствующим почти у 90% пациентов. Кроме того, большинство пациентов принимали ИПП.
Большинство пациентов страдали вторичным гиперпаратиреозом из-за ХБП и последовательного нарушения метаболизма кальция и фосфора, что, в свою очередь, представляет собой фактор, коррелирующий со вспышкой кальцифилаксии, как было показано во многих предыдущих исследованиях [4, 14, 15, 16]. Тем не менее, лишь у немногих пациентов был выявлен повышенный уровень кальций-фосфатных метаболитов. Данный факт может быть связан с терапевтическим вмешательством в метаболизм кальция и фосфора с помощью назначения добавок кальция и витамина D для перорального приема, а также кальцийсодержащих фосфат-связывающих препаратов. В любом случае, наличествуют равносильные доказательства, как подтверждающие, так и оспаривающие влияние кальций-фосфатных метаболитов на развитие кальцифилаксии [13, 17, 18, 19].
Таким образом, хотя патологические кальций-фосфатные метаболиты обычно обнаруживают у пациентов, страдающих кальцифилаксией, их присутствие не является обязательным фактором для диагностики и может отсутствовать у некоторых пациентов. Другим фактором, влияющим на гомеостаз кальция и фосфора, являются добавки витамина D для перорального приема, которые принимало большинство участников исследования с кальцифилаксией до вспышки заболевания. Данное наблюдение подтверждается несколькими исследованиями и сообщениями [4, 9, 13, 17]. Аналогичным образом ИПП, видимо, влияет на уровень магния и кальция в сыворотке, что, в свою очередь, может привести к снижению уровня кальция [10]. Отметим, что 80% участников настоящего исследования принимали ИПП. Насколько известно, в настоящее время нет биологического обоснования вклада ИПП в развитие кальцифилаксии, поэтому может представлять интерес проведение будущих исследований, посвященных возможной патофизиологической связи.
Наиболее заметным результатом данного исследования был высокий процент пациентов, которых лечили с помощью АВК (почти 90%). В других работах АВК назначали приблизительно 25% участникам исследования [4, 20]. АВК являются признанным сопутствующим фактором развития кальцифилаксии и ускоряют ее прогрессирование. Исследования на животных моделях с использованием крыс, которым вводили АВК, продемонстрировали не только более быструю кальцификацию артерий, но также влияние на сердечные клапаны [21]. АВК ингибирует посттрансляционное гамма-карбоксилирование многих белков, включая матриксный Gla-белок (MGP — matrix Gla protein), который, в свою очередь, ингибирует кальцификацию. Nigwekar et al. выявили значительное снижение уровня карбоксилированного MGP у пациентов, страдающих кальцифилаксией, по сравнению с контрольной группой [ 22 ].
Другой случай, доказывающий связь между АВК и кальцифилаксией, был замечен у одного участника данного исследования, пережившего кальцифилаксию. Лечение АВК было начато из-за мерцательной аритмии. После постановки диагноза «кальцифилаксия» АВК был отменен и связанные с кальцифилаксией поражения были полностью излечены. Через год лечение АВК было продолжено, однако оно привело к рецидиву поражений, связанных с кальцифилаксией. Таким образом, следует избегать использования АВК у пациентов с кальцифилаксией, в качестве альтернативы нужно рассматривать новые пероральные антикоагулянты.
Нарушение функции печени, по-видимому, до сих пор является недооцененным фактором. В исследуемой группе отмечен низкий сывороточный уровень альбумина, а пониженные уровни ПХЭ определены как обусловливающие факторы.
Кроме того, ожирение, по-видимому, представляет собой один из основных обусловливающих факторов. Значение ИМТ ни одного из участников не находилось в пределах нормы, у большинства ИМТ > 35 кг/м2. Однако для подтверждения связи между ожирением и кальцифилаксией требуется большее количество участников. При ожирении патогенетический фактор может быть обусловлен повышенной экспрессией фактора некроза опухолей альфа в жировой ткани, что, в свою очередь, уменьшает кровообращение, таким образом ускоряя процесс кальцификации.
Ограничения исследования: неслепой анализ медицинских карт пациентов может быть источником систематической ошибки. Ретроспективная оценка нестандартизованных данных также является ограничением данной работы. Проведение будущих исследований с большим количеством участников и контрольной группой будут представлять интерес для того, чтобы сделать определенные выводы относительно факторов риска развития кальцифилаксии.
Заключение
Кальцифилаксия представляет собой редкое заболевание с высокой смертностью, ассоциированное с принадлежностью женскому полу, ожирением, тяжелой хронической болезнью почек и гиперпаратиреозом. Особенно важными факторами, обусловливающими развитие кальцифилаксии, являются прием АВК и дисфункция печени. Кумуляция множества сопутствующих факторов, по-видимому, приводит к манифестации заболевания. Нормальная почечная функция с одновременным нарушением гомеостаза кальция и фосфатов в сочетании со вторичным гиперпаратиреозом, приемом АВК или терапией витамином D также может привести к вспышке кальцифилаксии. Таким образом, по-видимому, нет единой детерминанты, вызывающей кальцифилаксию, однако взаимодействие различных факторов, каждый из которых имеет свой вес, может привести к вспышке заболевания. Как только определенный порог превышен, начинается кальцифилаксия.
В целом это угрожающее жизни событие для пациентов. В качестве результата настоящего исследования врачам стоит рассмотреть возможность применения ПАПД у пациентов с хроническим заболеванием почек, где это возможно. Поскольку прогрессирование и развитие кальцифилаксии являются скорее хроническими, чем острыми процессами, раннее применение ПАПД вместо АВК может оказывать благотворное воздействие и снижать заболеваемость кальцифилаксией. В последнее время некоторые ПАПД были одобрены для применения у пациентов с умеренной до тяжелой и тяжелой хронической болезнью почек. К сожалению, данные о безопасности применения ПАПД у пациентов с прогрессирующей ХБП ограничены, и работы, исследующие риски и преимущества их применения у пациентов с риском кальцифилаксии, крайне необходимы. И последнее, у пациентов с дополнительными поражениями кожи и гиперпаратиреозом переход с АВК на ПАПД или гепарин является весьма оправданным.
Из-за растущей осведомленности об этом заболевании частота диагностированных случаев кальцифилаксии в ближайшие годы увеличится. Но, вероятно, с учетом возрастающей роли ПАПД, заменяющих АВК, в будущем мы можем увидеть снижение общей заболеваемости.
Необходимо проведение дальнейших проспективных исследовании (и они частично проводятся), в которых исследуются уже выявленные факторы.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
BMC Nephrology2019
Филипп Русс, Мартин Руссвурм, Биргит Кортус-Гетце, Иоахим Хойер, Сахана Камаланабхайя
Аннотация
Введение
Кальцифилаксия является опасным для жизни осложнением у почечных больных, поэтому большое значение приобретает выявление сопутствующих факторов этого заболевания. Из-за вариабельности клинической картины определение таких факторов может быть затруднено в тех случаях, когда постановка диагноза «кальцифилаксия» основана только на клинических признаках. Целью настоящего исследования стало охарактеризовать ассоциированные факторы только у пациентов с кальцифилаксией, подтвержденной гистоморфологическими исследованиями в дополнение к клинической картине.
Методы
В ретроспективном исследовании, проведенном в одном медицинском центре, проанализированы данные 15 пациентов, собранные в течение 8 лет в период с 2008 по 2016 годы. В исследование были включены только пациенты с клиническими особенностями и гистоморфологическим подтверждением кальцифилаксии. Критериями для постановки диагноза «кальцифилаксия» на основании гистологических исследований были гиперплазия интимы, микротромбия или кальцификация медии, выявленная окрашиванием по фон Косса.
Результаты
Средний возраст пациентов составлял 64,8 года. Девять пациентов (60%) были женского пола; 12 (80%) страдали ожирением с индексом массы тела (ИМТ) более 30 кг/м2; у трех пациентов (20%) не было почечных заболеваний; 12 (80%) страдали от ХБП четвертой или пятой степени, а у 10 (66,7%) была терминальная стадия почечной недостаточности (ТСПН). Одногодичная летальность во всей когорте составила 73,3%.
Информация о приеме лекарств: большинство пациентов (n = 13 (86,7%)) получали антагонисты витамина К (АВК); 10 (66,7%) — витамин D; шестеро (40%) —добавки кальция перорально; пятеро (33,3%) проходили лечение кортикостероидами; 12 (80%) принимали ингибиторы протонной помпы (ИПП); у 13 (86,7%) пациентов был клинически подтвержденный гиперпаратиреоз. Десять (66,7%) пациентов во время диагностики имели гипоальбуминемию.
Выводы
Оценка доказанной результатами биопсии кальцифилаксии показывает, что в особенности лечение антагонистами витамина К и дисфункция печени являются наиболее важными сопутствующими факторами развития кальцифилаксии. Поскольку прогрессирование и развитие кальцифилаксии представляют собой скорее хронические, чем острые процессы, раннее назначение пероральных антикоагулянтов прямого действия (ПАПД) вместо АВК может оказывать благоприятное действие и снизить частоту возникновения кальцифилаксии.
Введение
Кальцифилаксия, также известная как кальцифицирующаяся уремическая артериолопатия (КУА), представляет собой редкое заболевание, связанное с хронической болезнью почек (ХБП). Кристаллы осаждаются в мелких кожных кровеносных сосудах, по-видимому, из-за дисбаланса сывороточных уровней кальция и фосфатов [1], а также из-за нарушений, связанных с модуляторами обмена веществ, таких как паратиреоидный гормон [2]. Возникающая в результате периваскулярная кальцификация вызывает болезненную облитерацию сосудов, изъязвления и некроз. Уровень одногодичной летальности колеблется от 50 до 70% [1, 3], и в основном смертность обусловлена инфекционными осложнениями или сепсисом. Пациенты, страдающие терминальной стадией почечной недостаточности (ТСПН), в подавляющем большинстве случаев подвержены кальцифилаксии, однако она также возникает у пациентов с умеренно сниженной или даже нормальной функцией почек [4]. При предполагаемой частоте развития ТСПН ниже 1% [5] проспективные клинические испытания трудно проводить из-за редкости заболевания.
Перед постановкой диагноза «кальцифилаксия» необходимо рассмотреть несколько других факторов, таких как заболевание периферических артерий, васкулит, фенпрокумон- или гепарин-индуцированный некроз кожи, криоглобулинемия и синдромы холестериновой эмболии. Лабораторные исследования, показывающие патологические уровни паратиреоидного гормона, кальция и фосфата в сыворотке крови являются типичными, но не определяющими критериями заболевания. Кроме того, вторичный гиперпаратиреоз и нарушенный гомеостаз кальция и фосфатов представляют собой частые сопутствующие патологии у пациентов с ТСПН. Стандартным критерием для постановки диагноза «кальцифилаксия» являются положительные результаты биопсии кожи с четко определенными диагностическими показателями, такими как наличие кальцификации медии при окрашивании по фон Косса, гиперплазия интимы, микротромбия, изъязвление эпидермиса или внесосудистая кальцификация мягких тканей [6]. Тем не менее, в большинстве исследований доля подтвержденных результатами биопсии случаев кальцифилаксии остается низкой, а постановку диагноза зачастую проводят на основании клинических и лабораторных признаков [7]. С другой стороны, отсутствие биопсии, вероятно, приводит к учету при постановке диагноза язвенных поражений, обусловленных не кальцифилаксией. Поэтому мы провели исследование факторов, ассоциированных с кальцифилаксией, включающее только пациентов с этим диагнозом, подтвержденным результатами биопсии.
Основная цель состояла в том, чтобы оценить сопутствующие факторы, которые могут способствовать либо вспышке заболеваемости, либо обострению течения кальцифилаксии, для более глубокого понимания этиологии этого заболевания. Для этого в университетской больнице Марбурга (Германия) были собраны данные о лабораторных показателях, эпидемиологии и уровнях выживаемости у пациентов, страдающих кальцифилаксией, подтвержденной результатами биопсии. Кроме того, при изучении факторов, влияющих на метаболизм кальция и кальцификацию, особое внимание было уделено лечению пациентов.
Методы
Проведен ретроспективный анализ пациентов Университетской клиники г. Марбург, которые найдены по коду Международной классификации болезней (МКБ) для кальцифилаксии (E83.50) в системе документооборота клиник «Орбис» (AGFA®). Период сбора информации о пациентах включал 2005–2016 годы. С помощью данного метода было выявлено 20 пациентов.
В исследование были включены только пациенты с четкой клинической картиной кальцифилаксии и положительными результатами гистологических исследований. Отдельные гистологические данные о кальцифилаксии включали положительное на кальцификацию медии окрашивание по фон Косса, или, по крайней мере, одно из вторичных изменений, таких как гиперплазия интимы, микротромбия или кальцификация мягких тканей [6]. Следовательно, в соответствии с результатами дерматогистологических исследований у всех включенных в исследование пациентов наблюдалась гистологическая картина, соответствующая кальцифилаксии. Пациенты с клиническими признаками, но без дерматогистологических доказательств или при отсутствии биопсии были исключены из исследования.
Данные об эпидемиологии, сопутствующих патологиях, назначенных препаратах и лечении до постановки диагноза, лабораторных параметрах, а также выживаемости были взяты из электронных медицинских карт пациентов. Анализ данных проводили с применением описательной статистики.
Результаты
Эпидемиология и сопутствующие патологии пациентов
Все 15 пациентов-европеоидов имели диагноз «кальцифилаксия», подтвержденный результатами биопсии. В таблице 1 обобщены демографические данные пациентов и сопутствующие патологии. На момент постановки диагноза средний возраст пациентов составлял 64,8 года (SD = 15,4 года) с возрастным диапазоном 20–80 лет. Девять пациентов (60%) были женского пола. Ни у одного пациента значение ИМТ не было ниже 25 кг/м2. В соответствии с Международной классификацией ожирения у взрослых три пациента имели предожирение (ИМТ = 25,00–29,99 кг/м2), трое — ожирение первого класса (ИМТ = 30,00–34,99 кг/м2), двое — ожирение второго класса (ИМТ = 35,00–39,99 кг/м2) и семь пациентов — ожирение третьего класса (ИМТ = 40 кг/м2 или выше). Поражения проксимальных участков тела наблюдались в большинстве случаев (11, 73,3%), однако у четырех (26,7%) пациентов имелись только поражения дистальных частей тела. В таблице 1 представлены сопутствующие патологии пациентов до постановки диагноза «кальцифилаксия». У трех пациентов (20%) не было заболеваний почек. У 12 (80%) пациентов при первичном обследовании выявлены патологические лабораторные показатели почечной функции, такие как уровни креатинина и мочевины, скорость клубочковой фильтрации и параметры мочеиспускания, или диагностирована нефропатия, подтвержденная результатами биопсии. Эти пациенты могут быть классифицированы как имеющие ХБП четвертой–пятой стадии. До постановки диагноза у 10 пациентов была ТСПН, троим проводился диализ в течение последних 6 месяцев. В ходе исследования у всех пациентов измеряли уровни ПТГ. Гиперпаратиреоз был определен как превышение верхнего предела нормы уровня ПТГ для применявшегося анализа (выше 65 нг/л). У 13 пациентов (86,7%) был выявлен гиперпаратиреоз (медиана значений уровня ПТГ = 157 нг/л; межквартильный размах = 73–241 нг/л). Все случаи гиперпаратиреоза носили вторичный характер. Семь (46,7%) пациентов имели сопутствующий диабет второго типа и двое (13,3%) — заболевания печени. Одногодичная летальность составила 73,3%.
Таблица 1.Демографические данные и сопутствующие патологии участников исследования
Лабораторные показатели на момент постановки диагноза
В таблице 2 обобщены лабораторные показатели, ассоциированные с нарушениями гомеостаза у пациентов с ХБП и идентифицированные как потенциальные сопутствующие факторы развития кальцифилаксии. У большинства пациентов (9 из 15, 60%) наблюдался повышенный уровень фосфатов в сыворотке крови. 46,7% всех пациентов получали фосфат-связывающие препараты. Хотя десять пациентов перорально принимали витамин D и шесть — кальций, сывороточный уровень кальция был низким у семи пациентов. Только у одного пациента был повышен уровень кальция в сыворотке, у всех остальных (46,7%) он находился в пределах нормы. Однако после коррекции содержания кальция в сыворотке крови у семи пациентов (46,7%) была выявлена гиперкальциемия (> 2,58 ммоль/л). На момент постановки диагноза у десяти пациентов зафиксирована гипоальбуминемия. У 13 пациентов во время прогрессирования заболевания снижались сывороточные уровни альбумина. Кроме того, был исследован уровень псевдохолинэстеразы (ПХЭ) в качестве маркера ее синтеза в печени. Данные были доступны только для десяти (66,7%) пациентов, но все уровни ПХЭ в сыворотке были снижены. Уровень щелочной фосфатазы был повышен у шести (40%) пациентов.
Таблица 2. Лабораторные показатели пациентов, страдающих кальцифилаксией
Результаты гистологических исследований
Mochel et al. [6] изучали гистологические признаки кальцифилаксии, в том числе такие гистологические показатели, как микротромбия, гиперплазия интимы, изъязвление эпидермиса и внесосудистая кальцификация мягких тканей. У всех пациентов были выявлены определяющие кальцифилаксию гистологические признаки. У двух третей пациентов была выявлена кальцификация медии мелких и средних сосудов кожи, положительно окрашиваемая по фон Косса. У одной трети кальцификация отсутствовала, но наблюдались вторичные гистологические изменения, связанные с кальцифилаксией, такие как гиперплазия интимы, микротромбия или внесосудистая кальцификация мягких тканей (таблица 3 ).
Таблица 3. Результаты гистологических исследований участников исследования
Прием лекарств во время диагностики
В таблице 4 обобщены конкретные лекарства, принимаемые пациентами. На рис. 1 (прием препаратов на момент постановки диагноза) показано часто наблюдаемое сопутствующее медикаментозное лечение у пациентов с кальцифилаксией, как это было установлено различными авторами [8, 9]. 13 (86,7%) пациентов принимали антагонист витамина K из-за мерцательной аритмии. Две трети (10 пациентов, 66,7%) получали витамин D, шестеро (40%) —добавки кальция для перорального приема. Одна треть (пять пациентов, 33,3%) принимали системные кортикостероиды.
Таблица 4. Лекарственные препараты, назначенные участникам исследования, страдающим кальцифилаксией, подтвержденной результатами биопсии
 Рисунок 1. Прием лекарств во время диагностики
Рисунок 1. Прием лекарств во время диагностикиИзвестно, что ИПП вызывают статистически значимое различие в общих уровнях кальция и паратиреоидного гормона (ПТГ) в сыворотке [10], поэтому принимаемые пациентом лекарства представляют определенный интерес. В настоящем исследовании участвовали 12 (80%) пациентов, принимающих ИПП.
Аналогичным образом предполагается, что прием добавок железа оказывает отрицательное влияние на развитие кальцифилаксии [11, 12]. В исследуемой группе пять пациентов получали ферритин внутривенно (33,3%). Статины, в свою очередь, имеют антикальцифицирующие, антитромботические и противовоспалительные свойства, поэтому их назначают пациентам с кальцифилаксией [13]. В исследуемой группе семь (46,7%) пациентов принимали статины.
Обсуждение
В настоящем ретроспективном анализе сделана попытка выявить несколько взаимодействующих факторов, которые могут быть связаны со вспышкой кальцифилаксии. Создается впечатление отсутствия единого, специфического набора факторов, которые приводят к этому заболеванию. Однако в исследовании выявлены факторы, которые казались наиболее распространенными и клинически значимыми. Конечно, отдельные факторы также различаются по своей значимости.
Мы можем подтвердить, что помимо вторичного гиперпаратиреоза, ожирение и принадлежность к женскому полу представляются основными сопутствующими факторами. Кроме того, лечение с помощью АВК является важным фактором, связанным с кальцифилаксией, присутствующим почти у 90% пациентов. Кроме того, большинство пациентов принимали ИПП.
Большинство пациентов страдали вторичным гиперпаратиреозом из-за ХБП и последовательного нарушения метаболизма кальция и фосфора, что, в свою очередь, представляет собой фактор, коррелирующий со вспышкой кальцифилаксии, как было показано во многих предыдущих исследованиях [4, 14, 15, 16]. Тем не менее, лишь у немногих пациентов был выявлен повышенный уровень кальций-фосфатных метаболитов. Данный факт может быть связан с терапевтическим вмешательством в метаболизм кальция и фосфора с помощью назначения добавок кальция и витамина D для перорального приема, а также кальцийсодержащих фосфат-связывающих препаратов. В любом случае, наличествуют равносильные доказательства, как подтверждающие, так и оспаривающие влияние кальций-фосфатных метаболитов на развитие кальцифилаксии [13, 17, 18, 19].
Таким образом, хотя патологические кальций-фосфатные метаболиты обычно обнаруживают у пациентов, страдающих кальцифилаксией, их присутствие не является обязательным фактором для диагностики и может отсутствовать у некоторых пациентов. Другим фактором, влияющим на гомеостаз кальция и фосфора, являются добавки витамина D для перорального приема, которые принимало большинство участников исследования с кальцифилаксией до вспышки заболевания. Данное наблюдение подтверждается несколькими исследованиями и сообщениями [4, 9, 13, 17]. Аналогичным образом ИПП, видимо, влияет на уровень магния и кальция в сыворотке, что, в свою очередь, может привести к снижению уровня кальция [10]. Отметим, что 80% участников настоящего исследования принимали ИПП. Насколько известно, в настоящее время нет биологического обоснования вклада ИПП в развитие кальцифилаксии, поэтому может представлять интерес проведение будущих исследований, посвященных возможной патофизиологической связи.
Наиболее заметным результатом данного исследования был высокий процент пациентов, которых лечили с помощью АВК (почти 90%). В других работах АВК назначали приблизительно 25% участникам исследования [4, 20]. АВК являются признанным сопутствующим фактором развития кальцифилаксии и ускоряют ее прогрессирование. Исследования на животных моделях с использованием крыс, которым вводили АВК, продемонстрировали не только более быструю кальцификацию артерий, но также влияние на сердечные клапаны [21]. АВК ингибирует посттрансляционное гамма-карбоксилирование многих белков, включая матриксный Gla-белок (MGP — matrix Gla protein), который, в свою очередь, ингибирует кальцификацию. Nigwekar et al. выявили значительное снижение уровня карбоксилированного MGP у пациентов, страдающих кальцифилаксией, по сравнению с контрольной группой [ 22 ].
Другой случай, доказывающий связь между АВК и кальцифилаксией, был замечен у одного участника данного исследования, пережившего кальцифилаксию. Лечение АВК было начато из-за мерцательной аритмии. После постановки диагноза «кальцифилаксия» АВК был отменен и связанные с кальцифилаксией поражения были полностью излечены. Через год лечение АВК было продолжено, однако оно привело к рецидиву поражений, связанных с кальцифилаксией. Таким образом, следует избегать использования АВК у пациентов с кальцифилаксией, в качестве альтернативы нужно рассматривать новые пероральные антикоагулянты.
Нарушение функции печени, по-видимому, до сих пор является недооцененным фактором. В исследуемой группе отмечен низкий сывороточный уровень альбумина, а пониженные уровни ПХЭ определены как обусловливающие факторы.
Кроме того, ожирение, по-видимому, представляет собой один из основных обусловливающих факторов. Значение ИМТ ни одного из участников не находилось в пределах нормы, у большинства ИМТ > 35 кг/м2. Однако для подтверждения связи между ожирением и кальцифилаксией требуется большее количество участников. При ожирении патогенетический фактор может быть обусловлен повышенной экспрессией фактора некроза опухолей альфа в жировой ткани, что, в свою очередь, уменьшает кровообращение, таким образом ускоряя процесс кальцификации.
Ограничения исследования: неслепой анализ медицинских карт пациентов может быть источником систематической ошибки. Ретроспективная оценка нестандартизованных данных также является ограничением данной работы. Проведение будущих исследований с большим количеством участников и контрольной группой будут представлять интерес для того, чтобы сделать определенные выводы относительно факторов риска развития кальцифилаксии.
Заключение
Кальцифилаксия представляет собой редкое заболевание с высокой смертностью, ассоциированное с принадлежностью женскому полу, ожирением, тяжелой хронической болезнью почек и гиперпаратиреозом. Особенно важными факторами, обусловливающими развитие кальцифилаксии, являются прием АВК и дисфункция печени. Кумуляция множества сопутствующих факторов, по-видимому, приводит к манифестации заболевания. Нормальная почечная функция с одновременным нарушением гомеостаза кальция и фосфатов в сочетании со вторичным гиперпаратиреозом, приемом АВК или терапией витамином D также может привести к вспышке кальцифилаксии. Таким образом, по-видимому, нет единой детерминанты, вызывающей кальцифилаксию, однако взаимодействие различных факторов, каждый из которых имеет свой вес, может привести к вспышке заболевания. Как только определенный порог превышен, начинается кальцифилаксия.
В целом это угрожающее жизни событие для пациентов. В качестве результата настоящего исследования врачам стоит рассмотреть возможность применения ПАПД у пациентов с хроническим заболеванием почек, где это возможно. Поскольку прогрессирование и развитие кальцифилаксии являются скорее хроническими, чем острыми процессами, раннее применение ПАПД вместо АВК может оказывать благотворное воздействие и снижать заболеваемость кальцифилаксией. В последнее время некоторые ПАПД были одобрены для применения у пациентов с умеренной до тяжелой и тяжелой хронической болезнью почек. К сожалению, данные о безопасности применения ПАПД у пациентов с прогрессирующей ХБП ограничены, и работы, исследующие риски и преимущества их применения у пациентов с риском кальцифилаксии, крайне необходимы. И последнее, у пациентов с дополнительными поражениями кожи и гиперпаратиреозом переход с АВК на ПАПД или гепарин является весьма оправданным.
Из-за растущей осведомленности об этом заболевании частота диагностированных случаев кальцифилаксии в ближайшие годы увеличится. Но, вероятно, с учетом возрастающей роли ПАПД, заменяющих АВК, в будущем мы можем увидеть снижение общей заболеваемости.
Необходимо проведение дальнейших проспективных исследовании (и они частично проводятся), в которых исследуются уже выявленные факторы.
Список использованной литературы
- Schmid-Simbeck M, Udvardi A, Volc-Platzer B. Hautmanifestationen bei Nierenerkrankungen. Hautarzt. 2016;67:960–9. doi.org .View ArticlePubMedGoogle Scholar
- Jeong HS, Dominguez AR. Calciphylaxis: controversies in pathogenesis, diagnosis and treatment. Am J Med Sci. 2016;351:217–27. doi.org .View ArticlePubMedGoogle Scholar
- Zhang Y, Corapi KM, Luongo M, Thadhani R, Nigwekar SU. Calciphylaxis in peritoneal dialysis patients: a single center cohort study. Int J Nephrol Renovasc Dis. 2016;9:235–41. doi.org .View ArticlePubMedPubMed CentralGoogle Scholar
- Renner R, Dissemond J, Goerge T, Hoff N, Kroger K, Erfurt-Berge C. Analysis of the German DRG data for livedoid vasculopathy and calciphylaxis. J Eur Acad Dermatol Venereol. 2017. doi.org .
- Brandenburg VM, Kramann R, Rothe H, Kaesler N, Korbiel J, Specht P, et al. Calcific uraemic arteriolopathy (calciphylaxis): data from a large nationwide registry. Nephrol Dial Transplant. 2016. doi.org .
- Mochel MC, Arakaki RY, Wang G, Kroshinsky D, Hoang MP. Cutaneous calciphylaxis: a retrospective histopathologic evaluation. Am J Dermatopathol. 2013;35:582–6. doi.org .View ArticlePubMedGoogle Scholar
- Brandenburg VM, Martin H, Sohn CMP, Ketteler M. Kalziphylaxie. Dtsch Med Wochenschr. 2015;140:347–51. doi.org .View ArticlePubMedGoogle Scholar
- Brandenburg VM, Evenepoel P, Floege J, Goldsmith D, Kramann R, Massy Z, et al. Lack of evidence does not justify neglect: how can we address unmet medical needs in calciphylaxis? Nephrol Dial Transplant. 2016;31:1211–9. doi.org .View ArticlePubMedGoogle Scholar
- Storan ER, O’Gorman SM, Murphy A, Laing M. Case report of Calciphylaxis secondary to calcium and vitamin D3 supplementation. J Cutan Med Surg. 2016. doi.org .
- Bahtiri E, Islami H, Hoxha R, Gashi A, Thaci K, Karakulak C, et al. Proton pump inhibitor use for 12 months is not associated with changes in serum magnesium levels: a prospective open label comparative study. Turk J Gastroenterol. 2017;28:104–9. doi.org .View ArticlePubMedGoogle Scholar
- Farah M, Crawford RI, Levin A, Chan Yan C. Calciphylaxis in the current era: emerging 'ironic' features? Nephrol Dial Transplant. 2011;26:191–5. doi.org .View ArticlePubMedGoogle Scholar
- Goodkin DA, Larkina M, Robinson BM. Iron and calciphylaxis. Nephrol Dial Transplant. 2011; 26:3063; author reply 3063-4. doi:10.1093/ndt/gfr330 .Google Scholar
- Nigwekar SU, Bhan I, Turchin A, Skentzos SC, Hajhosseiny R, Steele D, et al. Statin use and calcific uremic arteriolopathy: a matched case-control study. Am J Nephrol. 2013;37:325–32. doi.org .View ArticlePubMedPubMed CentralGoogle Scholar
- Ghosh T, Winchester DS, Davis MDP, El-Azhary R, Comfere NI. Early clinical presentations and progression of calciphylaxis. Int J Dermatol. 2017. doi.org .
- McCarthy JT, El-Azhary RA, Patzelt MT, Weaver AL, Albright RC, Bridges AD, et al. Survival, risk factors, and effect of treatment in 101 patients with Calciphylaxis. Mayo Clin Proc. 2016;91:1384–94. doi.org .View ArticlePubMedGoogle Scholar
- Loidi Pascual L, Valcayo Penalba A, Oscoz Jaime S, Cordoba Iturriagagoitia A, Rodil Fraile R, Yanguas Bayona JI. Calcifilaxia. Estudio de 9 casos. Med Clin (Barc). 2016;147:157–61. doi.org .View ArticleGoogle Scholar
- Fine A, Zacharias J. Calciphylaxis is usually non-ulcerating: risk factors, outcome and therapy. Kidney Int. 2002;61:2210–7. doi.org .View ArticlePubMedGoogle Scholar
- Weenig RH, Sewell LD, Davis MDP, McCarthy JT, Pittelkow MR. Calciphylaxis: natural history, risk factor analysis, and outcome. J Am Acad Dermatol. 2007;56:569–79. doi.org .View ArticlePubMedGoogle Scholar
- Mazhar AR, Johnson RJ, Gillen D, Stivelman JC, Ryan MJ, Davis CL, Stehman-Breen CO. Risk factors and mortality associated with calciphylaxis in end-stage renal disease. Kidney Int. 2001;60:324–32. doi.org .View ArticlePubMedGoogle Scholar
- Tian F, Patterson AT, Davick JJ, Ing SW, Kaffenberger BH, Gru AA. The cutaneous expression of vitamin K-dependent and other osteogenic proteins in calciphylaxis stratified by clinical features and warfarin use: a case control study. J Am Acad Dermatol. 2016;75:840–842.e1. doi.org .View ArticlePubMedGoogle Scholar
- Price PA, Faus SA, Williamson MK. Warfarin causes rapid calcification of the elastic lamellae in rat arteries and heart valves. Arterioscler Thromb Vasc Biol. 1998;18:1400–7. doi.org .View ArticlePubMedGoogle Scholar
- Nigwekar SU, Bloch DB, Nazarian RM, Vermeer C, Booth SL, Xu D, et al. Vitamin K-dependent carboxylation of matrix Gla protein influences the risk of Calciphylaxis. J Am Soc Nephrol. 2017. doi.org .





