5287
05 Июня 2020
Клинический случай в нефрологии, 2018; 2018: 7381505
Электронная версия опубликована 9 декабря 2018 года.
Антикоагулянт-ассоциированная нефропатия, индуцированная дабигатраном
Авторы: Nazia Sharfuddin,1 Mahra Nourbakhsh,2 Alan Box, 2 Hallgrimur Benediktsson, 2, 3 и Daniel A. Muruve
Введение
Антикоагулянт-ассоциированная нефропатия – форма острого поврежден...
Антикоагулянт-ассоциированная нефропатия, индуцированная дабигатраном
Авторы: Nazia Sharfuddin,1 Mahra Nourbakhsh,2 Alan Box, 2 Hallgrimur Benediktsson, 2, 3 и Daniel A. Muruve
- Медицинский факультет, Университет Калгари, Канада
- Кафедра патологии и лабораторной медицины, Университет Калгари, Канада
- Институт хронических заболеваний Снайдера, Университет Калгари, Канада
Введение
Антикоагулянт-ассоциированная нефропатия – форма острого поврежден...
Клинический случай в нефрологии, 2018; 2018: 7381505
Электронная версия опубликована 9 декабря 2018 года.
Антикоагулянт-ассоциированная нефропатия, индуцированная дабигатраном
Авторы: Nazia Sharfuddin,1 Mahra Nourbakhsh,2 Alan Box, 2 Hallgrimur Benediktsson, 2, 3 и Daniel A. Muruve
Введение
Антикоагулянт-ассоциированная нефропатия – форма острого повреждения почек, обусловленная избыточным антикоагулянтным эффектом [1–3]. Хотя этот вид повреждения почек традиционно связывают с применением варфарина [1, 4, 5], продемонстрировано, что с ним может быть связан прием прямых пероральных антикоагулянов (ПОАК) [3].
Диагноз «антикоагулянт-ассоциированная нефропатия» устанавливается на основании данных патогистологического исследования: острого повреждения почечных канальцев, присутствия эритроцитарных цилиндров в канальцах по данным световой микроскопии и отсутствии острой гломерулярной болезни [3]. Интраренальное кровотечение в условиях антикоагулянтной терапии приводит к обструкции канальцев эритроцитами и последующему повреждению почек [1, 3]. Дальнейшее клеточное повреждение, вероятно, обусловлено также токсическим воздействием гема [6].
Уровень общей заболеваемости ПОАК-ассоциированной нефропатией неизвестен, имеется лишь некоторое количество сообщений о клинических случаях [7]. Согласно сообщениям, из всех ПОАК антикоагулянт-ассоциированная нефропатия чаще всего развивается при использовании дабигатрана, прямого ингибитора тромбина [8]. Апиксабан, ингибитор фактора Xa, также связан с антикоагулянт-ассоциированной нефропатией [9]. Все известные случаи дабигатран-ассоциированной нефропатии наблюдались у пациентов с IgA-нефропатией. Это свидетельствует о том, что гломерулярные болезни, в особенности IgA-нефропатия, являются факторами риска дабигатран-ассоциированной нефропатии [7]. В данной статье описан случай дабигатран-ассоциированной нефропатии, подтвержденной результатами биопсии, у пациентки без предшествующей IgA-нефропатии. Данный случай еще больше подтверждает концепцию, согласно которой ПОАК могут индуцировать повреждение почек, сходное с повреждением при использовании варфарина, при отсутствии значимой патологии почек.
Описание клинического случая
Женщина 81 года со множеством сопутствующих заболеваний, из которых большое значение имеет фибрилляция предсердий. Получала антикоагулянтную терапию дабигатраном 150 мг два раза в сутки. Поступила с хроническим повреждением почек в условиях объемной перегрузки. Пациентка начала прием дабигатрана два года назад. В анамнезе имеются следующие заболевания: ишемическая болезнь сердца, хроническая болезнь почек стадии 2A, инсулинзависимый сахарный диабет, артериальная гипертензия, хроническая лимфоцитарная лейкемия, гипотиреоз и лимфоузел в легком. Пациентка принимала следующие препараты: аспирин 81 мг один раз в сутки, амлодипин 5 мг один раз в сутки, лозартан 150 мг один раз в сутки, гидрохлортиазид 37,5 мг один раз в сутки, бисопролол 7,5 мг один раз в сутки, нитроглицерин в форме трансдермального пластыря 0,4 мг с 8:00 до 20:00 ежедневно, метформин 500 мг четыре раза в сутки, инсулин гларгин 70 единиц два раза в сутки, инсулин Хумалог 30–60 единиц в зависимости от уровня гипергликемии три раза в сутки перед едой и левотироксин 125 мкг один раз в сутки. Она не злоупотребляла алкоголем и не курила.
На момент поступления у пациентки в течение недели отмечалась прогрессирующая одышка. Кашель, повышение температуры, озноб и контакты с больными отрицала. При обследовании по системам органов другой значимой патологии обнаружено не было. При поступлении у пациентки отмечалась гипоксия. Сатурация кислорода варьировала от 88% до 92% после оксигенотерапии через назальные канюли со скоростью 6 л/мин. Гемодинамика пациентки была стабильной, повышения температуры не отмечалось, остальные показатели жизненных функций были в пределах нормы. При объективном осмотре венозное давление в яремной вене определялось в 6 см над стернальным углом. Шумов, дополнительных тонов сердца, сердечного толчка или сердечного дрожания не определяется. Определялся отек голеней до коленных суставов с возникновением ямки при надавливании. При аускультации легких дыхание ослабленное с обеих сторон с крупнопузырчатыми влажными хрипами. Других значимых отклонений при проведении физикального обследования обнаружено не было.
При проведении лабораторных исследований на момент поступления был выявлен лейкоцитоз 16,8 (норма: 4–10 X 109/л) (см. таблицу 2), лимфоциты – 11,3 (норма: 0,5–3,3 X 109/л), нейтрофилы – 5,4 (норма: 2,0–9,0 X 109/л) и моноциты – 0,2 (норма: 0,0 – 1,0 X 109/л). Гемоглобин – 118 г/л (норма: 123–157 г/л); тромбоциты – 217 (норма: 130–400 X 109/л) (см. таблицу 2). У пациентки определялся повышенный уровень мозгового натрийуретического пептида (МНП) – 5741 (возрастная норма для лиц в возрасте >75 лет: 300 – 1800 нг/л) (см. таблицу 2). Сывороточный креатинин – 177 мкмоль/л (норма: 40–100 мкмоль/л), рСКФ – 23 мл/мин/1,73 м2 (норма: ≥ 60 мл/мин/1,73 м2). Исходно уровень сывороточного креатинина составлял 91 мкмоль/л, рСКФ – 57 мл/мин/1,73 м2. Уровень электролитов был в пределах нормы (см. таблицу 2). Значение МНО повышено до 1,6 (норма: 0,8–1,1), активированное частичное тромбопластиновое время (АЧТВ) было повышено до 50 секунд (норма: 28–38 секунд) (см. таблицу 2).
Таблица 2
Лабораторные исследования
При рентгенографии грудной клетки был выявлен интерстициальный отек легких без смещения контуров сердца и средостения. Минимальный выпот в плевральных полостях. Размер желудочков и систолическая функция при трансторакальной эхокардиографии – в пределах нормы. Фракция выброса составила >60 %. Гипертрофия левого желудочка легкой степени, клапаны – без патологических изменений.
Пациентки был назначен диуретик фуросемид 40 мг в/в два раза в сутки, суммарная доза 80 мг в/в в первые сутки, прием жидкости ограничили до <2 л/сут. Одышка и гипоксемия разрешились в течение 24 часов. Однако уровень сывороточного креатинина продолжал расти. Сывороточный креатинин пациентки вырос с исходного уровня 91 мкмоль/л (норма: 40–100 мкмоль/л) до 177 мкмоль/л в день поступления и достиг 618 мкмоль/л за 7 дней пребывания в стационаре (рисунок 1). Фуросемид отменили на второй день после поступления. В связи с нарастанием уровня креатинина ограничение приема жидкости отменили и вместо этого начали вводить изотонические растворы внутривенно. Это не повлияло на показатели сывороточного креатинина. Пациентка была направлена в нефрологическое отделение для оценки степени тяжести острого повреждения почек. Была начата заместительная почечная терапия через центральный венозный катетер, а также периодический гемодиализ. Прием дабигатрана был прекращен.
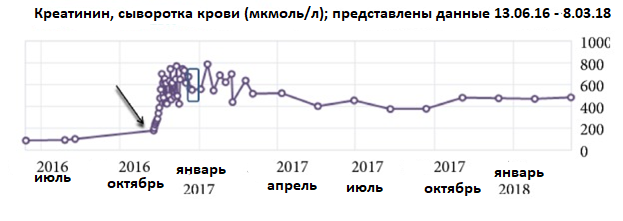 Рисунок 1
Рисунок 1
Динамика уровней сывороточного креатинина.
Исходный уровень сывороточного креатинина составил 91 мкмоль/л (норма: 40–100 мкмоль/л). Он повысился до 177 мкмоль/л в день поступления (стрелка), максимальное значение за время госпитализации составило 800 мкмоль/л. В день выписки уровень сывороточного креатинина составил 554 мкмоль/л (рамка). Пациентка начала прием дабигатрана за два года до этого эпизода.
Общий анализ мочи:
Моча мутная коричневого цвета, макрогематурии нет. При микроскопическом анализе обнаружено >30 измененных эритроцитов в поле зрения, белок> 5 г/л, лейкоциты (лейк.) > 5 в поле зрения, лейкоцитэстераза и нитриты не обнаружены (см. таблицу 1). До настоящей госпитализации гематурии или протеинурии в общем анализе мочи не определялось.
Ультразвуковое исследование почек показало легкое повышение эхогенности паренхимы с двух сторон, предполагающее заболевание почек. Гидронефроза обнаружено не было. Фракционная экскреция натрия (FeNa) составила 1,1%. Титр анти-стрептолизина O составил 449 МЕ/мл (норма: 0–200 МЕ/мл), а IgA сыворотки – 5,85 г/л (норма: 0,60–4,20 г/л) (см. таблицу 2). Уровни компонентов системы комплемента C3 и C4 были в пределах нормы (см. таблицу 2). Уровни антинуклеарных антител, антител к двуцепочечной ДНК, антител к циклическому цитруллиновому пептиду, антител к базальной мембране клубочка, цитоплазматических антинейтрофильных цитоплазматических антител (c-ANCA) и перинуклеарных антинейтрофильных цитоплазматических антител (p-ANCA) были в пределах нормы (см. таблицу 2). Соотношение свободных легких цепей (каппа/лямбда) в сыворотке также было слегка повышено до уровня 3,16 (норма: 0,26–1,65) (см. таблицу 2). Отношение альмумин/креатинин – 15,37 мг/ммоль (норма: <2,29 мг/ммоль). Результаты серологических исследований на ВИЧ и гепатиты были отрицательными.
Таблица 1
Общий анализ мочи
Пациентке была выполнена диагностическая биопсия почек, которая показала большое количество эритроцитарных цилиндров в просвете канальцев, а также повреждение клеток эпителия канальцев по данным световой микроскопии (рисунки 2(a) и 2(b)) при отсутствии признаков острого гломерулонефрита (рисунки 3(a) и 3(b)). Электронная микроскопия показала наличие субэпителиальных «горбовидных» отложений, большинство из которых локализовались в зонах мезангиальной борозды (mesangial notch areas), и были расценены признаком разрешающегося постинфекционного гломерулонефрита (рисунок 4). При проведении исследования с помощью иммунофлуоресцентной микроскопии антитела IgA и IgG обнаружены не были, однако были выявлены компоненты системы комплемента C3 (рисунок 5). Эти результаты больше всего соответствовали диагнозу «антикоагулянт-ассоциированная нефропатия с сопутствующим разрешившимся постинфекционным гломерулонефритом».
 Рисунок 2
Рисунок 2
Патогистологическое исследование почек I. (a) Биопсия почек показывает наличие большого количества эритроцитов (рамка) и эритроцитарных цилиндров (стрелки) (ШИК-реакция, световая микроскопия, увеличение: X200). (b) Биопсия почек показывает острое повреждение канальцев с потерей щеточной каемки, ослаблением и реактивными изменениями канальцевого эпителия. Эритроцитарные цилиндры (стрелки) указывают на выраженные кровоизлияния в канальцах. Отмечается минимальное растяжение мезангия клубочка без признаков пролиферации (ШИК-реакция, световая микроскопия, увеличение: X200).
 Рисунок 3
Рисунок 3
Патогистологическое исследование биоптата почек II. (a) При окраске клубочка методом ШИК-реакции (увеличение: X200) обнаружено минимальное расширение мезангия без признаков пролиферации мезангиоцитов и эндотелия капилляров. Хроническое ишемическое повреждение подтверждается также утолщением мембраны боуменовской капсулы (синяя стрелка). Также показаны поврежденные канальцы (черная стрелка) (световая микроскопия). (b) при окраске гематоксилин-эозином (увеличение: X100) обнаружены поврежденные канальцы с эритроцитарными цилиндрами (стрелки). Признаки активного гломерулонефрита отсутствуют.
 Рисунок 4
Рисунок 4
Электронная микроскопия биоптата почки. Показаны субэпителиальные электронно-плотные отложения в области мезангиальной борозды (рамка) (электронная микроскопия).
 Рисунок 5
Рисунок 5
Иммунофлуоресцентный анализ биоптата почки. Иммунофлуоресцентная микроскопия с целью определения отложений IgA, IgG, легких цепей каппа, легких цепей лямбда, компонентов системы комплемента C3 и C1Q. Присутствуют отложения компонента системы комплементов C3 в следовых количествах. Депозиты IgA, IgG, легких цепей каппа, легких цепей лямбда, компонентов системы комплемента C1Q не визуализируются.
Пациентка находилась в стационаре длительное время. За время госпитализации у пациентки была обнаружена инфекция мочевыводящих путей, вызванная Enterococcus faecium, реагирующая на терапию ванкомицином, а также субсегментарная эмболия легочной артерии, которую лечили нефракционированным гепарином. Функция почек не восстановилась, и пациентке продолжили проведение периодического гемодиализа.
Обсуждение
Антикоагулянт-ассоциированная нефропатия имеет характерные патогистологические признаки: внутриканальцевые кровоизлияния, канальцевые эритроцитарные цилиндры и повреждение эпителия канальцев по данным световой микроскопии без признаков активного гломерулонефрита [2, 3]. Результаты патогистологического исследования пациентки соответствовали вышеописанным типичным нарушениям, что подтверждало диагноз антикоагулянт-ассоциированной нефропатии, вызванной дабигатраном.
Биопсия почек показала острое повреждение канальцев с внутриканальцевыми эритроцитарными цилиндрами на фоне хронической тубулоинтерстициальной болезни от легкой до средней степени тяжести (рисунки 2(a), 2(b), 3(a) и 3(b)). При электронной микроскопии в области мезангиальной борозды были обнаружены электронно-плотные депозиты (рисунок 4). Их наличие свидетельствовало в пользу постинфекционного гломерулонефрита. Однако ни активный гломерулонефрит, ни IgA-нефропатия не наблюдались. Следовательно, резкое ухудшение функции почек не могло быть связано с гломерулонефритом, а скорее было обусловлено повреждением, вызванным внутриканальцевыми кровоизлияниями. Находки в виде нескольких плотных отложений, соответствующих постинфекционному гломерулонефриту, вероятно, были сопутствующим фактором. Впрочем, возможно, это повреждение способствовало развитию кровоизлияний в клубочках, а затем и внутри канальцев. До настоящей госпитализации гематурии или протеинурии в общем анализе мочи не определялось.
При биопсии варфарин- и дабигатран-ассоциированные нефропатии выглядят одинаково [10]. Избыточный антикоагулянтный эффект при использовании обоих препаратов приводит к выраженному канальцевому кровотечению, что, в свою очередь, вызывает обструкцию канальцев эритроцитарными цилиндрами [11]. Следствием этого является повреждение эпителия канальцев, а также токсическое действие гема и клеточное повреждение, связанное с воздействием железа [6, 12, 13]. Варфарин оказывает прямое повреждающее воздействие на клубочки, ингибируя витамин K-зависимые белки, матриксный белок G1a и гены блокировки роста 6 (GAS-6) [14]. GAS-6 вовлечены в подавление кальцификации сосудов, а также миграцию гладкомышечных клеток сосудов и апоптоз [15]. Поскольку это ингибирующее действие блокируется варфарином, прогрессируют апоптоз гладкомышечных клеток сосудов и их кальцификация. [11]. Дабигатран снижает активность тромбина, что, в свою очередь, может подавлять активность активируемого протеазой рецептора 1 (PAR-1) [8, 11]. PAR-1 является рецептором тромбина, сопряженным с G-белком. Он синтезируется на поверхности эндотелиоцитов, участвующих в функции эндотелия, проницаемости сосудов, миграции лейкоцитов и адгезии [10, 16, 17]. Снижение активности рецепторов PAR-1 может приводить к нарушению тонуса эндотелия сосудов, целостности однослойного эндотелия и повреждению клубочкового фильтрационного барьера [16, 17]. Таким образом, варфарин и дабигатран, вероятно, реализуют один и тот же механизм повреждающего воздействия на почки [8, 11]: разрушение клубочкового фильтрационного барьера, внутриканальцевые кровоизлияния и закупорка канальцев эритроцитарными цилиндрами, цитотоксичность, обусловленная воздействием свободных радикалов гема, и, наконец, повреждение клеток канальцевого эпителия [5, 8, 11].
Имеющиеся на сегодняшний день данные по дабигатран-ассоциированной нефропатии позволяют предположить, что IgA-нефропатия может быть предрасполагающим фактором [7]. Это предположение основано на нескольких сообщениях о случаях, в которых у всех пациентов был сопутствующий диагноз «IgA-нефропатия» [7]. У описанной в этом клиническом случае пациентки этот диагноз отсутствовал. Напротив, клиническая картина напоминала варфарин-ассоциированную нефропатию [4]. Варфарин-ассоциированная нефропатия наблюдается у пациентов вне зависимости от сопутствующей хронической болезни почек, хотя она и считается значительным фактором риска [18, 19]. Кроме того, факторами риска являются пожилой возраст, артериальная гипертензия, сахарный диабет, диабетическая нефропатия [18], сердечная недостаточность, а также ишемическая болезнь сердца [18, 20]. С повышенным риском развития варфарин-ассоциированной нефропатии связан прием таких препаратов как аспирин, блокаторы кальциевых каналов, а также ингибиторов АПФ [11, 18]. Таким образом, на основании литературных данных по варфарину [8, 21] можно сделать вывод, что сопутствующее заболевание почек, в описанном случае – хроническая болезнь почек стадии 2a и разрешившийся постинфекционный гломерулонефрит, могли способствовать развитию дабигатран-ассоциированной нефропатии у пациентки. Более того, имеющиеся у описанной пациентки сопутствующие заболевания (артериальная гипертензия, сердечная недостаточность, сахарный диабет, а также ишемическая болезнь сердца), препараты, включая аспирин и амлодипин, в условиях пожилого возраста и длительного приема дабигатрана могли способствовать развитию предрасположенности к ангикоагулянт-ассоциированной нефропатии.
Данные по дабигатран-ассоциированной нефропатии ограничены. Нефропатия, связанная с применением варфарина, напротив, широко изучается с момента обнаружения в 2009 году [1]. Варфарин-ассоциированная нефропатия может ускорять прогрессирование хронической болезни почек [18, 22]. Кроме того, она коррелирует с повышением летальности [20]. Более того, на крысиных моделях было показано, что стадия хронической болезни почек прямо соотносится с риском развития варфарин-ассоциированной нефропатии [23]. Что касается дабигатран-ассоциированной нефропатии, подобных данных по влиянию на летальность и прогрессирование хронической болезни почек пока нет [7]. Чтобы выяснить частоту новых случаев доказанной патогистологическими исследованиями дабигатран-ассоциированной нефропатии, необходимы дальнейшие исследования. Однако, вероятно, эти случаи редки, учитывая, что в клинической практике все чаще применяются ПОАК. Тем не менее, появляется все больше сообщений о случаях, в том числе, в последнее время, связанных с применением апибаксана – ингибитора фактора свертывания Xa [9]. Поскольку ПОАК применяются все чаще, важно определить не только частоту возникновения новых случаев острого повреждения почек, но и потенциальные факторы риска, как независимые, так и дополнительные, а также их влияние на показатели летальности и заболеваемости.
Выводы
Данный клинический случай описывает новое открытие: дабигатран-ассоциированная нефропатия, как и варфарин-ассоциированная, может развиться и без сопутствующей IgA-нефропатии или значимого предшествующего заболевания почек. [3]. Этот факт расширяет круг возможных диагнозов при дифференциальной диагностике острой почечной недостаточности, особенно в случаях, когда велика вероятность почечной этиологии при приеме ПОАК пациентом. Ранняя постановка диагноза и своевременное прекращение приема вызвавших это осложнение препаратов могут предотвратить значимое прогрессирование заболевания почек и необходимость в проведении заместительной почечной терапии. Таким образом, наличие сопутствующих заболеваний может служить дополнительным фактором риска. Направления дальнейших исследований включают в себя подсчет частоты возникновения новых случаев и распространенности описанного заболевания и стратификацию факторов риска, а также исходов, связанных с данным осложнением лекарственной терапии.
Список литературы
Антикоагулянт-ассоциированная нефропатия, индуцированная дабигатраном
Авторы: Nazia Sharfuddin,1 Mahra Nourbakhsh,2 Alan Box, 2 Hallgrimur Benediktsson, 2, 3 и Daniel A. Muruve
- Медицинский факультет, Университет Калгари, Канада
- Кафедра патологии и лабораторной медицины, Университет Калгари, Канада
- Институт хронических заболеваний Снайдера, Университет Калгари, Канада
Введение
Антикоагулянт-ассоциированная нефропатия – форма острого повреждения почек, обусловленная избыточным антикоагулянтным эффектом [1–3]. Хотя этот вид повреждения почек традиционно связывают с применением варфарина [1, 4, 5], продемонстрировано, что с ним может быть связан прием прямых пероральных антикоагулянов (ПОАК) [3].
Диагноз «антикоагулянт-ассоциированная нефропатия» устанавливается на основании данных патогистологического исследования: острого повреждения почечных канальцев, присутствия эритроцитарных цилиндров в канальцах по данным световой микроскопии и отсутствии острой гломерулярной болезни [3]. Интраренальное кровотечение в условиях антикоагулянтной терапии приводит к обструкции канальцев эритроцитами и последующему повреждению почек [1, 3]. Дальнейшее клеточное повреждение, вероятно, обусловлено также токсическим воздействием гема [6].
Уровень общей заболеваемости ПОАК-ассоциированной нефропатией неизвестен, имеется лишь некоторое количество сообщений о клинических случаях [7]. Согласно сообщениям, из всех ПОАК антикоагулянт-ассоциированная нефропатия чаще всего развивается при использовании дабигатрана, прямого ингибитора тромбина [8]. Апиксабан, ингибитор фактора Xa, также связан с антикоагулянт-ассоциированной нефропатией [9]. Все известные случаи дабигатран-ассоциированной нефропатии наблюдались у пациентов с IgA-нефропатией. Это свидетельствует о том, что гломерулярные болезни, в особенности IgA-нефропатия, являются факторами риска дабигатран-ассоциированной нефропатии [7]. В данной статье описан случай дабигатран-ассоциированной нефропатии, подтвержденной результатами биопсии, у пациентки без предшествующей IgA-нефропатии. Данный случай еще больше подтверждает концепцию, согласно которой ПОАК могут индуцировать повреждение почек, сходное с повреждением при использовании варфарина, при отсутствии значимой патологии почек.
Описание клинического случая
Женщина 81 года со множеством сопутствующих заболеваний, из которых большое значение имеет фибрилляция предсердий. Получала антикоагулянтную терапию дабигатраном 150 мг два раза в сутки. Поступила с хроническим повреждением почек в условиях объемной перегрузки. Пациентка начала прием дабигатрана два года назад. В анамнезе имеются следующие заболевания: ишемическая болезнь сердца, хроническая болезнь почек стадии 2A, инсулинзависимый сахарный диабет, артериальная гипертензия, хроническая лимфоцитарная лейкемия, гипотиреоз и лимфоузел в легком. Пациентка принимала следующие препараты: аспирин 81 мг один раз в сутки, амлодипин 5 мг один раз в сутки, лозартан 150 мг один раз в сутки, гидрохлортиазид 37,5 мг один раз в сутки, бисопролол 7,5 мг один раз в сутки, нитроглицерин в форме трансдермального пластыря 0,4 мг с 8:00 до 20:00 ежедневно, метформин 500 мг четыре раза в сутки, инсулин гларгин 70 единиц два раза в сутки, инсулин Хумалог 30–60 единиц в зависимости от уровня гипергликемии три раза в сутки перед едой и левотироксин 125 мкг один раз в сутки. Она не злоупотребляла алкоголем и не курила.
На момент поступления у пациентки в течение недели отмечалась прогрессирующая одышка. Кашель, повышение температуры, озноб и контакты с больными отрицала. При обследовании по системам органов другой значимой патологии обнаружено не было. При поступлении у пациентки отмечалась гипоксия. Сатурация кислорода варьировала от 88% до 92% после оксигенотерапии через назальные канюли со скоростью 6 л/мин. Гемодинамика пациентки была стабильной, повышения температуры не отмечалось, остальные показатели жизненных функций были в пределах нормы. При объективном осмотре венозное давление в яремной вене определялось в 6 см над стернальным углом. Шумов, дополнительных тонов сердца, сердечного толчка или сердечного дрожания не определяется. Определялся отек голеней до коленных суставов с возникновением ямки при надавливании. При аускультации легких дыхание ослабленное с обеих сторон с крупнопузырчатыми влажными хрипами. Других значимых отклонений при проведении физикального обследования обнаружено не было.
При проведении лабораторных исследований на момент поступления был выявлен лейкоцитоз 16,8 (норма: 4–10 X 109/л) (см. таблицу 2), лимфоциты – 11,3 (норма: 0,5–3,3 X 109/л), нейтрофилы – 5,4 (норма: 2,0–9,0 X 109/л) и моноциты – 0,2 (норма: 0,0 – 1,0 X 109/л). Гемоглобин – 118 г/л (норма: 123–157 г/л); тромбоциты – 217 (норма: 130–400 X 109/л) (см. таблицу 2). У пациентки определялся повышенный уровень мозгового натрийуретического пептида (МНП) – 5741 (возрастная норма для лиц в возрасте >75 лет: 300 – 1800 нг/л) (см. таблицу 2). Сывороточный креатинин – 177 мкмоль/л (норма: 40–100 мкмоль/л), рСКФ – 23 мл/мин/1,73 м2 (норма: ≥ 60 мл/мин/1,73 м2). Исходно уровень сывороточного креатинина составлял 91 мкмоль/л, рСКФ – 57 мл/мин/1,73 м2. Уровень электролитов был в пределах нормы (см. таблицу 2). Значение МНО повышено до 1,6 (норма: 0,8–1,1), активированное частичное тромбопластиновое время (АЧТВ) было повышено до 50 секунд (норма: 28–38 секунд) (см. таблицу 2).
Таблица 2
Лабораторные исследования
| Исследование | Результат | Норма | Отклонение от нормы |
| Натрий | 137 ммоль/л | 133 – 145 ммоль/л | |
| Калий | 4,5 ммоль/л | 3,3 – 5,1 ммоль/л | |
| Хлор | 104 ммоль/л | 98 – 111 ммоль/л | |
| Бикарбонаты сыворотки | 19 ммоль/л | 21 – 31 ммоль/л | |
| Креатинин | 177 мкмоль/л | 35 – 100 мкмоль/л | Отклонение от нормы |
| Гемоглобин | 118 г/л | 123 – 157 г/л | |
| Количество лейкоцитов | 16,8 X 109/л | 4 – 10 X 109/л | Отклонение от нормы |
| Тромбоциты | 217 X 109/л | 130 – 400 X 109/л | |
| МНО | 1,6 | ≤ 1,1 | Отклонение от нормы |
| АЧТВ | 50 секунд | 28 – 38 секунд | Отклонение от нормы |
| Антинуклеарные антитела, антитела к двуцепочечной ДНК | Отрицательный | ||
| C-ANCA (цитоплазматические антинейтрофильные цитоплазматические антитела), P-ANCA (перинуклеарные антинейтрофильные цитоплазматические антитела) | Отрицательный | ||
| Антитела к базальной мембране клубочков | Отрицательный | ||
| C3, C4 | В норме | ||
| ВИЧ, серологические исследования на вирусы гепатита | Отрицательный | ||
| IgA сыворотки | 5,85 г/л | 0,60 – 4,20 г/л | Отклонение от нормы |
| Титр анти-стрептолизина O | 449 МЕ/мл | 0–200 | Отклонение от нормы |
| Свободные легкие каппа-цепи иммуноглобулинов | 223 мг/л | 3,3 – 19,4 мг/л | Отклонение от нормы |
| Свободные легкие лямбда-цепи иммуноглобулинов | 70,50 мг/л | 5,71 – 26,3 мг/л | Отклонение от нормы |
| Отношение каппа/лямбда | 3,16 | 0,26 – 1,65 | Отклонение от нормы |
При рентгенографии грудной клетки был выявлен интерстициальный отек легких без смещения контуров сердца и средостения. Минимальный выпот в плевральных полостях. Размер желудочков и систолическая функция при трансторакальной эхокардиографии – в пределах нормы. Фракция выброса составила >60 %. Гипертрофия левого желудочка легкой степени, клапаны – без патологических изменений.
Пациентки был назначен диуретик фуросемид 40 мг в/в два раза в сутки, суммарная доза 80 мг в/в в первые сутки, прием жидкости ограничили до <2 л/сут. Одышка и гипоксемия разрешились в течение 24 часов. Однако уровень сывороточного креатинина продолжал расти. Сывороточный креатинин пациентки вырос с исходного уровня 91 мкмоль/л (норма: 40–100 мкмоль/л) до 177 мкмоль/л в день поступления и достиг 618 мкмоль/л за 7 дней пребывания в стационаре (рисунок 1). Фуросемид отменили на второй день после поступления. В связи с нарастанием уровня креатинина ограничение приема жидкости отменили и вместо этого начали вводить изотонические растворы внутривенно. Это не повлияло на показатели сывороточного креатинина. Пациентка была направлена в нефрологическое отделение для оценки степени тяжести острого повреждения почек. Была начата заместительная почечная терапия через центральный венозный катетер, а также периодический гемодиализ. Прием дабигатрана был прекращен.
 Рисунок 1
Рисунок 1 Динамика уровней сывороточного креатинина.
Исходный уровень сывороточного креатинина составил 91 мкмоль/л (норма: 40–100 мкмоль/л). Он повысился до 177 мкмоль/л в день поступления (стрелка), максимальное значение за время госпитализации составило 800 мкмоль/л. В день выписки уровень сывороточного креатинина составил 554 мкмоль/л (рамка). Пациентка начала прием дабигатрана за два года до этого эпизода.
Общий анализ мочи:
Моча мутная коричневого цвета, макрогематурии нет. При микроскопическом анализе обнаружено >30 измененных эритроцитов в поле зрения, белок> 5 г/л, лейкоциты (лейк.) > 5 в поле зрения, лейкоцитэстераза и нитриты не обнаружены (см. таблицу 1). До настоящей госпитализации гематурии или протеинурии в общем анализе мочи не определялось.
Ультразвуковое исследование почек показало легкое повышение эхогенности паренхимы с двух сторон, предполагающее заболевание почек. Гидронефроза обнаружено не было. Фракционная экскреция натрия (FeNa) составила 1,1%. Титр анти-стрептолизина O составил 449 МЕ/мл (норма: 0–200 МЕ/мл), а IgA сыворотки – 5,85 г/л (норма: 0,60–4,20 г/л) (см. таблицу 2). Уровни компонентов системы комплемента C3 и C4 были в пределах нормы (см. таблицу 2). Уровни антинуклеарных антител, антител к двуцепочечной ДНК, антител к циклическому цитруллиновому пептиду, антител к базальной мембране клубочка, цитоплазматических антинейтрофильных цитоплазматических антител (c-ANCA) и перинуклеарных антинейтрофильных цитоплазматических антител (p-ANCA) были в пределах нормы (см. таблицу 2). Соотношение свободных легких цепей (каппа/лямбда) в сыворотке также было слегка повышено до уровня 3,16 (норма: 0,26–1,65) (см. таблицу 2). Отношение альмумин/креатинин – 15,37 мг/ммоль (норма: <2,29 мг/ммоль). Результаты серологических исследований на ВИЧ и гепатиты были отрицательными.
Таблица 1
Общий анализ мочи
| Исследование | Результат | Норма | Отклонение от нормы |
| Цвет | Коричневый | Отклонение от нормы | |
| Внешний вид | Мутная | Отклонение от нормы | |
| Удельный вес мочи | 1,015 | ≤1,030 | |
| pH | 6,0 | 5,0–8,5 | |
| Лейкоциты | Отрицательный | Отрицательный | |
| Нитриты | Отрицательный | Отрицательный | |
| Белок | ≥5,0 | Отрицательный (г/л) | Отклонение от нормы |
| Глюкоза | 8,3 | Отрицательный | Отклонение от нормы |
| Кетоны | Отрицательный | Отрицательный | |
| Кровь | Макрогематурия | Отрицательный | Отклонение от нормы |
| Лейкоциты | Присутствуют | 0–5 (в поле зрения) | Отклонение от нормы |
| Эритроциты в моче | > 30 | 0–5 (в поле зрения) | Отклонение от нормы |
| Эпителиальные клетки | Присутствуют | (в поле зрения) | |
| Аморфные кристаллы | Присутствуют | (в поле зрения) | |
| Бактерии | Присутствуют | (в поле зрения) | Отклонение от нормы |
| Гиалиновые цилиндры | Присутствуют | (в поле зрения) |
Пациентке была выполнена диагностическая биопсия почек, которая показала большое количество эритроцитарных цилиндров в просвете канальцев, а также повреждение клеток эпителия канальцев по данным световой микроскопии (рисунки 2(a) и 2(b)) при отсутствии признаков острого гломерулонефрита (рисунки 3(a) и 3(b)). Электронная микроскопия показала наличие субэпителиальных «горбовидных» отложений, большинство из которых локализовались в зонах мезангиальной борозды (mesangial notch areas), и были расценены признаком разрешающегося постинфекционного гломерулонефрита (рисунок 4). При проведении исследования с помощью иммунофлуоресцентной микроскопии антитела IgA и IgG обнаружены не были, однако были выявлены компоненты системы комплемента C3 (рисунок 5). Эти результаты больше всего соответствовали диагнозу «антикоагулянт-ассоциированная нефропатия с сопутствующим разрешившимся постинфекционным гломерулонефритом».
 Рисунок 2
Рисунок 2 Патогистологическое исследование почек I. (a) Биопсия почек показывает наличие большого количества эритроцитов (рамка) и эритроцитарных цилиндров (стрелки) (ШИК-реакция, световая микроскопия, увеличение: X200). (b) Биопсия почек показывает острое повреждение канальцев с потерей щеточной каемки, ослаблением и реактивными изменениями канальцевого эпителия. Эритроцитарные цилиндры (стрелки) указывают на выраженные кровоизлияния в канальцах. Отмечается минимальное растяжение мезангия клубочка без признаков пролиферации (ШИК-реакция, световая микроскопия, увеличение: X200).
 Рисунок 3
Рисунок 3Патогистологическое исследование биоптата почек II. (a) При окраске клубочка методом ШИК-реакции (увеличение: X200) обнаружено минимальное расширение мезангия без признаков пролиферации мезангиоцитов и эндотелия капилляров. Хроническое ишемическое повреждение подтверждается также утолщением мембраны боуменовской капсулы (синяя стрелка). Также показаны поврежденные канальцы (черная стрелка) (световая микроскопия). (b) при окраске гематоксилин-эозином (увеличение: X100) обнаружены поврежденные канальцы с эритроцитарными цилиндрами (стрелки). Признаки активного гломерулонефрита отсутствуют.
 Рисунок 4
Рисунок 4Электронная микроскопия биоптата почки. Показаны субэпителиальные электронно-плотные отложения в области мезангиальной борозды (рамка) (электронная микроскопия).
 Рисунок 5
Рисунок 5Иммунофлуоресцентный анализ биоптата почки. Иммунофлуоресцентная микроскопия с целью определения отложений IgA, IgG, легких цепей каппа, легких цепей лямбда, компонентов системы комплемента C3 и C1Q. Присутствуют отложения компонента системы комплементов C3 в следовых количествах. Депозиты IgA, IgG, легких цепей каппа, легких цепей лямбда, компонентов системы комплемента C1Q не визуализируются.
Пациентка находилась в стационаре длительное время. За время госпитализации у пациентки была обнаружена инфекция мочевыводящих путей, вызванная Enterococcus faecium, реагирующая на терапию ванкомицином, а также субсегментарная эмболия легочной артерии, которую лечили нефракционированным гепарином. Функция почек не восстановилась, и пациентке продолжили проведение периодического гемодиализа.
Обсуждение
Антикоагулянт-ассоциированная нефропатия имеет характерные патогистологические признаки: внутриканальцевые кровоизлияния, канальцевые эритроцитарные цилиндры и повреждение эпителия канальцев по данным световой микроскопии без признаков активного гломерулонефрита [2, 3]. Результаты патогистологического исследования пациентки соответствовали вышеописанным типичным нарушениям, что подтверждало диагноз антикоагулянт-ассоциированной нефропатии, вызванной дабигатраном.
Биопсия почек показала острое повреждение канальцев с внутриканальцевыми эритроцитарными цилиндрами на фоне хронической тубулоинтерстициальной болезни от легкой до средней степени тяжести (рисунки 2(a), 2(b), 3(a) и 3(b)). При электронной микроскопии в области мезангиальной борозды были обнаружены электронно-плотные депозиты (рисунок 4). Их наличие свидетельствовало в пользу постинфекционного гломерулонефрита. Однако ни активный гломерулонефрит, ни IgA-нефропатия не наблюдались. Следовательно, резкое ухудшение функции почек не могло быть связано с гломерулонефритом, а скорее было обусловлено повреждением, вызванным внутриканальцевыми кровоизлияниями. Находки в виде нескольких плотных отложений, соответствующих постинфекционному гломерулонефриту, вероятно, были сопутствующим фактором. Впрочем, возможно, это повреждение способствовало развитию кровоизлияний в клубочках, а затем и внутри канальцев. До настоящей госпитализации гематурии или протеинурии в общем анализе мочи не определялось.
При биопсии варфарин- и дабигатран-ассоциированные нефропатии выглядят одинаково [10]. Избыточный антикоагулянтный эффект при использовании обоих препаратов приводит к выраженному канальцевому кровотечению, что, в свою очередь, вызывает обструкцию канальцев эритроцитарными цилиндрами [11]. Следствием этого является повреждение эпителия канальцев, а также токсическое действие гема и клеточное повреждение, связанное с воздействием железа [6, 12, 13]. Варфарин оказывает прямое повреждающее воздействие на клубочки, ингибируя витамин K-зависимые белки, матриксный белок G1a и гены блокировки роста 6 (GAS-6) [14]. GAS-6 вовлечены в подавление кальцификации сосудов, а также миграцию гладкомышечных клеток сосудов и апоптоз [15]. Поскольку это ингибирующее действие блокируется варфарином, прогрессируют апоптоз гладкомышечных клеток сосудов и их кальцификация. [11]. Дабигатран снижает активность тромбина, что, в свою очередь, может подавлять активность активируемого протеазой рецептора 1 (PAR-1) [8, 11]. PAR-1 является рецептором тромбина, сопряженным с G-белком. Он синтезируется на поверхности эндотелиоцитов, участвующих в функции эндотелия, проницаемости сосудов, миграции лейкоцитов и адгезии [10, 16, 17]. Снижение активности рецепторов PAR-1 может приводить к нарушению тонуса эндотелия сосудов, целостности однослойного эндотелия и повреждению клубочкового фильтрационного барьера [16, 17]. Таким образом, варфарин и дабигатран, вероятно, реализуют один и тот же механизм повреждающего воздействия на почки [8, 11]: разрушение клубочкового фильтрационного барьера, внутриканальцевые кровоизлияния и закупорка канальцев эритроцитарными цилиндрами, цитотоксичность, обусловленная воздействием свободных радикалов гема, и, наконец, повреждение клеток канальцевого эпителия [5, 8, 11].
Имеющиеся на сегодняшний день данные по дабигатран-ассоциированной нефропатии позволяют предположить, что IgA-нефропатия может быть предрасполагающим фактором [7]. Это предположение основано на нескольких сообщениях о случаях, в которых у всех пациентов был сопутствующий диагноз «IgA-нефропатия» [7]. У описанной в этом клиническом случае пациентки этот диагноз отсутствовал. Напротив, клиническая картина напоминала варфарин-ассоциированную нефропатию [4]. Варфарин-ассоциированная нефропатия наблюдается у пациентов вне зависимости от сопутствующей хронической болезни почек, хотя она и считается значительным фактором риска [18, 19]. Кроме того, факторами риска являются пожилой возраст, артериальная гипертензия, сахарный диабет, диабетическая нефропатия [18], сердечная недостаточность, а также ишемическая болезнь сердца [18, 20]. С повышенным риском развития варфарин-ассоциированной нефропатии связан прием таких препаратов как аспирин, блокаторы кальциевых каналов, а также ингибиторов АПФ [11, 18]. Таким образом, на основании литературных данных по варфарину [8, 21] можно сделать вывод, что сопутствующее заболевание почек, в описанном случае – хроническая болезнь почек стадии 2a и разрешившийся постинфекционный гломерулонефрит, могли способствовать развитию дабигатран-ассоциированной нефропатии у пациентки. Более того, имеющиеся у описанной пациентки сопутствующие заболевания (артериальная гипертензия, сердечная недостаточность, сахарный диабет, а также ишемическая болезнь сердца), препараты, включая аспирин и амлодипин, в условиях пожилого возраста и длительного приема дабигатрана могли способствовать развитию предрасположенности к ангикоагулянт-ассоциированной нефропатии.
Данные по дабигатран-ассоциированной нефропатии ограничены. Нефропатия, связанная с применением варфарина, напротив, широко изучается с момента обнаружения в 2009 году [1]. Варфарин-ассоциированная нефропатия может ускорять прогрессирование хронической болезни почек [18, 22]. Кроме того, она коррелирует с повышением летальности [20]. Более того, на крысиных моделях было показано, что стадия хронической болезни почек прямо соотносится с риском развития варфарин-ассоциированной нефропатии [23]. Что касается дабигатран-ассоциированной нефропатии, подобных данных по влиянию на летальность и прогрессирование хронической болезни почек пока нет [7]. Чтобы выяснить частоту новых случаев доказанной патогистологическими исследованиями дабигатран-ассоциированной нефропатии, необходимы дальнейшие исследования. Однако, вероятно, эти случаи редки, учитывая, что в клинической практике все чаще применяются ПОАК. Тем не менее, появляется все больше сообщений о случаях, в том числе, в последнее время, связанных с применением апибаксана – ингибитора фактора свертывания Xa [9]. Поскольку ПОАК применяются все чаще, важно определить не только частоту возникновения новых случаев острого повреждения почек, но и потенциальные факторы риска, как независимые, так и дополнительные, а также их влияние на показатели летальности и заболеваемости.
Выводы
Данный клинический случай описывает новое открытие: дабигатран-ассоциированная нефропатия, как и варфарин-ассоциированная, может развиться и без сопутствующей IgA-нефропатии или значимого предшествующего заболевания почек. [3]. Этот факт расширяет круг возможных диагнозов при дифференциальной диагностике острой почечной недостаточности, особенно в случаях, когда велика вероятность почечной этиологии при приеме ПОАК пациентом. Ранняя постановка диагноза и своевременное прекращение приема вызвавших это осложнение препаратов могут предотвратить значимое прогрессирование заболевания почек и необходимость в проведении заместительной почечной терапии. Таким образом, наличие сопутствующих заболеваний может служить дополнительным фактором риска. Направления дальнейших исследований включают в себя подсчет частоты возникновения новых случаев и распространенности описанного заболевания и стратификацию факторов риска, а также исходов, связанных с данным осложнением лекарственной терапии.
Список литературы
- Brodsky S. V., Satoskar A., Chen J., et al. Acute kidney injury during warfarin therapy associated with obstructive tubular red blood cell casts: a report of 9 cases. American Journal of Kidney Diseases. 2009;54(6):1121–1126. doi: 10.1053/j.ajkd.2009.04.024.
- Kalaitzidis R. G., Duni A., Liapis G., et al. Anticoagulant-related nephropathy: a case report and review of the literature of an increasingly recognized entity. International Urology and Nephrology. 2017;49(8):1401–1407. doi: 10.1007/s11255-017-1527-9.
- Wheeler D. S., Giugliano R. P., Rangaswami J. Anticoagulation-related nephropathy. Journal of Thrombosis and Hemostasis. 2016;14(3):461–467. doi: 10.1111/jth.13229.
- Rizk D. V., Warnock D. G. Warfarin-related nephropathy: another newly recognized complication of an old drug. Kidney International. 2011;80(2):131–133. doi: 10.1038/ki.2011.85.
- Ryan M., Ware K., Qamri Z., et al. Warfarin-related nephropathy is the tip of the iceberg: Direct thrombin inhibitor dabigatran induces glomerular hemorrhage with acute kidney injury in rats. Nephrology Dialysis Transplantation . 2014;29(12):2228–2234. doi: 10.1093/ndt/gft380.
- Tracz M. J., Alam J., Nath K. A. Physiology and pathophysiology of heme: implications for kidney disease. Journal of the American Society of Nephrology. 2007;18(2):414–420. doi: 10.1681/ASN.2006080894.
- Escoli R., Santos P., Andrade S., Carvalho F. Dabigatran-related nephropathy in a patient with undiagnosed IgA nephropathy. Case Reports in Nephrology. 2015
- Knauf F., Chaknos C. M., Berns J. S., Perazella M. A. Dabigatran and kidney disease: a bad combination. Clinical Journal of the American Society of Nephrology. 2013;8(9):1591–1597. doi: 10.2215/cjn.01260213.
- Brodsky S. V., Mhaskar N. S., Thiruveedi S., et al. Acute kidney injury aggravated by treatment initiation with apixaban: Another twist of anticoagulant-related nephropathy. Kidney Research and Clinical Practice. 2017;36(4):387–392. doi: 10.23876/j.krcp.2017.36.4.387.
- Kadiyala D., Brewster U. C., Moeckel G. W. American Society of Nephrology Annual Meeting; 2012. Dabigatran induced acute kidney injury.
- Narasimha Krishna V., Warnock D. G., Saxena N., Rizk D. V. Oral anticoagulants and risk of nephropathy. Drug Safety. 2015;38(6):527–533. doi: 10.1007/s40264-015-0290-z.
- Homsi E., Janino P., De Faria J. B. L. Role of caspases on cell death, inflammation, and cell cycle in glycerol-induced acute renal failure. Kidney International. 2006;69(8):1385–1392. doi: 10.1038/sj.ki.5000315.
- Patel R. P., Svistunenko D. A., Darley-Usmar V. M., Symons M. C. R., Wilson M. T. Redox cycling of human methaemoglobin by H2O2 yields persistent ferryl iron and protein based radicals. Free Radical Research. 1996;25(2):117–123. doi: 10.3109/10715769609149916.
- Chang C.-C., Liou H.-H., Wu C.-L., et al. Warfarin slows deterioration of renal function in elderly patients with chronic kidney disease and atrial fibrillation. Clinical Interventions in Aging. 2013;8:523–529.
- Ware K., Brodsky P., Satoskar A. A., et al. Warfarin-related nephropathy modeled by nephron reduction and excessive anticoagulation. Journal of the American Society of Nephrology. 2011;22(10):1856–1862. doi: 10.1681/ASN.2010101110.
- Coughlin S. R. Protease-activated receptors in vascular biology. Thrombosis and Haemostasis. 2001;86(1):298–307. doi: 10.1055/s-0037-1616227.
- Coughlin S. R. Protease-activated receptors in hemostasis, thrombosis and vascular biology. Journal of Thrombosis and Haemostasis. 2005;3(8):1800–1814. doi: 10.1111/j.1538-7836.2005.01377.x.
- Brodsky S. V., Nadasdy T., Rovin B. H., et al. Warfarin-related nephropathy occurs in patients with and without chronic kidney disease and is associated with an increased mortality rate. Kidney International. 2011;80(2):181–189. doi: 10.1038/ki.2011.44.
- Moeckel G. W., Luciano R. L., Brewster U. C. Warfarin-related nephropathy in a patient with mild IgA nephropathy on dabigatran and aspirin. Clinical Kidney Journal. 2013;6(5):507–509. doi: 10.1093/ckj/sft076.
- An J. N., Ahn S. Y., Yoon C. H., et al. The occurrence of warfarin-related nephropathy and effects on renal and patient outcomes in korean patients. PLoS One. 2013;8(4)e57661
- Mendonca S., Gupta D., Valsan A., Tewari R. Warfarin related acute kidney injury: A case report. Indian Journal of Nephrology. 2017;27(1):78–80. doi: 10.4103/0971-4065.177142.
- Cleary C. M., Moreno J. A., Fernández B., et al. Glomerular haematuria, renal interstitial haemorrhage and acute kidney injury. Nephrology Dialysis Transplantation . 2010;25(12):4103–4106. doi: 10.1093/ndt/gfq493.
- Ozcan A., Ware K., Calomeni E., et al. 5/6 nephrectomy as a validated rat model mimicking human warfarin-related nephropathy. American Journal of Nephrology. 2012;35(4):356–364. doi: 10.1159/000337918.





