2014
06 Мая 2021
Christina Wacker, Anna Prkno, Frank M Brunkhorst, Peter Schlattmann (Германия)
Lancet Infect Dis 2013;
dx.doi.org
Резюме
Предпосылка
Прокальцитонин является весьма перспективным маркером для выявления бактериальных инфекций. Мы провели оценку точности и клинической ценности прокальцитонина для диагностики сепсиса у пациентов в критическом состоянии.
Методы
Мы провели поиск в таких базах данных, как Medline, Embase, ISI Web of Knowledge, Cochrane Library, Scopus, BioMed Central и Science Direct с момента создания и до 21 февраля 2012 года, а также списки литера...
Lancet Infect Dis 2013;
dx.doi.org
Резюме
Предпосылка
Прокальцитонин является весьма перспективным маркером для выявления бактериальных инфекций. Мы провели оценку точности и клинической ценности прокальцитонина для диагностики сепсиса у пациентов в критическом состоянии.
Методы
Мы провели поиск в таких базах данных, как Medline, Embase, ISI Web of Knowledge, Cochrane Library, Scopus, BioMed Central и Science Direct с момента создания и до 21 февраля 2012 года, а также списки литера...
Christina Wacker, Anna Prkno, Frank M Brunkhorst, Peter Schlattmann (Германия)
Lancet Infect Dis 2013;
dx.doi.org
Резюме
Предпосылка
Прокальцитонин является весьма перспективным маркером для выявления бактериальных инфекций. Мы провели оценку точности и клинической ценности прокальцитонина для диагностики сепсиса у пациентов в критическом состоянии.
Методы
Мы провели поиск в таких базах данных, как Medline, Embase, ISI Web of Knowledge, Cochrane Library, Scopus, BioMed Central и Science Direct с момента создания и до 21 февраля 2012 года, а также списки литературы идентифицированных первичных исследований. В нашу работу были включены статьи на английском, немецком и французском языках, описывающие исследования прокальцитонина для дифференциации пациентов с септическими состояниями (сепсисом, тяжелым сепсисом или септическим шоком) и пациентов с синдромом системного воспалительного ответа неинфекционного происхождения. Исследования с участием здоровых людей, пациентов без вероятной инфекции и детей младше 28 дней были исключены. Сбор данных по характеристикам пациентов и исследований выполняли два независимых исследователя; расхождения были разрешены коллегиально. Мы рассчитали индивидуальные и объединенные показатели чувствительности и специфичности. Для проверки гетерогенности был использован коэффициент I2, а источник гетерогенности был изучен с помощью метарегрессии.
Результаты
Для нашего исследования было выбрано 3487 сообщений, 30 из которых соответствовали критериям включения и насчитывали 3244 пациента. По результатам двумерного анализа средняя чувствительность составила 0,77 (95% ДИ 0,72 – 0,81), а специфичность – 0,79 (95% ДИ 0,74 – 0,84). Площадь под кривой операционной характеристики диагностического метода составляла 0,85 (95% ДИ 0,81 – 0,88). Исследования имели существенную гетерогенность (Р = 96%, 95% ДИ 94 – 99). Ни одна из исследованных подгрупп — популяция, категория госпитализации, используемый метод анализа, тяжесть заболевания, описание и маскировка эталонного стандарта — не могла объяснить эту гетерогенность.
Интерпретация
Прокальцитонин является полезным биомаркером для ранней диагностики сепсиса у пациентов в критическом состоянии. Однако результаты теста должны быть интерпретированы с осторожностью, в контексте анамнеза заболевания, данных медицинского осмотра и результатов микробиологического исследования.
Введение
Во всем мире сепсис и его последствия по-прежнему являются наиболее распространенной причиной острой заболеваемости и смертности у пациентов с внебольничными и внутрибольничными инфекциями [12] Американская коллегия специалистов в области торакальной медицины и Конференции по достижению консенсуса в области реаниматологии (г. Нортбрук, штат Иллинойс, США; август 1991 г.) определила сепсис как системный воспалительный ответ, вызванный инфекцией [3]. Однако золотого стандарта для подтверждения инфекции не существует. Бактериемию выявляют только у 30% пациентов с сепсисом в зависимости от предшествующего лечения антибиотиками. Кроме того, ранние клинические признаки сепсиса, такие как лихорадка, тахикардия и лейкоцитоз, неспецифичны и перекрываются с признаками синдромов системного воспалительного ответа неинфекционного происхождения, особенно у пациентов, перенесших хирургическое вмешательство. Другие признаки, такие как артериальная гипотония, тромбоцитопения или повышенная концентрация лактата, свидетельствуют о прогрессировании дисфункции органов и о том, что время для назначения жизненно необходимого лечения упущено. Таким образом, задержка в диагностике и лечении сепсиса ведет к повышению смертности, увеличению продолжительности пребывания в стационаре, а также к увеличению затрат [67], что подчеркивает необходимость ранних и надежных диагностических биомаркеров сепсиса.
При сепсисе происходит активация нескольких гуморальных и клеточных систем с последующим высвобождением различных молекул, которые опосредуют ответ макроорганизма на инфекцию. Было изучено несколько потенциальных биомаркеров в кровотоке с точки зрения возможности их использования для диагностики сепсиса, оценки степени его тяжести и определения прогноза. Прокальцитонин – полипептид, состоящий из 116-аминокислот, был назван «чемпионом на текущий момент» для идентификации бактериальных инфекций, поскольку он имеет несколько преимуществ перед другими потенциальными биомаркерами - широкий биологический диапазон, короткий период индукции после бактериального стимула и длительный период полувыведения [9].
Однако только в двух метаанализах исследовали точность диагностики сепсиса в зависимости от уровня прокальцитонина, и в них были получены противоречивые результаты [10, 11]. Как в одном, так и в другом случае имели место ограничения, обусловленные выбранными популяциями, и не были включены гетерогенные популяции пациентов и, что наиболее важно, были предвзятыми за счет выбора золотого стандарта для определения сепсиса. Кроме того, с момента публикации этих метаанализов были проведены новые исследования прокальцитонина, и наше понимание прокальцитонина все еще формируется.
Нами был проведен метаанализ, направленный на изучение возможности использования прокальцитонина для дифференциальной диагностики синдромов сепсиса и системного воспалительного ответа неинфекционного происхождения у пациентов в критическом состоянии с учетом гетерогенности пациентов и влияния отдельных переменных показателей.
Методы
Стратегия поиска и критерии отбора
Мы провели систематический поиск в базах данных Medline (через PubMed), Embase (через OvidSP), ISI Web of Knowledge, Cochrane library, Scopus, BioMed Central и Science Direct для выявлений исследований, в которых проводилась оценка точности диагностики сепсиса на основании концентраций прокальцитонина.
Мы использовали такие медицинские термины для поиска по предметным рубрикам (для базы данных Medline), термины EMTREE (для Embase) и текст (для других) как «прокальцитонин или PCT, сепсис или бактериальная инфекция, синдром системного воспалительного ответа или SIRS». Чтобы уменьшить количество результатов поиска, в базах данных Science Direct, Embase и Scopus мы также использовали поисковые термины «обзор или письмо, редакционная статья, эксперимент на животных, резюме встречи, работа, постерный доклад, метаанализ, сообщение о случае». Мы проводили поиск по базам данных с момента их создания и до 21 февраля 2012 года. Мы также просмотрели список литературы по каждому выявленному первичному исследованию и по предыдущим систематическим обзорам. Исследования были включены, если в них проводилась оценка точности дифференциальной диагностики сепсиса и синдрома системного воспалительного ответа неинфекционного происхождения у пациентов в критическом состоянии в зависимости от концентрации прокальцитонина.
Для включения в нашу работу исследования должны были иметь четко определенный эталонный стандарт для сепсиса, который включал использование определений, установленных Американской коллегией специалистов в области торакальной медицины и Конференцией по достижению консенсуса в области реаниматологии [3] или Немецким сообществом по сепсису [12]. В соответствии с этими определениями наличие инфекции должно было иметь микробиологическое подтверждение или, по крайней мере, быть заподозрено на основании клинической ситуации по наличию одного или более показателей: наличие лейкоцитов в стерильной биологической жидкости организма, наличие перфорации внутренних органов, рентгенологические признаки пневмонии в сочетании с образованием гнойной мокроты и синдром, связанный с высоким риском инфицирования (например, восходящий холангит).
Кроме того, исследования должны были предоставить достаточную информацию для составления таблицы сопряженности признаков 2x2, т.е. были предоставлены ложные и истинные положительные и отрицательные результаты.
Мы включали только публикации, написанные на английском, немецком и французском языках. Эксперименты на животных, обзоры, переписки, сообщения о случаях, экспертные заключения и редакционные статьи были исключены. Мы также исключили все исследования, в которых участвовали здоровые люди, пациенты без вероятной инфекции и дети в возрасте младше 28 дней.
Процедуры
Два исследователя (CW, AP) независимо собирали данные, включая оценку качества, из полученных исследований. Расхождения были устранены в рамках консенсусной встречи или, если соглашение не было достигнуто, были устранены путем передачи третьему исследователю (FMB).
Собранные данные были представлены общими и подробными методологическими характеристиками, характеристиками исследуемой популяции (взрослые или дети), условиями (отделение неотложной помощи, отделение общего профиля или отделение интенсивной терапии), категорией госпитализации (хирургическая или терапевтическая), тяжестью заболевания (сепсис, тяжелый сепсис или септический шок) и описанием используемых методов количественного определения и пограничных значений концентрации прокальцитонина.
Каждый исследователь также фиксировал количество истинных и ложных положительных и отрицательных результатов. При необходимости, для получения дополнительной информации мы связывались с соответствующими авторами. Если после направления напоминания ответа получено не было, исследование исключалось.
Мы провели оценку методологического качества исследований с помощью Контрольного списка вопросов для оценки качества диагностической точности исследований [13]. Для оценки каждого вопроса в контрольном списке в нашем обзоре мы разработали руководящие принципы [14]. Поскольку общая оценка качества является трудоемкой и не должна включаться в метаанализы [15], мы включили только пункт 9 (описание эталонного стандарта) и пункт 11 (систематическая ошибка диагностического обзора) из 14 отдельных пунктов, связанных с качеством, служивших переменными показателями в двухмерной модели со случайными уровнями факторов для проверки их в качестве возможных источников вариации и системных ошибок.
Статистический анализ
Мы составили таблицы истинных положительных, ложноотрицательных, ложноположительных и истинных отрицательных результатов у пациентов с сепсисом и синдромом системного воспалительного ответа. Для вычисления чувствительности, специфичности и соответствующего ДИ мы использовали числовые значения.
Для синтеза данных использовалось точное биномиальное воспроизведение [16] из двухмерной регрессионной модели смешанных эффектов, разработанное van Houwelingen [17, 18] для метаанализа исследований, в которых проводилось лечение, с модификацией для синтеза данных, полученных в диагностических тестах [19? 20]. Эта модель не преобразует парные показатели чувствительности и специфичности отдельных исследований в единый показатель диагностической точности, но сохраняет двумерный характер данных с учетом любой корреляции между ними.
На основе этой модели мы оценили средние логистические показатели чувствительности и специфичности с соответствующей стандартной ошибкой и 95% ДИ, вариабельность логистических показателей чувствительности и специфичности между исследованиями, а также ковариацию между ними. Мы провели обратное преобразование этих величин к исходной шкале площади под кривой операционной характеристики диагностического метода, чтобы получить суммарную чувствительность, специфичность и отношения диагностических шансов. Затем мы использовали полученные логистические оценки чувствительности, специфичности и соответствующих дисперсий для построения иерархической суммарной кривой операционной характеристики диагностического метода для прокальцитонина с суммарными операционными точками для чувствительности и специфичности на кривых и эллипсоидом контура 95%-ной достоверности (двумерный ДИ).
Для оценки гетерогенности мы рассчитали коэффициент I2. Если регистрировалась гетерогенность между исследованиями, то потенциальный источник гетерогенности исследовался с применением метарегрессии. Ковариаты уровня исследования могут использоваться в метарегрессии для объединения результатов нескольких исследований с вниманием к вариациям между исследованиями. Мы использовали специфические для исследования ковариаты, такие как популяция или категория госпитализации. Чтобы изучить систематическую ошибку публикации, мы построили воронкообразные графики эффективного размера выборки в зависимости от логарифмического отношения диагностических шансов и провели регрессионный тест асимметрии [21].
Чтобы оценить согласованность между двумя исследователями для оценки качества методологии, мы рассчитали статистические показатели.
Таблица. Характеристики исследования
Для построения двумерной общей кривой операционной характеристики диагностического метода и расчета статистических показателей мы использовали программу MIDAS модуль 22 для STATA (версия 12). Для выполнения метарегрессии мы использовали программу Proc GLIMMIX в SAS (версия 9.3). Графики были получены с помощью модуля MIDAS и модуля оценки качества диагностических исследований точности для STATA.
Роль источника финансирования
Спонсор исследования не играл никакой роли в планировании исследования, сборе, анализе, интерпретации данных или написании отчета. Соответствующий автор имел полный доступ ко всем данным исследования и нес полную ответственность за принятие решения о публикации.
Результаты
В результате нашего поиска по базам данных было получено 3487 статей. После рассмотрения названий тезисов мы исключили 3321 статью. После обзора полного текста мы исключили еще 136 статей, оставив для включения 30 исследований. Поскольку в одном исследовании исследователи сообщали о диагностической точности отдельно для пациентов терапевтического и хирургического профиля, исследование было разделено на две части; таким образом, мы проанализировали 31 набор данных. Поиск по спискам литературы в выбранных статьях и предыдущих систематических обзорах[10, 11, 23] не выявил никаких более подходящих статей.
Основные характеристики исследования показаны в таблице. В анализ было включено 3244 пациента в критическом состоянии, у 1863 из которых (57%) был сепсис и у 1381 (43%) – синдром системного воспалительного ответа неинфекционного происхождения. В 21 из 30 исследований была описана классификация степени тяжести заболевания (сепсис, тяжелый сепсис или септический шок). Из 1173 пациентов 499 (42%) имели сепсис, 234 (20%) имели тяжелый сепсис и 440 (38%) имели септический шок.
Распространенность сепсиса в исследованиях колебалась от 34% до 88% (в среднем 60%). Только 4 исследования были проведены у пациентов детского возраста, тогда как 27 пациентов, включенных в исследование, были взрослыми (таблица). Очаги инфекции (например, легкие, брюшная полость, кровеносная система, мочевыводящие пути) были разными. Источник инфекции (вне- или внутрибольничный) также различался в разных исследованиях. Большинство исследований проводилось в отделениях интенсивной терапии, четыре из них – в детском отделении интенсивной терапии; большинство исследований (20 из 30) проводилось в Европе (таблица). Пограничные значения концентрации прокальцитонина существенно различалась между исследованиями (медиана 1,1 нг/мл, межквартильный диапазон (МКД) 0,5–2,0).
В большинстве исследований (17 из 30) для диагностики сепсиса использовался ручной метод количественного определения прокальцитонина (таблица). Приведены характеристики метода количественного определения, методологическое качество включенных исследований, согласно контрольному списку вопросов для оценки качества диагностической точности исследования [13], как проводилась оценка исследований по каждому пункту и как эти пункты были оценены. Мы пропустили пункт 12 из контрольного списка вопросов (клинические данные), поскольку изучаемый диагностический тест полностью автоматизирован и дополнительные клинические данные для интерпретации результатов не требуются.
Надежность рейтинговых оценок по части качества составляла 0,59 (p <0,0001). Общее методологическое качество было средним. Ни одно из исследований не соответствовало всем пунктам, но все исследования соответствовали, по крайней мере, четырем пунктам. 22 исследования (73%) соответствовали, по крайней мере, 50% пунктам [24, 26-28, 30-36, 39, 41, 43-45, 47-52].
Все исследования соответствовали пунктам 3 (эталонный стандарт), 5 (частичная систематическая ошибка верификации), 6 (системная ошибка дифференциальной верификации) и 14 (выбывания). Отчеты о систематической ошибке анализа результатов испытаний (пункт 10) и неинтерпретируемых результатов (пункт 13) были неудовлетворительными. Мы выявили систематическую ошибку публикации с помощью регрессионного критерия асимметрии Дикса (t=4,12; p <0,0005).
Объединенная чувствительность составляла 0,77 (95% ДИ 0,72-0,81), а объединенная специфичность составляла 0,79 (95% ДИ 0,74-0,84).
Площадь под кривой операционной характеристики диагностического метода составляла 0,85 (95% ДИ 0,81-0,88; рисунок 1). Между исследованиями существует значимая гетерогенность (в целом, I2 для двумерной модели 96%, 95% ДИ 94—99). Мы не зарегистрировали доказательств порогового эффекта (проверено с использованием модуля STATA MIDAS). Доля гетерогенности, вероятно, обусловленная различными пограничными значениями концентрации, была небольшой (0,05). Для выявления источника гетерогенности был проведен метарегрессионный анализ.
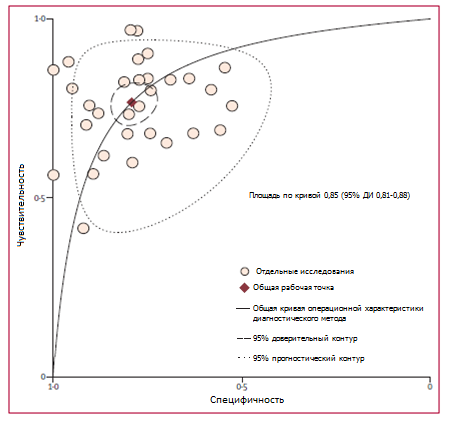 Рисунок 1. Общая кривая операционной характеристики диагностического метода
Рисунок 1. Общая кривая операционной характеристики диагностического метода
Также показан 95% доверительный контур и 95% прогностический контур.
Чтобы сравнить пациентов терапевтического и хирургического профиля, мы провели стратифицированный двумерный регрессионный анализ. Мы получили данные из 13 исследований (в девяти были представлены данные пациентов терапевтического профиля, в четырех исследованиях - данные пациентов хирургического профиля). Диагностическая точность у пациентов хирургического профиля была выше, чем у пациентов терапевтического профиля, что было оценено по площади под общей кривой операционной характеристики диагностического метода (0,83 [95% ДИ 0,80-0,86] в сравнении с 0,79 [0,75-0,83]; уровень значимости не определяли). Мы также сравнивали взрослых пациентов и пациентов детского возраста (0,85 [0,82–0,88] в сравнении с 0,85 [0,81–0,88]; уровень значимости не определяли). Анализ других ковариат не дал значимых результатов (данные не представлены). Таким образом, гетерогенность невозможно объяснить с помощью метарегрессионного анализа.
Обсуждение результатов
Прокальцитонин позволяет эффективно отличать сепсис и синдром системного воспалительного ответа неинфекционного происхождения. Ранее в двух метаанализах была изучена диагностическая точность прокальцитонина у пациентов в критических состояниях, и полученные результаты оказались противоречивыми [10, 11].
В метаанализе 2006 года, включая исследования, опубликованные в период с апреля 1996 года по октябрь 2004 года, Uzzan и соавт. [11] сообщили, что общая кривая операционной характеристики диагностического метода определения прокальцитонина для идентификации сепсиса была лучше, чем у С-реактивного белка. Однако исследователи ограничили популяцию пациентами хирургического и травматологического профиля. Соответственно, сделать выводы по другим категориям пациентов, помимо хирургических, нельзя. Кроме того, исследователи не проводили оценку гетерогенности пациентов в различных условиях с разными очагами инфекции или по другим ковариатам, специфичным для исследования.
В метаанализе 2007 года, который включал 18 исследований, опубликованных в период с апреля 1996 года по ноябрь 2005 года, Tang и соавт. [10] сделали вывод, что прокальцитонин не позволяет отличить сепсис и синдром системного воспалительного ответа. Диагностическая точность определения прокальцитонина была низкой; средняя чувствительность и специфичность составляли по 71% (95% 67-76) и площадь под общей кривой операционной характеристики диагностического метода составляла 0,78 (95% ДИ 0,73-83). Однако полученные ими результаты были значительно искажены за счет используемых критериев отбора. Во-первых, были исключены исследования, в которых очаг инфекции был типичным для сепсиса, например, абдоминальный сепсис, панкреатит или менингит. Во-вторых, были исключены исследования по оценке использования прокальцитонина для диагностики септического шока. Поскольку прогрессирование сепсиса до септического шока сопровождается повышением концентрации прокальцитонина [1], исключение пациентов с септическим шоком могло привести к снижению общей оценки диагностической точности. Чтобы предотвратить систематическую ошибку, мы включили все подходящие исследования, в которых проводилось изучение возможности использования прокальцитонина для диагностики состояний в диапазоне от сепсиса до тяжелого сепсиса. В-третьих, они включали исследования, в которых не проводили оценку состояния пациентов без синдрома системного воспалительного ответа или пациентов, не находившихся в критическом состоянии, что может привести к недооценке точности диагностики.
Соответственно, 23 исследования, включенные в предыдущий метаанализ [10, 11], были исключены из нашего систематического обзора, потому что 13 из них включали контрольные группы здоровых добровольцев или пациентов, у которых не было синдрома системного воспалительного ответа [54-66], и в семи из них не было дано четких определений целевого состояния или они включали пациентов, у которых была инфекция без синдрома системного воспалительного ответа, таким образом, эти исследования не соответствовали нашим критериям отбора [54, 64-60]. Кроме того, в четырех исследованиях было недостаточно информации для построения таблицы сопряженности признаков 2x2 [70-73]. В одном исследовании изучали прогностическое значение прокальцитонина для концентраций фактора некроза опухоли α и интерлейкина 6. В другом исследовании было проведено несколько измерений у нескольких пациентов [75], и в одном исследовании изучалось прогностическое значение прокальцитонина для развития инфекции после кардиологических операций [76].
Кроме того, метаанализ Tang и соавт. [10] имеет существенные недостатки в количественном анализе данных. В нем пары чувствительность-специфичность объединены в один показатель диагностической точности. Таким образом, важная информация отсутствует. Для сохранения двухмерности использовалась двухмерная регрессионная модель смешанных эффектов.
Наш метаанализ имеет несколько ограничений. Во-первых, мы обнаружили существенную гетерогенность между исследованиями, но ни одна из характеристик исследования не была причиной большей части этой гетерогенности. Исследования имеют несколько различий, например, методологическим качеством, клиническим спектром пациентов, категорией госпитализации, используемым методом количественного определения прокальцитонина. Таким образом, гетерогенности, вероятно, способствуют другие неучтенные различия между исследованиями. Использование более однородной популяции решило бы эту проблему, но вызвало бы системную ошибку, связанную с отбором.
Во-вторых, надежный тест для диагностики инфекции все еще отсутствует, так что обсервационные исследования подвержены систематической ошибке за счет выбора золотого стандарта. Согласно нашим критериям включения, наличие инфекции должно было иметь микробиологическое подтверждение или, как минимум, подозреваться клинически. Все включенные исследования соответствовали этому требованию, но в большинстве из них не были предоставлены достаточно подробные данные о том, как подтверждалась инфекция. Тем не менее, в зависимости от ранее проводимой антибиотикотерапии, бактериемия развивается примерно у 30% пациентов с сепсисом [4, 5]. Кроме того, отсутствие стандартизации клинических и рентгенологических данных может стать причиной вариабельности субъективной экспертной оценки, которая повлечет за собой ложноотрицательные или ложноположительные заключения относительно медицинского состояния пациента. Мы включали только те исследования, в которых был хорошо определен эталонный стандарт сепсиса. Тем не менее, мы не можем точно знать, все ли пациенты с инфекцией были определены таким образом.
В-третьих, в некоторых исследованиях интерпретация результатов была описана недостаточно хорошо, особенно в отношении неинтерпретируемых результатов и систематической ошибки анализа результатов исследований. Чтобы минимизировать итоговую систематическую ошибку и обеспечить большую однородность, исследователи должны были использовать Контрольный список вопросов стандартов описания диагностической точности [78], а также учитывать возможность использования контрольного списка вопросов по оценке исследований диагностической точности [13].
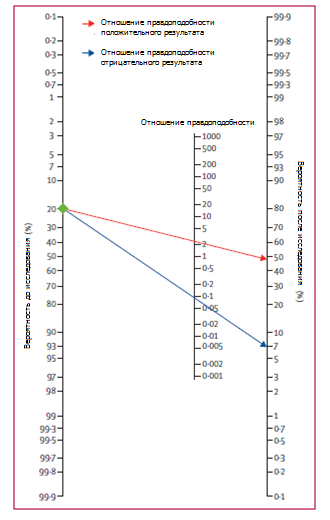 Рисунок 2. Номограмма Фагана для теста на прокальцитонин при диагностике сепсиса
Рисунок 2. Номограмма Фагана для теста на прокальцитонин при диагностике сепсиса
В-четвертых, мы обнаружили систематическую ошибку публикации. Исследования с желаемыми результатами публиковались с большей вероятностью, что может привести к переоценке общей диагностической точности. Чтобы решить эту проблему, мы еще раз провели поиск дополнительных исследований по базам данных и спискам литературы первичных исследований, но не смогли выявить дополнительных значимых статей. Наконец, мы включали только исследования, описанные на немецком, английском или французском языке, что могло повлиять на наши выводы.
Пограничные значения, используемые в различных исследованиях, чтобы отличать пациентов с сепсисом от пациентов, у которых не было сепсиса, существенно отличались. В некоторых исследованиях были использованы пограничные значения, которые приводили к наиболее благоприятным результатам оценки диагностической точности. В других исследованиях чувствительность и специфичность были даны с разными пороговыми значениями. Сложность состоит в том, что пограничные значения впоследствии не были валидированы. Значения диагностической точности отрицательно коррелировали друг с другом. Изменить пограничные значения означает изменить чувствительность за счет специфичности или наоборот. Ложноотрицательные результаты, приводящие к отказу от лечения, могут привести к летальному исходу при сепсисе [6]. Однако для предотвращения развития антибиотикорезистентности, увеличения побочных эффектов и стоимости, необходимо правильно определять пациентов в критических состояниях без бактериальной инфекции. Таким образом, необходимо рациональное пограничное значение. Мы рекомендуем различные этапы тестирования диагностической точности. Во-первых, исследователи должны изучить валидность прокальцитонина в выбранной группе пациентов, чтобы выбрать рациональное пограничное значение. Во-вторых, чтобы установить диагностическую ценность в повседневной клинической практике, установленное пограничное значение должно быть подтверждено в диагностическом контролируемом исследовании.
Наиболее важной особенностью биомаркера является его способность влиять на процесс принятия клинического решения. В последние годы было определено, что у пациентов с инфекциями нижних дыхательных путей пограничные значения находились в диапазоне от 0,1 до 0,5 нг/мл [79]. Наш метаанализ предоставляет важную информацию для пациентов в критических состояниях, для которых принятие диагностических решений имеет первостепенное значение. Медиана пограничного значения во включенных в анализ исследованиях составила 1,1 нг/мл (МКД 0,5-2,0). Отсутствие эффекта клинического порогового значения говорит о том, что пограничное значение от 1,0 до 2,0 нг/мл полезно для отделения пациентов с сепсисом от пациентов с другими воспалительными процессами, в соответствии с рекомендациями [80].
Отношения правдоподобия и вероятности после исследования также актуальны для клиницистов. Они дают информацию о вероятности того, что пациент с положительным или отрицательным результатом действительно имеет сепсис или нет. В нашем исследовании как отношение правдоподобия, так и вероятность после исследования были умеренными (рисунок 2). Отношение правдоподобия положительного результата, равное 4, означает, что у человека с заболеванием в четыре раза больше вероятность получения положительного результата теста, чем у здорового человека. Учитывая вероятность до исследования, равную 20%, после исследования вероятность получения положительного результата составляет 48% (рисунок 2). Аналогично, отношение правдоподобия отрицательного результата, равное 0,29, уменьшает вероятность после исследования получить отрицательный результат до 7%. Однако эти коэффициенты правдоподобия рассчитываются на основе дихотомированных данных. Результат теста на прокальцитонин может быть либо положительным, либо отрицательным. Недостатком формирования дихотомических данных является то, что утрачивается полезная информация [81]. Поскольку концентрация прокальцитонина повышается по мере прогрессирования тяжести заболевания [56], у пациентов с высокой концентрацией прокальцитонина вероятность развития сепсиса выше, чем у пациентов с низкой концентрацией. Чтобы получить более точную информацию о надежности теста, мы предлагаем рассчитать коэффициенты правдоподобия на основе нескольких пограничных значений.
Как показывают наши результаты, прокальцитонин не является совершенным маркером для диагностики сепсиса, но идеальный маркер все-таки существует. Сепсис – это патофизиологический процесс, а не определенный синдром, и он слишком сложен, чтобы его можно было описать одним параметром. Тем не менее, прокальцитонин служит одним из наиболее многообещающих показателей. Были изучены некоторые другие медиаторы и молекулы реакции макроорганизма на инфекцию – С-реактивный белок, растворимый TREM1, интерлейкин 6, интерлейкин 8 и растворимый PLAUR – но каких-либо выдающихся результатов получено не было [23, 35, 40, 82].
В заключение следует отметить, что прокальцитонин является полезным маркером для диагностики сепсиса у пациентов в критических состояниях. Однако он не может быть рекомендован как единственный доказательный тест для диагностики сепсиса; напротив, его следует интерпретировать с учетом подробных анамнестических данных, результатов физического обследования и, если возможно, микробиологического исследования. Кроме того, рекомендуется проводить повторную оценку в течение заболевания.
Список литературы
Lancet Infect Dis 2013;
dx.doi.org
Резюме
Предпосылка
Прокальцитонин является весьма перспективным маркером для выявления бактериальных инфекций. Мы провели оценку точности и клинической ценности прокальцитонина для диагностики сепсиса у пациентов в критическом состоянии.
Методы
Мы провели поиск в таких базах данных, как Medline, Embase, ISI Web of Knowledge, Cochrane Library, Scopus, BioMed Central и Science Direct с момента создания и до 21 февраля 2012 года, а также списки литературы идентифицированных первичных исследований. В нашу работу были включены статьи на английском, немецком и французском языках, описывающие исследования прокальцитонина для дифференциации пациентов с септическими состояниями (сепсисом, тяжелым сепсисом или септическим шоком) и пациентов с синдромом системного воспалительного ответа неинфекционного происхождения. Исследования с участием здоровых людей, пациентов без вероятной инфекции и детей младше 28 дней были исключены. Сбор данных по характеристикам пациентов и исследований выполняли два независимых исследователя; расхождения были разрешены коллегиально. Мы рассчитали индивидуальные и объединенные показатели чувствительности и специфичности. Для проверки гетерогенности был использован коэффициент I2, а источник гетерогенности был изучен с помощью метарегрессии.
Результаты
Для нашего исследования было выбрано 3487 сообщений, 30 из которых соответствовали критериям включения и насчитывали 3244 пациента. По результатам двумерного анализа средняя чувствительность составила 0,77 (95% ДИ 0,72 – 0,81), а специфичность – 0,79 (95% ДИ 0,74 – 0,84). Площадь под кривой операционной характеристики диагностического метода составляла 0,85 (95% ДИ 0,81 – 0,88). Исследования имели существенную гетерогенность (Р = 96%, 95% ДИ 94 – 99). Ни одна из исследованных подгрупп — популяция, категория госпитализации, используемый метод анализа, тяжесть заболевания, описание и маскировка эталонного стандарта — не могла объяснить эту гетерогенность.
Интерпретация
Прокальцитонин является полезным биомаркером для ранней диагностики сепсиса у пациентов в критическом состоянии. Однако результаты теста должны быть интерпретированы с осторожностью, в контексте анамнеза заболевания, данных медицинского осмотра и результатов микробиологического исследования.
Введение
Во всем мире сепсис и его последствия по-прежнему являются наиболее распространенной причиной острой заболеваемости и смертности у пациентов с внебольничными и внутрибольничными инфекциями [12] Американская коллегия специалистов в области торакальной медицины и Конференции по достижению консенсуса в области реаниматологии (г. Нортбрук, штат Иллинойс, США; август 1991 г.) определила сепсис как системный воспалительный ответ, вызванный инфекцией [3]. Однако золотого стандарта для подтверждения инфекции не существует. Бактериемию выявляют только у 30% пациентов с сепсисом в зависимости от предшествующего лечения антибиотиками. Кроме того, ранние клинические признаки сепсиса, такие как лихорадка, тахикардия и лейкоцитоз, неспецифичны и перекрываются с признаками синдромов системного воспалительного ответа неинфекционного происхождения, особенно у пациентов, перенесших хирургическое вмешательство. Другие признаки, такие как артериальная гипотония, тромбоцитопения или повышенная концентрация лактата, свидетельствуют о прогрессировании дисфункции органов и о том, что время для назначения жизненно необходимого лечения упущено. Таким образом, задержка в диагностике и лечении сепсиса ведет к повышению смертности, увеличению продолжительности пребывания в стационаре, а также к увеличению затрат [67], что подчеркивает необходимость ранних и надежных диагностических биомаркеров сепсиса.
При сепсисе происходит активация нескольких гуморальных и клеточных систем с последующим высвобождением различных молекул, которые опосредуют ответ макроорганизма на инфекцию. Было изучено несколько потенциальных биомаркеров в кровотоке с точки зрения возможности их использования для диагностики сепсиса, оценки степени его тяжести и определения прогноза. Прокальцитонин – полипептид, состоящий из 116-аминокислот, был назван «чемпионом на текущий момент» для идентификации бактериальных инфекций, поскольку он имеет несколько преимуществ перед другими потенциальными биомаркерами - широкий биологический диапазон, короткий период индукции после бактериального стимула и длительный период полувыведения [9].
Однако только в двух метаанализах исследовали точность диагностики сепсиса в зависимости от уровня прокальцитонина, и в них были получены противоречивые результаты [10, 11]. Как в одном, так и в другом случае имели место ограничения, обусловленные выбранными популяциями, и не были включены гетерогенные популяции пациентов и, что наиболее важно, были предвзятыми за счет выбора золотого стандарта для определения сепсиса. Кроме того, с момента публикации этих метаанализов были проведены новые исследования прокальцитонина, и наше понимание прокальцитонина все еще формируется.
Нами был проведен метаанализ, направленный на изучение возможности использования прокальцитонина для дифференциальной диагностики синдромов сепсиса и системного воспалительного ответа неинфекционного происхождения у пациентов в критическом состоянии с учетом гетерогенности пациентов и влияния отдельных переменных показателей.
Методы
Стратегия поиска и критерии отбора
Мы провели систематический поиск в базах данных Medline (через PubMed), Embase (через OvidSP), ISI Web of Knowledge, Cochrane library, Scopus, BioMed Central и Science Direct для выявлений исследований, в которых проводилась оценка точности диагностики сепсиса на основании концентраций прокальцитонина.
Мы использовали такие медицинские термины для поиска по предметным рубрикам (для базы данных Medline), термины EMTREE (для Embase) и текст (для других) как «прокальцитонин или PCT, сепсис или бактериальная инфекция, синдром системного воспалительного ответа или SIRS». Чтобы уменьшить количество результатов поиска, в базах данных Science Direct, Embase и Scopus мы также использовали поисковые термины «обзор или письмо, редакционная статья, эксперимент на животных, резюме встречи, работа, постерный доклад, метаанализ, сообщение о случае». Мы проводили поиск по базам данных с момента их создания и до 21 февраля 2012 года. Мы также просмотрели список литературы по каждому выявленному первичному исследованию и по предыдущим систематическим обзорам. Исследования были включены, если в них проводилась оценка точности дифференциальной диагностики сепсиса и синдрома системного воспалительного ответа неинфекционного происхождения у пациентов в критическом состоянии в зависимости от концентрации прокальцитонина.
Для включения в нашу работу исследования должны были иметь четко определенный эталонный стандарт для сепсиса, который включал использование определений, установленных Американской коллегией специалистов в области торакальной медицины и Конференцией по достижению консенсуса в области реаниматологии [3] или Немецким сообществом по сепсису [12]. В соответствии с этими определениями наличие инфекции должно было иметь микробиологическое подтверждение или, по крайней мере, быть заподозрено на основании клинической ситуации по наличию одного или более показателей: наличие лейкоцитов в стерильной биологической жидкости организма, наличие перфорации внутренних органов, рентгенологические признаки пневмонии в сочетании с образованием гнойной мокроты и синдром, связанный с высоким риском инфицирования (например, восходящий холангит).
Кроме того, исследования должны были предоставить достаточную информацию для составления таблицы сопряженности признаков 2x2, т.е. были предоставлены ложные и истинные положительные и отрицательные результаты.
Мы включали только публикации, написанные на английском, немецком и французском языках. Эксперименты на животных, обзоры, переписки, сообщения о случаях, экспертные заключения и редакционные статьи были исключены. Мы также исключили все исследования, в которых участвовали здоровые люди, пациенты без вероятной инфекции и дети в возрасте младше 28 дней.
Процедуры
Два исследователя (CW, AP) независимо собирали данные, включая оценку качества, из полученных исследований. Расхождения были устранены в рамках консенсусной встречи или, если соглашение не было достигнуто, были устранены путем передачи третьему исследователю (FMB).
Собранные данные были представлены общими и подробными методологическими характеристиками, характеристиками исследуемой популяции (взрослые или дети), условиями (отделение неотложной помощи, отделение общего профиля или отделение интенсивной терапии), категорией госпитализации (хирургическая или терапевтическая), тяжестью заболевания (сепсис, тяжелый сепсис или септический шок) и описанием используемых методов количественного определения и пограничных значений концентрации прокальцитонина.
Каждый исследователь также фиксировал количество истинных и ложных положительных и отрицательных результатов. При необходимости, для получения дополнительной информации мы связывались с соответствующими авторами. Если после направления напоминания ответа получено не было, исследование исключалось.
Мы провели оценку методологического качества исследований с помощью Контрольного списка вопросов для оценки качества диагностической точности исследований [13]. Для оценки каждого вопроса в контрольном списке в нашем обзоре мы разработали руководящие принципы [14]. Поскольку общая оценка качества является трудоемкой и не должна включаться в метаанализы [15], мы включили только пункт 9 (описание эталонного стандарта) и пункт 11 (систематическая ошибка диагностического обзора) из 14 отдельных пунктов, связанных с качеством, служивших переменными показателями в двухмерной модели со случайными уровнями факторов для проверки их в качестве возможных источников вариации и системных ошибок.
Статистический анализ
Мы составили таблицы истинных положительных, ложноотрицательных, ложноположительных и истинных отрицательных результатов у пациентов с сепсисом и синдромом системного воспалительного ответа. Для вычисления чувствительности, специфичности и соответствующего ДИ мы использовали числовые значения.
Для синтеза данных использовалось точное биномиальное воспроизведение [16] из двухмерной регрессионной модели смешанных эффектов, разработанное van Houwelingen [17, 18] для метаанализа исследований, в которых проводилось лечение, с модификацией для синтеза данных, полученных в диагностических тестах [19? 20]. Эта модель не преобразует парные показатели чувствительности и специфичности отдельных исследований в единый показатель диагностической точности, но сохраняет двумерный характер данных с учетом любой корреляции между ними.
На основе этой модели мы оценили средние логистические показатели чувствительности и специфичности с соответствующей стандартной ошибкой и 95% ДИ, вариабельность логистических показателей чувствительности и специфичности между исследованиями, а также ковариацию между ними. Мы провели обратное преобразование этих величин к исходной шкале площади под кривой операционной характеристики диагностического метода, чтобы получить суммарную чувствительность, специфичность и отношения диагностических шансов. Затем мы использовали полученные логистические оценки чувствительности, специфичности и соответствующих дисперсий для построения иерархической суммарной кривой операционной характеристики диагностического метода для прокальцитонина с суммарными операционными точками для чувствительности и специфичности на кривых и эллипсоидом контура 95%-ной достоверности (двумерный ДИ).
Для оценки гетерогенности мы рассчитали коэффициент I2. Если регистрировалась гетерогенность между исследованиями, то потенциальный источник гетерогенности исследовался с применением метарегрессии. Ковариаты уровня исследования могут использоваться в метарегрессии для объединения результатов нескольких исследований с вниманием к вариациям между исследованиями. Мы использовали специфические для исследования ковариаты, такие как популяция или категория госпитализации. Чтобы изучить систематическую ошибку публикации, мы построили воронкообразные графики эффективного размера выборки в зависимости от логарифмического отношения диагностических шансов и провели регрессионный тест асимметрии [21].
Чтобы оценить согласованность между двумя исследователями для оценки качества методологии, мы рассчитали статистические показатели.
Таблица. Характеристики исследования
Для построения двумерной общей кривой операционной характеристики диагностического метода и расчета статистических показателей мы использовали программу MIDAS модуль 22 для STATA (версия 12). Для выполнения метарегрессии мы использовали программу Proc GLIMMIX в SAS (версия 9.3). Графики были получены с помощью модуля MIDAS и модуля оценки качества диагностических исследований точности для STATA.
Роль источника финансирования
Спонсор исследования не играл никакой роли в планировании исследования, сборе, анализе, интерпретации данных или написании отчета. Соответствующий автор имел полный доступ ко всем данным исследования и нес полную ответственность за принятие решения о публикации.
Результаты
В результате нашего поиска по базам данных было получено 3487 статей. После рассмотрения названий тезисов мы исключили 3321 статью. После обзора полного текста мы исключили еще 136 статей, оставив для включения 30 исследований. Поскольку в одном исследовании исследователи сообщали о диагностической точности отдельно для пациентов терапевтического и хирургического профиля, исследование было разделено на две части; таким образом, мы проанализировали 31 набор данных. Поиск по спискам литературы в выбранных статьях и предыдущих систематических обзорах[10, 11, 23] не выявил никаких более подходящих статей.
Основные характеристики исследования показаны в таблице. В анализ было включено 3244 пациента в критическом состоянии, у 1863 из которых (57%) был сепсис и у 1381 (43%) – синдром системного воспалительного ответа неинфекционного происхождения. В 21 из 30 исследований была описана классификация степени тяжести заболевания (сепсис, тяжелый сепсис или септический шок). Из 1173 пациентов 499 (42%) имели сепсис, 234 (20%) имели тяжелый сепсис и 440 (38%) имели септический шок.
Распространенность сепсиса в исследованиях колебалась от 34% до 88% (в среднем 60%). Только 4 исследования были проведены у пациентов детского возраста, тогда как 27 пациентов, включенных в исследование, были взрослыми (таблица). Очаги инфекции (например, легкие, брюшная полость, кровеносная система, мочевыводящие пути) были разными. Источник инфекции (вне- или внутрибольничный) также различался в разных исследованиях. Большинство исследований проводилось в отделениях интенсивной терапии, четыре из них – в детском отделении интенсивной терапии; большинство исследований (20 из 30) проводилось в Европе (таблица). Пограничные значения концентрации прокальцитонина существенно различалась между исследованиями (медиана 1,1 нг/мл, межквартильный диапазон (МКД) 0,5–2,0).
В большинстве исследований (17 из 30) для диагностики сепсиса использовался ручной метод количественного определения прокальцитонина (таблица). Приведены характеристики метода количественного определения, методологическое качество включенных исследований, согласно контрольному списку вопросов для оценки качества диагностической точности исследования [13], как проводилась оценка исследований по каждому пункту и как эти пункты были оценены. Мы пропустили пункт 12 из контрольного списка вопросов (клинические данные), поскольку изучаемый диагностический тест полностью автоматизирован и дополнительные клинические данные для интерпретации результатов не требуются.
Надежность рейтинговых оценок по части качества составляла 0,59 (p <0,0001). Общее методологическое качество было средним. Ни одно из исследований не соответствовало всем пунктам, но все исследования соответствовали, по крайней мере, четырем пунктам. 22 исследования (73%) соответствовали, по крайней мере, 50% пунктам [24, 26-28, 30-36, 39, 41, 43-45, 47-52].
Все исследования соответствовали пунктам 3 (эталонный стандарт), 5 (частичная систематическая ошибка верификации), 6 (системная ошибка дифференциальной верификации) и 14 (выбывания). Отчеты о систематической ошибке анализа результатов испытаний (пункт 10) и неинтерпретируемых результатов (пункт 13) были неудовлетворительными. Мы выявили систематическую ошибку публикации с помощью регрессионного критерия асимметрии Дикса (t=4,12; p <0,0005).
Объединенная чувствительность составляла 0,77 (95% ДИ 0,72-0,81), а объединенная специфичность составляла 0,79 (95% ДИ 0,74-0,84).
Площадь под кривой операционной характеристики диагностического метода составляла 0,85 (95% ДИ 0,81-0,88; рисунок 1). Между исследованиями существует значимая гетерогенность (в целом, I2 для двумерной модели 96%, 95% ДИ 94—99). Мы не зарегистрировали доказательств порогового эффекта (проверено с использованием модуля STATA MIDAS). Доля гетерогенности, вероятно, обусловленная различными пограничными значениями концентрации, была небольшой (0,05). Для выявления источника гетерогенности был проведен метарегрессионный анализ.
 Рисунок 1. Общая кривая операционной характеристики диагностического метода
Рисунок 1. Общая кривая операционной характеристики диагностического методаТакже показан 95% доверительный контур и 95% прогностический контур.
Чтобы сравнить пациентов терапевтического и хирургического профиля, мы провели стратифицированный двумерный регрессионный анализ. Мы получили данные из 13 исследований (в девяти были представлены данные пациентов терапевтического профиля, в четырех исследованиях - данные пациентов хирургического профиля). Диагностическая точность у пациентов хирургического профиля была выше, чем у пациентов терапевтического профиля, что было оценено по площади под общей кривой операционной характеристики диагностического метода (0,83 [95% ДИ 0,80-0,86] в сравнении с 0,79 [0,75-0,83]; уровень значимости не определяли). Мы также сравнивали взрослых пациентов и пациентов детского возраста (0,85 [0,82–0,88] в сравнении с 0,85 [0,81–0,88]; уровень значимости не определяли). Анализ других ковариат не дал значимых результатов (данные не представлены). Таким образом, гетерогенность невозможно объяснить с помощью метарегрессионного анализа.
Обсуждение результатов
Прокальцитонин позволяет эффективно отличать сепсис и синдром системного воспалительного ответа неинфекционного происхождения. Ранее в двух метаанализах была изучена диагностическая точность прокальцитонина у пациентов в критических состояниях, и полученные результаты оказались противоречивыми [10, 11].
В метаанализе 2006 года, включая исследования, опубликованные в период с апреля 1996 года по октябрь 2004 года, Uzzan и соавт. [11] сообщили, что общая кривая операционной характеристики диагностического метода определения прокальцитонина для идентификации сепсиса была лучше, чем у С-реактивного белка. Однако исследователи ограничили популяцию пациентами хирургического и травматологического профиля. Соответственно, сделать выводы по другим категориям пациентов, помимо хирургических, нельзя. Кроме того, исследователи не проводили оценку гетерогенности пациентов в различных условиях с разными очагами инфекции или по другим ковариатам, специфичным для исследования.
В метаанализе 2007 года, который включал 18 исследований, опубликованных в период с апреля 1996 года по ноябрь 2005 года, Tang и соавт. [10] сделали вывод, что прокальцитонин не позволяет отличить сепсис и синдром системного воспалительного ответа. Диагностическая точность определения прокальцитонина была низкой; средняя чувствительность и специфичность составляли по 71% (95% 67-76) и площадь под общей кривой операционной характеристики диагностического метода составляла 0,78 (95% ДИ 0,73-83). Однако полученные ими результаты были значительно искажены за счет используемых критериев отбора. Во-первых, были исключены исследования, в которых очаг инфекции был типичным для сепсиса, например, абдоминальный сепсис, панкреатит или менингит. Во-вторых, были исключены исследования по оценке использования прокальцитонина для диагностики септического шока. Поскольку прогрессирование сепсиса до септического шока сопровождается повышением концентрации прокальцитонина [1], исключение пациентов с септическим шоком могло привести к снижению общей оценки диагностической точности. Чтобы предотвратить систематическую ошибку, мы включили все подходящие исследования, в которых проводилось изучение возможности использования прокальцитонина для диагностики состояний в диапазоне от сепсиса до тяжелого сепсиса. В-третьих, они включали исследования, в которых не проводили оценку состояния пациентов без синдрома системного воспалительного ответа или пациентов, не находившихся в критическом состоянии, что может привести к недооценке точности диагностики.
Соответственно, 23 исследования, включенные в предыдущий метаанализ [10, 11], были исключены из нашего систематического обзора, потому что 13 из них включали контрольные группы здоровых добровольцев или пациентов, у которых не было синдрома системного воспалительного ответа [54-66], и в семи из них не было дано четких определений целевого состояния или они включали пациентов, у которых была инфекция без синдрома системного воспалительного ответа, таким образом, эти исследования не соответствовали нашим критериям отбора [54, 64-60]. Кроме того, в четырех исследованиях было недостаточно информации для построения таблицы сопряженности признаков 2x2 [70-73]. В одном исследовании изучали прогностическое значение прокальцитонина для концентраций фактора некроза опухоли α и интерлейкина 6. В другом исследовании было проведено несколько измерений у нескольких пациентов [75], и в одном исследовании изучалось прогностическое значение прокальцитонина для развития инфекции после кардиологических операций [76].
Кроме того, метаанализ Tang и соавт. [10] имеет существенные недостатки в количественном анализе данных. В нем пары чувствительность-специфичность объединены в один показатель диагностической точности. Таким образом, важная информация отсутствует. Для сохранения двухмерности использовалась двухмерная регрессионная модель смешанных эффектов.
Наш метаанализ имеет несколько ограничений. Во-первых, мы обнаружили существенную гетерогенность между исследованиями, но ни одна из характеристик исследования не была причиной большей части этой гетерогенности. Исследования имеют несколько различий, например, методологическим качеством, клиническим спектром пациентов, категорией госпитализации, используемым методом количественного определения прокальцитонина. Таким образом, гетерогенности, вероятно, способствуют другие неучтенные различия между исследованиями. Использование более однородной популяции решило бы эту проблему, но вызвало бы системную ошибку, связанную с отбором.
Во-вторых, надежный тест для диагностики инфекции все еще отсутствует, так что обсервационные исследования подвержены систематической ошибке за счет выбора золотого стандарта. Согласно нашим критериям включения, наличие инфекции должно было иметь микробиологическое подтверждение или, как минимум, подозреваться клинически. Все включенные исследования соответствовали этому требованию, но в большинстве из них не были предоставлены достаточно подробные данные о том, как подтверждалась инфекция. Тем не менее, в зависимости от ранее проводимой антибиотикотерапии, бактериемия развивается примерно у 30% пациентов с сепсисом [4, 5]. Кроме того, отсутствие стандартизации клинических и рентгенологических данных может стать причиной вариабельности субъективной экспертной оценки, которая повлечет за собой ложноотрицательные или ложноположительные заключения относительно медицинского состояния пациента. Мы включали только те исследования, в которых был хорошо определен эталонный стандарт сепсиса. Тем не менее, мы не можем точно знать, все ли пациенты с инфекцией были определены таким образом.
В-третьих, в некоторых исследованиях интерпретация результатов была описана недостаточно хорошо, особенно в отношении неинтерпретируемых результатов и систематической ошибки анализа результатов исследований. Чтобы минимизировать итоговую систематическую ошибку и обеспечить большую однородность, исследователи должны были использовать Контрольный список вопросов стандартов описания диагностической точности [78], а также учитывать возможность использования контрольного списка вопросов по оценке исследований диагностической точности [13].
 Рисунок 2. Номограмма Фагана для теста на прокальцитонин при диагностике сепсиса
Рисунок 2. Номограмма Фагана для теста на прокальцитонин при диагностике сепсисаВ-четвертых, мы обнаружили систематическую ошибку публикации. Исследования с желаемыми результатами публиковались с большей вероятностью, что может привести к переоценке общей диагностической точности. Чтобы решить эту проблему, мы еще раз провели поиск дополнительных исследований по базам данных и спискам литературы первичных исследований, но не смогли выявить дополнительных значимых статей. Наконец, мы включали только исследования, описанные на немецком, английском или французском языке, что могло повлиять на наши выводы.
Пограничные значения, используемые в различных исследованиях, чтобы отличать пациентов с сепсисом от пациентов, у которых не было сепсиса, существенно отличались. В некоторых исследованиях были использованы пограничные значения, которые приводили к наиболее благоприятным результатам оценки диагностической точности. В других исследованиях чувствительность и специфичность были даны с разными пороговыми значениями. Сложность состоит в том, что пограничные значения впоследствии не были валидированы. Значения диагностической точности отрицательно коррелировали друг с другом. Изменить пограничные значения означает изменить чувствительность за счет специфичности или наоборот. Ложноотрицательные результаты, приводящие к отказу от лечения, могут привести к летальному исходу при сепсисе [6]. Однако для предотвращения развития антибиотикорезистентности, увеличения побочных эффектов и стоимости, необходимо правильно определять пациентов в критических состояниях без бактериальной инфекции. Таким образом, необходимо рациональное пограничное значение. Мы рекомендуем различные этапы тестирования диагностической точности. Во-первых, исследователи должны изучить валидность прокальцитонина в выбранной группе пациентов, чтобы выбрать рациональное пограничное значение. Во-вторых, чтобы установить диагностическую ценность в повседневной клинической практике, установленное пограничное значение должно быть подтверждено в диагностическом контролируемом исследовании.
Наиболее важной особенностью биомаркера является его способность влиять на процесс принятия клинического решения. В последние годы было определено, что у пациентов с инфекциями нижних дыхательных путей пограничные значения находились в диапазоне от 0,1 до 0,5 нг/мл [79]. Наш метаанализ предоставляет важную информацию для пациентов в критических состояниях, для которых принятие диагностических решений имеет первостепенное значение. Медиана пограничного значения во включенных в анализ исследованиях составила 1,1 нг/мл (МКД 0,5-2,0). Отсутствие эффекта клинического порогового значения говорит о том, что пограничное значение от 1,0 до 2,0 нг/мл полезно для отделения пациентов с сепсисом от пациентов с другими воспалительными процессами, в соответствии с рекомендациями [80].
Отношения правдоподобия и вероятности после исследования также актуальны для клиницистов. Они дают информацию о вероятности того, что пациент с положительным или отрицательным результатом действительно имеет сепсис или нет. В нашем исследовании как отношение правдоподобия, так и вероятность после исследования были умеренными (рисунок 2). Отношение правдоподобия положительного результата, равное 4, означает, что у человека с заболеванием в четыре раза больше вероятность получения положительного результата теста, чем у здорового человека. Учитывая вероятность до исследования, равную 20%, после исследования вероятность получения положительного результата составляет 48% (рисунок 2). Аналогично, отношение правдоподобия отрицательного результата, равное 0,29, уменьшает вероятность после исследования получить отрицательный результат до 7%. Однако эти коэффициенты правдоподобия рассчитываются на основе дихотомированных данных. Результат теста на прокальцитонин может быть либо положительным, либо отрицательным. Недостатком формирования дихотомических данных является то, что утрачивается полезная информация [81]. Поскольку концентрация прокальцитонина повышается по мере прогрессирования тяжести заболевания [56], у пациентов с высокой концентрацией прокальцитонина вероятность развития сепсиса выше, чем у пациентов с низкой концентрацией. Чтобы получить более точную информацию о надежности теста, мы предлагаем рассчитать коэффициенты правдоподобия на основе нескольких пограничных значений.
Как показывают наши результаты, прокальцитонин не является совершенным маркером для диагностики сепсиса, но идеальный маркер все-таки существует. Сепсис – это патофизиологический процесс, а не определенный синдром, и он слишком сложен, чтобы его можно было описать одним параметром. Тем не менее, прокальцитонин служит одним из наиболее многообещающих показателей. Были изучены некоторые другие медиаторы и молекулы реакции макроорганизма на инфекцию – С-реактивный белок, растворимый TREM1, интерлейкин 6, интерлейкин 8 и растворимый PLAUR – но каких-либо выдающихся результатов получено не было [23, 35, 40, 82].
В заключение следует отметить, что прокальцитонин является полезным маркером для диагностики сепсиса у пациентов в критических состояниях. Однако он не может быть рекомендован как единственный доказательный тест для диагностики сепсиса; напротив, его следует интерпретировать с учетом подробных анамнестических данных, результатов физического обследования и, если возможно, микробиологического исследования. Кроме того, рекомендуется проводить повторную оценку в течение заболевания.
Список литературы
- Angus DC, Linde-Zwirble WT, Lidicker J, Clermont G, Carcillo J, Pinsky MR. Epidemiology of severe sepsis in the United States: analysis of incidence, outcome, and associated costs of care. Crit Care Med. 2001; 29: 1303-1310.
- Martin GS, Mannino DM, Eaton S, Moss M. The epidemiology of sepsis in the United States from 1979 through 2000. N Engl J Med. 2003; 348: 1546-1554.
- Bone RC, Balk RA, Cerra FB, et al. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. 1992. Chest. 2009; 136: e28.
- Bates DW, Cook EF, Goldman L, Lee TH. Predicting bacteremia in hospitalized patients. A prospectively validated model. Ann Intern Med. 1990; 113: 495-500.
- Bates DW, Sands K, Miller E, et al. Predicting bacteremia in patients with sepsis syndrome. Academic Medical Center Consortium Sepsis Project Working Group. J Infect Dis. 1997; 176: 1538-1551.
- Garnacho-Montero J, Ortiz-Leyba C, Herrera-Melero I, et al. Mortality and morbidity attributable to inadequate empirical antimicrobial therapy in patients admitted to the ICU with sepsis: a matched cohort study. J Antimicrob Chemother. 2008; 61: 436-441.
- Pittet D, Rangel-Frausto S, Li N, et al. Systemic inflammatory response syndrome, sepsis, severe sepsis and septic shock: incidence, morbidities and outcomes in surgical ICU patients. Intensive Care Med. 1995; 21: 302-309.
- Moyer MW. New biomarkers sought for improving sepsis management and care. Nat Med. 2012; 18: 999
- Dandona P, Nix D, Wilson MF, et al. Procalcitonin increase after endotoxin injection in normal subjects. J Clin Endocrinol Metab. 1994; 79: 1605-1608.
- Tang BM, Eslick GD, Craig JC, McLean AS. Accuracy of procalcitonin for sepsis diagnosis in critically ill patients: systematic review and meta-analysis. Lancet Infect Dis. 2007; 7: 210-217.
- Uzzan B, Cohen R, Nicolas P, Cucherat M, Perret GY. Procalcitonin as a diagnostic test for sepsis in critically ill adults and after surgery or trauma: a systematic review and meta-analysis. Crit Care Med. 2006; 34: 1996-2003.
- Reinhart K, Brunkhorst FM, Bone HG, et al. Prevention, diagnosis, treatment, and follow-up care of sepsis. First revision of the S2k Guidelines of the German Sepsis Society (DSG) and the German Interdisciplinary Association for Intensive and Emergency Care Medicine (DIVI). Anaesthesist. 2010; 59 (in German).: 347-370.
- Whiting P, Rutjes AW, Reitsma JB, Bossuyt PM, Kleijnen J. The development of QUADAS: a tool for the quality assessment of studies of diagnostic accuracy included in systematic reviews. BMC Med Res Methodol. 2003; 3: 25.
- Whiting PF, Weswood ME, Rutjes AW, Reitsma JB, Bossuyt PN, Kleijnen J. Evaluation of QUADAS, a tool for the quality assessment of diagnostic accuracy studies. BMC Med Res Methodol. 2006; 6: 9.
- Whiting P, Harbord R, Kleijnen J. No role for quality scores in systematic reviews of diagnostic accuracy studies. BMC Med Res Methodol. 2005; 5: 19.
- Chu H, Cole SR. Bivariate meta-analysis of sensitivity and specificity with sparse data: a generalized linear mixed model approach. J Clin Epidemiol. 2006; 59: 1331-1332.
- Van Houwelingen HC, Zwinderman KH, Stijnen T. A bivariate approach to meta-analysis. Stat Med. 1993; 12: 2273-2284.
- Van Houwelingen HC, Arends LR, Stijnen T. Advanced methods in meta-analysis: multivariate approach and meta-regression. Stat Med. 2002; 21: 589-624.
- Reitsma JB, Glas AS, Rutjes AW, Scholten RJ, Bossuyt PM, Zwinderman AH. Bivariate analysis of sensitivity and specificity produces informative summary measures in diagnostic reviews. J Clin Epidemiol. 2005; 58: 982-990.
- Riley RD, Abrams KR, Sutton AJ, Lambert PC, Thompson JR. Bivariate random-effects meta-analysis and the estimation of between-study correlation. BMC Med Res Methodol. 2007; 7: 3.
- Deeks JJ, Macaskill P, Irwig L. The performance of tests of publication bias and other sample size effects in systematic reviews of diagnostic test accuracy was assessed. J Clin Epidemiol 2005; 58: 882-893.
- Dwamena BA. Midas: a program for meta-analytical integration of diagnostic accuracy studies in stata. 2007. University of Michigan (accessed Jan 15, 2013).
- Simon L, Gauvin F, Amre DK, Saint-Louis P, Lacroix J. Serum procalcitonin and C-reactive protein levels as markers of bacterial infection: a systematic review and meta-analysis. Clin Infect Dis. 2004; 39: 206-217.
- Ahmadinejad Z, Dadsetan B, Jalili M, Soudbakhsh A, Rasolinejad M. Evaluation of serum procalcitonin in patients with systemic inflammatory response syndrome with and without infection. Acta Med Iran. 2009; 47: 383-388.
- Al-Nawas B, Krammer I, Shah PM. Procalcitonin in diagnosis of severe infections. Eur J Med Res. 1996; 1: 331-333.
- Arkader R, Troster EJ, Lopes MR, et al. Procalcitonin does discriminate between sepsis and systemic inflammatory response syndrome. Arch Dis Child. 2006; 91: 117-120.
- Bell K, Wattie M, Byth K, et al. Procalcitonin: a marker of bacteraemia in SIRS. Anaesth Intensive Care. 2003; 31: 629-636.
- Castelli GP, Pognani C, Meisner M, Stuani A, Bellomi D, Sgarbi L. Procalcitonin and C-reactive protein during systemic inflammatory response syndrome, sepsis and organ dysfunction. Crit Care. 2004; 8: R234-R242.
- Clec'h C, Fosse JP, Karoubi P, et al. Differential diagnostic value Crit Care Med. 2006; 34: 102-107.
- Dorizzi RM, Polati E, Sette P, Ferrari A, Rizzotti P, Luzzani A. Procalcitonin in the diagnosis of inflammation in intensive care units. Clin Biochem. 2006; 39: 1138-1143.
- Du B, Pan J, Chen D, Li Y. Serum procalcitonin and interleukin-6 levels may help to differentiate systemic inflammatory response of infectious and non-infectious origin. Chin Med J (Engl). 2003; 116: 538-542.
- Gaini S, Koldkjaer OG, Pedersen C, Pedersen SS. Procalcitonin, lipopolysaccharide-binding protein, interleukin-6 and C-reactive protein in community-acquired infections and sepsis: a prospective study. Crit Care. 2006; 10: R53.
- Gibot S, Kolopp-Sarda MN, Bene MC, et al. Plasma level of a triggering receptor expressed on myeloid cells-1: its diagnostic accuracy in patients with suspected sepsis. Ann Intern Med. 2004; 141: 9-15.
- Groselj-Grenc M, Ihan A, Pavcnik-Arnol M, Kopitar AN, Gmeiner-Stopar T, Derganc M. Neutrophil and monocyte CD64 indexes, lipopolysaccharide-binding protein, procalcitonin and C-reactive protein in sepsis of critically ill neonates and children. Intensive Care Med. 2009; 35: 1950-1958.
- Harbarth S, Holeckova K, Froidevaux C, et al. Diagnostic value of procalcitonin, interleukin-6, and interleukin-8 in critically ill patients admitted with suspected sepsis. Am J Respir Crit Care Med. 2001; 164: 396-402.
- Hsu KH, Chan MC, Wang JM Lin LY, Wu CL. Comparison of Fcgamma receptor expression on neutrophils with procalcitonin for the diagnosis of sepsis in critically ill patients. Respirology. 2011; 16: 152-160.
- Ivancevic N, Radenkovic D, Bumbasirevic V, et al. Procalcitonin in preoperative diagnosis of abdominal sepsis. Langenbecks Arch Surg. 2008; 393: 397-403.
- Jimeno A, Garcia-Velasco A, del Val O, et al. Assessment of procalcitonin as a diagnostic and prognostic marker in patients with solid tumors and febrile neutropenia. Cancer. 2004; 100: 2462-2469.
- Kofoed K, Andersen O, Kronborg G, et al. Use of plasma C-reactive protein, procalcitonin, neutrophils, macrophage migration inhibitory factor, soluble urokinase-type plasminogen activator receptor, and soluble triggering receptor expressed on myeloid cells-1 in combination to diagnose infections: a prospective study. Crit Care. 2007; 11: R38.
- Latour-Perez J, Alcala-Lopez A, Garcia-Garcia MA, et al. Diagnostic accuracy of sTREM-1 to identify infection in critically ill patients with systemic inflammatory response syndrome. Clin Biochem. 2010; 43: 720-724.
- Meynaar IA, Droog W, Batstra M, Vreede R, Herbrink P. In critically ill patients, serum procalcitonin is more useful in differentiating between sepsis and SIRS than CRP, Il-6, or LBP. Crit Care Res Pract. 2011; 2011: 594645.
- Naeini AE, Montazerolghaem S. Procalcitonin marker for sepsis diagnosis. Evaluating a rapid immuno-chromatografic test. Saudi Med J. 2006; 27: 422-424.
- Oshita H, Sakurai J, Kamitsuna M. Semi-quantitative procalcitonin test for the diagnosis of bacterial infection: clinical use and experience in Japan. J Microbiol Immunol Infect. 2010; 43: 222-227.
- Pavcnik-Arnol M, Hojker S, Derganc M, Lipopolysaccharide-binding protein, lipopolysaccharide, and soluble CD14 in sepsis of critically ill neonates and children. Intensive Care Med. 2007; 33: 1025-1032.
- Ruiz-Alvarez MJ, Garcia-Valdecasas S, De Pablo R, et al. Diagnostic efficacy and prognostic value of serum procalcitonin concentration in patients with suspected sepsis. J Intensive Care Med. 2009; 24: 63-71.
- Sakr Y, Burgett U, Nacul FE, Reinhart K, Brunkhorst F. Lipopolysaccharide binding protein in a surgical intensive care unit: a marker of sepsis? Crit Care Med. 2008; 36: 2014-2022.
- Selberg O, Hecker H, Martin M, Klos A, Bautsch W, Kohl J. Discrimination of sepsis and systemic inflammatory response syndrome by determination of circulating plasma concentrations of procalcitonin, protein complement 3a, and interleukin-6. Crit Care Med. 2000; 28: 2793-2798.
- Simon L, Saint-Louis P, Amre DK, Lacroix J, Gauvin F. Procalcitonin and C-reactive protein as markers of bacterial infection in critically ill children at onset of systemic inflammatory response syndrome. Pediatr Crit Care Med. 2008; 9: 407-413.
- Suprin E, Camus C, Gacouin A, et al. Procalcitonin: a valuable indicator of infection in a medical ICU? Intensive Care Med. 2000; 26: 1232-1238.
- Tsalik EL, Jaggers LB, Glickman SW, et al. Discriminative value of inflammatory biomarkers for suspected sepsis. J Emerg Med. 2012; 43: 97-106.
- Tsangaris I, Plachouras D, Kavatha D, et al. Diagnostic and prognostic value of procalcitonin among febrile critically ill patients with prolonged ICU stay. BMC Infect Dis. 2009; 9: 213.
- Tugrul S, Esen F, Celebi S, et al. Reliability of procalcitonin as a severity marker in critically ill patients with inflammatory response. Anaesth Intensive Care. 2002; 30: 747-754.
- Wanner GA, Keel M, Steckholzer U, Beier W, Stocker R, Ertel W. Relationship between procalcitonin plasma levels and severity of injury, sepsis, organ failure, and mortality in injured patients. Crit Care Med. 2000; 28: 950-957.
- Aouifi A, Piriou V, Bastien O, et al. Usefulness of procalcitonin for diagnosis of infection in cardiac surgical patients. Crit Care Med. 2000; 28: 3171-3176.
- Brunkhorst FM, Wegscheider K, Forycki ZF, Brunkhorst R. Procalcitonin for early diagnosis and differentiation of SIRS, sepsis, severe sepsis, and septic shock. Intensive Care Med. 2000; 26: S148-S152.
- Baumgarten R, Pequeriaux NCV, Van Puyenbroek MJE, Speelberg B. Diagnosis of sepsis by procalcitonin. Nederlands Tijdschrift voor de Klinische Chemie. 2002; 27 (in Dutch): 32-35.
- Chan YL, Tseng CP, Tsay PK, Chang SS, Chiu TF, Chen JC. Procalcitonin as a marker of bacterial infection in the emergency department: an observational study. Crit Care. 2004; 8: R12-R20.
- Cheval C, Timsit JF, Garrouste-Orgeas M, et al. Procalcitonin (PCT) is useful in predicting the bacterial origin of an acute circulatory failure in critically ill patients. Intensive Care Med. 2000; 26: S153-S158.
- Clec'h C, Ferriere et al. Diagnostic and prognostic value of procalcitonin in patients with septic shock. Crit Care Med. 2004; 32: 1166-1169.
- Geppert A, Huber K. Usefulness of procalcitonin for diagnosing complicating sepsis in patients with cardiogenic shock. Intensive Care Med. 2003; 29: 1384-1389.
- Giamarellos-Bourboulis EJ, Mega A, Grecka P, et al. Procalcitonin: a marker to clearly differentiate systemic inflammatory response syndrome and sepsis in the critically ill patient? Intensive Care Med. 2002; 28: 1351-1356.
- Hensler T, Sauerland S, Lefering R, et al. The clinical value of procalcitonin and neopterin in predicting sepsis and organ failure after major trauma. Shock. 2003; 20: 420-446.
- Mokart D, Merlin M, Sannini A, et al. Procalcitonin, interleukin 6 and systemic inflammatory response syndrome (SIRS): early markers of postoperative sepsis after major surgery. Br J Anaesth. 2005; 94: 767-773.
- Rothenburger M, Markewitz A, Lenz T, et al. Detection of acute phase response and infection. The role of procalcitonin and C-reactive protein. Clin Chem Lab Med. 1999; 37: 275-279.
- Ruokonen E, Ilkka L, Niskanen M, Takala J. Procalcitonin and neopterin as indicators of infection in critically ill patients. Acta Anaesthesiol Scand. 2002; 46: 398-404.
- Ugarte H, Silva E, Mercan D, De Mendonca A, Vincent JL. Procalcitonin used as a marker of infection in the intensive care unit. Crit Care Med. 1999; 27: 498-504.
- Bossink AW, Groeneveld AB, Thijs LG. Prediction of microbial infection and mortality in medical patients with fever: plasma procalcitonin, neutrophilic elastase-alpha1-antitrypsin, and lactoferrin compared with clinical variables. Clin Infect Dis. 1999; 29: 398-407.
- Hausfater P, Garric S, Ayed SB, Rosenheim M, Bernard M, Riou B. Usefulness of procalcitonin as a marker of systemic infection in emergency department patients: a prospective study. Clin Infect Dis. 2002; 34: 895-901.
- Meisner M, Rauschmayer C, Schmidt J, et al. Early increase of procalcitonin after cardiovascular surgery in patients with postoperative complications. Intensive Care Med. 2002; 28: 1094-1102.
- Balc IC, Sungurtekin H, Gurses E, Sungurtekin U, Kaptanoglu B. Usefulness of procalcitonin for diagnosis of sepsis in the intensive care unit Crit Care. 2003; 7: 85-90.
- Benoist JF, Mimoz O, Assicot M, Edouard A. Serum procalcitonin, but not C-reactive protein, identifies sepsis in trauma patients. Clin Chem. 1998; 44: 1778-1779.
- De Talancé N, Claudel C, Burlet C. La procalcitonine (PCT) est-elle le marqueur spécifique du choc septique? Immuno-analyse & Biologie Spécialisée. 2003; 18: 120-122.
- Luzzani A, Polati E, Dorizzi R, Rungatscher A, Pavan R, Merlini A. Comparison of procalcitonin and C-reactive protein as markers of sepsis. Crit Care Med. 2003; 31: 1737-1741.
- Oberhoffer M, Karzai W, Meier-Hellmann A, Bogel D, Fassbinder J, Reinhart K. Sensitivity and specificity of various markers of inflammation for the prediction of tumor necrosis factor-alpha and interleukin-6 in patients with sepsis. Crit Care Med. 1999; 27: 1814-1818.
- Muller B, Becker KL, Schachinger H, et al. Calcitonin precursors are reliable markers of sepsis in a medical intensive care unit. Crit Care Med. 2000; 28: 977-983.
- Dorge H, Schondube FA, Dorge P, Seipelt R, Voss M, Messmer BJ. Procalcitonin is a valuable prognostic marker in cardiac surgery but not specific for infection. Thorac Cardiovasc Surg. 2003; 51: 322-326.
- Whiting P, Rutjes AW, Reitsma JB, Glas AS, Bossuyt PM, Kleijnen J. Sources of variation and bias in studies of diagnostic accuracy: a systematic review. Ann Intern Med. 2004; 140: 189-202.
- Bossuyt PM, Reitsma JB, Bruns DE, et al. Towards complete and accurate reporting of studies of diagnostic accuracy: the STARD initiative. Fam Pract. 2004; 21: 4-10.
- Schuetz P, Chiappa V, Briel M, Greenwald JL. Procalcitonin algorithms for antibiotic therapy decisions. a systematic review of randomized controlled trials and recommendations for clinical algorithms. Arch Intern Med. 2011; 171: 1322-1331.
- Schuetz P, Briel M, Christ-Crain M, et al. Procalcitonin to guide initiation and duration of antibiotic treatment in acute respiratory infections: an individual patient data meta-analysis. Clin Infect Dis. 2012; 55: 651-662.
- Fischer JE, Bachmann LM, Jaeschke R. A readers' guide to the interpretation of diagnostic test properties: clinical example of sepsis. Intensive Care Med. 2003; 29: 1043-1051.
- Backes Y, van der Sluijs KF, Mackie DP, et al. Usefulness of suPAR as a biological marker in patients with systemic inflammation or infection: a systematic review. Intensive Care Med. 2012; 38: 1418-1428.





