6218
01 Ноября 2021
Авторское право © 2019, Viera Stubnova, Ingrid Os, Aud Høieggen, Marit D. Solbu, Morten Grundtvig, Arne S. Westheim, Dan Atar, Bård Waldum-Grevbo (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Вьера Стабнова, Ингрид Ос, Ауд Хёйегген, Марит Д. Солбу, Мортен Грундтвиг, Арне С. Вестхайм, Дэн Атар, Берд Вальдум-Гревбо
BMC Cardiovascular Disorders201919:4
Аннотация
Введение
Повышенный уровень мочевой кислоты ...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Вьера Стабнова, Ингрид Ос, Ауд Хёйегген, Марит Д. Солбу, Мортен Грундтвиг, Арне С. Вестхайм, Дэн Атар, Берд Вальдум-Гревбо
BMC Cardiovascular Disorders201919:4
Аннотация
Введение
Повышенный уровень мочевой кислоты ...
Авторское право © 2019, Viera Stubnova, Ingrid Os, Aud Høieggen, Marit D. Solbu, Morten Grundtvig, Arne S. Westheim, Dan Atar, Bård Waldum-Grevbo (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Вьера Стабнова, Ингрид Ос, Ауд Хёйегген, Марит Д. Солбу, Мортен Грундтвиг, Арне С. Вестхайм, Дэн Атар, Берд Вальдум-Гревбо
BMC Cardiovascular Disorders201919:4
Аннотация
Введение
Повышенный уровень мочевой кислоты сыворотки (МКС) сопутствует неблагоприятным прогнозам у пациентов с СС заболеваниями, однако до сих пор не ясно, является ли уровень МКС причиной основного заболевания или только указывает на него. Целью исследования стало выявить, является ли уровень МКС независимым прогностическим фактором смертности от всех причин за 5-летний период среди групп пациентов, отобранных согласно индексу соответствия (propensity score, PS) по показателям хронической сердечной недостаточности (СН), а также оценка наличия влияния пола или почечной функции на эффект уровня МКС.
Методы
В исследование были включены пациенты (n = 4684) из Норвежского регистра пациентов с сердечной недостаточностью (Norwegian Heart Failure Registry) с базовым уровнем МКС. Пациенты верхнего квартиля по специфичному для пола уровню МКС были отобраны в соотношении 1:1 с пациентами низших трех квартилей по уровню МКС. В результате проведения процедуры псевдорандомизации методом propensity score matching (PSM) были созданы 928 пар пациентов (73,4% мужчин, средний возраст 71,4 ± 11,5 лет) с сопоставимыми исходными характеристиками. Для исследования независимого влияния уровня МКС на смертность от всех причин применяли метод Каплана-Мейера и регрессия Кокса.
Результаты
Уровень МКС в верхнем квартиле являлся независимым прогностическим фактором смертности от всех причин у пациентов с сердечной недостаточностью (отношение рисков (hazard ratio, HR) 1,19, доверительный интервал 95% (CI) 1,03–1,37, p-значение 0,021). Было обнаружено, что половая принадлежность пациентов влияет на взаимосвязь уровня МКС и смертности от всех причин (p-значение для взаимодействия 0,007). Высокий уровень МКС являлся независимым прогностическим фактором смертности от всех причин у женщин (HR 1,65, 95% CI 1,24–2,20, p-значение 0,001), но не был таковым у мужчин (HR 1,06, 95% CI 0,89–1,25, p-значение 0,527). Почечная функция не влияла на взаимосвязь между уровнем МКС и смертностью от всех причин (p-значение для взаимодействия 0,539).
Выводы
Высокий уровень МКС оказался независимо связанным с низкой 5-летней выживаемостью у норвежских пациентов с сердечной недостаточностью. Полученные данные изменялись в зависимости от половой принадлежности, а высокий уровень МКС являлся независимым прогностическим фактором смертности от всех причин за 5-летний период только у женщин, но не был таковым у мужчин.
Ключевые слова
Взаимосвязь между повышенным уровнем мочевой кислоты сыворотки (МКС) и сердечно-сосудистыми (СС) заболеваниями и смертностью является общепризнанной [1, 2], однако до сих пор не выявлено, указывает ли эта корреляция на наличие причинно-следственной связи, или уровень МКС является маркером риска, отражающим бремя основного заболевания.
МКС, конечный продукт метаболизма пуринов у человека, образуется под действием ксантиноксидазы (XO) и выводится преимущественно почками [3]. На уровень МКС могут влиять почечная функция, пол, раса и медикаментозная терапия [2]. Кроме того, в генетических исследованиях были обнаружены вариации уратных транспортеров, отвечающих за их реабсорбцию и экскрецию, ответственные за некоторое варьирование уровня МКС [4].
Высокий уровень МКС при сердечной недостаточности (СН) может быть результатом нарушения окислительного метаболизма, вызывающего накопление предшественников мочевой кислоты, и повышенной активации XO [5], а также снижения скорости ее выведения почками, в связи с широким распространением хронических болезней почек (ХБП) [6].
Установлено, что высокий уровень МКС связан с инцидентной СН [7, 8, 9, 10] и ассоциирован с неблагоприятными исходами у пациентов с СН [11, 12, 13, 14]. Также была обнаружена связь между уровнем МКС и впервые диагностированной (инцидентной), ранее диагностированной и прогрессирующей ХБП [15, 16, 17], но данные, касающиеся влияния уровня МКС на смертность у пациентов с ХБП, противоречивы [18, 19, 20, 21]
Факторы риска возникновения СС заболеваний и исходы отличаются у пациентов мужского и женского пола [22]. Половые различия также очевидны у пациентов с СН, как в отношении этиологии, фракции выброса левого желудочка (ФВЛЖ), так и прогноза [23, 24, 25, 26]. По-видимому, связь между уровнем МКС и исходами СС заболеваний более выражена у женщин, чем у мужчин [7, 27, 28], но роль пола во взаимосвязи между уровнем МКС и выживаемостью пациентов с СН до сих пор точно не определена.
При оценке взаимосвязей в обсервационных исследованиях уменьшение эффекта конфаундинга имеет решающее значение. Псевдорандомизация методом propensity score matching (PSM) представляет собой статистический метод, который учитывает искажающие факторы (confounding variables) иначе, чем традиционная многомерная модель пропорциональных рисков Кокса, и может оказываться более эффективным [29].
Целью настоящего исследования стало выявление того, является ли уровень МКС независимым прогностическим фактором смертности от всех причин в когорте норвежских пациентов с СН. Кроме того, мы стремились проанализировать, изменяется ли влияние МКС на смертность от всех причин в зависимости от пола или почечной функции.
Методы
Норвежский регистр пациентов с сердечной недостаточностью
Норвежский регистр пациентов с сердечной недостаточностью собирает данные по амбулаторным больным, направляемым в клиники, специализирующиеся на СН, в норвежских больницах, начиная с 2000 года. К февралю 2012 года в 25 клиниках, специализирующихся на СН, в различных регионах Норвегии в исследование было включено в общей сложности 6675 пациентов, что охватывает около половины норвежской популяции. Пациентов регистрировали после того, как им был поставлен диагноз хронической СН любой этиологии в соответствии с рекомендациями Европейского общества кардиологов (ESC) [30, 31]. Регистрировали три посещения. Во время первого посещения (первичное обследование) регистрировали данные истории болезни, физикального обследования, эхокардиографии, функционального класса по классификации Нью-Йоркской кардиологической ассоциации (NYHA), результаты лабораторных исследований и лечения СН. Следующее корректировочное посещение зарегистрировали при постоянном последующем врачебном наблюдении, после того как многопрофильная команда оптимизировала лечение, и пациент принимал участие в образовательной программе. Во время третьего посещения, проводимого через 6 месяцев после последнего корректировочного посещения, состояние здоровья пациента оценивали снова, а также регистрировали результаты лечения и лабораторных исследований. Данные о смертности ежегодно получали из базы данных Статистического управления Норвегии.
Исследование популяции
Данные по первичному измерению уровня МКС в общей сложности получили о 4953 (74,2%) пациентах Норвежского реестра сердечной недостаточности, которые были доступны и удовлетворяли критериям включения в исследование. Пациенты в каждой предоставляющей сведения больнице были сгруппированы в квартили по уровням МКС, специфичным для пола, так как участвовавшие в исследовании больницы использовали различные лабораторные методы для анализа уровня МКС, а рекомендуемый референсный диапазон уровня МКС отличается для женщин и мужчин (женщины 18–49 лет: 155–350 мкмоль/л, женщины старше 50 лет: 155–400 мкмоль/л, мужчины – 230–480 мкмоль/л) [32]. Пациенты из больниц с менее чем 40 зарегистрированными пациентами были исключены из анализа для достижения надлежащей стратификации. Следовательно, 4684 пациента из 19 больниц были стратифицированы и включены в анализ. Наконец, пациенты в каждом квартиле по уровню МКС были объединены по больницам и по полу, причем в каждую группу было включено около 1180 индивидуумов.
Определения терминов
Почечную функцию выражали как расчетную скорость клубочковой фильтрации (рСКФ) и рассчитывали по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [33]. Почечную функцию определяли как сниженную при СКФ <60 мл/мин./1,73 м2.
На основании Руководства ESC 2016 года по СН [34], ФВЛЖ определяли как сниженный при значении <40% и как сохраненный при значении ≥50%.
Диагноз «гипертония» устанавливали на основании информации о гипотензивном лечении.
Суточные дозы ингибиторов ангиотензин-превращающего фермента (ингибиторов АПФ) были пересчитаны в эквивалентные дозы эналаприла (20 мг лизалаприла = 20 мг = рамиприла 10 мг = 100 мг каптоприла), а затем выражены в процентах от целевой дозы эналаприла. Целевая доза эналаприла была определена как 20 мг в сутки. Суточные дозы петлевых диуретиков были пересчитаны в эквивалентные дозы фуросемида (40 мг фуросемида = 1 мг буметанида). Суточные дозы β-блокаторов были пересчитаны в эквивалентные дозы метопролола (200 мг метопролола = 10 мг бисопролола = 50 мг карведилола = 100 мг атенолола).
Статистический анализ
Непрерывные переменные приведены как средние значения ± стандартное отклонение, категориальные переменные приведены в виде частот (в процентах). Различия в непрерывных переменных выявляли с помощью одностороннего дисперсионного анализа и t-критерия Стьюдента при необходимости. Аналогично, различия в категориальных переменных выявляли с помощью критерия χ2. Двусторонний критерий уровня значимости был установлен на значении р <0,05.
Индивидуальный индекс соответствия (propensity score, PS), вероятность того, что уровень МКС находится в верхнем квартиле, был получен для каждого пациента с использованием многомерной модели логистической регрессии. При вычислении PS было установлено, что базовые переменные, связанные с уровнем МКС в самом верхнем (p <0,10), и переменные, которые могут потенциально вмешиваться во взаимосвязь между уровнем МКС и смертностью, были выбраны в качестве независимых переменных. В модель были введены 16 ковариат: пол, возраст, индекс массы тела (ИМТ), курение, сахарный диабет, инсульт в анамнезе, систолическое артериальное давление, функциональный класс по NYHA, применение блокаторов ренин-ангиотензиновой системы (РАС), доза β-блокатора, доза диуретика, применение статина, рСКФ, уровень гемоглобина, уровень натрия и уровень калия в сыворотке. Затем каждому пациенту с уровнем МКС в четвертом квартиле подбирали пару (соотношение 1:1) из пациентов с уровнем МКС в квартилях 1–3 согласно индексу соответствия, используя допустимое отклонение соответствия 0,05, без проведения замен и не отдавая предпочтений кому-либо для достижения точного соответствия.
Кривые выживаемости за пятилетний период наблюдения были представлены с применением статистического метода Каплана-Мейера. Одномерную модель пропорциональных рисков Кокса применяли в полученной методом PSM когорте, результаты представляли в виде отношения рисков (HR) и 95% доверительного интервала (95% CI). Из-за ограниченного числа пациентов женского пола при оценке влияния уровня МКС на смертность от всех причин в стратифицированной по полу модели применяли многомерную модель пропорциональных рисков Кокса. Исходные значения переменных, которые были связаны с уровнем МКС в верхнем квартиле у женщин (p <0,10), были включены в многомерную модель: возраст, ИМТ, курение, ишемическая болезнь сердца, сахарный диабет, гипертония, функциональный класс по NYHA, систолическое артериальное давление, ФВЛЖ, применение блокаторов РАС, доза β-блокатора, доза диуретика, рСКФ и уровень натрия в сыворотке.
Все статистические анализы были выполнены с использованием программного обеспечения IBM SPSS Statistics версии 25 (IBM SPSS Statistics, Нью-Йорк, США). Кривые выживаемости Каплана-Мейера были получены с использованием программного обеспечения STATA/SE версии 14.1 (StataCorp LP, Техас, США).
Результаты
Исходные характеристики и метод PSM
Исходные характеристики 4684 включенных в исследование амбулаторных пациентов с СН представлены квартилями уровней МКС в Таблице 1. Средний возраст пациентов составлял 69,6 ± 12,2 года, 73,3% пациентов составляли мужчины. Пациенты в квартилях с более высоким уровнем МКС чаще оказывались старше, имели в анамнезе диабет и гипертонию, более тяжелые симптомы СН, более высокий ИМТ и худшую почечную функцию по сравнению с пациентами в квартилях с более низким уровнем МКС. Они также применяли более высокие дозы диуретиков и β-блокаторов и реже применяли блокаторы РАС и ацетилсалициловую кислоту. Медиана периода последующего врачебного наблюдения составила 50 (межквартильный интервал [IQR] 27, 78) месяцев.
Таблица 1. Исходные характеристики пациентов с СН до и после проведения процедуры PSM по квартилям МКС
Кривые выживаемости Каплана-Мейера для уровня МКС в квартилях 1-3 практически совпадали при наложении, а смертность от всех причин для пациентов с уровнем МКС в квартиле 4 была значительно выше, чем для тех, кто имел уровень МКС в квартилях 1–3 (логранговый критерий <0,001, рис. 1)). Таким образом, все пациенты с уровнем МКС в трех нижних квартилях были выбраны в качестве потенциальных контролей в модели псевдорандомизации методом PSM. В общей сложности 928 пациентов с уровнем МКС в квартиле 4 были сопоставлены 1:1 по индексу соответствия с пациентами с уровнем МКС в квартилях 1-3. Исходные характеристики 1856 испытуемых, прошедших процедуру PSM, были хорошо сбалансированы (Таблица 1).
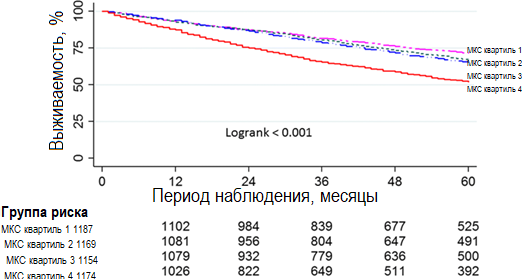 Рисунок 1. График выживаемости Каплана-Мейера для 4684 амбулаторных больных с СН согласно квартилю МКС
Рисунок 1. График выживаемости Каплана-Мейера для 4684 амбулаторных больных с СН согласно квартилю МКС
Было установлено, что половая принадлежность влияет на взаимосвязь уровня МКС со смертностью от всех причин в модели PSM (p-значение для взаимодействия 0,007). Различия в выживаемости амбулаторных больных с СН в зависимости от пола и квартиля уровня МКС изображены на кривых выживаемости Каплана-Мейера на рис. 2. Высокий уровень МКС был независимым прогностическим фактором смертности от всех причин у женщин (HR 1,65, 95% CI 1,24–2,20, р-значение 0,001), но не был таковым у мужчин (HR 1,06, 95% CI 0,89–1,25, р-значение 0,527). Почечная функция не влияла на взаимосвязь уровня МКС со смертностью от всех причин (p-значение для взаимодействия 0,539).
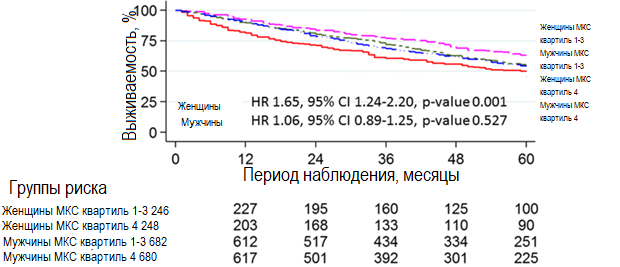 Рисунок 2. График выживаемости Каплана-Мейера амбулаторных пациентов, прошедших процедуру PSM, с СН в соответствии с полом и квартилем МКС
Рисунок 2. График выживаемости Каплана-Мейера амбулаторных пациентов, прошедших процедуру PSM, с СН в соответствии с полом и квартилем МКС
Как по возрасту, сопутствующей патологии, медикаментозному лечению, так и по физико-лабораторным показателям женщины и мужчины с уровнем МКС в верхнем квартиле отличались от пациентов с более низким уровнем МКС (Таблица 2). Число пациентов женского пола было ограничено, и применение стратифицированной по полу модели PSM было невозможно. Впоследствии был проведен многофакторный анализ модели пропорциональных рисков Кокса в отношении влияния пола в подгруппах амбулаторных больных 1251 женщин и 3433 мужчин с СН для дальнейшего изучения половых различий в прогностической ценности уровня МКС для прогнозирования выживаемости. Для подгруппы амбулаторных пациентов женского пола с СН было подтверждено, что уровень МКС в верхнем квартиле является независимым прогностическим фактором смертности от всех причин (HR 1,51, 95% CI 1,13–2,02, p-значение 0,005). В подгруппе амбулаторных пациентов мужского пола с СН уровень МКС, наоборот, не являлся независимым прогностическим фактором смертности от всех причин (HR 1,10, 95% CI 0,94–1,30, p-значение 0,249).
Таблица 2. Исходные характеристики пациентов с СН по квартилям МКС и полу
Обсуждение
Текущее исследование демонстрирует, что высокий уровень МКС являлся гендер-специфичным независимым прогностическим фактором смертности от всех причин за пять лет у пациентов с хронической СН и только для пациентов женского пола. Насколько нам известно, данное исследование является первым PSM исследованием, в котором сообщается о влиянии пола на взаимосвязь между уровнем МКС и смертностью от всех причин при хронической СН. Прогностическая ценность уровня МКС относительно смертности не изменялась в зависимости от почечной функции.
Другие исследования обнаружили связь между высоким уровнем МКС и неблагоприятными исходами у пациентов с хронической СН [13, 21, 35, 36, 37], однако причинно-следственная связь до сих пор считается неустановленной. Мы сообщаем, что уровень МКС в четвертом квартиле является независимым прогностическим фактором смертности от всех причин исключительно у пациентов женского пола, как в модели PSM, так и в многомерной модели регрессии Кокса.
Ранее сообщалось о различиях в зависимости от пола во влиянии уровня МКС на исходы у пациентов с СС заболеваниями. Сообщалось, что у пациентов с гипертонической болезнью с гипертрофией левого желудочка связь между уровнем МКС и СС событиями была более выражена у женщин, чем у мужчин [28]. Исследование пациентов с острым коронарным синдромом показало, что уровень МКС является прогностическим фактором СС событий у женщин, но не является таковым у мужчин [38]. При опросах населения было аналогично установлено, что уровень МКС является независимым прогностическим фактором смертности только среди женщин [27]. Наши результаты теперь расширяют доказательную базу в пользу того, что роль половых различий во влиянии уровня МКС также применим к амбулаторным пациентам с СН.
В большинстве предыдущих исследований, оценивающих различия в выживаемости между мужчинами и женщинами с СН, сообщалось, что выживаемость у женщин выше [25, 39, 40, 41, 42, 43, 44]. Половые гормоны влияют на удержание кальция в миокарде, метаболизм оксида азота, глюкозы и жиров, а также на сердечный фиброз и могут участвовать в механизмах формирования различий в СН между мужчинами и женщинами [26]. МКС представляет собой мощный антиоксидант, но в то же время МКС и XO приводят к снижению биологической доступности оксида азота, что ведет к дисфункции эндотелия, воспалению и сужению сосудов [45]. Обнаружено, что менопауза ассоциирована с увеличением уровня МКС, возможно, из-за измененного влияния эстрогена на удержание мочевой кислоты в почечных канальцах [46]. У нас не было информации о менопаузальном статусе у амбулаторных пациентов женского пола с СН в текущем исследовании, но средний возраст 72,1 ± 12,1 года указывает на то, что подавляющее большинство их находилось в постменопаузе. Наше исследование выявило четкие различия между женщинами и мужчинами с уровнем МКС в квартиле 4 в отношении возраста, типа, симптомов и лечения СН, а также сопутствующей патологии и функции почек. Тем не менее, как модель PSM, так и модель многомерной регрессии Кокса определили уровень МКС в верхнем квартиле как прогностический фактор смертности от всех причин среди женщин независимо от упомянутых выше вмешивающихся переменных. Механизмы влияния высокого уровня МКС на снижение выживаемости избирательно у женщин в постменопаузе нуждаются в дальнейшем изучении, однако наши результаты позволяют предполагать, что уровень МКС представляет собой будущую цель лекарственной терапии для пациентов с СН. Терапия, снижающая уровень уратов, в настоящее время не рекомендуется при бессимптомной гиперурикемии из-за ограниченных данных о рисках и пользе ее применения при заболеваниях помимо подагры [47]. Тем не менее было показано, что XO-ингибирующая терапия оказывает благоприятные эффекты в некоторых группах пациентов [48]. У пациентов с СН, страдающих гиперурикемией, XO-ингибирующая терапия не улучшала выживаемость, но следует отметить, что это исследование не было стратифицированным по полу и продолжалось всего 24 недели [49].
Почечная функция не изменила влияние уровня МКС на смертность от всех причин в настоящем исследовании. Это подтверждает наблюдение Anker et al. [13], которые также обнаружили, что уровень МКС является прогностическим фактором неблагоприятного исхода при СН независимо от функции почек, в то время как Filippatos et al. [21] обнаружили, что уровень МКС связан с неблагоприятным исходом только у пациентов с СН без ХБП. Исследования влияния уровня МКС у пациентов с ХБП показывают противоречивые результаты [18, 19, 20].
Необходимо рассмотреть некоторые ограничения настоящего исследования. Мы сгруппировали пациентов в каждой больнице в квартили МКС с учетом пола из-за применения различных лабораторных методов для анализа уровня МКС в больницах, предоставлявших данные для исследования. Небольшие величины групп могут вызвать появление систематической ошибки, поэтому мы не включили в исследование пациентов из больниц, в которых зарегистрировано менее 40 человек. С другой стороны, мы могли бы ввести систематическую ошибку выбора, исключив некоторые больницы. Пациенты в каждом квартиле уровня МКС были объединены по больницам и полу, что в итоге привело к некоторым перекрывающимся значениям уровней МКС в четырех квартилях.
Чтобы уменьшить смещение в результате эффекта конфаундинга, мы применяли как метод PSM, так и метод многомерной регрессии Кокса. Псевдорандомизация является все более широко используемым методом, который имитирует некоторые характеристики рандомизированных контрольных испытаний (РКИ) и позволяет напрямую сравнивать результаты в двух исследуемых группах [29]. Мы применяли метод PSM при оценке влияния высокого уровня МКС на выживаемость у всех пациентов с СН. Индекс соответствия (propensity score, PS) уровня МКС в верхнем квартиле оценивали на основе 16 измеренных исходных переменных. На основании значений PS были установлены две группы пациентов, различающиеся наличием или отсутствием уровня МКС в четвертом квартиле, и, как и в РКИ, мы могли затем напрямую сравнить выживаемость в этих двух группах. Распределение исходных характеристик в группах, прошедших процедуру PSM, было хорошо сбалансировано, за исключением суточных доз диуретиков. Тем не менее, разница была незначительной и вряд ли может объяснить разницу в выживаемости. Кроме того, большой размер исследуемой популяции и большое количество переменных, используемых для процедуры PSM, и тот факт, что почти 80% пациентов с уровнем МКС в верхнем квартиле прошли процедуру PSM, должны обеспечить достоверность наших результатов. В стратифицированном по полу анализе мы использовали многовариантную модель пропорциональных рисков Кокса, чтобы скорректировать влияние вмешивающих переменных, поскольку процедура PSM привела бы к небольшому размеру исследуемых групп и, таким образом, могла бы привести к смещению выборки. Тем не менее, ни метод PSM, ни многомерный метод пропорциональных рисков Кокса не могут скорректировать неизмеряемые вмешивающиеся факторы.
Данное исследование является обсервационным и поэтому ограничено существующими в настоящее время данными в Норвежском реестре пациентов с СН. Мы не могли повлиять на выбор собранных переменных. Информация о потреблении алкоголя, применении лозартана, заместительной гормональной терапии, применении препаратов, снижающих уровень МКС, функции щитовидной железы и уровне триглицеридов, могла бы оказаться ценной для настоящего исследования. В то же время обсервационный характер этого исследования является одной из его сильных сторон, так как включенные в исследование пациенты представляют собой популяцию, практически не подвергшуюся отбору, в отличие от пациентов, участвующих в РКИ, которые проходят строгий отбор.
Выводы
Уровень МКС в верхнем квартиле является независимым прогностическим фактором низкой 5-летней выживаемости у норвежских пациентов с СН. Полученные данные менялись в зависимости от пола, а высокий уровень МКС являлся независимым прогностическим фактором смертности от всех причин за 5-летний период наблюдения только у женщин, но не был таковым у мужчин. Наши результаты показывают, что уровень МКС может быть мишенью для лекарственной терапии избирательно для женщин с СН. Почечная функция не изменяет влияние уровня МКС на смертность от всех причин.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Вьера Стабнова, Ингрид Ос, Ауд Хёйегген, Марит Д. Солбу, Мортен Грундтвиг, Арне С. Вестхайм, Дэн Атар, Берд Вальдум-Гревбо
BMC Cardiovascular Disorders201919:4
Аннотация
Введение
Повышенный уровень мочевой кислоты сыворотки (МКС) сопутствует неблагоприятным прогнозам у пациентов с СС заболеваниями, однако до сих пор не ясно, является ли уровень МКС причиной основного заболевания или только указывает на него. Целью исследования стало выявить, является ли уровень МКС независимым прогностическим фактором смертности от всех причин за 5-летний период среди групп пациентов, отобранных согласно индексу соответствия (propensity score, PS) по показателям хронической сердечной недостаточности (СН), а также оценка наличия влияния пола или почечной функции на эффект уровня МКС.
Методы
В исследование были включены пациенты (n = 4684) из Норвежского регистра пациентов с сердечной недостаточностью (Norwegian Heart Failure Registry) с базовым уровнем МКС. Пациенты верхнего квартиля по специфичному для пола уровню МКС были отобраны в соотношении 1:1 с пациентами низших трех квартилей по уровню МКС. В результате проведения процедуры псевдорандомизации методом propensity score matching (PSM) были созданы 928 пар пациентов (73,4% мужчин, средний возраст 71,4 ± 11,5 лет) с сопоставимыми исходными характеристиками. Для исследования независимого влияния уровня МКС на смертность от всех причин применяли метод Каплана-Мейера и регрессия Кокса.
Результаты
Уровень МКС в верхнем квартиле являлся независимым прогностическим фактором смертности от всех причин у пациентов с сердечной недостаточностью (отношение рисков (hazard ratio, HR) 1,19, доверительный интервал 95% (CI) 1,03–1,37, p-значение 0,021). Было обнаружено, что половая принадлежность пациентов влияет на взаимосвязь уровня МКС и смертности от всех причин (p-значение для взаимодействия 0,007). Высокий уровень МКС являлся независимым прогностическим фактором смертности от всех причин у женщин (HR 1,65, 95% CI 1,24–2,20, p-значение 0,001), но не был таковым у мужчин (HR 1,06, 95% CI 0,89–1,25, p-значение 0,527). Почечная функция не влияла на взаимосвязь между уровнем МКС и смертностью от всех причин (p-значение для взаимодействия 0,539).
Выводы
Высокий уровень МКС оказался независимо связанным с низкой 5-летней выживаемостью у норвежских пациентов с сердечной недостаточностью. Полученные данные изменялись в зависимости от половой принадлежности, а высокий уровень МКС являлся независимым прогностическим фактором смертности от всех причин за 5-летний период только у женщин, но не был таковым у мужчин.
Ключевые слова
- Мочевая кислота
- Сердечная недостаточность
- Пол
- Болезнь почек
- Смертность от всех причин
- Псевдорандомизация
- Эпидемиология
Взаимосвязь между повышенным уровнем мочевой кислоты сыворотки (МКС) и сердечно-сосудистыми (СС) заболеваниями и смертностью является общепризнанной [1, 2], однако до сих пор не выявлено, указывает ли эта корреляция на наличие причинно-следственной связи, или уровень МКС является маркером риска, отражающим бремя основного заболевания.
МКС, конечный продукт метаболизма пуринов у человека, образуется под действием ксантиноксидазы (XO) и выводится преимущественно почками [3]. На уровень МКС могут влиять почечная функция, пол, раса и медикаментозная терапия [2]. Кроме того, в генетических исследованиях были обнаружены вариации уратных транспортеров, отвечающих за их реабсорбцию и экскрецию, ответственные за некоторое варьирование уровня МКС [4].
Высокий уровень МКС при сердечной недостаточности (СН) может быть результатом нарушения окислительного метаболизма, вызывающего накопление предшественников мочевой кислоты, и повышенной активации XO [5], а также снижения скорости ее выведения почками, в связи с широким распространением хронических болезней почек (ХБП) [6].
Установлено, что высокий уровень МКС связан с инцидентной СН [7, 8, 9, 10] и ассоциирован с неблагоприятными исходами у пациентов с СН [11, 12, 13, 14]. Также была обнаружена связь между уровнем МКС и впервые диагностированной (инцидентной), ранее диагностированной и прогрессирующей ХБП [15, 16, 17], но данные, касающиеся влияния уровня МКС на смертность у пациентов с ХБП, противоречивы [18, 19, 20, 21]
Факторы риска возникновения СС заболеваний и исходы отличаются у пациентов мужского и женского пола [22]. Половые различия также очевидны у пациентов с СН, как в отношении этиологии, фракции выброса левого желудочка (ФВЛЖ), так и прогноза [23, 24, 25, 26]. По-видимому, связь между уровнем МКС и исходами СС заболеваний более выражена у женщин, чем у мужчин [7, 27, 28], но роль пола во взаимосвязи между уровнем МКС и выживаемостью пациентов с СН до сих пор точно не определена.
При оценке взаимосвязей в обсервационных исследованиях уменьшение эффекта конфаундинга имеет решающее значение. Псевдорандомизация методом propensity score matching (PSM) представляет собой статистический метод, который учитывает искажающие факторы (confounding variables) иначе, чем традиционная многомерная модель пропорциональных рисков Кокса, и может оказываться более эффективным [29].
Целью настоящего исследования стало выявление того, является ли уровень МКС независимым прогностическим фактором смертности от всех причин в когорте норвежских пациентов с СН. Кроме того, мы стремились проанализировать, изменяется ли влияние МКС на смертность от всех причин в зависимости от пола или почечной функции.
Методы
Норвежский регистр пациентов с сердечной недостаточностью
Норвежский регистр пациентов с сердечной недостаточностью собирает данные по амбулаторным больным, направляемым в клиники, специализирующиеся на СН, в норвежских больницах, начиная с 2000 года. К февралю 2012 года в 25 клиниках, специализирующихся на СН, в различных регионах Норвегии в исследование было включено в общей сложности 6675 пациентов, что охватывает около половины норвежской популяции. Пациентов регистрировали после того, как им был поставлен диагноз хронической СН любой этиологии в соответствии с рекомендациями Европейского общества кардиологов (ESC) [30, 31]. Регистрировали три посещения. Во время первого посещения (первичное обследование) регистрировали данные истории болезни, физикального обследования, эхокардиографии, функционального класса по классификации Нью-Йоркской кардиологической ассоциации (NYHA), результаты лабораторных исследований и лечения СН. Следующее корректировочное посещение зарегистрировали при постоянном последующем врачебном наблюдении, после того как многопрофильная команда оптимизировала лечение, и пациент принимал участие в образовательной программе. Во время третьего посещения, проводимого через 6 месяцев после последнего корректировочного посещения, состояние здоровья пациента оценивали снова, а также регистрировали результаты лечения и лабораторных исследований. Данные о смертности ежегодно получали из базы данных Статистического управления Норвегии.
Исследование популяции
Данные по первичному измерению уровня МКС в общей сложности получили о 4953 (74,2%) пациентах Норвежского реестра сердечной недостаточности, которые были доступны и удовлетворяли критериям включения в исследование. Пациенты в каждой предоставляющей сведения больнице были сгруппированы в квартили по уровням МКС, специфичным для пола, так как участвовавшие в исследовании больницы использовали различные лабораторные методы для анализа уровня МКС, а рекомендуемый референсный диапазон уровня МКС отличается для женщин и мужчин (женщины 18–49 лет: 155–350 мкмоль/л, женщины старше 50 лет: 155–400 мкмоль/л, мужчины – 230–480 мкмоль/л) [32]. Пациенты из больниц с менее чем 40 зарегистрированными пациентами были исключены из анализа для достижения надлежащей стратификации. Следовательно, 4684 пациента из 19 больниц были стратифицированы и включены в анализ. Наконец, пациенты в каждом квартиле по уровню МКС были объединены по больницам и по полу, причем в каждую группу было включено около 1180 индивидуумов.
Определения терминов
Почечную функцию выражали как расчетную скорость клубочковой фильтрации (рСКФ) и рассчитывали по формуле CKD-EPI (Chronic Kidney Disease Epidemiology Collaboration) [33]. Почечную функцию определяли как сниженную при СКФ <60 мл/мин./1,73 м2.
На основании Руководства ESC 2016 года по СН [34], ФВЛЖ определяли как сниженный при значении <40% и как сохраненный при значении ≥50%.
Диагноз «гипертония» устанавливали на основании информации о гипотензивном лечении.
Суточные дозы ингибиторов ангиотензин-превращающего фермента (ингибиторов АПФ) были пересчитаны в эквивалентные дозы эналаприла (20 мг лизалаприла = 20 мг = рамиприла 10 мг = 100 мг каптоприла), а затем выражены в процентах от целевой дозы эналаприла. Целевая доза эналаприла была определена как 20 мг в сутки. Суточные дозы петлевых диуретиков были пересчитаны в эквивалентные дозы фуросемида (40 мг фуросемида = 1 мг буметанида). Суточные дозы β-блокаторов были пересчитаны в эквивалентные дозы метопролола (200 мг метопролола = 10 мг бисопролола = 50 мг карведилола = 100 мг атенолола).
Статистический анализ
Непрерывные переменные приведены как средние значения ± стандартное отклонение, категориальные переменные приведены в виде частот (в процентах). Различия в непрерывных переменных выявляли с помощью одностороннего дисперсионного анализа и t-критерия Стьюдента при необходимости. Аналогично, различия в категориальных переменных выявляли с помощью критерия χ2. Двусторонний критерий уровня значимости был установлен на значении р <0,05.
Индивидуальный индекс соответствия (propensity score, PS), вероятность того, что уровень МКС находится в верхнем квартиле, был получен для каждого пациента с использованием многомерной модели логистической регрессии. При вычислении PS было установлено, что базовые переменные, связанные с уровнем МКС в самом верхнем (p <0,10), и переменные, которые могут потенциально вмешиваться во взаимосвязь между уровнем МКС и смертностью, были выбраны в качестве независимых переменных. В модель были введены 16 ковариат: пол, возраст, индекс массы тела (ИМТ), курение, сахарный диабет, инсульт в анамнезе, систолическое артериальное давление, функциональный класс по NYHA, применение блокаторов ренин-ангиотензиновой системы (РАС), доза β-блокатора, доза диуретика, применение статина, рСКФ, уровень гемоглобина, уровень натрия и уровень калия в сыворотке. Затем каждому пациенту с уровнем МКС в четвертом квартиле подбирали пару (соотношение 1:1) из пациентов с уровнем МКС в квартилях 1–3 согласно индексу соответствия, используя допустимое отклонение соответствия 0,05, без проведения замен и не отдавая предпочтений кому-либо для достижения точного соответствия.
Кривые выживаемости за пятилетний период наблюдения были представлены с применением статистического метода Каплана-Мейера. Одномерную модель пропорциональных рисков Кокса применяли в полученной методом PSM когорте, результаты представляли в виде отношения рисков (HR) и 95% доверительного интервала (95% CI). Из-за ограниченного числа пациентов женского пола при оценке влияния уровня МКС на смертность от всех причин в стратифицированной по полу модели применяли многомерную модель пропорциональных рисков Кокса. Исходные значения переменных, которые были связаны с уровнем МКС в верхнем квартиле у женщин (p <0,10), были включены в многомерную модель: возраст, ИМТ, курение, ишемическая болезнь сердца, сахарный диабет, гипертония, функциональный класс по NYHA, систолическое артериальное давление, ФВЛЖ, применение блокаторов РАС, доза β-блокатора, доза диуретика, рСКФ и уровень натрия в сыворотке.
Все статистические анализы были выполнены с использованием программного обеспечения IBM SPSS Statistics версии 25 (IBM SPSS Statistics, Нью-Йорк, США). Кривые выживаемости Каплана-Мейера были получены с использованием программного обеспечения STATA/SE версии 14.1 (StataCorp LP, Техас, США).
Результаты
Исходные характеристики и метод PSM
Исходные характеристики 4684 включенных в исследование амбулаторных пациентов с СН представлены квартилями уровней МКС в Таблице 1. Средний возраст пациентов составлял 69,6 ± 12,2 года, 73,3% пациентов составляли мужчины. Пациенты в квартилях с более высоким уровнем МКС чаще оказывались старше, имели в анамнезе диабет и гипертонию, более тяжелые симптомы СН, более высокий ИМТ и худшую почечную функцию по сравнению с пациентами в квартилях с более низким уровнем МКС. Они также применяли более высокие дозы диуретиков и β-блокаторов и реже применяли блокаторы РАС и ацетилсалициловую кислоту. Медиана периода последующего врачебного наблюдения составила 50 (межквартильный интервал [IQR] 27, 78) месяцев.
Таблица 1. Исходные характеристики пациентов с СН до и после проведения процедуры PSM по квартилям МКС
Кривые выживаемости Каплана-Мейера для уровня МКС в квартилях 1-3 практически совпадали при наложении, а смертность от всех причин для пациентов с уровнем МКС в квартиле 4 была значительно выше, чем для тех, кто имел уровень МКС в квартилях 1–3 (логранговый критерий <0,001, рис. 1)). Таким образом, все пациенты с уровнем МКС в трех нижних квартилях были выбраны в качестве потенциальных контролей в модели псевдорандомизации методом PSM. В общей сложности 928 пациентов с уровнем МКС в квартиле 4 были сопоставлены 1:1 по индексу соответствия с пациентами с уровнем МКС в квартилях 1-3. Исходные характеристики 1856 испытуемых, прошедших процедуру PSM, были хорошо сбалансированы (Таблица 1).
 Рисунок 1. График выживаемости Каплана-Мейера для 4684 амбулаторных больных с СН согласно квартилю МКС
Рисунок 1. График выживаемости Каплана-Мейера для 4684 амбулаторных больных с СН согласно квартилю МКСБыло установлено, что половая принадлежность влияет на взаимосвязь уровня МКС со смертностью от всех причин в модели PSM (p-значение для взаимодействия 0,007). Различия в выживаемости амбулаторных больных с СН в зависимости от пола и квартиля уровня МКС изображены на кривых выживаемости Каплана-Мейера на рис. 2. Высокий уровень МКС был независимым прогностическим фактором смертности от всех причин у женщин (HR 1,65, 95% CI 1,24–2,20, р-значение 0,001), но не был таковым у мужчин (HR 1,06, 95% CI 0,89–1,25, р-значение 0,527). Почечная функция не влияла на взаимосвязь уровня МКС со смертностью от всех причин (p-значение для взаимодействия 0,539).
 Рисунок 2. График выживаемости Каплана-Мейера амбулаторных пациентов, прошедших процедуру PSM, с СН в соответствии с полом и квартилем МКС
Рисунок 2. График выживаемости Каплана-Мейера амбулаторных пациентов, прошедших процедуру PSM, с СН в соответствии с полом и квартилем МКСКак по возрасту, сопутствующей патологии, медикаментозному лечению, так и по физико-лабораторным показателям женщины и мужчины с уровнем МКС в верхнем квартиле отличались от пациентов с более низким уровнем МКС (Таблица 2). Число пациентов женского пола было ограничено, и применение стратифицированной по полу модели PSM было невозможно. Впоследствии был проведен многофакторный анализ модели пропорциональных рисков Кокса в отношении влияния пола в подгруппах амбулаторных больных 1251 женщин и 3433 мужчин с СН для дальнейшего изучения половых различий в прогностической ценности уровня МКС для прогнозирования выживаемости. Для подгруппы амбулаторных пациентов женского пола с СН было подтверждено, что уровень МКС в верхнем квартиле является независимым прогностическим фактором смертности от всех причин (HR 1,51, 95% CI 1,13–2,02, p-значение 0,005). В подгруппе амбулаторных пациентов мужского пола с СН уровень МКС, наоборот, не являлся независимым прогностическим фактором смертности от всех причин (HR 1,10, 95% CI 0,94–1,30, p-значение 0,249).
Таблица 2. Исходные характеристики пациентов с СН по квартилям МКС и полу
Обсуждение
Текущее исследование демонстрирует, что высокий уровень МКС являлся гендер-специфичным независимым прогностическим фактором смертности от всех причин за пять лет у пациентов с хронической СН и только для пациентов женского пола. Насколько нам известно, данное исследование является первым PSM исследованием, в котором сообщается о влиянии пола на взаимосвязь между уровнем МКС и смертностью от всех причин при хронической СН. Прогностическая ценность уровня МКС относительно смертности не изменялась в зависимости от почечной функции.
Другие исследования обнаружили связь между высоким уровнем МКС и неблагоприятными исходами у пациентов с хронической СН [13, 21, 35, 36, 37], однако причинно-следственная связь до сих пор считается неустановленной. Мы сообщаем, что уровень МКС в четвертом квартиле является независимым прогностическим фактором смертности от всех причин исключительно у пациентов женского пола, как в модели PSM, так и в многомерной модели регрессии Кокса.
Ранее сообщалось о различиях в зависимости от пола во влиянии уровня МКС на исходы у пациентов с СС заболеваниями. Сообщалось, что у пациентов с гипертонической болезнью с гипертрофией левого желудочка связь между уровнем МКС и СС событиями была более выражена у женщин, чем у мужчин [28]. Исследование пациентов с острым коронарным синдромом показало, что уровень МКС является прогностическим фактором СС событий у женщин, но не является таковым у мужчин [38]. При опросах населения было аналогично установлено, что уровень МКС является независимым прогностическим фактором смертности только среди женщин [27]. Наши результаты теперь расширяют доказательную базу в пользу того, что роль половых различий во влиянии уровня МКС также применим к амбулаторным пациентам с СН.
В большинстве предыдущих исследований, оценивающих различия в выживаемости между мужчинами и женщинами с СН, сообщалось, что выживаемость у женщин выше [25, 39, 40, 41, 42, 43, 44]. Половые гормоны влияют на удержание кальция в миокарде, метаболизм оксида азота, глюкозы и жиров, а также на сердечный фиброз и могут участвовать в механизмах формирования различий в СН между мужчинами и женщинами [26]. МКС представляет собой мощный антиоксидант, но в то же время МКС и XO приводят к снижению биологической доступности оксида азота, что ведет к дисфункции эндотелия, воспалению и сужению сосудов [45]. Обнаружено, что менопауза ассоциирована с увеличением уровня МКС, возможно, из-за измененного влияния эстрогена на удержание мочевой кислоты в почечных канальцах [46]. У нас не было информации о менопаузальном статусе у амбулаторных пациентов женского пола с СН в текущем исследовании, но средний возраст 72,1 ± 12,1 года указывает на то, что подавляющее большинство их находилось в постменопаузе. Наше исследование выявило четкие различия между женщинами и мужчинами с уровнем МКС в квартиле 4 в отношении возраста, типа, симптомов и лечения СН, а также сопутствующей патологии и функции почек. Тем не менее, как модель PSM, так и модель многомерной регрессии Кокса определили уровень МКС в верхнем квартиле как прогностический фактор смертности от всех причин среди женщин независимо от упомянутых выше вмешивающихся переменных. Механизмы влияния высокого уровня МКС на снижение выживаемости избирательно у женщин в постменопаузе нуждаются в дальнейшем изучении, однако наши результаты позволяют предполагать, что уровень МКС представляет собой будущую цель лекарственной терапии для пациентов с СН. Терапия, снижающая уровень уратов, в настоящее время не рекомендуется при бессимптомной гиперурикемии из-за ограниченных данных о рисках и пользе ее применения при заболеваниях помимо подагры [47]. Тем не менее было показано, что XO-ингибирующая терапия оказывает благоприятные эффекты в некоторых группах пациентов [48]. У пациентов с СН, страдающих гиперурикемией, XO-ингибирующая терапия не улучшала выживаемость, но следует отметить, что это исследование не было стратифицированным по полу и продолжалось всего 24 недели [49].
Почечная функция не изменила влияние уровня МКС на смертность от всех причин в настоящем исследовании. Это подтверждает наблюдение Anker et al. [13], которые также обнаружили, что уровень МКС является прогностическим фактором неблагоприятного исхода при СН независимо от функции почек, в то время как Filippatos et al. [21] обнаружили, что уровень МКС связан с неблагоприятным исходом только у пациентов с СН без ХБП. Исследования влияния уровня МКС у пациентов с ХБП показывают противоречивые результаты [18, 19, 20].
Необходимо рассмотреть некоторые ограничения настоящего исследования. Мы сгруппировали пациентов в каждой больнице в квартили МКС с учетом пола из-за применения различных лабораторных методов для анализа уровня МКС в больницах, предоставлявших данные для исследования. Небольшие величины групп могут вызвать появление систематической ошибки, поэтому мы не включили в исследование пациентов из больниц, в которых зарегистрировано менее 40 человек. С другой стороны, мы могли бы ввести систематическую ошибку выбора, исключив некоторые больницы. Пациенты в каждом квартиле уровня МКС были объединены по больницам и полу, что в итоге привело к некоторым перекрывающимся значениям уровней МКС в четырех квартилях.
Чтобы уменьшить смещение в результате эффекта конфаундинга, мы применяли как метод PSM, так и метод многомерной регрессии Кокса. Псевдорандомизация является все более широко используемым методом, который имитирует некоторые характеристики рандомизированных контрольных испытаний (РКИ) и позволяет напрямую сравнивать результаты в двух исследуемых группах [29]. Мы применяли метод PSM при оценке влияния высокого уровня МКС на выживаемость у всех пациентов с СН. Индекс соответствия (propensity score, PS) уровня МКС в верхнем квартиле оценивали на основе 16 измеренных исходных переменных. На основании значений PS были установлены две группы пациентов, различающиеся наличием или отсутствием уровня МКС в четвертом квартиле, и, как и в РКИ, мы могли затем напрямую сравнить выживаемость в этих двух группах. Распределение исходных характеристик в группах, прошедших процедуру PSM, было хорошо сбалансировано, за исключением суточных доз диуретиков. Тем не менее, разница была незначительной и вряд ли может объяснить разницу в выживаемости. Кроме того, большой размер исследуемой популяции и большое количество переменных, используемых для процедуры PSM, и тот факт, что почти 80% пациентов с уровнем МКС в верхнем квартиле прошли процедуру PSM, должны обеспечить достоверность наших результатов. В стратифицированном по полу анализе мы использовали многовариантную модель пропорциональных рисков Кокса, чтобы скорректировать влияние вмешивающих переменных, поскольку процедура PSM привела бы к небольшому размеру исследуемых групп и, таким образом, могла бы привести к смещению выборки. Тем не менее, ни метод PSM, ни многомерный метод пропорциональных рисков Кокса не могут скорректировать неизмеряемые вмешивающиеся факторы.
Данное исследование является обсервационным и поэтому ограничено существующими в настоящее время данными в Норвежском реестре пациентов с СН. Мы не могли повлиять на выбор собранных переменных. Информация о потреблении алкоголя, применении лозартана, заместительной гормональной терапии, применении препаратов, снижающих уровень МКС, функции щитовидной железы и уровне триглицеридов, могла бы оказаться ценной для настоящего исследования. В то же время обсервационный характер этого исследования является одной из его сильных сторон, так как включенные в исследование пациенты представляют собой популяцию, практически не подвергшуюся отбору, в отличие от пациентов, участвующих в РКИ, которые проходят строгий отбор.
Выводы
Уровень МКС в верхнем квартиле является независимым прогностическим фактором низкой 5-летней выживаемости у норвежских пациентов с СН. Полученные данные менялись в зависимости от пола, а высокий уровень МКС являлся независимым прогностическим фактором смертности от всех причин за 5-летний период наблюдения только у женщин, но не был таковым у мужчин. Наши результаты показывают, что уровень МКС может быть мишенью для лекарственной терапии избирательно для женщин с СН. Почечная функция не изменяет влияние уровня МКС на смертность от всех причин.
Список использованной литературы
- Feig DI, Kang DH, Johnson RJ. Uric acid and cardiovascular risk. N Engl J Med. 2008;359(17):1811–21. PubMedPubMedCentralViewArticleGoogle Scholar
- Wu AH, Gladden JD, Ahmed M, Ahmed A, Filippatos G. Relation of serum uric acid to cardiovascular disease. Int J Cardiol. 2016;213:4–7. PubMedView ArticleGoogle Scholar
- Maesaka JK, Fishbane S. Regulation of renal urate excretion: a critical review. Am J Kidney Dis. 1998;32(6):917–33. PubMedView ArticleGoogle Scholar
- Benn CL, Dua P, Gurrell R, Loudon P, Pike A, Storer RI, Vangjeli C. Physiology of hyperuricemia and urate-lowering treatments. Front Med. 2018;5:160. View ArticleGoogle Scholar
- Leyva F, Anker S, Swan JW, Godsland IF, Wingrove CS, Chua TP, Stevenson JC, Coats AJ. Serum uric acid as an index of impaired oxidative metabolism in chronic heart failure. Eur Heart J. 1997;18(5):858–65. PubMedView ArticleGoogle Scholar
- Waldum B, Westheim AS, Sandvik L, Flonaes B, Grundtvig M, Gullestad L, Hole T, Os I. Renal function in outpatients with chronic heart failure. J Card Fail. 2010;16(5):374–80. PubMedView ArticleGoogle Scholar
- Holme I, Aastveit AH, Hammar N, Jungner I, Walldius G. Uric acid and risk of myocardial infarction, stroke and congestive heart failure in 417,734 men and women in the apolipoprotein MOrtality RISk study (AMORIS). J Intern Med. 2009;266(6):558–70. PubMedView ArticleGoogle Scholar
- Ekundayo OJ, Dell'Italia LJ, Sanders PW, Arnett D, Aban I, Love TE, Filippatos G, Anker SD, Lloyd-Jones DM, Bakris G, et al. Association between hyperuricemia and incident heart failure among older adults: a propensity-matched study. Int J Cardiol. 2010;142(3):279–87. PubMedView ArticleGoogle Scholar
- Eisen A, Benderly M, Goldbourt U, Haim M. Is serum uric acid level an independent predictor of heart failure among patients with coronary artery disease? Clin Cardiol. 2013;36(2):110–6.PubMedView ArticleGoogle Scholar
- Krishnan E. Hyperuricemia and incident heart failure. Circ Heart fail. 2009;2(6):556–62.PubMedPubMed CentralView ArticleGoogle Scholar
- Palazzuoli A, Ruocco G, Pellegrini M, Beltrami M, Giordano N, Nuti R, McCullough PA. Prognostic significance of hyperuricemia in patients with acute heart failure. Am J Cardiol. 2016;117(10):1616–21.PubMedView ArticleGoogle Scholar
- Pascual-Figal DA, Hurtado-Martinez JA, Redondo B, Antolinos MJ, Ruiperez JA, Valdes M. Hyperuricaemia and long-term outcome after hospital discharge in acute heart failure patients. Eur J Heart Fail. 2007;9(5):518–24.PubMedView ArticleGoogle Scholar
- Anker SD, Doehner W, Rauchhaus M, Sharma R, Francis D, Knosalla C, Davos CH, Cicoira M, Shamim W, Kemp M, et al. Uric acid and survival in chronic heart failure: validation and application in metabolic, functional, and hemodynamic staging. Circulation. 2003;107(15):1991–7.PubMedView ArticleGoogle Scholar
- Tamariz L, Harzand A, Palacio A, Verma S, Jones J, Hare J. Uric acid as a predictor of all-cause mortality in heart failure: a meta-analysis. Congest Heart Fail. 2011;17(1):25–30.PubMedView ArticleGoogle Scholar
- Chonchol M, Shlipak MG, Katz R, Sarnak MJ, Newman AB, Siscovick DS, Kestenbaum B, Carney JK, Fried LF. Relationship of uric acid with progression of kidney disease. Am J Kidney Dis. 2007;50(2):239–47.PubMedView ArticleGoogle Scholar
- Obermayr RP, Temml C, Gutjahr G, Knechtelsdorfer M, Oberbauer R, Klauser-Braun R. Elevated uric acid increases the risk for kidney disease. J Am Soc Nephrol. 2008;19(12):2407–13.PubMedPubMed CentralView ArticleGoogle Scholar
- Weiner DE, Tighiouart H, Elsayed EF, Griffith JL, Salem DN, Levey AS. Uric acid and incident kidney disease in the community. J Am Soc Nephrol. 2008;19(6):1204–11.PubMedPubMed CentralView ArticleGoogle Scholar
- Madero M, Sarnak MJ, Wang X, Greene T, Beck GJ, Kusek JW, Collins AJ, Levey AS, Menon V. Uric acid and long-term outcomes in CKD. Am J Kidney Dis. 2009;53(5):796–803.PubMedPubMed CentralView ArticleGoogle Scholar
- Suliman ME, Johnson RJ, Garcia-Lopez E, Qureshi AR, Molinaei H, Carrero JJ, Heimburger O, Barany P, Axelsson J, Lindholm B, et al. J-shaped mortality relationship for uric acid in CKD. Am J Kidney Dis. 2006;48(5):761–71.PubMedView ArticleGoogle Scholar
- Navaneethan SD, Beddhu S. Associations of serum uric acid with cardiovascular events and mortality in moderate chronic kidney disease. Nephrol Dial Transplant. 2009;24(4):1260–6.PubMedView ArticleGoogle Scholar
- Filippatos GS, Ahmed MI, Gladden JD, Mujib M, Aban IB, Love TE, Sanders PW, Pitt B, Anker SD, Ahmed A. Hyperuricaemia, chronic kidney disease, and outcomes in heart failure: potential mechanistic insights from epidemiological data. Eur Heart J. 2011;32(6):712–20.PubMedPubMed CentralView ArticleGoogle Scholar
- Maas AH, van der Schouw YT, Regitz-Zagrosek V, Swahn E, Appelman YE, Pasterkamp G, Ten Cate H, Nilsson PM, Huisman MV, Stam HC, et al. Red alert for women's heart: the urgent need for more research and knowledge on cardiovascular disease in women: proceedings of the workshop held in Brussels on gender differences in cardiovascular disease, 29 September 2010. Eur Heart J. 2011;32(11):1362–8.PubMedView ArticleGoogle Scholar
- Lenzen MJ, Rosengren A, Scholte op Reimer WJ, Follath F, Boersma E, Simoons ML, Cleland JG, Komajda M. Management of patients with heart failure in clinical practice: differences between men and women. Heart. 2008;94(3):e10.PubMedView ArticleGoogle Scholar
- Cleland JG, Swedberg K, Follath F, Komajda M, Cohen-Solal A, Aguilar JC, Dietz R, Gavazzi A, Hobbs R, Korewicki J, et al. The EuroHeart failure survey programme-- a survey on the quality of care among patients with heart failure in Europe. Part 1: patient characteristics and diagnosis. Eur Heart J. 2003;24(5):442–63.PubMedView ArticleGoogle Scholar
- Ho KK, Anderson KM, Kannel WB, Grossman W, Levy D. Survival after the onset of congestive heart failure in Framingham heart study subjects. Circulation. 1993;88(1):107–15.PubMedView ArticleGoogle Scholar
- Regitz-Zagrosek V, Oertelt-Prigione S, Seeland U, Hetzer R. Sex and gender differences in myocardial hypertrophy and heart failure. Circ J. 2010;74(7):1265–73.PubMedView ArticleGoogle Scholar
- Freedman DS, Williamson DF, Gunter EW, Byers T. Relation of serum uric acid to mortality and ischemic heart disease. The NHANES I epidemiologic follow-up study. Am J Epidemiol. 1995;141(7):637–44.PubMedView ArticleGoogle Scholar
- Hoieggen A, Alderman MH, Kjeldsen SE, Julius S, Devereux RB, De Faire U, Fyhrquist F, Ibsen H, Kristianson K, Lederballe-Pedersen O, et al. The impact of serum uric acid on cardiovascular outcomes in the LIFE study. Kidney Int. 2004;65(3):1041–9.PubMedView ArticleGoogle Scholar
- Austin PC. An introduction to propensity score methods for reducing the effects of confounding in observational studies. Multivar Behav Res. 2011;46(3):399–424.View ArticleGoogle Scholar
- Remme WJ, Swedberg K. Task force for the D, treatment of chronic heart failure ESoC: guidelines for the diagnosis and treatment of chronic heart failure. Eur Heart J. 2001;22(17):1527–60.PubMedView ArticleGoogle Scholar
- McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Dickstein K, Falk V, Filippatos G, Fonseca C, Gomez-Sanchez MA, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: the task force for the diagnosis and treatment of acute and chronic heart failure 2012 of the European Society of Cardiology. Developed in collaboration with the heart failure association (HFA) of the ESC. Eur J Heart Fail. 2012;14(8):803–69.PubMedView ArticleGoogle Scholar
- Rustad P, Felding P, Franzson L, Kairisto V, Lahti A, Martensson A, Hyltoft Petersen P, Simonsson P, Steensland H, Uldall A. The Nordic reference interval project 2000: recommended reference intervals for 25 common biochemical properties. Scand J Clin Lab Invest. 2004;64(4):271–84.PubMedView ArticleGoogle Scholar
- Levey AS, Stevens LA, Schmid CH, Zhang YL, Castro AF 3rd, Feldman HI, Kusek JW, Eggers P, Van Lente F, Greene T, et al. A new equation to estimate glomerular filtration rate. Ann Intern Med. 2009;150(9):604–12.PubMedPubMed CentralView ArticleGoogle Scholar
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, Falk V, Gonzalez-Juanatey JR, Harjola VP, Jankowska EA, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the heart failure association (HFA) of the ESC. Eur J Heart Fail. 2016;18(8):891–975.PubMedView ArticleGoogle Scholar
- Jankowska EA, Ponikowska B, Majda J, Zymlinski R, Trzaska M, Reczuch K, Borodulin-Nadzieja L, Banasiak W, Ponikowski P. Hyperuricaemia predicts poor outcome in patients with mild to moderate chronic heart failure. Int J Cardiol. 2007;115(2):151–5.PubMedView ArticleGoogle Scholar
- von Lueder TG, Girerd N, Atar D, Agewall S, Lamiral Z, Kanbay M, Pitt B, Dickstein K, Zannad F, Rossignol P, et al. Serum uric acid is associated with mortality and heart failure hospitalizations in patients with complicated myocardial infarction: findings from the high-risk myocardial infarction database initiative. Eur J Heart Fail. 2015;17(11):1144–51.View ArticleGoogle Scholar
- Wu AH, Ghali JK, Neuberg GW, O'Connor CM, Carson PE, Levy WC. Uric acid level and allopurinol use as risk markers of mortality and morbidity in systolic heart failure. Am Heart J. 2010;160(5):928–33.PubMedView ArticleGoogle Scholar
- Kawabe M, Sato A, Hoshi T, Sakai S, Hiraya D, Watabe H, Kakefuda Y, Ishibashi M, Abe D, Takeyasu N, et al. Gender differences in the association between serum uric acid and prognosis in patients with acute coronary syndrome. J Cardiol. 2016;67(2):170–6.PubMedView ArticleGoogle Scholar
- Alla F, Al-Hindi AY, Lee CR, Schwartz TA, Patterson JH, Adams KF Jr. Relation of sex to morbidity and mortality in patients with heart failure and reduced or preserved left ventricular ejection fraction. Am Heart J. 2007;153(6):1074–80.PubMedView ArticleGoogle Scholar
- Adams KF Jr, Sueta CA, Gheorghiade M, O'Connor CM, Schwartz TA, Koch GG, Uretsky B, Swedberg K, McKenna W, Soler-Soler J, et al. Gender differences in survival in advanced heart failure. Insights from the FIRST study. Circulation. 1999;99(14):1816–21.PubMedView ArticleGoogle Scholar
- O'Meara E, Clayton T, McEntegart MB, McMurray JJ, Pina IL, Granger CB, Ostergren J, Michelson EL, Solomon SD, Pocock S, et al. Sex differences in clinical characteristics and prognosis in a broad spectrum of patients with heart failure: results of the candesartan in heart failure: assessment of reduction in mortality and morbidity (CHARM) program. Circulation. 2007;115(24):3111–20.PubMedView ArticleGoogle Scholar
- Ghali JK, Krause-Steinrauf HJ, Adams KF, Khan SS, Rosenberg YD, Yancy CW, Young JB, Goldman S, Peberdy MA, Lindenfeld J. Gender differences in advanced heart failure: insights from the BEST study. J Am Coll Cardiol. 2003;42(12):2128–34.PubMedView ArticleGoogle Scholar
- Sakata Y, Miyata S, Nochioka K, Miura M, Takada T, Tadaki S, Takahashi J, Shimokawa H. Gender differences in clinical characteristics, treatment and long-term outcome in patients with stage C/D heart failure in Japan. Report from the CHART-2 study. Circ J. 2014;78(2):428–35.PubMedView ArticleGoogle Scholar
- Ahmed MI, Lainscak M, Mujib M, Love TE, Aban I, Pina IL, Aronow WS, Bittner V, Ahmed A. Gender-related dissociation in outcomes in chronic heart failure: reduced mortality but similar hospitalization in women. Int J Cardiol. 2011;148(1):36–42.PubMedView ArticleGoogle Scholar
- Puddu P, Puddu GM, Cravero E, Vizioli L, Muscari A. Relationships among hyperuricemia, endothelial dysfunction and cardiovascular disease: molecular mechanisms and clinical implications. J Cardiol. 2012;59(3):235–42.PubMedView ArticleGoogle Scholar
- Hak AE, Choi HK. Menopause, postmenopausal hormone use and serum uric acid levels in US women--the third National Health and nutrition examination survey. Arthritis Res Ther. 2008;10(5):R116.PubMedPubMed CentralView ArticleGoogle Scholar
- Stamp L, Dalbeth N. Urate-lowering therapy for asymptomatic hyperuricaemia: a need for caution. Semin Arthritis Rheum. 2017;46(4):457–64.PubMedView ArticleGoogle Scholar
- Bredemeier M, Lopes LM, Eisenreich MA, Hickmann S, Bongiorno GK, d'Avila R, Morsch ALB, da Silva Stein F, Campos GGD. Xanthine oxidase inhibitors for prevention of cardiovascular events: a systematic review and meta-analysis of randomized controlled trials. BMC Cardiovasc Disord. 2018;18(1):24.PubMedPubMed CentralView ArticleGoogle Scholar
- Givertz MM, Anstrom KJ, Redfield MM, Deswal A, Haddad H, Butler J, Tang WH, Dunlap ME, LeWinter MM, Mann DL, et al. Effects of xanthine oxidase inhibition in Hyperuricemic heart failure patients: the xanthine oxidase inhibition for Hyperuricemic heart failure patients (EXACT-HF) study. Circulation. 2015;131(20):1763–71.PubMedPubMed CentralView ArticleGoogle Scholar





