3467
13 Сентября 2021
Авторское право © 2018, Yan Gao, Nanette H. Bishopric, Hong-wei Chen, Jiang-tao Li, Yu-lang Huang, He-xun Huang (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Янь Гао, Нанетт Х. Епископство, Хун-вэй Чэнь, Цзян-тао Ли, Юй-лан Хуан, Хэ-сюнь Хуан
BMC Cardiovascular Disorders201818:234
Аннотация
Введение
С внедрением первичной чрескожной коронарной ангиопластики (ПЧКА) количество случаев синдрома постпо...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Янь Гао, Нанетт Х. Епископство, Хун-вэй Чэнь, Цзян-тао Ли, Юй-лан Хуан, Хэ-сюнь Хуан
BMC Cardiovascular Disorders201818:234
Аннотация
Введение
С внедрением первичной чрескожной коронарной ангиопластики (ПЧКА) количество случаев синдрома постпо...
Авторское право © 2018, Yan Gao, Nanette H. Bishopric, Hong-wei Chen, Jiang-tao Li, Yu-lang Huang, He-xun Huang (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Янь Гао, Нанетт Х. Епископство, Хун-вэй Чэнь, Цзян-тао Ли, Юй-лан Хуан, Хэ-сюнь Хуан
BMC Cardiovascular Disorders201818:234
Аннотация
Введение
С внедрением первичной чрескожной коронарной ангиопластики (ПЧКА) количество случаев синдрома постповреждения сердца (СППС) среди пациентов с острым инфарктом миокарда (ОИМ), прошедших лечение с применением ПЧКА, уменьшилось. Тем не менее патогенез заболевания по-прежнему не до конца изучен. В отличие от предыдущих исследований в данной публикации представлены новые данные о механизме развития СППС после ПЧКА.
Описание случая
У мужчины 45 лет через 3 часа после ПЧКА, назначенной для лечения ОИМ, развился СППС. При последующем проведении коронарной ангиографии (КАГ) было выявлено неполное восстановление кровотока (TIMI ≤ 2) в поврежденных артериях. Выраженных признаков тромбоза стента или ятрогенной травмы, которая могла возникнуть после вмешательства, не обнаружено. Тем не менее, в ходе длительного мониторинга лабораторных показателей крови обнаружено, что уровень высокочувствительного С-реактивного белка (вчСРБ) имеет динамику, схожую с динамикой количества нейтрофилов и уровня тропонина Т. Это может свидетельствовать о взаимосвязи между коронарной микроваскулярной дисфункцией (КМД), вызванной ПЧКА, и механизмом развития СППС.
Вывод
В данном клиническом случае описывается пациент, у которого наблюдалась ярко выраженная воспалительная реакция и коронарная микроваскулярная дисфункция (КМД), возникшая в результате ишемического реперфузионного повреждения миокарда после ОИМ. У пациента также присутствуют факторы риска развития эндотелиальной дисфункции. Существует потенциальная взаимосвязь между СППС и эффективностью ПЧКА у пациента с ОИМ, предрасположенного к повреждениям эндотелия.
Ключевые слова
Синдром постповреждения сердца (сидром Дресслера) представляет собой аутоиммунную реакцию, которая возникает в результате различных повреждений сердца, в том числе некроза миокарда, травмы сердца или операции на сердце. С внедрением первичной чрескожной коронарной ангиопластики (ПЧКА) процентная доля вновь зарегистрированных случаев СППС, возникших после ПЧКА, снизилась до 0,5%. Тем не менее патогенез СППС остается неизвестным [1]. В данной публикации описывается необычный клинический случай раннего наступления СППС после ПЧКА для лечения ОИМ, а также послеоперационной коронарной микроваскулярной дисфункции (КМД). Далее будет обсужден вероятный патогенез и возможные методы снижения риска СППС после ПЧКА.
Описание случая
У мужчины 45 лет с факторами риска эндотелиальной дисфункции (в том числе курение и гиперлипидемия) в течение 3 суток наблюдались типичные приступы стенокардии. Характерные динамические изменения показателей электрокардиограммы (ЭКГ) и маркера некроза миокарда cTnT (тропонина Т) указывали на инфаркт миокарда с подъемом сегмента ST. Срочная коронарная ангиография (КАГ) выявила полную окклюзию срединной огибающей артерии (рис. 1а). В проксимальную часть левой срединной огибающей артерии (p-LCX) был введен стент с лекарственным покрытием. Успешность ПЧКА подтверждалась результатами последующего ангиографического исследования (рис. 1b). Спустя три часа, у пациента появились одышка и постоянные боли в плевральной области. На ЭКГ был обнаружен значительный подъем сегмента ST вогнутой формы и депрессия сегмента PR (рис. 2a). Дополнительная КАГ была проведена через 33 часа после ПЧКА. При этом не было выявлено признаков тромбоза стента или выраженной ятрогенной травмы, вызванной вмешательством. Тем не менее в инфаркт-зависимых артериях отмечены замедление кровотока (TIMI ≤ 2) (рис. 1c) и высокий показатель перфузии миокарда (TMPFEC = 140 кадров при скорости съемки 30 кадров в секунду). Устойчивый подъем сегмента ST на ЭКГ и увеличение уровня тропонина Т при отсутствии повторного подъема уровня КФК-ММ, скорее всего, свидетельствовал о том, что устойчивое очаговое повреждение миокарда могло быть обусловлено коронарной микроваскулярной дисфункцией (КМД). В последние годы исследования резервного коронарного кровотока (РКК) с помощью внутрикоронарного допплеровского датчика кровотока и позитронно-эмиссионной томографии (ПЭТ) считаются общепринятым стандартным методом количественной оценки нарушений коронарной микроциркуляции. Тем не менее данный метод является технологически сложным и дорогостоящим, и не применялся в данном случае, учитывая состояние пациента и особенности процесса лечения. Томография грудной клетки выявила небольшое количество плеврального выпота и интерстициальную инфильтрацию обоих легких (рис. 2b, c), а ультразвуковое исследование показало небольшое количество жидкости в перикарде с затуханием движения задней стенки (рис. 2d, e). Анализ крови выявил непрерывное увеличение содержания вчСРБ. Количество нейтрофилов и уровень тропонина Т повышались параллельно с уровнем вчСРБ на ранней и поздней стадиях СППС соответственно (рис. 3). Скорость оседания эритроцитов (СОЭ) составляла 83 м/с, то есть была значительно выше нормы и представляла собой дополнительный маркер воспаления. В то же время уровень антистрептолизина О (АСЛ О) и антинуклеарных антител (АНА), считающихся маркерами ревматизма и туберкулеза, а также уровень натрийуретического пептида типа В (ВNP, 107 пг/мл) оставались в пределах нормы. Таким образом было установлено развитие СППС у пациента. После прохождения курса лечения противоишемическими препаратами и аспирином в дозировке, достаточной для подавления воспаления, пациент не испытывал симптомов заболевания в течение дальнейшего нахождения в стационаре. Объем перикардиального выпота постепенно снизился, уровень вчСРБ и тропонина Т в сыворотке крови снизился до нормальных значений через 3 недели после возникновения СППС.
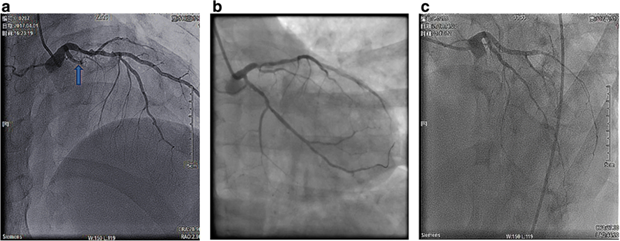 Рисунок 1. А) Предоперационный снимок: коронарная ангиография показала полную срединную окклюзию огибающей артерии (показано стрелкой). B) послеоперационный снимок: в полость огибающей артерии (p-LCX) успешно введен стент с лекарственным покрытием; последний ангиографический снимок демонстрирует благоприятный результат. С) Последующая ангиография, проведенная спустя 33 часа после наступления СППС, не выявила тромбозов стента; в то же время, наблюдалось значительное замедление кровотока (TIMI ≤ 2)
Рисунок 1. А) Предоперационный снимок: коронарная ангиография показала полную срединную окклюзию огибающей артерии (показано стрелкой). B) послеоперационный снимок: в полость огибающей артерии (p-LCX) успешно введен стент с лекарственным покрытием; последний ангиографический снимок демонстрирует благоприятный результат. С) Последующая ангиография, проведенная спустя 33 часа после наступления СППС, не выявила тромбозов стента; в то же время, наблюдалось значительное замедление кровотока (TIMI ≤ 2)
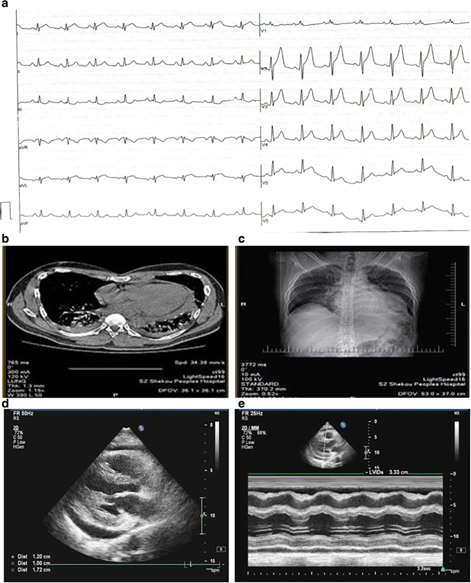 Рисунок 2. А) Спустя 24 часа после СППС, ЭКЗ с 12 отведениями выявила обширные вогнутые подъемы сегментов ST; B) и С) Томографическое исследование грудной клетки показало небольшое количество плеврального выпота и интерститиальную инфильтрацию обоих легких. D) и E): Ультразвуковое исследование выявило небольшое количество жидкости в перикарде с затуханием движения задней стенки
Рисунок 2. А) Спустя 24 часа после СППС, ЭКЗ с 12 отведениями выявила обширные вогнутые подъемы сегментов ST; B) и С) Томографическое исследование грудной клетки показало небольшое количество плеврального выпота и интерститиальную инфильтрацию обоих легких. D) и E): Ультразвуковое исследование выявило небольшое количество жидкости в перикарде с затуханием движения задней стенки
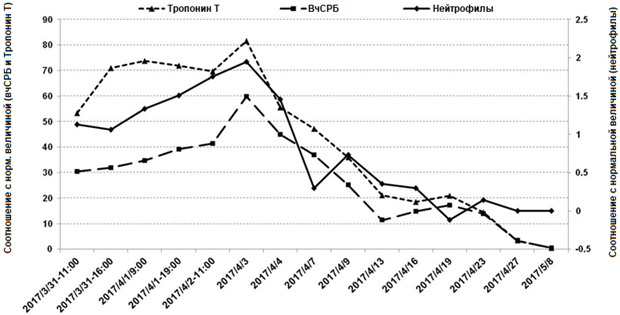 Рисунок 3. Анализ крови выявил параллельное увеличение концентрации тропонина T и вчСРБ на ранней и поздней стадии ПОС соответственно
Рисунок 3. Анализ крови выявил параллельное увеличение концентрации тропонина T и вчСРБ на ранней и поздней стадии ПОС соответственно
Обсуждение и выводы
Термины «синдром постповреждения сердца (СППС)» и «постинфарктный синдром» используются для обозначения раннего проявления плевроперикардита после ОИМ и последующей катетеризации артерий. Данное состояние, которое также называют «синдромом Дресслера», обычно развивается спустя 3-4 недели после ОИМ. Согласно распространенной гипотезе, аутоиммунная реакция против антигенов сердца приводит к обширному воспалению перикарда и развитию перикардита [2]. С внедрением ПЧКА заболеваемость синдромом Дресслера (CППС) стала снижаться. Хотя патогенез этого синдрома остается неизученным, предполагают, что аутоиммунная реакция, провоцируемая некрозом миокарда, запускается еще до проведения ПЧКА [3]. Кроме того, могут повреждаться клетки мезотелия перикарда и (или) плевры, приводя к развитию синдрома [4]. В данном исследовании описан редкий случай СППС в сочетании с КМД после ПЧКА. Как и клинический случай, описанным Джинсоком Парком в 2010 году [5], описанный нами клинический случай СППС после ЧКА характеризуется нетипично ранним наступлением, а также присутствием плевральных болей, небольшого повышения температуры тела, а также перикардического и (или) плеврального выпота.
К тому же, данный случай, по-видимому, свидетельствовал о связи увеличения уровня маркеров воспаления у пациентов, перенесших ОИМ и СППС, с развитием КМД после ПЧКА и последующим развитием стойких очаговых повреждений миокарда. Как показывают исследования на животных [6] и клинические исследования [7], активизация нейтрофилов и высвобождение провоспалительных цитокинов приводят к повреждению микроваскулярных клеток эндотелия и клеток мезотелия перикарда и плевры. Эти процессы могут стать причиной развития КМД и плевроперикардита наряду с ишемией миокарда и реперфузией. Кроме того, Г. М. Фролих et al. [8] и Л. Ф. Робберс et al. [9] показали, что воспалительные реакции, вызванные реперфузионными повреждениями, стимулируют продукцию хемокинов, цитокинов и адгезивных молекул, что, по-видимому, связано с КМД и закупоркой коронарных артерий. Это препятствует оттоку крови и может привести к развитию гематомы миокарда. Согласно отчету Джинсока Парка et al. [5], при анализе перикардиального выпота у пациента с СППС после успешной ПЧКА было обнаружено некоторое количество эритроцитов. Это свидетельствовало о том, что гематома миокарда, развившаяся вследствие послеоперационной КМД, способствует истечению крови в перикардиальное пространство и таким образом играет заметную роль в развитии СППС.
Помимо ОИМ к факторам риска коронарной микроциркулярной дисфункции относят курение, ожирение, гиперлипидемию, гиперурикемию, диабет и хронические заболевания почек. Установлено, что длительное присутствие сигналов, стимулирующих повреждение эндотелия, может способствовать метилированию ДНК и привести к изменению структуры и функций хромосом. Кроме того, такое воздействие может увеличивать эффект стресс-сигналов в различных сигнальных путях, связанных с повреждением эндотелия [10]. У описываемого пациента нарушение хромосомной структуры клеток эндотелия могло быть вызвано длительным курением, поскольку он оказался восприимчивым к повреждениям эндотелия с «эффектом метаболической памяти». Такая ситуация может усилить ишемическое/реперфузионное повреждение эндотелия после ПЧКА, что может привести к серьезному ослаблению структуры и резерва коронарного кровотока / дистолической функции. В исследовании Маттео et al. [11] сообщалось, что хронические заболевания почек могут способствовать развитию микроциркулярной дисфункции и уменьшению дистолической дисфункцию и недостаточности функционального резерва сердца. У описанного нами пациента отмечался повышенный уровень тропонина Т, который сохранялся даже после деблокирования инфаркт-связанной артерии (ИСА) посредством ЧКА. Возможно, это стало следствием очагового некроза миокарда, вызванного усугубленной табакокурением микроциркулярной дисфункцией и снижением перфузии сосудов миокарда.
Кроме того, в описанном случае уровень маркеров воспаления совпадал со стойким повышением уровня тропонина Т, который, вероятно, был связан с длительным очаговым повреждением миокарда, вызванным КМД. Это подтверждает результаты недавнего исследования Г. Вилахура et al [12], в котором сообщается, что обширный некроз ишемических кардиомиоцитов в миокарде с недостатком кровообращения может активировать внутренний иммунный ответ, провоцируя компенсаторное воспаление. В настоящее время взаимосвязь между периоперационным СППС и КМД на фоне ОИМ нуждается в дальнейшем изучении.
Данные, представленные в описании данного клинического случая, свидетельствуют о том, что выраженная воспалительная реакция и КМД, вызванная послеоперационной ишемической реперфузионной травмой, вероятно, связаны с возникновением СППС. Поэтому следует обращать внимание на выраженную воспалительную реакцию и КМД, вызванную ишемической реперфузионной травмой у перенесших ОИМ пациентов с факторами риска развития эндотелиальной дисфункции, так как данное заболевание создает реальную угрозу, особенно для людей, склонных к СППС.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Янь Гао, Нанетт Х. Епископство, Хун-вэй Чэнь, Цзян-тао Ли, Юй-лан Хуан, Хэ-сюнь Хуан
BMC Cardiovascular Disorders201818:234
Аннотация
Введение
С внедрением первичной чрескожной коронарной ангиопластики (ПЧКА) количество случаев синдрома постповреждения сердца (СППС) среди пациентов с острым инфарктом миокарда (ОИМ), прошедших лечение с применением ПЧКА, уменьшилось. Тем не менее патогенез заболевания по-прежнему не до конца изучен. В отличие от предыдущих исследований в данной публикации представлены новые данные о механизме развития СППС после ПЧКА.
Описание случая
У мужчины 45 лет через 3 часа после ПЧКА, назначенной для лечения ОИМ, развился СППС. При последующем проведении коронарной ангиографии (КАГ) было выявлено неполное восстановление кровотока (TIMI ≤ 2) в поврежденных артериях. Выраженных признаков тромбоза стента или ятрогенной травмы, которая могла возникнуть после вмешательства, не обнаружено. Тем не менее, в ходе длительного мониторинга лабораторных показателей крови обнаружено, что уровень высокочувствительного С-реактивного белка (вчСРБ) имеет динамику, схожую с динамикой количества нейтрофилов и уровня тропонина Т. Это может свидетельствовать о взаимосвязи между коронарной микроваскулярной дисфункцией (КМД), вызванной ПЧКА, и механизмом развития СППС.
Вывод
В данном клиническом случае описывается пациент, у которого наблюдалась ярко выраженная воспалительная реакция и коронарная микроваскулярная дисфункция (КМД), возникшая в результате ишемического реперфузионного повреждения миокарда после ОИМ. У пациента также присутствуют факторы риска развития эндотелиальной дисфункции. Существует потенциальная взаимосвязь между СППС и эффективностью ПЧКА у пациента с ОИМ, предрасположенного к повреждениям эндотелия.
Ключевые слова
- Синдром Дресслера (синдром постповреждения сердца)
- Острый инфаркт миокарда
- Первичная чрескожная коронарная ангиопластика
- Коронарная микроваскулярная дисфункция
Синдром постповреждения сердца (сидром Дресслера) представляет собой аутоиммунную реакцию, которая возникает в результате различных повреждений сердца, в том числе некроза миокарда, травмы сердца или операции на сердце. С внедрением первичной чрескожной коронарной ангиопластики (ПЧКА) процентная доля вновь зарегистрированных случаев СППС, возникших после ПЧКА, снизилась до 0,5%. Тем не менее патогенез СППС остается неизвестным [1]. В данной публикации описывается необычный клинический случай раннего наступления СППС после ПЧКА для лечения ОИМ, а также послеоперационной коронарной микроваскулярной дисфункции (КМД). Далее будет обсужден вероятный патогенез и возможные методы снижения риска СППС после ПЧКА.
Описание случая
У мужчины 45 лет с факторами риска эндотелиальной дисфункции (в том числе курение и гиперлипидемия) в течение 3 суток наблюдались типичные приступы стенокардии. Характерные динамические изменения показателей электрокардиограммы (ЭКГ) и маркера некроза миокарда cTnT (тропонина Т) указывали на инфаркт миокарда с подъемом сегмента ST. Срочная коронарная ангиография (КАГ) выявила полную окклюзию срединной огибающей артерии (рис. 1а). В проксимальную часть левой срединной огибающей артерии (p-LCX) был введен стент с лекарственным покрытием. Успешность ПЧКА подтверждалась результатами последующего ангиографического исследования (рис. 1b). Спустя три часа, у пациента появились одышка и постоянные боли в плевральной области. На ЭКГ был обнаружен значительный подъем сегмента ST вогнутой формы и депрессия сегмента PR (рис. 2a). Дополнительная КАГ была проведена через 33 часа после ПЧКА. При этом не было выявлено признаков тромбоза стента или выраженной ятрогенной травмы, вызванной вмешательством. Тем не менее в инфаркт-зависимых артериях отмечены замедление кровотока (TIMI ≤ 2) (рис. 1c) и высокий показатель перфузии миокарда (TMPFEC = 140 кадров при скорости съемки 30 кадров в секунду). Устойчивый подъем сегмента ST на ЭКГ и увеличение уровня тропонина Т при отсутствии повторного подъема уровня КФК-ММ, скорее всего, свидетельствовал о том, что устойчивое очаговое повреждение миокарда могло быть обусловлено коронарной микроваскулярной дисфункцией (КМД). В последние годы исследования резервного коронарного кровотока (РКК) с помощью внутрикоронарного допплеровского датчика кровотока и позитронно-эмиссионной томографии (ПЭТ) считаются общепринятым стандартным методом количественной оценки нарушений коронарной микроциркуляции. Тем не менее данный метод является технологически сложным и дорогостоящим, и не применялся в данном случае, учитывая состояние пациента и особенности процесса лечения. Томография грудной клетки выявила небольшое количество плеврального выпота и интерстициальную инфильтрацию обоих легких (рис. 2b, c), а ультразвуковое исследование показало небольшое количество жидкости в перикарде с затуханием движения задней стенки (рис. 2d, e). Анализ крови выявил непрерывное увеличение содержания вчСРБ. Количество нейтрофилов и уровень тропонина Т повышались параллельно с уровнем вчСРБ на ранней и поздней стадиях СППС соответственно (рис. 3). Скорость оседания эритроцитов (СОЭ) составляла 83 м/с, то есть была значительно выше нормы и представляла собой дополнительный маркер воспаления. В то же время уровень антистрептолизина О (АСЛ О) и антинуклеарных антител (АНА), считающихся маркерами ревматизма и туберкулеза, а также уровень натрийуретического пептида типа В (ВNP, 107 пг/мл) оставались в пределах нормы. Таким образом было установлено развитие СППС у пациента. После прохождения курса лечения противоишемическими препаратами и аспирином в дозировке, достаточной для подавления воспаления, пациент не испытывал симптомов заболевания в течение дальнейшего нахождения в стационаре. Объем перикардиального выпота постепенно снизился, уровень вчСРБ и тропонина Т в сыворотке крови снизился до нормальных значений через 3 недели после возникновения СППС.
 Рисунок 1. А) Предоперационный снимок: коронарная ангиография показала полную срединную окклюзию огибающей артерии (показано стрелкой). B) послеоперационный снимок: в полость огибающей артерии (p-LCX) успешно введен стент с лекарственным покрытием; последний ангиографический снимок демонстрирует благоприятный результат. С) Последующая ангиография, проведенная спустя 33 часа после наступления СППС, не выявила тромбозов стента; в то же время, наблюдалось значительное замедление кровотока (TIMI ≤ 2)
Рисунок 1. А) Предоперационный снимок: коронарная ангиография показала полную срединную окклюзию огибающей артерии (показано стрелкой). B) послеоперационный снимок: в полость огибающей артерии (p-LCX) успешно введен стент с лекарственным покрытием; последний ангиографический снимок демонстрирует благоприятный результат. С) Последующая ангиография, проведенная спустя 33 часа после наступления СППС, не выявила тромбозов стента; в то же время, наблюдалось значительное замедление кровотока (TIMI ≤ 2) Рисунок 2. А) Спустя 24 часа после СППС, ЭКЗ с 12 отведениями выявила обширные вогнутые подъемы сегментов ST; B) и С) Томографическое исследование грудной клетки показало небольшое количество плеврального выпота и интерститиальную инфильтрацию обоих легких. D) и E): Ультразвуковое исследование выявило небольшое количество жидкости в перикарде с затуханием движения задней стенки
Рисунок 2. А) Спустя 24 часа после СППС, ЭКЗ с 12 отведениями выявила обширные вогнутые подъемы сегментов ST; B) и С) Томографическое исследование грудной клетки показало небольшое количество плеврального выпота и интерститиальную инфильтрацию обоих легких. D) и E): Ультразвуковое исследование выявило небольшое количество жидкости в перикарде с затуханием движения задней стенки Рисунок 3. Анализ крови выявил параллельное увеличение концентрации тропонина T и вчСРБ на ранней и поздней стадии ПОС соответственно
Рисунок 3. Анализ крови выявил параллельное увеличение концентрации тропонина T и вчСРБ на ранней и поздней стадии ПОС соответственноОбсуждение и выводы
Термины «синдром постповреждения сердца (СППС)» и «постинфарктный синдром» используются для обозначения раннего проявления плевроперикардита после ОИМ и последующей катетеризации артерий. Данное состояние, которое также называют «синдромом Дресслера», обычно развивается спустя 3-4 недели после ОИМ. Согласно распространенной гипотезе, аутоиммунная реакция против антигенов сердца приводит к обширному воспалению перикарда и развитию перикардита [2]. С внедрением ПЧКА заболеваемость синдромом Дресслера (CППС) стала снижаться. Хотя патогенез этого синдрома остается неизученным, предполагают, что аутоиммунная реакция, провоцируемая некрозом миокарда, запускается еще до проведения ПЧКА [3]. Кроме того, могут повреждаться клетки мезотелия перикарда и (или) плевры, приводя к развитию синдрома [4]. В данном исследовании описан редкий случай СППС в сочетании с КМД после ПЧКА. Как и клинический случай, описанным Джинсоком Парком в 2010 году [5], описанный нами клинический случай СППС после ЧКА характеризуется нетипично ранним наступлением, а также присутствием плевральных болей, небольшого повышения температуры тела, а также перикардического и (или) плеврального выпота.
К тому же, данный случай, по-видимому, свидетельствовал о связи увеличения уровня маркеров воспаления у пациентов, перенесших ОИМ и СППС, с развитием КМД после ПЧКА и последующим развитием стойких очаговых повреждений миокарда. Как показывают исследования на животных [6] и клинические исследования [7], активизация нейтрофилов и высвобождение провоспалительных цитокинов приводят к повреждению микроваскулярных клеток эндотелия и клеток мезотелия перикарда и плевры. Эти процессы могут стать причиной развития КМД и плевроперикардита наряду с ишемией миокарда и реперфузией. Кроме того, Г. М. Фролих et al. [8] и Л. Ф. Робберс et al. [9] показали, что воспалительные реакции, вызванные реперфузионными повреждениями, стимулируют продукцию хемокинов, цитокинов и адгезивных молекул, что, по-видимому, связано с КМД и закупоркой коронарных артерий. Это препятствует оттоку крови и может привести к развитию гематомы миокарда. Согласно отчету Джинсока Парка et al. [5], при анализе перикардиального выпота у пациента с СППС после успешной ПЧКА было обнаружено некоторое количество эритроцитов. Это свидетельствовало о том, что гематома миокарда, развившаяся вследствие послеоперационной КМД, способствует истечению крови в перикардиальное пространство и таким образом играет заметную роль в развитии СППС.
Помимо ОИМ к факторам риска коронарной микроциркулярной дисфункции относят курение, ожирение, гиперлипидемию, гиперурикемию, диабет и хронические заболевания почек. Установлено, что длительное присутствие сигналов, стимулирующих повреждение эндотелия, может способствовать метилированию ДНК и привести к изменению структуры и функций хромосом. Кроме того, такое воздействие может увеличивать эффект стресс-сигналов в различных сигнальных путях, связанных с повреждением эндотелия [10]. У описываемого пациента нарушение хромосомной структуры клеток эндотелия могло быть вызвано длительным курением, поскольку он оказался восприимчивым к повреждениям эндотелия с «эффектом метаболической памяти». Такая ситуация может усилить ишемическое/реперфузионное повреждение эндотелия после ПЧКА, что может привести к серьезному ослаблению структуры и резерва коронарного кровотока / дистолической функции. В исследовании Маттео et al. [11] сообщалось, что хронические заболевания почек могут способствовать развитию микроциркулярной дисфункции и уменьшению дистолической дисфункцию и недостаточности функционального резерва сердца. У описанного нами пациента отмечался повышенный уровень тропонина Т, который сохранялся даже после деблокирования инфаркт-связанной артерии (ИСА) посредством ЧКА. Возможно, это стало следствием очагового некроза миокарда, вызванного усугубленной табакокурением микроциркулярной дисфункцией и снижением перфузии сосудов миокарда.
Кроме того, в описанном случае уровень маркеров воспаления совпадал со стойким повышением уровня тропонина Т, который, вероятно, был связан с длительным очаговым повреждением миокарда, вызванным КМД. Это подтверждает результаты недавнего исследования Г. Вилахура et al [12], в котором сообщается, что обширный некроз ишемических кардиомиоцитов в миокарде с недостатком кровообращения может активировать внутренний иммунный ответ, провоцируя компенсаторное воспаление. В настоящее время взаимосвязь между периоперационным СППС и КМД на фоне ОИМ нуждается в дальнейшем изучении.
Данные, представленные в описании данного клинического случая, свидетельствуют о том, что выраженная воспалительная реакция и КМД, вызванная послеоперационной ишемической реперфузионной травмой, вероятно, связаны с возникновением СППС. Поэтому следует обращать внимание на выраженную воспалительную реакцию и КМД, вызванную ишемической реперфузионной травмой у перенесших ОИМ пациентов с факторами риска развития эндотелиальной дисфункции, так как данное заболевание создает реальную угрозу, особенно для людей, склонных к СППС.
Список использованной литературы
- Jaworska-Wilczynska M, Abramczuk E, Hryniewiecki T. Postcardiac injury syndrome. Med Sci Monit. 2011;17:13–4. ViewArticleGoogle Scholar
- Dressler W. The postmyocardial infarction syndrome. AMA Arch Int Med. 1959;103:28–42. ViewArticleGoogle Scholar
- Setoyama T, Furukawa Y, Abe M, Nakagawa Y, Kita T, Kimura. Acute pleuropericarditis after coronary stenting: a case report. Circ J. 2006;70:358–61. ViewArticleGoogle Scholar
- Imazio M, Brucato A, Rovere ME, Adler Y. Contemporary features, risk factors, and prognosis of the postpericardiotomy syndrome. Am J Cardiol. 2011;108:1183–7. ViewArticleGoogle Scholar
- Park JS, Kim DH, Choi WG, Woo SI, Kwan J, Park KS, Lee WH, Lee JJ, Choi YJ. Postcardiac injury syndrome after percutaneous coronary intervention. Yonsei Med J. 2010;51:284–6. ViewArticleGoogle Scholar
- Neumann FJ, Ott I, Gawaz M, Richardt G, Holzapfel H, Jochum M, Schömig A. Cardiac release of cytokines and inflammatory responses in acute myocardial infarction. Circulation. 1995;92:748–55. ViewArticleGoogle Scholar
- Carbone F, Nencioni A, Mach F, Vuilleumier N, Montecucco F. Pathophysiological role of neutrophils in acute myocardial infarction. Thromb Haemost. 2013;110:501–14. ViewArticleGoogle Scholar
- Frohlich GM, Meier P, White SK, Yellon DM, Hausenloy DJ. Myocardial reperfusion injury: looking beyond primary PCI. Eur Heart J. 2013;34:1714–22. ViewArticleGoogle Scholar
- Robbers LF, Eerenberg ES, Teunissen PF, Jansen MF, Hollander MR, Horrevoets AJ, Knaapen P, Nijveldt R, Heymans MW, Levi MM, van Rossum AC, Niessen HW, Marcu CB, Beek AM, van Royen N. Magnetic resonance imaging-defined areas of microvascular obstruction after acute myocardial infarction represent microvascular destruction and haemorrhage. Eur Heart J. 2013;34:2346–53. ViewArticleGoogle Scholar
- Roberts AC, Porter KE. Cellular and molecular mechanisms of endothelial dysfunction in diabetes. Diab Vasc Dis Res. 2013;10(6):472–82. ViewArticleGoogle Scholar
- Tebaldi M, Biscaglia S, Fineschi M, Manari A, Menozzi M, Secco GG, Di Lorenzo E, D’Ascenzo F, Fabbian F, Tumscitz C, Ferrari R, Campo G, Vilahur G, Badimon L. Fractional flow reserve evaluation and chronic kidney disease: analysis from a multicenter Italian registry (the FREAK study). Catheter Cardiovasc Interv. 2016;88(4):555–62. ViewArticleGoogle Scholar
- Vilahur G, Badimon L. Ischemia/reperfusion activates myocardial innate mmune response: the key role of the toll-like receptor. Front Physiol. 2014;5:496. ViewArticleGoogle Scholar





