1882
08 Ноября 2021
Авторское право © 2018, Eyup Avci, Tuncay Kiris, Aykan Çelik, Eser Variş, Fatma Kayaalti Esin, Diyar Köprülü, Hasan Kadi (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эюп Авчи, Тункай Кирис, Айкан Челик, Эсер Вариш, Фатьма Каяалти Эсин, Диар Копрулу, Хасан Кади
BMC Cardiovascular Disorders201818:226
Аннотация
Введение
Прогностическое значение изменений среднего объема тромбоцитов (mean platelet vo...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эюп Авчи, Тункай Кирис, Айкан Челик, Эсер Вариш, Фатьма Каяалти Эсин, Диар Копрулу, Хасан Кади
BMC Cardiovascular Disorders201818:226
Аннотация
Введение
Прогностическое значение изменений среднего объема тромбоцитов (mean platelet vo...
Авторское право © 2018, Eyup Avci, Tuncay Kiris, Aykan Çelik, Eser Variş, Fatma Kayaalti Esin, Diyar Köprülü, Hasan Kadi (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эюп Авчи, Тункай Кирис, Айкан Челик, Эсер Вариш, Фатьма Каяалти Эсин, Диар Копрулу, Хасан Кади
BMC Cardiovascular Disorders201818:226
Аннотация
Введение
Прогностическое значение изменений среднего объема тромбоцитов (mean platelet volume – MPV) в период госпитализации у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное чрескожное коронарное вмешательство (пЧКВ), в настоящий момент не оценено. Целью настоящего исследования было установление связи между изменениями MPV в период стационарного лечения и летальностью у этих пациентов.
Методы
В данное ретроспективное исследование было включено 480 пациентов, перенесших инфаркт миокарда с подъемом сегмента ST. Пациенты были разделены на две группы: выжившие (n = 370) и невыжившие (n = 110). MPV оценивали при поступлении и через 48–72 ч. Изменение MPV (MPV через 48–72 ч минус MPV при поступлении) определяли как ΔMPV.
Результаты
При последующем наблюдении летальность в отдаленном периоде составила 23%. У невыживших значение ΔMPV было выше, чем у выживших (0,37 (− 0,1–0,89) против 0,79 (0,30–1,40) фл, p <0,001). Высокое значение ΔMPV было независимым предиктором летальности от всех причин (отношение рисков (ОР): 1,301 [1,070–1,582], p = 0,008). Кроме того, значение AUC (area under curve – площадь под кривой) летальности в отдаленном периоде в многомерной модели, включающей возраст, фракцию выброса левого желудочка (ФВЛЖ), класс по Киллипу и наличие в анамнезе инсульта/ТИА (транзиторной ишемической атаки) составило 0,781 (95% ДИ: 0,731–0,832, p < 0,001). При добавлении в многомерную модель ΔMPV, значение AUC составило 0,800 (95% ДИ: 0,750–0,848, z = 2,256, разность значений p = 0,0241, рис. 1). Кроме того, добавление ΔMPV к многомерной модели было связано со значительным увеличением показателя улучшения перераспределения (Net Reclassification Improvement), который оценивался в 24,5% (p = 0,027) и показателя улучшения интегрированной дискриминации (integrated discrimination improvement), который составил 0,014 (p = 00198).
Выводы
Увеличение MPV в период госпитализации у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших пЧКВ, связано с летальностью в отдаленном периоде.
Ключевые слова
Тромбоциты играют важную роль как в запуске, так и в прогрессировании острых коронарных синдромов (ОКС) [1, 2]. Предыдущие исследования показали, что тромбоциты обладают провоспалительной активностью независимо от их участия в гемостазе и внутрисосудистом тромбообразовании [3,4, 5]. Средний объем тромбоцитов (MPV) является показателем активации тромбоцитов [6]. Большие тромбоциты более активны и обладают более выраженным тромботическим потенциалом, чем малые. Кроме того, они более мощные, имеют более высокий уровень тромбоксана A2 и больше гликопротеиновых рецепторов Ib и IIb/IIIa. Благодаря этому агрегация больших тромбоцитов с коллагеном происходит быстрее, чем агрегация малых тромбоцитов [7].
За последние годы многочисленные исследования показали, что повышенное значение MPV у пациентов с ОКС при поступлении в стационар было связано с отдаленной летальностью [8, 9, 10]. Более того, было обнаружено, что увеличение MPV в период стационарного лечения является предиктором летальности как у пациентов с инфарктом миокарда без подъема сегмента ST, так и у пациентов в критическом состоянии [11, 12]. Данные о связи изменения MPV в период стационарного лечения с летальностью у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное чрескожное коронарное вмешательство (ЧКВ), отсутствуют.
Целью настоящего исследования было изучение связи между увеличением MPV в период стационарного лечения с отдаленной летальностью у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ.
Методы
Исследуемая популяция
Мы включили в исследование 514 пациентов с инфарктом миокарда с подъемом сегмента ST, которые перенесли первичное ЧКВ с января 2008 г. по июнь 2015 г. Пациенты со злокачественными новообразованиями, инфекционными или гематологическими заболеваниями, а также пациенты с неполными данными были исключены из настоящего исследования. Итоговый анализ включал 480 пациентов. Разрешение на проведение исследования было получено в местном этическом комитете. Диагноз «инфаркт миокарда с подъемом сегмента ST» ставили на основании типичной ангинозной боли, продолжавщейся >30 минут, с повышением уровня сердечных ферментов (тропонина I) и данных ЭКГ: подъема сегмента ST >1 мм в двух и более отведениях подряд или вновь появившаяся блокада левой ножки пучка Гиса (ЛНПГ) [13]. Мы определяли артериальную гипертензию (АГ) как предшествующее применение антигипертензивных препаратов, систолическое давление >140 мм рт. ст. или диастолическое давление >90 мм рт. ст. и сахарный диабет как применение инсулина или противодиабетических препаратов, или уровень глюкозы натощак >126 мг/дл. Диагноз «гиперхолестеринемия» выставляли при значении общего холестерина ≥200 мг/дл. Курение определяли как курение или отсутствие курения в настоящее время. Данное исследование проводилось в соответствии с Хельсинкской Декларацией.
Мы определяли общую летальность как смерть от любых причин в период последующего наблюдения и рассматривали ее в качестве первичной конечной точки. Кроме того, в анализ были включены повторная реваскуляризация, госпитализация по поводу сердечной недостаточности, инсульт/транзиторная ишемическая атака (ТИА) и 30-дневная летальность. Данные за период последующего наблюдения получали из медицинской документации стационаров, от пациентов и их родственников.
Методы
Все пациенты получали лечение согласно текущим рекомендациям. Было проведено 13 первичных ЧКВ с использованием стандартных методик с использованием трансфеморального доступа. Вмешательства проводили два опытных специалиста в области интервенционной кардиологии. Стратегии лечения каждого пациента оставались на усмотрение интервенционного кардиолога. Данные по ангиографии получали из документации лаборатории катетеризации сердца. Инфаркт-связанную артерию (ИСА) оценивали по классификации TIMI (thrombolysis in myocardial infarction - тромболизис при инфаркте миокарда). Мы определяли инвазивную процедуру в острой фазе как успешную при уменьшении обструкции и стеноза ИСА до <20% с оценкой кровотока TIMI 3 сразу после первичного ЧКВ. После ангиопластики всех пациентов переводили в отделение интенсивной терапии. В соответствии с текущими рекомендациями проводили двойную антитромбоцитарную терапию, пациенты получали бета-блокаторы, ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов ангитензина (БРА) и статины [13].
После измерения конечно-диастолического и конечно-систолического объемов левого желудочка (ЛЖ) подсчитывали фракцию выброса левого желудочка (ФВЛЖ) по апикальному четырехкамерному и двухкамерному срезам с помощью модифицированного метода Симпсона.
Забор образцов крови, общий и биохимический анализы крови
Для оценки MPV отбирали образцы периферической крови при поступлении до введения антитромбоцитарных препаратов и через 48–72 ч. после поступления. Образцы крови собирали в стандартизированные пробирки, содержащие порошок этилендиаминтетраацетата дикалия в качестве антикоагулянта, и хранили при комнатной температуре. Все показатели анализировали в течение одного часа после сбора образцов. Изменение MPV определяли как ΔMPV (MPV через 48–72 ч. минус MPV при поступлении). Для биохимического исследования при поступлении отбирали дополнительные пробы образцы крови. Их анализ проводили по стандартным методикам.
Статистический анализ
Статистический анализ выполняли с помощью программы SPSS (версия 16.0; SPSS Inc., Чикаго, Иллинойс, США). Переменные с нормальным распределением анализировали с помощью критерия Колмогорова - Смирнова и представляли как среднее арифметическое ± стандартное отклонение, тогда как переменные без нормального распределения были представлены как медианные значения с размахом. Категориальные переменные были представлены в виде числа и процентной доли. Группы сравнивали с помощью критерия хи-квадрат для категориальных переменных и t-критерия Стьюдента или U-критерия Манна - Уитни для непрерывных переменных. Чтобы оценить, являлось ли значение ΔMPV независимым предиктором летальности, проводили многофакторный регрессионный анализ Кокса. Факторы с p-значением <0,1 при однофакторном анализе были включены в многофакторный регрессионный анализ Кокса. Прогностическую ценность многомерной модели и сочетания ΔMPV с многомерной моделью анализировали путем сравнения площадей под ROC-кривой (receivers operating characteristic curve - рабочая характеристическая кривая). AUC каждой модели, которую анализировали с помощью программы NCSS 12, сравнивали с помощью критерия Де Лонга [14]. Кроме того, увеличение дискриминационной способности после добавления ΔMPV в многомерную модель также оценивали с помощью показателей улучшения перераспределения (NRI - Net Reclassification Improvement) и интегрированного улучшения дискриминационной способности (Integrated Discrimination Improvement) [15]. Различия расценивали как значимые при уровне двустороннего p-значения < 0,05.
Результаты
Исходные характеристики
Исходные демографические и клинические характеристики представлены в таблице 1. Медиана длительности последующего наблюдения составляла 65,9 (41,9–80,4) месяцев. Невыжившие были значительно старше (68 ± 13 против 58 ± 11, p < 0,001). Сахарный диабет, АГ, инсульт/ТИА чаще встречались у невыживших, чем у выживших (таблица 1). Частота ИМ с классом по Киллипу ≥2 и многососудистое поражение чаще наблюдались у невыживших, чем у выживших. По сравнению с выжившими доля женщин среди невыживших была больше. Показатели использования ИАПФ/БРА после выписки из стационара у невыживших были ниже, чем у выживших.
Таблица 1. Исходные характеристики исследуемой популяции
Лабораторные показатели
Лабораторные показатели представлены в таблице 2. Уровень креатинина сыворотки был выше у невыживших. Уровень гемоглобина при поступлении был ниже у невыживших, чем у выживших. По количеству тромбоцитов как при поступлении, так и через 48–72 ч. значимых различий между группами не наблюдалось. MPV через 48–72 ч. был выше у невыживших, чем у выживших. У невыживших было более высокое значение показателя ΔMPV, чем у выживших [0,79 (0,30–1,40) против 0,37 (− 0,1–0,89), p < 0,001]. Исходные значения MPV были сопоставимы в обеих группах.
Таблица 2. Результаты лабораторных анализов в исследуемой популяции
ФВЛЖ у невыживших была значительно ниже, чем у выживших (41 ± 10 против 45 ± 9, p < 0,001).
Клинические исходы и ΔMPV
Показатель тридцатидневной летальности у невыживших составил 20% (таблица 1). Частота РЦС, инсультов и ИМ были сопоставимыми в обеих группах. У невыживших отмечалась более высокая частота новых случаев госпитализации по поводу СН, чем у выживших (14% против 2%, p < 0,001).
ΔMPV (ОР: 1,301 [1,070–1,582], p = 0,008), класс по Киллипу ≥ 2, ФВЛЖ, инсульт/ТИА в анамнезе и возраст являлись независимыми предикторами отдаленной летальности при многофакторном анализе (таблица 3).
Таблица 3. Однофакторный и многофакторный анализ летальности от всех причин с помощью модели пропорциональных рисков Кокса
Анализ ΔMPV с помощью ROC-кривой показал, что площадь под кривой (AUC) прогноза отдаленной летальности составляет 0,646 (рис. 1). Кроме того, значение AUC (area under curve – площадь под кривой) летальности в отдаленном периоде в многомерной модели, включающей возраст, фракцию выброса левого желудочка (ФВЛЖ), класс по Киллипу и наличие в анамнезе инсульта/ТИА, составило 0,781 (95% ДИ: 0,731–0,832, p < 0,001). При добавлении ΔMPV в многомерную модель, значение AUC составило 0,800 (95% ДИ: 0,750–0,848, z = 2,256, разность p = 0,0241, рис. 1). Кроме того, добавление ΔMPV к многомерной модели было связано со значительным увеличением показателя улучшения перераспределения (Net Reclassification Improvement), который оценивался в 24,5% (p = 0,027) и показателем улучшения интегрированной дискриминации (Integrated Discrimination Improvement), который составил 0,014 (p = 00198). Кривые выживаемости Каплана-Майера согласно точке отсечения ΔMPV (≥ 0,44 фл и < 0,44 фл) представлены на рис. 2. По результатам анализа в подгруппе, проведенного в соответствии с этой точкой отсечения, показатели 30-дневной летальности (2% против 6%, p = 0,009), отдаленной летальности (16% против 30%, p < 0,001) и госпитализации по поводу сердечной недостаточности (3% против 7%, p = 0,028) в группе с высокими значениями ΔMPV были выше, чем в группе с низкими значениями ΔMPV. Не наблюдалось статистически значимых различий между группами в отношении повторного инфаркта миокарда (8% против 8%, p = 0,756), инсульта (3% против 3%, p = 0,998) и РЦС (12% против 12%, p = 0,974).
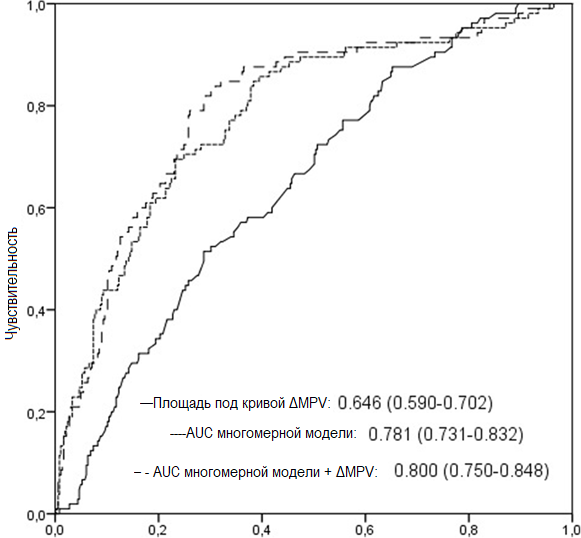 Рисунок 1. ROC-кривые прогнозирования общей летальности от всех причин для ΔMPV, многомерной модели и многомерной модели плюс ΔMPV
Рисунок 1. ROC-кривые прогнозирования общей летальности от всех причин для ΔMPV, многомерной модели и многомерной модели плюс ΔMPV
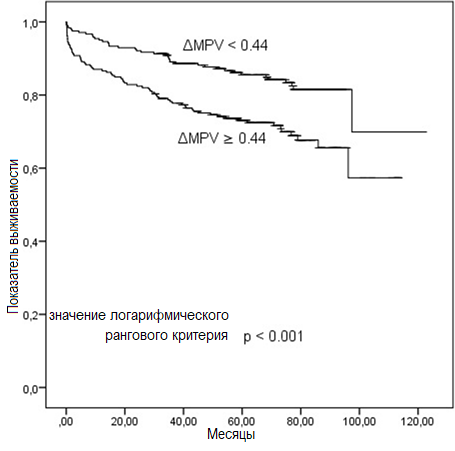 Рисунок. 2. Кривые выживаемости Каплана-Майера летальности от всех причин по ΔMPV
Рисунок. 2. Кривые выживаемости Каплана-Майера летальности от всех причин по ΔMPV
Обсуждение
Насколько нам известно, данное исследование является первым исследованием, проведенным с целью изучения связи между увеличением MPV в период стационарного лечения и отдаленной летальностью у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ. В настоящем исследовании мы обнаружили, что увеличение MPV в период стационарного лечения через 48–72 ч. после поступления связано с отдаленной летальностью у этих пациентов.
Grabovac et al. продемонстрировали увеличение MPV через 72 ч. у пациентов с инфарктом миокарда с подъемом сегмента ST [16]. Присутствие больших тромбоцитов является признаком повышенной активации тромбоцитов. Эти тромбоциты в основном гиперактивированы и содержат большое количество гранул с внутриклеточным тромбоксаном A2, мембранными белками клеточной адгезии, такими как P-селектин и GPIIIa, последний из которых является индикатором протромботического статуса. Кроме того, у этих тромбоцитов повышены агрегация в ответ на коллаген или АДФ, высвобождение тромбоксана и экспрессия мембранного P-селектина или GP1b и GPIIb/IIIa [17, 18, 19]. Существует связь между MPV и провоспалительными, а также протромботическими состояниями, при которых тромбопоэтин и различные воспалительные цитокины, например, интерлейкин (ИЛ) 1, ИЛ-3, ИЛ-6 и фактор некроза опухоли (ФНО) альфа, формируют тромб. Кроме того, показано, что MPV является маркером воспаления при заболеваниях с активным воспалением [20, 21]. Вклад тромбоцитов в воспаление, который заключается в связывании с моноцитами и их активации, был продемонстрирован на пациентах с ИМ [22, 23].
Остается неясным, что происходит с циркулирующими увеличенными тромбоцитами после их выхода из костного мозга. Тромбоциты, вновь образовавшиеся из мегакариоцита костного мозга, по размеру обычно больше [18]. На дифференцировку и созревание мегакариоцита требуется примерно 4–5 дней [18, 19]. Формирование тромбоцитов de novo и освобождение их из этих зрелых мегакариоцитов занимает 24 ч. Таким образом, маловероятно, что раннее увеличение MPV после ИМ является только результатом формирования новых тромбоцитов большего размера в костном мозге. Селезенка человека служит резервуаром циркулирующих тромбоцитов (около одной трети всех тромбоцитов). Кроме того, MPV тромбоцитов человеческой селезенки примерно на 20% больше, чем MPV циркулирующих тромбоцитов. Следовательно, селезенка может быть резервуаром крупных тромбоцитов, и она может быть ответственна за быстрое изменение количества циркулирующих крупных тромбоцитов в стрессовых условиях, в том числе при интенсивной физической нагрузке и стимуляции цитокинами или катехоламинами [24, 25, 26, 27].
В предыдущем исследовании было продемонстрировано, что механизм быстрого увеличения MPV циркулирующих тромбоцитов заключается в выходе тромбоцитов селезенки вскоре после ИМ [28]. Выход из селезенки моноцитов и тромбоцитов для активизации воспалительного процесса играет ключевую роль в системном ответе на ишемическое повреждение. Еще один элемент кардиоспленической оси – селезеночные тромбоциты [28]. В указанном исследовании обнаружилось, что спленэктомия препятствует данным изменениям после ИМ у мышей [28]. Не ясно, что отвечает за инициацию выхода, высвобождение и активацию селезеночных тромбоцитов после ИМ. Возможно, за это отвечают катехоламины и ангиотензин II. Swirski et al. показали, что эти показатели повышаются у пациентов с острым ИМ [29]. Таким образом, повышенные уровни ангиотензина II и катехоламинов в условиях острого ИМ могут вызывать выход селезеночных тромбоцитов.
Показано, что тромбоциты играют важную роль в воспалении [30]. Провоспалительные свойства тромбоцитов опосредуются через взаимодействие с большими лейкоцитами [28]. У пациентов с острым ИМ увеличение MPV, ассоциированное как с воспалением, так и с прокоагулирующей активностью, связано с риском тромбоза стента, отсутствием восстановления кровотока из-за микротромбов или повреждения сосудов микроциркуляторного русла после первичного ЧКВ, повторным инфарктом миокарда, большой площадью инфаркта, отдаленной летальностью и летальностью в ближайшем периоде [31, 32, 33, 34].
Kiriş et al. продемонстрировали связь между повышением MPV в течение 24 ч. после поступления и летальностью у пациентов с инфарктом миокарда без подъема сегмента ST [11]. В этом исследовании у пациентов с высокими значениями ΔMPV (> 0,62 фл) были более высокие показатели 30-дневной и отдаленной летальности – так же, как было установлено и в настоящем исследовании. Различия между точками отсечения могут быть обусловлены разными клиническими условиями (например, инфаркт миокарда с подъемом сегмента ST и инфаркт миокарда без подъема сегмента ST) и применяемыми стратегиями лечения. В другом исследовании, опубликованном Wang et al., было продемонстрировано, что последовательные изменения MPV были связаны с более высоким классом по Киллипу и феноменом no-reflow (феномен невосстановленного кровотока) после ЧКВ у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ [35]. Значение MPV на исходном уровне, через 30, 60, 90 дней и через 1, 2 и 3 года после ЧКВ анализировали у пациентов, не проходивших специального отбора [36]. В этом исследовании повышение MPV со временем было связано с отдаленной летальностью. В отличие от их исследования, мы изучали связь между повышением MPV в период стационарного лечения и летальностью у пациентов с подъемом сегмента ST, перенесших первичное ЧКВ. Мы обнаружили, что у этих пациентов увеличение MPV в период стационарного лечения после поступления связано с летальностью.
На MPV могут влиять лекарственные препараты, в том числе ИАПФ/БРА, бета-блокаторы, статины и антитромбоцитарные препараты [37, 38]. Что касается ΔMPV, мы не обнаружили никаких различий между пациентами, получающими эти препараты, и пациентами, которые их не получали. Более того, в нашем исследовании применение тирофибана не влияло на ΔMPV (данные не представлены). Чтобы определить влияние этих препаратов на ΔMPV, требуются дальнейшие исследования.
Высокое значение ΔMPV может указывать на повышенную тромбогенность и активность тромбоцитов. Кроме того, высокое значение ΔMPV может свидетельствовать о повышенном тромбообразовании и о воспалении. Таким образом, увеличение размера тромбоцитов способствует формированию тромба. Кроме того, большие тромбоциты могут приводить к вазоконстрикции и дисфункции эндотелия. Таким образом, вышеупомянутые связи могут являться механизмом развития летальных исходов у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ.
Настоящее исследование имеет несколько ограничений. В данном ретроспективном исследовании использовалась выборка относительно малого размера, что препятствует точному определению взаимоотношений между ΔMPV и исходами. В настоящем исследовании не изучали воздействие разных нагрузочных доз пероральных антитромбоцитарных препаратов на MPV. Кроме того, мы не могли проанализировать предшествующее применение нестероидных противовоспалительных средств до ЧКВ. У пациентов с СД, которые получали инкретин, уровень больших сердечно-сосудистых событий был значительно ниже, чем у тех, которые не получали этот препарат [39, 40]. Поскольку данные по применению инкретина у многих пациентов отсутствовали, в настоящем исследовании невозможно оценить его влияние на летальность. Более того, мы не оценивали воздействие этого препарата на молекулы, участвующие в стабилизации атеросклеротической бляшки. Наконец, на эти результаты могла повлиять систематическая ошибка отбора.
Выводы
Увеличение MPV в период стационарного лечения у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ, было связано с летальностью в отдаленном периоде. Мы предполагаем, что повторные определения MPV в период стационарного лечения могут улучшить стратификацию риска у этих пациентов.
Список литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эюп Авчи, Тункай Кирис, Айкан Челик, Эсер Вариш, Фатьма Каяалти Эсин, Диар Копрулу, Хасан Кади
BMC Cardiovascular Disorders201818:226
Аннотация
Введение
Прогностическое значение изменений среднего объема тромбоцитов (mean platelet volume – MPV) в период госпитализации у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное чрескожное коронарное вмешательство (пЧКВ), в настоящий момент не оценено. Целью настоящего исследования было установление связи между изменениями MPV в период стационарного лечения и летальностью у этих пациентов.
Методы
В данное ретроспективное исследование было включено 480 пациентов, перенесших инфаркт миокарда с подъемом сегмента ST. Пациенты были разделены на две группы: выжившие (n = 370) и невыжившие (n = 110). MPV оценивали при поступлении и через 48–72 ч. Изменение MPV (MPV через 48–72 ч минус MPV при поступлении) определяли как ΔMPV.
Результаты
При последующем наблюдении летальность в отдаленном периоде составила 23%. У невыживших значение ΔMPV было выше, чем у выживших (0,37 (− 0,1–0,89) против 0,79 (0,30–1,40) фл, p <0,001). Высокое значение ΔMPV было независимым предиктором летальности от всех причин (отношение рисков (ОР): 1,301 [1,070–1,582], p = 0,008). Кроме того, значение AUC (area under curve – площадь под кривой) летальности в отдаленном периоде в многомерной модели, включающей возраст, фракцию выброса левого желудочка (ФВЛЖ), класс по Киллипу и наличие в анамнезе инсульта/ТИА (транзиторной ишемической атаки) составило 0,781 (95% ДИ: 0,731–0,832, p < 0,001). При добавлении в многомерную модель ΔMPV, значение AUC составило 0,800 (95% ДИ: 0,750–0,848, z = 2,256, разность значений p = 0,0241, рис. 1). Кроме того, добавление ΔMPV к многомерной модели было связано со значительным увеличением показателя улучшения перераспределения (Net Reclassification Improvement), который оценивался в 24,5% (p = 0,027) и показателя улучшения интегрированной дискриминации (integrated discrimination improvement), который составил 0,014 (p = 00198).
Выводы
Увеличение MPV в период госпитализации у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших пЧКВ, связано с летальностью в отдаленном периоде.
Ключевые слова
- Средний объем тромбоцитов
- Инфаркт миокарда с подъемом сегмента ST
- Летальность
Тромбоциты играют важную роль как в запуске, так и в прогрессировании острых коронарных синдромов (ОКС) [1, 2]. Предыдущие исследования показали, что тромбоциты обладают провоспалительной активностью независимо от их участия в гемостазе и внутрисосудистом тромбообразовании [3,4, 5]. Средний объем тромбоцитов (MPV) является показателем активации тромбоцитов [6]. Большие тромбоциты более активны и обладают более выраженным тромботическим потенциалом, чем малые. Кроме того, они более мощные, имеют более высокий уровень тромбоксана A2 и больше гликопротеиновых рецепторов Ib и IIb/IIIa. Благодаря этому агрегация больших тромбоцитов с коллагеном происходит быстрее, чем агрегация малых тромбоцитов [7].
За последние годы многочисленные исследования показали, что повышенное значение MPV у пациентов с ОКС при поступлении в стационар было связано с отдаленной летальностью [8, 9, 10]. Более того, было обнаружено, что увеличение MPV в период стационарного лечения является предиктором летальности как у пациентов с инфарктом миокарда без подъема сегмента ST, так и у пациентов в критическом состоянии [11, 12]. Данные о связи изменения MPV в период стационарного лечения с летальностью у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное чрескожное коронарное вмешательство (ЧКВ), отсутствуют.
Целью настоящего исследования было изучение связи между увеличением MPV в период стационарного лечения с отдаленной летальностью у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ.
Методы
Исследуемая популяция
Мы включили в исследование 514 пациентов с инфарктом миокарда с подъемом сегмента ST, которые перенесли первичное ЧКВ с января 2008 г. по июнь 2015 г. Пациенты со злокачественными новообразованиями, инфекционными или гематологическими заболеваниями, а также пациенты с неполными данными были исключены из настоящего исследования. Итоговый анализ включал 480 пациентов. Разрешение на проведение исследования было получено в местном этическом комитете. Диагноз «инфаркт миокарда с подъемом сегмента ST» ставили на основании типичной ангинозной боли, продолжавщейся >30 минут, с повышением уровня сердечных ферментов (тропонина I) и данных ЭКГ: подъема сегмента ST >1 мм в двух и более отведениях подряд или вновь появившаяся блокада левой ножки пучка Гиса (ЛНПГ) [13]. Мы определяли артериальную гипертензию (АГ) как предшествующее применение антигипертензивных препаратов, систолическое давление >140 мм рт. ст. или диастолическое давление >90 мм рт. ст. и сахарный диабет как применение инсулина или противодиабетических препаратов, или уровень глюкозы натощак >126 мг/дл. Диагноз «гиперхолестеринемия» выставляли при значении общего холестерина ≥200 мг/дл. Курение определяли как курение или отсутствие курения в настоящее время. Данное исследование проводилось в соответствии с Хельсинкской Декларацией.
Мы определяли общую летальность как смерть от любых причин в период последующего наблюдения и рассматривали ее в качестве первичной конечной точки. Кроме того, в анализ были включены повторная реваскуляризация, госпитализация по поводу сердечной недостаточности, инсульт/транзиторная ишемическая атака (ТИА) и 30-дневная летальность. Данные за период последующего наблюдения получали из медицинской документации стационаров, от пациентов и их родственников.
Методы
Все пациенты получали лечение согласно текущим рекомендациям. Было проведено 13 первичных ЧКВ с использованием стандартных методик с использованием трансфеморального доступа. Вмешательства проводили два опытных специалиста в области интервенционной кардиологии. Стратегии лечения каждого пациента оставались на усмотрение интервенционного кардиолога. Данные по ангиографии получали из документации лаборатории катетеризации сердца. Инфаркт-связанную артерию (ИСА) оценивали по классификации TIMI (thrombolysis in myocardial infarction - тромболизис при инфаркте миокарда). Мы определяли инвазивную процедуру в острой фазе как успешную при уменьшении обструкции и стеноза ИСА до <20% с оценкой кровотока TIMI 3 сразу после первичного ЧКВ. После ангиопластики всех пациентов переводили в отделение интенсивной терапии. В соответствии с текущими рекомендациями проводили двойную антитромбоцитарную терапию, пациенты получали бета-блокаторы, ингибиторы ангиотензинпревращающего фермента (ИАПФ), блокаторы рецепторов ангитензина (БРА) и статины [13].
После измерения конечно-диастолического и конечно-систолического объемов левого желудочка (ЛЖ) подсчитывали фракцию выброса левого желудочка (ФВЛЖ) по апикальному четырехкамерному и двухкамерному срезам с помощью модифицированного метода Симпсона.
Забор образцов крови, общий и биохимический анализы крови
Для оценки MPV отбирали образцы периферической крови при поступлении до введения антитромбоцитарных препаратов и через 48–72 ч. после поступления. Образцы крови собирали в стандартизированные пробирки, содержащие порошок этилендиаминтетраацетата дикалия в качестве антикоагулянта, и хранили при комнатной температуре. Все показатели анализировали в течение одного часа после сбора образцов. Изменение MPV определяли как ΔMPV (MPV через 48–72 ч. минус MPV при поступлении). Для биохимического исследования при поступлении отбирали дополнительные пробы образцы крови. Их анализ проводили по стандартным методикам.
Статистический анализ
Статистический анализ выполняли с помощью программы SPSS (версия 16.0; SPSS Inc., Чикаго, Иллинойс, США). Переменные с нормальным распределением анализировали с помощью критерия Колмогорова - Смирнова и представляли как среднее арифметическое ± стандартное отклонение, тогда как переменные без нормального распределения были представлены как медианные значения с размахом. Категориальные переменные были представлены в виде числа и процентной доли. Группы сравнивали с помощью критерия хи-квадрат для категориальных переменных и t-критерия Стьюдента или U-критерия Манна - Уитни для непрерывных переменных. Чтобы оценить, являлось ли значение ΔMPV независимым предиктором летальности, проводили многофакторный регрессионный анализ Кокса. Факторы с p-значением <0,1 при однофакторном анализе были включены в многофакторный регрессионный анализ Кокса. Прогностическую ценность многомерной модели и сочетания ΔMPV с многомерной моделью анализировали путем сравнения площадей под ROC-кривой (receivers operating characteristic curve - рабочая характеристическая кривая). AUC каждой модели, которую анализировали с помощью программы NCSS 12, сравнивали с помощью критерия Де Лонга [14]. Кроме того, увеличение дискриминационной способности после добавления ΔMPV в многомерную модель также оценивали с помощью показателей улучшения перераспределения (NRI - Net Reclassification Improvement) и интегрированного улучшения дискриминационной способности (Integrated Discrimination Improvement) [15]. Различия расценивали как значимые при уровне двустороннего p-значения < 0,05.
Результаты
Исходные характеристики
Исходные демографические и клинические характеристики представлены в таблице 1. Медиана длительности последующего наблюдения составляла 65,9 (41,9–80,4) месяцев. Невыжившие были значительно старше (68 ± 13 против 58 ± 11, p < 0,001). Сахарный диабет, АГ, инсульт/ТИА чаще встречались у невыживших, чем у выживших (таблица 1). Частота ИМ с классом по Киллипу ≥2 и многососудистое поражение чаще наблюдались у невыживших, чем у выживших. По сравнению с выжившими доля женщин среди невыживших была больше. Показатели использования ИАПФ/БРА после выписки из стационара у невыживших были ниже, чем у выживших.
Таблица 1. Исходные характеристики исследуемой популяции
Лабораторные показатели
Лабораторные показатели представлены в таблице 2. Уровень креатинина сыворотки был выше у невыживших. Уровень гемоглобина при поступлении был ниже у невыживших, чем у выживших. По количеству тромбоцитов как при поступлении, так и через 48–72 ч. значимых различий между группами не наблюдалось. MPV через 48–72 ч. был выше у невыживших, чем у выживших. У невыживших было более высокое значение показателя ΔMPV, чем у выживших [0,79 (0,30–1,40) против 0,37 (− 0,1–0,89), p < 0,001]. Исходные значения MPV были сопоставимы в обеих группах.
Таблица 2. Результаты лабораторных анализов в исследуемой популяции
ФВЛЖ у невыживших была значительно ниже, чем у выживших (41 ± 10 против 45 ± 9, p < 0,001).
Клинические исходы и ΔMPV
Показатель тридцатидневной летальности у невыживших составил 20% (таблица 1). Частота РЦС, инсультов и ИМ были сопоставимыми в обеих группах. У невыживших отмечалась более высокая частота новых случаев госпитализации по поводу СН, чем у выживших (14% против 2%, p < 0,001).
ΔMPV (ОР: 1,301 [1,070–1,582], p = 0,008), класс по Киллипу ≥ 2, ФВЛЖ, инсульт/ТИА в анамнезе и возраст являлись независимыми предикторами отдаленной летальности при многофакторном анализе (таблица 3).
Таблица 3. Однофакторный и многофакторный анализ летальности от всех причин с помощью модели пропорциональных рисков Кокса
Анализ ΔMPV с помощью ROC-кривой показал, что площадь под кривой (AUC) прогноза отдаленной летальности составляет 0,646 (рис. 1). Кроме того, значение AUC (area under curve – площадь под кривой) летальности в отдаленном периоде в многомерной модели, включающей возраст, фракцию выброса левого желудочка (ФВЛЖ), класс по Киллипу и наличие в анамнезе инсульта/ТИА, составило 0,781 (95% ДИ: 0,731–0,832, p < 0,001). При добавлении ΔMPV в многомерную модель, значение AUC составило 0,800 (95% ДИ: 0,750–0,848, z = 2,256, разность p = 0,0241, рис. 1). Кроме того, добавление ΔMPV к многомерной модели было связано со значительным увеличением показателя улучшения перераспределения (Net Reclassification Improvement), который оценивался в 24,5% (p = 0,027) и показателем улучшения интегрированной дискриминации (Integrated Discrimination Improvement), который составил 0,014 (p = 00198). Кривые выживаемости Каплана-Майера согласно точке отсечения ΔMPV (≥ 0,44 фл и < 0,44 фл) представлены на рис. 2. По результатам анализа в подгруппе, проведенного в соответствии с этой точкой отсечения, показатели 30-дневной летальности (2% против 6%, p = 0,009), отдаленной летальности (16% против 30%, p < 0,001) и госпитализации по поводу сердечной недостаточности (3% против 7%, p = 0,028) в группе с высокими значениями ΔMPV были выше, чем в группе с низкими значениями ΔMPV. Не наблюдалось статистически значимых различий между группами в отношении повторного инфаркта миокарда (8% против 8%, p = 0,756), инсульта (3% против 3%, p = 0,998) и РЦС (12% против 12%, p = 0,974).
 Рисунок 1. ROC-кривые прогнозирования общей летальности от всех причин для ΔMPV, многомерной модели и многомерной модели плюс ΔMPV
Рисунок 1. ROC-кривые прогнозирования общей летальности от всех причин для ΔMPV, многомерной модели и многомерной модели плюс ΔMPV Рисунок. 2. Кривые выживаемости Каплана-Майера летальности от всех причин по ΔMPV
Рисунок. 2. Кривые выживаемости Каплана-Майера летальности от всех причин по ΔMPVОбсуждение
Насколько нам известно, данное исследование является первым исследованием, проведенным с целью изучения связи между увеличением MPV в период стационарного лечения и отдаленной летальностью у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ. В настоящем исследовании мы обнаружили, что увеличение MPV в период стационарного лечения через 48–72 ч. после поступления связано с отдаленной летальностью у этих пациентов.
Grabovac et al. продемонстрировали увеличение MPV через 72 ч. у пациентов с инфарктом миокарда с подъемом сегмента ST [16]. Присутствие больших тромбоцитов является признаком повышенной активации тромбоцитов. Эти тромбоциты в основном гиперактивированы и содержат большое количество гранул с внутриклеточным тромбоксаном A2, мембранными белками клеточной адгезии, такими как P-селектин и GPIIIa, последний из которых является индикатором протромботического статуса. Кроме того, у этих тромбоцитов повышены агрегация в ответ на коллаген или АДФ, высвобождение тромбоксана и экспрессия мембранного P-селектина или GP1b и GPIIb/IIIa [17, 18, 19]. Существует связь между MPV и провоспалительными, а также протромботическими состояниями, при которых тромбопоэтин и различные воспалительные цитокины, например, интерлейкин (ИЛ) 1, ИЛ-3, ИЛ-6 и фактор некроза опухоли (ФНО) альфа, формируют тромб. Кроме того, показано, что MPV является маркером воспаления при заболеваниях с активным воспалением [20, 21]. Вклад тромбоцитов в воспаление, который заключается в связывании с моноцитами и их активации, был продемонстрирован на пациентах с ИМ [22, 23].
Остается неясным, что происходит с циркулирующими увеличенными тромбоцитами после их выхода из костного мозга. Тромбоциты, вновь образовавшиеся из мегакариоцита костного мозга, по размеру обычно больше [18]. На дифференцировку и созревание мегакариоцита требуется примерно 4–5 дней [18, 19]. Формирование тромбоцитов de novo и освобождение их из этих зрелых мегакариоцитов занимает 24 ч. Таким образом, маловероятно, что раннее увеличение MPV после ИМ является только результатом формирования новых тромбоцитов большего размера в костном мозге. Селезенка человека служит резервуаром циркулирующих тромбоцитов (около одной трети всех тромбоцитов). Кроме того, MPV тромбоцитов человеческой селезенки примерно на 20% больше, чем MPV циркулирующих тромбоцитов. Следовательно, селезенка может быть резервуаром крупных тромбоцитов, и она может быть ответственна за быстрое изменение количества циркулирующих крупных тромбоцитов в стрессовых условиях, в том числе при интенсивной физической нагрузке и стимуляции цитокинами или катехоламинами [24, 25, 26, 27].
В предыдущем исследовании было продемонстрировано, что механизм быстрого увеличения MPV циркулирующих тромбоцитов заключается в выходе тромбоцитов селезенки вскоре после ИМ [28]. Выход из селезенки моноцитов и тромбоцитов для активизации воспалительного процесса играет ключевую роль в системном ответе на ишемическое повреждение. Еще один элемент кардиоспленической оси – селезеночные тромбоциты [28]. В указанном исследовании обнаружилось, что спленэктомия препятствует данным изменениям после ИМ у мышей [28]. Не ясно, что отвечает за инициацию выхода, высвобождение и активацию селезеночных тромбоцитов после ИМ. Возможно, за это отвечают катехоламины и ангиотензин II. Swirski et al. показали, что эти показатели повышаются у пациентов с острым ИМ [29]. Таким образом, повышенные уровни ангиотензина II и катехоламинов в условиях острого ИМ могут вызывать выход селезеночных тромбоцитов.
Показано, что тромбоциты играют важную роль в воспалении [30]. Провоспалительные свойства тромбоцитов опосредуются через взаимодействие с большими лейкоцитами [28]. У пациентов с острым ИМ увеличение MPV, ассоциированное как с воспалением, так и с прокоагулирующей активностью, связано с риском тромбоза стента, отсутствием восстановления кровотока из-за микротромбов или повреждения сосудов микроциркуляторного русла после первичного ЧКВ, повторным инфарктом миокарда, большой площадью инфаркта, отдаленной летальностью и летальностью в ближайшем периоде [31, 32, 33, 34].
Kiriş et al. продемонстрировали связь между повышением MPV в течение 24 ч. после поступления и летальностью у пациентов с инфарктом миокарда без подъема сегмента ST [11]. В этом исследовании у пациентов с высокими значениями ΔMPV (> 0,62 фл) были более высокие показатели 30-дневной и отдаленной летальности – так же, как было установлено и в настоящем исследовании. Различия между точками отсечения могут быть обусловлены разными клиническими условиями (например, инфаркт миокарда с подъемом сегмента ST и инфаркт миокарда без подъема сегмента ST) и применяемыми стратегиями лечения. В другом исследовании, опубликованном Wang et al., было продемонстрировано, что последовательные изменения MPV были связаны с более высоким классом по Киллипу и феноменом no-reflow (феномен невосстановленного кровотока) после ЧКВ у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ [35]. Значение MPV на исходном уровне, через 30, 60, 90 дней и через 1, 2 и 3 года после ЧКВ анализировали у пациентов, не проходивших специального отбора [36]. В этом исследовании повышение MPV со временем было связано с отдаленной летальностью. В отличие от их исследования, мы изучали связь между повышением MPV в период стационарного лечения и летальностью у пациентов с подъемом сегмента ST, перенесших первичное ЧКВ. Мы обнаружили, что у этих пациентов увеличение MPV в период стационарного лечения после поступления связано с летальностью.
На MPV могут влиять лекарственные препараты, в том числе ИАПФ/БРА, бета-блокаторы, статины и антитромбоцитарные препараты [37, 38]. Что касается ΔMPV, мы не обнаружили никаких различий между пациентами, получающими эти препараты, и пациентами, которые их не получали. Более того, в нашем исследовании применение тирофибана не влияло на ΔMPV (данные не представлены). Чтобы определить влияние этих препаратов на ΔMPV, требуются дальнейшие исследования.
Высокое значение ΔMPV может указывать на повышенную тромбогенность и активность тромбоцитов. Кроме того, высокое значение ΔMPV может свидетельствовать о повышенном тромбообразовании и о воспалении. Таким образом, увеличение размера тромбоцитов способствует формированию тромба. Кроме того, большие тромбоциты могут приводить к вазоконстрикции и дисфункции эндотелия. Таким образом, вышеупомянутые связи могут являться механизмом развития летальных исходов у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ.
Настоящее исследование имеет несколько ограничений. В данном ретроспективном исследовании использовалась выборка относительно малого размера, что препятствует точному определению взаимоотношений между ΔMPV и исходами. В настоящем исследовании не изучали воздействие разных нагрузочных доз пероральных антитромбоцитарных препаратов на MPV. Кроме того, мы не могли проанализировать предшествующее применение нестероидных противовоспалительных средств до ЧКВ. У пациентов с СД, которые получали инкретин, уровень больших сердечно-сосудистых событий был значительно ниже, чем у тех, которые не получали этот препарат [39, 40]. Поскольку данные по применению инкретина у многих пациентов отсутствовали, в настоящем исследовании невозможно оценить его влияние на летальность. Более того, мы не оценивали воздействие этого препарата на молекулы, участвующие в стабилизации атеросклеротической бляшки. Наконец, на эти результаты могла повлиять систематическая ошибка отбора.
Выводы
Увеличение MPV в период стационарного лечения у пациентов с инфарктом миокарда с подъемом сегмента ST, перенесших первичное ЧКВ, было связано с летальностью в отдаленном периоде. Мы предполагаем, что повторные определения MPV в период стационарного лечения могут улучшить стратификацию риска у этих пациентов.
Список литературы
- Braunwald E, Antman EM, Beasley JW, et al. American College of Cardiology; American Heart Association. Committee on theManagement of patients with unstable angina. ACC/AHA 2002 guideline update for the management of patients with unstable angina and non-ST-segment elevation myocardial infarction–summary article: a report of the American College of Cardiology/American Heart Association task force on practice guidelines (committee on the Management of Patients with Unstable Angina). J Am Coll Cardiol. 2002;40(07):1366–74. View ArticlePubMedGoogle Scholar
- Fitzgerald DJ, Roy L, Catella F, Fitzgerald GA. Platelet activation in unstable coronary disease. N Engl J Med. 1986;315(16):983–9. View ArticlePubMedGoogle Scholar
- Zarbock A, Polanowska - Grabowska RK, Ley K. Platelet – neutrophil - interactions: linking hemostasis and inflammation. Blood Rev. 2007;21(2):99–111. View ArticlePubMedGoogle Scholar
- Gawaz M, Langer H, May AE. Platelets in inflammation and atherogenesis. J Clin Invest. 2005;115(12):3378–84. View ArticlePubMedPubMedCentralGoogle Scholar
- Liu Y, et al. Novel role of platelets in mediating inflammatory responses and ventricular rupture or remodeling following myocardial infarction. Arterioscler Thromb Vasc Biol. 2011;31(4):834–41. View ArticlePubMedGoogle Scholar
- Pizzulli L, Yang A, Martin JF, Lüderitz B. Changes in platelet size and count in unstable angina compared to stable angina or noncardiac chest pain. Eur Heart J. 1998;19(01):80–4. View ArticlePubMedGoogle Scholar
- Martin JF, Penington DG. The relationship between the age and density of circulating 51-Cr labelled platelets in the sub-human primate. Thromb Res. 1983;30(02):157–64. View ArticlePubMedGoogle Scholar
- Sansanayudh N, Numthavaj P, Muntham D, et al. Prognostic effect of mean platelet volume in patients with coronary artery disease. A systematic review and meta-analysis. Thromb Haemost. 2015;114(06):1299–309. View ArticlePubMedGoogle Scholar
- Sansanayudh N, Anothaisintawee T, Muntham D, McEvoy M, Attia J, Thakkinstian A. Mean platelet volume and coronary artery disease: a systematic review and meta-analysis. Int J Cardiol. 2014;175(03):433–40. View ArticlePubMedGoogle Scholar
- Lai HM, Chen QJ, Yang YN, et al. Association of mean platelet volume with impaired myocardial reperfusion and short-term mortality in patients with ST-segment elevation myocardial infarction undergoing primary percutaneous coronary intervention. Blood Coagul Fibrinolysis. 2016;27(01):5–12. View ArticlePubMedGoogle Scholar
- Kırış T, et al. The prognostic impact of in-hospital change in mean platelet volume in patients with non-ST-segment elevation myocardial infarction. Angiology. 2016;67(7):690–6. View ArticlePubMedGoogle Scholar
- Kim CH, et al. An increase in mean platelet volume from baseline is associated with mortality in patients with severe sepsis or septic shock. PLoS One. 2015;10(3):e0119437. View ArticlePubMedPubMedCentralGoogle Scholar
- Steg PG, James SK, Atar D, et al. ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Task force on the management of ST-segment elevation acute myocardial infarction of the European Society of Cardiology (ESC). Eur Heart J. 2012;33(20):2569–619. View ArticlePubMedGoogle Scholar
- DeLong ER, DeLong DM, Clarke-Pearson DL. Comparing the areas under two or more correlated receiver operating characteristic curves: a nonparametric approach. Biometrics. 1988;44(3):837–45. View ArticlePubMedPubMedCentralGoogle Scholar
- Pencina MJ, D'Agostino RB Sr, Steyerberg EW. Extensions of net reclassification improvement calculations to measure usefulness of new biomarkers. Stat Med. 2011;30(1):11–21. View ArticlePubMedGoogle Scholar
- Sušilović Grabovac Z, Baković D, Lozo M, Pintarić I, Dujić Ž. Early changes in platelet size and number in patients with acute coronary syndrome. Int J Angiol. 2017;26(4):249–52. View ArticlePubMedPubMedCentralGoogle Scholar
- Leader A, Pereg D, Lishner M. Are platelet volume indices of clinical use ? A multidisciplinary review. Ann Med. 2012;44(8):805–16.View ArticlePubMedGoogle Scholar
- Machlus KR, Italiano JE Jr. The incredible journey: from megakaryocyte development to platelet formation. J Cell Biol. 2013;201(6):785–96.View ArticlePubMedPubMed CentralGoogle Scholar
- Thon JN, Italiano JE Jr. Does size matter in platelet production? Blood. 2012;120(8):1552–61.View ArticlePubMedPubMed CentralGoogle Scholar
- Gasparyan AY, Stavropoulos-Kalinoglou A, Toms TE, Douglas KM, Kitas GD. Association of mean platelet volume with hypertension in rheumatoid arthritis. Inflamm Allergy Drug Targets. 2010;9(1):45–50.View ArticlePubMedGoogle Scholar
- Makay B, Turkyilmaz Z, Unsal E. Mean platelet volume in children with familial Mediterranean fever. Clin Rheumatol. 2009;28(8):975–8.View ArticlePubMedGoogle Scholar
- Furman MI, Barnard MR, Krueger LA, et al. Circulating monocyte-platelet aggregates are an early marker of acute myocardial infarction. J Am Coll Cardiol. 2001;38(4):1002–6.View ArticlePubMedGoogle Scholar
- Sarma J, Laan CA, Alam S, Jha A, Fox KA, Dransfield I. Increased platelet binding to circulating monocytes in acute coronary syndromes. Circulation. 2002;105(18):2166–71.View ArticlePubMedGoogle Scholar
- Bakovic D, et al. The effects of low-dose epinephrine infusion on spleen size, central and hepatic circulation and circulating platelets. Clin Physiol Funct Imaging. 2013;33(1):30–7.View ArticlePubMedGoogle Scholar
- Bakovic D, et al. Changes in platelet size and spleen volume in response to selective and non-selective beta-adrenoceptor blockade in hypertensive patients. Clin Exp Pharmacol Physiol. 2009;36(4):441–6.View ArticlePubMedGoogle Scholar
- Chamberlain KG, Tong M, Penington DG. Properties of the exchangeable splenic platelets released into the circulation during exercise-induced thrombocytosis. Am J Hematol. 1990;34(3):161–8.View ArticlePubMedGoogle Scholar
- Wadenvik H, Kutti J. The effect of an adrenaline infusion on the splenic blood flow and intrasplenic platelet kinetics. Br J Haematol. 1987;67(2):187–92.View ArticlePubMedGoogle Scholar
- Gao XM, et al. Splenic release of platelets contributes to increased circulating platelet size and inflammation after myocardial infarction. Clin Sci (Lond). 2016;130(13):1089–104.View ArticleGoogle Scholar
- Swirski FK, et al. Identification of splenic reservoir monocytes and their deployment to inflammatory sites. Science. 2009;325(5940):612–6.View ArticlePubMedPubMed CentralGoogle Scholar
- Vorchheimer DA, Becker R. Platelets in atherothrombosis. Mayo Clin Proc. 2006;81(1):59–68.View ArticlePubMedGoogle Scholar
- Huczek Z, et al. Baseline platelet size is increased in patients with acute coronary syndromes developing early stent thrombosis and predicts future residual platelet reactivity. A case-control study. Thromb Res. 2010;125(5):406–12.View ArticlePubMedGoogle Scholar
- Huczek Z, et al. Mean platelet volume on admission predicts impaired reperfusion and long-term mortality in acute myocardial infarction treated with primary percutaneous coronary intervention. J Am Coll Cardiol. 2005;46(2):284–90.View ArticlePubMedGoogle Scholar
- Fabregat-Andrés Ó, et al. Mean platelet volume is associated with infarct size and microvascular obstruction estimated by cardiac magnetic resonance in ST segment elevation myocardial infarction. Blood Coagul Fibrinolysis. 2013;24(4):424–7.View ArticlePubMedGoogle Scholar
- Tekbas E, et al. Mean platelet volume in predicting short- and long-term morbidity and mortality in patients with or without ST-segment elevation myocardial infarction. Scand J Clin Lab Invest. 2011;71(7):613–9.View ArticlePubMedGoogle Scholar
- Wang XY, et al. Serial changes of mean platelet volume in relation to Killip class in patients with acute myocardial infarction and primary percutaneous coronary intervention. Thromb Res. 2015;135(4):652–8.View ArticlePubMedGoogle Scholar
- Shah B, Oberweis B, Tummala L, et al. Mean platelet volume and long-term mortality in patients undergoing percutaneous coronary intervention. Am J Cardiol. 2013;111(2):185–9.View ArticlePubMedGoogle Scholar
- Coban E, Afacan B. The effect of rosuvastatin treatment on the mean platelet volume in patients with uncontrolled primary dyslipidemia with hypolipidemic diet treatment. Platelets. 2008;19(2):111–4.View ArticlePubMedGoogle Scholar
- Jagroop IA, Mikhailidis DP. Angiotensin II can induce and potentiate shape change in human platelets: effect of losartan. J Hum Hypertens. 2000;14(9):581–5.View ArticlePubMedGoogle Scholar
- Marfella R, Sardu C, Balestrieri ML, Siniscalchi M, Minicucci F, Signoriello G, Calabrò P, Mauro C, Pieretti G, Coppola A, Nicoletti G, Rizzo MR, Paolisso G, Barbieri M. Effects of incretin treatment on cardiovascular outcomes in diabetic STEMIpatients with culprit obstructive and multivessel non obstructive-coronary-stenosis. Diabetol Metab Syndr. 2018;3(10):1.View ArticleGoogle Scholar
- Marfella R, Sardu C, Calabrò P, Siniscalchi M, Minicucci F, Signoriello G, Balestrieri ML, Mauro C, Rizzo MR, Paolisso G, Barbieri M. Non-ST-elevation myocardial infarction outcomes in patients with type 2 diabetes with non-obstructive coronary artery stenosis: Effects of incretin treatment. Diabetes Obes Metab. 2017. doi.org [Epub ahead of print].





