6500
15 Декабря 2021
Авторское право © 2019, Dipak Kotecha, Marcus D. Flather, Dan Atar, Peter Collins, John Pepper, Elizabeth Jenkins, Christopher M. Reid, David Eccleston (doi:
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Дипак Котеча, Маркус Д. Флатер, Дэн Атар, Питер Коллинз, Джон Пеппер, Элизабет Дженкинс, Кристофер М. Рид, Дэвид Экклстон в интересах исследования альтернативных маркеров риска при ишемических болезнях сердца (ARM-CAD)...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Дипак Котеча, Маркус Д. Флатер, Дэн Атар, Питер Коллинз, Джон Пеппер, Элизабет Дженкинс, Кристофер М. Рид, Дэвид Экклстон в интересах исследования альтернативных маркеров риска при ишемических болезнях сердца (ARM-CAD)...
Авторское право © 2019, Dipak Kotecha, Marcus D. Flather, Dan Atar, Peter Collins, John Pepper, Elizabeth Jenkins, Christopher M. Reid, David Eccleston (doi:
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Дипак Котеча, Маркус Д. Флатер, Дэн Атар, Питер Коллинз, Джон Пеппер, Элизабет Дженкинс, Кристофер М. Рид, Дэвид Экклстон в интересах исследования альтернативных маркеров риска при ишемических болезнях сердца (ARM-CAD)
BMC Medicine201917:72
Аннотация
Введение
Прогнозирование рисков у пациентов с предполагаемой ишемической болезнью сердца осложняется предшествующими сердечно-сосудистыми заболеваниями и различными видами рисков при оказании первой помощи. Большинство маркеров могут использоваться для прогнозирования и планирования лечения, но в настоящее время нам не хватает доказательств для их применения.
Методы
Проспективное многоцентровое обсервационное исследование последовательных пациентов, направленных на плановую коронароангиографию. Врачи не были осведомлены об оценке рисков, включающих общепринятые факторы, исследования пульсовой волны лучевой артерии, вариабельности сердечного ритма в течение пяти минут, высокочувствительного С-реактивного белка и натрийуретического пептида типа B (МНП). Независимая экспертиза была проведена для общей летальности, включая смерть от инфаркта миокарда или инсульта, проанализированных с помощью модели пропорциональных рисков Кокса.
Результаты
Были обследованы 522 пациента, средний возраст — 66 лет, после проведения реваскуляризации — 21%. Средняя исходная фракция выброса левого желудочка составила 64%, у 62% выявлен стеноз ≥ 50% при ангиографии. В течение пяти лет среднего периода наблюдения у 30% пациентов была проведена чрескожная реваскуляризация, у 16% — хирургическая. При проведении многовариантного анализа только возраст и МНП коррелировали с исходами. Скорректированное отношение рисков на каждую логарифмическую единицу повышения МНП составило 2,15 для смертности (95% ДИ 1,45–3,19; p = 0,0001) и 1,27 для сложных клинических явлений (1,04–1,54; p = 0,018). В группе пациентов с исходным МНП >100 пг/мл в основном наблюдались повышенная смертность и сложные клинические явления (20,9% и 32,2%) в сравнении с пациентами с МНП ≤ 100 пг/мл (5,6% и 15,5%). МНП улучшил как классификацию, так и распознавание исходов (p ≤ 0,003) независимо от систолической функции левого желудочка. Напротив, высокочувствительный С-реактивный белок, измерение пульсовой волны и вариабельность сердечного ритма не связаны с пятилетним прогнозом после модификации рисков и лечения ишемической болезни сердца.
Выводы
Общепринятые факторы риска и другие маркеры артериальной комплаентности, воспаления и вегетативной функции имеют ограниченное значение для прогнозирования исходов у пациентов с модификацией рисков после установления ишемической болезни сердца. МНП может независимо определять пациентов со скрытыми нарушениями функций сердца, что может быть полезным при интенсивной терапии.
Ключевые слова
Риск, смертность, ишемическая болезнь сердца, коронароангиография, натрийуретический пептид типа B.
Введение
Прогнозирование побочных сердечно-сосудистых осложнений и смертности хорошо описаны у пациентов без сердечно-сосудистых заболеваний (ССЗ) [1, 2]. Однако у большинства пациентов имелись предшествующие инфаркты миокарда (ИМ) или другие ССЗ, что делает недействительными стандартные шкалы риска, такие как Фрамингемская шкала. Кроме того, пациенты часто получали расширенную первичную и вторичную профилактическую терапию (антиагрегантную и антигипертензивную терапию, снижение липидного уровня, прекращение курения и реваскуляризация). Таким образом, общепринятые факторы риска часто слабо коррелируют с ишемической болезнью сердца (ИБС) [3] или прогнозами у пациентов с подтвержденными ССЗ [4, 5]. Это ограничивает область определения пациентов с высоким риском, который может быть снижен при более интенсивной терапии.
Для дополнения клинических факторов были предложены ряд различных маркеров риска с потенциально новыми механизмами. Натрийуретический пептид типа B (мозговой натрийуретический пептид; МНП) определяет нагрузку на сердце и функциональную способность [6], но редко учитывается в клинической практике вне оценки сердечной недостаточности, несмотря на убедительные доказательства его применения у пациентов с ИБС [7]. Технологии для измерения пульсовой волны используются в качестве заменителей при ригидности сосудов [8]; однако их ценность при стандартном артериальном давлении неясна. Вариабельность сердечного ритма (ВСР) — маркер вегетативной функции [9], но его эффективность неизвестна при прогнозировании рисков [10]. Высокочувствительный С-реактивный белок (вчСРБ) — эффективный маркер воспаления, хотя дополнительные риски стратификации не установлены [11].
Исследование ARM-CAD («Альтернативные маркеры рисков при ишемической болезни сердца») предназначено для получения объективной оценки неинвазивных маркеров у населения в режиме реального времени. Рандомизированное клиническое исследование было бы неэтичным в этой ситуации, поэтому мы использовали множество методов для снижения возможных отклонений. Оценку рисков проводили перед проведением ангиографии, врачи не были осведомлены о результатах во избежание любых влияний на лечение в течение пяти лет периода наблюдения, исходы оценивались независимой экспертизой. Исследование проводили с целью подтверждения клинического значения маркеров риска путем оценки их взаимосвязи со смертностью, включая смерти от инфаркта миокарда или инсульта до и после плановой коронароангиографии.
Методы
Популяция пациентов
Пациенты, направленные на плановую коронароангиографию, были выбраны в трех центрах города Мельбурн, Австралия, и последовательно зарегистрированы в период с 2006 по 2008 годы после подписания информированного согласия. Критериями исключения были только острый коронарный синдром (ОКС) и предшествующая трансплантация сердца. Всех пациентов обследовали проспективно, до проведения ангиографии; кардиологи не были осведомлены об оценке рисков на протяжении всего периода наблюдения. Исследование было подтверждено местными этическими комитетами, проведено в соответствии с Хельсинкской декларацией и проспективно зарегистрировано ( clinicaltrials.gov).
Маркеры риска
Общепринятые факторы риска были определены посредством визитов исследователя к пациентам и анализов крови в дополнение к тщательному сбору анамнеза. Подтверждение проводили с применением электронных медицинских карт и записей. Информация об участниках была собрана с помощью специальной электронной системы отчетов о медицинских случаях отдельно от всех клинических баз данных. Определение маркеров риска было опубликовано ранее [3, 8, 9].
Коронароангиография
Коронароангиография проводилась квалифицированными операторами согласно стандартизированным процедурам. Пациенты были разделены на группы: здоровые, с небольшими бляшками или с люминальным стенозом (≥ 50%) на некоторых участках коронарных артерий в магистральных сосудах или крупных протоках. Чтобы обеспечить согласованность, центральная лаборатория ангиографии произвольным образом оценивала ангиограммы в каждом центре с помощью двух квалифицированных операторов, не осведомленных о деталях исследования.
Исходы
Все причины смертности, включая смерти от ИМ или инсульта, были независимо зарегистрированы врачами, не осведомленными о состоянии пациентов. Для регистрации событий были необходимы документальные подтверждения диагноза (к примеру, свидетельство о смерти, диагноз кардиолога или невролога или тропонин-положительный ОКС). Кроме того, была собрана подробная информация о чрескожном коронарном вмешательстве (ЧКВ), аортокоронарном шунтировании (АКШ) и других клинических явлениях во время периода наблюдения при помощи просмотра электронных и физических записей, обсуждения с наблюдающими пациентов кардиологами или врачами общей практики, а также ежегодного опроса участников по телефону.
Статистические данные
Значения представлены в виде среднего значения ± межквартильный размах (МКР 25–75-го центиля) или процентного соотношения. Переменные факторов риска оценивались в терцилях по методу Каплана — Мейера и непрерывно в модели регрессии Кокса. В тех случаях, когда переменные показали размытое распределение (например, МНП, вчСРБ, мощность ВСР и шкалы риска), они были нормализованы для статистического анализа путем взятия натурального логарифма. Мы предварительно указали точки пересечения для ряда интересующих переменных: МНП — 100 пг/мл, центральное аугментационное давление — 24 мм рт. ст., центральное пульсовое давление — 50 мм рт. ст., НЧ-диапазон ВСР — 250 мс2 и вчСРБ — 3 мг/л. Сравнения групп проводили посредством критерия Краскела — Уоллиса для дисперсионного анализа при подборе p-значений для множественных сравнений. Группы Каплана — Мейера сравнивали по логранговому критерию оценки бинарных переменных и логранговому критерию в терцилях.
Основная многовариантная модель Кокса включает возраст, пол, курение, систолическое и диастолическое артериальное давление, использование антагонистов ренин-ангиотензин-альдостерона, уровень общего холестерина, терапию статинами, наличие сахарного диабета, предшествующего инфаркта миокарда, МНП, объем ИБС при ангиографии, систолическую дисфункцию левого желудочка и реваскуляризацию в период наблюдения. Отдельно были добавлены дополнительные маркеры риска. Также был включен зависимый от времени термин взаимодействия; результаты отображаются в виде относительного риска (ОР) и связанных с ним 95% доверительных интервалов (ДИ). Проведено последовательное включение пороговых значений p < 0,2 более широкой области переменных (включая функцию почек, индекс массы тела и другое медицинское лечение), но это не повлияло на результаты. Взаимосвязи оценивали при помощи измерения коэффициента вероятности, предположение о пропорциональных рисках было подтверждено использованием остатков Шенфельда. Для понимания влияния модификации факторов риска в течение времени анализы были повторно проведены через год.
С-статистика Харрелла (область под ROC-кривой) и D-статистика Сомерса были подсчитаны с показателями МНП и без них в финальной модели для оценки его аддитивности. Эти статистики сравнивали по описанным методам [12] со случайным образом сгенерированными настройками деривации и валидации равных размеров, стратифицированными по возрасту и систолической дисфункции левого желудочка. Для обнаружения различительной способности исходных значений МНП рассчитали улучшение чистой реклассификации и интегрированное улучшение дискриминационной способности, используя логистическую регрессию в многовариантной модели с добавлением параметра МНП к общепринятым предикторам клинического риска (возраст, мужской пол, эпизоды ССЗ в семейном анамнезе, курение, предшествующий ИМ, диабет, артериальное давление ≥ 140 / ≥ 90 мм рт. ст., гипертензивная терапия, общий холестерин > 5,2 ммоль/л [200 мг/дл], стеноз ≥ 50% при ангиографии и фракция выброса левого желудочка [ФВЛЖ] < 50%) [13]. Точки пересечения были предварительно установлены на 20%, 30% и 40% для отображения высоких пропорций события и прогнозирования рисков смерти.
Апостериорный анализ проводили (1) для исключения пациентов с предсердными аритмиями из центрального аугментационного давления и ВСР-диаграммы Каплана — Мейера, (2) для оценки влияния ВСР у пациентов без реваскуляризации, (3) для определения любых взаимодействий МНП с тяжестью ИБС и диастолической дисфункцией, (4) для исключения пациентов с нормальной коронароангиографией и (5) для оценки предварительно указанных точек пересечения МНП 100 пг/мл.
Двустороннее p-значение < 0,05 считали статистически значимым. В измерениях использовали данные завершенных случаев, поскольку утраченных данных было немного (подстановка не производилась). Статистический анализ проводили с помощью программного обеспечения Stata (версия 14.2, StataCorp LP, Техас, США).
Результаты
Динамическое популяционное исследование ARM-CAD состояло из 526 пациентов, отобранных перед проведением плановой коронароангиографии. Средний период наблюдения составил пять лет (МКР 3,5–6,0). Данные четверых участников, полученные в период наблюдения, недоступны (0,8%, Рис. 1).
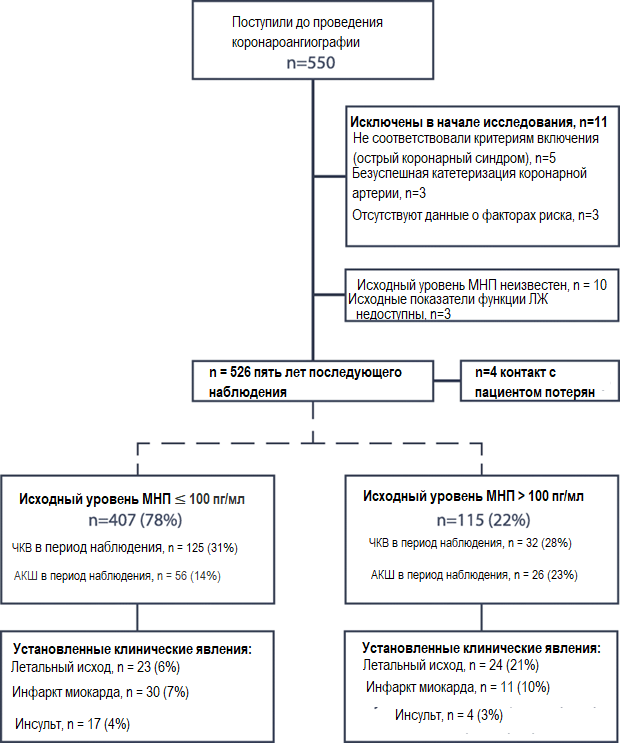 Рисунок 1. Графическая схема исследования ARM-CAD. Включает независимо подтвержденные события, разделенные в соответствии с исходными показателями МНП. МНП — натрийуретический пептид типа B; ЧКВ — чрескожное коронарное вмешательство; АКШ — аортокоронарное шунтирование (ЧКВ и АКШ не являются взаимоисключающими)
Рисунок 1. Графическая схема исследования ARM-CAD. Включает независимо подтвержденные события, разделенные в соответствии с исходными показателями МНП. МНП — натрийуретический пептид типа B; ЧКВ — чрескожное коронарное вмешательство; АКШ — аортокоронарное шунтирование (ЧКВ и АКШ не являются взаимоисключающими)
Исходные характеристики и корреляции
Таблица 1 отражает базовые демографические данные для исследуемой популяции, средний возраст — 66 лет (МКР 58–73) и ФВЛЖ 64% (МКР 53–71%). Перед проведением ангиографии у 394 пациентов (75,5%) выявили боль в области груди, у 335 (64,2%) — диспноэ различной степени. У 12 пациентов (2,3%) в анамнезе эпизоды сердечной недостаточности. Широкий диапазон значений МНП коррелировал со стадией систолической дисфункции левого желудочка, но не с центральным пульсовым давлением. МНП находился в диапазоне сердечной недостаточности (> 400 пг/мл) только у 5,6%.
Таблица 1. Исходные характеристики
Ишемическая болезнь сердца, реваскуляризация и снижение риска
У большинства пациентов (80%) в начале исследования при проведении ангиографии была выявлена атерома на различных стадиях, у 62% — один и более люминальных стенозов ≥ 50%. В течение пяти лет периода наблюдения у 15,6% пациентов было проведено АКШ, у 29,9% — по меньшей мере одно ЧКВ (стент с элюирующим лекарственным покрытием использовали у 55% пациентов). Схожее число проведенных реваскуляризаций выявлено у пациентов с показателями МНП ≤ 100 пг/мл в начале исследования и > 100 пг/мл (p = 0,69; см. распределение на рис. 1. До проведения ангиографии пациенты получали интенсивную терапию, проводимую высококвалифицированным персоналом вторичной медицинской помощи: среднее число посещений госпиталя каждым пациентом — 1,3 в течение первых 12 месяцев после проведения ангиографии (стандартное отклонение — 0,6 посещений).
Установленные исходы
47 участников (9,0%) умерли в период наблюдения. ССЗ стали причиной 23 смертей (49%), из которых 18 (38%) — в результате кардиогенных причин и 5 (11%) — от инсульта. Смерть, инфаркт или инсульт миокарда произошли у 100 участников (19,2%, общее число событий — 109). Одномерный анализ Каплан — Мейера подтвердил значительную тенденцию по терцилям МНП как через год с момента начала исследования, так и в период пятилетнего наблюдения (рис. 2а). ВчСРБ (рис. 2b) и центральное аугментационное давление (рис. 2c) не связаны с исходами в любой момент времени, тогда как отношение мощности НЧ- и ВЧ-диапазонов ВСР было значимым в течение первого года наблюдения, но не в течение пяти лет (рис. 2d). С другой стороны, Фрамингемская шкала риска (рис. 2e) и распространение ИБС при ангиографии (рис. 2f) были незначимы в первый год, но оказались статистически связаны с побочными исходами в конце наблюдения. Ни Фрамингемская шкала, ни шкала SCORE не были значимы за исключением параметров возраста.
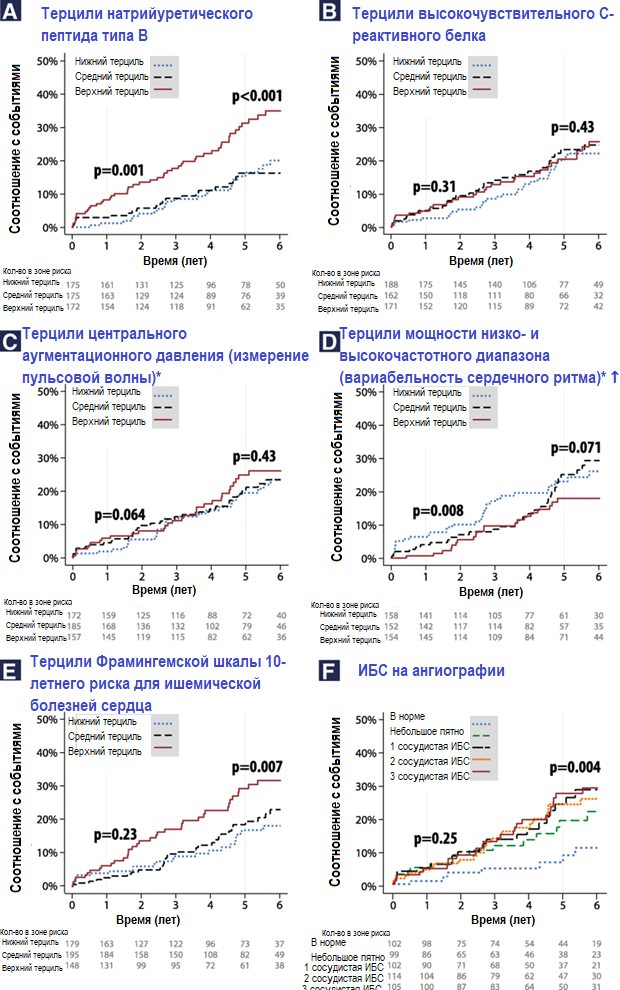 Рисунок 2. Кривые Каплана — Мейера для летального исхода, инфаркта миокарда или инсульта. Врачи не были осведомлены об исходных маркерах риска, за исключением результатов коронароангиографии. p-значения внесены в статистику ХИ-квадрата логрангового критерия для анализа изменения начальных показателей через год и через пять лет наблюдения. Соответствующие p-значения для общей летальности в течение пяти лет наблюдения: a) МНП p = 0,001, b) вчСРБ p = 0,27, c) центральное аугментационное давление p = 0,38, d) НЧ- и ВЧ-диапазон ВСР p = 0,30, е) риск по Фрамингемской шкале p = 0,026, f) ишемическая болезнь на ангиографии р = 0,09. * Апостериорное исключение пациентов с предсердной аритмией на исходном уровне или после наблюдения не оказало влияния на результаты. † Апостериорное исключение пациентов после проведения любых реваскуляризаций в течение пяти лет привело к показателю p-отклонения = 0,029 для летальных исходов в результате ИМ или сердечно-сосудистых осложнений и 0,18 только для смертности. ИБС — ишемическая болезнь сердца
Рисунок 2. Кривые Каплана — Мейера для летального исхода, инфаркта миокарда или инсульта. Врачи не были осведомлены об исходных маркерах риска, за исключением результатов коронароангиографии. p-значения внесены в статистику ХИ-квадрата логрангового критерия для анализа изменения начальных показателей через год и через пять лет наблюдения. Соответствующие p-значения для общей летальности в течение пяти лет наблюдения: a) МНП p = 0,001, b) вчСРБ p = 0,27, c) центральное аугментационное давление p = 0,38, d) НЧ- и ВЧ-диапазон ВСР p = 0,30, е) риск по Фрамингемской шкале p = 0,026, f) ишемическая болезнь на ангиографии р = 0,09. * Апостериорное исключение пациентов с предсердной аритмией на исходном уровне или после наблюдения не оказало влияния на результаты. † Апостериорное исключение пациентов после проведения любых реваскуляризаций в течение пяти лет привело к показателю p-отклонения = 0,029 для летальных исходов в результате ИМ или сердечно-сосудистых осложнений и 0,18 только для смертности. ИБС — ишемическая болезнь сердца
Во всех многовариантных моделях среди индивидуальных исходных маркеров риска только возраст и МНП были связаны с побочными исходами (Таблица 2). Для общей летальности рост ОР на каждые 10 лет составил 2,29 (95% ДИ 1,51–3,48; p = 0,0001) после применения общепринятых факторов риска, медицинской терапии, распространения ИБС при ангиографии и явной систолической дисфункции левого желудочка. На каждую единицу повышения МНП скорректированный ОР составил 2,15 (95% ДИ 1,45–3,19; p = 0,0001) без взаимодействия с систолической дисфункцией левого желудочка (pвзаимодействие = 0,69). Аналогичные результаты наблюдались для смертей от ИМ и инсультов. И Фрамингемская шкала, и шкала SCORE были связаны с побочными исходами в многовариантном анализе без взаимодействия с исходными ССЗ (все pвзаимодействия ≥ 0,50; Таблица 2). Проведение реваскуляризации в период наблюдения было связано со значимым снижением риска летального исхода; при скорректированном ОР 0,45 (95% ДИ 0,23–0,87; p = 0,018).
Таблица 2. Многовариантный анализ
У пациентов с исходными показателями МНП > 100 пг/мл исходы были более неблагоприятными. Смерти зарегистрированы в 24/115 (20,9%) против 23/407 (5,7%) случаев у пациентов с показателями МНП ≤ 100 пг/мл со скорректированным ОР 4,49 (95% ДИ 2,09–9,62; p = 0,0001) без взаимодействий при анализе подгруппы. Смерть, инфаркт или инсульт миокарда зарегистрированы у 37/115 (32,2%) пациентов с показателями МНП > 100 пг/мл против 63/407 (15,5) с показателями МНП ≤ 100 пг/мл при скорректированном ОР 1,95 (95% ДИ 1,20–3,18; p = 0,007). Кривые выживания Каплана — Мейера представлены на рис. 3 с четким и ранним разделением у пациентов с исходными показателями МНП > 100 пг/мл для всех исходов. Другие точки пересечения не были статистически значимыми, в том числе значения центрального аугментационного давления, центрального пульсового давления, мощности НЧ-диапазона ВСР и вчСРБ. При анализе чувствительности показатели МНП > 100 пг/мл имели ту же корреляцию с комбинированными исходами после исключения пациентов с нормальной коронароангиографией (скорректированный ОР 2,03, 95% ДИ 1,23–3,34; p = 0,006; n = 420) или пациентов с любой степенью систолической дисфункции левого желудочка (скорректированный ОР 2,55 95% ДИ 1,40–4,61; p = 0,002; n = 423).
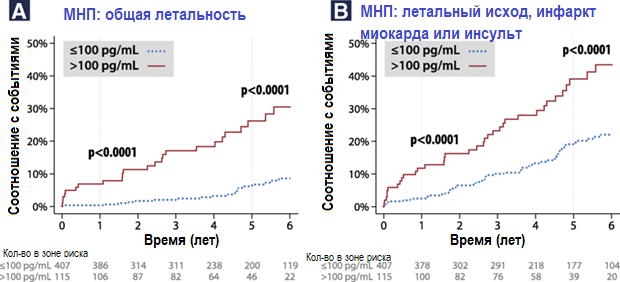 Рисунок 3. Кривые побочных событий Каплана — Мейера согласно предварительно установленным точкам пересечения МНП 100 пг/мл для a) общей летальности и b) смертей от ИМ или инсульта. МНП — натрийуретический пептид типа B; ИМ — инфаркт миокарда
Рисунок 3. Кривые побочных событий Каплана — Мейера согласно предварительно установленным точкам пересечения МНП 100 пг/мл для a) общей летальности и b) смертей от ИМ или инсульта. МНП — натрийуретический пептид типа B; ИМ — инфаркт миокарда
Дискриминационное значение МНП
Добавление МНП в качестве непрерывной переменной увеличило C-статистику Харрелла и D-статистику Сомерса в многомерных моделях (t = 4,0, p < 0,001 и t = 5,9, p < 0,001 соответственно для смертности от всех причин). С-статистика в выборке со случайной валидацией составила 0,91 при показателях МНП и 0,69 — без них. При добавлении к общепринятым предикторам риска МНП > 100 против ≤ 100 пг/мл улучшилась классификация смерти (чистое улучшение в десяти случаях из 47 случаев смерти, 21,3%) с минимальным изменением в классификации выживших (чистое улучшение в двух случаях из 475 выживших, 0,4%. Анализы чистых улучшений реклассификации (NRI) и интегрированного улучшения дискриминационной способности (IDI) были очень значимыми (NRI 0,281, p = 0,003; IDI 0,038, p = 0,0007). На рисунке 4 показана контурная карта прогнозирования, объединяющая возраст и МНП для оценки клинического риска пятилетней смертности.
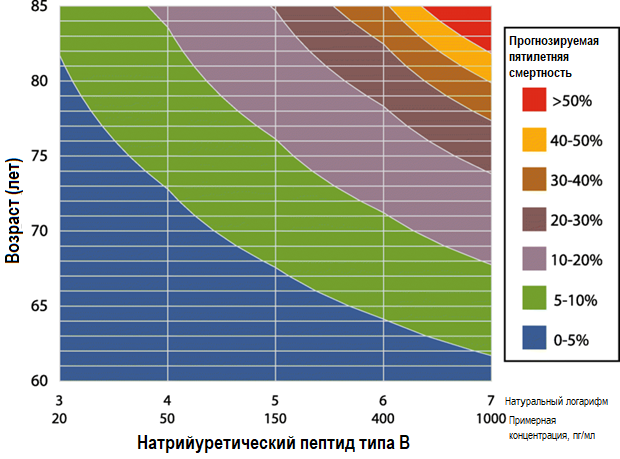 Рисунок 4. Контурная карта риска при скорректированной смертности в соответствии с возрастом и МНП. Пример: 75-летний пациент с показателем МНП 25 пг/мл имел прогнозируемую пятилетнюю смертность 0–5% относительно 10–20% у пациентов того же возраста с показателем МНП 200 пг/мл. Обратите внимание, что оценки риска основаны на когорте пациентов ARM-CAD с обширной модификацией факторов риска и сопутствующим заболеванием, реваскуляризацией по мере необходимости и высококвалифицированными врачами вторичной помощи
Рисунок 4. Контурная карта риска при скорректированной смертности в соответствии с возрастом и МНП. Пример: 75-летний пациент с показателем МНП 25 пг/мл имел прогнозируемую пятилетнюю смертность 0–5% относительно 10–20% у пациентов того же возраста с показателем МНП 200 пг/мл. Обратите внимание, что оценки риска основаны на когорте пациентов ARM-CAD с обширной модификацией факторов риска и сопутствующим заболеванием, реваскуляризацией по мере необходимости и высококвалифицированными врачами вторичной помощи
Обсуждение
Наше исследование повышает важность МНП, маркера дисфункции миокарда, для включения неблагоприятных сердечно-сосудистых событий и смерти у пациентов с подозрением на ИБС, даже при небольшом повышении МНП (что свидетельствует о скрытой сердечной недостаточности). Корреляция МНП с прогнозом не зависела от явной систолической дисфункции левого желудочка, возраста и других факторов риска и сохранялась, несмотря на эффективную модификацию первичного и вторичного факторов риска и высокие показатели реваскуляризации в течение пяти лет. Напротив, другие маркеры риска, которые фокусируются на сосудистом давлении и артериальной податливости (PWA), воспалительных реакциях (вчСРБ) и вегетативной функции (ВСР), были зависимыми от модификации риска. Преимуществами когортного исследования ARM-CAD были включение неотобранных последовательных пациентов (с результатами, общими для обычной клинической практики); сокрытие оценки риска от клиницистов; строгая оценка и последующее наблюдение, определяемые протоколом; низкие показатели потери для последующего наблюдения; самостоятельное вынесение решения о неблагоприятных исходах.
Определение сердечно-сосудистого риска
Показатели риска, такие как шкала GRACE («Глобальный реестр острых коронарных событий») для пациентов с ОКС [14], подтверждают, что многие из исходных факторов риска Фрамингемского исследования сердца могут потерять актуальность у пациентов с распространенными сердечно-сосудистыми заболеваниями. В проведенном нами исследовании только показатель возраста был независимо связан с исходами. Это подчеркивает необходимость поиска альтернативных маркеров, которые помогут определять пациентов с высоким остаточным риском независимо от управления факторами риска и наличия заболевания.
Измерение пульсовой волны
После двух крупных исследований исходов у пациентов, не имеющих серьезных ССЗ [15, 16], полученные формы аортального сигнала в настоящее время часто используются в научных исследованиях в качестве суррогатных показателей исхода. Наш анализ у коморбидных пациентов, у которых количество клинических явлений было почти в четыре раза больше, чем в предыдущем исследовании [17], не обнаружил никакой связи между формой артериальной волны и клиническими исходами. Это может быть связано с лечением основных факторов риска и применением вазоактивных препаратов, которые, как известно, влияют на центральное давление [18].
Вариабельность сердечного ритма
Низкая ВСР связана с повышенным риском возникновения внезапных клинических явлений у пациентов без ССЗ [19], может отличать пациентов с осложненным течением после ИМ [20, 21] и является прогностическим маркером сердечной недостаточности [22]. Наши предыдущие результаты подтверждают, что снижение вариабельности сердечного ритма было независимым предиктором наличия и тяжести ИБС при ангиографии [9]. В настоящем анализе мы определили значимую взаимосвязь клинических явлений в течение года с момента начала исследования, но не выявили корреляции на момент окончания периода наблюдения даже при многовариантном анализе. То, что ВСР не полностью независима от общепринятых факторов или что реваскуляризация может играть определенную роль, может быть связано с недостаточной мощностью (однако в этом случае клиническая ценность, вероятно, будет небольшой) [10]. Затем мы исключили пациентов с перенесенными операциями по реваскуляризации и определили статистически значимую тенденцию для терцилей отношения мощности НЧ- и ВЧ-диапазона ВСР в течение пяти лет. Тем не менее, это следует рассматривать как гипотезу из-за меньшего размера выборки (n = 223) и апостериорной оценки. Также важно отметить, что измерение данных ВСР было неудачным у 11% нашей группы, в основном из-за нарушений ритма [9].
Биомаркеры
ВчСРБ широко изучался как маркер воспаления, но обладает относительно слабой способностью изменять клиническое ведение [11]. В нашей слепой оценке группы с расширенным контролем над рисками не обнаружено никакой связи с долгосрочными исходами.
Напротив, МНП не зависел от других факторов риска и был единственным индивидуальным маркером (кроме возраста), который был связан с клиническими исходами в многомерном анализе. МНП вырабатывается миокардом в ответ на стресс на стенке и способствует уменьшению венозного возврата к сердцу за счет воздействия на эндотелий сосудов (расслабление гладких мышц и повышение проницаемости эндотелия), почки (стимуляция диуреза и натрийуреза) и подавление активации симпатического рефлекса [23, 24]. У пациентов с ИБС или ОКС МНП является мощным предиктором смерти и других клинических явлений [25, 26, 27], с аналогичными результатами для NT-proBNP [28, 29]. Интересно, что МНП не связан с клиническими явлениями у здоровых пациентов с нормальной эхокардиограммой и отсутствием сердечно-сосудистых факторов риска [30]. Механизм повышения МНП у пациентов с коронарным атеросклерозом, но отсутствием некроза миокарда, по-видимому, является преходящей систолической дисфункцией левого желудочка, вызывая стресс миокарда и активацию транскрипции гена МНП. Эта гипотеза подтверждается данными о том, что увеличение ишемической нагрузки и, следовательно, увеличение объема пораженного миокарда приводит к пропорционально более высокому повышению уровня МНП [31]. В нашем исследовании степень тяжести ИБС с учетом нарушения обычного коронарного кровотока действительно коррелировала с уровнем МНП, хотя и слабо. Однако не было никакого взаимодействия с корреляцией МНП с неблагоприятными клиническими событиями. Влияние гибернации миокарда и характер самого ишемического инсульта являются сложными вопросами, которые усугубляются неявной или преходящей систолической или диастолической дисфункцией левого желудочка [32, 33]. Как и другие исследования, мы демонстрируем, что МНП является гораздо более чувствительным маркером, чем параметры визуализации систолической дисфункции [29, 34], а также устанавливаем, что МНП является маркером риска, не зависящим от модификации риска или инцидентной реваскуляризации. Наша точка пересечения МНП 100 пг/мл была определена предварительно, но при последующем анализе продемонстрировала себя как хорошая точка перегиба для повышения риска клинических явлений.
Наши данные подтверждают пользу натрийуретических пептидов для стандартной оценки не только пациентов с сердечной недостаточностью, но и тех, которые находятся под наблюдением по подозрению на ИБС, даже без явной систолической дисфункции. МНП и NT-proBNP доступны во всем мире, относительно дешевы и могут улучшить как классификацию, так и распознавание для более отдаленных исходов. Во время первоначальной оценки выявление пациентов с незначительным повышением уровня натрийуретического пептида (МНП > 100 пг/мл; примерно эквивалентно NT-proBNP > 300 пг/мл) предполагает профиль высокого риска. У таких пациентов было бы разумно рассмотреть дальнейшее фармакологическое или интервенционное лечение, хотя необходимы дополнительные исследования, чтобы установить, улучшит ли проактивная интенсивная терапия прогноз.
Ограничения
Поскольку это исследование было наблюдательным, остаются потенциальные отклонения, которые следует учитывать, в том числе отбор для коронароангиографии (особенно у пациентов с зафиксированной ИБС или предыдущей реваскуляризацией, которым с большей вероятностью предложат ангиографию). Известно, что уровень МНП после АКШ зависит от ряда взаимодействующих и переменных факторов [35]; поэтому все анализы были повторены в когорте пациентов без предшествующего АКШ, и результаты были идентичны представленным. Также важно отметить, что показатели реваскуляризации были одинаковыми, независимо от исходной (слепой) категории МНП Хотя врачи не были осведомлены об оценке рисков, мы не исключаем возможности того, что биомаркеры могли быть проверены в клинической практике в течение периода наблюдения. Малое количество исходов сердечной недостаточности является ограничением исследования. Изучение диастолической дисфункции не являлось требованием протокола этого исследования. Внеочередной анализ у пациентов с имеющимися данными (n = 142) показал, что соотношение E/A при митральном притоке > 2, соотношение E/e' тканевого допплера ≥ 13, или составные показатели диастолического нарушения не взаимодействуют с корреляцией МНП с исходами (p-значимости = 0,16 для смерти, p-значимости = 0,72 для сложных клинических явлений).
Выводы
Общепринятые факторы риска и другие маркеры податливости сосудистой стенки, воспаления и вегетативной функции имели ограниченные значения для прогнозирования долгосрочных исходов у пациентов с модифицированным риском, обследованных на ишемическую болезнь сердца. Показатель МПН имеет строгую корреляцию с летальным исходом и сердечно-сосудистыми явлениями, даже при отсутствии сердечной недостаточности или явных дисфункций желудочка, независимо от реваскуляризации. МНП > 100 пг/мл может определять пациентов со скрытым нарушением сердечной деятельности, что теоретически полезно для раннего, целевого и индивидуализированного лечения с целью улучшения прогнозов.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Дипак Котеча, Маркус Д. Флатер, Дэн Атар, Питер Коллинз, Джон Пеппер, Элизабет Дженкинс, Кристофер М. Рид, Дэвид Экклстон в интересах исследования альтернативных маркеров риска при ишемических болезнях сердца (ARM-CAD)
BMC Medicine201917:72
Аннотация
Введение
Прогнозирование рисков у пациентов с предполагаемой ишемической болезнью сердца осложняется предшествующими сердечно-сосудистыми заболеваниями и различными видами рисков при оказании первой помощи. Большинство маркеров могут использоваться для прогнозирования и планирования лечения, но в настоящее время нам не хватает доказательств для их применения.
Методы
Проспективное многоцентровое обсервационное исследование последовательных пациентов, направленных на плановую коронароангиографию. Врачи не были осведомлены об оценке рисков, включающих общепринятые факторы, исследования пульсовой волны лучевой артерии, вариабельности сердечного ритма в течение пяти минут, высокочувствительного С-реактивного белка и натрийуретического пептида типа B (МНП). Независимая экспертиза была проведена для общей летальности, включая смерть от инфаркта миокарда или инсульта, проанализированных с помощью модели пропорциональных рисков Кокса.
Результаты
Были обследованы 522 пациента, средний возраст — 66 лет, после проведения реваскуляризации — 21%. Средняя исходная фракция выброса левого желудочка составила 64%, у 62% выявлен стеноз ≥ 50% при ангиографии. В течение пяти лет среднего периода наблюдения у 30% пациентов была проведена чрескожная реваскуляризация, у 16% — хирургическая. При проведении многовариантного анализа только возраст и МНП коррелировали с исходами. Скорректированное отношение рисков на каждую логарифмическую единицу повышения МНП составило 2,15 для смертности (95% ДИ 1,45–3,19; p = 0,0001) и 1,27 для сложных клинических явлений (1,04–1,54; p = 0,018). В группе пациентов с исходным МНП >100 пг/мл в основном наблюдались повышенная смертность и сложные клинические явления (20,9% и 32,2%) в сравнении с пациентами с МНП ≤ 100 пг/мл (5,6% и 15,5%). МНП улучшил как классификацию, так и распознавание исходов (p ≤ 0,003) независимо от систолической функции левого желудочка. Напротив, высокочувствительный С-реактивный белок, измерение пульсовой волны и вариабельность сердечного ритма не связаны с пятилетним прогнозом после модификации рисков и лечения ишемической болезни сердца.
Выводы
Общепринятые факторы риска и другие маркеры артериальной комплаентности, воспаления и вегетативной функции имеют ограниченное значение для прогнозирования исходов у пациентов с модификацией рисков после установления ишемической болезни сердца. МНП может независимо определять пациентов со скрытыми нарушениями функций сердца, что может быть полезным при интенсивной терапии.
Ключевые слова
Риск, смертность, ишемическая болезнь сердца, коронароангиография, натрийуретический пептид типа B.
Введение
Прогнозирование побочных сердечно-сосудистых осложнений и смертности хорошо описаны у пациентов без сердечно-сосудистых заболеваний (ССЗ) [1, 2]. Однако у большинства пациентов имелись предшествующие инфаркты миокарда (ИМ) или другие ССЗ, что делает недействительными стандартные шкалы риска, такие как Фрамингемская шкала. Кроме того, пациенты часто получали расширенную первичную и вторичную профилактическую терапию (антиагрегантную и антигипертензивную терапию, снижение липидного уровня, прекращение курения и реваскуляризация). Таким образом, общепринятые факторы риска часто слабо коррелируют с ишемической болезнью сердца (ИБС) [3] или прогнозами у пациентов с подтвержденными ССЗ [4, 5]. Это ограничивает область определения пациентов с высоким риском, который может быть снижен при более интенсивной терапии.
Для дополнения клинических факторов были предложены ряд различных маркеров риска с потенциально новыми механизмами. Натрийуретический пептид типа B (мозговой натрийуретический пептид; МНП) определяет нагрузку на сердце и функциональную способность [6], но редко учитывается в клинической практике вне оценки сердечной недостаточности, несмотря на убедительные доказательства его применения у пациентов с ИБС [7]. Технологии для измерения пульсовой волны используются в качестве заменителей при ригидности сосудов [8]; однако их ценность при стандартном артериальном давлении неясна. Вариабельность сердечного ритма (ВСР) — маркер вегетативной функции [9], но его эффективность неизвестна при прогнозировании рисков [10]. Высокочувствительный С-реактивный белок (вчСРБ) — эффективный маркер воспаления, хотя дополнительные риски стратификации не установлены [11].
Исследование ARM-CAD («Альтернативные маркеры рисков при ишемической болезни сердца») предназначено для получения объективной оценки неинвазивных маркеров у населения в режиме реального времени. Рандомизированное клиническое исследование было бы неэтичным в этой ситуации, поэтому мы использовали множество методов для снижения возможных отклонений. Оценку рисков проводили перед проведением ангиографии, врачи не были осведомлены о результатах во избежание любых влияний на лечение в течение пяти лет периода наблюдения, исходы оценивались независимой экспертизой. Исследование проводили с целью подтверждения клинического значения маркеров риска путем оценки их взаимосвязи со смертностью, включая смерти от инфаркта миокарда или инсульта до и после плановой коронароангиографии.
Методы
Популяция пациентов
Пациенты, направленные на плановую коронароангиографию, были выбраны в трех центрах города Мельбурн, Австралия, и последовательно зарегистрированы в период с 2006 по 2008 годы после подписания информированного согласия. Критериями исключения были только острый коронарный синдром (ОКС) и предшествующая трансплантация сердца. Всех пациентов обследовали проспективно, до проведения ангиографии; кардиологи не были осведомлены об оценке рисков на протяжении всего периода наблюдения. Исследование было подтверждено местными этическими комитетами, проведено в соответствии с Хельсинкской декларацией и проспективно зарегистрировано ( clinicaltrials.gov).
Маркеры риска
Общепринятые факторы риска были определены посредством визитов исследователя к пациентам и анализов крови в дополнение к тщательному сбору анамнеза. Подтверждение проводили с применением электронных медицинских карт и записей. Информация об участниках была собрана с помощью специальной электронной системы отчетов о медицинских случаях отдельно от всех клинических баз данных. Определение маркеров риска было опубликовано ранее [3, 8, 9].
Коронароангиография
Коронароангиография проводилась квалифицированными операторами согласно стандартизированным процедурам. Пациенты были разделены на группы: здоровые, с небольшими бляшками или с люминальным стенозом (≥ 50%) на некоторых участках коронарных артерий в магистральных сосудах или крупных протоках. Чтобы обеспечить согласованность, центральная лаборатория ангиографии произвольным образом оценивала ангиограммы в каждом центре с помощью двух квалифицированных операторов, не осведомленных о деталях исследования.
Исходы
Все причины смертности, включая смерти от ИМ или инсульта, были независимо зарегистрированы врачами, не осведомленными о состоянии пациентов. Для регистрации событий были необходимы документальные подтверждения диагноза (к примеру, свидетельство о смерти, диагноз кардиолога или невролога или тропонин-положительный ОКС). Кроме того, была собрана подробная информация о чрескожном коронарном вмешательстве (ЧКВ), аортокоронарном шунтировании (АКШ) и других клинических явлениях во время периода наблюдения при помощи просмотра электронных и физических записей, обсуждения с наблюдающими пациентов кардиологами или врачами общей практики, а также ежегодного опроса участников по телефону.
Статистические данные
Значения представлены в виде среднего значения ± межквартильный размах (МКР 25–75-го центиля) или процентного соотношения. Переменные факторов риска оценивались в терцилях по методу Каплана — Мейера и непрерывно в модели регрессии Кокса. В тех случаях, когда переменные показали размытое распределение (например, МНП, вчСРБ, мощность ВСР и шкалы риска), они были нормализованы для статистического анализа путем взятия натурального логарифма. Мы предварительно указали точки пересечения для ряда интересующих переменных: МНП — 100 пг/мл, центральное аугментационное давление — 24 мм рт. ст., центральное пульсовое давление — 50 мм рт. ст., НЧ-диапазон ВСР — 250 мс2 и вчСРБ — 3 мг/л. Сравнения групп проводили посредством критерия Краскела — Уоллиса для дисперсионного анализа при подборе p-значений для множественных сравнений. Группы Каплана — Мейера сравнивали по логранговому критерию оценки бинарных переменных и логранговому критерию в терцилях.
Основная многовариантная модель Кокса включает возраст, пол, курение, систолическое и диастолическое артериальное давление, использование антагонистов ренин-ангиотензин-альдостерона, уровень общего холестерина, терапию статинами, наличие сахарного диабета, предшествующего инфаркта миокарда, МНП, объем ИБС при ангиографии, систолическую дисфункцию левого желудочка и реваскуляризацию в период наблюдения. Отдельно были добавлены дополнительные маркеры риска. Также был включен зависимый от времени термин взаимодействия; результаты отображаются в виде относительного риска (ОР) и связанных с ним 95% доверительных интервалов (ДИ). Проведено последовательное включение пороговых значений p < 0,2 более широкой области переменных (включая функцию почек, индекс массы тела и другое медицинское лечение), но это не повлияло на результаты. Взаимосвязи оценивали при помощи измерения коэффициента вероятности, предположение о пропорциональных рисках было подтверждено использованием остатков Шенфельда. Для понимания влияния модификации факторов риска в течение времени анализы были повторно проведены через год.
С-статистика Харрелла (область под ROC-кривой) и D-статистика Сомерса были подсчитаны с показателями МНП и без них в финальной модели для оценки его аддитивности. Эти статистики сравнивали по описанным методам [12] со случайным образом сгенерированными настройками деривации и валидации равных размеров, стратифицированными по возрасту и систолической дисфункции левого желудочка. Для обнаружения различительной способности исходных значений МНП рассчитали улучшение чистой реклассификации и интегрированное улучшение дискриминационной способности, используя логистическую регрессию в многовариантной модели с добавлением параметра МНП к общепринятым предикторам клинического риска (возраст, мужской пол, эпизоды ССЗ в семейном анамнезе, курение, предшествующий ИМ, диабет, артериальное давление ≥ 140 / ≥ 90 мм рт. ст., гипертензивная терапия, общий холестерин > 5,2 ммоль/л [200 мг/дл], стеноз ≥ 50% при ангиографии и фракция выброса левого желудочка [ФВЛЖ] < 50%) [13]. Точки пересечения были предварительно установлены на 20%, 30% и 40% для отображения высоких пропорций события и прогнозирования рисков смерти.
Апостериорный анализ проводили (1) для исключения пациентов с предсердными аритмиями из центрального аугментационного давления и ВСР-диаграммы Каплана — Мейера, (2) для оценки влияния ВСР у пациентов без реваскуляризации, (3) для определения любых взаимодействий МНП с тяжестью ИБС и диастолической дисфункцией, (4) для исключения пациентов с нормальной коронароангиографией и (5) для оценки предварительно указанных точек пересечения МНП 100 пг/мл.
Двустороннее p-значение < 0,05 считали статистически значимым. В измерениях использовали данные завершенных случаев, поскольку утраченных данных было немного (подстановка не производилась). Статистический анализ проводили с помощью программного обеспечения Stata (версия 14.2, StataCorp LP, Техас, США).
Результаты
Динамическое популяционное исследование ARM-CAD состояло из 526 пациентов, отобранных перед проведением плановой коронароангиографии. Средний период наблюдения составил пять лет (МКР 3,5–6,0). Данные четверых участников, полученные в период наблюдения, недоступны (0,8%, Рис. 1).
 Рисунок 1. Графическая схема исследования ARM-CAD. Включает независимо подтвержденные события, разделенные в соответствии с исходными показателями МНП. МНП — натрийуретический пептид типа B; ЧКВ — чрескожное коронарное вмешательство; АКШ — аортокоронарное шунтирование (ЧКВ и АКШ не являются взаимоисключающими)
Рисунок 1. Графическая схема исследования ARM-CAD. Включает независимо подтвержденные события, разделенные в соответствии с исходными показателями МНП. МНП — натрийуретический пептид типа B; ЧКВ — чрескожное коронарное вмешательство; АКШ — аортокоронарное шунтирование (ЧКВ и АКШ не являются взаимоисключающими)Исходные характеристики и корреляции
Таблица 1 отражает базовые демографические данные для исследуемой популяции, средний возраст — 66 лет (МКР 58–73) и ФВЛЖ 64% (МКР 53–71%). Перед проведением ангиографии у 394 пациентов (75,5%) выявили боль в области груди, у 335 (64,2%) — диспноэ различной степени. У 12 пациентов (2,3%) в анамнезе эпизоды сердечной недостаточности. Широкий диапазон значений МНП коррелировал со стадией систолической дисфункции левого желудочка, но не с центральным пульсовым давлением. МНП находился в диапазоне сердечной недостаточности (> 400 пг/мл) только у 5,6%.
Таблица 1. Исходные характеристики
Ишемическая болезнь сердца, реваскуляризация и снижение риска
У большинства пациентов (80%) в начале исследования при проведении ангиографии была выявлена атерома на различных стадиях, у 62% — один и более люминальных стенозов ≥ 50%. В течение пяти лет периода наблюдения у 15,6% пациентов было проведено АКШ, у 29,9% — по меньшей мере одно ЧКВ (стент с элюирующим лекарственным покрытием использовали у 55% пациентов). Схожее число проведенных реваскуляризаций выявлено у пациентов с показателями МНП ≤ 100 пг/мл в начале исследования и > 100 пг/мл (p = 0,69; см. распределение на рис. 1. До проведения ангиографии пациенты получали интенсивную терапию, проводимую высококвалифицированным персоналом вторичной медицинской помощи: среднее число посещений госпиталя каждым пациентом — 1,3 в течение первых 12 месяцев после проведения ангиографии (стандартное отклонение — 0,6 посещений).
Установленные исходы
47 участников (9,0%) умерли в период наблюдения. ССЗ стали причиной 23 смертей (49%), из которых 18 (38%) — в результате кардиогенных причин и 5 (11%) — от инсульта. Смерть, инфаркт или инсульт миокарда произошли у 100 участников (19,2%, общее число событий — 109). Одномерный анализ Каплан — Мейера подтвердил значительную тенденцию по терцилям МНП как через год с момента начала исследования, так и в период пятилетнего наблюдения (рис. 2а). ВчСРБ (рис. 2b) и центральное аугментационное давление (рис. 2c) не связаны с исходами в любой момент времени, тогда как отношение мощности НЧ- и ВЧ-диапазонов ВСР было значимым в течение первого года наблюдения, но не в течение пяти лет (рис. 2d). С другой стороны, Фрамингемская шкала риска (рис. 2e) и распространение ИБС при ангиографии (рис. 2f) были незначимы в первый год, но оказались статистически связаны с побочными исходами в конце наблюдения. Ни Фрамингемская шкала, ни шкала SCORE не были значимы за исключением параметров возраста.
 Рисунок 2. Кривые Каплана — Мейера для летального исхода, инфаркта миокарда или инсульта. Врачи не были осведомлены об исходных маркерах риска, за исключением результатов коронароангиографии. p-значения внесены в статистику ХИ-квадрата логрангового критерия для анализа изменения начальных показателей через год и через пять лет наблюдения. Соответствующие p-значения для общей летальности в течение пяти лет наблюдения: a) МНП p = 0,001, b) вчСРБ p = 0,27, c) центральное аугментационное давление p = 0,38, d) НЧ- и ВЧ-диапазон ВСР p = 0,30, е) риск по Фрамингемской шкале p = 0,026, f) ишемическая болезнь на ангиографии р = 0,09. * Апостериорное исключение пациентов с предсердной аритмией на исходном уровне или после наблюдения не оказало влияния на результаты. † Апостериорное исключение пациентов после проведения любых реваскуляризаций в течение пяти лет привело к показателю p-отклонения = 0,029 для летальных исходов в результате ИМ или сердечно-сосудистых осложнений и 0,18 только для смертности. ИБС — ишемическая болезнь сердца
Рисунок 2. Кривые Каплана — Мейера для летального исхода, инфаркта миокарда или инсульта. Врачи не были осведомлены об исходных маркерах риска, за исключением результатов коронароангиографии. p-значения внесены в статистику ХИ-квадрата логрангового критерия для анализа изменения начальных показателей через год и через пять лет наблюдения. Соответствующие p-значения для общей летальности в течение пяти лет наблюдения: a) МНП p = 0,001, b) вчСРБ p = 0,27, c) центральное аугментационное давление p = 0,38, d) НЧ- и ВЧ-диапазон ВСР p = 0,30, е) риск по Фрамингемской шкале p = 0,026, f) ишемическая болезнь на ангиографии р = 0,09. * Апостериорное исключение пациентов с предсердной аритмией на исходном уровне или после наблюдения не оказало влияния на результаты. † Апостериорное исключение пациентов после проведения любых реваскуляризаций в течение пяти лет привело к показателю p-отклонения = 0,029 для летальных исходов в результате ИМ или сердечно-сосудистых осложнений и 0,18 только для смертности. ИБС — ишемическая болезнь сердцаВо всех многовариантных моделях среди индивидуальных исходных маркеров риска только возраст и МНП были связаны с побочными исходами (Таблица 2). Для общей летальности рост ОР на каждые 10 лет составил 2,29 (95% ДИ 1,51–3,48; p = 0,0001) после применения общепринятых факторов риска, медицинской терапии, распространения ИБС при ангиографии и явной систолической дисфункции левого желудочка. На каждую единицу повышения МНП скорректированный ОР составил 2,15 (95% ДИ 1,45–3,19; p = 0,0001) без взаимодействия с систолической дисфункцией левого желудочка (pвзаимодействие = 0,69). Аналогичные результаты наблюдались для смертей от ИМ и инсультов. И Фрамингемская шкала, и шкала SCORE были связаны с побочными исходами в многовариантном анализе без взаимодействия с исходными ССЗ (все pвзаимодействия ≥ 0,50; Таблица 2). Проведение реваскуляризации в период наблюдения было связано со значимым снижением риска летального исхода; при скорректированном ОР 0,45 (95% ДИ 0,23–0,87; p = 0,018).
Таблица 2. Многовариантный анализ
У пациентов с исходными показателями МНП > 100 пг/мл исходы были более неблагоприятными. Смерти зарегистрированы в 24/115 (20,9%) против 23/407 (5,7%) случаев у пациентов с показателями МНП ≤ 100 пг/мл со скорректированным ОР 4,49 (95% ДИ 2,09–9,62; p = 0,0001) без взаимодействий при анализе подгруппы. Смерть, инфаркт или инсульт миокарда зарегистрированы у 37/115 (32,2%) пациентов с показателями МНП > 100 пг/мл против 63/407 (15,5) с показателями МНП ≤ 100 пг/мл при скорректированном ОР 1,95 (95% ДИ 1,20–3,18; p = 0,007). Кривые выживания Каплана — Мейера представлены на рис. 3 с четким и ранним разделением у пациентов с исходными показателями МНП > 100 пг/мл для всех исходов. Другие точки пересечения не были статистически значимыми, в том числе значения центрального аугментационного давления, центрального пульсового давления, мощности НЧ-диапазона ВСР и вчСРБ. При анализе чувствительности показатели МНП > 100 пг/мл имели ту же корреляцию с комбинированными исходами после исключения пациентов с нормальной коронароангиографией (скорректированный ОР 2,03, 95% ДИ 1,23–3,34; p = 0,006; n = 420) или пациентов с любой степенью систолической дисфункции левого желудочка (скорректированный ОР 2,55 95% ДИ 1,40–4,61; p = 0,002; n = 423).
 Рисунок 3. Кривые побочных событий Каплана — Мейера согласно предварительно установленным точкам пересечения МНП 100 пг/мл для a) общей летальности и b) смертей от ИМ или инсульта. МНП — натрийуретический пептид типа B; ИМ — инфаркт миокарда
Рисунок 3. Кривые побочных событий Каплана — Мейера согласно предварительно установленным точкам пересечения МНП 100 пг/мл для a) общей летальности и b) смертей от ИМ или инсульта. МНП — натрийуретический пептид типа B; ИМ — инфаркт миокардаДискриминационное значение МНП
Добавление МНП в качестве непрерывной переменной увеличило C-статистику Харрелла и D-статистику Сомерса в многомерных моделях (t = 4,0, p < 0,001 и t = 5,9, p < 0,001 соответственно для смертности от всех причин). С-статистика в выборке со случайной валидацией составила 0,91 при показателях МНП и 0,69 — без них. При добавлении к общепринятым предикторам риска МНП > 100 против ≤ 100 пг/мл улучшилась классификация смерти (чистое улучшение в десяти случаях из 47 случаев смерти, 21,3%) с минимальным изменением в классификации выживших (чистое улучшение в двух случаях из 475 выживших, 0,4%. Анализы чистых улучшений реклассификации (NRI) и интегрированного улучшения дискриминационной способности (IDI) были очень значимыми (NRI 0,281, p = 0,003; IDI 0,038, p = 0,0007). На рисунке 4 показана контурная карта прогнозирования, объединяющая возраст и МНП для оценки клинического риска пятилетней смертности.
 Рисунок 4. Контурная карта риска при скорректированной смертности в соответствии с возрастом и МНП. Пример: 75-летний пациент с показателем МНП 25 пг/мл имел прогнозируемую пятилетнюю смертность 0–5% относительно 10–20% у пациентов того же возраста с показателем МНП 200 пг/мл. Обратите внимание, что оценки риска основаны на когорте пациентов ARM-CAD с обширной модификацией факторов риска и сопутствующим заболеванием, реваскуляризацией по мере необходимости и высококвалифицированными врачами вторичной помощи
Рисунок 4. Контурная карта риска при скорректированной смертности в соответствии с возрастом и МНП. Пример: 75-летний пациент с показателем МНП 25 пг/мл имел прогнозируемую пятилетнюю смертность 0–5% относительно 10–20% у пациентов того же возраста с показателем МНП 200 пг/мл. Обратите внимание, что оценки риска основаны на когорте пациентов ARM-CAD с обширной модификацией факторов риска и сопутствующим заболеванием, реваскуляризацией по мере необходимости и высококвалифицированными врачами вторичной помощиОбсуждение
Наше исследование повышает важность МНП, маркера дисфункции миокарда, для включения неблагоприятных сердечно-сосудистых событий и смерти у пациентов с подозрением на ИБС, даже при небольшом повышении МНП (что свидетельствует о скрытой сердечной недостаточности). Корреляция МНП с прогнозом не зависела от явной систолической дисфункции левого желудочка, возраста и других факторов риска и сохранялась, несмотря на эффективную модификацию первичного и вторичного факторов риска и высокие показатели реваскуляризации в течение пяти лет. Напротив, другие маркеры риска, которые фокусируются на сосудистом давлении и артериальной податливости (PWA), воспалительных реакциях (вчСРБ) и вегетативной функции (ВСР), были зависимыми от модификации риска. Преимуществами когортного исследования ARM-CAD были включение неотобранных последовательных пациентов (с результатами, общими для обычной клинической практики); сокрытие оценки риска от клиницистов; строгая оценка и последующее наблюдение, определяемые протоколом; низкие показатели потери для последующего наблюдения; самостоятельное вынесение решения о неблагоприятных исходах.
Определение сердечно-сосудистого риска
Показатели риска, такие как шкала GRACE («Глобальный реестр острых коронарных событий») для пациентов с ОКС [14], подтверждают, что многие из исходных факторов риска Фрамингемского исследования сердца могут потерять актуальность у пациентов с распространенными сердечно-сосудистыми заболеваниями. В проведенном нами исследовании только показатель возраста был независимо связан с исходами. Это подчеркивает необходимость поиска альтернативных маркеров, которые помогут определять пациентов с высоким остаточным риском независимо от управления факторами риска и наличия заболевания.
Измерение пульсовой волны
После двух крупных исследований исходов у пациентов, не имеющих серьезных ССЗ [15, 16], полученные формы аортального сигнала в настоящее время часто используются в научных исследованиях в качестве суррогатных показателей исхода. Наш анализ у коморбидных пациентов, у которых количество клинических явлений было почти в четыре раза больше, чем в предыдущем исследовании [17], не обнаружил никакой связи между формой артериальной волны и клиническими исходами. Это может быть связано с лечением основных факторов риска и применением вазоактивных препаратов, которые, как известно, влияют на центральное давление [18].
Вариабельность сердечного ритма
Низкая ВСР связана с повышенным риском возникновения внезапных клинических явлений у пациентов без ССЗ [19], может отличать пациентов с осложненным течением после ИМ [20, 21] и является прогностическим маркером сердечной недостаточности [22]. Наши предыдущие результаты подтверждают, что снижение вариабельности сердечного ритма было независимым предиктором наличия и тяжести ИБС при ангиографии [9]. В настоящем анализе мы определили значимую взаимосвязь клинических явлений в течение года с момента начала исследования, но не выявили корреляции на момент окончания периода наблюдения даже при многовариантном анализе. То, что ВСР не полностью независима от общепринятых факторов или что реваскуляризация может играть определенную роль, может быть связано с недостаточной мощностью (однако в этом случае клиническая ценность, вероятно, будет небольшой) [10]. Затем мы исключили пациентов с перенесенными операциями по реваскуляризации и определили статистически значимую тенденцию для терцилей отношения мощности НЧ- и ВЧ-диапазона ВСР в течение пяти лет. Тем не менее, это следует рассматривать как гипотезу из-за меньшего размера выборки (n = 223) и апостериорной оценки. Также важно отметить, что измерение данных ВСР было неудачным у 11% нашей группы, в основном из-за нарушений ритма [9].
Биомаркеры
ВчСРБ широко изучался как маркер воспаления, но обладает относительно слабой способностью изменять клиническое ведение [11]. В нашей слепой оценке группы с расширенным контролем над рисками не обнаружено никакой связи с долгосрочными исходами.
Напротив, МНП не зависел от других факторов риска и был единственным индивидуальным маркером (кроме возраста), который был связан с клиническими исходами в многомерном анализе. МНП вырабатывается миокардом в ответ на стресс на стенке и способствует уменьшению венозного возврата к сердцу за счет воздействия на эндотелий сосудов (расслабление гладких мышц и повышение проницаемости эндотелия), почки (стимуляция диуреза и натрийуреза) и подавление активации симпатического рефлекса [23, 24]. У пациентов с ИБС или ОКС МНП является мощным предиктором смерти и других клинических явлений [25, 26, 27], с аналогичными результатами для NT-proBNP [28, 29]. Интересно, что МНП не связан с клиническими явлениями у здоровых пациентов с нормальной эхокардиограммой и отсутствием сердечно-сосудистых факторов риска [30]. Механизм повышения МНП у пациентов с коронарным атеросклерозом, но отсутствием некроза миокарда, по-видимому, является преходящей систолической дисфункцией левого желудочка, вызывая стресс миокарда и активацию транскрипции гена МНП. Эта гипотеза подтверждается данными о том, что увеличение ишемической нагрузки и, следовательно, увеличение объема пораженного миокарда приводит к пропорционально более высокому повышению уровня МНП [31]. В нашем исследовании степень тяжести ИБС с учетом нарушения обычного коронарного кровотока действительно коррелировала с уровнем МНП, хотя и слабо. Однако не было никакого взаимодействия с корреляцией МНП с неблагоприятными клиническими событиями. Влияние гибернации миокарда и характер самого ишемического инсульта являются сложными вопросами, которые усугубляются неявной или преходящей систолической или диастолической дисфункцией левого желудочка [32, 33]. Как и другие исследования, мы демонстрируем, что МНП является гораздо более чувствительным маркером, чем параметры визуализации систолической дисфункции [29, 34], а также устанавливаем, что МНП является маркером риска, не зависящим от модификации риска или инцидентной реваскуляризации. Наша точка пересечения МНП 100 пг/мл была определена предварительно, но при последующем анализе продемонстрировала себя как хорошая точка перегиба для повышения риска клинических явлений.
Наши данные подтверждают пользу натрийуретических пептидов для стандартной оценки не только пациентов с сердечной недостаточностью, но и тех, которые находятся под наблюдением по подозрению на ИБС, даже без явной систолической дисфункции. МНП и NT-proBNP доступны во всем мире, относительно дешевы и могут улучшить как классификацию, так и распознавание для более отдаленных исходов. Во время первоначальной оценки выявление пациентов с незначительным повышением уровня натрийуретического пептида (МНП > 100 пг/мл; примерно эквивалентно NT-proBNP > 300 пг/мл) предполагает профиль высокого риска. У таких пациентов было бы разумно рассмотреть дальнейшее фармакологическое или интервенционное лечение, хотя необходимы дополнительные исследования, чтобы установить, улучшит ли проактивная интенсивная терапия прогноз.
Ограничения
Поскольку это исследование было наблюдательным, остаются потенциальные отклонения, которые следует учитывать, в том числе отбор для коронароангиографии (особенно у пациентов с зафиксированной ИБС или предыдущей реваскуляризацией, которым с большей вероятностью предложат ангиографию). Известно, что уровень МНП после АКШ зависит от ряда взаимодействующих и переменных факторов [35]; поэтому все анализы были повторены в когорте пациентов без предшествующего АКШ, и результаты были идентичны представленным. Также важно отметить, что показатели реваскуляризации были одинаковыми, независимо от исходной (слепой) категории МНП Хотя врачи не были осведомлены об оценке рисков, мы не исключаем возможности того, что биомаркеры могли быть проверены в клинической практике в течение периода наблюдения. Малое количество исходов сердечной недостаточности является ограничением исследования. Изучение диастолической дисфункции не являлось требованием протокола этого исследования. Внеочередной анализ у пациентов с имеющимися данными (n = 142) показал, что соотношение E/A при митральном притоке > 2, соотношение E/e' тканевого допплера ≥ 13, или составные показатели диастолического нарушения не взаимодействуют с корреляцией МНП с исходами (p-значимости = 0,16 для смерти, p-значимости = 0,72 для сложных клинических явлений).
Выводы
Общепринятые факторы риска и другие маркеры податливости сосудистой стенки, воспаления и вегетативной функции имели ограниченные значения для прогнозирования долгосрочных исходов у пациентов с модифицированным риском, обследованных на ишемическую болезнь сердца. Показатель МПН имеет строгую корреляцию с летальным исходом и сердечно-сосудистыми явлениями, даже при отсутствии сердечной недостаточности или явных дисфункций желудочка, независимо от реваскуляризации. МНП > 100 пг/мл может определять пациентов со скрытым нарушением сердечной деятельности, что теоретически полезно для раннего, целевого и индивидуализированного лечения с целью улучшения прогнозов.
Список использованной литературы
- Wilson PW, D'Agostino RB, Levy D, Belanger AM, Silbershatz H, Kannel WB. Prediction of coronary heart disease using risk factor categories. Circulation. 1998;97:1837–47.
- Conroy RM, Pyorala K, Fitzgerald AP, Sans S, Menotti A, De Backer G, et al. Estimation of ten-year risk of fatal cardiovascular disease in Europe: the SCORE project. Eur Heart J. 2003;24:987–1003.
- Kotecha D, Flather M, McGrady M, Pepper J, New G, Krum H, et al. Contemporary predictors of coronary artery disease in patients referred for angiography. Eur J Cardiovasc Prev Rehabil. 2010;17:280–8.
- Halkin A, Singh M, Nikolsky E, Grines CL, Tcheng JE, Garcia E, et al. Prediction of mortality after primary percutaneous coronary intervention for acute myocardial infarction: the CADILLAC risk score. J Am Coll Cardiol. 2005;45:1397–405.
- Bottle A, Mozid A, Grocott HP, Walters MR, Lees KR, Aylin P, et al. Preoperative risk factors in 10 418 patients with prior myocardial infarction and 5241 patients with prior unstable angina undergoing elective coronary artery bypass graft surgery. Br J Anaesth. 2013;111:417–23.
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JG, Coats AJ, et al. 2016 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC) developed with the special contribution of the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2016;37:2129–200.
- Palazzuoli A, Caputo M, Fineschi M, Navarri R, Calabro A, Cameli M, et al. B-type natriuretic peptide as an independent predictor of coronary disease extension in non-ST elevation coronary syndromes with preserved systolic function. Eur J Prev Cardiol. 2012;19:366–73.
- Kotecha D, New G, Collins P, Eccleston D, Krum H, Pepper J, et al. Radial artery pulse wave analysis for non-invasive assessment of coronary artery disease. Int J Cardiol. 2013;167:917–24.
- Kotecha D, New G, Flather MD, Eccleston D, Pepper J, Krum H. Five-minute heart rate variability can predict obstructive angiographic coronary disease. Heart. 2012;98:395–401.
- Compostella L, Lakusic N, Compostella C, Truong LV, Iliceto S, Bellotto F. Does heart rate variability correlate with long-term prognosis in myocardial infarction patients treated by early revascularization? World J Cardiol. 2017;9:27–38.
- Yousuf O, Mohanty BD, Martin SS, Joshi PH, Blaha MJ, Nasir K, et al. High-sensitivity C-reactive protein and cardiovascular disease: a resolute belief or an elusive link? J Am Coll Cardiol. 2013;62:397–408.
- Newson RB. Comparing the predictive powers of survival models using Harrell’s C or Somers’ D. Stata J. 2004;10:339–58.
- Sundstrom J, Byberg L, Gedeborg R, Michaelsson K, Berglund L. Useful tests of usefulness of new risk factors: tools for assessing reclassification and discrimination. Scand J Public Health. 2011;39:439–41.
- Fox KA, Dabbous OH, Goldberg RJ, Pieper KS, Eagle KA, Van de Werf F, et al. Prediction of risk of death and myocardial infarction in the six months after presentation with acute coronary syndrome: prospective multinational observational study (GRACE). BMJ. 2006;333:1091.
- Williams B, Lacy PS, Thom SM, Cruickshank K, Stanton A, Collier D, et al. Differential impact of blood pressure-lowering drugs on central aortic pressure and clinical outcomes: principal results of the Conduit Artery Function Evaluation (CAFE) study. Circulation. 2006;113:1213–25.
- Roman MJ, Devereux RB, Kizer JR, Lee ET, Galloway JM, Ali T, et al. Central pressure more strongly relates to vascular disease and outcome than does brachial pressure: the Strong Heart Study. Hypertension. 2007;50:197–203.
- Weber T, Auer J, O'Rourke MF, Kvas E, Lassnig E, Lamm G, et al. Increased arterial wave reflections predict severe cardiovascular events in patients undergoing percutaneous coronary interventions. Eur Heart J. 2005;26:2657–63.
- Shah NK, Smith SM, Nichols WW, Lo MC, Ashfaq U, Satish P, et al. Carvedilol reduces aortic wave reflection and improves left ventricular/vascular coupling: a comparison with atenolol (CENTRAL study). J Clin Hypertens (Greenwich). 2011;13:917–24.
- Hillebrand S, Gast KB, de Mutsert R, Swenne CA, Jukema JW, Middeldorp S, et al. Heart rate variability and first cardiovascular event in populations without known cardiovascular disease: meta-analysis and dose-response meta-regression. Europace. 2013;15:742–9.
- Bigger JT, Fleiss JL, Rolnitzky LM, Steinman RC. The ability of several short-term measures of RR variability to predict mortality after myocardial infarction. Circulation. 1993;88:927–34.
- Odemuyiwa O, Malik M, Farrell T, Bashir Y, Poloniecki J, Camm J. Comparison of the predictive characteristics of heart rate variability index and left ventricular ejection fraction for all-cause mortality, arrhythmic events and sudden death after acute myocardial infarction. Am J Cardiol. 1991;68:434–9.
- Nolan J, Batin PD, Andrews R, Lindsay SJ, Brooksby P, Mullen M, et al. Prospective study of heart rate variability and mortality in chronic heart failure: results of the United Kingdom heart failure evaluation and assessment of risk trial (UK-heart). Circulation. 1998;98:1510–6.
- Levin ER, Gardner DG, Samson WK. Natriuretic peptides. N Engl J Med. 1998;339:321–8.
- von Lueder TG, Kotecha D, Atar D, Hopper I. Neurohormonal blockade in heart failure. Cardiac Fail Rev. 2016;3:19–24.
- de Lemos JA, Morrow DA, Bentley JH, Omland T, Sabatine MS, McCabe CH, et al. The prognostic value of B-type natriuretic peptide in patients with acute coronary syndromes. N Engl J Med. 2001;345:1014–21.
- Kragelund C, Gronning B, Kober L, Hildebrandt P, Steffensen R. N-terminal pro-B-type natriuretic peptide and long-term mortality in stable coronary heart disease. N Engl J Med. 2005;352:666–75.
- Schnabel R, Lubos E, Rupprecht HJ, Espinola-Klein C, Bickel C, Lackner KJ, et al. B-type natriuretic peptide and the risk of cardiovascular events and death in patients with stable angina: results from the AtheroGene study. J Am Coll Cardiol. 2006;47:552–8.
- Di Angelantonio E, Chowdhury R, Sarwar N, Ray KK, Gobin R, Saleheen D, et al. B-type natriuretic peptides and cardiovascular risk: systematic review and meta-analysis of 40 prospective studies. Circulation. 2009;120:2177–87.
- Jernberg T, James S, Lindahl B, Johnston N, Stridsberg M, Venge P, et al. Natriuretic peptides in unstable coronary artery disease. Eur Heart J. 2004;25:1486–93.
- McKie PM, Cataliotti A, Lahr BD, Martin FL, Redfield MM, Bailey KR, et al. The prognostic value of N-terminal pro-B-type natriuretic peptide for death and cardiovascular events in healthy normal and stage A/B heart failure subjects. J Am Coll Cardiol. 2010;55:2140–7.
- Sabatine MS, Morrow DA, de Lemos JA, Omland T, Desai MY, Tanasijevic M, et al. Acute changes in circulating natriuretic peptide levels in relation to myocardial ischemia. J Am Coll Cardiol. 2004;44:1988–95.
- Palazzuoli A, Poldermans D, Capobianco S, Giannotti G, Iovine F, Campagna MS, et al. Rise and fall of B-type natriuretic peptide levels in patients with coronary artery disease and normal left ventricular function after cardiac revascularization. Coron Artery Dis. 2006;17:419–23.
- Redfors B, Chen S, Crowley A, Ben-Yehuda O, Gersh BJ, Lembo NJ, et al. B-type natriuretic peptide assessment in patients undergoing revascularization for left main coronary artery disease. Circulation. 2018;138:469–78.
- Richards M, Nicholls MG, Espiner EA, Lainchbury JG, Troughton RW, Elliott J, et al. Comparison of B-type natriuretic peptides for assessment of cardiac function and prognosis in stable ischemic heart disease. J Am Coll Cardiol. 2006;47:52–60.
- Berendes E, Schmidt C, Van Aken H, Hartlage MG, Rothenburger M, Wirtz S, et al. A-type and B-type natriuretic peptides in cardiac surgical procedures. Anesth Analg. 2004;98:11–9.





