5383
29 Октября 2021
Авторское право © 2019, Neda M. Bogari, Ashwag Aljohani, Amr A. Amin, Faisal A. Al-Allaf, Anas Dannoun, Mohiuddin M. Taher, Atalla Elsayed, Dareen ibrahim Rednah, Osama Elkhatee, Massimo Porqueddu, Francesco Alamanni, Soud Abdulraof A. Khogeer, Ahmed Fawzy (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Богари Неда М., Ашваг Алджохани, Амр А. Амин, Фейсал А. Аль-Аллаф, Анас Даннун, Мохиуддин М. Тахер, Аталла Эльсайе, Д...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Богари Неда М., Ашваг Алджохани, Амр А. Амин, Фейсал А. Аль-Аллаф, Анас Даннун, Мохиуддин М. Тахер, Аталла Эльсайе, Д...
Авторское право © 2019, Neda M. Bogari, Ashwag Aljohani, Amr A. Amin, Faisal A. Al-Allaf, Anas Dannoun, Mohiuddin M. Taher, Atalla Elsayed, Dareen ibrahim Rednah, Osama Elkhatee, Massimo Porqueddu, Francesco Alamanni, Soud Abdulraof A. Khogeer, Ahmed Fawzy (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Богари Неда М., Ашваг Алджохани, Амр А. Амин, Фейсал А. Аль-Аллаф, Анас Даннун, Мохиуддин М. Тахер, Аталла Эльсайе, Дарин Ибрагим Редна, Усама Эльхати, Массимо Поркиеду, Франческо Аламанни, Суд Абдулраоф А. Хогир, Ахмед Фаузи
BMC Cardiovascular Disorders201919:2
Введение
Повышенное содержание триглицеридов в плазме крови является основным фактором риска и играет важную роль в развитии коронарной недостаточности (КН). Доказана взаимосвязь между снижением уровня липидов в крови и снижением уровня смертности среди пациентов, страдающих КН. Целью данного исследования является изучение влияния полиморфного варианта c.553G > T (rs2075291) гена алипопротеина А5 (APOA5) на уровень триглицеридов у пациентов с КН, принимающих гиполидемический препарат аторвастатин.
Методика
В ходе исследования обнаружено, что полиморфный вариант c.553G > T гена APOA5, который вызывает замену цистеина на глицин в позиции 185 соответствующего белка (G185C), ассоциируется с повышенным уровнем триглицеридов. В исследовании применялся метод «случай-контроль» с участием 608 пациентов, проживающих в одном регионе.
Результаты
Уровень триглицеридов у носителей аллеля Т был значительно ниже, чем у пациентов с генотипом GT в контрольной группе (χ2 = 2.382E2a, Р < 0,001). В целом, у носителей аллеля Т уровень триглицеридов был ниже, чем у пациентов с генотипом GG. У пациента, гомозиготного по аллелю Т, наблюдался нормальный уровень холестерина (134 мг/дл), в то время как у пациентов с генотипом GG он находился в диапазоне 25–340 мг/дл (Р < 0,001). Таким образом, наличие полиморфного варианта с.553G > T (rs2075291) гена APOA5 способствует повышению уровня триглицеридов в крови.
Вывод
Тем не менее, установлено, что аллель Т уменьшает содержание триглицеридов в плазме крови пациентов с КН, принимающих препарат аторвастатин, контролирующий уровень холестерина в крови. Таким образом, вариант c.553G > T можно считать значимым фактором прогноза развития гипертриглицеридемии. Кроме того, он может служить отличительным клиническим признаком во время диагностики и прогнозирования течения КН.
Ключевые слова
Коронарная недостаточность (КН) – одно из наиболее часто диагностируемых сердечно-сосудистых заболеваний. Диабет, высокое артериальное давление и диета с высоким содержанием жиров считаются факторами, способствующими развитию КН [1]. Показано, что повышение уровня триглицеридов (ТГ) связано с проявлением КН, тем не менее, механизм этого явления недостаточно изучен [2]. Существует ряд как первичных (главным образом, генетических), так и вторичных факторов (диабет, гиперлипидемия), которые могут способствовать развитию гипертриглицеридемии [2]. Генетические отклонения, способствующие развитию гипертриглицеридемии, влияют на метаболизм триглицеридов [3]. Показано, что избыточная выработка аполипопротеина С3, вызванная генетическими факторами, а также липопротеинлипазы (ЛПЛ) связаны с изменением уровня триглицеридов в крови [4].
Благодаря данным секвенирования геномной ДНК человека был открыт ген аполипопротеина А5 (АРОА5), который принадлежит к семейству регуляторных генов, включающему также гены АРОА1, АРОС3 и АРОА4 [5]. АРОА5 расположен в локусе 11q23 приблизительно в 30 т. п. н. от гена АРОА4 и содержит четыре экзона. В ряде исследований показано, что данный, недавно идентифицированный локус играет важную роль в гомеостазе триглицеридов, так как кодирует белок аполипопротеин А5, снижающий уровень триглицеридов в плазме крови [6]. Структурные изменения в гене АРОА5 могут привести к колебаниям уровня ТГ в плазме крови. Точечные мутации гена АРОА5 приводят к неполной сборке белка apoA-V и преимущественно встречаются у пациентов с гипертриглицеридемией. На данный момент не обнаружено конкретных мутаций, способных вызвать серьезные заболевания, однако результаты ряда исследований показывают возможную ассоциацию между однонуклеотидными полиморфизмами (SNP) гена АРОА5 и рядом заболеваний. Полиморфные варианты -1131 T > C и c.56C > G (S19 W) гена APOA5 являются примерами SNP, ассоциированных с повышенным уровнем триглицеридов в плазме [7]. Также недавно путем секвенирования кодирующего участка гена АРОА5 был выявлен новый полиморфный вариант c.553G > T. Этот SNP приводит к замене аминокислоты цистеина на глицин [4]. Последствия такого замещения были проанализированы, но окончательный вывод еще предстоит сделать. Совсем недавно при изучении полиморфного варианта c.553G > T обнаружено, что свободная SH-группа цистеина в белковой структуре АРОА5 может участвовать в образовании дисульфидных связей с другими белками и тем самым влияет на уровень триглицеридов в крови. [8]. Кроме того, полиморфный вариант c.553G > T (rs2075291) чаще встречался в группе пациентов с острым коронарным синдромом, чем у пациентов контрольной группы[1]. Аторвастатин – препарат, традиционно использующийся для регуляции метаболизма липидов [9]. В соответствии с биофармацевтической классификационной системой аторвастатин является препаратом II категории [10] и принадлежит к семейству статинов, также известных как ингибиторы 3-гидрокси-3-метилглютарил-кофермент А редуктазы [11]. Аторвастатин используется для снижения уровня холестерина у пациентов с КН. При изучении влияния аторвастатина на различные липопротеины обнаружено, что препарат не влияет на содержание ТГ в хиломикронах, липопротеинах низкой плотности (ЛНП), липопротеинах средней плотности (ЛСП), липопротеинах очень низкой плотности (ЛОНП), однако снижает уровень холестерина в этих липопротеинах [12]. Целью данного исследования является оценка влияния полиморфного варианта c.553G > T (rs2075291) на уровень ТГ у пациентов с КН, ежедневно принимающих аторвастатин с целью снижения содержания концентрации липидов в плазме крови.
Методы
Характеристика пациентов
Проведение исследования одобрено экспертным советом организации и научными этическими комитетами (НЭК) медицинского колледжа при Исламском Университете Умм аль-Кура г. Мекка, Королевство Саудовская Аравия. Образцы крови получали после подписания пациентами или их представителями письменного информированного согласия. В исследовании участвовали пациенты с диагнозом КН, подтвержденным данными коронарного ангиографического исследования (стеноз более 50% одной или нескольких артерий, а также устойчивая либо неустойчивая стенокардия). Контрольная группа состояла из здоровых лиц, проживавших в том же регионе, что и пациенты с КН. Большинство больных принимали оптимальные дозы статинов в соответствии с рекомендациями для лечения коронарной недостаточности. Продолжительность курса лечения в данном исследовании не учитывалась.
Для того чтобы исключить наличие у пациентов контрольной группы клинически выраженной КН или других сердечно-сосудистых заболеваний, все лица в контрольной группе прошли клиническое и электрокардиографическое обследование.
Данные лабораторных анализов
Образцы крови объемом 5 мл собирали у пациентов утром, натощак. Показатели липидного профиля сыворотки крови, в том числе уровня триглицеридов (ТГ), общего холестерина (ОХ), холестерина липопротеинов высокой плотности (Х-ЛПВП) и холестерина липопротеинов низкой плотности (Х-ЛПНП) и аполипопротеина измеряли с помощью клинической биохимической системы Dimension® с использованием Flex-реагентов.
Генотипирование ДНК
Геномную ДНК выделяли из образцов периферической крови с использованием набора реагентов для выделения геномной ДНК из цельной крови GeneJET (Thermo Scientific Co. Ltd.) и хранили при температуре − 20°C. Генотипирование полиморфного варианта 553G > T (rs2075291) проводили с использованием полимеразной цепной реакции (ПЦР) и расщеплением эндонуклеазами рестрикции. ПЦР проводили с использованием следующих праймеров: прямые: 5′-AGA CAC CAA GGC CCA GTT GCT GGG ‘3; обратные: 5’-ATG CCG CTC ACC AGG CTC TCG GCG ‘3. Реакцию проводили с использованием амплификатора Veriti (Life Technologies co.) и реагента AmpliTaq Gold 360 Master Mix (Life Technologies co.) в следующих условиях: первоначальная денатурация 95°C / 5 мин., 37 циклов при 95°C / 30 сек., 58°C / 30 сек., 72°C / 1 мин., элонгацию проводили при температуре 72°C / 10 мин. Длина полученного ПЦР-продукта составляла 138 п. н. Далее к 20 мкл ПЦР-продукта добавляли 5 единиц эндонуклеазы рестрикции HaeIII (New England BioLabs Inc.) (общий объем 25 мкл) и инкубировали в течение ночи при температуре 37°C. После расщепления эндонуклеазой рестрикции проводили разделение продуктов в 3% агарозном геле и визуализировали ДНК в ультрафиолете с помощью бромистого этидия. Мы обнаружили фрагменты, состоящие из 138 и 87 п. н. у гетерозиготных (GT) пациентов, один фрагмент размером 138 п. н. у гомозиготных (ТТ) и один фрагмент размером 87 п. н. у гомозиготных пациентов с генотипом GG (рис. 1).
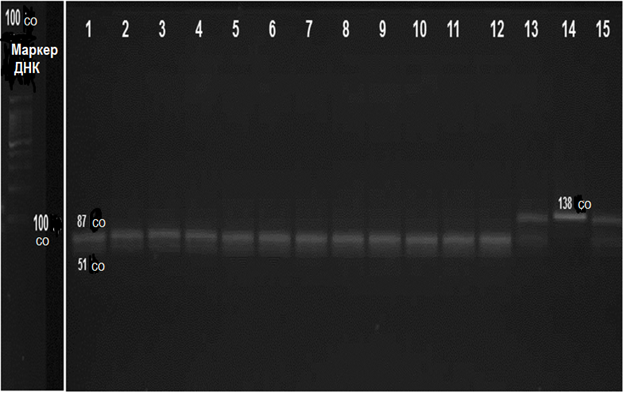 Рисунок 1. Результат ПДРФ-анализа полиморфных вариантов c.553G > T гена APOA5. Продукты разделяли в 2%-ом агарозном геле и окрашивали гель бромистым этидием. Дорожки 1-12 соответствуют гетерозиготному генотипу GG (87 и 51 п. н.); дорожки 13 и 14 соответствуют гетерозиготному генотипу GT (138, 87 и 51 п. н.); дорожка 14 соответствует гомозиготному генотипу ТТ (138 п. н.)
Рисунок 1. Результат ПДРФ-анализа полиморфных вариантов c.553G > T гена APOA5. Продукты разделяли в 2%-ом агарозном геле и окрашивали гель бромистым этидием. Дорожки 1-12 соответствуют гетерозиготному генотипу GG (87 и 51 п. н.); дорожки 13 и 14 соответствуют гетерозиготному генотипу GT (138, 87 и 51 п. н.); дорожка 14 соответствует гомозиготному генотипу ТТ (138 п. н.)
Результаты
Исходные характеристики
В исследование было включено 585 человек, в том числе 247 женщин (130 из них были включены в контрольную группу, 117 – в группу клинических случаев КН) и 338 мужчин (107 включены в контрольную группу, 231 – в группу клинических случаев КН). Исходные характеристики пациентов группы клинических случаев КН (пациенты с КН) и контрольной группы представлены в таблице 1. Статистически значимых различий между группами по полу не наблюдалось. Группы значительно различались по возрасту: средний возраст в контрольной группе был ниже, чем у пациентов с КН. Среднее артериальное давление и уровень глюкозы в крови были выше в контрольной группе, чем у пациентов с КН. Между группами не наблюдались статистически значимые различия в показателях липидного профиля, таких как уровень ЛПНП и ЛПВП. Тем не менее, у пациентов с КН уровень холестерина и триглицеридов был выше по сравнению с контрольной группой, несмотря на прием аторвастатина некоторыми пациентами.
Таблица 1. Исходные характеристики в группе клинических случаев КН и контрольной группе
Взаимосвязь между аллелем Т и содержанием триглицеридов в крови
Содержание ТГ в крови носителей аллеля дикого типа G зависит от приема препарата аторвастатина, снижающего уровень холестерина в плазме крови. У пациентов с КН, принимавших аторвастатин, наблюдался более высокий уровень содержания ТГ в крови по сравнению с пациентами, не принимавшим препарат (средний уровень ТГ 143,5 мг/дл и 125.8 мг/дл соответственно). Аллель Т гена APOA5 обнаружен у двух пациентов мужского пола (генотип TG), один пациент имел генотип ТТ. Один из пациентов с гетерозиготным генотипом GT и пациент с генотипом ТТ принимали аторвастатин. В то же время, другой пациент с генотипом GT не принимал аторвастатин и принадлежал к контрольной группе. У пациентов с аллелем Т уровень триглицеридов был значительно ниже, чем у представителей контрольной группы с генотипом GT (χ2 = 2.382E2a, значение Р < 0,001). В целом, у пациентов с аллелем Т наблюдался более низкий уровень ТГ по сравнению с пациентами с генотипом GG. Данные представлены в таблице 2.
Таблица 2. Уровень ТГ в крови пациентов с КН по генотипам APOA5. Генотип GG – дикий тип, генотипы GT и TT имеют аллель c.553G > T
Взаимосвязь между аллелем Т и другими липидными параметрами крови
У исследуемых пациентов помимо уровня ТГ измерялись также уровень липопротеинов низкой плотности, липопротеинов высокой плотности и холестерина. В ходе анализа были выявлены небольшие различия между пациентами с аллелями дикого типа и носителями минорного аллеля Т. У пациентов с генотипами ТТ и GT, принимавших аторвастатин, наблюдался нормальный уровень ЛПНП (77 мг/дл и 45 мг/дл соответственно). Напротив, у пациента с генотипом GT, не принимавшего аторвастатин, уровень ЛПНП был несколько выше (158 мг/дл), но находился в пределах нормы. У пациентов с аллелем G отмечается широкий диапазон значений уровня ЛПНП (11 – 199 мг/дл). Значительные различия между уровнями ЛПВП у пациентов с генотипами GT и ТТ отсутствовали. Значения находились в диапазоне 32 – 44 мг/дл. У одного пациента с генотипом GT, принимавшего холестерин-снижающие препараты, уровень холестерина соответствовал норме (111 мг/дл), в то время как у второго пациента уровень холестерина был выше нормы (258 мг/дл). У пациента, гомозиготного по аллелю Т, наблюдался нормальный уровень холестерина – 134 мг/дл, а у пациентов с генотипом GG он находился в диапазоне 25 – 264 мг/дл (Р < 0,001, рис. 2.)
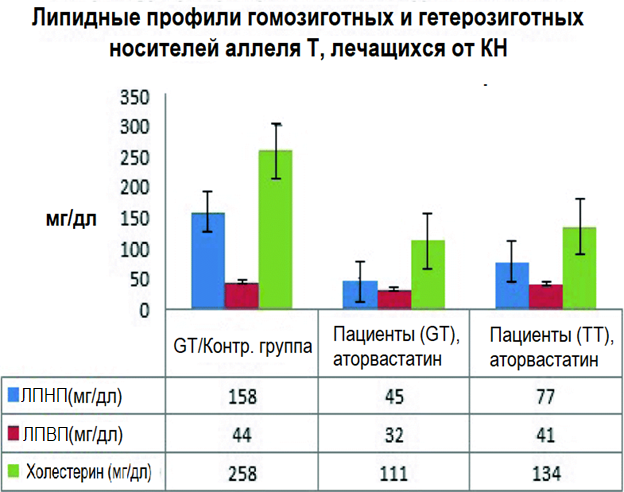 Рисунок 2. Профили уровня липидов у пациентов с КН гомозиготных и гетерозиготных по аллелю Т гена АРОА5. Генотипы (GT и ТТ) определяются по наличию аллеля c.553G > Т
Рисунок 2. Профили уровня липидов у пациентов с КН гомозиготных и гетерозиготных по аллелю Т гена АРОА5. Генотипы (GT и ТТ) определяются по наличию аллеля c.553G > Т
Взаимосвязь аллеля T с другими факторами
В данном исследовании учитывались прочие факторы риска, такие как табакокурение, наличие или отсутствие диабета, уровень физической активности. Пациент, гомозиготный по аллелю Т, курил, вел малоподвижный образ жизни и страдал диабетом. Напротив, пациенты, гетерозиготные по аллелю Т, не курили, не страдали диабетом и были физически активными. Различия по предыдущим параметрам не влияли на уровень содержания ТГ в крови. Таким образом, эти факторы, по-видимому, связаны с присутствием аллеля Т. С другой стороны, существуют различия в исходах для пациентов, принимавших аспирин. У двух носителей аллеля Т, принимавших аспирин, уровень ТГ был ниже – 71 и 170 мг/мл, по сравнению с пациентом с генотипом ТТ из контрольной группы, не принимавшим аспирин (см. Таблицу 1). Кроме того, у пациентов с аллелем дикого типа, принимавших аспирин и аторвастатин, наблюдался наиболее низкий уровень ТГ – 35 мг/дл, по сравнению с пациентами с генотипом GG, принимавшими либо аспирин, либо аторвастатин и уровнем ТГ 40 и 37 мг/дл соответственно (рис. 2, 3, 4).
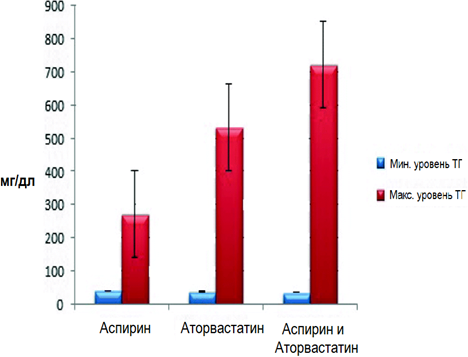 Рисунок 3. Уровень ТГ у гомозиготных пациентов по аллелю G. Значения распределены по трем группам, в зависимости от препаратов, принимаемых пациентами
Рисунок 3. Уровень ТГ у гомозиготных пациентов по аллелю G. Значения распределены по трем группам, в зависимости от препаратов, принимаемых пациентами
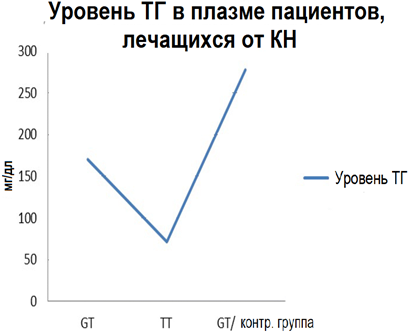 Рисунок 4. Уровень ТГ у пациентов с аллелем c.553G > T. GT/контр. группа – пациент с генотипом GT, не принимавший аторвастатин и аспирин. Пациенты с генотипами GT и TT принимали аторвастатин и аспирин
Рисунок 4. Уровень ТГ у пациентов с аллелем c.553G > T. GT/контр. группа – пациент с генотипом GT, не принимавший аторвастатин и аспирин. Пациенты с генотипами GT и TT принимали аторвастатин и аспирин
Обсуждение
Представленное исследование показывает важность изучения КН, так как, по данным Всемирной организации здравоохранения (ВОЗ), КН является одной из наиболее частых причин смерти [13]. Данное заболевание может быть обусловлено взаимодействием генетических и экологических рисков, возникающих на важных этапах развития организма. Ряд эпидемиологических исследований показал, что гены аполипопротеинового кластера A1/C3/A4/A5 относятся к факторам, способствующим раннему развитию КН [14]. Входящий в состав кластера ген APOA5, по-видимому, оказывает влияние на уровень ТГ [1]. Недавно установлено, что SNP гена АРОА5 вызывают повышение уровня ТГ. Одно из исследований показало, что один из SNP гена АРОА5 – полиморфный вариант 1131 T > C (rs2075291) – влияет на уровень ТГ и ЛПВП, увеличивая риск развития сердечно-сосудистых заболеваний и диабета [15]. Другое исследование показало, что при введении аденовирусных конструкций AAV2/8-LacZ, AAV2/8-WT apoA-V и AAV2/8-G162C apoA-V концентрация ТГ в плазме крови мышей дикого типа была ниже по сравнению с мышами, которые получили конструкции с мутантными аллелями [16]. В этом исследовании мы описали взаимосвязь между вариантом G162C (соответствующем аллелю c.553G > T) и уровнем ТГ в плазме пациентов с коронарной недостаточностью и ежедневно принимающих аторвастатин.
В Саудовской Аравии наблюдается очень высокая заболеваемость диабетом среди населения, по некоторым сообщениям она достигает 40%. Существует вероятность, что многие пациенты контрольной группы имеют недиагностированный или нелеченый диабет, либо находятся в состоянии преддиабета. С другой стороны, у пациентов с КН уровень глюкозы в крови был ниже, вероятно по причине того, что они получили достаточное лечение.
Следует отметить недостаток данного исследования – ограниченное количество пациентов в каждой группе, которого недостаточно для получения убедительных выводов. К тому же, между контрольной и группой пациентов с КН имелись различия, которые могли повлиять на результат. Для того чтобы более тщательно изучить влияние статинов на концентрацию ТГ в плазме, требуется большее количество участников. Кроме того, в исследовании не учитывались продолжительность лечения и его эффективность.
Частота обнаружения варианта с.553G > T у пациентов с КН была выше, чем в контрольной группе. Обычно присутствие аллеля Т ассоциировано с повышением уровня ТГ. Однако у пациентов – носителей данного аллеля, принимавших аторвастатин, он вызвал снижение содержания ТГ. Тем не менее, Ikejiri с соавт. ранее утверждали, что аторвастатин не способствует снижению уровня липопротеинов, богатых ТГ [12]. Данный вывод справедлив для пациентов, имеющих генотип GG, поскольку аторвастатин не оказал заметного влияния на уровень ТГ в их крови. К тому же, уровень ЛПНП практически не различался у пациентов с аллелем Т и аллелем G. Недавние исследования показали, что ген АРОА5 может отрицательным образом влиять на гомеостаз холестерина и вызвать гипертриглицеридемию [17]. Существует вероятность, что терапия статинами может сильнее влиять на метаболизм ТГ у пациентов с генотипом GG. Требуются дальнейшие исследования для изучения механизма действия препаратов у таких пациентов. Еще одно исследование, в котором участвовали граждане Китая, показало, что среди пациентов с КН, а также у представителей контрольной группы, носители генотипа GG дикого типа отличались значительно более низким уровнем ТГ в крови по сравнению с носителями аллеля Т [18]. У пациентов с аллелем Т, принимавших аторвастатин, наблюдался более низкий уровень ЛПВП по сравнению с пациентами – носителями аллеля Т, которые не принимали аторвастатин. Тем не менее, все показатели были в пределах нормы. Это также продемонстрировано в ранее проведенном китайскими учеными исследовании, которое не выявило значимой взаимосвязи между аллелем Т и липидными показателями, в том числе ЛПНП, общего холестерина и ЛПВП [19]. Как и следовало ожидать, уровень холестерина у пациентов с аллелем Т, принимавших аторвастатин, находился в пределах нормы и был ниже, чем у носителя аллеля Т, не принимавшего препарат. Такой результат объясняется тем, что фармакологическое действие аторвастатина заключается в снижении уровня холестерина в плазме крови. Предыдущие исследования подтвердили, что аторвастатин снижает как уровень холестерина в ЛПНП, так и общий уровень холестерина. При этом у женщин наблюдается более существенное снижение, чем у мужчин [20]. Клинические проявления присутствия ТГ при КН изучены хуже, чем проявления наличия ЛПНП и холестерина у пациентов с КН. В отличие от терапии статинами, терапия фенофибратами, снижающими концентрацию ТГ, не приводит к улучшению состояния пациентов с КН. Поэтому фенофибраты назначаются только при крайне высоком уровне ТГ, который не контролируется диетой.
Наконец, у носителей как аллеля T, так и аллеля G, принимавших аторвастатин совместно с аспирином, наблюдается наименьший уровень ТГ в крови по сравнению с пациентами, не принимавшими аспирин и (или) аторвастатин. Это свидетельствует о том, что аспирин влияет на уровень ТГ при приеме вместе с препаратами, снижающими уровень холестерина. Тем не менее, требуются дополнительные исследования, чтобы определить, влияет ли присутствие/отсутствие аллеля Т на эффективность препарата. Эксперименты на мышах показали, что аспирин снижает секрецию ЛОНП в печени, который, в свою очередь, снижает проявление гипертриглицеридемии, вызванной употреблением пищи с высоким содержанием жира, что подтверждает выводы, сделанные нами в ходе данного исследования [21].
Вывод
Данное исследование показывает, что присутствие аллеля c.553G > T (rs2075291) в гене АРОА5 способствует повышению уровня ТГ в плазме крови человека. Тем не менее, аллель Т способствует снижению уровня ТГ у больных КН, которые принимают препарат аторвастатин, снижающий уровень холестерина. Таким образом, аллель c.553G > T можно считать важным индикатором риска развития гипертриглицеридемии. Кроме того, он может служить отличительным клиническим признаком во время диагностики и прогнозирования течения КН.
Список литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Богари Неда М., Ашваг Алджохани, Амр А. Амин, Фейсал А. Аль-Аллаф, Анас Даннун, Мохиуддин М. Тахер, Аталла Эльсайе, Дарин Ибрагим Редна, Усама Эльхати, Массимо Поркиеду, Франческо Аламанни, Суд Абдулраоф А. Хогир, Ахмед Фаузи
BMC Cardiovascular Disorders201919:2
Введение
Повышенное содержание триглицеридов в плазме крови является основным фактором риска и играет важную роль в развитии коронарной недостаточности (КН). Доказана взаимосвязь между снижением уровня липидов в крови и снижением уровня смертности среди пациентов, страдающих КН. Целью данного исследования является изучение влияния полиморфного варианта c.553G > T (rs2075291) гена алипопротеина А5 (APOA5) на уровень триглицеридов у пациентов с КН, принимающих гиполидемический препарат аторвастатин.
Методика
В ходе исследования обнаружено, что полиморфный вариант c.553G > T гена APOA5, который вызывает замену цистеина на глицин в позиции 185 соответствующего белка (G185C), ассоциируется с повышенным уровнем триглицеридов. В исследовании применялся метод «случай-контроль» с участием 608 пациентов, проживающих в одном регионе.
Результаты
Уровень триглицеридов у носителей аллеля Т был значительно ниже, чем у пациентов с генотипом GT в контрольной группе (χ2 = 2.382E2a, Р < 0,001). В целом, у носителей аллеля Т уровень триглицеридов был ниже, чем у пациентов с генотипом GG. У пациента, гомозиготного по аллелю Т, наблюдался нормальный уровень холестерина (134 мг/дл), в то время как у пациентов с генотипом GG он находился в диапазоне 25–340 мг/дл (Р < 0,001). Таким образом, наличие полиморфного варианта с.553G > T (rs2075291) гена APOA5 способствует повышению уровня триглицеридов в крови.
Вывод
Тем не менее, установлено, что аллель Т уменьшает содержание триглицеридов в плазме крови пациентов с КН, принимающих препарат аторвастатин, контролирующий уровень холестерина в крови. Таким образом, вариант c.553G > T можно считать значимым фактором прогноза развития гипертриглицеридемии. Кроме того, он может служить отличительным клиническим признаком во время диагностики и прогнозирования течения КН.
Ключевые слова
- Триглицерид
- Ген APOA5
- Полиморфизм
- Генетическая вариация
- Аторвастатин
- Препараты, снижающие уровень липидов
- Коронарная недостаточность
- Королевство Саудовская Аравия (КСА)
Коронарная недостаточность (КН) – одно из наиболее часто диагностируемых сердечно-сосудистых заболеваний. Диабет, высокое артериальное давление и диета с высоким содержанием жиров считаются факторами, способствующими развитию КН [1]. Показано, что повышение уровня триглицеридов (ТГ) связано с проявлением КН, тем не менее, механизм этого явления недостаточно изучен [2]. Существует ряд как первичных (главным образом, генетических), так и вторичных факторов (диабет, гиперлипидемия), которые могут способствовать развитию гипертриглицеридемии [2]. Генетические отклонения, способствующие развитию гипертриглицеридемии, влияют на метаболизм триглицеридов [3]. Показано, что избыточная выработка аполипопротеина С3, вызванная генетическими факторами, а также липопротеинлипазы (ЛПЛ) связаны с изменением уровня триглицеридов в крови [4].
Благодаря данным секвенирования геномной ДНК человека был открыт ген аполипопротеина А5 (АРОА5), который принадлежит к семейству регуляторных генов, включающему также гены АРОА1, АРОС3 и АРОА4 [5]. АРОА5 расположен в локусе 11q23 приблизительно в 30 т. п. н. от гена АРОА4 и содержит четыре экзона. В ряде исследований показано, что данный, недавно идентифицированный локус играет важную роль в гомеостазе триглицеридов, так как кодирует белок аполипопротеин А5, снижающий уровень триглицеридов в плазме крови [6]. Структурные изменения в гене АРОА5 могут привести к колебаниям уровня ТГ в плазме крови. Точечные мутации гена АРОА5 приводят к неполной сборке белка apoA-V и преимущественно встречаются у пациентов с гипертриглицеридемией. На данный момент не обнаружено конкретных мутаций, способных вызвать серьезные заболевания, однако результаты ряда исследований показывают возможную ассоциацию между однонуклеотидными полиморфизмами (SNP) гена АРОА5 и рядом заболеваний. Полиморфные варианты -1131 T > C и c.56C > G (S19 W) гена APOA5 являются примерами SNP, ассоциированных с повышенным уровнем триглицеридов в плазме [7]. Также недавно путем секвенирования кодирующего участка гена АРОА5 был выявлен новый полиморфный вариант c.553G > T. Этот SNP приводит к замене аминокислоты цистеина на глицин [4]. Последствия такого замещения были проанализированы, но окончательный вывод еще предстоит сделать. Совсем недавно при изучении полиморфного варианта c.553G > T обнаружено, что свободная SH-группа цистеина в белковой структуре АРОА5 может участвовать в образовании дисульфидных связей с другими белками и тем самым влияет на уровень триглицеридов в крови. [8]. Кроме того, полиморфный вариант c.553G > T (rs2075291) чаще встречался в группе пациентов с острым коронарным синдромом, чем у пациентов контрольной группы[1]. Аторвастатин – препарат, традиционно использующийся для регуляции метаболизма липидов [9]. В соответствии с биофармацевтической классификационной системой аторвастатин является препаратом II категории [10] и принадлежит к семейству статинов, также известных как ингибиторы 3-гидрокси-3-метилглютарил-кофермент А редуктазы [11]. Аторвастатин используется для снижения уровня холестерина у пациентов с КН. При изучении влияния аторвастатина на различные липопротеины обнаружено, что препарат не влияет на содержание ТГ в хиломикронах, липопротеинах низкой плотности (ЛНП), липопротеинах средней плотности (ЛСП), липопротеинах очень низкой плотности (ЛОНП), однако снижает уровень холестерина в этих липопротеинах [12]. Целью данного исследования является оценка влияния полиморфного варианта c.553G > T (rs2075291) на уровень ТГ у пациентов с КН, ежедневно принимающих аторвастатин с целью снижения содержания концентрации липидов в плазме крови.
Методы
Характеристика пациентов
Проведение исследования одобрено экспертным советом организации и научными этическими комитетами (НЭК) медицинского колледжа при Исламском Университете Умм аль-Кура г. Мекка, Королевство Саудовская Аравия. Образцы крови получали после подписания пациентами или их представителями письменного информированного согласия. В исследовании участвовали пациенты с диагнозом КН, подтвержденным данными коронарного ангиографического исследования (стеноз более 50% одной или нескольких артерий, а также устойчивая либо неустойчивая стенокардия). Контрольная группа состояла из здоровых лиц, проживавших в том же регионе, что и пациенты с КН. Большинство больных принимали оптимальные дозы статинов в соответствии с рекомендациями для лечения коронарной недостаточности. Продолжительность курса лечения в данном исследовании не учитывалась.
Для того чтобы исключить наличие у пациентов контрольной группы клинически выраженной КН или других сердечно-сосудистых заболеваний, все лица в контрольной группе прошли клиническое и электрокардиографическое обследование.
Данные лабораторных анализов
Образцы крови объемом 5 мл собирали у пациентов утром, натощак. Показатели липидного профиля сыворотки крови, в том числе уровня триглицеридов (ТГ), общего холестерина (ОХ), холестерина липопротеинов высокой плотности (Х-ЛПВП) и холестерина липопротеинов низкой плотности (Х-ЛПНП) и аполипопротеина измеряли с помощью клинической биохимической системы Dimension® с использованием Flex-реагентов.
Генотипирование ДНК
Геномную ДНК выделяли из образцов периферической крови с использованием набора реагентов для выделения геномной ДНК из цельной крови GeneJET (Thermo Scientific Co. Ltd.) и хранили при температуре − 20°C. Генотипирование полиморфного варианта 553G > T (rs2075291) проводили с использованием полимеразной цепной реакции (ПЦР) и расщеплением эндонуклеазами рестрикции. ПЦР проводили с использованием следующих праймеров: прямые: 5′-AGA CAC CAA GGC CCA GTT GCT GGG ‘3; обратные: 5’-ATG CCG CTC ACC AGG CTC TCG GCG ‘3. Реакцию проводили с использованием амплификатора Veriti (Life Technologies co.) и реагента AmpliTaq Gold 360 Master Mix (Life Technologies co.) в следующих условиях: первоначальная денатурация 95°C / 5 мин., 37 циклов при 95°C / 30 сек., 58°C / 30 сек., 72°C / 1 мин., элонгацию проводили при температуре 72°C / 10 мин. Длина полученного ПЦР-продукта составляла 138 п. н. Далее к 20 мкл ПЦР-продукта добавляли 5 единиц эндонуклеазы рестрикции HaeIII (New England BioLabs Inc.) (общий объем 25 мкл) и инкубировали в течение ночи при температуре 37°C. После расщепления эндонуклеазой рестрикции проводили разделение продуктов в 3% агарозном геле и визуализировали ДНК в ультрафиолете с помощью бромистого этидия. Мы обнаружили фрагменты, состоящие из 138 и 87 п. н. у гетерозиготных (GT) пациентов, один фрагмент размером 138 п. н. у гомозиготных (ТТ) и один фрагмент размером 87 п. н. у гомозиготных пациентов с генотипом GG (рис. 1).
 Рисунок 1. Результат ПДРФ-анализа полиморфных вариантов c.553G > T гена APOA5. Продукты разделяли в 2%-ом агарозном геле и окрашивали гель бромистым этидием. Дорожки 1-12 соответствуют гетерозиготному генотипу GG (87 и 51 п. н.); дорожки 13 и 14 соответствуют гетерозиготному генотипу GT (138, 87 и 51 п. н.); дорожка 14 соответствует гомозиготному генотипу ТТ (138 п. н.)
Рисунок 1. Результат ПДРФ-анализа полиморфных вариантов c.553G > T гена APOA5. Продукты разделяли в 2%-ом агарозном геле и окрашивали гель бромистым этидием. Дорожки 1-12 соответствуют гетерозиготному генотипу GG (87 и 51 п. н.); дорожки 13 и 14 соответствуют гетерозиготному генотипу GT (138, 87 и 51 п. н.); дорожка 14 соответствует гомозиготному генотипу ТТ (138 п. н.)Результаты
Исходные характеристики
В исследование было включено 585 человек, в том числе 247 женщин (130 из них были включены в контрольную группу, 117 – в группу клинических случаев КН) и 338 мужчин (107 включены в контрольную группу, 231 – в группу клинических случаев КН). Исходные характеристики пациентов группы клинических случаев КН (пациенты с КН) и контрольной группы представлены в таблице 1. Статистически значимых различий между группами по полу не наблюдалось. Группы значительно различались по возрасту: средний возраст в контрольной группе был ниже, чем у пациентов с КН. Среднее артериальное давление и уровень глюкозы в крови были выше в контрольной группе, чем у пациентов с КН. Между группами не наблюдались статистически значимые различия в показателях липидного профиля, таких как уровень ЛПНП и ЛПВП. Тем не менее, у пациентов с КН уровень холестерина и триглицеридов был выше по сравнению с контрольной группой, несмотря на прием аторвастатина некоторыми пациентами.
Таблица 1. Исходные характеристики в группе клинических случаев КН и контрольной группе
Взаимосвязь между аллелем Т и содержанием триглицеридов в крови
Содержание ТГ в крови носителей аллеля дикого типа G зависит от приема препарата аторвастатина, снижающего уровень холестерина в плазме крови. У пациентов с КН, принимавших аторвастатин, наблюдался более высокий уровень содержания ТГ в крови по сравнению с пациентами, не принимавшим препарат (средний уровень ТГ 143,5 мг/дл и 125.8 мг/дл соответственно). Аллель Т гена APOA5 обнаружен у двух пациентов мужского пола (генотип TG), один пациент имел генотип ТТ. Один из пациентов с гетерозиготным генотипом GT и пациент с генотипом ТТ принимали аторвастатин. В то же время, другой пациент с генотипом GT не принимал аторвастатин и принадлежал к контрольной группе. У пациентов с аллелем Т уровень триглицеридов был значительно ниже, чем у представителей контрольной группы с генотипом GT (χ2 = 2.382E2a, значение Р < 0,001). В целом, у пациентов с аллелем Т наблюдался более низкий уровень ТГ по сравнению с пациентами с генотипом GG. Данные представлены в таблице 2.
Таблица 2. Уровень ТГ в крови пациентов с КН по генотипам APOA5. Генотип GG – дикий тип, генотипы GT и TT имеют аллель c.553G > T
Взаимосвязь между аллелем Т и другими липидными параметрами крови
У исследуемых пациентов помимо уровня ТГ измерялись также уровень липопротеинов низкой плотности, липопротеинов высокой плотности и холестерина. В ходе анализа были выявлены небольшие различия между пациентами с аллелями дикого типа и носителями минорного аллеля Т. У пациентов с генотипами ТТ и GT, принимавших аторвастатин, наблюдался нормальный уровень ЛПНП (77 мг/дл и 45 мг/дл соответственно). Напротив, у пациента с генотипом GT, не принимавшего аторвастатин, уровень ЛПНП был несколько выше (158 мг/дл), но находился в пределах нормы. У пациентов с аллелем G отмечается широкий диапазон значений уровня ЛПНП (11 – 199 мг/дл). Значительные различия между уровнями ЛПВП у пациентов с генотипами GT и ТТ отсутствовали. Значения находились в диапазоне 32 – 44 мг/дл. У одного пациента с генотипом GT, принимавшего холестерин-снижающие препараты, уровень холестерина соответствовал норме (111 мг/дл), в то время как у второго пациента уровень холестерина был выше нормы (258 мг/дл). У пациента, гомозиготного по аллелю Т, наблюдался нормальный уровень холестерина – 134 мг/дл, а у пациентов с генотипом GG он находился в диапазоне 25 – 264 мг/дл (Р < 0,001, рис. 2.)
 Рисунок 2. Профили уровня липидов у пациентов с КН гомозиготных и гетерозиготных по аллелю Т гена АРОА5. Генотипы (GT и ТТ) определяются по наличию аллеля c.553G > Т
Рисунок 2. Профили уровня липидов у пациентов с КН гомозиготных и гетерозиготных по аллелю Т гена АРОА5. Генотипы (GT и ТТ) определяются по наличию аллеля c.553G > ТВзаимосвязь аллеля T с другими факторами
В данном исследовании учитывались прочие факторы риска, такие как табакокурение, наличие или отсутствие диабета, уровень физической активности. Пациент, гомозиготный по аллелю Т, курил, вел малоподвижный образ жизни и страдал диабетом. Напротив, пациенты, гетерозиготные по аллелю Т, не курили, не страдали диабетом и были физически активными. Различия по предыдущим параметрам не влияли на уровень содержания ТГ в крови. Таким образом, эти факторы, по-видимому, связаны с присутствием аллеля Т. С другой стороны, существуют различия в исходах для пациентов, принимавших аспирин. У двух носителей аллеля Т, принимавших аспирин, уровень ТГ был ниже – 71 и 170 мг/мл, по сравнению с пациентом с генотипом ТТ из контрольной группы, не принимавшим аспирин (см. Таблицу 1). Кроме того, у пациентов с аллелем дикого типа, принимавших аспирин и аторвастатин, наблюдался наиболее низкий уровень ТГ – 35 мг/дл, по сравнению с пациентами с генотипом GG, принимавшими либо аспирин, либо аторвастатин и уровнем ТГ 40 и 37 мг/дл соответственно (рис. 2, 3, 4).
 Рисунок 3. Уровень ТГ у гомозиготных пациентов по аллелю G. Значения распределены по трем группам, в зависимости от препаратов, принимаемых пациентами
Рисунок 3. Уровень ТГ у гомозиготных пациентов по аллелю G. Значения распределены по трем группам, в зависимости от препаратов, принимаемых пациентами Рисунок 4. Уровень ТГ у пациентов с аллелем c.553G > T. GT/контр. группа – пациент с генотипом GT, не принимавший аторвастатин и аспирин. Пациенты с генотипами GT и TT принимали аторвастатин и аспирин
Рисунок 4. Уровень ТГ у пациентов с аллелем c.553G > T. GT/контр. группа – пациент с генотипом GT, не принимавший аторвастатин и аспирин. Пациенты с генотипами GT и TT принимали аторвастатин и аспиринОбсуждение
Представленное исследование показывает важность изучения КН, так как, по данным Всемирной организации здравоохранения (ВОЗ), КН является одной из наиболее частых причин смерти [13]. Данное заболевание может быть обусловлено взаимодействием генетических и экологических рисков, возникающих на важных этапах развития организма. Ряд эпидемиологических исследований показал, что гены аполипопротеинового кластера A1/C3/A4/A5 относятся к факторам, способствующим раннему развитию КН [14]. Входящий в состав кластера ген APOA5, по-видимому, оказывает влияние на уровень ТГ [1]. Недавно установлено, что SNP гена АРОА5 вызывают повышение уровня ТГ. Одно из исследований показало, что один из SNP гена АРОА5 – полиморфный вариант 1131 T > C (rs2075291) – влияет на уровень ТГ и ЛПВП, увеличивая риск развития сердечно-сосудистых заболеваний и диабета [15]. Другое исследование показало, что при введении аденовирусных конструкций AAV2/8-LacZ, AAV2/8-WT apoA-V и AAV2/8-G162C apoA-V концентрация ТГ в плазме крови мышей дикого типа была ниже по сравнению с мышами, которые получили конструкции с мутантными аллелями [16]. В этом исследовании мы описали взаимосвязь между вариантом G162C (соответствующем аллелю c.553G > T) и уровнем ТГ в плазме пациентов с коронарной недостаточностью и ежедневно принимающих аторвастатин.
В Саудовской Аравии наблюдается очень высокая заболеваемость диабетом среди населения, по некоторым сообщениям она достигает 40%. Существует вероятность, что многие пациенты контрольной группы имеют недиагностированный или нелеченый диабет, либо находятся в состоянии преддиабета. С другой стороны, у пациентов с КН уровень глюкозы в крови был ниже, вероятно по причине того, что они получили достаточное лечение.
Следует отметить недостаток данного исследования – ограниченное количество пациентов в каждой группе, которого недостаточно для получения убедительных выводов. К тому же, между контрольной и группой пациентов с КН имелись различия, которые могли повлиять на результат. Для того чтобы более тщательно изучить влияние статинов на концентрацию ТГ в плазме, требуется большее количество участников. Кроме того, в исследовании не учитывались продолжительность лечения и его эффективность.
Частота обнаружения варианта с.553G > T у пациентов с КН была выше, чем в контрольной группе. Обычно присутствие аллеля Т ассоциировано с повышением уровня ТГ. Однако у пациентов – носителей данного аллеля, принимавших аторвастатин, он вызвал снижение содержания ТГ. Тем не менее, Ikejiri с соавт. ранее утверждали, что аторвастатин не способствует снижению уровня липопротеинов, богатых ТГ [12]. Данный вывод справедлив для пациентов, имеющих генотип GG, поскольку аторвастатин не оказал заметного влияния на уровень ТГ в их крови. К тому же, уровень ЛПНП практически не различался у пациентов с аллелем Т и аллелем G. Недавние исследования показали, что ген АРОА5 может отрицательным образом влиять на гомеостаз холестерина и вызвать гипертриглицеридемию [17]. Существует вероятность, что терапия статинами может сильнее влиять на метаболизм ТГ у пациентов с генотипом GG. Требуются дальнейшие исследования для изучения механизма действия препаратов у таких пациентов. Еще одно исследование, в котором участвовали граждане Китая, показало, что среди пациентов с КН, а также у представителей контрольной группы, носители генотипа GG дикого типа отличались значительно более низким уровнем ТГ в крови по сравнению с носителями аллеля Т [18]. У пациентов с аллелем Т, принимавших аторвастатин, наблюдался более низкий уровень ЛПВП по сравнению с пациентами – носителями аллеля Т, которые не принимали аторвастатин. Тем не менее, все показатели были в пределах нормы. Это также продемонстрировано в ранее проведенном китайскими учеными исследовании, которое не выявило значимой взаимосвязи между аллелем Т и липидными показателями, в том числе ЛПНП, общего холестерина и ЛПВП [19]. Как и следовало ожидать, уровень холестерина у пациентов с аллелем Т, принимавших аторвастатин, находился в пределах нормы и был ниже, чем у носителя аллеля Т, не принимавшего препарат. Такой результат объясняется тем, что фармакологическое действие аторвастатина заключается в снижении уровня холестерина в плазме крови. Предыдущие исследования подтвердили, что аторвастатин снижает как уровень холестерина в ЛПНП, так и общий уровень холестерина. При этом у женщин наблюдается более существенное снижение, чем у мужчин [20]. Клинические проявления присутствия ТГ при КН изучены хуже, чем проявления наличия ЛПНП и холестерина у пациентов с КН. В отличие от терапии статинами, терапия фенофибратами, снижающими концентрацию ТГ, не приводит к улучшению состояния пациентов с КН. Поэтому фенофибраты назначаются только при крайне высоком уровне ТГ, который не контролируется диетой.
Наконец, у носителей как аллеля T, так и аллеля G, принимавших аторвастатин совместно с аспирином, наблюдается наименьший уровень ТГ в крови по сравнению с пациентами, не принимавшими аспирин и (или) аторвастатин. Это свидетельствует о том, что аспирин влияет на уровень ТГ при приеме вместе с препаратами, снижающими уровень холестерина. Тем не менее, требуются дополнительные исследования, чтобы определить, влияет ли присутствие/отсутствие аллеля Т на эффективность препарата. Эксперименты на мышах показали, что аспирин снижает секрецию ЛОНП в печени, который, в свою очередь, снижает проявление гипертриглицеридемии, вызванной употреблением пищи с высоким содержанием жира, что подтверждает выводы, сделанные нами в ходе данного исследования [21].
Вывод
Данное исследование показывает, что присутствие аллеля c.553G > T (rs2075291) в гене АРОА5 способствует повышению уровня ТГ в плазме крови человека. Тем не менее, аллель Т способствует снижению уровня ТГ у больных КН, которые принимают препарат аторвастатин, снижающий уровень холестерина. Таким образом, аллель c.553G > T можно считать важным индикатором риска развития гипертриглицеридемии. Кроме того, он может служить отличительным клиническим признаком во время диагностики и прогнозирования течения КН.
Список литературы
- Ding Y, et al. Associations of polymorphisms in the apolipoprotein APOA1-C3-A5 gene cluster with acute coronary syndrome. J Biomed Biotechnol. 2012;2012:509420. View ArticleGoogle Scholar
- Gotto AM Jr. Triglyceride as a risk factor for coronary artery disease. Am J Cardiol. 1998;82(9A):22Q–5Q. View ArticleGoogle Scholar
- Rade N, Pejic M, Daniel M, Lee T. Hypertriglyceridemia. J Am Board Fam Med. 2006;19:310–6. View ArticleGoogle Scholar
- Kao JT, et al. A novel genetic variant in the apolipoprotein A5 gene is associated with hypertriglyceridemia. Hum Mol Genet. 2003;12(19):2533–9. View ArticleGoogle Scholar
- Charlton-Menys V, Durrington PN. Apolipoprotein A5 and hypertriglyceridemia. Clin Chem. 2005;51(2):295–7. View ArticleGoogle Scholar
- Pennacchio LA, Rubin EM. Apolipoprotein A5, a newly identified gene that affects plasma triglyceride levels in humans and mice. Arterioscler Thromb Vasc Biol. 2003;23(4):529–34. View ArticleGoogle Scholar
- Vaessen SF, et al. Apolipoprotein A-V, triglycerides and risk of coronary artery disease: the prospective epic-Norfolk population study. J Lipid Res. 2006;47(9):2064–70. View ArticleGoogle Scholar
- Sharma V, et al. Aberrant hetero-disulfide bond formation by the hypertriglyceridemia-associated p.Gly185Cys APOA5 variant (rs2075291). Arterioscler Thromb Vasc Biol. 2014;34(10):2254–60. View ArticleGoogle Scholar
- Jing F, et al. Effects of atorvastatin combined with low-molecular-weight heparin on plasma inflammatory cytokine level and pulmonary pathophysiology of rats with sepsis. Exp Ther Med. 2016;12(2):1048–54. View ArticleGoogle Scholar
- Affandi MM, Tripathy M, Majeed AB. Conductometric and volumetric studies of atorvastatin in aqueous solution of arginine from 298.15 to 313.15 K. J Adv Pharm Technol Res. 2016;7(3):80–6. View ArticleGoogle Scholar
- Shah RV, Goldfine AB. Statins and risk of new-onset diabetes mellitus. Circulation. 2012;126(18):e282–4. View ArticleGoogle Scholar
- Ikejiri A, et al. Effects of atorvastatin on triglyceride-rich lipoproteins, low-density lipoprotein subclass, and C-reactive protein in hemodialysis patients. Metabolism. 2004;53(9):1113–7. View ArticleGoogle Scholar
- Bampali K, et al. Genetics and coronary artery disease: present and future. Hell J Cardiol. 2014;55:156–63. Google Scholar
- Qi L, et al. Associations of the apolipoprotein A1/C3/A4/A5 gene cluster with triglyceride and HDL cholesterol levels in women with type 2 diabetes. Atherosclerosis. 2007;192(1):204–10. View ArticleGoogle Scholar
- Song KH, et al. Association of apolipoprotein A5 gene 1131TC polymorphism with the risk of metabolic syndrome in Korean subjects. Biomed Res Int. 2013;2013:7. Google Scholar
- Sharma V, et al. Hypertriglyceridemia associated with the c.553G>T APOA5 SNP results from aberrant hetero-disulfide bond formation. Arterioscler Thromb Vasc Biol. 2014;34(10):2254. View ArticleGoogle Scholar
- Chien KL, et al. Genetic association study of APOA1/C3/A4/A5 gene cluster and haplotypes on triglyceride and HDL cholesterol in a community-based population. Clin Chim Acta. 2008;388(1–2):78–83. View ArticleGoogle Scholar
- Yin RX, Li YY, Lai CQ. Apolipoprotein A1/C3/A5 haplotypes and serum lipid levels. Lipids Health Dis. 2011;10:140. View ArticleGoogle Scholar
- Tang Y, et al. A genetic variant c.553G > T in the apolipoprotein A5 gene is associated with an increased risk of coronary artery disease and altered triglyceride levels in a Chinese population. Atherosclerosis. 2006;185(2):433–7. View ArticleGoogle Scholar
- Adams SP, Tsang M, Wright JM. Lipid-lowering efficacy of atorvastatin. Cochrane Database Syst Rev. 2015;3:CD008226. Google Scholar
- van Diepen JA, et al. Aspirin reduces hypertriglyceridemia by lowering VLDL-triglyceride production in mice fed a high-fat diet. Am J Physiol Endocrinol Metab. 2011;301(6):E1099–107. View ArticleGoogle Scholar





