6519
22 Декабря 2021
Авторское право © 2019, Amie J. Moyes, Adrian J. Hobbs (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эми Мойес, Адриан Хоббс
Int. J. Mol. Sci. 2019, 20(9), 2281
Аннотация
Натрийуретический пептид типа С (ЦНП) — аутокринный и паракринный медиатор, вырабатываемый эндотелиальными клетками, кардиомиоцитами и фибробластами, который регулирует физиологические функции сердечно-сосудистой системы. Эти роли передаются через два родс...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эми Мойес, Адриан Хоббс
Int. J. Mol. Sci. 2019, 20(9), 2281
Аннотация
Натрийуретический пептид типа С (ЦНП) — аутокринный и паракринный медиатор, вырабатываемый эндотелиальными клетками, кардиомиоцитами и фибробластами, который регулирует физиологические функции сердечно-сосудистой системы. Эти роли передаются через два родс...
Авторское право © 2019, Amie J. Moyes, Adrian J. Hobbs (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эми Мойес, Адриан Хоббс
Int. J. Mol. Sci. 2019, 20(9), 2281
Аннотация
Натрийуретический пептид типа С (ЦНП) — аутокринный и паракринный медиатор, вырабатываемый эндотелиальными клетками, кардиомиоцитами и фибробластами, который регулирует физиологические функции сердечно-сосудистой системы. Эти роли передаются через два родственных рецептора — рецептор натрийуретического пептида типа B (NPR-B) и рецептор натрийуретического пептида типа C (NPR-C), которые активируют различные сигнальные пути, опосредующие комплементарные, но разные клеточные ответы. Традиционно ЦНП считается эндотелиальным компонентом системы натрийуретических пептидов, в то время как родственные ему пептиды, предсердный натрийуретический пептид (ПНП) и мозговой натрийуретический пептид (МНП), считаются эндокринными протекторами сердечной функции и объема крови. Однако накопленные доказательства указывают, что ЦНП не только модулирует тонус сосудов и артериальное давление, но также регулирует широкий спектр сердечно-сосудистых эффектов, включая контроль над воспалением, ангиогенезом, пролиферацией гладких мышц и эндотелиальных клеток, атеросклерозом, сократимостью кардиомиоцитов, гипертрофией, фиброзом и электрофизиологией сердца. Этот обзор будет сфокусирован на новых физиологических функциях, приписываемых ЦНП, рецепторам / сигнальным механизмам, участвующим в опосредовании его кардиопротективных эффектов, и разработке терапевтических средств, нацеленных на сигнальные пути ЦНП при различных патологиях.
Ключевые слова: натрийуретический пептид, сосудистый, эндотелиальные клетки, кардиомиоциты, фибробласты, воспаление, сердечная недостаточность, гипертензия, ангиогенез.
2. Синтез, секреция и деградация ЦНП
Натрийуретические пептиды относятся к семейству трех структурно взаимосвязанных гормонов, которые выполняют уникальную роль в сердечно-сосудистой системе. Физиологические функции предсердного натрийуретического пептида (ПНП) и мозгового натрийуретического пептида (МНП) активно исследуются в течение последних десятилетий, однако мало внимания уделялось изучению натрийуретического пептида типа C (ЦНП). ПНП и МНП попадают в сердце [1, 2, 3, 4] и вырабатываются в ответ на объем-индуцированное растяжение предсердия и желудочков соответственно [5, 6]. Эти пептиды действуют как эндокринные гормоны и способствуют регуляции структур сердца, артериального давления и объема циркулирующей крови [7]. Напротив, распределение и способ действия ЦНП в тканях различны; недавние исследования выявили разнообразные эндогенные роли ЦНП, включая контроль над тонусом сосудов, активацией лейкоцитов, ангиогенезом, пролиферацией гладких мышц и эндотелиальных клеток, целостностью сосудов, коронарным кровотоком, фиброзом сердца, гипертрофией сердца и электрофизиологией. Такие аспекты физиологии и патологии ЦНП будут детально рассмотрены в этой статье.
2. Синтез, секреция и деградация ЦНП
ЦНП представляет собой пептид из 22 аминокислот, который синтезируется в результате обработки preproCNP сигнальной пептидазой и последующей сегментации proCNP эндопротеазой фурином [8]. В тканях и плазме имеются две формы ЦНП — ЦНП-53 и ЦНП-22 [8], однако протеаза, ответственная за обработку удлиненного пептида в его более короткую форму, неизвестна. ЦНП-22 был обнаружен в экстрактах мозга свиньи [9]. В дополнение к его избыточному синтезу в ЦНС высокий уровень ЦНП был обнаружен в хондроцитах [10] и эндотелиальных клетках [11, 12], которые постоянно вырабатывают пептиды. Другие клетки сердечно-сосудистой системы, в том числе кардиомиоциты [13, 14] и фибробласты [15], также вырабатывают ЦНП, однако тканевый синтез и уровень плазмы у здоровых людей относительно низкие, что указывает на действие ЦНП как местного паракринного или аутокринного медиатора сердца и кровеносных сосудов.
Период полувыведения ЦНП в плазме короткий (2,6 мин) [16], однако деградация происходит быстро, что объясняет низкую концентрацию (диапазон фмоль — пмоль) пептида в циркулирующей крови [11, 17]. Существуют два основных пути инактивации ЦНП: сегментация нейтральной эндопептидазой (НЭП) [18] и интернализация рецепторами натрийуретических пептидов типа С (NPR-C) с последующими эндоцитозом и лизосомальной деградацией [19, 20]. Кроме того, участие каждого пути в деградации натрийуретических пептидов кажется равным [21] у здоровых людей, хотя есть признаки, указывающие, что во время патофизиологических состояний, когда уровень натрийуретических пептидов повышается и NPR-C может быть избыточным, НЭП может играть важную роль в очищении [22]. К тому же доставка НЭП и/или NPR-C в ткани может негативно влиять на инактивацию ЦНП в различных органах: например, ЦНП интернализуется посредством NPR-C в почках легче, чем в легких [23].
Большинство известных стимулирующих веществ для повышения экспрессии гена или запуска производства ЦНП имеют отношение к состоянию сердечно-сосудистой системы, включая гемодинамический стресс [24, 25], воспалительные цитокины, такие как фактор некроза опухоли альфа (ФНО-α) [26], интерлейкин 1β (ИЛ1β) [26, 27], трансформирующий фактор роста бета (ТФР-β) [12, 28] и бактериальные полисахариды [26, 29]. В соответствии с этими данными, исследования показывают, что уровень ЦНП в плазме повышается у пациентов с сердечной недостаточностью (СН) [30] и сепсисом [31]. Напротив, производство ЦНП снижается окисленными липопротеинами низкой плотности [32] и фактором роста эндотелия сосудов (ФРЭС) [33].
3. Рецепторы натрийуретических пептидов
ЦНП оказывает биологический эффект посредством активации двух рецепторов клеточной поверхности: рецептора натрийуретического пептида типа B (NPR-B, также называемого гуанилатциклаза-Б, ГЦ-Б) и рецептора натрийуретического пептида типа С (NPR-C) [34, 35]. Пептид обладает очень низкой аффинностью к рецептору натрийуретического пептида A (NPR-A) [36], который является эндогенным рецептором для лигандов ПНП и МНП. Как NPR-B, так и NPR-C массово синтезируются и обнаруживаются в эндотелиальных клетках [37, 38], клетках гладких мышц [37, 39], кардиомиоцитах [14, 40] и фибробластах [15, 41]. NPR-C — наиболее распространенный рецептор натрийуретического пептида, он насчитывает около 95% от общего числа рецепторов натрийуретических пептидов в эндотелиальных клетках [42].
ЦНП обладает схожей связывающей способностью с NPR-B и NPR-C [36], хотя сигнальные пути активируются каждым рецептором отдельно. NPR-B представляет собой рецептор гуанилатциклазы в виде частиц, который катализирует превращение гуанозин-5'-трифосфата в циклический гуанозин-3',5'-монофосфат (цГМФ), вторичный посредник, который активирует протеинкиназу G I и II [43, 44, 45], которая, в свою очередь, изменяет клеточные функции путем фосфорилирования специфических белков-мишеней. Первоначально считалось, что NPR-C является рецептором клиренса [46], лишенным сигнальной активности, но позже было показано, что он содержит чувствительные к коклюшному токсину Gi-связывающие домены во внутриклеточном C-концевом хвосте, которые связываются с ингибированием аденилатциклазы (посредством субъединицы Gi α) и активацией фосфолипазы C-β (субъединицами Gi βγ) [47, 48, 49, 50]. Сообщалось о двух подтипах NPR-C с разными молекулярными массами: белок 67 кДа и белок 77 кДа, но неизвестно, различна ли их способность сигнализировать и очищать натрийуретические пептиды in vivo [51, 52]. Исследование изолированных клубочковых мембран крыс показало, что NPR-C 67 кДа имеет высокую аффинность к ЦНП и активация этого подтипа снижает синтез циклического аденозинмонофосфата (цАМФ) посредством передачи сигналов Gi, тогда как рецептор 77 кДа имеет очень низкую аффинность к ЦНП и участвует в интернализации лигандов [48, 53].
4. ЦНП регулирует тонус сосудов и артериальное давление
Фармакологические эксперименты на препаратах изолированных кровеносных сосудов показали, что ЦНП является мощным сосудорасширяющим средством для артериальных каналов и резистентных артерий по всему сосудистому дереву [54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66]. В микроциркуляторном русле ЦНП более эффективен, чем ПНП и МНП, что позволяет предположить, что он может играть роль в регуляции периферического сосудистого сопротивления [64, 67]. Многочисленные исследования показали, что инфузия ЦНП снижает системное кровяное давление как у людей, так и у животных [68, 69, 70, 71, 72]. Несмотря на это, физиологическая роль эндогенного ЦНП в сердечно-сосудистой системе не была выяснена до недавнего времени. Ранние исследования мышей с глобальным нокаутом ЦНП были затруднены эффектами делеции ЦНП на развитие кости [10]. У этих животных проявляются скелетные аномалии, карликовость и высокий уровень смертности, поэтому исследования, использующие систему рекомбинации Cre-Lox для генерации животных с ограниченной в клетках делецией ЦНП, были ключом к более полному пониманию функции этого пептида in vivo. Эндотелиально-специфическая делеция ЦНП у мышей приводит к повышению артериального давления и нарушению реакции на эндотелий-зависимые вазодилататоры, что является убедительным доказательством того, что конститутивное высвобождение ЦНП способствует регуляции тонуса сосудов [73, 74, 75]. Патофизиологическая значимость этих экспериментальных данных иллюстрируется обнаружением полиморфизмов в генах ЦНП и фурина, которые связаны с гипертонией у людей [76, 77].
ЦНП-опосредованная вазодилатация проявляется через различные механизмы в зависимости от видов, исследуемых сосудов и/или активированных рецепторов натрийуретических пептидов. В проводящих артериях релаксация, вызванная ЦНП, блокируется двойными антагонистами NPR-B/NPR-A HS-142-1, что свидетельствует об активации NPR-B и последующей выработке цГМФ, которая опосредует дилатационный эффект ЦНП в магистральных сосудах [57, 60, 63]. Однако при резистентности сосудистой системы важность NPR-C в вазореактивности ЦНП увеличивается. И у грызунов, и у людей имеются схожие пути, включающие активацию NPR-C и гиперполяризацию гладкомышечных клеток [66, 71, 78, 79, 80]. В брыжеечной артерии крыс синтез ЦНП включает основной компонент эндотелий-производной гиперполяризации (EDH), вызванной ацетилхолином (ACh), — ответ, который может быть замедлен антагонистами NPR-C, блокадой кальций-чувствительных калиевых каналов малой и средней проводимости (SKCa и IKCa) и G-белок-связанных калиевых каналов внутреннего выпрямления (GIRK) [65]. Предполагалось, что открытие SKCa и IKCa в эндотелиальных клетках способствует синтезу ЦНП, который связывает NPR-C на гладкомышечных клетках, приводя к Gi/0-опосредованной активации GIRK, выбросу калия и гиперполяризации. У людей в артериях и GIRK, и кальций-активируемые K+ каналы высокой проводимости (BKCa каналы) участвовали в ЦНП-спровоцированной вазодилатации [79]. С другой стороны, как показано в исследованиях на крысах, NPR-C также может соединяться с эндотелиальной NO-синтазой, приводя к синтезу окиси азота, хотя этот механизм был описан только в сосудах большего диаметра [81, 82].
Рецептор, который опосредует эндогенные регуляторные эффекты эндотелий-производных на сосудистый тонус in vivo, все еще находится в стадии обсуждения. Мыши с глобальным и специфическим к гладкой мускулатуре нокаутами NPR-B нормотензивны, и функции их сердечно-сосудистой системы в норме, несмотря на вазодилататорный ответ на нарушение экзогенного ЦНП [74, 83]. Предполагалось, что ЦНП обеспечивает функцию эндотелия независимо от NPR-B гладкой мускулатуры и что изменения в продукции вазоконстриктора эндотелина-1 участвуют в повышении артериального давления у животных с нокаутом ecCNP, однако участвующие механизмы не были выяснены. В недавнем исследовании предположили, что передача сигнала NPR-B в перициты более важна, чем гладкая мускулатура сосудов. Последние исследования показывают, что разрушение NPR-B под контролем рецептора к фактору роста, выделенному из тромбоцитов-β у мышей, приводит к гипертензивному фенотипу, указывая, что ЦНП может принимать участие в паракринной связи между эндотелиальными клетками и перицитами для регулирования сосудистой резистентности [75].
Напротив, собранные доказательства свидетельствуют, что NPR-C опосредует большую долю вазодилататорных эффектов ЦНП в сосудистой системе. Мыши с нокаутом NPR-C проявляли нарушение эндотелиальной функции и сниженный гипотензивный ответ на ЦНП in vitro и in vivo [73]. В оригинальной публикации, описывающей глобальную делецию NPR-C у мышей, сообщается о более низком кровяном давлении у самцов этих животных. Однако недавно было показано, что у самок с нокаутом NPR-C повышено артериальное давление и снижена эндотелиальная функция сосудов [73, 84]. Это расхождение может быть связано с половыми различиями в клиренсе и сигнальных функциях NPR-C у мышей, однако данные исследований широких ассоциаций генома человека, связывающих варианты гена NPR-C с гипертонией, не обнаружили несоответствия между полами, что позволяет предположить, что сигнальный путь NPR-C одинаково важен для мужчин и женщин [85]. Пациенты с повышенным артериальным давлением генотипа NPR-C имеют более низкий уровень рецептора иРНК и белка в клетках гладких мышц сосудов, поддерживая теорию, что уменьшенная активация ЦНП посредством NPR-C может лежать в основе этой связи (в противоположность измененному клиренсу) [86]. Еще одно доказательство в пользу роли NPR-C в патогенезе гипертонии было опубликовано в исследовании, посвященном влиянию эндогенного пептида мусклин (также известного как остеокрин). Мусклин является конкурентным лигандом при NPR-C, а инфузия мусклина повышает систолическое артериальное давление in vivo [87]. Уровень экспрессии генов musclin повышен у крыс со спонтанной гипертензией (SHR), и введение антимусклиновых антител снижает артериальное давление у этих животных, что указывает на то, что вмешательство в связывание натрийуретических пептидов с NPR-C с помощью мусклина может способствовать гипертоническому состоянию этих животных [87]. Вопреки этим данным, исследование, показывающее, что инфузия мусклина (остеокрина) снижает кровяное давление у мышей (эффект, который отсутствует у животных с нокаутом NPR-A), предполагает, что повышение уровня циркулирующего ПНП и/или МНП из-за блокады клиренса пептидов NPR-C объясняет этот ответ [88]. Возможно, что мусклин мешает как сигнальной, так и клиренсной функциям NPR-C и играет различную роль в регуляции кровяного давления у здоровых и больных животных. Действительно, вазоконстрикторный и повышающий артериальное давление эффекты мусклина значительно усиливаются при SHR по сравнению с нормотензивной контрольной группой, что указывает на то, что изменение экспрессии рецептора или сигнальной/клиренсной функции NPR-C происходит при гипертонии, которая изменяет реакцию на мусклин в этой модели болезни [87]. Это также подтверждается данными, демонстрирующими, что агонизм NPR-C в SHR ослабляет развитие высокого кровяного давления — эффект, который не наблюдается у контрольной группы крыс линии Вистар-Киото [89].
5. ЦНП влияет на ремоделирование сосудов и участвует в ангиогенезе
ЦНП оказывает непосредственное влияние на митогенез клеток эндотелия и гладких мышц, способствует заживлению ран и восстановлению сосудов, стимулируя рост эндотелия и одновременно препятствуя пролиферации клеток гладких мышц. Эта двойная защитная роль ЦНП была впервые описана на животных моделях трансплантации вен и баллонной ангиопластики, ясно показывая, что лечение ЦНП ускоряет повторную эндотелиализацию и уменьшает вредную неоинтимальную гиперплазию [90, 91, 92]. Подобный ответ на ЦНП наблюдался в сонных артериях, подвергшихся физическому повреждению [93]. Многие из этих исследований сообщают об увеличении продукции цГМФ после лечения ЦНП [91, 93, 94, 95], что указывает на вовлечение NPR-B, однако другие показали, что ЦНП влияет на рост клеток эндотелия и гладких мышц через NPR-C цГМФ-независимым способом. Эти эксперименты продемонстрировали, что про- и антимитогенные эффекты ЦНП опосредованы киназой, регулируемой внеклеточными сигналами, (ERK) 1/2 и могут блокироваться антагонистом NPR-C, M372049, и ингибитором Gi/0, токсином коклюша, несмотря на значительное увеличение продукции цГМФ обоими типами клеток [37, 96]. Активация ERK 1/2 с помощью ЦНП приводит к усилению экспрессии промоторов клеточного цикла (циклин D1) в эндотелиальных клетках и белков — ингибиторов клеточного цикла в клетках гладких мышц (p21 и p27). Это также подтверждается наблюдением, что первичные эндотелиальные клетки микрососудов легких, выделенные у мышей с нокаутом NPR-C, пролиферируют медленнее, чем клетки дикого типа (ДТ), тогда как клетки гладкой мускулатуры аорты, выделенные у животных с нокаутом, растут более быстрыми темпами [37]. Действительно, исследования in vivo показывают, что у мышей, у которых отсутствуют эндотелиальные ЦНП и NPR-C, наблюдается более медленное заживление ран и повышенная гиперплазия интимы после повреждения сосудов, что свидетельствует о том, что высвобождение ЦНП из сосудов является жизненно важным этапом восстановления тканей [97].
Способность ЦНП влиять на рост эндотелиальных клеток заставила исследователей усомниться в роли этого пептида в ангиогенезе. Потенциальный ангиогенный эффект ЦНП был первоначально проверен в классических анализах формирования эндотелиальной трубки in vitro, которые показали, что вызванное ЦНП увеличение образования капиллярной сети имеет величину, сходную с мощным проангиогенным медиатором, VEGF [98]. Кроме того, сообщается, что перенос гена ЦНП непосредственно в ишемическую мышцу улучшает восстановление кровотока и увеличивает плотность капилляров после лигирования и иссечения бедренной артерии у мышей [98]. Исследования сходятся во мнении, что эти ангиогенные ответы зависят от активации ERK 1/2, однако опубликованы противоположные данные, касающиеся вовлеченного рецептора.
Всестороннее исследование, проведенное на животных с нокаутом, предполагает, что эндогенные эффекты эндотелиального ЦНП на ангиогенез опосредуются NPR-C, в то время как при фармакологическом вводе ЦНП участвуют оба рецептора. Например, было показано, что разветвленный ангиогенез в эндотелиальных клетках пупочной вены человека (HUVEC) блокируется ингибитором цГМФ-зависимой протеинкиназы, что предполагает участие передачи сигналов NPR-B [98]. Напротив, образование трубок в легочных эндотелиальных клетках мышей ингибируется антагонизмом токсина коклюша и NPR-C [97]. Эксперименты, проведенные на трансгенных мышах, показывают, что образование базальных эндотелиальных канальцев, отрастание аорты de novo и восстановление кровотока после ишемии задних конечностей снижаются в тканях или у животных с нокаутом ecCNP и NPR-C, в то время как нокаут NPR-B показывает подобный ангиогенный потенциал для мышей ДТ [97]. Кроме того, то же самое исследование сообщает, что у пациентов с критической ишемией конечностей понижен уровень ЦНП и NPR-C в биоптатах икроножной мышцы, предполагая, что уменьшенная передача сигналов через этот путь может способствовать недостаточному ангиогенному ответу на гипоксию, связанную с заболеванием периферических артерий.
Хотя большинство исследований указывают на то, что ЦНП способствует ангиогенезу, имеются также доказательства того, что агонист NPR-C cANF4-23 снижает неоваскуляризацию в губчатых имплантатах мышей [99]. Это открытие сопровождалось снижением уровня ФРЭС, что подтверждается другими исследованиями, показывающими, что ЦНП и cANF4-23 ингибируют экспрессию и передачу сигналов ФРЭС в гладких мышцах сосудов и эндотелиальных клетках [100]. В противоположность этому было показано, что ФРЭС также снижают секрецию ЦНП из культивируемых эндотелиальных клеток [33], предполагая, что между двумя медиаторами сосудов может быть взаимная связь, однако неизвестно, влияет ли взаимодействие двух факторов на ангиогенез.
6. ЦНП ингибирует воспаление и замедляет развитие атеросклероза
Первое указание на то, что ЦНП может влиять на воспалительный ответ на инфекцию и заболевание, исходит из исследований, показывающих, что цитокины ИЛ1α, ИЛ1β и ФНО-α стимулируют высвобождение ЦНП из эндотелиальных клеток [26, 27]. Наиболее эффективным из этих цитокинов (при индукции секреции ЦНП) является ФНО-α, который выделяется макрофагами во время острой фазы воспаления. Другим сильным стимулом для запуска высвобождения ЦНП из эндотелия является бактериальный эндотоксин липополисахарид (ЛПС) [26, 29]. Действительно, уровень ЦНП заметно повышается у пациентов с септическим шоком, в нескольких исследованиях сообщалось о 5–10-кратном увеличении концентрации ЦНП в плазме [31, 101, 102, 103]. Кроме того, концентрация NT-proCNP в плазме тесно связана с вызванной воспалением дисфункцией органов и является предиктором неблагоприятного исхода [101, 104]. Также было высказано предположение, что измерение NT-proCNP в ранней фазе септического шока может помочь предсказать возникновение сепсис-индуцированной энцефалопатии [103]. Вместе эти данные свидетельствуют о том, что острое высвобождение ЦНП может модулировать прогрессирование сепсиса и других воспалительных заболеваний.
Активация эндотелия медиаторами воспаления является ключевым событием в патогенезе сепсиса и сердечно-сосудистых заболеваний, таких как атеросклероз. Изменения в экспрессии молекул клеточной адгезии, таких как интегрины и селектины, облегчают рекрутирование и адгезию лейкоцитов во время начальной фазы иммунного ответа [105, 106]. Было показано, что ЦНП подавляет активацию эндотелия, вызванную рядом воспалительных стимулов как in vitro, так и in vivo. ИЛ-1β и вызванное гистамином свертывание лейкоцитов в посткапиллярных венулах мышей ингибируются ЦНП и cANF4-23 посредством подавления экспрессии Р-селектина [107]. Инфузия ЦНП с помощью мини-насоса ингибирует стимулированную ЛПС инфильтрацию лейкоцитов в легкие, ослабляет экспрессию гена Е-селектина и снижает уровень медиаторов воспаления ФНО-α, макрофагального воспалительного белка-2, моноцитарного хемотаксического протеина-1 (МХП-1) и интерлейкина-6 (ИЛ-6) [108]. Кроме того, ЦНП ингибирует повышение экспрессии молекулы межклеточной адгезии-1, молекулы адгезии сосудистых клеток-1, E-селектина и P-селектина в HUVEC, стимулированных ЛПС [109]. Механизм, с помощью которого ЦНП ослабляет этот ответ, по крайней мере in vitro, заключается в ингибировании провоспалительных путей передачи сигналов NF-κB и p38 и активации пути выживания PI3K/Akt.
ЦНП, происходящий из эндотелия, также, по-видимому, поддерживает в состоянии покоя противовоспалительное влияние на стенку сосудов, так как у мышей с нокаутом ecCNP наблюдается большая подвижность лейкоцитов на исходном уровне до стимуляции активатором воспаления [73]. Кроме того, у этих животных значительно усиливается реакция на перитонит, вызванный ЛПС и ФНО-α. Антилейкоцитарные эффекты эндогенного пептида могут включать механизмы, сходные с теми, которые индуцируются экзогенным применением пептида, поскольку более высокая экспрессия P-селектина в сосудах наблюдается у мышей, у которых отсутствует эндотелиальный ЦНП. Учитывая, что подобное увеличение рекрутирования лейкоцитов наблюдалось у мышей с нокаутом NPR-C после лечения ЛПС, предполагается, что подавление экспрессии молекул клеточной адгезии, вызванное NPR-C, может лежать в основе иммунопонижающего эффекта ЦНП [73]. Этот аспект биологии ЦНП, несомненно, важен в контексте атеросклероза, поскольку генетическая абляция ЦНП приводит к увеличению развития атеросклеротических поражений, большей инфильтрации макрофагов и образованию аневризм аорты и брюшной полости при двойном нокауте ecCNP/ApoE у мышей [73]. Действительно, это открытие согласуется с предыдущей работой, демонстрирующей снижение иммунореактивности ЦНП в пораженных коронарных артериях человека и обратную связь между экспрессией ЦНП и тяжестью поражения [110]. Более того, ЦНП ингибирует пролиферативное и промиграционное воздействие окисленных ЛПНП на клетки гладких мышц, которые могут влиять на рост и стабильность атеросклеротических бляшек [111]. Спонтанное развитие аневризм у мышей с нокаутом ApoE встречается редко, однако мыши с двойным нокаутом ecCNP/ApoE более восприимчивы к этому явлению, и это позволяет предположить, что ЦНП может способствовать поддержанию структурной целостности стенки сосуда [73]. Интересно, что аневризмы наблюдались только у самцов мышей с двойным нокаутом; это наблюдение согласуется с состоянием человека, которое преимущественно влияет на пожилых мужчин [112]. Возможно, что ЦНП регулирует экспрессию и высвобождение матриксных металлопротеиназ (ММР), которые участвуют в развитии аневризм. В подтверждение этого тезиса приводятся данные, показывающие, что ЦНП модулирует экспрессию ММР-2 и ММР-9 в хондроцитах и почках [113, 114].
Существует ряд других воспалительных заболеваний, в которых ЦНП оказался полезным на экспериментальных моделях. ЦНП снижает количество макрофагов, нейтрофилов и лимфоцитов, накапливающихся в легких у мышей, подвергшихся воздействию блеомицина, в модели легочной гипертонии [115]. На модели геморрагического шока у крыс ЦНП снижает маркеры окислительного стресса и экспрессию ФНО-α, ИЛ-6 и ИЛ-1β в почках, что позволяет предположить, что он может улучшить симптомы острой почечной недостаточности, связанные с этим условием [116]. Кроме того, исследования, проведенные с использованием трансгенных мышей со сверхэкспрессией ЦНП в эндотелиальных клетках, позволяют предположить, что ЦНП регулирует воспаление, связанное с ожирением. Сверхэкспрессия эндотелиального ЦНП улучшает толерантность к глюкозе, снижает резистентность к инсулину и ингибирует инфильтрацию жировых макрофагов у мышей, которых кормят рационом с высоким содержанием жиров [117]. Используя тех же животных, эти авторы демонстрируют, что ЦНП ингибирует экспрессию маркеров воспаления ИЛ-6, МСР-1 и CD68 в печени мышей, получавших рацион с высоким содержанием жиров, в модели неалкогольного стеатогепатита [118]. Таким образом, противовоспалительные преимущества эндотелиального ЦНП не ограничиваются сердечно-сосудистыми заболеваниями.
7. ЦНП — новейший регулятор структур и функций сердца
7.1. ЦНП и СН
В течение многих лет роль ЦНП в сердце в значительной степени игнорировалась, так как большинство исследований были посвящены гормонам сердца ПНП и МНП. Кроме того, экспрессия ЦНП в кардиомиоцитах значительно ниже, чем экспрессия ПНП и МНП, что позволяет предположить, что в базовых условиях он не играет ключевой роли в регуляции сердечной функции [14, 119]. Однако было немало сообщений и о том, что сердечная экспрессия и уровень ЦНП в плазме повышаются у пациентов с СН [13, 30, 120, 121, 122, 123]. Повышенный уровень ЦНП в крови связан с фенотипом высокого риска у пациентов с сопутствующими сердечно-сосудистыми заболеваниями и дисфункцией левого желудочка [17]. Кроме того, уровень NT-proCNP в плазме крови у пациентов с сердечной недостаточностью коррелирует с тяжестью заболевания и является сильным предиктором смертности от всех причин и госпитализации у пациентов с сердечной недостаточностью и сохраненной фракцией выброса левого желудочка (ФВЛЖ) [124]. Однако эти исследования не говорят нам, вырабатывается ли ЦНП сердцем или другими органами во время сердечной недостаточности. Ключевой эксперимент, в котором сравнивались уровни ЦНП в плазме коронарного синуса и корня аорты при сердечной недостаточности, обнаружил, что концентрация ЦНП значительно выше в коронарном кровотоке, чем в системном, что является первым прямым доказательством того, что ЦНП при СН высвобождается сердцем [125].
В здоровом сердце уровень ЦНП выше в предсердиях, чем в желудочках, но исследования на карликовых домашних свиньях показали, что кардиостимуляция вызывает 15-кратное увеличение экспрессии ЦНП в желудочках наряду с повышенным уровнем белка ЦНП, демонстрируя, что острый сердечный стресс вызывает немедленную активацию гена и увеличение высвобождения ЦНП [13]. По-видимому, таким же образом происходит переключение между передачей сигналов натрийуретического пептида в разрушающемся желудочке. В условиях симуляции гемодинамики сердца ПНП индуцирует повышение активности гуанилатциклазы в сравнении с ЦНП, однако при давлении, обусловленном перегрузкой из-за СН, ЦНП вызывает удвоенный синтез цГМФ по сравнению с ПНП. Это может быть связано с уменьшением экспрессии NPR-A, и предполагается, что передача сигналов ЦНП через NPR-B может быть более важной во время СН [126]. Однако в других исследованиях сообщалось, что экспрессия NPR-B в желудочках при сердечной недостаточности снижается [13, 127], тогда как повышение NPR-C является наиболее выраженным из трех рецепторов натрийуретических пептидов при терминальной стадии заболевания [128].
7.2. ЦНП непосредственно модулирует сократимость, фиброз и гипертрофию кардиомиоцитов
Было показано, что ЦНП оказывает прямое влияние на сократимость сердца, хотя сообщалось как о положительных, так и об отрицательных инотропных реакциях. Например, ЦНП увеличивает силу сокращения миоцитов в изолированных препаратах предсердий и желудочков у собак [129, 130], тогда как в препаратах сердечной мышцы крысы наблюдались положительный лузитропный и отрицательный инотропный эффекты [131, 132]. Ряд исследований показали, что ЦНП индуцирует фосфорилирование регулятора кальциевого насоса саркоплазматического ретикулума 2 (SERCA2), фосфоламбана (ФЛБ) и тропонина I сердца (cTnI), регуляторного белка, который контролирует опосредованное кальцием взаимодействие между актином и миозином [131, 132, 133, 134]. Положительные лузитропные и инотропные эффекты ЦНП, обнаруженные у крысы с сердечной недостаточностью, связаны с фосфорилированием обоих этих регуляторных белков в дополнение к увеличению кальциевой нагрузки саркоплазматического ретикулума (СР) [132]. Дальнейшие исследования показали, что этот отрицательный инотропный эффект ЦНП чувствителен к ингибированию протеинкиназ (например, NPR-B-зависимых), ингибированию SERCA2 и отсутствует у мышей с нокаутом SERCA2 [135]. Предполагается, что увеличение активации SERCA2 посредством фосфорилирования ФЛБ с помощью ЦНП приводит к тому, что более высокая доля цитозольного Ca2 + возвращается обратно в СР, что снижает активацию Ca2 + миофиламентами, что приводит к отрицательному инотропному эффекту. Напротив, другие исследования продемонстрировали, что ЦНП индуцирует положительный инотропный ответ в сердце и что фосфорилирование ФЛБ приводит к большему поглощению Ca2 + в СР, создавая больший пул Ca2 +, доступный для сокращения [134].
Также в ряде исследований были описаны двухфазные ответы на ЦНП, где за первоначальным, преходящим положительным инотропным ответом следует медленно развивающееся снижение сократительной способности [133, 135, 136]. Природа этого двухфазного ответа была исследована, чтобы выяснить, были ли два противоположных эффекта вызваны активацией различных рецепторов. Однако оказалось, что обе фазы ответа опосредованы NPR-B как аналогом цГМФ, имитирующим и немедленную, и задержанную фазу сократительного ответа. Агонист NPR-C cANF4-23 не влиял на сократительную способность, и никаких изменений сердечного цАМФ не наблюдалось [133]. Причину такой неоднозначности в сократительных реакциях, вызванных ЦНП, можно объяснить перекрестным взаимодействием между сигнальными системами цГМФ и цАМФ в сердце. Было показано, что отрицательный инотропный ответ на ЦНП является доминирующим эффектом, когда передача сигналов цАМФ снижается (например, во время блокады бета-адренорецепторов), в то время как эффект полностью теряется в присутствии максимальной стимуляции бета-адренорецепторов изопреналином [135]. В сердцах как с нарушениями, так и без них ЦНП увеличивает положительный инотропный эффект стимуляции бета-адренорецептором благодаря ингибированию цГМФ фосфодиэстеразы 3 (ФДЭ 3), фермента, ответственного за расщепление цАМФ, образующегося при стимуляции бета-адреноцептором [137, 138]. Таким образом, сократительный эффект ЦНП, наблюдаемый в различных экспериментальных моделях, вероятно, будет зависеть от внутриклеточного уровня цАМФ и стимуляции бета-адренорецептором. Передача сигналов NPR-C может также влиять на сократительную способность сердца, хотя это непосредственно не изучалось; стимуляция рецепторов, вероятно, приведет к снижению цАМФ за счет ингибирования аденилатциклазы [50, 139]. Также было показано, что cANF4-23 ингибирует кальциевые каналы L-типа в предсердных миоцитах [140], если подобный путь присутствует в желудочковых миоцитах. Активация NPR-C может индуцировать отрицательный инотропный ответ.
Ремоделирование сердца во время сердечной недостаточности характеризуется пролиферацией фибробластов, трансформацией миофибробластов и отложением коллагена, что приводит к развитию фиброза сердца. Это приводит к дисфункции желудочков и повышению жесткости миокарда, что имеет существенные последствия для функции сердца [141]. ЦНП оказывает антифиброзный эффект на сердце и значительно более эффективен в снижении роста фибробластов и продукции внеклеточного матрикса, чем другие натрийуретические пептиды [15]. ЦНП экспрессируется и высвобождается фибробластами сердца в ответ на основной фактор роста фибробластов (FGF2), трансформирующий ростовой фактор бета (TGFβ) и эндотелин-1. Он вызывает большее увеличение цГМФ и большее подавление синтеза коллагена, чем ПНП и МНП [15]. Кроме того, дифференцировка фибробластов, миграция и продуцирование патологических медиаторов, MCP-1 и PAI-1, ослабляются ЦНП in vitro [128, 142, 143].
В дополнение к ослаблению фиброза ЦНП также оказывает антигипертрофический эффект на сердце. Эксперименты, проведенные в изолированных кардиомиоцитах крысы, показали, что ЦНП ингибирует базальную и индуцированную эндотелином-1 экспрессию белка, секрецию ПНП и экспрессию гипертрофических генов GATA4 и MEF2. Эндотелин-1-индуцированное повышение активности кальций/кальмодулин-зависимой киназы и ERK также ослабляется ЦНП. Эти эффекты повторяются с использованием аналога цГМФ, что позволяет предположить, что механизм включает активацию NPR-B [144]. Точно так же было показано, что ЦНП уменьшает вызванное ангиотензином II увеличение размера кардиомиоцитов у мышей, что указывает на то, что ЦНП непосредственно подавляет гипертрофические сигнальные каскады [145].
8. Эндогенный ЦНП обладает кардиопротективным действием у экспериментальных животных при сердечной недостаточности
Генерирование тканеспецифических нокаутов позволило лучше понять типы клеток, ответственных за высвобождение ЦНП в сердце, и то, как каждый источник ЦНП влияет на структуру и функцию сердца при заболевании. В начале исследования у мышей, у которых отсутствовал кардиомиоцит (нокаут cmCNP) и полученный из фибробластов ЦНП (нокаут fbCNP), не наблюдалось явных изменений сократимости, структуры или фиброза сердца, что подтверждает предыдущие предположения, что ЦНП играет минимальную роль в здоровом сердце [145]. Однако после аортального связывания (СН, вызванной перегрузкой давлением) у мышей с нокаутом cmCNP и fbCNP наблюдались большее снижение фракции выброса, повышенная дилатация желудочков, большая гипертрофия сердца (только для нокаута cmCNP) и большее отложение коллагена по сравнению с контрольной группой из того же помета. Напротив, ЦНП эндотелиального происхождения не обладает кардиопротективными свойствами, по крайней мере, в этой модели. Таким образом, эндогенный ЦНП, выделенный кардиомиоцитами и фибробластами, снижает патологические изменения, которые возникают при сердечной недостаточности. Сопоставимая сердечная дисфункция, гипертрофия и фиброз наблюдаются у животных с нокаутом NPR-C, подвергнутых аортальному связыванию, что позволяет предположить, что NPR-C опосредует эффекты ЦНП в миоцитах и фибробластах. Действительно, инфузия ЦНП с помощью мини-насоса устраняет сердечную дисфункцию и фиброз при сердечной недостаточности у животных ДТ, но не у мышей с нокаутом NPR-C. Животные с нокаутом cmCNP чувствовали себя хуже, чем животные ДТ, при стимуляции изопреналином (то есть в модели симпатической гиперактивации СН), в то время как потеря NPR-B не оказывала неблагоприятного влияния на гипертрофический или фиброзный ответ [145]. Это контрастирует с предыдущими исследованиями, в которых показано, что у трансгенных крыс, экспрессирующих доминантную отрицательную форму NPR-B, в начале исследования наблюдалась гипертрофия сердца [146]. Однако эти мутанты не проявляют фиброза сердца и изменений сократительной функции до или после хронической перегрузки объемом, поэтому, возможно, в более отдаленной перспективе NPR-B играет доминирующую роль в регуляции компенсаторной гипертрофии, тогда как NPR-C регулирует дезадаптивную гипертрофию и антифиброзные эффекты ЦНП. В подтверждение этого приводятся данные, показывающие, что специфичная для кардиомиоцитов делеция NPR-B не изменяет у мышей ответ на СН, вызванную перегрузкой давлением [147], указывая на то, что либо передача сигналов эндогенным NPR-B не является жизненно важной при патологическом ремоделировании сердца, либо другая система компенсирует потерю NPR-B. Однако мыши с гетерозиготами NPR-B подвержены аортальному стенозу [148], что позволяет предположить, что важность этого подтипа рецепторов натрийуретических пептидов может находиться за пределами кардиомиоцитов. Это не означает, что NPR-B не может быть нацелен на фармакологическое воздействие, поскольку недавние исследования показывают, что новые дизайнерские пептиды, которые связываются с NPR-B, могут снижать пролиферацию фибробластов и секрецию коллагена in vitro и in vivo [128, 149, 150]. Эта роль эндогенной передачи сигналов NPR-C в регуляции фиброза подтверждается другими исследованиями, в которых наблюдались более выраженная сердечная дисфункция, отложение коллагена в предсердии и более высокий уровень TGFβ и TIMP1 у мышей с нокаутом NPR-C, подвергнутых индуцированной ангиотензином II перегрузке давлением [151, 152]. Кроме того, у человека был обнаружен функциональный генетический вариант NPR-C, связанный с диастолической дисфункцией. Этот однонуклеотидный полиморфизм (SNP; снип) не влияет на экспрессию белка NPR-C или уровень циркулирующих в плазме натрийуретических пептидов, что свидетельствует о влиянии нисходящей передачи сигналов. Постулируется, что этот снип приводит к дисфункции каталитического домена NPR-C и что аберрантная передача сигналов в фибробластах способствует фиброзу сердца и нарушению диастолической функции [153]. Точный механизм, с помощью которого передача сигналов NPR-C ингибирует пролиферацию фибробластов / синтез коллагена, неизвестен, но было показано, что ЦНП- и cANF4-23-опосредованная стимуляция NPR-C может активировать неселективный катионный ток, который частично переносится транзиторным рецепторным потенциалом C-каналов, и авторы предварительно предполагают, что это может повлиять на секреторное состояние клетки [154].
Тем не менее, похоже, что NPR-C может играть двоякую роль при СН, поскольку другие исследования показывают, что удаление или блокада клиренсной функции NPR-C полезна при сердечных заболеваниях. Мыши с нокаутом NPR-C, скрещенные с животными, у которых самопроизвольно развивается фиброз предсердий (сверхэкспрессия ТФР-β1), показывают значительно меньший фиброз и отложение коллагена, чем в контрольной группе. Кроме того, нокдаун NPR-C в культивируемых фибробластах, стимулированных ТФР-β1, приводит к снижению экспрессии маркеров фиброза pSmad и коллагена. Эти эффекты отменяются нокдауном NPR-A, что указывает на то, что в основе этого эффекта лежат уменьшенный клиренс ПНП и последующее увеличение сигнала ПНП [88, 155]. Кроме того, трансгенные мыши со сверхэкспрессией остеокрина (OSTN-Tg) имеют улучшенный прогноз и более высокие показатели выживаемости после инфаркта миокарда (ИМ) [88]. Уровни ПНП и ЦНП у мышей OSTN-Tg повышены, поэтому кардиопротективный эффект остеокрина в этой модели объясняется ингибированием NPR-C-опосредованного клиренса натрийуретического пептида. Очевидно, что требуется дополнительное исследование, чтобы понять больше о переключении между передачей сигналов NPR-C и клиренсом, а также о том, изменяется ли баланс при различных патологических состояниях, способствующих заболеваниям сердца (например, при перегрузке давлением или ИМ).
9. Влияние ЦНП на вазодилатацию коронарных сосудов
Первые исследования сосудистого действия ЦНП в сердце были выполнены на коронарных артериях свиньи. Эти ранние эксперименты представили первые доказательства того, что ЦНП расслабляет коронарные сосуды посредством гиперполяризации. Ответы ЦНП могут быть ингибированы блокаторами калиевых каналов харибдотоксином и глибенкламидом [55]. Те же авторы также обнаружили, что HS-142-1 ингибирует уменьшение коронарного кровотока, вызванного ЦНП у собак, что позволяет предположить наличие компонента NPR-B /цГМФ в расслаблении ЦНП в сердце [156]. Напротив, исследования на перфузированных сердцах грызунов показали, что ЦНП и cANF4-23 индуцируют снижение давления коронарной перфузии посредством активации NPR-C и открытия каналов GIRK в механизме, аналогичном брыжеечной сосудистой сети [157]. Кроме того, увеличение пептида ЦНП может быть измерено в коронарном стоке после стимуляции с помощью ACh, что позволяет предположить, что ЦНП высвобождается как эндотелиальный фактор гиперполяризации (EDHF) в коронарных сосудах. Интересно отметить, что у мышей с нокаутом ecCNP и NPR-C реакция на эндотелий-зависимые вазодилататоры и обусловленную потоком дилатацию (реакция на напряжение сдвига), уменьшена [145]. Таким образом, ЦНП может синтезироваться при кардиострессе в ответ на изменение кровотока. Интересно, что уровень NT-proCNP предсказывает смертность и реадмиссию сердечной недостаточности у пациентов с нестабильной стенокардией, состоянием, характеризующимся высоким сдвигом клеток эндотелия стенки сосудов и изменением кровотока в сердечной мышце [158].
10. Роль ЦНП при ишемических, реперфузионных повреждениях и ИМ
Микрососудистая обструкция является патологическим признаком острого ИМ и часто возникает, несмотря на восстановление кровотока в ишемической ткани после коронарных вмешательств. Двумя основными факторами, способствующими этому, являются нарушение вазодилатации и закупорка нейтрофилов, которые приводят к механической обструкции сосудов и выбросу окислителей и провоспалительных медиаторов [159]. Учитывая способность ЦНП к расширению коронарных сосудов и его высвобождение в ответ на напряжение сдвига, предполагается, что этот вазоактивный медиатор может улучшать коронарный кровоток и уменьшать повреждение тканей, ингибируя накопление воспалительных клеток и закупорку коронарных сосудов. Данные исследований на людях показывают, что экспрессия гена ЦНП повышена при ишемии на фоне сердечной недостаточности, а это позволяет предположить, что он может играть роль в физиологическом защитном ответе во время ИМ [160]. Острые эффекты ЦНП при реперфузионном повреждении миокарда (РПМ) были изучены на изолированных сердцах — экспериментальной системе, лишенной циркулирующих воспалительных клеток. В этой ситуации инфузия ЦНП ослабляет повышение коронарного перфузионного давления во время реперфузии, уменьшает размер инфаркта и улучшает сократимость левого желудочка [157]. Защитный эффект ЦНП в этой модели отменяется антагонистом NPR-C M372049 и повторяется путем инфузии cANF4-23. Кроме того, больший размер инфаркта и худшее функциональное восстановление сердца наблюдались у животных с нокаутом NPR-C, подвергнутых тому же экспериментальному протоколу, что указывает на то, что активация NPR-C с помощью ЦНП полезна во время РПМ [145]. Однако следует отметить, что коронарный вазодилататорный ответ на ЦНП полностью не отменен у мышей с нокаутом NPR-C, что позволяет предположить, что активация NPR-B может отчасти опосредовать некоторые вазорелаксантные эффекты ЦНП в сердце. Также вероятно, что NPR-B-опосредованное увеличение передачи сигналов цГМФ/ПКG вносит вклад в кардиопротективное действие ЦНП после ишемии [161, 162].
Пациенты с уже существующей микрососудистой дисфункцией более чувствительны к повреждению миокарда после чрескожного коронарного вмешательства, поэтому можно ожидать, что потеря ЦНП эндотелиального происхождения сделает сердце более чувствительным к повреждениям после РПМ. Однако генетическая абляция ЦНП из кардиомиоцитов приводит к худшему восстановлению после РПМ, в то время как удаление эндотелиального ЦНП не ухудшает фенотип [145]. Возможно, полученный из кардиомиоцитов ЦНП оказывает прямое влияние на сократимость после РПМ в изолированном сердце, однако этот механизм не был исследован. Было высказано предположение, что соединение NPR-C с АТФ-чувствительными калиевыми каналами (KATP) может оказывать благотворное влияние на ЦНП при РПМ, поскольку ЦНП может вызывать открытие KATP, которое, как известно, снижает сердечный и метаболический стресс во время ишемического повреждения [162].
Эффект сверхэкспрессии и нокдауна ЦНП также изучался на хронических моделях ИМ с целью понимания его роли в опосредовании воспаления и ремоделирования сердца в долгосрочной перспективе. Последние исследования с использованием глушения генов ЦНП у крыс демонстрируют, что прекращение эндогенной продукции ЦНП кардиомиоцитами приводит к увеличению размера инфаркта после РПМ, большему фиброзу сердца и увеличению воспалительных маркеров ФНО-α и ИЛ-6 [163]. Напротив, другие сообщали, что сверхэкспрессия ЦНП кардиомиоцитами не влияет на размер инфаркта, но уменьшает гипертрофию сердца и количество мононуклеарных инфильтратов, наблюдаемых в миокарде [164]. Аналогичным образом хроническая инфузия ЦНП в модели перманентной перевязки коронарной артерии уменьшает расширение левого желудочка, отложение коллагена и увеличивает сердечный выброс [165]. В дополнение к этому сообщалось об увеличении экспрессии ЦНП в пограничной зоне инфаркта в сердцах свиней, где, как полагают, он может способствовать восстановлению миокарда за счет увеличения плотности капилляров (хорошо сочетаясь с проангиогенным действием пептида) [166]. Вместе эти данные позволяют предположить, что ЦНП может быть терапевтической мишенью при инфаркте миокарда, поскольку он эффективен для уменьшения размера инфаркта, воспаления сердца и неблагоприятного ремоделирования желудочков, происходящего после инфаркта миокарда, что может замедлить прогрессирование сердечной недостаточности.
11. Роль ЦНП в регуляции сердечных сокращений и электрической проводимости синоатриального узла (САУ)
ЦНП влияет на частоту сердечных сокращений с помощью двух механизмов: изменения ионных токов в САУ и модуляции симпатической передачи. Сообщалось, что он вызывает как положительные, так и отрицательные хронотропные эффекты в сердце посредством модуляции кальциевых каналов L-типа в САУ [129, 140, 167, 168]. При базальных условиях или слабой стимуляции агонистом бета-адренорецептора ЦНП вызывает увеличение частоты сердечных сокращений и электрической проводимости через САУ. Этот ответ ослабляется ингибитором PDE3 милриноном, что позволяет предположить, что механизм включает опосредованное NPR-B/цГМФ ингибирование PDE3 и увеличение цАМФ, сходное с положительными инотропными эффектами ЦНП, наблюдаемыми в миоцитах [169]. Напротив, когда сердечный ритм повышен, ЦНП вызывает отрицательный хронотропный эффект и уменьшает скорость проводимости в пределах САУ. NPR-C, как полагают, опосредует этот ответ, так как cANF4-23 снижает хронотропный эффект изопреналина, но не оказывает влияния в базальных условиях [170]. Важность NPR-C, проводящих сигнал в САУ, показана в исследовании на мышах с нокаутированным геном. Делеция NPR-C приводит к дисфункции САУ, пролонгации времени восстановления САУ и повышенной восприимчивости к фибрилляции предсердий [171]. У этих мышей в начале исследования также наблюдался фиброз предсердий, который в дальнейшем участвовал в нарушении проводимости САУ. Это усугубляется на моделях сердечной недостаточности, хотя лечение cANF4-23 снижает число аритмий и изменяет электрофизиологию [151].
Второй механизм, посредством которого ЦНП регулирует сердечный ритм, — ингибирование сердечной симпатической нейротрансмиссии. Лечение ЦНП снижает тахикардию во время стимуляции правого звездчатого узла у крыс и ингибирует синтез норэпинефрина из изолированного предсердия [172]. Доказательства наличия эндогенного пути ЦНП/ NPR-B, регулирующего симпатическую активность, продемонстрированы у трансгенных крыс с нейронспецифической гиперэкспрессией доминантно-отрицательной формы NPR-B. Эти животные демонстрируют повышенную частоту сердечных сокращений, большую вариабельность сердечного ритма, а анализ частотной области выявляет более высокое соотношение низких (НЧ) и высоких (ВЧ) частот, свидетельствующее о сдвиге в сторону возбуждения симпатической нервной системы [172]. Аналогичные результаты также были у мышей без NPR-C. Эти животные демонстрировали снижение циркадных изменений сердечного ритма, потерю динамических изменений из-за перемен в активности и более высокое соотношение НЧ/ВЧ, что свидетельствует об усилении симпатической активности [173]. Тем не менее, независимо от рецептора, который опосредует этот симпато-ингибирующий эффект ЦНП, способность подавлять симпатическую активность в сердце может быть важным защитным механизмом при заболеваниях, характеризующихся вегетативной дисрегуляцией.
12. Текущие и будущие терапевтические подходы
За последнее десятилетие было получено огромное количество данных, подтверждающих широкую гомеостатическую роль ЦНП в поддержании сосудистой и сердечной функции. Более того, последние исследования с использованием трансгенных моделей позволили глубже понять ключевые физиологические функции пептида в сердечно-сосудистой системе. Терапевтические средства, разработанные для связывания с родственными рецепторами ЦНП, могут найти широкое клиническое применение при таких заболеваниях, как гипертония, атеросклероз, рестеноз, критическая ишемия конечностей, заболевания периферических артерий, реперфузионное повреждение миокарда, инфаркт миокарда, сердечная недостаточность и нарушения ритма сердца. В настоящее время существует два метода лечения натрийуретической пептидной системы, которые были проверены в клинических испытаниях: ингибиторы НЭП (подавляют расщепление натрийуретических пептидов) и цендеритид (химерный агонист NPR-A/NPR-B). Ингибиторы НЭП, используемые в сочетании с ингибиторами ангиотензинпревращающего фермента (иАПФ), были опробованы на пациентах с гипертонией и СН. Первоначальные результаты казались многообещающими, однако у пациентов, получавших двойное лечение, было больше случаев ангионевротического отека по сравнению с теми, кто получал лечение одним ингибитором АПФ, поэтому исследование было остановлено [174]. Однако ингибитор НЭП сакубитрил, вводимый в сочетании с блокатором рецепторов ангиотензина (БРА) валсартаном (LCZ696), использовался с большим успехом. Этот препарат, по-видимому, более эффективен для снижения артериального давления, чем доступные в настоящее время иАПФ и БРА с аналогичным профилем безопасности и переносимости [175, 176]. Кроме того, LCZ696 показал впечатляющие результаты в исследовании PARADIGM-HF для лечения пациентов с СН и сниженной фракцией выброса. Результаты исследования показали значительно большие преимущества этой комбинированной терапии по сравнению со стандартной терапией (только лечение иАПФ) [177]. Сообщалось о значительном снижении смертности от сердечно-сосудистых заболеваний и госпитализаций, связанных с сердечной недостаточностью (20%), и исследование было прекращено досрочно из-за подавляющего эффекта в отношении первичной конечной точки. LCZ696 в настоящее время лицензируется как Entresto и используется в клинических испытаниях (PARAGON-HF) для пациентов с сердечной недостаточностью с сохраненной фракцией выброса (СНсФВ) [178]. Учитывая, что артериальная гипертензия является распространенным явлением в этой группе пациентов, а заболевание связано со снижением доступности цГМФ [179], повышение уровня натрийуретика может быть полезным. Теоретически ингибирование НЭП может повышать уровень всех натрийуретических пептидов и усиливать их полезные эффекты, однако следует отметить, что НЭП также расщепляет другие вазоактивные пептиды, такие как брадикинин, поэтому такое лечение может показать результат вплоть до снижения деградации натрийуретического пептида. Хотя у пациентов, получавших LCZ696, был зарегистрирован более высокий уровень цГМФ и МНП, что указывает на то, что повышенный уровень натрийуретического пептида, вероятно, способствует защитному эффекту от ингибирования НЭП. Более того, ЦНП более восприимчив, чем ПНП и МНП, к деградации НЭП, поэтому он может вносить важный вклад в эффективность LCZ696 [18].
Цендеритид (CD-NP) — это новый дизайнерский натрийуретический пептид, который состоит из ЦНП и C-концевого хвоста натрийуретического пептида Dendroaspis (выделенного из яда змеи зеленой мамбы). Это двойной агонист NPR-A/ NPR-B, который был спроектирован для использования антифиброзных, антипролиферативных и сосудовосстанавливающих возможностей ЦНП и полезных почечных эффектов активации NPR-A [180]. Ключевым преимуществом этого препарата является тот факт, что он более устойчив к деградации НЭП, чем нативные натрийуретические пептиды [181]. Первой клинической целью CD-NP является СН, так как он доказал свою эффективность на модели ранней стадии заболевания у крыс, при которой уменьшил фиброз и диастолическую дисфункцию [149]. Кроме того, CD-NP вызывает большее снижение выработки коллагена фибробластами сердца человека, чем только МНП или ЦНП [128, 182]. Было высказано предположение, что нацеливание на NPR-B в сердце может быть потенциально вредным, если передача сигналов NPR-B/цГМФ увеличивает адренергическую передачу (посредством ингибирования PDE3) in vivo, как это было показано in vitro [138]. Действительно, клинические исследования ингибитора PDE3 милринона демонстрируют повышение смертности, количества внезапных смертей и аритмии у пациентов с СН, поэтому необходимо тщательно изучить влияние агонистов NPR-B на активность PDE3. Однако первое исследование на человеке показало, что цендеритид безопасен, хорошо переносится и вызывает повышение уровня цГМФ в плазме и моче у пациентов с СН, что позволяет предположить, что он может оказаться перспективным терапевтическим средством в будущем [182]. Совсем недавно Burnett et al. разработали другие дизайнерские натрийуретические пептиды, такие как C53, активатор NPR-B пролонгированного действия, устойчивый к НЭП и имеющий ограниченное взаимодействие с NPR-C, который вызывает сильные антифиброзные эффекты в фибробластах почек и сердца [150]. Новейшее соединение в этой разработке лекарств, CRRL269, негипотензивный активатор NPR-A, рассматривается для применения при остром поражении почек [183].
Обоснованием для разработки агонистов NPR-C послужили исследования, показывающие, что этот рецептор опосредует большую часть воздействия ЦНП на тонус сосудов [65, 73]. Кроме того, мутации NPR-C связаны с гипертонией в GWAS [85]. Также было показано, что NPR-C опосредует, по крайней мере, частично, эндогенные эффекты ЦНП при сердечной недостаточности, регенерации сосудов / ангиогенезе и воспалении. Кроме того, NPR-C является рецептором, который наиболее активирован при СН. Нацеливание NPR-C может также потенциально избежать влияния на развитие кости, которое опосредуется главным образом NPR-B. Таким образом, низкомолекулярные агонисты NPR-C были сконструированы в соответствии с кристаллической структурой рецептора, связанного с ЦНП [184] и селективного антагониста M372049 [185]. Было показано, что соединение свинца 118 снижает артериальное давление in vivo и расслабляет брыжеечные артерии in vitro [73]. Кроме того, 118 имеет высокую аффинность и характеристики медленной диссоциации на рецепторе, поэтому он может конкурировать за клиренсную функцию NPR-C. Соответственно, у агонистов NPR-C может быть дополнительное преимущество, заключающееся в том, что они способны уменьшать деградацию всех натрийуретических пептидов и могут оказывать более широкий терапевтический эффект, чем эффект, вызываемый только передачей сигналов NPR-C. Дальнейшее развитие и оптимизация продолжаются.
13. Статистика
ЦНП обеспечивает множество защитных эффектов для сердца и сосудов благодаря двум своим родственным рецепторам, NPR-B и NPR-C. Эти полезные действия опосредованы рядом различных молекулярных путей (рис. 1). Фармакологическое воздействие на NPR-B и/или NPR-C использует эти целительные функции и имеет широкие терапевтические перспективы для сердечно-сосудистых заболеваний.
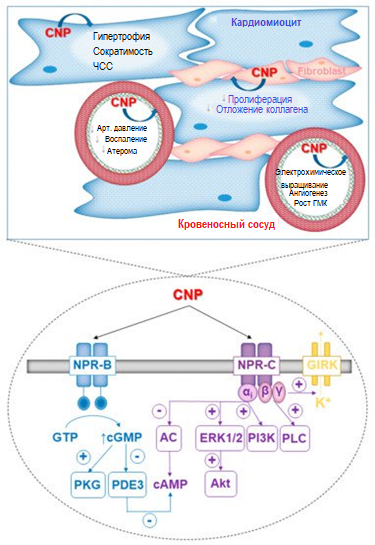 Рисунок 1. Патофизиологические функции (верхняя панель) и сигнальные пути (нижняя панель) активировались ЦНП в эндотелиальных клетках, кардиомиоцитах и фибробластах. ЦНП снижает гипертрофию сердца, замедляет образование фиброза и способствует инотропии и хронотропии миоцитов. В сосудистой сети ЦНП снижает артериальное давление, ингибирует воспаление, уменьшает отложение атеросклеротических бляшек, модулирует рост эндотелиальных клеток (ЭК) и гладкомышечных клеток (ГМК) и стимулирует ангиогенез. Клеточные эффекты ЦНП опосредованы двумя родственными рецепторами, NPR-B и NPR-C. NPR-B является частичным рецептором гуанилилциклазы, и стимуляция приводит к выработке цГМФ и активации протеинкиназы G (PKG) I. NPR-C представляет собой связанный с Gi-протеином рецептор, который модулирует различные внутриклеточные ферменты, в том числе аденилатциклазу (АЦ), фосфолипазу C (PLC), киназу, регулируемую внеклеточным сигналом, (ERK) 1/2, фосфоинозитид-3-киназу (PI3K) и протеинкиназу B (Akt). Активация NPR-C также запускает открытие G-белок-связанных калиевых каналов внутреннего выпрямления (GIRK). Перекрестное взаимодействие происходит между двумя рецепторными сигнальными путями посредством цГМФ-опосредованного ингибирования фосфодиэстеразы (ФДЭ) 3 — фермента, ответственного за гидролиз цАМФ в кардиомиоцитах
Рисунок 1. Патофизиологические функции (верхняя панель) и сигнальные пути (нижняя панель) активировались ЦНП в эндотелиальных клетках, кардиомиоцитах и фибробластах. ЦНП снижает гипертрофию сердца, замедляет образование фиброза и способствует инотропии и хронотропии миоцитов. В сосудистой сети ЦНП снижает артериальное давление, ингибирует воспаление, уменьшает отложение атеросклеротических бляшек, модулирует рост эндотелиальных клеток (ЭК) и гладкомышечных клеток (ГМК) и стимулирует ангиогенез. Клеточные эффекты ЦНП опосредованы двумя родственными рецепторами, NPR-B и NPR-C. NPR-B является частичным рецептором гуанилилциклазы, и стимуляция приводит к выработке цГМФ и активации протеинкиназы G (PKG) I. NPR-C представляет собой связанный с Gi-протеином рецептор, который модулирует различные внутриклеточные ферменты, в том числе аденилатциклазу (АЦ), фосфолипазу C (PLC), киназу, регулируемую внеклеточным сигналом, (ERK) 1/2, фосфоинозитид-3-киназу (PI3K) и протеинкиназу B (Akt). Активация NPR-C также запускает открытие G-белок-связанных калиевых каналов внутреннего выпрямления (GIRK). Перекрестное взаимодействие происходит между двумя рецепторными сигнальными путями посредством цГМФ-опосредованного ингибирования фосфодиэстеразы (ФДЭ) 3 — фермента, ответственного за гидролиз цАМФ в кардиомиоцитах
* CNP – натрийуретический пептид типа С, GTP Гамма – ГТ, Cgmp – цГМФ
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эми Мойес, Адриан Хоббс
Int. J. Mol. Sci. 2019, 20(9), 2281
Аннотация
Натрийуретический пептид типа С (ЦНП) — аутокринный и паракринный медиатор, вырабатываемый эндотелиальными клетками, кардиомиоцитами и фибробластами, который регулирует физиологические функции сердечно-сосудистой системы. Эти роли передаются через два родственных рецептора — рецептор натрийуретического пептида типа B (NPR-B) и рецептор натрийуретического пептида типа C (NPR-C), которые активируют различные сигнальные пути, опосредующие комплементарные, но разные клеточные ответы. Традиционно ЦНП считается эндотелиальным компонентом системы натрийуретических пептидов, в то время как родственные ему пептиды, предсердный натрийуретический пептид (ПНП) и мозговой натрийуретический пептид (МНП), считаются эндокринными протекторами сердечной функции и объема крови. Однако накопленные доказательства указывают, что ЦНП не только модулирует тонус сосудов и артериальное давление, но также регулирует широкий спектр сердечно-сосудистых эффектов, включая контроль над воспалением, ангиогенезом, пролиферацией гладких мышц и эндотелиальных клеток, атеросклерозом, сократимостью кардиомиоцитов, гипертрофией, фиброзом и электрофизиологией сердца. Этот обзор будет сфокусирован на новых физиологических функциях, приписываемых ЦНП, рецепторам / сигнальным механизмам, участвующим в опосредовании его кардиопротективных эффектов, и разработке терапевтических средств, нацеленных на сигнальные пути ЦНП при различных патологиях.
Ключевые слова: натрийуретический пептид, сосудистый, эндотелиальные клетки, кардиомиоциты, фибробласты, воспаление, сердечная недостаточность, гипертензия, ангиогенез.
2. Синтез, секреция и деградация ЦНП
Натрийуретические пептиды относятся к семейству трех структурно взаимосвязанных гормонов, которые выполняют уникальную роль в сердечно-сосудистой системе. Физиологические функции предсердного натрийуретического пептида (ПНП) и мозгового натрийуретического пептида (МНП) активно исследуются в течение последних десятилетий, однако мало внимания уделялось изучению натрийуретического пептида типа C (ЦНП). ПНП и МНП попадают в сердце [1, 2, 3, 4] и вырабатываются в ответ на объем-индуцированное растяжение предсердия и желудочков соответственно [5, 6]. Эти пептиды действуют как эндокринные гормоны и способствуют регуляции структур сердца, артериального давления и объема циркулирующей крови [7]. Напротив, распределение и способ действия ЦНП в тканях различны; недавние исследования выявили разнообразные эндогенные роли ЦНП, включая контроль над тонусом сосудов, активацией лейкоцитов, ангиогенезом, пролиферацией гладких мышц и эндотелиальных клеток, целостностью сосудов, коронарным кровотоком, фиброзом сердца, гипертрофией сердца и электрофизиологией. Такие аспекты физиологии и патологии ЦНП будут детально рассмотрены в этой статье.
2. Синтез, секреция и деградация ЦНП
ЦНП представляет собой пептид из 22 аминокислот, который синтезируется в результате обработки preproCNP сигнальной пептидазой и последующей сегментации proCNP эндопротеазой фурином [8]. В тканях и плазме имеются две формы ЦНП — ЦНП-53 и ЦНП-22 [8], однако протеаза, ответственная за обработку удлиненного пептида в его более короткую форму, неизвестна. ЦНП-22 был обнаружен в экстрактах мозга свиньи [9]. В дополнение к его избыточному синтезу в ЦНС высокий уровень ЦНП был обнаружен в хондроцитах [10] и эндотелиальных клетках [11, 12], которые постоянно вырабатывают пептиды. Другие клетки сердечно-сосудистой системы, в том числе кардиомиоциты [13, 14] и фибробласты [15], также вырабатывают ЦНП, однако тканевый синтез и уровень плазмы у здоровых людей относительно низкие, что указывает на действие ЦНП как местного паракринного или аутокринного медиатора сердца и кровеносных сосудов.
Период полувыведения ЦНП в плазме короткий (2,6 мин) [16], однако деградация происходит быстро, что объясняет низкую концентрацию (диапазон фмоль — пмоль) пептида в циркулирующей крови [11, 17]. Существуют два основных пути инактивации ЦНП: сегментация нейтральной эндопептидазой (НЭП) [18] и интернализация рецепторами натрийуретических пептидов типа С (NPR-C) с последующими эндоцитозом и лизосомальной деградацией [19, 20]. Кроме того, участие каждого пути в деградации натрийуретических пептидов кажется равным [21] у здоровых людей, хотя есть признаки, указывающие, что во время патофизиологических состояний, когда уровень натрийуретических пептидов повышается и NPR-C может быть избыточным, НЭП может играть важную роль в очищении [22]. К тому же доставка НЭП и/или NPR-C в ткани может негативно влиять на инактивацию ЦНП в различных органах: например, ЦНП интернализуется посредством NPR-C в почках легче, чем в легких [23].
Большинство известных стимулирующих веществ для повышения экспрессии гена или запуска производства ЦНП имеют отношение к состоянию сердечно-сосудистой системы, включая гемодинамический стресс [24, 25], воспалительные цитокины, такие как фактор некроза опухоли альфа (ФНО-α) [26], интерлейкин 1β (ИЛ1β) [26, 27], трансформирующий фактор роста бета (ТФР-β) [12, 28] и бактериальные полисахариды [26, 29]. В соответствии с этими данными, исследования показывают, что уровень ЦНП в плазме повышается у пациентов с сердечной недостаточностью (СН) [30] и сепсисом [31]. Напротив, производство ЦНП снижается окисленными липопротеинами низкой плотности [32] и фактором роста эндотелия сосудов (ФРЭС) [33].
3. Рецепторы натрийуретических пептидов
ЦНП оказывает биологический эффект посредством активации двух рецепторов клеточной поверхности: рецептора натрийуретического пептида типа B (NPR-B, также называемого гуанилатциклаза-Б, ГЦ-Б) и рецептора натрийуретического пептида типа С (NPR-C) [34, 35]. Пептид обладает очень низкой аффинностью к рецептору натрийуретического пептида A (NPR-A) [36], который является эндогенным рецептором для лигандов ПНП и МНП. Как NPR-B, так и NPR-C массово синтезируются и обнаруживаются в эндотелиальных клетках [37, 38], клетках гладких мышц [37, 39], кардиомиоцитах [14, 40] и фибробластах [15, 41]. NPR-C — наиболее распространенный рецептор натрийуретического пептида, он насчитывает около 95% от общего числа рецепторов натрийуретических пептидов в эндотелиальных клетках [42].
ЦНП обладает схожей связывающей способностью с NPR-B и NPR-C [36], хотя сигнальные пути активируются каждым рецептором отдельно. NPR-B представляет собой рецептор гуанилатциклазы в виде частиц, который катализирует превращение гуанозин-5'-трифосфата в циклический гуанозин-3',5'-монофосфат (цГМФ), вторичный посредник, который активирует протеинкиназу G I и II [43, 44, 45], которая, в свою очередь, изменяет клеточные функции путем фосфорилирования специфических белков-мишеней. Первоначально считалось, что NPR-C является рецептором клиренса [46], лишенным сигнальной активности, но позже было показано, что он содержит чувствительные к коклюшному токсину Gi-связывающие домены во внутриклеточном C-концевом хвосте, которые связываются с ингибированием аденилатциклазы (посредством субъединицы Gi α) и активацией фосфолипазы C-β (субъединицами Gi βγ) [47, 48, 49, 50]. Сообщалось о двух подтипах NPR-C с разными молекулярными массами: белок 67 кДа и белок 77 кДа, но неизвестно, различна ли их способность сигнализировать и очищать натрийуретические пептиды in vivo [51, 52]. Исследование изолированных клубочковых мембран крыс показало, что NPR-C 67 кДа имеет высокую аффинность к ЦНП и активация этого подтипа снижает синтез циклического аденозинмонофосфата (цАМФ) посредством передачи сигналов Gi, тогда как рецептор 77 кДа имеет очень низкую аффинность к ЦНП и участвует в интернализации лигандов [48, 53].
4. ЦНП регулирует тонус сосудов и артериальное давление
Фармакологические эксперименты на препаратах изолированных кровеносных сосудов показали, что ЦНП является мощным сосудорасширяющим средством для артериальных каналов и резистентных артерий по всему сосудистому дереву [54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66]. В микроциркуляторном русле ЦНП более эффективен, чем ПНП и МНП, что позволяет предположить, что он может играть роль в регуляции периферического сосудистого сопротивления [64, 67]. Многочисленные исследования показали, что инфузия ЦНП снижает системное кровяное давление как у людей, так и у животных [68, 69, 70, 71, 72]. Несмотря на это, физиологическая роль эндогенного ЦНП в сердечно-сосудистой системе не была выяснена до недавнего времени. Ранние исследования мышей с глобальным нокаутом ЦНП были затруднены эффектами делеции ЦНП на развитие кости [10]. У этих животных проявляются скелетные аномалии, карликовость и высокий уровень смертности, поэтому исследования, использующие систему рекомбинации Cre-Lox для генерации животных с ограниченной в клетках делецией ЦНП, были ключом к более полному пониманию функции этого пептида in vivo. Эндотелиально-специфическая делеция ЦНП у мышей приводит к повышению артериального давления и нарушению реакции на эндотелий-зависимые вазодилататоры, что является убедительным доказательством того, что конститутивное высвобождение ЦНП способствует регуляции тонуса сосудов [73, 74, 75]. Патофизиологическая значимость этих экспериментальных данных иллюстрируется обнаружением полиморфизмов в генах ЦНП и фурина, которые связаны с гипертонией у людей [76, 77].
ЦНП-опосредованная вазодилатация проявляется через различные механизмы в зависимости от видов, исследуемых сосудов и/или активированных рецепторов натрийуретических пептидов. В проводящих артериях релаксация, вызванная ЦНП, блокируется двойными антагонистами NPR-B/NPR-A HS-142-1, что свидетельствует об активации NPR-B и последующей выработке цГМФ, которая опосредует дилатационный эффект ЦНП в магистральных сосудах [57, 60, 63]. Однако при резистентности сосудистой системы важность NPR-C в вазореактивности ЦНП увеличивается. И у грызунов, и у людей имеются схожие пути, включающие активацию NPR-C и гиперполяризацию гладкомышечных клеток [66, 71, 78, 79, 80]. В брыжеечной артерии крыс синтез ЦНП включает основной компонент эндотелий-производной гиперполяризации (EDH), вызванной ацетилхолином (ACh), — ответ, который может быть замедлен антагонистами NPR-C, блокадой кальций-чувствительных калиевых каналов малой и средней проводимости (SKCa и IKCa) и G-белок-связанных калиевых каналов внутреннего выпрямления (GIRK) [65]. Предполагалось, что открытие SKCa и IKCa в эндотелиальных клетках способствует синтезу ЦНП, который связывает NPR-C на гладкомышечных клетках, приводя к Gi/0-опосредованной активации GIRK, выбросу калия и гиперполяризации. У людей в артериях и GIRK, и кальций-активируемые K+ каналы высокой проводимости (BKCa каналы) участвовали в ЦНП-спровоцированной вазодилатации [79]. С другой стороны, как показано в исследованиях на крысах, NPR-C также может соединяться с эндотелиальной NO-синтазой, приводя к синтезу окиси азота, хотя этот механизм был описан только в сосудах большего диаметра [81, 82].
Рецептор, который опосредует эндогенные регуляторные эффекты эндотелий-производных на сосудистый тонус in vivo, все еще находится в стадии обсуждения. Мыши с глобальным и специфическим к гладкой мускулатуре нокаутами NPR-B нормотензивны, и функции их сердечно-сосудистой системы в норме, несмотря на вазодилататорный ответ на нарушение экзогенного ЦНП [74, 83]. Предполагалось, что ЦНП обеспечивает функцию эндотелия независимо от NPR-B гладкой мускулатуры и что изменения в продукции вазоконстриктора эндотелина-1 участвуют в повышении артериального давления у животных с нокаутом ecCNP, однако участвующие механизмы не были выяснены. В недавнем исследовании предположили, что передача сигнала NPR-B в перициты более важна, чем гладкая мускулатура сосудов. Последние исследования показывают, что разрушение NPR-B под контролем рецептора к фактору роста, выделенному из тромбоцитов-β у мышей, приводит к гипертензивному фенотипу, указывая, что ЦНП может принимать участие в паракринной связи между эндотелиальными клетками и перицитами для регулирования сосудистой резистентности [75].
Напротив, собранные доказательства свидетельствуют, что NPR-C опосредует большую долю вазодилататорных эффектов ЦНП в сосудистой системе. Мыши с нокаутом NPR-C проявляли нарушение эндотелиальной функции и сниженный гипотензивный ответ на ЦНП in vitro и in vivo [73]. В оригинальной публикации, описывающей глобальную делецию NPR-C у мышей, сообщается о более низком кровяном давлении у самцов этих животных. Однако недавно было показано, что у самок с нокаутом NPR-C повышено артериальное давление и снижена эндотелиальная функция сосудов [73, 84]. Это расхождение может быть связано с половыми различиями в клиренсе и сигнальных функциях NPR-C у мышей, однако данные исследований широких ассоциаций генома человека, связывающих варианты гена NPR-C с гипертонией, не обнаружили несоответствия между полами, что позволяет предположить, что сигнальный путь NPR-C одинаково важен для мужчин и женщин [85]. Пациенты с повышенным артериальным давлением генотипа NPR-C имеют более низкий уровень рецептора иРНК и белка в клетках гладких мышц сосудов, поддерживая теорию, что уменьшенная активация ЦНП посредством NPR-C может лежать в основе этой связи (в противоположность измененному клиренсу) [86]. Еще одно доказательство в пользу роли NPR-C в патогенезе гипертонии было опубликовано в исследовании, посвященном влиянию эндогенного пептида мусклин (также известного как остеокрин). Мусклин является конкурентным лигандом при NPR-C, а инфузия мусклина повышает систолическое артериальное давление in vivo [87]. Уровень экспрессии генов musclin повышен у крыс со спонтанной гипертензией (SHR), и введение антимусклиновых антител снижает артериальное давление у этих животных, что указывает на то, что вмешательство в связывание натрийуретических пептидов с NPR-C с помощью мусклина может способствовать гипертоническому состоянию этих животных [87]. Вопреки этим данным, исследование, показывающее, что инфузия мусклина (остеокрина) снижает кровяное давление у мышей (эффект, который отсутствует у животных с нокаутом NPR-A), предполагает, что повышение уровня циркулирующего ПНП и/или МНП из-за блокады клиренса пептидов NPR-C объясняет этот ответ [88]. Возможно, что мусклин мешает как сигнальной, так и клиренсной функциям NPR-C и играет различную роль в регуляции кровяного давления у здоровых и больных животных. Действительно, вазоконстрикторный и повышающий артериальное давление эффекты мусклина значительно усиливаются при SHR по сравнению с нормотензивной контрольной группой, что указывает на то, что изменение экспрессии рецептора или сигнальной/клиренсной функции NPR-C происходит при гипертонии, которая изменяет реакцию на мусклин в этой модели болезни [87]. Это также подтверждается данными, демонстрирующими, что агонизм NPR-C в SHR ослабляет развитие высокого кровяного давления — эффект, который не наблюдается у контрольной группы крыс линии Вистар-Киото [89].
5. ЦНП влияет на ремоделирование сосудов и участвует в ангиогенезе
ЦНП оказывает непосредственное влияние на митогенез клеток эндотелия и гладких мышц, способствует заживлению ран и восстановлению сосудов, стимулируя рост эндотелия и одновременно препятствуя пролиферации клеток гладких мышц. Эта двойная защитная роль ЦНП была впервые описана на животных моделях трансплантации вен и баллонной ангиопластики, ясно показывая, что лечение ЦНП ускоряет повторную эндотелиализацию и уменьшает вредную неоинтимальную гиперплазию [90, 91, 92]. Подобный ответ на ЦНП наблюдался в сонных артериях, подвергшихся физическому повреждению [93]. Многие из этих исследований сообщают об увеличении продукции цГМФ после лечения ЦНП [91, 93, 94, 95], что указывает на вовлечение NPR-B, однако другие показали, что ЦНП влияет на рост клеток эндотелия и гладких мышц через NPR-C цГМФ-независимым способом. Эти эксперименты продемонстрировали, что про- и антимитогенные эффекты ЦНП опосредованы киназой, регулируемой внеклеточными сигналами, (ERK) 1/2 и могут блокироваться антагонистом NPR-C, M372049, и ингибитором Gi/0, токсином коклюша, несмотря на значительное увеличение продукции цГМФ обоими типами клеток [37, 96]. Активация ERK 1/2 с помощью ЦНП приводит к усилению экспрессии промоторов клеточного цикла (циклин D1) в эндотелиальных клетках и белков — ингибиторов клеточного цикла в клетках гладких мышц (p21 и p27). Это также подтверждается наблюдением, что первичные эндотелиальные клетки микрососудов легких, выделенные у мышей с нокаутом NPR-C, пролиферируют медленнее, чем клетки дикого типа (ДТ), тогда как клетки гладкой мускулатуры аорты, выделенные у животных с нокаутом, растут более быстрыми темпами [37]. Действительно, исследования in vivo показывают, что у мышей, у которых отсутствуют эндотелиальные ЦНП и NPR-C, наблюдается более медленное заживление ран и повышенная гиперплазия интимы после повреждения сосудов, что свидетельствует о том, что высвобождение ЦНП из сосудов является жизненно важным этапом восстановления тканей [97].
Способность ЦНП влиять на рост эндотелиальных клеток заставила исследователей усомниться в роли этого пептида в ангиогенезе. Потенциальный ангиогенный эффект ЦНП был первоначально проверен в классических анализах формирования эндотелиальной трубки in vitro, которые показали, что вызванное ЦНП увеличение образования капиллярной сети имеет величину, сходную с мощным проангиогенным медиатором, VEGF [98]. Кроме того, сообщается, что перенос гена ЦНП непосредственно в ишемическую мышцу улучшает восстановление кровотока и увеличивает плотность капилляров после лигирования и иссечения бедренной артерии у мышей [98]. Исследования сходятся во мнении, что эти ангиогенные ответы зависят от активации ERK 1/2, однако опубликованы противоположные данные, касающиеся вовлеченного рецептора.
Всестороннее исследование, проведенное на животных с нокаутом, предполагает, что эндогенные эффекты эндотелиального ЦНП на ангиогенез опосредуются NPR-C, в то время как при фармакологическом вводе ЦНП участвуют оба рецептора. Например, было показано, что разветвленный ангиогенез в эндотелиальных клетках пупочной вены человека (HUVEC) блокируется ингибитором цГМФ-зависимой протеинкиназы, что предполагает участие передачи сигналов NPR-B [98]. Напротив, образование трубок в легочных эндотелиальных клетках мышей ингибируется антагонизмом токсина коклюша и NPR-C [97]. Эксперименты, проведенные на трансгенных мышах, показывают, что образование базальных эндотелиальных канальцев, отрастание аорты de novo и восстановление кровотока после ишемии задних конечностей снижаются в тканях или у животных с нокаутом ecCNP и NPR-C, в то время как нокаут NPR-B показывает подобный ангиогенный потенциал для мышей ДТ [97]. Кроме того, то же самое исследование сообщает, что у пациентов с критической ишемией конечностей понижен уровень ЦНП и NPR-C в биоптатах икроножной мышцы, предполагая, что уменьшенная передача сигналов через этот путь может способствовать недостаточному ангиогенному ответу на гипоксию, связанную с заболеванием периферических артерий.
Хотя большинство исследований указывают на то, что ЦНП способствует ангиогенезу, имеются также доказательства того, что агонист NPR-C cANF4-23 снижает неоваскуляризацию в губчатых имплантатах мышей [99]. Это открытие сопровождалось снижением уровня ФРЭС, что подтверждается другими исследованиями, показывающими, что ЦНП и cANF4-23 ингибируют экспрессию и передачу сигналов ФРЭС в гладких мышцах сосудов и эндотелиальных клетках [100]. В противоположность этому было показано, что ФРЭС также снижают секрецию ЦНП из культивируемых эндотелиальных клеток [33], предполагая, что между двумя медиаторами сосудов может быть взаимная связь, однако неизвестно, влияет ли взаимодействие двух факторов на ангиогенез.
6. ЦНП ингибирует воспаление и замедляет развитие атеросклероза
Первое указание на то, что ЦНП может влиять на воспалительный ответ на инфекцию и заболевание, исходит из исследований, показывающих, что цитокины ИЛ1α, ИЛ1β и ФНО-α стимулируют высвобождение ЦНП из эндотелиальных клеток [26, 27]. Наиболее эффективным из этих цитокинов (при индукции секреции ЦНП) является ФНО-α, который выделяется макрофагами во время острой фазы воспаления. Другим сильным стимулом для запуска высвобождения ЦНП из эндотелия является бактериальный эндотоксин липополисахарид (ЛПС) [26, 29]. Действительно, уровень ЦНП заметно повышается у пациентов с септическим шоком, в нескольких исследованиях сообщалось о 5–10-кратном увеличении концентрации ЦНП в плазме [31, 101, 102, 103]. Кроме того, концентрация NT-proCNP в плазме тесно связана с вызванной воспалением дисфункцией органов и является предиктором неблагоприятного исхода [101, 104]. Также было высказано предположение, что измерение NT-proCNP в ранней фазе септического шока может помочь предсказать возникновение сепсис-индуцированной энцефалопатии [103]. Вместе эти данные свидетельствуют о том, что острое высвобождение ЦНП может модулировать прогрессирование сепсиса и других воспалительных заболеваний.
Активация эндотелия медиаторами воспаления является ключевым событием в патогенезе сепсиса и сердечно-сосудистых заболеваний, таких как атеросклероз. Изменения в экспрессии молекул клеточной адгезии, таких как интегрины и селектины, облегчают рекрутирование и адгезию лейкоцитов во время начальной фазы иммунного ответа [105, 106]. Было показано, что ЦНП подавляет активацию эндотелия, вызванную рядом воспалительных стимулов как in vitro, так и in vivo. ИЛ-1β и вызванное гистамином свертывание лейкоцитов в посткапиллярных венулах мышей ингибируются ЦНП и cANF4-23 посредством подавления экспрессии Р-селектина [107]. Инфузия ЦНП с помощью мини-насоса ингибирует стимулированную ЛПС инфильтрацию лейкоцитов в легкие, ослабляет экспрессию гена Е-селектина и снижает уровень медиаторов воспаления ФНО-α, макрофагального воспалительного белка-2, моноцитарного хемотаксического протеина-1 (МХП-1) и интерлейкина-6 (ИЛ-6) [108]. Кроме того, ЦНП ингибирует повышение экспрессии молекулы межклеточной адгезии-1, молекулы адгезии сосудистых клеток-1, E-селектина и P-селектина в HUVEC, стимулированных ЛПС [109]. Механизм, с помощью которого ЦНП ослабляет этот ответ, по крайней мере in vitro, заключается в ингибировании провоспалительных путей передачи сигналов NF-κB и p38 и активации пути выживания PI3K/Akt.
ЦНП, происходящий из эндотелия, также, по-видимому, поддерживает в состоянии покоя противовоспалительное влияние на стенку сосудов, так как у мышей с нокаутом ecCNP наблюдается большая подвижность лейкоцитов на исходном уровне до стимуляции активатором воспаления [73]. Кроме того, у этих животных значительно усиливается реакция на перитонит, вызванный ЛПС и ФНО-α. Антилейкоцитарные эффекты эндогенного пептида могут включать механизмы, сходные с теми, которые индуцируются экзогенным применением пептида, поскольку более высокая экспрессия P-селектина в сосудах наблюдается у мышей, у которых отсутствует эндотелиальный ЦНП. Учитывая, что подобное увеличение рекрутирования лейкоцитов наблюдалось у мышей с нокаутом NPR-C после лечения ЛПС, предполагается, что подавление экспрессии молекул клеточной адгезии, вызванное NPR-C, может лежать в основе иммунопонижающего эффекта ЦНП [73]. Этот аспект биологии ЦНП, несомненно, важен в контексте атеросклероза, поскольку генетическая абляция ЦНП приводит к увеличению развития атеросклеротических поражений, большей инфильтрации макрофагов и образованию аневризм аорты и брюшной полости при двойном нокауте ecCNP/ApoE у мышей [73]. Действительно, это открытие согласуется с предыдущей работой, демонстрирующей снижение иммунореактивности ЦНП в пораженных коронарных артериях человека и обратную связь между экспрессией ЦНП и тяжестью поражения [110]. Более того, ЦНП ингибирует пролиферативное и промиграционное воздействие окисленных ЛПНП на клетки гладких мышц, которые могут влиять на рост и стабильность атеросклеротических бляшек [111]. Спонтанное развитие аневризм у мышей с нокаутом ApoE встречается редко, однако мыши с двойным нокаутом ecCNP/ApoE более восприимчивы к этому явлению, и это позволяет предположить, что ЦНП может способствовать поддержанию структурной целостности стенки сосуда [73]. Интересно, что аневризмы наблюдались только у самцов мышей с двойным нокаутом; это наблюдение согласуется с состоянием человека, которое преимущественно влияет на пожилых мужчин [112]. Возможно, что ЦНП регулирует экспрессию и высвобождение матриксных металлопротеиназ (ММР), которые участвуют в развитии аневризм. В подтверждение этого тезиса приводятся данные, показывающие, что ЦНП модулирует экспрессию ММР-2 и ММР-9 в хондроцитах и почках [113, 114].
Существует ряд других воспалительных заболеваний, в которых ЦНП оказался полезным на экспериментальных моделях. ЦНП снижает количество макрофагов, нейтрофилов и лимфоцитов, накапливающихся в легких у мышей, подвергшихся воздействию блеомицина, в модели легочной гипертонии [115]. На модели геморрагического шока у крыс ЦНП снижает маркеры окислительного стресса и экспрессию ФНО-α, ИЛ-6 и ИЛ-1β в почках, что позволяет предположить, что он может улучшить симптомы острой почечной недостаточности, связанные с этим условием [116]. Кроме того, исследования, проведенные с использованием трансгенных мышей со сверхэкспрессией ЦНП в эндотелиальных клетках, позволяют предположить, что ЦНП регулирует воспаление, связанное с ожирением. Сверхэкспрессия эндотелиального ЦНП улучшает толерантность к глюкозе, снижает резистентность к инсулину и ингибирует инфильтрацию жировых макрофагов у мышей, которых кормят рационом с высоким содержанием жиров [117]. Используя тех же животных, эти авторы демонстрируют, что ЦНП ингибирует экспрессию маркеров воспаления ИЛ-6, МСР-1 и CD68 в печени мышей, получавших рацион с высоким содержанием жиров, в модели неалкогольного стеатогепатита [118]. Таким образом, противовоспалительные преимущества эндотелиального ЦНП не ограничиваются сердечно-сосудистыми заболеваниями.
7. ЦНП — новейший регулятор структур и функций сердца
7.1. ЦНП и СН
В течение многих лет роль ЦНП в сердце в значительной степени игнорировалась, так как большинство исследований были посвящены гормонам сердца ПНП и МНП. Кроме того, экспрессия ЦНП в кардиомиоцитах значительно ниже, чем экспрессия ПНП и МНП, что позволяет предположить, что в базовых условиях он не играет ключевой роли в регуляции сердечной функции [14, 119]. Однако было немало сообщений и о том, что сердечная экспрессия и уровень ЦНП в плазме повышаются у пациентов с СН [13, 30, 120, 121, 122, 123]. Повышенный уровень ЦНП в крови связан с фенотипом высокого риска у пациентов с сопутствующими сердечно-сосудистыми заболеваниями и дисфункцией левого желудочка [17]. Кроме того, уровень NT-proCNP в плазме крови у пациентов с сердечной недостаточностью коррелирует с тяжестью заболевания и является сильным предиктором смертности от всех причин и госпитализации у пациентов с сердечной недостаточностью и сохраненной фракцией выброса левого желудочка (ФВЛЖ) [124]. Однако эти исследования не говорят нам, вырабатывается ли ЦНП сердцем или другими органами во время сердечной недостаточности. Ключевой эксперимент, в котором сравнивались уровни ЦНП в плазме коронарного синуса и корня аорты при сердечной недостаточности, обнаружил, что концентрация ЦНП значительно выше в коронарном кровотоке, чем в системном, что является первым прямым доказательством того, что ЦНП при СН высвобождается сердцем [125].
В здоровом сердце уровень ЦНП выше в предсердиях, чем в желудочках, но исследования на карликовых домашних свиньях показали, что кардиостимуляция вызывает 15-кратное увеличение экспрессии ЦНП в желудочках наряду с повышенным уровнем белка ЦНП, демонстрируя, что острый сердечный стресс вызывает немедленную активацию гена и увеличение высвобождения ЦНП [13]. По-видимому, таким же образом происходит переключение между передачей сигналов натрийуретического пептида в разрушающемся желудочке. В условиях симуляции гемодинамики сердца ПНП индуцирует повышение активности гуанилатциклазы в сравнении с ЦНП, однако при давлении, обусловленном перегрузкой из-за СН, ЦНП вызывает удвоенный синтез цГМФ по сравнению с ПНП. Это может быть связано с уменьшением экспрессии NPR-A, и предполагается, что передача сигналов ЦНП через NPR-B может быть более важной во время СН [126]. Однако в других исследованиях сообщалось, что экспрессия NPR-B в желудочках при сердечной недостаточности снижается [13, 127], тогда как повышение NPR-C является наиболее выраженным из трех рецепторов натрийуретических пептидов при терминальной стадии заболевания [128].
7.2. ЦНП непосредственно модулирует сократимость, фиброз и гипертрофию кардиомиоцитов
Было показано, что ЦНП оказывает прямое влияние на сократимость сердца, хотя сообщалось как о положительных, так и об отрицательных инотропных реакциях. Например, ЦНП увеличивает силу сокращения миоцитов в изолированных препаратах предсердий и желудочков у собак [129, 130], тогда как в препаратах сердечной мышцы крысы наблюдались положительный лузитропный и отрицательный инотропный эффекты [131, 132]. Ряд исследований показали, что ЦНП индуцирует фосфорилирование регулятора кальциевого насоса саркоплазматического ретикулума 2 (SERCA2), фосфоламбана (ФЛБ) и тропонина I сердца (cTnI), регуляторного белка, который контролирует опосредованное кальцием взаимодействие между актином и миозином [131, 132, 133, 134]. Положительные лузитропные и инотропные эффекты ЦНП, обнаруженные у крысы с сердечной недостаточностью, связаны с фосфорилированием обоих этих регуляторных белков в дополнение к увеличению кальциевой нагрузки саркоплазматического ретикулума (СР) [132]. Дальнейшие исследования показали, что этот отрицательный инотропный эффект ЦНП чувствителен к ингибированию протеинкиназ (например, NPR-B-зависимых), ингибированию SERCA2 и отсутствует у мышей с нокаутом SERCA2 [135]. Предполагается, что увеличение активации SERCA2 посредством фосфорилирования ФЛБ с помощью ЦНП приводит к тому, что более высокая доля цитозольного Ca2 + возвращается обратно в СР, что снижает активацию Ca2 + миофиламентами, что приводит к отрицательному инотропному эффекту. Напротив, другие исследования продемонстрировали, что ЦНП индуцирует положительный инотропный ответ в сердце и что фосфорилирование ФЛБ приводит к большему поглощению Ca2 + в СР, создавая больший пул Ca2 +, доступный для сокращения [134].
Также в ряде исследований были описаны двухфазные ответы на ЦНП, где за первоначальным, преходящим положительным инотропным ответом следует медленно развивающееся снижение сократительной способности [133, 135, 136]. Природа этого двухфазного ответа была исследована, чтобы выяснить, были ли два противоположных эффекта вызваны активацией различных рецепторов. Однако оказалось, что обе фазы ответа опосредованы NPR-B как аналогом цГМФ, имитирующим и немедленную, и задержанную фазу сократительного ответа. Агонист NPR-C cANF4-23 не влиял на сократительную способность, и никаких изменений сердечного цАМФ не наблюдалось [133]. Причину такой неоднозначности в сократительных реакциях, вызванных ЦНП, можно объяснить перекрестным взаимодействием между сигнальными системами цГМФ и цАМФ в сердце. Было показано, что отрицательный инотропный ответ на ЦНП является доминирующим эффектом, когда передача сигналов цАМФ снижается (например, во время блокады бета-адренорецепторов), в то время как эффект полностью теряется в присутствии максимальной стимуляции бета-адренорецепторов изопреналином [135]. В сердцах как с нарушениями, так и без них ЦНП увеличивает положительный инотропный эффект стимуляции бета-адренорецептором благодаря ингибированию цГМФ фосфодиэстеразы 3 (ФДЭ 3), фермента, ответственного за расщепление цАМФ, образующегося при стимуляции бета-адреноцептором [137, 138]. Таким образом, сократительный эффект ЦНП, наблюдаемый в различных экспериментальных моделях, вероятно, будет зависеть от внутриклеточного уровня цАМФ и стимуляции бета-адренорецептором. Передача сигналов NPR-C может также влиять на сократительную способность сердца, хотя это непосредственно не изучалось; стимуляция рецепторов, вероятно, приведет к снижению цАМФ за счет ингибирования аденилатциклазы [50, 139]. Также было показано, что cANF4-23 ингибирует кальциевые каналы L-типа в предсердных миоцитах [140], если подобный путь присутствует в желудочковых миоцитах. Активация NPR-C может индуцировать отрицательный инотропный ответ.
Ремоделирование сердца во время сердечной недостаточности характеризуется пролиферацией фибробластов, трансформацией миофибробластов и отложением коллагена, что приводит к развитию фиброза сердца. Это приводит к дисфункции желудочков и повышению жесткости миокарда, что имеет существенные последствия для функции сердца [141]. ЦНП оказывает антифиброзный эффект на сердце и значительно более эффективен в снижении роста фибробластов и продукции внеклеточного матрикса, чем другие натрийуретические пептиды [15]. ЦНП экспрессируется и высвобождается фибробластами сердца в ответ на основной фактор роста фибробластов (FGF2), трансформирующий ростовой фактор бета (TGFβ) и эндотелин-1. Он вызывает большее увеличение цГМФ и большее подавление синтеза коллагена, чем ПНП и МНП [15]. Кроме того, дифференцировка фибробластов, миграция и продуцирование патологических медиаторов, MCP-1 и PAI-1, ослабляются ЦНП in vitro [128, 142, 143].
В дополнение к ослаблению фиброза ЦНП также оказывает антигипертрофический эффект на сердце. Эксперименты, проведенные в изолированных кардиомиоцитах крысы, показали, что ЦНП ингибирует базальную и индуцированную эндотелином-1 экспрессию белка, секрецию ПНП и экспрессию гипертрофических генов GATA4 и MEF2. Эндотелин-1-индуцированное повышение активности кальций/кальмодулин-зависимой киназы и ERK также ослабляется ЦНП. Эти эффекты повторяются с использованием аналога цГМФ, что позволяет предположить, что механизм включает активацию NPR-B [144]. Точно так же было показано, что ЦНП уменьшает вызванное ангиотензином II увеличение размера кардиомиоцитов у мышей, что указывает на то, что ЦНП непосредственно подавляет гипертрофические сигнальные каскады [145].
8. Эндогенный ЦНП обладает кардиопротективным действием у экспериментальных животных при сердечной недостаточности
Генерирование тканеспецифических нокаутов позволило лучше понять типы клеток, ответственных за высвобождение ЦНП в сердце, и то, как каждый источник ЦНП влияет на структуру и функцию сердца при заболевании. В начале исследования у мышей, у которых отсутствовал кардиомиоцит (нокаут cmCNP) и полученный из фибробластов ЦНП (нокаут fbCNP), не наблюдалось явных изменений сократимости, структуры или фиброза сердца, что подтверждает предыдущие предположения, что ЦНП играет минимальную роль в здоровом сердце [145]. Однако после аортального связывания (СН, вызванной перегрузкой давлением) у мышей с нокаутом cmCNP и fbCNP наблюдались большее снижение фракции выброса, повышенная дилатация желудочков, большая гипертрофия сердца (только для нокаута cmCNP) и большее отложение коллагена по сравнению с контрольной группой из того же помета. Напротив, ЦНП эндотелиального происхождения не обладает кардиопротективными свойствами, по крайней мере, в этой модели. Таким образом, эндогенный ЦНП, выделенный кардиомиоцитами и фибробластами, снижает патологические изменения, которые возникают при сердечной недостаточности. Сопоставимая сердечная дисфункция, гипертрофия и фиброз наблюдаются у животных с нокаутом NPR-C, подвергнутых аортальному связыванию, что позволяет предположить, что NPR-C опосредует эффекты ЦНП в миоцитах и фибробластах. Действительно, инфузия ЦНП с помощью мини-насоса устраняет сердечную дисфункцию и фиброз при сердечной недостаточности у животных ДТ, но не у мышей с нокаутом NPR-C. Животные с нокаутом cmCNP чувствовали себя хуже, чем животные ДТ, при стимуляции изопреналином (то есть в модели симпатической гиперактивации СН), в то время как потеря NPR-B не оказывала неблагоприятного влияния на гипертрофический или фиброзный ответ [145]. Это контрастирует с предыдущими исследованиями, в которых показано, что у трансгенных крыс, экспрессирующих доминантную отрицательную форму NPR-B, в начале исследования наблюдалась гипертрофия сердца [146]. Однако эти мутанты не проявляют фиброза сердца и изменений сократительной функции до или после хронической перегрузки объемом, поэтому, возможно, в более отдаленной перспективе NPR-B играет доминирующую роль в регуляции компенсаторной гипертрофии, тогда как NPR-C регулирует дезадаптивную гипертрофию и антифиброзные эффекты ЦНП. В подтверждение этого приводятся данные, показывающие, что специфичная для кардиомиоцитов делеция NPR-B не изменяет у мышей ответ на СН, вызванную перегрузкой давлением [147], указывая на то, что либо передача сигналов эндогенным NPR-B не является жизненно важной при патологическом ремоделировании сердца, либо другая система компенсирует потерю NPR-B. Однако мыши с гетерозиготами NPR-B подвержены аортальному стенозу [148], что позволяет предположить, что важность этого подтипа рецепторов натрийуретических пептидов может находиться за пределами кардиомиоцитов. Это не означает, что NPR-B не может быть нацелен на фармакологическое воздействие, поскольку недавние исследования показывают, что новые дизайнерские пептиды, которые связываются с NPR-B, могут снижать пролиферацию фибробластов и секрецию коллагена in vitro и in vivo [128, 149, 150]. Эта роль эндогенной передачи сигналов NPR-C в регуляции фиброза подтверждается другими исследованиями, в которых наблюдались более выраженная сердечная дисфункция, отложение коллагена в предсердии и более высокий уровень TGFβ и TIMP1 у мышей с нокаутом NPR-C, подвергнутых индуцированной ангиотензином II перегрузке давлением [151, 152]. Кроме того, у человека был обнаружен функциональный генетический вариант NPR-C, связанный с диастолической дисфункцией. Этот однонуклеотидный полиморфизм (SNP; снип) не влияет на экспрессию белка NPR-C или уровень циркулирующих в плазме натрийуретических пептидов, что свидетельствует о влиянии нисходящей передачи сигналов. Постулируется, что этот снип приводит к дисфункции каталитического домена NPR-C и что аберрантная передача сигналов в фибробластах способствует фиброзу сердца и нарушению диастолической функции [153]. Точный механизм, с помощью которого передача сигналов NPR-C ингибирует пролиферацию фибробластов / синтез коллагена, неизвестен, но было показано, что ЦНП- и cANF4-23-опосредованная стимуляция NPR-C может активировать неселективный катионный ток, который частично переносится транзиторным рецепторным потенциалом C-каналов, и авторы предварительно предполагают, что это может повлиять на секреторное состояние клетки [154].
Тем не менее, похоже, что NPR-C может играть двоякую роль при СН, поскольку другие исследования показывают, что удаление или блокада клиренсной функции NPR-C полезна при сердечных заболеваниях. Мыши с нокаутом NPR-C, скрещенные с животными, у которых самопроизвольно развивается фиброз предсердий (сверхэкспрессия ТФР-β1), показывают значительно меньший фиброз и отложение коллагена, чем в контрольной группе. Кроме того, нокдаун NPR-C в культивируемых фибробластах, стимулированных ТФР-β1, приводит к снижению экспрессии маркеров фиброза pSmad и коллагена. Эти эффекты отменяются нокдауном NPR-A, что указывает на то, что в основе этого эффекта лежат уменьшенный клиренс ПНП и последующее увеличение сигнала ПНП [88, 155]. Кроме того, трансгенные мыши со сверхэкспрессией остеокрина (OSTN-Tg) имеют улучшенный прогноз и более высокие показатели выживаемости после инфаркта миокарда (ИМ) [88]. Уровни ПНП и ЦНП у мышей OSTN-Tg повышены, поэтому кардиопротективный эффект остеокрина в этой модели объясняется ингибированием NPR-C-опосредованного клиренса натрийуретического пептида. Очевидно, что требуется дополнительное исследование, чтобы понять больше о переключении между передачей сигналов NPR-C и клиренсом, а также о том, изменяется ли баланс при различных патологических состояниях, способствующих заболеваниям сердца (например, при перегрузке давлением или ИМ).
9. Влияние ЦНП на вазодилатацию коронарных сосудов
Первые исследования сосудистого действия ЦНП в сердце были выполнены на коронарных артериях свиньи. Эти ранние эксперименты представили первые доказательства того, что ЦНП расслабляет коронарные сосуды посредством гиперполяризации. Ответы ЦНП могут быть ингибированы блокаторами калиевых каналов харибдотоксином и глибенкламидом [55]. Те же авторы также обнаружили, что HS-142-1 ингибирует уменьшение коронарного кровотока, вызванного ЦНП у собак, что позволяет предположить наличие компонента NPR-B /цГМФ в расслаблении ЦНП в сердце [156]. Напротив, исследования на перфузированных сердцах грызунов показали, что ЦНП и cANF4-23 индуцируют снижение давления коронарной перфузии посредством активации NPR-C и открытия каналов GIRK в механизме, аналогичном брыжеечной сосудистой сети [157]. Кроме того, увеличение пептида ЦНП может быть измерено в коронарном стоке после стимуляции с помощью ACh, что позволяет предположить, что ЦНП высвобождается как эндотелиальный фактор гиперполяризации (EDHF) в коронарных сосудах. Интересно отметить, что у мышей с нокаутом ecCNP и NPR-C реакция на эндотелий-зависимые вазодилататоры и обусловленную потоком дилатацию (реакция на напряжение сдвига), уменьшена [145]. Таким образом, ЦНП может синтезироваться при кардиострессе в ответ на изменение кровотока. Интересно, что уровень NT-proCNP предсказывает смертность и реадмиссию сердечной недостаточности у пациентов с нестабильной стенокардией, состоянием, характеризующимся высоким сдвигом клеток эндотелия стенки сосудов и изменением кровотока в сердечной мышце [158].
10. Роль ЦНП при ишемических, реперфузионных повреждениях и ИМ
Микрососудистая обструкция является патологическим признаком острого ИМ и часто возникает, несмотря на восстановление кровотока в ишемической ткани после коронарных вмешательств. Двумя основными факторами, способствующими этому, являются нарушение вазодилатации и закупорка нейтрофилов, которые приводят к механической обструкции сосудов и выбросу окислителей и провоспалительных медиаторов [159]. Учитывая способность ЦНП к расширению коронарных сосудов и его высвобождение в ответ на напряжение сдвига, предполагается, что этот вазоактивный медиатор может улучшать коронарный кровоток и уменьшать повреждение тканей, ингибируя накопление воспалительных клеток и закупорку коронарных сосудов. Данные исследований на людях показывают, что экспрессия гена ЦНП повышена при ишемии на фоне сердечной недостаточности, а это позволяет предположить, что он может играть роль в физиологическом защитном ответе во время ИМ [160]. Острые эффекты ЦНП при реперфузионном повреждении миокарда (РПМ) были изучены на изолированных сердцах — экспериментальной системе, лишенной циркулирующих воспалительных клеток. В этой ситуации инфузия ЦНП ослабляет повышение коронарного перфузионного давления во время реперфузии, уменьшает размер инфаркта и улучшает сократимость левого желудочка [157]. Защитный эффект ЦНП в этой модели отменяется антагонистом NPR-C M372049 и повторяется путем инфузии cANF4-23. Кроме того, больший размер инфаркта и худшее функциональное восстановление сердца наблюдались у животных с нокаутом NPR-C, подвергнутых тому же экспериментальному протоколу, что указывает на то, что активация NPR-C с помощью ЦНП полезна во время РПМ [145]. Однако следует отметить, что коронарный вазодилататорный ответ на ЦНП полностью не отменен у мышей с нокаутом NPR-C, что позволяет предположить, что активация NPR-B может отчасти опосредовать некоторые вазорелаксантные эффекты ЦНП в сердце. Также вероятно, что NPR-B-опосредованное увеличение передачи сигналов цГМФ/ПКG вносит вклад в кардиопротективное действие ЦНП после ишемии [161, 162].
Пациенты с уже существующей микрососудистой дисфункцией более чувствительны к повреждению миокарда после чрескожного коронарного вмешательства, поэтому можно ожидать, что потеря ЦНП эндотелиального происхождения сделает сердце более чувствительным к повреждениям после РПМ. Однако генетическая абляция ЦНП из кардиомиоцитов приводит к худшему восстановлению после РПМ, в то время как удаление эндотелиального ЦНП не ухудшает фенотип [145]. Возможно, полученный из кардиомиоцитов ЦНП оказывает прямое влияние на сократимость после РПМ в изолированном сердце, однако этот механизм не был исследован. Было высказано предположение, что соединение NPR-C с АТФ-чувствительными калиевыми каналами (KATP) может оказывать благотворное влияние на ЦНП при РПМ, поскольку ЦНП может вызывать открытие KATP, которое, как известно, снижает сердечный и метаболический стресс во время ишемического повреждения [162].
Эффект сверхэкспрессии и нокдауна ЦНП также изучался на хронических моделях ИМ с целью понимания его роли в опосредовании воспаления и ремоделирования сердца в долгосрочной перспективе. Последние исследования с использованием глушения генов ЦНП у крыс демонстрируют, что прекращение эндогенной продукции ЦНП кардиомиоцитами приводит к увеличению размера инфаркта после РПМ, большему фиброзу сердца и увеличению воспалительных маркеров ФНО-α и ИЛ-6 [163]. Напротив, другие сообщали, что сверхэкспрессия ЦНП кардиомиоцитами не влияет на размер инфаркта, но уменьшает гипертрофию сердца и количество мононуклеарных инфильтратов, наблюдаемых в миокарде [164]. Аналогичным образом хроническая инфузия ЦНП в модели перманентной перевязки коронарной артерии уменьшает расширение левого желудочка, отложение коллагена и увеличивает сердечный выброс [165]. В дополнение к этому сообщалось об увеличении экспрессии ЦНП в пограничной зоне инфаркта в сердцах свиней, где, как полагают, он может способствовать восстановлению миокарда за счет увеличения плотности капилляров (хорошо сочетаясь с проангиогенным действием пептида) [166]. Вместе эти данные позволяют предположить, что ЦНП может быть терапевтической мишенью при инфаркте миокарда, поскольку он эффективен для уменьшения размера инфаркта, воспаления сердца и неблагоприятного ремоделирования желудочков, происходящего после инфаркта миокарда, что может замедлить прогрессирование сердечной недостаточности.
11. Роль ЦНП в регуляции сердечных сокращений и электрической проводимости синоатриального узла (САУ)
ЦНП влияет на частоту сердечных сокращений с помощью двух механизмов: изменения ионных токов в САУ и модуляции симпатической передачи. Сообщалось, что он вызывает как положительные, так и отрицательные хронотропные эффекты в сердце посредством модуляции кальциевых каналов L-типа в САУ [129, 140, 167, 168]. При базальных условиях или слабой стимуляции агонистом бета-адренорецептора ЦНП вызывает увеличение частоты сердечных сокращений и электрической проводимости через САУ. Этот ответ ослабляется ингибитором PDE3 милриноном, что позволяет предположить, что механизм включает опосредованное NPR-B/цГМФ ингибирование PDE3 и увеличение цАМФ, сходное с положительными инотропными эффектами ЦНП, наблюдаемыми в миоцитах [169]. Напротив, когда сердечный ритм повышен, ЦНП вызывает отрицательный хронотропный эффект и уменьшает скорость проводимости в пределах САУ. NPR-C, как полагают, опосредует этот ответ, так как cANF4-23 снижает хронотропный эффект изопреналина, но не оказывает влияния в базальных условиях [170]. Важность NPR-C, проводящих сигнал в САУ, показана в исследовании на мышах с нокаутированным геном. Делеция NPR-C приводит к дисфункции САУ, пролонгации времени восстановления САУ и повышенной восприимчивости к фибрилляции предсердий [171]. У этих мышей в начале исследования также наблюдался фиброз предсердий, который в дальнейшем участвовал в нарушении проводимости САУ. Это усугубляется на моделях сердечной недостаточности, хотя лечение cANF4-23 снижает число аритмий и изменяет электрофизиологию [151].
Второй механизм, посредством которого ЦНП регулирует сердечный ритм, — ингибирование сердечной симпатической нейротрансмиссии. Лечение ЦНП снижает тахикардию во время стимуляции правого звездчатого узла у крыс и ингибирует синтез норэпинефрина из изолированного предсердия [172]. Доказательства наличия эндогенного пути ЦНП/ NPR-B, регулирующего симпатическую активность, продемонстрированы у трансгенных крыс с нейронспецифической гиперэкспрессией доминантно-отрицательной формы NPR-B. Эти животные демонстрируют повышенную частоту сердечных сокращений, большую вариабельность сердечного ритма, а анализ частотной области выявляет более высокое соотношение низких (НЧ) и высоких (ВЧ) частот, свидетельствующее о сдвиге в сторону возбуждения симпатической нервной системы [172]. Аналогичные результаты также были у мышей без NPR-C. Эти животные демонстрировали снижение циркадных изменений сердечного ритма, потерю динамических изменений из-за перемен в активности и более высокое соотношение НЧ/ВЧ, что свидетельствует об усилении симпатической активности [173]. Тем не менее, независимо от рецептора, который опосредует этот симпато-ингибирующий эффект ЦНП, способность подавлять симпатическую активность в сердце может быть важным защитным механизмом при заболеваниях, характеризующихся вегетативной дисрегуляцией.
12. Текущие и будущие терапевтические подходы
За последнее десятилетие было получено огромное количество данных, подтверждающих широкую гомеостатическую роль ЦНП в поддержании сосудистой и сердечной функции. Более того, последние исследования с использованием трансгенных моделей позволили глубже понять ключевые физиологические функции пептида в сердечно-сосудистой системе. Терапевтические средства, разработанные для связывания с родственными рецепторами ЦНП, могут найти широкое клиническое применение при таких заболеваниях, как гипертония, атеросклероз, рестеноз, критическая ишемия конечностей, заболевания периферических артерий, реперфузионное повреждение миокарда, инфаркт миокарда, сердечная недостаточность и нарушения ритма сердца. В настоящее время существует два метода лечения натрийуретической пептидной системы, которые были проверены в клинических испытаниях: ингибиторы НЭП (подавляют расщепление натрийуретических пептидов) и цендеритид (химерный агонист NPR-A/NPR-B). Ингибиторы НЭП, используемые в сочетании с ингибиторами ангиотензинпревращающего фермента (иАПФ), были опробованы на пациентах с гипертонией и СН. Первоначальные результаты казались многообещающими, однако у пациентов, получавших двойное лечение, было больше случаев ангионевротического отека по сравнению с теми, кто получал лечение одним ингибитором АПФ, поэтому исследование было остановлено [174]. Однако ингибитор НЭП сакубитрил, вводимый в сочетании с блокатором рецепторов ангиотензина (БРА) валсартаном (LCZ696), использовался с большим успехом. Этот препарат, по-видимому, более эффективен для снижения артериального давления, чем доступные в настоящее время иАПФ и БРА с аналогичным профилем безопасности и переносимости [175, 176]. Кроме того, LCZ696 показал впечатляющие результаты в исследовании PARADIGM-HF для лечения пациентов с СН и сниженной фракцией выброса. Результаты исследования показали значительно большие преимущества этой комбинированной терапии по сравнению со стандартной терапией (только лечение иАПФ) [177]. Сообщалось о значительном снижении смертности от сердечно-сосудистых заболеваний и госпитализаций, связанных с сердечной недостаточностью (20%), и исследование было прекращено досрочно из-за подавляющего эффекта в отношении первичной конечной точки. LCZ696 в настоящее время лицензируется как Entresto и используется в клинических испытаниях (PARAGON-HF) для пациентов с сердечной недостаточностью с сохраненной фракцией выброса (СНсФВ) [178]. Учитывая, что артериальная гипертензия является распространенным явлением в этой группе пациентов, а заболевание связано со снижением доступности цГМФ [179], повышение уровня натрийуретика может быть полезным. Теоретически ингибирование НЭП может повышать уровень всех натрийуретических пептидов и усиливать их полезные эффекты, однако следует отметить, что НЭП также расщепляет другие вазоактивные пептиды, такие как брадикинин, поэтому такое лечение может показать результат вплоть до снижения деградации натрийуретического пептида. Хотя у пациентов, получавших LCZ696, был зарегистрирован более высокий уровень цГМФ и МНП, что указывает на то, что повышенный уровень натрийуретического пептида, вероятно, способствует защитному эффекту от ингибирования НЭП. Более того, ЦНП более восприимчив, чем ПНП и МНП, к деградации НЭП, поэтому он может вносить важный вклад в эффективность LCZ696 [18].
Цендеритид (CD-NP) — это новый дизайнерский натрийуретический пептид, который состоит из ЦНП и C-концевого хвоста натрийуретического пептида Dendroaspis (выделенного из яда змеи зеленой мамбы). Это двойной агонист NPR-A/ NPR-B, который был спроектирован для использования антифиброзных, антипролиферативных и сосудовосстанавливающих возможностей ЦНП и полезных почечных эффектов активации NPR-A [180]. Ключевым преимуществом этого препарата является тот факт, что он более устойчив к деградации НЭП, чем нативные натрийуретические пептиды [181]. Первой клинической целью CD-NP является СН, так как он доказал свою эффективность на модели ранней стадии заболевания у крыс, при которой уменьшил фиброз и диастолическую дисфункцию [149]. Кроме того, CD-NP вызывает большее снижение выработки коллагена фибробластами сердца человека, чем только МНП или ЦНП [128, 182]. Было высказано предположение, что нацеливание на NPR-B в сердце может быть потенциально вредным, если передача сигналов NPR-B/цГМФ увеличивает адренергическую передачу (посредством ингибирования PDE3) in vivo, как это было показано in vitro [138]. Действительно, клинические исследования ингибитора PDE3 милринона демонстрируют повышение смертности, количества внезапных смертей и аритмии у пациентов с СН, поэтому необходимо тщательно изучить влияние агонистов NPR-B на активность PDE3. Однако первое исследование на человеке показало, что цендеритид безопасен, хорошо переносится и вызывает повышение уровня цГМФ в плазме и моче у пациентов с СН, что позволяет предположить, что он может оказаться перспективным терапевтическим средством в будущем [182]. Совсем недавно Burnett et al. разработали другие дизайнерские натрийуретические пептиды, такие как C53, активатор NPR-B пролонгированного действия, устойчивый к НЭП и имеющий ограниченное взаимодействие с NPR-C, который вызывает сильные антифиброзные эффекты в фибробластах почек и сердца [150]. Новейшее соединение в этой разработке лекарств, CRRL269, негипотензивный активатор NPR-A, рассматривается для применения при остром поражении почек [183].
Обоснованием для разработки агонистов NPR-C послужили исследования, показывающие, что этот рецептор опосредует большую часть воздействия ЦНП на тонус сосудов [65, 73]. Кроме того, мутации NPR-C связаны с гипертонией в GWAS [85]. Также было показано, что NPR-C опосредует, по крайней мере, частично, эндогенные эффекты ЦНП при сердечной недостаточности, регенерации сосудов / ангиогенезе и воспалении. Кроме того, NPR-C является рецептором, который наиболее активирован при СН. Нацеливание NPR-C может также потенциально избежать влияния на развитие кости, которое опосредуется главным образом NPR-B. Таким образом, низкомолекулярные агонисты NPR-C были сконструированы в соответствии с кристаллической структурой рецептора, связанного с ЦНП [184] и селективного антагониста M372049 [185]. Было показано, что соединение свинца 118 снижает артериальное давление in vivo и расслабляет брыжеечные артерии in vitro [73]. Кроме того, 118 имеет высокую аффинность и характеристики медленной диссоциации на рецепторе, поэтому он может конкурировать за клиренсную функцию NPR-C. Соответственно, у агонистов NPR-C может быть дополнительное преимущество, заключающееся в том, что они способны уменьшать деградацию всех натрийуретических пептидов и могут оказывать более широкий терапевтический эффект, чем эффект, вызываемый только передачей сигналов NPR-C. Дальнейшее развитие и оптимизация продолжаются.
13. Статистика
ЦНП обеспечивает множество защитных эффектов для сердца и сосудов благодаря двум своим родственным рецепторам, NPR-B и NPR-C. Эти полезные действия опосредованы рядом различных молекулярных путей (рис. 1). Фармакологическое воздействие на NPR-B и/или NPR-C использует эти целительные функции и имеет широкие терапевтические перспективы для сердечно-сосудистых заболеваний.
 Рисунок 1. Патофизиологические функции (верхняя панель) и сигнальные пути (нижняя панель) активировались ЦНП в эндотелиальных клетках, кардиомиоцитах и фибробластах. ЦНП снижает гипертрофию сердца, замедляет образование фиброза и способствует инотропии и хронотропии миоцитов. В сосудистой сети ЦНП снижает артериальное давление, ингибирует воспаление, уменьшает отложение атеросклеротических бляшек, модулирует рост эндотелиальных клеток (ЭК) и гладкомышечных клеток (ГМК) и стимулирует ангиогенез. Клеточные эффекты ЦНП опосредованы двумя родственными рецепторами, NPR-B и NPR-C. NPR-B является частичным рецептором гуанилилциклазы, и стимуляция приводит к выработке цГМФ и активации протеинкиназы G (PKG) I. NPR-C представляет собой связанный с Gi-протеином рецептор, который модулирует различные внутриклеточные ферменты, в том числе аденилатциклазу (АЦ), фосфолипазу C (PLC), киназу, регулируемую внеклеточным сигналом, (ERK) 1/2, фосфоинозитид-3-киназу (PI3K) и протеинкиназу B (Akt). Активация NPR-C также запускает открытие G-белок-связанных калиевых каналов внутреннего выпрямления (GIRK). Перекрестное взаимодействие происходит между двумя рецепторными сигнальными путями посредством цГМФ-опосредованного ингибирования фосфодиэстеразы (ФДЭ) 3 — фермента, ответственного за гидролиз цАМФ в кардиомиоцитах
Рисунок 1. Патофизиологические функции (верхняя панель) и сигнальные пути (нижняя панель) активировались ЦНП в эндотелиальных клетках, кардиомиоцитах и фибробластах. ЦНП снижает гипертрофию сердца, замедляет образование фиброза и способствует инотропии и хронотропии миоцитов. В сосудистой сети ЦНП снижает артериальное давление, ингибирует воспаление, уменьшает отложение атеросклеротических бляшек, модулирует рост эндотелиальных клеток (ЭК) и гладкомышечных клеток (ГМК) и стимулирует ангиогенез. Клеточные эффекты ЦНП опосредованы двумя родственными рецепторами, NPR-B и NPR-C. NPR-B является частичным рецептором гуанилилциклазы, и стимуляция приводит к выработке цГМФ и активации протеинкиназы G (PKG) I. NPR-C представляет собой связанный с Gi-протеином рецептор, который модулирует различные внутриклеточные ферменты, в том числе аденилатциклазу (АЦ), фосфолипазу C (PLC), киназу, регулируемую внеклеточным сигналом, (ERK) 1/2, фосфоинозитид-3-киназу (PI3K) и протеинкиназу B (Akt). Активация NPR-C также запускает открытие G-белок-связанных калиевых каналов внутреннего выпрямления (GIRK). Перекрестное взаимодействие происходит между двумя рецепторными сигнальными путями посредством цГМФ-опосредованного ингибирования фосфодиэстеразы (ФДЭ) 3 — фермента, ответственного за гидролиз цАМФ в кардиомиоцитах* CNP – натрийуретический пептид типа С, GTP Гамма – ГТ, Cgmp – цГМФ
Список использованной литературы
- De Bold, A.J. Atrial natriuretic factor: A hormone produced by the heart. Science 1985, 230, 767–770.
- Mukoyama, M.; Nakao, K.; Saito, Y.; Ogawa, Y.; Hosoda, K.; Suga, S.; Shirakami, G.; Jougasaki, M.; Imura, H. Human brain natriuretic peptide, a novel cardiac hormone. Lancet 1990, 335, 801–802.
- Mukoyama, M.; Nakao, K.; Hosoda, K.; Suga, S.; Saito, Y.; Ogawa, Y.; Shirakami, G.; Jougasaki, M.; Obata, K.; Yasue, H.; et al. Brain natriuretic peptide as a novel cardiac hormone in humans. Evidence for an exquisite dual natriuretic peptide system, atrial natriuretic peptide and brain natriuretic peptide. J. Clin. Investig. 1991, 87, 1402–1412.
- Oikawa, S.; Imai, M.; Ueno, A.; Tanaka, S.; Noguchi, T.; Nakazato, H.; Kangawa, K.; Fukuda, A.; Matsuo, H. Cloning and sequence analysis of cDNA encoding a precursor for human atrial natriuretic polypeptide. Nature 1984, 309, 724–726.
- Edwards, B.S.; Zimmerman, R.S.; Schwab, T.R.; Heublein, D.M.; Burnett, J.C., Jr. Atrial stretch, not pressure, is the principal determinant controlling the acute release of atrial natriuretic factor. Circ. Res. 1988, 62, 191–195.
- Kinnunen, P.; Vuolteenaho, O.; Ruskoaho, H. Mechanisms of atrial and brain natriuretic peptide release from rat ventricular myocardium: Effect of stretching. Endocrinology 1993, 132, 1961–1970.
- Potter, L.R.; Yoder, A.R.; Flora, D.R.; Antos, L.K.; Dickey, D.M. Natriuretic peptides: Their structures, receptors, physiologic functions and therapeutic applications. Handb. Exp. Pharmacol. 2009, 341–366.
- Wu, C.; Wu, F.; Pan, J.; Morser, J.; Wu, Q. Furin-mediated processing of Pro-C-type natriuretic peptide. J. Biol. Chem. 2003, 278, 25847–25852
- Sudoh, T.; Minamino, N.; Kangawa, K.; Matsuo, H. C-type natriuretic peptide (CNP): A new member of natriuretic peptide family identified in porcine brain. Biochem. Biophys. Res. Commun. 1990, 168, 863–870.
- Chusho, H.; Tamura, N.; Ogawa, Y.; Yasoda, A.; Suda, M.; Miyazawa, T.; Nakamura, K.; Nakao, K.; Kurihara, T.; Komatsu, Y.; et al. Dwarfism and early death in mice lacking C-type natriuretic peptide. Proc. Natl. Acad. Sci. USA 2001, 98, 4016–4021.
- Stingo, A.J.; Clavell, A.L.; Heublein, D.M.; Wei, C.M.; Pittelkow, M.R.; Burnett, J.C., Jr. Presence of C-type natriuretic peptide in cultured human endothelial cells and plasma. Am. J. Physiol. 1992, 263 Pt 2, H1318–H1321.
- Suga, S.; Nakao, K.; Itoh, H.; Komatsu, Y.; Ogawa, Y.; Hama, N.; Imura, H. Endothelial production of C-type natriuretic peptide and its marked augmentation by transforming growth factor-beta. Possible existence of "vascular natriuretic peptide system". J. Clin. Investig. 1992, 90, 1145–1149.
- Del Ry, S.; Cabiati, M.; Lionetti, V.; Emdin, M.; Recchia, F.A.; Giannessi, D. Expression of C-type natriuretic peptide and of its receptor NPR-B in normal and failing heart. Peptides 2008, 29, 2208–2215.
- Del Ry, S.; Cabiati, M.; Vozzi, F.; Battolla, B.; Caselli, C.; Forini, F.; Segnani, C.; Prescimone, T.; Giannessi, D.; Mattii, L. Expression of C-type natriuretic peptide and its receptor NPR-B in cardiomyocytes. Peptides2011, 32, 1713–1718.
- Horio, T.; Tokudome, T.; Maki, T.; Yoshihara, F.; Suga, S.; Nishikimi, T.; Kojima, M.; Kawano, Y.; Kangawa, K. Gene expression, secretion, and autocrine action of C-type natriuretic peptide in cultured adult rat cardiac fibroblasts. Endocrinology 2003, 144, 2279–2284.
- Hunt, P.J.; Richards, A.M.; Espiner, E.A.; Nicholls, M.G.; Yandle, T.G. Bioactivity and metabolism of C-type natriuretic peptide in normal man. J. Clin. Endocrinol. Metab. 1994, 78, 1428–1435.
- Sangaralingham, S.J.; McKie, P.M.; Ichiki, T.; Scott, C.G.; Heublein, D.M.; Chen, H.H.; Bailey, K.R.; Redfield, M.M.; Rodeheffer, R.J.; Burnett, J.C., Jr. Circulating C-type natriuretic peptide and its relationship to cardiovascular disease in the general population. Hypertension 2015, 65, 1187–1194.
- Kenny, A.J.; Bourne, A.; Ingram, J. Hydrolysis of human and pig brain natriuretic peptides, urodilatin, C-type natriuretic peptide and some C-receptor ligands by endopeptidase-24.11. Biochem. J. 1993, 291 Pt 1, 83–88.
- Maack, T.; Suzuki, M.; Almeida, F.A.; Nussenzveig, D.; Scarborough, R.M.; McEnroe, G.A.; Lewicki, J.A. Physiological role of silent receptors of atrial natriuretic factor. Science 1987, 238, 675–678.
- Cohen, D.; Koh, G.Y.; Nikonova, L.N.; Porter, J.G.; Maack, T. Molecular determinants of the clearance function of type C receptors of natriuretic peptides. J. Biol. Chem. 1996, 271, 9863–9869.
- Charles, C.J.; Espiner, E.A.; Nicholls, M.G.; Richards, A.M.; Yandle, T.G.; Protter, A.; Kosoglou, T. Clearance receptors and endopeptidase 24.11: Equal role in natriuretic peptide metabolism in conscious sheep. Am. J. Physiol. 1996, 271 Pt 2, R373–R380.
- Hashimoto, Y.; Nakao, K.; Hama, N.; Imura, H.; Mori, S.; Yamaguchi, M.; Yasuhara, M.; Hori, R. Clearance mechanisms of atrial and brain natriuretic peptides in rats. Pharm. Res. 1994, 11, 60–64.
- Brandt, R.R.; Heublein, D.M.; Aarhus, L.L.; Lewicki, J.A.; Burnett, J.C., Jr. Role of natriuretic peptide clearance receptor in in vivo control of C-type natriuretic peptide. Am. J. Physiol. 1995, 269 Pt 2, H326–H331.
- Okahara, K.; Kambayashi, J.; Ohnishi, T.; Fujiwara, Y.; Kawasaki, T.; Monden, M. Shear stress induces expression of CNP gene in human endothelial cells. FEBS Lett. 1995, 373, 108–110.
- Zhang, Z.; Xiao, Z.; Diamond, S.L. Shear stress induction of C-type natriuretic peptide (CNP) in endothelial cells is independent of NO autocrine signaling. Ann. Biomed. Eng. 1999, 27, 419–426.
- Suga, S.; Itoh, H.; Komatsu, Y.; Ogawa, Y.; Hama, N.; Yoshimasa, T.; Nakao, K. Cytokine-induced C-type natriuretic peptide (CNP) secretion from vascular endothelial cells—Evidence for CNP as a novel autocrine/paracrine regulator from endothelial cells. Endocrinology 1993, 133, 3038–3041.
- Osterbur, K.; Yu, D.H.; DeClue, A.E. Interleukin-1beta, tumour necrosis factor-alpha and lipopolysaccharide induce C-type natriuretic peptide from canine aortic endothelial cells. Res. Vet. Sci. 2013, 94, 478–483.
- Mendonca, M.C.; Koles, N.; Doi, S.Q.; Sellitti, D.F. Transforming growth factor-beta1 regulation of C-type natriuretic peptide expression in human vascular smooth muscle cells: dependence on TSC22D1. Am. J. Physiol. Heart Circ. Physiol. 2010, 299, H2018–H2027.
- Vollmar, A.M.; Schulz, R. Expression and differential regulation of natriuretic peptides in mouse macrophages. J. Clin. Investig. 1995, 95, 2442–2450.
- Del Ry, S.; Passino, C.; Maltinti, M.; Emdin, M.; Giannessi, D. C-type natriuretic peptide plasma levels increase in patients with chronic heart failure as a function of clinical severity. Eur. J. Heart Fail. 2005, 7, 1145–1148
- Hama, N.; Itoh, H.; Shirakami, G.; Suga, S.; Komatsu, Y.; Yoshimasa, T.; Tanaka, I.; Mori, K.; Nakao, K. Detection of C-type natriuretic peptide in human circulation and marked increase of plasma CNP level in septic shock patients. Biochem. Biophys. Res. Commun. 1994, 198, 1177–1182.
- Sugiyama, S.; Kugiyama, K.; Matsumura, T.; Suga, S.; Itoh, H.; Nakao, K.; Yasue, H. Lipoproteins regulate C-type natriuretic peptide secretion from cultured vascular endothelial cells. Arterioscler. Thromb. Vasc. Biol.1995, 15, 1968–1974.
- Doi, K.; Itoh, H.; Komatsu, Y.; Igaki, T.; Chun, T.H.; Takaya, K.; Yamashita, J.; Inoue, M.; Yoshimasa, T.; Nakao, K. Vascular endothelial growth factor suppresses C-type natriuretic peptide secretion. Hypertension1996, 27 Pt 2, 811–815.
- Levin, E.R.; Gardner, D.G.; Samson, W.K. Natriuretic peptides. N. Engl. J. Med. 1998, 339, 321–328.
- Potter, L.R.; Abbey-Hosch, S.; Dickey, D.M. Natriuretic peptides, their receptors, and cyclic guanosine monophosphate-dependent signaling functions. Endocr. Rev. 2006, 27, 47–72
- He, X.L.; Dukkipati, A.; Garcia, K.C. Structural determinants of natriuretic peptide receptor specificity and degeneracy. J. Mol. Biol. 2006, 361, 698–714.
- Khambata, R.S.; Panayiotou, C.M.; Hobbs, A.J. Natriuretic peptide receptor-3 underpins the disparate regulation of endothelial and vascular smooth muscle cell proliferation by C-type natriuretic peptide. Br. J. Pharmacol. 2011, 164, 584–597.
- Suga, S.; Nakao, K.; Mukoyama, M.; Arai, H.; Hosoda, K.; Ogawa, Y.; Imura, H. Characterization of natriuretic peptide receptors in cultured cells. Hypertension 1992, 19, 762–765
- Fujio, N.; Gossard, F.; Bayard, F.; Tremblay, J. Regulation of natriuretic peptide receptor A and B expression by transforming growth factor-beta 1 in cultured aortic smooth muscle cells. Hypertension 1994, 23 Pt 2, 908–913.
- Lin, X.; Hanze, J.; Heese, F.; Sodmann, R.; Lang, R.E. Gene expression of natriuretic peptide receptors in myocardial cells. Circ. Res. 1995, 77, 750–758.
- Huntley, B.K.; Sandberg, S.M.; Noser, J.A.; Cataliotti, A.; Redfield, M.M.; Matsuda, Y.; Burnett, J.C., Jr. BNP-induced activation of cGMP in human cardiac fibroblasts: Interactions with fibronectin and natriuretic peptide receptors. J. Cell Physiol. 2006, 209, 943–949
- Leitman, D.C.; Andresen, J.W.; Kuno, T.; Kamisaki, Y.; Chang, J.K.; Murad, F. Identification of multiple binding sites for atrial natriuretic factor by affinity cross-linking in cultured endothelial cells. J. Biol. Chem.1986, 261, 11650–11655.
- Koller, K.J.; Lowe, D.G.; Bennett, G.L.; Minamino, N.; Kangawa, K.; Matsuo, H.; Goeddel, D.V. Selective activation of the B natriuretic peptide receptor by C-type natriuretic peptide (CNP). Science 1991, 252, 120–123.
- Schlossmann, J.; Feil, R.; Hofmann, F. Insights into cGMP signalling derived from cGMP kinase knockout mice. Front. Biosci. 2005, 10, 1279–1289.
- Miyazawa, T.; Ogawa, Y.; Chusho, H.; Yasoda, A.; Tamura, N.; Komatsu, Y.; Pfeifer, A.; Hofmann, F.; Nakao, K. Cyclic GMP-dependent protein kinase II plays a critical role in C-type natriuretic peptide-mediated endochondral ossification. Endocrinology 2002, 143, 3604–3610.
- Nussenzveig, D.R.; Lewicki, J.A.; Maack, T. Cellular mechanisms of the clearance function of type C receptors of atrial natriuretic factor. J. Biol. Chem. 1990, 265, 20952–20958.
- Murthy, K.S.; Makhlouf, G.M. Identification of the G protein-activating domain of the natriuretic peptide clearance receptor (NPR-C). J. Biol. Chem. 1999, 274, 17587–17592.
- Anand-Srivastava, M.B.; Sairam, M.R.; Cantin, M. Ring-deleted analogs of atrial natriuretic factor inhibit adenylate cyclase/cAMP system. Possible coupling of clearance atrial natriuretic factor receptors to adenylate cyclase/cAMP signal transduction system. J. Biol. Chem. 1990, 265, 8566–8572.
- Murthy, K.S.; Teng, B.Q.; Zhou, H.; Jin, J.G.; Grider, J.R.; Makhlouf, G.M. G(i-1)/G(i-2)-dependent signaling by single-transmembrane natriuretic peptide clearance receptor. Am. J. Physiol. Gastrointest. Liver Physiol.2000, 278, G974–G980.
- Pagano, M.; Anand-Srivastava, M.B. Cytoplasmic domain of natriuretic peptide receptor C constitutes Gi activator sequences that inhibit adenylyl cyclase activity. J. Biol. Chem. 2001, 276, 22064–22070.
- Trachte, G.J.; Kanwal, S.; Elmquist, B.J.; Ziegler, R.J. C-type natriuretic peptide neuromodulates via "clearance" receptors. Am. J. Physiol. 1995, 268 Pt 1, C978–C984.
- Savoie, P.; de Champlain, J.; Anand-Srivastava, M.B. C-type natriuretic peptide and brain natriuretic peptide inhibit adenylyl cyclase activity: interaction with ANF-R2/ANP-C receptors. FEBS Lett. 1995, 370, 6–10.
- Brown, J.; Zuo, Z. Receptor proteins and biological effects of C-type natriuretic peptides in the renal glomerulus of the rat. Am. J. Physiol. 1994, 266 Pt 2, R1383–R1394.
- Wei, C.M.; Aarhus, L.L.; Miller, V.M.; Burnett, J.C., Jr. Action of C-type natriuretic peptide in isolated canine arteries and veins. Am. J. Physiol. 1993, 264 Pt 2, H71–H73.
- Wei, C.M.; Hu, S.; Miller, V.M.; Burnett, J.C., Jr. Vascular actions of C-type natriuretic peptide in isolated porcine coronary arteries and coronary vascular smooth muscle cells. Biochem. Biophys. Res. Commun.1994, 205, 765–771.
- Klinger, J.R.; Siddiq, F.M.; Swift, R.A.; Jackson, C.; Pietras, L.; Warburton, R.R.; Alia, C.; Hill, N.S. C-type natriuretic peptide expression and pulmonary vasodilation in hypoxia-adapted rats. Am. J. Physiol. 1998, 275, L645–L652.
- Drewett, J.G.; Fendly, B.M.; Garbers, D.L.; Lowe, D.G. Natriuretic peptide receptor-B (guanylyl cyclase-B) mediates C-type natriuretic peptide relaxation of precontracted rat aorta. J. Biol. Chem. 1995, 270, 4668–4674.
- Mori, Y.; Takayasu, M.; Suzuki, Y.; Shibuya, M.; Yoshida, J.; Hidaka, H. Vasodilator effects of C-type natriuretic peptide on cerebral arterioles in rats. Eur. J. Pharmacol. 1997, 320, 183–186
- Barber, D.A.; Burnett, J.C., Jr.; Fitzpatrick, L.A.; Sieck, G.C.; Miller, V.M. Gender and relaxation to C-type natriuretic peptide in porcine coronary arteries. J. Cardiovasc. Pharmacol. 1998, 32, 5–11.
- Wennberg, P.W.; Miller, V.M.; Rabelink, T.; Burnett, J.C., Jr. Further attenuation of endothelium-dependent relaxation imparted by natriuretic peptide receptor antagonism. Am. J. Physiol. 1999, 277, H1618–H1621
- Brunner, F.; Wolkart, G. Relaxant effect of C-type natriuretic peptide involves endothelium and nitric oxide-cGMP system in rat coronary microvasculature. Cardiovasc. Res. 2001, 51, 577–584
- Otsuka, K.; Tanaka, H.; Horinouchi, T.; Koike, K.; Shigenobu, K.; Tanaka, Y. Functional contribution of voltage-dependent and Ca2+ activated K+ (BK(Ca)) channels to the relaxation of guinea-pig aorta in response to natriuretic peptides. J. Smooth Muscle Res. 2002, 38, 117–129.
- Madhani, M.; Scotland, R.S.; MacAllister, R.J.; Hobbs, A.J. Vascular natriuretic peptide receptor-linked particulate guanylate cyclases are modulated by nitric oxide-cyclic GMP signalling. Br. J. Pharmacol. 2003, 139, 1289–1296.
- Garcha, R.S.; Hughes, A.D. CNP, but not ANP or BNP, relax human isolated subcutaneous resistance arteries by an action involving cyclic GMP and BKCa channels. J. Renin Angiotensin Aldosterone Syst. 2006, 7, 87–91
- Villar, I.C.; Panayiotou, C.M.; Sheraz, A.; Madhani, M.; Scotland, R.S.; Nobles, M.; Kemp-Harper, B.; Ahluwalia, A.; Hobbs, A.J. Definitive role for natriuretic peptide receptor-C in mediating the vasorelaxant activity of C-type natriuretic peptide and endothelium-derived hyperpolarising factor. Cardiovasc. Res. 2007, 74, 515–525. [
- Leuranguer, V.; Vanhoutte, P.M.; Verbeuren, T.; Feletou, M. C-type natriuretic peptide and endothelium-dependent hyperpolarization in the guinea-pig carotid artery. Br. J. Pharmacol. 2008, 153, 57–65.
- Edvinsson, M.L.; Ahnstedt, H.; Edvinsson, L.; Andersson, S.E. Characterization of Relaxant Responses to Natriuretic Peptides in the Human Microcirculation In Vitro and In Vivo. Microcirculation 2016, 23, 438–446.
- Clavell, A.L.; Stingo, A.J.; Wei, C.M.; Heublein, D.M.; Burnett, J.C., Jr. Натрийуретический пептид типа c: A selective cardiovascular peptide. Am. J. Physiol. 1993, 264 Pt 2, R290–R295.
- Nakamura, M.; Arakawa, N.; Yoshida, H.; Makita, S.; Hiramori, K. Vasodilatory effects of C-type natriuretic peptide on forearm resistance vessels are distinct from those of atrial natriuretic peptide in chronic heart failure. Circulation 1994, 90, 1210–1214
- Igaki, T.; Itoh, H.; Suga, S.; Hama, N.; Ogawa, Y.; Komatsu, Y.; Mukoyama, M.; Sugawara, A.; Yoshimasa, T.; Tanaka, I.; et al. C-type natriuretic peptide in chronic renal failure and its action in humans. Kidney Int. Suppl.1996, 55, S144–S147.
- Honing, M.L.; Smits, P.; Morrison, P.J.; Burnett, J.C., Jr.; Rabelink, T.J. C-type natriuretic peptide-induced vasodilation is dependent on hyperpolarization in human forearm resistance vessels. Hypertension 2001, 37, 1179–1183.
- Aizawa, N.; Ishizuka, O.; Ogawa, T.; Mizusawa, H.; Igawa, Y.; Nishizawa, O.; Andersson, K.E. Effects of natriuretic peptides on intracavernous pressure and blood pressure in conscious rats. J. Sex. Med. 2008, 5, 2312–2317.
- Moyes, A.J.; Khambata, R.S.; Villar, I.; Bubb, K.J.; Baliga, R.S.; Lumsden, N.G.; Xiao, F.; Gane, P.J.; Rebstock, A.S.; Worthington, R.J.; et al. Endothelial C-type natriuretic peptide maintains vascular homeostasis. J. Clin. Investig. 2014, 124, 4039–4051. [
- Nakao, K.; Kuwahara, K.; Nishikimi, T.; Nakagawa, Y.; Kinoshita, H.; Minami, T.; Kuwabara, Y.; Yamada, C.; Yamada, Y.; Tokudome, T.; et al. Endothelium-Derived C-Type Natriuretic Peptide Contributes to Blood Pressure Regulation by Maintaining Endothelial Integrity. Hypertension 2017, 69, 286–296.
- Spiranec, K.; Chen, W.; Werner, F.; Nikolaev, V.O.; Naruke, T.; Koch, F.; Werner, A.; Eder-Negrin, P.; Dieguez-Hurtado, R.; Adams, R.H.; et al. Endothelial C-Type Natriuretic Peptide Acts on Pericytes to Regulate Microcirculatory Flow and Blood Pressure. Circulation 2018, 138, 494–508.
- Ono, K.; Mannami, T.; Baba, S.; Tomoike, H.; Suga, S.; Iwai, N. A single-nucleotide polymorphism in C-type natriuretic peptide gene may be associated with hypertension. Hypertens. Res. 2002, 25, 727–730.
- Li, N.; Luo, W.; Juhong, Z.; Yang, J.; Wang, H.; Zhou, L.; Chang, J. Associations between genetic variations in the FURIN gene and hypertension. BMC Med. Genet. 2010, 11, 124.
- Chauhan, S.D.; Nilsson, H.; Ahluwalia, A.; Hobbs, A.J. Release of C-type natriuretic peptide accounts for the biological activity of endothelium-derived hyperpolarizing factor. Proc. Natl. Acad. Sci. USA 2003, 100, 1426–1431.
- Kun, A.; Kiraly, I.; Pataricza, J.; Marton, Z.; Krassoi, I.; Varro, A.; Simonsen, U.; Papp, J.G.; Pajor, L. C-type natriuretic peptide hyperpolarizes and relaxes human penile resistance arteries. J. Sex. Med. 2008, 5, 1114–1125.
- Simon, A.; Harrington, E.O.; Liu, G.X.; Koren, G.; Choudhary, G. Mechanism of C-type natriuretic peptide-induced endothelial cell hyperpolarization. Am. J. Physiol. Lung Cell Mol. Physiol. 2009, 296, L248–L256.
- Caniffi, C.; Elesgaray, R.; Gironacci, M.; Arranz, C.; Costa, M.A. C-type natriuretic peptide effects on cardiovascular nitric oxide system in spontaneously hypertensive rats. Peptides 2010, 31, 1309–1318.
- Caniffi, C.; Cerniello, F.M.; Gobetto, M.N.; Sueiro, M.L.; Costa, M.A.; Arranz, C. Vascular Tone Regulation Induced by C-Type Natriuretic Peptide: Differences in Endothelium-Dependent and -Independent Mechanisms Involved in Normotensive and Spontaneously Hypertensive Rats. PLoS ONE 2016, 11, e0167817.
- Tamura, N.; Doolittle, L.K.; Hammer, R.E.; Shelton, J.M.; Richardson, J.A.; Garbers, D.L. Critical roles of the guanylyl cyclase B receptor in endochondral ossification and development of female reproductive organs. Proc. Natl. Acad. Sci. USA 2004, 101, 17300–17305.
- Matsukawa, N.; Grzesik, W.J.; Takahashi, N.; Pandey, K.N.; Pang, S.; Yamauchi, M.; Smithies, O. The natriuretic peptide clearance receptor locally modulates the physiological effects of the natriuretic peptide system. Proc. Natl. Acad. Sci. USA 1999, 96, 7403–7408. [
- Ehret, G.B.; Munroe, P.B.; Rice, K.M.; Bochud, M.; Johnson, A.D.; Chasman, D.I.; Smith, A.V.; Tobin, M.D.; Verwoert, G.C.; Hwang, S.J.; et al. Genetic variants in novel pathways influence blood pressure and cardiovascular disease risk. Nature 2011, 478, 103–109.
- Ren, M.; Ng, F.L.; Warren, H.R.; Witkowska, K.; Baron, M.; Jia, Z.; Cabrera, C.; Zhang, R.; Mifsud, B.; Munroe, P.B.; et al. The biological impact of blood pressure-associated genetic variants in the natriuretic peptide receptor C gene on human vascular smooth muscle. Hum. Mol. Genet. 2018, 27, 199–210.
- Li, Y.X.; Cheng, K.C.; Asakawa, A.; Kato, I.; Sato, Y.; Amitani, H.; Kawamura, N.; Cheng, J.T.; Inui, A. Role of musclin in the pathogenesis of hypertension in rat. PLoS ONE 2013, 8, e72004.
- Miyazaki, T.; Otani, K.; Chiba, A.; Nishimura, H.; Tokudome, T.; Takano-Watanabe, H.; Matsuo, A.; Ishikawa, H.; Shimamoto, K.; Fukui, H.; et al. A New Secretory Peptide of Natriuretic Peptide Family, Osteocrin, Suppresses the Progression of Congestive Heart Failure After Myocardial Infarction. Circ. Res. 2018, 122, 742–751.
- Li, Y.; Sarkar, O.; Brochu, M.; Anand-Srivastava, M.B. Natriuretic peptide receptor-C attenuates hypertension in spontaneously hypertensive rats: role of nitroxidative stress and Gi proteins. Hypertension 2014, 63, 846–855.
- Schachner, T.; Zou, Y.; Oberhuber, A.; Mairinger, T.; Tzankov, A.; Laufer, G.; Ott, H.; Bonatti, J. Perivascular application of C-type natriuretic peptide attenuates neointimal hyperplasia in experimental vein grafts. Eur. J. Cardiothorac. Surg. 2004, 25, 585–590.
- Doi, K.; Ikeda, T.; Itoh, H.; Ueyama, K.; Hosoda, K.; Ogawa, Y.; Yamashita, J.; Chun, T.H.; Inoue, M.; Masatsugu, K.; et al. C-type natriuretic peptide induces redifferentiation of vascular smooth muscle cells with accelerated reendothelialization. Arterioscler. Thromb. Vasc. Biol. 2001, 21, 930–936.
- Ohno, N.; Itoh, H.; Ikeda, T.; Ueyama, K.; Yamahara, K.; Doi, K.; Yamashita, J.; Inoue, M.; Masatsugu, K.; Sawada, N.; et al. Accelerated reendothelialization with suppressed thrombogenic property and neointimal hyperplasia of rabbit jugular vein grafts by adenovirus-mediated gene transfer of C-type natriuretic peptide. Circulation 2002, 105, 1623–1626.
- Furuya, M.; Aisaka, K.; Miyazaki, T.; Honbou, N.; Kawashima, K.; Ohno, T.; Tanaka, S.; Minamino, N.; Kangawa, K.; Matsuo, H. C-type natriuretic peptide inhibits intimal thickening after vascular injury. Biochem. Biophys. Res. Commun. 1993, 193, 248–253.
- Furuya, M.; Yoshida, M.; Hayashi, Y.; Ohnuma, N.; Minamino, N.; Kangawa, K.; Matsuo, H. C-type natriuretic peptide is a growth inhibitor of rat vascular smooth muscle cells. Biochem. Biophys. Res. Commun. 1991, 177, 927–931.
- Hutchinson, H.G.; Trindade, P.T.; Cunanan, D.B.; Wu, C.F.; Pratt, R.E. Mechanisms of natriuretic-peptide-induced growth inhibition of vascular smooth muscle cells. Cardiovasc. Res. 1997, 35, 158–167.
- Cahill, P.A.; Hassid, A. ANF-C-receptor-mediated inhibition of aortic smooth muscle cell proliferation and thymidine kinase activity. Am. J. Physiol. 1994, 266 Pt 2, R194–R1203.
- Bubb, K.J.; Aubdool, A.A.; Moyes, A.J.; Lewis, S.; Drayton, J.P.; Tang, O.; Mehta, V.; Zachary, I.C.; Abraham, D.J.; Tsui, J.; et al. Endothelial C-Type Natriuretic Peptide Is a Critical Regulator of Angiogenesis and Vascular Remodeling. Circulation 2019, 139, 1612–1628.
- Yamahara, K.; Itoh, H.; Chun, T.H.; Ogawa, Y.; Yamashita, J.; Sawada, N.; Fukunaga, Y.; Sone, M.; Yurugi-Kobayashi, T.; Miyashita, K.; et al. Significance and therapeutic potential of the natriuretic peptides/cGMP/cGMP-dependent protein kinase pathway in vascular regeneration. Proc. Natl. Acad. Sci. USA 2003, 100, 3404–3409. [
- Almeida, S.A.; Cardoso, C.C.; Orellano, L.A.; Reis, A.M.; Barcelos, L.S.; Andrade, S.P. Natriuretic peptide clearance receptor ligand (C-ANP4-23) attenuates angiogenesis in a murine sponge implant model. Clin. Exp. Pharmacol. Physiol. 2014, 41, 691–697.
- Pedram, A.; Razandi, M.; Hu, R.M.; Levin, E.R. Vasoactive peptides modulate vascular endothelial cell growth factor production and endothelial cell proliferation and invasion. J. Biol. Chem. 1997, 272, 17097–17103.
- Koch, A.; Voigt, S.; Sanson, E.; Duckers, H.; Horn, A.; Zimmermann, H.W.; Trautwein, C.; Tacke, F. Prognostic value of circulating amino-terminal pro-C-type natriuretic peptide in critically ill patients. Crit. Care2011, 15, R45.
- Bahrami, S.; Pelinka, L.; Khadem, A.; Maitzen, S.; Hawa, G.; van Griensven, M.; Redl, H. Circulating NT-proCNP predicts sepsis in multiple-traumatized patients without traumatic brain injury. Crit. Care Med. 2010, 38, 161–166.
- Ehler, J.; Saller, T.; Wittstock, M.; Rommer, P.S.; Chappell, D.; Zwissler, B.; Grossmann, A.; Richter, G.; Reuter, D.A.; Noldge-Schomburg, G.; et al. Diagnostic value of NT-proCNP compared to NSE and S100B in cerebrospinal fluid and plasma of patients with sepsis-associated encephalopathy. Neurosci. Lett. 2019, 692, 167–173.
- Tomasiuk, R.; Mikaszewska-Sokolewicz, M.; Szlufik, S.; Rzepecki, P.; Lazowski, T. The prognostic value of concomitant assessment of NT-proCNP, C-reactive protein, procalcitonin and inflammatory cytokines in septic patients. Crit. Care 2014, 18, 440.
- Ince, C.; Mayeux, P.R.; Nguyen, T.; Gomez, H.; Kellum, J.A.; Ospina-Tascon, G.A.; Hernandez, G.; Murray, P.; De Backer, D. The endothelium in sepsis. Shock 2016, 45, 259–270.
- Ross, R. Atherosclerosis—An inflammatory disease. N. Engl. J. Med. 1999, 340, 115–126. [
- Scotland, R.S.; Cohen, M.; Foster, P.; Lovell, M.; Mathur, A.; Ahluwalia, A.; Hobbs, A.J. C-type natriuretic peptide inhibits leukocyte recruitment and platelet-leukocyte interactions via suppression of P-selectin expression. Proc. Natl. Acad. Sci. USA 2005, 102, 14452–14457.
- Kimura, T.; Nojiri, T.; Hosoda, H.; Ishikane, S.; Shintani, Y.; Inoue, M.; Miyazato, M.; Okumura, M.; Kangawa, K. C-type natriuretic peptide attenuates lipopolysaccharide-induced acute lung injury in mice. J. Surg. Res.2015, 194, 631–637
- Chen, G.; Zhao, J.; Yin, Y.; Wang, B.; Liu, Q.; Li, P.; Zhao, L.; Zhou, H. C-type natriuretic peptide attenuates LPS-induced endothelial activation: Involvement of p38, Akt, and NF-kappaB pathways. Amino Acids 2014, 46, 2653–2663.
- Casco, V.H.; Veinot, J.P.; Kuroski de Bold, M.L.; Masters, R.G.; Stevenson, M.M.; de Bold, A.J. Natriuretic peptide system gene expression in human coronary arteries. J. Histochem. Cytochem. 2002, 50, 799–809.
- Kohno, M.; Yokokawa, K.; Yasunari, K.; Kano, H.; Minami, M.; Ueda, M.; Yoshikawa, J. Effect of natriuretic peptide family on the oxidized LDL-induced migration of human coronary artery smooth muscle cells. Circ. Res. 1997, 81, 585–590.
- Villard, C.; Hultgren, R. Abdominal aortic aneurysm: Sex differences. Maturitas 2018, 109, 63–69
- Hu, P.; Wang, J.; Zhao, X.Q.; Hu, B.; Lu, L.; Qin, Y.H. Overexpressed C-type natriuretic peptide serves as an early compensatory response to counteract extracellular matrix remodeling in unilateral ureteral obstruction rats. Mol. Biol. Rep. 2013, 40, 1429–1441.
- Krejci, P.; Masri, B.; Fontaine, V.; Mekikian, P.B.; Weis, M.; Prats, H.; Wilcox, W.R. Interaction of fibroblast growth factor and C-natriuretic peptide signaling in regulation of chondrocyte proliferation and extracellular matrix homeostasis. J. Cell Sci. 2005, 118 Pt 21, 5089–5100.
- Murakami, S.; Nagaya, N.; Itoh, T.; Fujii, T.; Iwase, T.; Hamada, K.; Kimura, H.; Kangawa, K. C-type natriuretic peptide attenuates bleomycin-induced pulmonary fibrosis in mice. Am. J. Physiol. Lung Cell. Mol. Physiol. 2004, 287, L1172–L1177.
- Chen, G.; Song, X.; Yin, Y.; Xia, S.; Liu, Q.; You, G.; Zhao, L.; Zhou, H. C-type natriuretic peptide prevents kidney injury and attenuates oxidative and inflammatory responses in hemorrhagic shock. Amino Acids 2017, 49, 347–354.
- Bae, C.R.; Hino, J.; Hosoda, H.; Arai, Y.; Son, C.; Makino, H.; Tokudome, T.; Tomita, T.; Kimura, T.; Nojiri, T.; et al. Overexpression of C-type Natriuretic Peptide in Endothelial Cells Protects against Insulin Resistance and Inflammation during Diet-induced Obesity. Sci. Rep. 2017, 7, 9807. [
- Bae, C.R.; Hino, J.; Hosoda, H.; Miyazato, M.; Kangawa, K. C-type natriuretic peptide (CNP) in endothelial cells attenuates hepatic fibrosis and inflammation in non-alcoholic steatohepatitis. Life Sci. 2018, 209, 349–356.
- Del Ry, S. C-type natriuretic peptide: a new cardiac mediator. Peptides 2013, 40, 93–98.
- Wei, C.M.; Heublein, D.M.; Perrella, M.A.; Lerman, A.; Rodeheffer, R.J.; McGregor, C.G.; Edwards, W.D.; Schaff, H.V.; Burnett, J.C., Jr. Natriuretic peptide system in human heart failure. Circulation 1993, 88, 1004–1009
- Palmer, S.C.; Prickett, T.C.; Espiner, E.A.; Yandle, T.G.; Richards, A.M. Regional release and clearance of C-type natriuretic peptides in the human circulation and relation to cardiac function. Hypertension 2009, 54, 612–618.
- Prickett, T.C.; Yandle, T.G.; Nicholls, M.G.; Espiner, E.A.; Richards, A.M. Identification of amino-terminal pro-C-type natriuretic peptide in human plasma. Biochem. Biophys. Res. Commun. 2001, 286, 513–517.
- Wright, S.P.; Prickett, T.C.; Doughty, R.N.; Frampton, C.; Gamble, G.D.; Yandle, T.G.; Sharpe, N.; Richards, M. Amino-terminal pro-C-type natriuretic peptide in heart failure. Hypertension 2004, 43, 94–100.
- Lok, D.J.; Klip, I.T.; Voors, A.A.; Lok, S.I.; Bruggink-Andre de la Porte, P.W.; Hillege, H.L.; Jaarsma, T.; van Veldhuisen, D.J.; van der Meer, P. Prognostic value of N-terminal pro C-type natriuretic peptide in heart failure patients with preserved and reduced ejection fraction. Eur. J. Heart Fail. 2014, 16, 958–966.
- Del Ry, S.; Maltinti, M.; Piacenti, M.; Passino, C.; Emdin, M.; Giannessi, D. Cardiac production of C-type natriuretic peptide in heart failure. J. Cardiovasc. Med. (Hagerstown) 2006, 7, 397–399. [
- Dickey, D.M.; Flora, D.R.; Bryan, P.M.; Xu, X.; Chen, Y.; Potter, L.R. Differential regulation of membrane guanylyl cyclases in congestive heart failure: Natriuretic peptide receptor (NPR)-B, Not NPR-A, is the predominant natriuretic peptide receptor in the failing heart. Endocrinology 2007, 148, 3518–3522.
- Dickey, D.M.; Dries, D.L.; Margulies, K.B.; Potter, L.R. Guanylyl cyclase (GC)-A and GC-B activities in ventricles and cardiomyocytes from failed and non-failed human hearts: GC-A is inactive in the failed cardiomyocyte. J. Mol. Cell. Cardiol. 2012, 52, 727–732.
- Ichiki, T.; Schirger, J.A.; Huntley, B.K.; Brozovich, F.V.; Maleszewski, J.J.; Sandberg, S.M.; Sangaralingham, S.J.; Park, S.J.; Burnett, J.C., Jr. Cardiac fibrosis in end-stage human heart failure and the cardiac natriuretic peptide guanylyl cyclase system: regulation and therapeutic implications. J. Mol. Cell. Cardiol. 2014, 75, 199–205
- Beaulieu, P.; Cardinal, R.; Page, P.; Francoeur, F.; Tremblay, J.; Lambert, C. Positive chronotropic and inotropic effects of C-type natriuretic peptide in dogs. Am. J. Physiol. 1997, 273 Pt 2, H1933–H1940.
- Hirose, M.; Furukawa, Y.; Kurogouchi, F.; Nakajima, K.; Miyashita, Y.; Chiba, S. C-type natriuretic peptide increases myocardial contractility and sinus rate mediated by guanylyl cyclase-linked natriuretic peptide receptors in isolated, blood-perfused dog heart preparations. J. Pharmacol. Exp. Ther. 1998, 286, 70–76.
- Brusq, J.M.; Mayoux, E.; Guigui, L.; Kirilovsky, J. Effects of C-type natriuretic peptide on rat cardiac contractility. Br. J. Pharmacol. 1999, 128, 206–212.
- Moltzau, L.R.; Aronsen, J.M.; Meier, S.; Skogestad, J.; Orstavik, O.; Lothe, G.B.; Sjaastad, I.; Skomedal, T.; Osnes, J.B.; Levy, F.O.; et al. Different compartmentation of responses to brain natriuretic peptide and C-type natriuretic peptide in failing rat ventricle. J. Pharmacol. Exp. Ther. 2014, 350, 681–690.
- Pierkes, M.; Gambaryan, S.; Boknik, P.; Lohmann, S.M.; Schmitz, W.; Potthast, R.; Holtwick, R.; Kuhn, M. Increased effects of C-type natriuretic peptide on cardiac ventricular contractility and relaxation in guanylyl cyclase A-deficient mice. Cardiovasc. Res. 2002, 53, 852–861.
- Wollert, K.C.; Yurukova, S.; Kilic, A.; Begrow, F.; Fiedler, B.; Gambaryan, S.; Walter, U.; Lohmann, S.M.; Kuhn, M. Increased effects of C-type natriuretic peptide on contractility and calcium regulation in murine hearts overexpressing cyclic GMP-dependent protein kinase I. Br. J. Pharmacol. 2003, 140, 1227–1236.
- Moltzau, L.R.; Aronsen, J.M.; Meier, S.; Nguyen, C.H.; Hougen, K.; Orstavik, O.; Sjaastad, I.; Christensen, G.; Skomedal, T.; Osnes, J.B.; et al. SERCA2 activity is involved in the CNP-mediated functional responses in failing rat myocardium. Br. J. Pharmacol. 2013, 170, 366–379.
- Frantz, S.; Klaiber, M.; Baba, H.A.; Oberwinkler, H.; Volker, K.; Gabetaner, B.; Bayer, B.; Abebetaer, M.; Schuh, K.; Feil, R.; et al. Stress-dependent dilated cardiomyopathy in mice with cardiomyocyte-restricted inactivation of cyclic GMP-dependent protein kinase I. Eur. Heart J. 2013, 34, 1233–1244.
- Qvigstad, E.; Moltzau, L.R.; Aronsen, J.M.; Nguyen, C.H.; Hougen, K.; Sjaastad, I.; Levy, F.O.; Skomedal, T.; Osnes, J.B. Natriuretic peptides increase beta1-adrenoceptor signalling in failing hearts through phosphodiesterase 3 inhibition. Cardiovasc. Res. 2010, 85, 763–772.
- Meier, S.; Andressen, K.W.; Aronsen, J.M.; Sjaastad, I.; Hougen, K.; Skomedal, T.; Osnes, J.B.; Qvigstad, E.; Levy, F.O.; Moltzau, L.R. PDE3 inhibition by C-type natriuretic peptide-induced cGMP enhances cAMP-mediated signaling in both non-failing and failing hearts. Eur. J. Pharmacol. 2017, 812, 174–183.
- Anand-Srivastava, M.B. Natriuretic peptide receptor-C signaling and regulation. Peptides 2005, 26, 1044–1059.
- Rose, R.A.; Lomax, A.E.; Kondo, C.S.; Anand-Srivastava, M.B.; Giles, W.R. Effects of C-type natriuretic peptide on ionic currents in mouse sinoatrial node: A role for the NPR-C receptor. Am. J. Physiol. Heart Circ. Physiol. 2004, 286, H1970–H1977.
- Travers, J.G.; Kamal, F.A.; Robbins, J.; Yutzey, K.E.; Blaxall, B.C. Cardiac Fibrosis: The Fibroblast Awakens. Circ. Res. 2016, 118, 1021–1040.
- Li, Z.Q.; Liu, Y.L.; Li, G.; Li, B.; Liu, Y.; Li, X.F.; Liu, A.J. Inhibitory effects of C-type natriuretic peptide on the differentiation of cardiac fibroblasts, and secretion of monocyte chemoattractant protein-1 and plasminogen activator inhibitor-1. Mol. Med. Rep. 2015, 11, 159–165.
- Sangaralingham, S.J.; Huntley, B.K.; Martin, F.L.; McKie, P.M.; Bellavia, D.; Ichiki, T.; Harders, G.E.; Chen, H.H.; Burnett, J.C., Jr. The aging heart, myocardial fibrosis, and its relationship to circulating C-type natriuretic Peptide. Hypertension 2011, 57, 201–207.
- Tokudome, T.; Horio, T.; Soeki, T.; Mori, K.; Kishimoto, I.; Suga, S.; Yoshihara, F.; Kawano, Y.; Kohno, M.; Kangawa, K. Inhibitory effect of C-type natriuretic peptide (CNP) on cultured cardiac myocyte hypertrophy: Interference between CNP and endothelin-1 signaling pathways. Endocrinology 2004, 145, 2131–2140.
- Moyes, A.J.; Chu, S.M.; Aubdool, A.A.; Dukinfield, M.S.; Margulies, K.B.; Bedi, K.C.; Hodivala-Dilke, K.; Baliga, R.S.; Hobbs, A.J. C-type natriuretic peptide co-ordinates cardiac structure and function. Eur. Heart J.2019.
- Langenickel, T.H.; Buttgereit, J.; Pagel-Langenickel, I.; Lindner, M.; Monti, J.; Beuerlein, K.; Al-Saadi, N.; Plehm, R.; Popova, E.; Tank, J.; et al. Cardiac hypertrophy in transgenic rats expressing a dominant-negative mutant of the natriuretic peptide receptor B. Proc. Natl. Acad. Sci. USA 2006, 103, 4735–4740.
- Michel, K.; Werner, F.; Prentki, E.; Abesser, M.; Voelker, K.; Baba, H.A.; Skryabin, B.V.; Schuh, K.; Herwig, M.; Hamdani, N.; et al. Blood pressure independent actions of C-type natriuretic peptide in hypertensive heart disease. Clin. Res. Cardiol. 2018, 107 (Suppl. 1).
- Blaser, M.C.; Wei, K.; Adams, R.L.E.; Zhou, Y.Q.; Caruso, L.L.; Mirzaei, Z.; Lam, A.Y.; Tam, R.K.K.; Zhang, H.; Heximer, S.P.; et al. Deficiency of Natriuretic Peptide Receptor 2 Promotes Bicuspid Aortic Valves, Aortic Valve Disease, Left Ventricular Dysfunction, and Ascending Aortic Dilatations in Mice. Circ. Res. 2018, 122, 405–416.
- Martin, F.L.; Sangaralingham, S.J.; Huntley, B.K.; McKie, P.M.; Ichiki, T.; Chen, H.H.; Korinek, J.; Harders, G.E.; Burnett, J.C., Jr. CD-NP: A novel engineered dual guanylyl cyclase activator with anti-fibrotic actions in the heart. PLoS ONE 2012, 7, e52422.
- Chen, Y.; Zheng, Y.; Iyer, S.R.; Harders, G.E.; Pan, S.; Chen, H.H.; Ichiki, T.; Burnett, J.C., Jr.; Sangaralingham, S.J. C53: A novel particulate guanylyl cyclase B receptor activator that has sustained activity in vivo with anti-fibrotic actions in human cardiac and renal fibroblasts. J. Mol. Cell. Cardiol. 2019, 130, 140–150.
- Jansen, H.J.; Mackasey, M.; Moghtadaei, M.; Liu, Y.; Kaur, J.; Egom, E.E.; Tuomi, J.M.; Rafferty, S.A.; Kirkby, A.W.; Rose, R.A. NPR-C (Natriuretic Peptide Receptor-C) Modulates the Progression of Angiotensin II-Mediated Atrial Fibrillation and Atrial Remodeling in Mice. Circ. Arrhythm. Electrophysiol. 2019, 12, e006863
- Mackasey, M.; Egom, E.E.; Jansen, H.J.; Hua, R.; Moghtadaei, M.; Liu, Y.; Kaur, J.; McRae, M.D.; Bogachev, O.; Rafferty, S.A.; et al. Natriuretic Peptide Receptor-C Protects Against Angiotensin II-Mediated Sinoatrial Node Disease in Mice. JACC Basic Transl. Sci. 2018, 3, 824–843.
- Pereira, N.L.; Redfield, M.M.; Scott, C.; Tosakulwong, N.; Olson, T.M.; Bailey, K.R.; Rodeheffer, R.J.; Burnett, J.C., Jr. A functional genetic variant (N521D) in natriuretic peptide receptor 3 is associated with diastolic dysfunction: The prevalence of asymptomatic ventricular dysfunction study. PLoS ONE 2014, 9, e85708.
- Rose, R.A.; Hatano, N.; Ohya, S.; Imaizumi, Y.; Giles, W.R. C-type natriuretic peptide activates a non-selective cation current in acutely isolated rat cardiac fibroblasts via natriuretic peptide C receptor-mediated signalling. J. Physiol. 2007, 580 Pt 1, 255–274.
- Rahmutula, D.; Zhang, H.; Wilson, E.E.; Olgin, J.E. Absence of natriuretic peptide clearance receptor attenuates TGF-beta1-induced selective atrial fibrosis and atrial fibrillation. Cardiovasc. Res. 2019, 115, 357–372.
- Wright, R.S.; Wei, C.M.; Kim, C.H.; Kinoshita, M.; Matsuda, Y.; Aarhus, L.L.; Burnett, J.C., Jr.; Miller, W.L. C-type natriuretic peptide-mediated coronary vasodilation: role of the coronary nitric oxide and particulate guanylate cyclase systems. J. Am. Coll. Cardiol. 1996, 28, 1031–1038.
- Hobbs, A.; Foster, P.; Prescott, C.; Scotland, R.; Ahluwalia, A. Natriuretic peptide receptor-C regulates coronary blood flow and prevents myocardial ischemia/reperfusion injury: Novel cardioprotective role for endothelium-derived C-type natriuretic peptide. Circulation 2004, 110, 1231–1235.
- Prickett, T.C.; Doughty, R.N.; Troughton, R.W.; Frampton, C.M.; Whalley, G.A.; Ellis, C.J.; Espiner, E.A.; Richards, A.M. C-Type Natriuretic Peptides in Coronary Disease. Clin. Chem. 2017, 63, 316–324.
- Hausenloy, D.J.; Yellon, D.M. Myocardial ischemia-reperfusion injury: A neglected therapeutic target. J. Clin. Investig. 2013, 123, 92–100.
- Tarazon, E.; Rosello-Lleti, E.; Ortega, A.; Molina-Navarro, M.M.; Sanchez-Lazaro, I.; Lago, F.; Gonzalez-Juanatey, J.R.; Rivera, M.; Portoles, M. Differential gene expression of C-type natriuretic peptide and its related molecules in dilated and ischemic cardiomyopathy. A new option for the management of heart failure. Int. J. Cardiol. 2014, 174, e84–e86.
- Gorbe, A.; Giricz, Z.; Szunyog, A.; Csont, T.; Burley, D.S.; Baxter, G.F.; Ferdinandy, P. Role of cGMP-PKG signaling in the protection of neonatal rat cardiac myocytes subjected to simulated ischemia/reoxygenation. Basic Res. Cardiol. 2010, 105, 643–650.
- Burley, D.S.; Cox, C.D.; Zhang, J.; Wann, K.T.; Baxter, G.F. Natriuretic peptides modulate ATP-sensitive K(+) channels in rat ventricular cardiomyocytes. Basic Res. Cardiol. 2014, 109, 402.
- Wu, L.H.; Zhang, Q.; Zhang, S.; Meng, L.Y.; Wang, Y.C.; Sheng, C.J. Effects of gene knockdown of CNP on ventricular remodeling after myocardial ischemia-reperfusion injury through NPRB/Cgmp signaling pathway in rats. J. Cell. Biochem. 2018, 119, 1804–1818.
- Wang, Y.; de Waard, M.C.; Sterner-Kock, A.; Stepan, H.; Schultheiss, H.P.; Duncker, D.J.; Walther, T. Cardiomyocyte-restricted over-expression of C-type natriuretic peptide prevents cardiac hypertrophy induced by myocardial infarction in mice. Eur. J. Heart Fail. 2007, 9, 548–557.
- Soeki, T.; Kishimoto, I.; Okumura, H.; Tokudome, T.; Horio, T.; Mori, K.; Kangawa, K. C-type natriuretic peptide, a novel antifibrotic and antihypertrophic agent, prevents cardiac remodeling after myocardial infarction. J. Am. Coll. Cardiol. 2005, 45, 608–616.
- Del Ry, S.; Cabiati, M.; Martino, A.; Cavallini, C.; Caselli, C.; Aquaro, G.D.; Battolla, B.; Prescimone, T.; Giannessi, D.; Mattii, L.; et al. High concentration of C-type natriuretic peptide promotes VEGF-dependent vasculogenesis in the remodeled region of infarcted swine heart with preserved left ventricular ejection fraction. Int. J. Cardiol. 2013, 168, 2426–2434.
- Rose, R.A.; Lomax, A.E.; Giles, W.R. Inhibition of L-type Ca2+ current by C-type natriuretic peptide in bullfrog atrial myocytes: An NPR-C-mediated effect. Am. J. Physiol. Heart Circ. Physiol. 2003, 285, H2454–H2462.
- Rose, R.A.; Giles, W.R. Natriuretic peptide C receptor signalling in the heart and vasculature. J. Physiol.2008, 586, 353–366.
- Springer, J.; Azer, J.; Hua, R.; Robbins, C.; Adamczyk, A.; McBoyle, S.; Bissell, M.B.; Rose, R.A. The natriuretic peptides BNP and CNP increase heart rate and electrical conduction by stimulating ionic currents in the sinoatrial node and atrial myocardium following activation of guanylyl cyclase-linked natriuretic peptide receptors. J. Mol. Cell. Cardiol. 2012, 52, 1122–1134.
- Azer, J.; Hua, R.; Vella, K.; Rose, R.A. Natriuretic peptides regulate heart rate and sinoatrial node function by activating multiple natriuretic peptide receptors. J. Mol. Cell. Cardiol. 2012, 53, 715–724.
- Egom, E.E.; Vella, K.; Hua, R.; Jansen, H.J.; Moghtadaei, M.; Polina, I.; Bogachev, O.; Hurnik, R.; Mackasey, M.; Rafferty, S.; et al. Impaired sinoatrial node function and increased susceptibility to atrial fibrillation in mice lacking natriuretic peptide receptor C. J. Physiol. 2015, 593, 1127–1146
- Buttgereit, J.; Shanks, J.; Li, D.; Hao, G.; Athwal, A.; Langenickel, T.H.; Wright, H.; da Costa Goncalves, A.C.; Monti, J.; Plehm, R.; et al. C-type natriuretic peptide and natriuretic peptide receptor B signalling inhibits cardiac sympathetic neurotransmission and autonomic function. Cardiovasc. Res. 2016, 112, 637–644.
- Moghtadaei, M.; Langille, E.; Rafferty, S.A.; Bogachev, O.; Rose, R.A. Altered heart rate regulation by the autonomic nervous system in mice lacking natriuretic peptide receptor C (NPR-C). Sci. Rep. 2017, 7, 17564
- Zanchi, A.; Maillard, M.; Burnier, M. Recent clinical trials with omapatrilat: new developments. Curr. Hypertens. Rep. 2003, 5, 346–352
- Ruilope, L.M.; Dukat, A.; Bohm, M.; Lacourciere, Y.; Gong, J.; Lefkowitz, M.P. Blood-pressure reduction with LCZ696, a novel dual-acting inhibitor of the angiotensin II receptor and neprilysin: A randomised, double-blind, placebo-controlled, active comparator study. Lancet 2010, 375, 1255–1266.
- Kario, K.; Sun, N.; Chiang, F.T.; Supasyndh, O.; Baek, S.H.; Inubushi-Molessa, A.; Zhang, Y.; Gotou, H.; Lefkowitz, M.; Zhang, J. Efficacy and safety of LCZ696, a first-in-class angiotensin receptor neprilysin inhibitor, in Asian patients with hypertension: A randomized, double-blind, placebo-controlled study. Hypertension 2014, 63, 698–705.
- McMurray, J.J.; Packer, M.; Desai, A.S.; Gong, J.; Lefkowitz, M.P.; Rizkala, A.R.; Rouleau, J.L.; Shi, V.C.; Solomon, S.D.; Swedberg, K.; et al. Angiotensin-neprilysin inhibition versus enalapril in heart failure. N. Engl. J. Med. 2014, 371, 993–1004
- Solomon, S.D.; Rizkala, A.R.; Gong, J.; Wang, W.; Anand, I.S.; Ge, J.; Lam, C.S.P.; Maggioni, A.P.; Martinez, F.; et al. Angiotensin Receptor Neprilysin Inhibition in Heart Failure With Preserved Ejection Fraction: Rationale and Design of the PARAGON-HF Trial. JACC. Heart Fail. 2017, 5, 471–482.
- Kovacs, A.; Alogna, A.; Post, H.; Hamdani, N. Is enhancing cGMP-PKG signalling a promising therapeutic target for heart failure with preserved ejection fraction? Neth. Heart J. 2016, 24, 268–274.
- Ichiki, T.; Dzhoyashvili, N.; Burnett, J.C., Jr. Natriuretic peptide based therapeutics for heart failure: Cenderitide: A novel first-in-class designer natriuretic peptide. Int. J. Cardiol. 2019, 281, 166–171. [
- Dickey, D.M.; Potter, L.R. Dendroaspis natriuretic peptide and the designer natriuretic peptide, CD-NP, are resistant to proteolytic inactivation. J. Mol. Cell. Cardiol. 2011, 51, 67–71.
- Lee, C.Y.; Chen, H.H.; Lisy, O.; Swan, S.; Cannon, C.; Lieu, H.D.; Burnett, J.C., Jr. Pharmacodynamics of a novel designer natriuretic peptide, CD-NP, in a first-in-human clinical trial in healthy subjects. J. Clin. Pharmacol. 2009, 49, 668–673.
- Chen, Y.; Harty, G.J.; Zheng, Y.; Iyer, S.R.; Sugihara, S.; Sangaralingham, S.J.; Ichiki, T.; Grande, J.P.; Lee, H.C.; Wang, X.L.; et al. CRRL269: A Novel Particulate Guanylyl Cyclase A Receptor Peptide Activator For Acute Kidney Injury. Circ. Res. 2019.
- He, X.; Chow, D.; Martick, M.M.; Garcia, K.C. Allosteric activation of a spring-loaded natriuretic peptide receptor dimer by hormone. Science 2001, 293, 1657–1662.
- Veale, C.A.; Alford, V.C.; Aharony, D.; Banville, D.L.; Bialecki, R.A.; Brown, F.J.; Damewood, J.R., Jr.; Dantzman, C.L.; Edwards, P.D.; Jacobs, R.T.; et al. The discovery of non-basic atrial natriuretic peptide clearance receptor antagonists. Part 1. Bioorg. Med. Chem. Lett. 2000, 10, 1949–1952.





