2040
12 Октября 2021
Авторское право © 2018, Nobuhiro Akuzawa, Masahiko Kurabayashi (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Нобухиро Акудзава, Масахико Курабаяси
BMC Cardiovascular Disorders201818:195
Аннотация
Обоснование
Инфекционный эндокардит, вызванный кишечной палочкой (Escherichia coli), встречается редко, однако частота данного заболевания увеличивается, особенно среди женщин пожилого возраста. Кроме тог...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Нобухиро Акудзава, Масахико Курабаяси
BMC Cardiovascular Disorders201818:195
Аннотация
Обоснование
Инфекционный эндокардит, вызванный кишечной палочкой (Escherichia coli), встречается редко, однако частота данного заболевания увеличивается, особенно среди женщин пожилого возраста. Кроме тог...
Авторское право © 2018, Nobuhiro Akuzawa, Masahiko Kurabayashi (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Нобухиро Акудзава, Масахико Курабаяси
BMC Cardiovascular Disorders201818:195
Аннотация
Обоснование
Инфекционный эндокардит, вызванный кишечной палочкой (Escherichia coli), встречается редко, однако частота данного заболевания увеличивается, особенно среди женщин пожилого возраста. Кроме того, смертность от эндокардита, вызванного Escherichia coli, выше, чем от эндокардита, вызванного грамотрицательными бактериями группы НАСЕК (Haemophilus spp., Aggregatibacter spp., Cardiobacterium hominis, Eikenella corrodens и Kingela spp.).
Описание клинического случая
По причине высокой температуры в стационар поступила 58-летняя гражданка Японии с избыточным употреблением алкоголя в анамнезе. Диагноз «инфекционный эндокардит» установлен на основании результатов повторных посевов крови и трансторакальной эхокардиографии, которая выявила вегетации на передней створке и сухожильных хордах митрального клапана. Несмотря на лечение сульбактамом/ампициллином и гентамицином, во время пребывания в стационаре у пациентки развился гнойный спондилит, требовавший проведения 6-недельного курса лечения меропенемом до устранения проявлений эндокардита. Пациентка принимала левофлоксацин внутрь в течение двух месяцев, и спондилит был полностью излечен через семь месяцев после возникновения.
Вывод
Escherichia coli поражает нативные клапаны, не вызывая при этом прогрессирующую вальвулопатию; искусственные клапаны не подвержены заболеванию. Наибольшему риску подвергаются пациенты с ослабленной иммунной системой, злоупотребляющие алкоголем, либо проходящие процедуру гемодиализа. Эмболия периферических сосудов, застойная сердечная недостаточность и абсцессы колец клапанов – наиболее часто встречающиеся осложнения инфекционного эндокардита. Также может развиться инфекционный миокардит. Смертность и частота оперативных вмешательств составляют 21% и 42% соответственно. При развитии устойчивости заболевания к лечению антибиотиками лечащему врачу следует принять решение о хирургическом вмешательстве.
Ключевые слова
Инфекционный эндокардит (ИЭ), вызванный Escherichia coli, является достаточно редким заболеванием и наблюдается примерно в 0,51% случаев ИЭ [1]. С 1909 по 2002 гг. в литературе описано 36 случаев эндокардита нативных клапанов сердца, вызванных E. coli, которые отвечают критериям Дьюка. Наиболее частой причиной развития заболевания являлись инфекции мочевыводящих путей. [2]. Низкая заболеваемость ИЭ объясняется неспособностью данного вида бактерий к удерживанию на внутренней оболочке сердца, а также наличием в плазме крови антител к E. сoli [3]. Тем не менее, следует отметить, что количество случаев ИЭ, вызванного E. coli, среди людей старше 70 лет заметно выросло, при этом около 70% пациентов – женщины пожилого возраста [2]. Кроме того, смертность от ИЭ, вызванного E. coli, выше (21%), чем от ИЭ, вызванного грамотрицательными бактериями группы НАСЕК (4%), такими как Haemophilus spp., Aggregatibacter spp., Cardiobacterium hominis, Eikenella corrodens и Kingela spp. [1, 4].
В данной публикации описан клинический случай ИЭ нативного клапана, вызванного инфекцией E. coli. Пациентку доставили в стационар для обследования по причине повышения температуры неизвестной этиологии. Повторные посевы крови выявили присутствие E. coli, однако E. coli не обнаружена в посевах мокроты и мочи. Трансторакальная эхокардиография выявила две вегетации на передней створке митрального клапана (МК) и ее хордах. Во время нахождения в стационаре у пациентки развилось осложнение в виде гнойного спондилита. После 8-недельного курса лечения антибиотиками пациентка была выписана без видимых осложнений.
Описание клинического случая
Женщина 58 лет, гражданка Японии, была доставлена в больницу в карете скорой помощи с жалобами на общее недомогание, боли в пояснице и повышение температуры тела неизвестной этиологии. Анамнез жизни пациентки и семейный анамнез не отягощены. Хотя женщина не курила, она в течение 30 лет употребляла от 60 до 80 г алкоголя ежедневно. В течение последних 10 лет у нее отмечались нарушения в работе печени.
При поступлении рост пациентки составлял 158 см, вес – 56,2 кг, температура тела – 39.5°C. Артериальное давление составляло 101/60 мм рт. ст. Частота сердечных сокращений – 106 ударов в минуту. При клиническом осмотре аномалий не выявлено. Сознание было ясным, однако отмечалось затруднение дыхания на выдохе, при этом насыщенность кислородом артериальной крови составляла 94%, парциальное давление кислорода – 72 мм рт. ст., углекислого газа – 27,2 мм рт. столба. В ходе рентгенографического исследования грудной клетки не было выявлено признаков пневмонии или застоя крови в легких. Электрокардиография показала наличие синусовой тахикардии, других отклонений обнаружено не было. Линейная компьютерная томография шеи, грудной клетки, брюшной полости, а также ультразвуковое исследование брюшной полости не выявили серьезных отклонений за исключением жирового гепатоза печени. Лабораторные исследования крови показали повышенное содержание лейкоцитов, ферментов печени, остаточного азота мочевины, креатинина, мочевой кислоты, С-реактивного белка (СРБ), а также мозгового натрийуретического пептида; выявлены гипопротеинемия и гипокалемия (см. табл. 1) Ревматоидный фактор в плазме крови не обнаружен. Анализ мочи показал присутствие кетоновых тел, однако в мочевом осадке отклонений обнаружено не было. Посевы крови, мочи и мокроты были взяты сразу же после поступления пациентки в стационар. Внутривенная терапия сульбактамом/ампициллином (9 г в сутки) началась в день госпитализации.
Таблица 1. Результаты лабораторных исследований при поступлении пациентки в стационар
На второй день температура оставалась повышенной. Посев мокроты не выявил значительного роста патогенных микроорганизмов, моча была стерильной. Тем не менее, в посеве крови были обнаружены грамотрицательные палочковидные бактерии. Последующее эхокардиографическое обследование выявило две вегетации, одна из которой находилась на передней створке МК, ее размер составлял приблизительно 4 х 1 мм (рис. 1a). Вторая вегетация находилась на сухожильных хордах рядом с задней папиллярной мышцей и имела больший размер (10 х 2 мм) (рис. 1b, c). На основании этих данных на 2-й день была назначена комбинированная терапия антибиотиками, в том числе сульбактамом/ампициллином (9 г/сутки) и гентамицином (80 мг/сутки). Повторные посевы крови проводились на 2-й и 3-й дни и показали присутствие грамотрицательных палочковидных бактерий. На 6-й день бактерии определены как E. сoli, чувствительные ко всем препаратам. На основании этих показателей в соответствии с модифицированными критериями Дьюка [5] был поставлен диагноз «инфекционный эндокардит». В тот же день пациентка была осмотрена офтальмологом и дерматологом - патологии, связанные с ИЭ, не обнаружены. На 7-й день была проведена компьютерная томография грудной клетки и брюшной полости с контрастированием. Значительных отклонений выявлено не было. На 8-й день проведены магнитно-резонансная томография и ангиография мозга, патологические изменения не обнаружены.
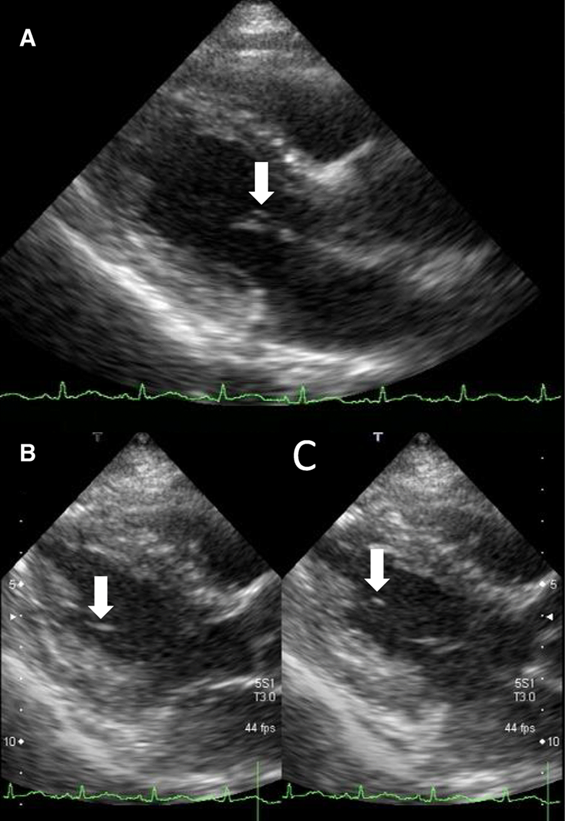 Рисунок 1. Результаты трансторакальной эхокардиографии, проведенной на 2-й день. А: в парастернальной длинноосевой проекции видна вегетация на передней створке митрального клапана (4 × 1 мм), см. белую стрелку. b, c: парастернальные длинноосевые томограммы, сделанные в пресистоле (b) и конце диастолы (С) (показано белыми стрелками). На сухожильной хорде митрального клапана видна подвижная, вытянутая по форме вегетация (10 х 2 мм)
Рисунок 1. Результаты трансторакальной эхокардиографии, проведенной на 2-й день. А: в парастернальной длинноосевой проекции видна вегетация на передней створке митрального клапана (4 × 1 мм), см. белую стрелку. b, c: парастернальные длинноосевые томограммы, сделанные в пресистоле (b) и конце диастолы (С) (показано белыми стрелками). На сухожильной хорде митрального клапана видна подвижная, вытянутая по форме вегетация (10 х 2 мм)
После лечения антибиотиками (сульбактам/ампициллин и гентамицин) общее состояние пациентки улучшилось. Температура тела пришла в норму уже на 5-й день, количество лейкоцитов вернулось к нормальному уровню (8600/мм3). На 6-й день значительно снизился уровень С-реактивного белка (5,09 мг/дл). Исследования крови, проведенные на 7-й день и в последующие дни, не выявили роста количества бактерий, однако уровень С-реактивного белка оставался незначительно повышенным (около 2,0 мг/дл). На 14-й день было проведено эхокардиографическое исследование, которое выявило уменьшение размеров вегетаций на створке клапана и сухожильной хорде до 2 х 1 и 5 х 1 мм соответственно. Тем не менее, на 20-й день у пациентки появились сильные боли в области поясницы. Уровень лейкоцитов был в норме (5900/мм3), но уровень С-реактивного белка увеличился до 3,1 мг/дл. На 21-й день было проведено МРТ-исследование поясничного отдела позвоночника, которое выявило очаги гнойного спондилита позвонков L1 и L2. Несмотря на отсутствие бактерий в посеве крови на 21-й день было продолжено лечение антибиотиками, при этом сульбактам/ампициллин и гентамицин были заменены на меропенем внутривенно. Впоследствии течение болезни было благоприятным, боли в пояснице уменьшились. На 35-й день была проведена трансторакальная эхокардиография, подтвердившая полное исчезновение вегетаций. На 54-й день уровень С-реактивного белка снизился до 0,34 мг/дл. Лечение меропенемом было прекращено, пациентка была выписана на 56-й день. По рекомендации хирургов-ортопедов, ей был назначен прием левофлоксацина (500 мг/сут.) в течение двух месяцев после выписки из стационара. Спустя два месяца уровень С-реактивного белка пришел в норму. Через три месяца после выписки пациентка прошла эндоскопическое и колоноскопическое обследования, которые не выявили патологических изменений. Результаты МРТ поясничного отдела позвоночника пришли в норму через семь месяцев. Также пациентка не принимала алкоголь в течение 12 месяцев, и в течение этого периода ее состояние было стабильным.
Обсуждение
ИЭ, вызванный E. coli, встречается редко и чаще всего обнаруживается у женщин, в особенности страдающих сахарным диабетом [1]. Тем не менее, данный вид ИЭ встречается и у более молодых пациентов. Fayyaz et al. [6] сообщают о том, что E. сoli была обнаружена у 8,4% больных с ИЭ в возрасте 20–40 лет. Также сообщается, что выделенные E. coli были чувствительны к амикацину и амоксилину/клавуланату не более чем в 60% случаев. Другие исследования показали, что треть всех случаев ИЭ, не вызванных бактериями группы HACEK, были спровоцированы грамотрицательными палочковидными бактериями, чаще всего E. coli [7, 8]. Эти данные говорят о большей, чем считалось ранее, распространенности ИЭ, вызванного E. coli. Ввиду высокой внутрибольничной смертности и частой необходимости кардиальных хирургических вмешательств для лечения данного типа ИЭ [1] врачам необходимо пристально следить за клиническим течением болезни у таких пациентов с ИЭ. К тому же несмотря на то, что бактерии, выделенные из посева крови, оказались чувствительными к сульбактаму и гентамицину, применение обоих антибиотиков не смогло предотвратить развитие гнойного спондилита. Интересно, что заболевание началось через три недели после госпитализации. Это может свидетельствовать о недостаточном распределении антибиотиков в организме, поскольку формирование сосудов в пораженных участках кости происходит в течение 3–4 недель, и лишь после этого антибиотик начинает воздействовать непосредственно на очаг [9].
Истории болезней
В настоящий момент в базе данных PubMed находится информация о 32 случаях ИЭ, вызванного E. coli за последние 30 лет [10-32]. В данном исследовании проанализировано всего 33 случая: 32 из базы данных и вышеописанный (Таблица 2). Пациенты - 13 мужчин и 16 женщин; пол оставшихся четырех пациентов не установлен. Средний возраст пациентов составляет 59,6 ± 19,8 лет (52,4 ± 21,2 для мужчин и 64,3 ± 17,2 для женщин). Чаще всего поражался МК (в 15 случаях, из них 4 случая поражения искусственных клапанов) [11, 13, 16, 17, 20, 22, 25, 27, 30, 32], вторым по восприимчивости к инфекции был аортальный клапан (АК) (11 случаев, из них 4 с поражением искусственного клапана) [12, 14, 15, 16, 23, 24, 30, 31]. У одного из пациентов отмечалось поражение и МК, и АК [28]. Отмечены два случая неклапанного ИЭ [26, 29]. Также поражались трехстворчатый и легочный клапаны: вегетации наблюдались у трех и одного пациентов соответственно [1, 18, 19, 21].
Таблица 2. Обзор случаев эндокардита, вызванного Escherichia coli, за последние 30 лет
Сопутствующие заболевания
У семи пациентов, помимо ИЭ (E. coli), был диагностирован сахарный диабет [11, 16, 25, 30, 32], у троих в анамнезе были онкологические заболевания [13, 16], примечательно, что у троих пациентов в анамнезе было злоупотребление алкоголем [14, 19]. У трех пациентов имелись заболевания почек [27, 29, 31]. Двум из них была показана заместительная почечная терапия [27, 29], при этом одному из них было назначено лечение преднизолоном и циклофосфамидом [27]; еще один пациент перенес трансплантацию почки [31]. Такие заболевания, как диабет, онкологические заболевания, а также лечение гемодиализом, сопряжены с недостаточностью иммунной системы. Одно из предыдущих исследований выявило склонность к ИЭ, не связанному с грамотрицательными бактериями группы НАСЕК, у пациентов с циррозом печени [33]. Следует отметить, что у трех пациентов из представленного нами обзора в анамнезе присутствует злоупотребление алкоголем, при этом у некоторых имелись признаки цирроза. При хроническом употреблении алкоголя повреждается слизистая оболочка кишечника, что способствует проникновению E. coli в кровеносную систему и в пищеварительный тракт. Как правило, очаги заражения грамотрицательными возбудителями ИЕ, не относящимися к НАСЕК, формируются в мочевыводящих путях [33, 34]. Кроме того, чрезмерное употребление алкоголя может быть самостоятельным фактором риска развития ИЭ, вызванного E. coli. Пациенты, проходящие заместительную почечную терапию, также склонны к заболеванию эндокардитом [35]. Таким образом, сопутствующие заболевания и состояния (диабет, онкологические заболевание, злоупотребление алкоголем и лечение гемодиализом) можно рассматривать как факторы риска развития ИЭ, вызванного E. coli. У 52% (17 из 33) пациентов развитию заболевания предшествовало поражение мочевыводящих путей [12-15, 20, 21, 25, 28, 30, 31, 32]. Посевы мочи 36% пациентов (12 из 33) подтвердили присутствие E. Coli [12-15, 20, 21, 25, 31, 32].
Поражение нативных и искусственных клапанов
Ранее считалось, что эндокардит, не связанный бактериями группы НАСЕК, чаще возникает у людей, употребляющих наркотики внутривенно. Тем не менее, доля таких пациентов составляет лишь 4% из всех, кто страдает этим заболеванием [33]. В данный обзор эта категория пациентов не включена. Установлено, что E. coli чаще обнаружена у пациентов с искусственными клапанами: у 33% (5 из 15) пациентов с эндокардитом МК и у 36% (4 из 11) пациентов с эндокардитом АК клапаны были заменены на искусственные (Таблица 3). В представленном нами обзоре частота случаев вызванного E. coli ИЭ искусственного клапана несколько выше, чем в ранее опубликованных исследованиях (7–25%) [36]. Недавний анализ реестра проспективных когортных исследования группы международного сотрудничества по эндокардиту(ICE-PCS) показал рост числа случаев заболевания ИЭ, не связанных с бактериями группы HACEK среди пациентов с имплантированными эндоваскулярными устройствами, в т. ч. искусственными клапанами, кардиостимуляторами и имплантируемыми кардиовертерами-дефибрилляторами [33]. Данная динамика может относиться к пациентам с ИЭ, вызванным E. coli. Однако 67% исследованных пациентов, страдающих ИЭ E. coli, имели нативные клапаны [10-21, 24, 25, 27, 28, 30, 31, 32]. Из этих 22 пациентов у 7 наблюдались дегенеративные заболевания клапанов, это составляет не более 32% (7 из 22) случаев ЭИ нативных клапанов, вызванного E. coli. Напротив, 68% (15 из 22) пациентов с ИЭ нативных клапанов, вызванным E. coli, в анамнезе отсутствовали дегенеративные заболевания клапанов. Это идет вразрез со статистикой случаев ИЭ, вызванных такими распространенными возбудителями, как стрептококки, стафилококки и энтерококки, так как у приблизительно 70% таких пациентов наблюдаются дегенеративные заболевания клапанов [37]. Причины, по которым нативные клапаны более подвержены заражению E. coli, неизвестны. Согласно данному исследованию, у 52% (17 из 33) пациентов до или во время выявления ИЭ имелись инфекционные поражения мочевыводящих путей [12-16, 20, 21, 25, 28, 30, 31, 32]. Отмечается, что у 12 пациентов из 17 бактерии обнаруживались как в моче, так и в крови, причем у 13 пациентов из 17 были поражены нативные клапаны [12, 13, 14, 15, 16, 20, 21, 25]. Это свидетельствует о том, что вирулентность внекишечных E. coli, обитающих в мочевыводящих путях, может иметь прямое отношение к развитию ИЭ. Недавние исследования показали, что среди внекишечных патогенных штаммов E. coli преобладают штаммы типа В2, для которых характерен ряд факторов вирулентности, способствующих проникновению бактерий в эндотелий сердца [38, 39]. Кроме того, по данным реестра ICE-PCS, у 90% пациентов с ИЭ, вызванным бактериями, не входящими в группу НАСЕК, с начала заболевания до установки диагноза проходит один или более месяц [33]. Нередко это становится причиной последующего длительного недостаточного лечения, в результате чего увеличивается вероятность инфекции нативных клапанов. Следует отметить, что в 48% случаев (16 из 33), включая описываемый нами, отсутствовала информация о первичных источниках заражения E. coli. Поэтому при обследовании пациентов, зараженных E. coli, важно правильно составлять список дифференциальных диагнозов ИЭ, вызванного E. coli.
Таблица 3. Характеристики инфекционного эндокардита искусственных и естественных клапанов, вызванного E. Coli
Осложнения, возникшие в ходе лечения в стационаре
У пациентов с ИЭ, не связанным с бактериями группы НАСЕК, отмечались такие осложнения, как периферическая эмболия, застойная сердечная недостаточность и абсцессы фиброзных колец клапанов [33]. Из пациентов, включенных в данный обзор, у восьми (24%) имелась периферическая эмболия [10, 11, 14, 16, 18, 19, 30, 32], у шести (22%) – застойная сердечная недостаточность [11, 12, 13, 16, 20, 25]. Абсцессы участков полости сердца или фиброзных колец отмечались у 8 (18%) пациентов [12, 15, 16,23,30]. Инфекционный миокардит, способствовавший развитию аневризмы левого желудочка, был отмечен у двух (6%) пациентов [13, 20]. Интересно, что у двух пациентов (6%) была обнаружена атриовентрикулярная блокада, при этом у одного наблюдался эндокардит с поражением трехстворчатого клапана, у остальных – атриального клапана на фоне абсцесса фиброзного кольца [21, 23]. Из этого следует, что инвазивная инфекция миокарда, вызванная E. coli, и последующее разрушение миокарда могут наступить до того, как изменения будут обнаружены посредством эхокардиографии. Также у шести (18%) пациентов [16, 25, 27] наблюдалась почечная недостаточность. Более того, у четырех (12%) пациентов были диагностированы суппуративный остеомиелит и спондилодисцит [16, 19, 20]. При лечении ИЭ, вызванного E. coli, специалистам необходимо обследовать пациентов на предмет осложнений со стороны опорно-двигательной системы.
Лечение и исход
Американская кардиологическая ассоциация рекомендует использовать комбинационную терапию бета-лактамными антибиотиками (пенициллинами, цефалоспоринами или карбапенемами) и либо аминогликозидом, либо фторхинолоном в течение 6 недель для лечения пациентов с ИЭ, не вызванным группой бактерий НАСЕК [5]. Из 31 пациента, для которых имеется информация об используемых антибиотиках, 6 (20%) получали пенициллины [10, 16, 17, 23, 26], 14 (45%) – цефемамы и (или) пенициллины [11-16, 25, 28-31], и 11 (35%) – карбапенемы и/или иные бета-лактамы [16-22, 24, 27, 30, 31, 32]. Хотя лишь у шести пациентов обнаружены E. coli, экспрессирующие бета-лактамазу расширенного спектра (БЛРС), треть всех пациентов получали карбапенемы. Интересно, что пятеро из шести БЛРС-положительных пациентов были успешно вылечены с помощью карбапенемов без хирургических вмешательств. Это говорит о важности своевременного назначения лечения карбапенемами в случае необходимости, поскольку E. coli могут оказаться устойчивыми к бета-лактамам, например за счет индуцируемых бета-лактамаз, что не всегда учитывается во время рутинных лабораторных in vitro исследований наличия устойчивости к антибиотикам [5]. Поэтому при выборе бета-лактамов для лечения ИЭ, вызванного E. coli, следует учитывать фактор устойчивости бактерий, связанный с бета-лактамазами. Аминогликозиды и фторхинолоны применялись вместе с бета-лактамами и карбаперенемами при лечении 21 и 7 пациентов соответственно [10, 11, 13, 15-18, 20, 21, 23, 25, 26, 27, 28, 30, 31]. Четверо пациентов, помимо бета-лактамов и карбапенемов, лечились аминогликозидами и фтороквиндолонами, и трое из этих четырех нуждались в хирургическом лечении несмотря на инфекцию не экспрессирующими БЛРС E.coli [16, 25, 27]. Поэтому для определения степени необходимости хирургического вмешательства важно тщательно обследовать пациентов с ИЭ E. coli.
Среди пациентов с ИЭ, не связанным с бактериями НАСЕК, не было отмечено значимых различий в уровне смертности между теми, кто получал медикаментозное лечение и теми, кто перенес хирургическое вмешательство. Уровни внутрибольничной и смертности по причине кардиологического хирургического вмешательства составляли 24% и 51% соответственно [33]. Среди исследованных пациентов с ИЭ, вызванном E. coli, уровень смертности и частоты хирургических вмешательств составили 21% (7 из 33) и 42% (14 из 33) соответственно [10-16, 18, 20, 23, 25, 29, 30, 32]. Из пациентов, описанных в данном обзоре, более половины (4 из 7) скончались в течение 1 месяца после госпитализации [11, 12, 13, 16, 29]. Между тем, из 14 прооперированных пациентов, у шести (43%) наблюдался эндокардит искусственного клапана, у восьми (57%) – эндокардит нативного клапана. В восьми случаях была проведена имплантация клапанов (4 аортальных и 4 митральных) [14, 15, 16, 20, 23, 25]; один пациент перенес аннулопластику [16]. Двум пациентам была проведена резекция створок без пересадки самих клапанов, в основном – пациентам с эндокардитом трехстворчатого и легочного клапанов [10, 18]. Для трех пациентов точные данные о хирургическом лечении отсутствуют [30]. Один из пациентов скончался спустя 9 месяцев после лечения [30], однако случаев смерти в условиях стационара на послеоперационной стадии зарегистрировано не было, что свидетельствует о важности своевременного принятия решения о проведении операции. К недостаткам нашего обследования можно отнести отсутствие данных чреспищеводных эхокардиограмм по состоянию МК ввиду отказа пациентов от прохождения процедуры и невозможности проведения полноценного статистического анализа данных по ИЭ, вызванному E. coli, из-за ограниченного числа пациентов. В то же время результаты обозначили несколько важных особенностей ИЭ, вызванного E.coli.
Вывод
Данный обзор показал, что у пациентов с диабетом, онкологическими заболеваниями, чрезмерным употреблением алкоголя или проходящих заместительную почечную терапию нативные клапаны, не подверженные дегенеративной вальвулопатии, более чувствительны к эндокардиту, вызванному E. coli, чем искусственные клапаны. Периферическая эмболия, застойная сердечная недостаточность и абсцессы фиброзных колец являются наиболее серьезными и распространенными осложнениями ИЭ, вызванного E. coli. К другим осложнениям можно отнести возникновение желудочковой аневризмы и атриовентрикулярной блокады в результате инфекционного миокардита, которые встречаются реже. Цефемы и карбапенемы часто используются при лечении ИЭ; уровень смертности и частота оперативных вмешательств при данной терапии составляют 21% и 42% соответственно. В случаях появления у E. coli устойчивости к антибиотикам специалистам следует своевременно принимать решение о проведении хирургического вмешательства.
Список литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Нобухиро Акудзава, Масахико Курабаяси
BMC Cardiovascular Disorders201818:195
Аннотация
Обоснование
Инфекционный эндокардит, вызванный кишечной палочкой (Escherichia coli), встречается редко, однако частота данного заболевания увеличивается, особенно среди женщин пожилого возраста. Кроме того, смертность от эндокардита, вызванного Escherichia coli, выше, чем от эндокардита, вызванного грамотрицательными бактериями группы НАСЕК (Haemophilus spp., Aggregatibacter spp., Cardiobacterium hominis, Eikenella corrodens и Kingela spp.).
Описание клинического случая
По причине высокой температуры в стационар поступила 58-летняя гражданка Японии с избыточным употреблением алкоголя в анамнезе. Диагноз «инфекционный эндокардит» установлен на основании результатов повторных посевов крови и трансторакальной эхокардиографии, которая выявила вегетации на передней створке и сухожильных хордах митрального клапана. Несмотря на лечение сульбактамом/ампициллином и гентамицином, во время пребывания в стационаре у пациентки развился гнойный спондилит, требовавший проведения 6-недельного курса лечения меропенемом до устранения проявлений эндокардита. Пациентка принимала левофлоксацин внутрь в течение двух месяцев, и спондилит был полностью излечен через семь месяцев после возникновения.
Вывод
Escherichia coli поражает нативные клапаны, не вызывая при этом прогрессирующую вальвулопатию; искусственные клапаны не подвержены заболеванию. Наибольшему риску подвергаются пациенты с ослабленной иммунной системой, злоупотребляющие алкоголем, либо проходящие процедуру гемодиализа. Эмболия периферических сосудов, застойная сердечная недостаточность и абсцессы колец клапанов – наиболее часто встречающиеся осложнения инфекционного эндокардита. Также может развиться инфекционный миокардит. Смертность и частота оперативных вмешательств составляют 21% и 42% соответственно. При развитии устойчивости заболевания к лечению антибиотиками лечащему врачу следует принять решение о хирургическом вмешательстве.
Ключевые слова
- Escherichia coli
- Злоупотребление алкоголем
- Инфекционный эндокардит
- Гнойный спондилит
Инфекционный эндокардит (ИЭ), вызванный Escherichia coli, является достаточно редким заболеванием и наблюдается примерно в 0,51% случаев ИЭ [1]. С 1909 по 2002 гг. в литературе описано 36 случаев эндокардита нативных клапанов сердца, вызванных E. coli, которые отвечают критериям Дьюка. Наиболее частой причиной развития заболевания являлись инфекции мочевыводящих путей. [2]. Низкая заболеваемость ИЭ объясняется неспособностью данного вида бактерий к удерживанию на внутренней оболочке сердца, а также наличием в плазме крови антител к E. сoli [3]. Тем не менее, следует отметить, что количество случаев ИЭ, вызванного E. coli, среди людей старше 70 лет заметно выросло, при этом около 70% пациентов – женщины пожилого возраста [2]. Кроме того, смертность от ИЭ, вызванного E. coli, выше (21%), чем от ИЭ, вызванного грамотрицательными бактериями группы НАСЕК (4%), такими как Haemophilus spp., Aggregatibacter spp., Cardiobacterium hominis, Eikenella corrodens и Kingela spp. [1, 4].
В данной публикации описан клинический случай ИЭ нативного клапана, вызванного инфекцией E. coli. Пациентку доставили в стационар для обследования по причине повышения температуры неизвестной этиологии. Повторные посевы крови выявили присутствие E. coli, однако E. coli не обнаружена в посевах мокроты и мочи. Трансторакальная эхокардиография выявила две вегетации на передней створке митрального клапана (МК) и ее хордах. Во время нахождения в стационаре у пациентки развилось осложнение в виде гнойного спондилита. После 8-недельного курса лечения антибиотиками пациентка была выписана без видимых осложнений.
Описание клинического случая
Женщина 58 лет, гражданка Японии, была доставлена в больницу в карете скорой помощи с жалобами на общее недомогание, боли в пояснице и повышение температуры тела неизвестной этиологии. Анамнез жизни пациентки и семейный анамнез не отягощены. Хотя женщина не курила, она в течение 30 лет употребляла от 60 до 80 г алкоголя ежедневно. В течение последних 10 лет у нее отмечались нарушения в работе печени.
При поступлении рост пациентки составлял 158 см, вес – 56,2 кг, температура тела – 39.5°C. Артериальное давление составляло 101/60 мм рт. ст. Частота сердечных сокращений – 106 ударов в минуту. При клиническом осмотре аномалий не выявлено. Сознание было ясным, однако отмечалось затруднение дыхания на выдохе, при этом насыщенность кислородом артериальной крови составляла 94%, парциальное давление кислорода – 72 мм рт. ст., углекислого газа – 27,2 мм рт. столба. В ходе рентгенографического исследования грудной клетки не было выявлено признаков пневмонии или застоя крови в легких. Электрокардиография показала наличие синусовой тахикардии, других отклонений обнаружено не было. Линейная компьютерная томография шеи, грудной клетки, брюшной полости, а также ультразвуковое исследование брюшной полости не выявили серьезных отклонений за исключением жирового гепатоза печени. Лабораторные исследования крови показали повышенное содержание лейкоцитов, ферментов печени, остаточного азота мочевины, креатинина, мочевой кислоты, С-реактивного белка (СРБ), а также мозгового натрийуретического пептида; выявлены гипопротеинемия и гипокалемия (см. табл. 1) Ревматоидный фактор в плазме крови не обнаружен. Анализ мочи показал присутствие кетоновых тел, однако в мочевом осадке отклонений обнаружено не было. Посевы крови, мочи и мокроты были взяты сразу же после поступления пациентки в стационар. Внутривенная терапия сульбактамом/ампициллином (9 г в сутки) началась в день госпитализации.
Таблица 1. Результаты лабораторных исследований при поступлении пациентки в стационар
На второй день температура оставалась повышенной. Посев мокроты не выявил значительного роста патогенных микроорганизмов, моча была стерильной. Тем не менее, в посеве крови были обнаружены грамотрицательные палочковидные бактерии. Последующее эхокардиографическое обследование выявило две вегетации, одна из которой находилась на передней створке МК, ее размер составлял приблизительно 4 х 1 мм (рис. 1a). Вторая вегетация находилась на сухожильных хордах рядом с задней папиллярной мышцей и имела больший размер (10 х 2 мм) (рис. 1b, c). На основании этих данных на 2-й день была назначена комбинированная терапия антибиотиками, в том числе сульбактамом/ампициллином (9 г/сутки) и гентамицином (80 мг/сутки). Повторные посевы крови проводились на 2-й и 3-й дни и показали присутствие грамотрицательных палочковидных бактерий. На 6-й день бактерии определены как E. сoli, чувствительные ко всем препаратам. На основании этих показателей в соответствии с модифицированными критериями Дьюка [5] был поставлен диагноз «инфекционный эндокардит». В тот же день пациентка была осмотрена офтальмологом и дерматологом - патологии, связанные с ИЭ, не обнаружены. На 7-й день была проведена компьютерная томография грудной клетки и брюшной полости с контрастированием. Значительных отклонений выявлено не было. На 8-й день проведены магнитно-резонансная томография и ангиография мозга, патологические изменения не обнаружены.
 Рисунок 1. Результаты трансторакальной эхокардиографии, проведенной на 2-й день. А: в парастернальной длинноосевой проекции видна вегетация на передней створке митрального клапана (4 × 1 мм), см. белую стрелку. b, c: парастернальные длинноосевые томограммы, сделанные в пресистоле (b) и конце диастолы (С) (показано белыми стрелками). На сухожильной хорде митрального клапана видна подвижная, вытянутая по форме вегетация (10 х 2 мм)
Рисунок 1. Результаты трансторакальной эхокардиографии, проведенной на 2-й день. А: в парастернальной длинноосевой проекции видна вегетация на передней створке митрального клапана (4 × 1 мм), см. белую стрелку. b, c: парастернальные длинноосевые томограммы, сделанные в пресистоле (b) и конце диастолы (С) (показано белыми стрелками). На сухожильной хорде митрального клапана видна подвижная, вытянутая по форме вегетация (10 х 2 мм)После лечения антибиотиками (сульбактам/ампициллин и гентамицин) общее состояние пациентки улучшилось. Температура тела пришла в норму уже на 5-й день, количество лейкоцитов вернулось к нормальному уровню (8600/мм3). На 6-й день значительно снизился уровень С-реактивного белка (5,09 мг/дл). Исследования крови, проведенные на 7-й день и в последующие дни, не выявили роста количества бактерий, однако уровень С-реактивного белка оставался незначительно повышенным (около 2,0 мг/дл). На 14-й день было проведено эхокардиографическое исследование, которое выявило уменьшение размеров вегетаций на створке клапана и сухожильной хорде до 2 х 1 и 5 х 1 мм соответственно. Тем не менее, на 20-й день у пациентки появились сильные боли в области поясницы. Уровень лейкоцитов был в норме (5900/мм3), но уровень С-реактивного белка увеличился до 3,1 мг/дл. На 21-й день было проведено МРТ-исследование поясничного отдела позвоночника, которое выявило очаги гнойного спондилита позвонков L1 и L2. Несмотря на отсутствие бактерий в посеве крови на 21-й день было продолжено лечение антибиотиками, при этом сульбактам/ампициллин и гентамицин были заменены на меропенем внутривенно. Впоследствии течение болезни было благоприятным, боли в пояснице уменьшились. На 35-й день была проведена трансторакальная эхокардиография, подтвердившая полное исчезновение вегетаций. На 54-й день уровень С-реактивного белка снизился до 0,34 мг/дл. Лечение меропенемом было прекращено, пациентка была выписана на 56-й день. По рекомендации хирургов-ортопедов, ей был назначен прием левофлоксацина (500 мг/сут.) в течение двух месяцев после выписки из стационара. Спустя два месяца уровень С-реактивного белка пришел в норму. Через три месяца после выписки пациентка прошла эндоскопическое и колоноскопическое обследования, которые не выявили патологических изменений. Результаты МРТ поясничного отдела позвоночника пришли в норму через семь месяцев. Также пациентка не принимала алкоголь в течение 12 месяцев, и в течение этого периода ее состояние было стабильным.
Обсуждение
ИЭ, вызванный E. coli, встречается редко и чаще всего обнаруживается у женщин, в особенности страдающих сахарным диабетом [1]. Тем не менее, данный вид ИЭ встречается и у более молодых пациентов. Fayyaz et al. [6] сообщают о том, что E. сoli была обнаружена у 8,4% больных с ИЭ в возрасте 20–40 лет. Также сообщается, что выделенные E. coli были чувствительны к амикацину и амоксилину/клавуланату не более чем в 60% случаев. Другие исследования показали, что треть всех случаев ИЭ, не вызванных бактериями группы HACEK, были спровоцированы грамотрицательными палочковидными бактериями, чаще всего E. coli [7, 8]. Эти данные говорят о большей, чем считалось ранее, распространенности ИЭ, вызванного E. coli. Ввиду высокой внутрибольничной смертности и частой необходимости кардиальных хирургических вмешательств для лечения данного типа ИЭ [1] врачам необходимо пристально следить за клиническим течением болезни у таких пациентов с ИЭ. К тому же несмотря на то, что бактерии, выделенные из посева крови, оказались чувствительными к сульбактаму и гентамицину, применение обоих антибиотиков не смогло предотвратить развитие гнойного спондилита. Интересно, что заболевание началось через три недели после госпитализации. Это может свидетельствовать о недостаточном распределении антибиотиков в организме, поскольку формирование сосудов в пораженных участках кости происходит в течение 3–4 недель, и лишь после этого антибиотик начинает воздействовать непосредственно на очаг [9].
Истории болезней
В настоящий момент в базе данных PubMed находится информация о 32 случаях ИЭ, вызванного E. coli за последние 30 лет [10-32]. В данном исследовании проанализировано всего 33 случая: 32 из базы данных и вышеописанный (Таблица 2). Пациенты - 13 мужчин и 16 женщин; пол оставшихся четырех пациентов не установлен. Средний возраст пациентов составляет 59,6 ± 19,8 лет (52,4 ± 21,2 для мужчин и 64,3 ± 17,2 для женщин). Чаще всего поражался МК (в 15 случаях, из них 4 случая поражения искусственных клапанов) [11, 13, 16, 17, 20, 22, 25, 27, 30, 32], вторым по восприимчивости к инфекции был аортальный клапан (АК) (11 случаев, из них 4 с поражением искусственного клапана) [12, 14, 15, 16, 23, 24, 30, 31]. У одного из пациентов отмечалось поражение и МК, и АК [28]. Отмечены два случая неклапанного ИЭ [26, 29]. Также поражались трехстворчатый и легочный клапаны: вегетации наблюдались у трех и одного пациентов соответственно [1, 18, 19, 21].
Таблица 2. Обзор случаев эндокардита, вызванного Escherichia coli, за последние 30 лет
Сопутствующие заболевания
У семи пациентов, помимо ИЭ (E. coli), был диагностирован сахарный диабет [11, 16, 25, 30, 32], у троих в анамнезе были онкологические заболевания [13, 16], примечательно, что у троих пациентов в анамнезе было злоупотребление алкоголем [14, 19]. У трех пациентов имелись заболевания почек [27, 29, 31]. Двум из них была показана заместительная почечная терапия [27, 29], при этом одному из них было назначено лечение преднизолоном и циклофосфамидом [27]; еще один пациент перенес трансплантацию почки [31]. Такие заболевания, как диабет, онкологические заболевания, а также лечение гемодиализом, сопряжены с недостаточностью иммунной системы. Одно из предыдущих исследований выявило склонность к ИЭ, не связанному с грамотрицательными бактериями группы НАСЕК, у пациентов с циррозом печени [33]. Следует отметить, что у трех пациентов из представленного нами обзора в анамнезе присутствует злоупотребление алкоголем, при этом у некоторых имелись признаки цирроза. При хроническом употреблении алкоголя повреждается слизистая оболочка кишечника, что способствует проникновению E. coli в кровеносную систему и в пищеварительный тракт. Как правило, очаги заражения грамотрицательными возбудителями ИЕ, не относящимися к НАСЕК, формируются в мочевыводящих путях [33, 34]. Кроме того, чрезмерное употребление алкоголя может быть самостоятельным фактором риска развития ИЭ, вызванного E. coli. Пациенты, проходящие заместительную почечную терапию, также склонны к заболеванию эндокардитом [35]. Таким образом, сопутствующие заболевания и состояния (диабет, онкологические заболевание, злоупотребление алкоголем и лечение гемодиализом) можно рассматривать как факторы риска развития ИЭ, вызванного E. coli. У 52% (17 из 33) пациентов развитию заболевания предшествовало поражение мочевыводящих путей [12-15, 20, 21, 25, 28, 30, 31, 32]. Посевы мочи 36% пациентов (12 из 33) подтвердили присутствие E. Coli [12-15, 20, 21, 25, 31, 32].
Поражение нативных и искусственных клапанов
Ранее считалось, что эндокардит, не связанный бактериями группы НАСЕК, чаще возникает у людей, употребляющих наркотики внутривенно. Тем не менее, доля таких пациентов составляет лишь 4% из всех, кто страдает этим заболеванием [33]. В данный обзор эта категория пациентов не включена. Установлено, что E. coli чаще обнаружена у пациентов с искусственными клапанами: у 33% (5 из 15) пациентов с эндокардитом МК и у 36% (4 из 11) пациентов с эндокардитом АК клапаны были заменены на искусственные (Таблица 3). В представленном нами обзоре частота случаев вызванного E. coli ИЭ искусственного клапана несколько выше, чем в ранее опубликованных исследованиях (7–25%) [36]. Недавний анализ реестра проспективных когортных исследования группы международного сотрудничества по эндокардиту(ICE-PCS) показал рост числа случаев заболевания ИЭ, не связанных с бактериями группы HACEK среди пациентов с имплантированными эндоваскулярными устройствами, в т. ч. искусственными клапанами, кардиостимуляторами и имплантируемыми кардиовертерами-дефибрилляторами [33]. Данная динамика может относиться к пациентам с ИЭ, вызванным E. coli. Однако 67% исследованных пациентов, страдающих ИЭ E. coli, имели нативные клапаны [10-21, 24, 25, 27, 28, 30, 31, 32]. Из этих 22 пациентов у 7 наблюдались дегенеративные заболевания клапанов, это составляет не более 32% (7 из 22) случаев ЭИ нативных клапанов, вызванного E. coli. Напротив, 68% (15 из 22) пациентов с ИЭ нативных клапанов, вызванным E. coli, в анамнезе отсутствовали дегенеративные заболевания клапанов. Это идет вразрез со статистикой случаев ИЭ, вызванных такими распространенными возбудителями, как стрептококки, стафилококки и энтерококки, так как у приблизительно 70% таких пациентов наблюдаются дегенеративные заболевания клапанов [37]. Причины, по которым нативные клапаны более подвержены заражению E. coli, неизвестны. Согласно данному исследованию, у 52% (17 из 33) пациентов до или во время выявления ИЭ имелись инфекционные поражения мочевыводящих путей [12-16, 20, 21, 25, 28, 30, 31, 32]. Отмечается, что у 12 пациентов из 17 бактерии обнаруживались как в моче, так и в крови, причем у 13 пациентов из 17 были поражены нативные клапаны [12, 13, 14, 15, 16, 20, 21, 25]. Это свидетельствует о том, что вирулентность внекишечных E. coli, обитающих в мочевыводящих путях, может иметь прямое отношение к развитию ИЭ. Недавние исследования показали, что среди внекишечных патогенных штаммов E. coli преобладают штаммы типа В2, для которых характерен ряд факторов вирулентности, способствующих проникновению бактерий в эндотелий сердца [38, 39]. Кроме того, по данным реестра ICE-PCS, у 90% пациентов с ИЭ, вызванным бактериями, не входящими в группу НАСЕК, с начала заболевания до установки диагноза проходит один или более месяц [33]. Нередко это становится причиной последующего длительного недостаточного лечения, в результате чего увеличивается вероятность инфекции нативных клапанов. Следует отметить, что в 48% случаев (16 из 33), включая описываемый нами, отсутствовала информация о первичных источниках заражения E. coli. Поэтому при обследовании пациентов, зараженных E. coli, важно правильно составлять список дифференциальных диагнозов ИЭ, вызванного E. coli.
Таблица 3. Характеристики инфекционного эндокардита искусственных и естественных клапанов, вызванного E. Coli
Осложнения, возникшие в ходе лечения в стационаре
У пациентов с ИЭ, не связанным с бактериями группы НАСЕК, отмечались такие осложнения, как периферическая эмболия, застойная сердечная недостаточность и абсцессы фиброзных колец клапанов [33]. Из пациентов, включенных в данный обзор, у восьми (24%) имелась периферическая эмболия [10, 11, 14, 16, 18, 19, 30, 32], у шести (22%) – застойная сердечная недостаточность [11, 12, 13, 16, 20, 25]. Абсцессы участков полости сердца или фиброзных колец отмечались у 8 (18%) пациентов [12, 15, 16,23,30]. Инфекционный миокардит, способствовавший развитию аневризмы левого желудочка, был отмечен у двух (6%) пациентов [13, 20]. Интересно, что у двух пациентов (6%) была обнаружена атриовентрикулярная блокада, при этом у одного наблюдался эндокардит с поражением трехстворчатого клапана, у остальных – атриального клапана на фоне абсцесса фиброзного кольца [21, 23]. Из этого следует, что инвазивная инфекция миокарда, вызванная E. coli, и последующее разрушение миокарда могут наступить до того, как изменения будут обнаружены посредством эхокардиографии. Также у шести (18%) пациентов [16, 25, 27] наблюдалась почечная недостаточность. Более того, у четырех (12%) пациентов были диагностированы суппуративный остеомиелит и спондилодисцит [16, 19, 20]. При лечении ИЭ, вызванного E. coli, специалистам необходимо обследовать пациентов на предмет осложнений со стороны опорно-двигательной системы.
Лечение и исход
Американская кардиологическая ассоциация рекомендует использовать комбинационную терапию бета-лактамными антибиотиками (пенициллинами, цефалоспоринами или карбапенемами) и либо аминогликозидом, либо фторхинолоном в течение 6 недель для лечения пациентов с ИЭ, не вызванным группой бактерий НАСЕК [5]. Из 31 пациента, для которых имеется информация об используемых антибиотиках, 6 (20%) получали пенициллины [10, 16, 17, 23, 26], 14 (45%) – цефемамы и (или) пенициллины [11-16, 25, 28-31], и 11 (35%) – карбапенемы и/или иные бета-лактамы [16-22, 24, 27, 30, 31, 32]. Хотя лишь у шести пациентов обнаружены E. coli, экспрессирующие бета-лактамазу расширенного спектра (БЛРС), треть всех пациентов получали карбапенемы. Интересно, что пятеро из шести БЛРС-положительных пациентов были успешно вылечены с помощью карбапенемов без хирургических вмешательств. Это говорит о важности своевременного назначения лечения карбапенемами в случае необходимости, поскольку E. coli могут оказаться устойчивыми к бета-лактамам, например за счет индуцируемых бета-лактамаз, что не всегда учитывается во время рутинных лабораторных in vitro исследований наличия устойчивости к антибиотикам [5]. Поэтому при выборе бета-лактамов для лечения ИЭ, вызванного E. coli, следует учитывать фактор устойчивости бактерий, связанный с бета-лактамазами. Аминогликозиды и фторхинолоны применялись вместе с бета-лактамами и карбаперенемами при лечении 21 и 7 пациентов соответственно [10, 11, 13, 15-18, 20, 21, 23, 25, 26, 27, 28, 30, 31]. Четверо пациентов, помимо бета-лактамов и карбапенемов, лечились аминогликозидами и фтороквиндолонами, и трое из этих четырех нуждались в хирургическом лечении несмотря на инфекцию не экспрессирующими БЛРС E.coli [16, 25, 27]. Поэтому для определения степени необходимости хирургического вмешательства важно тщательно обследовать пациентов с ИЭ E. coli.
Среди пациентов с ИЭ, не связанным с бактериями НАСЕК, не было отмечено значимых различий в уровне смертности между теми, кто получал медикаментозное лечение и теми, кто перенес хирургическое вмешательство. Уровни внутрибольничной и смертности по причине кардиологического хирургического вмешательства составляли 24% и 51% соответственно [33]. Среди исследованных пациентов с ИЭ, вызванном E. coli, уровень смертности и частоты хирургических вмешательств составили 21% (7 из 33) и 42% (14 из 33) соответственно [10-16, 18, 20, 23, 25, 29, 30, 32]. Из пациентов, описанных в данном обзоре, более половины (4 из 7) скончались в течение 1 месяца после госпитализации [11, 12, 13, 16, 29]. Между тем, из 14 прооперированных пациентов, у шести (43%) наблюдался эндокардит искусственного клапана, у восьми (57%) – эндокардит нативного клапана. В восьми случаях была проведена имплантация клапанов (4 аортальных и 4 митральных) [14, 15, 16, 20, 23, 25]; один пациент перенес аннулопластику [16]. Двум пациентам была проведена резекция створок без пересадки самих клапанов, в основном – пациентам с эндокардитом трехстворчатого и легочного клапанов [10, 18]. Для трех пациентов точные данные о хирургическом лечении отсутствуют [30]. Один из пациентов скончался спустя 9 месяцев после лечения [30], однако случаев смерти в условиях стационара на послеоперационной стадии зарегистрировано не было, что свидетельствует о важности своевременного принятия решения о проведении операции. К недостаткам нашего обследования можно отнести отсутствие данных чреспищеводных эхокардиограмм по состоянию МК ввиду отказа пациентов от прохождения процедуры и невозможности проведения полноценного статистического анализа данных по ИЭ, вызванному E. coli, из-за ограниченного числа пациентов. В то же время результаты обозначили несколько важных особенностей ИЭ, вызванного E.coli.
Вывод
Данный обзор показал, что у пациентов с диабетом, онкологическими заболеваниями, чрезмерным употреблением алкоголя или проходящих заместительную почечную терапию нативные клапаны, не подверженные дегенеративной вальвулопатии, более чувствительны к эндокардиту, вызванному E. coli, чем искусственные клапаны. Периферическая эмболия, застойная сердечная недостаточность и абсцессы фиброзных колец являются наиболее серьезными и распространенными осложнениями ИЭ, вызванного E. coli. К другим осложнениям можно отнести возникновение желудочковой аневризмы и атриовентрикулярной блокады в результате инфекционного миокардита, которые встречаются реже. Цефемы и карбапенемы часто используются при лечении ИЭ; уровень смертности и частота оперативных вмешательств при данной терапии составляют 21% и 42% соответственно. В случаях появления у E. coli устойчивости к антибиотикам специалистам следует своевременно принимать решение о проведении хирургического вмешательства.
Список литературы
- Morpeth S, Murdoch D, Cabell CH, Karchmer AW, Pappas P, Levine D, et al. International collaboration on endocarditis prospective cohort study (ICE-PCS) investigators. Non-HACEK gram-negative bacillus endocarditis. Ann Intern Med. 2007;147:829–35. View ArticleGoogle Scholar
- Micol R, Lortholary O, Jaureguy F, Bonacorsi S, Bingen E, Lefort A, et al. Escherichia coli native valve endocarditis. Clin Microbiol Infect. 2006;12:401–3. View ArticleGoogle Scholar
- Watanakunakorn C, Burket T. Infective endocarditis in a large community teaching hospital, 1980-1990. A review of 210 episodes. Medicine. 2013;72:90–102. View ArticleGoogle Scholar
- Chambers ST, Murdoch D, Morris A, Holland D, Pappas P, Almela M, et al. International collaboration on endocarditis prospective cohort study investigators. HACEK infective endocarditis: characteristics and outcomes from a large, multinational cohort. PLoS One. 2013;e63181:8. Google Scholar
- Baddour LM, Wilson WR, Bayer AS, Fowler VG, Tleyjeh IM, Rybak MJ, et al. Infective endocarditis in adults: diagnosis, antimicrobial therapy, and management of complications. Circulation. 2015;132:1435–86. View ArticleGoogle Scholar
- Fayyaz I, Rasheed MA, Ashraf M, Bukhsh A, Wadood A. Determination of bacterial etiological agents, sensitivity pattern and clinical outcome of patients with bacterial endocarditis at Punjab Institute of Cardiology. Lahore J Pak Med Assoc. 2014;64:1384–8. PubMedGoogle Scholar
- Loubet P, Lescure FX, Lepage L, Kirsch M, Armand-Lefevre L, Bouadma L, et al. Endocarditis due to gram-negative bacilli at a French teaching hospital over 6-year period: clinical characteristics and outcome. Infect Dis (Lond). 2015;47:889–95. View ArticleGoogle Scholar
- Muñoz P, Cruz AF, Rodríguez-Créixems M, Bouza E. Gram-negative bloodstream infections. Int J Antimicrob Agents. 2008;32(suppl. 1):S10–4. View ArticleGoogle Scholar
- Spellberg B, Lipsky BA. Systemic antibiotic therapy for chronic osteomyelitis in adults. Clin Infect Dis. 2012;54:393–407. View ArticleGoogle Scholar
- Murray NH, Cheesman MG, Millar-Craig M. Echocardiographic demonstration of Escherichia coli endocarditis restricted to the pulmonary valve. Br Heart J. 1988;80:452–4. View ArticleGoogle Scholar
- Watanakunakorn C, Kim J. Mitral valve endocarditis caused by a serum-resistant strain of Escherichia coli. Clin Infect Dis. 1992;14:501–5. View ArticleGoogle Scholar
- Raymond NJ, Robertson MD, Land SD. Aortic valve endocarditis due to Escherichia coli. Clin Infect Dis. 1992;15:749–50. View ArticleGoogle Scholar
- Oosterbosch L, Oei F, Rogiers P, Vaerenberg M, Ranquin R, Nagler J. Escherichia coliendocarditis of a native valve with paraventricular aneurysm formation and fatal hemopericardium. Acta Cardiol. 1996;51:535–40. PubMedGoogle Scholar
- Morrison DJ, Sperling LS, Schwartz DA, Felner JM. Escherichia coli endocarditis of a native aortic valve. Arch Pathol Lab Med. 1997;121:1292–5. PubMedGoogle Scholar
- Soma J, Stakkevold TI, Henriksen AZ. Escherichia coli endocarditis of the aortic valve with formation of a paravalvular abscess cavity. Echocardiography. 2005;22:129–31. View ArticleGoogle Scholar
- Branger S, Casalta JP, Habib G, Collard F. Escherichia coli endocarditis: seven new cases in adults and review of the literature. Eur J Clin Microbiol Infect Dis. 2005;24:537–41. View ArticleGoogle Scholar
- Kulas T, Habek D. Infective puerperal endocarditis caused by Escherichia coli. J Perinat Med. 2006;34:342–3. View ArticleGoogle Scholar
- Foley JA, Augustine D, Bond R, Boyce K, Maciver D. Lost without Occam’s razor: Escherichia coli tricuspid valve endocarditis in a non-intravenous drug user. BMJ Case Rep 2010;pii:bcr0220102769. Google Scholar
- Tsutsumi T, Hiraoka E, Kanazawa K, Akita H, Eron LJ. Diagnosis of E. coli tricuspid valve endocarditis: a case report. Hawaii Med J. 2010;69:286–8. PubMedPubMedCentralGoogle Scholar
- Lauridsen TK, Arpi M, Fritz-Hansen T, Fromodt-Moller N, Bruun NE. Infectious endocarditis caused by Escherichia coli. Scand J Infect Dis. 2011;43:545–6. View ArticleGoogle Scholar
- Fordyce CB, Leather RA, Partlow E, Swiggum EA. Complete heart block associated with tricuspid valve endocarditis due to extended spectrum β-lactamase-producing Escherichia coli. Can J Cardiol. 2011;263:e17–20. Google Scholar
- Modi HH, Modi SH, Siddiqui BR, Andreoni JM. A rare case of prosthetic valve endocarditis caused by extended-spectrum β-lactamase producing Escherichia coli. J Glob Infect Dis. 2011;3:99–101. View ArticleGoogle Scholar
- Senel AC, Ondrush J. A case of Echerichia coli endocarditis after hemorrhoidectomy performed by a herbalist. Balkan Med J. 2012;29:201–2.View ArticleGoogle Scholar
- Lupse M, Flonta M, Straut M, Usein CR, Tantau M, Serban A. Recurrent infective endocarditis of the native aortic valve due to ESBL-producing Escherichia coli (E.coli) after therapeutic ERCP. J Gastrointestin Liver Dis. 2012;21:217–9.PubMedGoogle Scholar
- Rangarajan D, Ramakrishnan S, Parto KC, Devaraj S, Krishnamurthy V, Kothari Y, et al. Native valve Escherichia coli endocarditis following urosepsis. Indian J Nephrol. 2013;23:232–4.View ArticleGoogle Scholar
- Gupta SK, Nanda V, Malviya P, Jacobs N, Naheed Z. An unusual case of early onset persistent Escherichia coli septicemia associated with endocarditis. Am J Perinatal Rep. 2013;3:105–6.View ArticleGoogle Scholar
- Spaleniak S, Romejko-Ciepielewska K, Lubas A, Ryczek R, Niemczyk S. Infective endocarditis in the course of urosepsis E. coli ESBL(+) in a patient with Goodpasture’s syndrome. Kardiol Pol. 2015;73:670.View ArticleGoogle Scholar
- Chen CA, Lin ZZ, Yu WL, Wu WS. Escherichia coli endocarditis of native aortic valve and mitral valve. J Formos Med Assoc. 2015;114:893–4.View ArticleGoogle Scholar
- Tsai MH, Leu JG, Fang YW, Hsieh SC. Necrotizing fasciitis and infective endocarditis caused by Escherichia coli in a hemodialysis patient. Hemodial Int. 2015;19:E41–4.View ArticleGoogle Scholar
- Loubet P, Lescure FX, Lepage L, Kirsch M, Armand-Lefevre L, Bouadma L, et al. Endocarditis due to gram-negative bacilli at a French teaching hospital over a 6-year period: clinical characteristics and outcome. Infect Dis (Lond). 2015;47:889–95.View ArticleGoogle Scholar
- Menon T, Balakrishman N, Somasundaram S, Dhandapani P. Native valve endocarditis caused by Escherichia coli. J Clin Diag Res. 2017;11:DD05–6.Google Scholar
- Kim CJ, Yi JE, Kim Y, Choi HJ. Emphysematous endocarditis caused by AMKЦ beta-lactamase-producing Escherichia coli. Medicine (Baltimore). \2018;97:e9620.View ArticleGoogle Scholar
- Raza SS, Sultan OW, Sohail MR. Gram-negative bacterial endocarditis in adults: state-of-the-heart. Expert Rev Anti-Infect Ther. 2010;8:879–85.View ArticleGoogle Scholar
- Tsiaoussis GI, Assimakopoulos SF, Tsamandas AC, Triantos CK, Thomopoulos KC. Intestinal barrier dysfunction in cirrhosis: current concepts in pathophysiology and clinical ИПМlications. World J Hepatol. 2015;7:2058–68.View ArticleGoogle Scholar
- Chaudry MS, Carison N, Gislason GH, Kamper AL, Rix M, Fowler VG Jr, et al. Risk of infective endocarditis in patients with end stage kidney disease. Clin J Am Soc Nephrol. 2017;12:1814–22.View ArticleGoogle Scholar
- Mylonakis E, Calderwood SB. Infective endocarditis in adults. N Engl J Med. 2001;345:1318–30.View ArticleGoogle Scholar
- Pierce D, Calkins BC, Thornton K. Infectious endocarditis: diagnosis and treatment. Am Fam Physician. 2012;85:981–6.PubMedGoogle Scholar
- Micenková L, Bosák J, Vrba M, Ševčíková A, Šmajs D. Human extraintestinal pathogenic Escherichia coli strains differ in prevalence of virulence factors, phylogroups, and bacteriocin determinants. BMC Microbiol. 2016;16:218.View ArticleGoogle Scholar
- Russo TA, Johnson JR. Proposal for a new inclusive designation for extraintestinal pathogenic isolates of Escherichia coli: ExPEC. J Infect Dis. 2000;181:1753–4.View ArticleGoogle Scholar





