2239
27 Августа 2021
Авторское право © 2018, Elke Parsi, Norman Bitterlich, Anne Winkelmann, Daniela Rösler, Christine Metzner (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эльке Парси, Норман Биттерлих, Анна Винкельманн, Даниэла Рёслер, Кристин Метцнер
BMC Cardiovascular Disorders201818:220
Аннотация
Введение
Аритмии сердца (АС) очень распространены и могут возникать на фоне болезни сердца или изолированно. Причинами этих нарушений могут быть к...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эльке Парси, Норман Биттерлих, Анна Винкельманн, Даниэла Рёслер, Кристин Метцнер
BMC Cardiovascular Disorders201818:220
Аннотация
Введение
Аритмии сердца (АС) очень распространены и могут возникать на фоне болезни сердца или изолированно. Причинами этих нарушений могут быть к...
Авторское право © 2018, Elke Parsi, Norman Bitterlich, Anne Winkelmann, Daniela Rösler, Christine Metzner (doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эльке Парси, Норман Биттерлих, Анна Винкельманн, Даниэла Рёслер, Кристин Метцнер
BMC Cardiovascular Disorders201818:220
Аннотация
Введение
Аритмии сердца (АС) очень распространены и могут возникать на фоне болезни сердца или изолированно. Причинами этих нарушений могут быть компоненты метаболического синдрома (МС) или дефицит микроэлементов, особенно магния, калия, витаминов группы B и коэнзима Q10. Обе причины могут также влиять друг на друга. Резистентность к инсулину (инсулинорезистентность, ИР) является фактором риска возникновения диастолической дисфункции. Одним из предварительных результатов настоящего пилотного исследования была оценка влияния диетического вмешательства со специфическими микроэлементами на снижение уровней ИР у пациентов с АС с целью улучшения функции левого желудочка (ЛЖ).
Методы
Был проведен анализ рандомизированного двойного слепого плацебо-контролируемого пилотного исследования у пациентов с CA (ЖЭС, НЖЭ, НЖ тахикардией), которые были привлечены к участию в исследовании с использованием данных от пациентов в возрасте от 18 до 75 лет из клиники амбулаторной кардиологической практики (Outpatient Practice of Cardiology). Аритмии оценивали по данным суточного мониторирования ЭКГ по Холтеру и стандартной эхокардиографии. Метаболизм глюкозы измеряли по уровню глюкозы и инсулина в крови натощак, а также индексу инсулинорезистентности HOMA-IR (Homeostasis Model Assessment of Insulin Resistance) в начале исследования и после шести недель приема пищевых добавок.
Результаты
В общей сложности 54 пациента с АС, распределенные по группам случайным образом, получали либо специфическую комбинацию микроэлементов, либо плацебо. Диетическое вмешательство привело к значительному снижению уровня инсулина в крови натощак ≥58 пмоль/л (р = 0,020) и индекса HOMA-IR (р = 0,053) в экспериментальной группе через шесть недель. В то же время после вмешательства в экспериментальной группе улучшились показатели диастолической функции ЛЖ: отмечено значительное снижение индекса массы миокарда ЛЖ (р = 0,003), а также тенденция как к уменьшению толщины межжелудочковой перегородки (р = 0,053), так и к увеличению соотношения E/A (р = 0,051). С другой стороны, экстрасистолии (ЭС) оставались неизменными в экспериментальной группе.
Выводы
В этом пилотном исследовании диетическое вмешательство с применением определенного сочетания микроэлементов в качестве дополнения к сопутствующей терапии препаратами для лечения заболеваний сердечно-сосудистой системы, по-видимому, улучшает кардиометаболическое здоровье у пациентов с АС. Необходимо проведение дальнейших исследований.
Регистрация исследования
Исследование было одобрено Международным Фрайбургским комитетом по этике (Freiburg Ethics Commission International) и ретроспективно зарегистрировано в международном реестре клинических исследований Национального института здоровья США, Clinical Trials.gov с идентификационным номером ID NCT 02652338 16 декабря 2015 года.
Ключевые слова
Наджелудочковые (НЖЭС) и желудочковые экстрасистолы (ЖЭС) являются очень распространенными типами аритмии у пациентов с сердечно-сосудистыми патологиями. Частота возникновения НЖЭС на электрокардиограмме (ЭКГ) в покое составляет 10–20% [1], ЖЭС – 5–10% [2]. С возрастом их доля возрастает. Пациенты с такими компонентами метаболического синдрома, как артериальная гипертензия (АГ), абдоминальное ожирение, сахарный диабет 2 типа (СД2), нарушение толерантности к глюкозе (НТГ) или HOMA-IR, помимо АС различной степени тяжести также демонстрируют нарушения обмена в сердечной мышце и функции ЛЖ. У пациентов с абдоминальным ожирением НТГ, обусловленное ИР, уже на ранней стадии приводит к изменениям диастолической функции сердца различной степени тяжести [3, 4]. Диастолическую дисфункцию описывают с помощью различных параметров [5, 6], но в соответствии с действующими рекомендациями ESC по диагностике и лечению острой и хронической сердечной недостаточности, одним из важных параметров для описания диастолической функции является индекс массы миокарда левого желудочка (ИММЛЖ) [7].
Были опубликованы многочисленные исследования терапевтических вмешательств с применением магния [8, 9, 10, 11, 12], калия [13], витаминов группы B [14, 15, 16, 17, 18, 19] и коэнзима Q10 [20, 21, 22, 23, 24] и при лечении АС и кардиометаболических факторов риска. Недостаточное обеспечения организма магнием может быть клинически значимым триггером АС, а также быть связано с различными компонентами метаболического синдрома, такими как СД2 и инсулинорезистентность, а также с лечением ингибиторами протонной помпы [25] и диуретиками [12]. Гипомагниемия может быть вызвана недостаточным пероральным приемом магния внутрь, повышенным выделением почками, диареей или алкоголизмом. Гипомагниемия также часто сочетается с гипокалиемией [26].
Одна из целей этого пилотного исследования - выявление возможности улучшения функции ЛЖ у больных с нарушениями метаболизма глюкозы через шесть недель ежедневного диетического вмешательства с применением определенной комбинации микроэлементов.
Методы
Исследование популяции
Был проведен апостериорный анализ рандомизированного двойного слепого плацебо-контролируемого пилотного исследования у пациентов с АС, отобранных для участия в исследовании среди пациентов в возрасте 18–75 лет в клинике Outpatient Practice of Cardiology в Берлине, Германия. С апреля 2014 года по июль 2015 года было обследовано 74 пациента европеоидной расы с различными типами аритмии сердца (ЖЭС, НЖЭС, НЖ тахикардией). В целом, пациенты, которые завершили исследование, совершали пять посещений клиники Outpatient Practice of Cardiology. Во время первого посещения пациенты были подробно проинформированы об исследовании, были проведены необходимые исследования на предмет критериев включения в исследование и исключения. При условии соблюдения критериев и подписания пациентом письменного информированного согласия на участие в исследовании во время второго посещения пациентам выдавали таблетки плацебо в рамках вводного периода исследования. Время третьего посещения помечали как начальную временную точку, снова проводили обследование на предмет критериев включения и исключения, и пациенты были распределены по группам случайным образом. Следующее посещение происходило после трехнедельной фазы проведения вмешательства, перед шестинедельным периодом наблюдения.
Критериями включения являлись следующие показатели: ≥ 500 ЖЭС или ≥ 200 НЖЭС или ≥ 10 НЖ тахикардия при мониторировании ЭКГпо Холтеру в течение 18 часов. Основными критериями исключения были: возраст > 75 лет, ФВЛЖ ≤40%, прием спиронолактона> 50 мг/сут., торасемида> 20 мг/сут., прием витаминов и минералов, гипо- или гиперкалиемия, гипо- или гипермагниемия, нарушение функции почек, гипертиреоз, наличие кардиостимулятора, острая или хроническая диарея. Четырнадцать обследованных пациентов не соответствовали критериям включения: у них не было необходимого количества наджелудочковых или желудочковых экстрасистол, а у одного пациента была гипомагниемия.
На рисунке 1 показан профиль исследования 74 обследованных пациентов. Все включенные субъекты получали плацебо (две таблетки два раза в день) в течение однонедельного вводного периода исследования. После оценки мониторирования ЭКГ по Холтеру в начальной точке исследования и проверки на предмет критериев включения 60 пациентов были случайным образом распределены в экспериментальную (группа приема терапевтического средства) или контрольную (группа приема плацебо) группы. Продолжительность диетического вмешательства составила шесть недель. Во время рандомизированного двойного слепого, плацебо-контролируемого пилотного исследования участники должны были принимать по две таблетки два раза в день терапевтического средства (5 ккал, 145,8 мг магния, 469,2 мг калия, 3,0 мкг витамина В12, 400,0 мкг фолиевой кислоты, 48,0 мг ниацина и 60,0 мг коэнзима Q10) или плацебо (микрокристаллическая целлюлоза) с 200 мл воды.
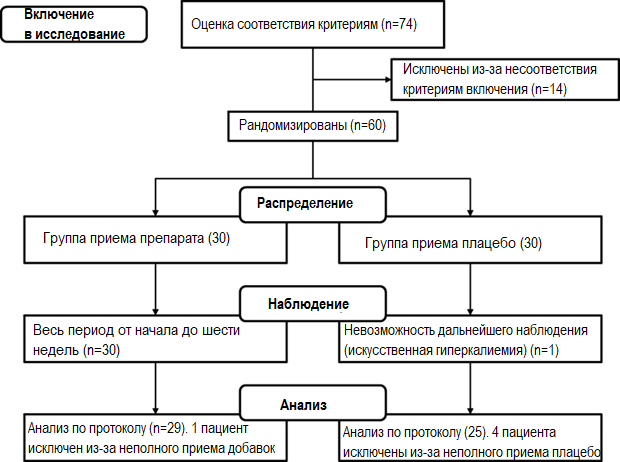 Рисунок 1. Профиль исследования
Рисунок 1. Профиль исследования
Исходы в отношении метаболизма глюкозы и функции ЛЖ
Поисковые исходы были представлены изменениями индекса HOMA-IR и функции ЛЖ после шести недель диетического вмешательства у пациентов с АС.
Клинические измерения компонентов метаболического синдрома
В начале исследования окружность талии (ОТ) определяли с помощью гибкой ленты с погрешностью измерений близким к 0,5 см. ОТ измеряли посередине между нижним краем ребра и гребнем подвздошной кости после обычного выдоха и в положении стоя. МС определяли с применением диагностических критериев International Diabetes Federation (IDF) [27]. Для соответствия определению IDF необходимы увеличение ОТ, а именно ≥94 см и ≥ 80 см для европейских мужчин и женщин соответственно, и любые два из следующих четырех компонентов: систолическое артериальное давление (АД) ≥ 130 мм рт. ст. или диастолическое АД ≥ 85 мм рт. ст., или лечение гипертонии, триглицериды (TG) ≥ 1,7 ммоль/л, холестерин-ЛПВП (Х-ЛПВП) < 1,29 ммоль/л у женщин и < 1,03 ммоль/л у мужчин или лечение нарушения липидного обмена, уровень глюкозы натощак ≥ 5,6 ммоль/л или ранее поставленный диагноз СД2. ОТ и отношение окружности талии к росту (ОТР) > 0,5 являются косвенными показателями абдоминального ожирения [28, 29].
Кроме того, эхокардиография (GE Medical Systems, Vivid S6), а также стандартная ЭКГ в 12 отведениях в покое (отведения по Эйнтховену, Голдбергу, Уилсону) были проведены и записаны на CUSTO CARD (программное обеспечение custo med GmbH, Мюнхен), как и мониторирование ЭКГ по Холтеру (CUSTO FLASH 500 Multiday, программное обеспечение custo med GmbH, Мюнхен) в течение не менее 18 часов. Результаты ЭКГ в покое и мониторирование по Холтеру анализировали с помощью компьютера с применением Миннесотского кода [30]. НЖЭС и ЖЭС были выявлены с помощью программного обеспечения и подтверждены двумя кардиологами.
Эхокардиографические исследования были выполнены двумя кардиологами в стандартных видах [31]: парастернальный доступ по длинной оси левого желудочка в 2D, с цветным допплеровским картированием и в М-режиме, парастернальный позиция приносящего и выносящего тракта ПЖ в 2D и с цветным допплеровским картированием, четырех-, пяти- и двухкамерные позиции, регистрируемые с верхушки сердца, 2D и с цветным допплеровским картированием, , позиция апикальной длинной оси, регистрируемая с верхушки сердца, в 2D и с цветным допплеровским картированием, а также измерение скорости кровотока через митральный клапан, аорту и трехстворчатый клапан, тканевая допплерография митрального кольца (показатель движения латерального края) в четырехкамерной позиции в соответствии с рекомендациями [32]. Верхний предел для ИММЛЖ у мужчин составляет ≥115 г/м2,,а у женщин ≥95 г/м2 [7]. Все параметры ЭХО-КГ, включая ИММЛЖ, были получены с помощью оборудования Vivid 6, GE Medical Systems, Ver. 11.2.0 b. 40.
Образцы крови и мочи для биохимической оценки были собраны в начальной точке исследования, через три и после шести недель диетического вмешательства (рис. 2).
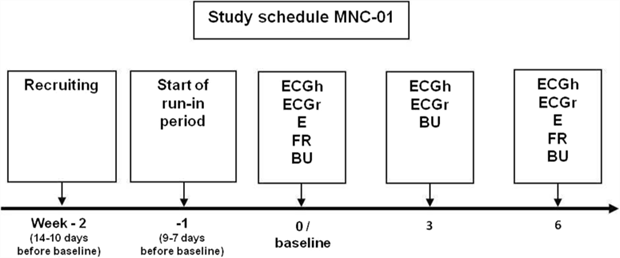 Рисунок 2. График исследования. Рекрутинг/начало вводного периода: при первом посещении пациенты были подробно проинформированы об исследовании, были проведены необходимые исследования для определения соответствия критериям включения и исключения. При условии соблюдения критериев и подписания пациентом письменного информированного согласия на участие в исследовании во время второго посещения пациентам выдавали таблетки плацебо в рамках вводного периода исследования. Начальная точка исследования: критерии включения и исключения были еще раз проверены, затем пациенты были распределены по группам случайным образом. Кроме того, антропологические параметры собирали при каждом посещении
Рисунок 2. График исследования. Рекрутинг/начало вводного периода: при первом посещении пациенты были подробно проинформированы об исследовании, были проведены необходимые исследования для определения соответствия критериям включения и исключения. При условии соблюдения критериев и подписания пациентом письменного информированного согласия на участие в исследовании во время второго посещения пациентам выдавали таблетки плацебо в рамках вводного периода исследования. Начальная точка исследования: критерии включения и исключения были еще раз проверены, затем пациенты были распределены по группам случайным образом. Кроме того, антропологические параметры собирали при каждом посещении
Используемые сокращения: E – эхокардиография; ECG – электрокардиограмма; ECGr – эхокардиография в покое; ECGh – мониторирование ЭКГ – по Холтеру; FR – трехдневная запись рациона; BU – образцы крови и мочи.
Лабораторные тесты
Все лабораторные анализы были проведены лабораторией Schottdorf MVZ GmbH, Аугсбург, Германия. Анализы содержания глюкозы (гексокиназный метод), гамма-глутамилтрансферазы (IFCC метод), гликированного гемоглобина (HbA1c) (турбидиметрический ингибиторный иммуноанализ, TINIA), инсулина (ECLIA), общего холестерина (TC) (метод CHOD-PAP), Х_ЛПНП и Х_ЛПВП(ферментативный колориметрический тест), ТГ (метод GPO-PAP) и чувствительный к CRP тест (турбидиметрический метод) проводили на анализаторе Roche. 24-часовую экскрецию магния и калия с мочой анализировали методом атомно-абсорбционной спектрометрии. HOMA являлся мерой для оценки инсулинорезистентности. HOMA-IR рассчитывали по концентрациям инсулина и глюкозы.
Статистический анализ
Статистические сравнения были сделаны между группами с использованием непараметрического U-критерия Манна-Уитни. Непараметрический критерий Уилкоксона применяли для сравнения данных в разные моменты времени внутри групп. Различия между категоризированными переменными были определены с помощью точного критерия Фишера. Влияние ковариат было проанализировано с помощью дисперсионного анализа (ANOVA). Все статистические тесты проводили в отношении популяции по протоколу и являлись двусторонними. Различия считали статистически значимыми при p <0,05. Данные представлены как среднее значение ± стандартное отклонение (SD). Линейное регрессионное моделирование было выполнено для выявления изменений различных компонентов кардиометаболических параметров в зависимости от ИММЛЖ и концентрации магния в сыворотке крови. Индекс размера эффекта d-Коэна определи как отношение разницы между двумя средними значениями к SD для данных. Порог значения размера эффекта (effect size, ES): маленький 0,20, средний 0,50, большой 0,80, очень большой 1,30 [33]. Приведены первый и третий квартили (Q1 и Q3 соответственно). Все анализы проводили с использованием программного обеспечения SPSS® для Windows (версия 22.0).
Результаты
Характеристики пациентов
Пятьдесят четыре пациента были оценены по протоколу, из них - 29 в экспериментальной группе и 25 в контрольной группе (рис. 1). Шесть пациентов не закончили исследование в соответствии с протоколом: у одного пациента в контрольной группе была искусственная гипергликемия, пять пациентов из исследуемой популяции потребляли менее 95% от назначения согласно исследованию (8%), четверо из этих пациентов были в контрольной группе.
О серьезных побочных эффектах на фоне диетического вмешательства не сообщалось. Один пациент из основной группы и один из контрольной группы сообщили о боли в желудке. Это могло быть вызвано приемом добавки. Прием добавок прекращен не был.
Предшествующие заболевания и лекарства
Артериальная гипертензия (АГ) была наиболее частым предшествующим заболеванием (65,5% в экспериментальной группе, 52,0% в контрольной группе). Ишемическая болезнь сердца (ИБС) была представлена у 27,6% пациентов в экспериментальной группе и у 28,0% в контрольной группе. Долгосрочное медикаментозное лечение бета-блокаторами, ингибиторами АПФ / антагонистами рецептора AT II, блокаторами кальциевых каналов, а также спиронолактоном было назначено 21 пациенту (72,4%) в экспериментальной группе и 16 пациентам (64,0%) в контрольной группе. СД2 был обнаружен у 10,3% пациентов в экспериментальной группе и у 8,0% в контрольной группе. В начальной точке исследования у 68,5% пациентов была дислипидемия (68,9% в экспериментальной, 68,0% в контрольной). Лечение статинами было зарегистрировано у 34,5% в экспериментальной группе и у 28,0% в контрольной группе. Дополнительные исходные характеристики обеих групп показаны в таблице 1.
Таблица 1. Исходные характеристики пациентов
Метаболический синдром и его компоненты
Индекс массы тела (ИМТ) ≥ 25 кг/м2 был зарегистрирован у 65,5% экспериментальной группы и у 72,0% контрольной группы в начале исследования. Абдоминальное ожирение с ОТР ≥0,5 было обнаружено в 72,4% экспериментальной группы и в 80,0% контрольной группы (таблица 1). Количество пациентов с критериями МС в соответствии с IDF по сравнению с исходным уровнем к концу исследования уменьшилось в экспериментальной группе с 16 до 15, а в контрольной группе увеличилось с 8 до 12. При исходном уровне у пяти пациентов (17,2%) в экспериментальной группе и у четырех (16,0%) в контрольной группе была атерогенная дислипидемия, а в конце исследования у четырех пациентов в экспериментальной группе (13,8%) и у 3 (12,0%) в контрольной группе.
Функция ЛЖ
У всех пациентов в начале исследования конечно-диастолический диаметр правого желудочка (КДДПЖ), левое предсердие (ЛП), конечно-систолический диаметр левого желудочка (КСДЛЖ), конечно-диастолический диаметр левого желудочка (КДДЛЖ), фракция выброса левого желудочка (ФВЛЖ), межжелудочковая перегородка (МЖП) и задняя стенка левого желудочка (ЗСЛЖ) были в пределах нормы. Тем не менее, у пациентов с ФВЛЖ 54–65% наблюдалось значительное увеличение ФВЛЖ (p = 0,020, ES = 0,995, Q1; Q3: 0,5; 15,0) в экспериментальной группе после вмешательства (Таблица 2).
Таблица 2. Изменение характеристик пациента: сравнение эхокардиографических показателей до и после диетического вмешательства
После диетического вмешательства индекс массы миокарда левого желудочка (ИММЛЖ) значительно снизился в экспериментальной группе (р = 0,003, ES = 0,260, Q1; Q3: -26,5; -2,2). Если различие проводить между мужчинами и женщинами, этот параметр также значительно снижен, особенно за счет уменьшения этого параметра у женщины (р = 0,035). КДДЛЖ (p = 0,050, ES = 0,210, Q1/Q3: -5,0; 1,0) были уменьшены, и улучшилось отношение E/A (p = 0,051, ES = 0,401, Q1; Q3: -0,04; 0,27) в нормальном диапазоне. В контрольной группе подобные результаты не были обнаружены. Но различия между этими двумя группами статистически не значимы.
Линейный регрессионный анализ показал, что ИММЛЖ в экспериментальной группе зависели от исходной концентрации магния в сыворотке крови и ее значения в ходе исследования. Изменение ИММЛЖ зависит от колебаний уровня Х-ЛПВП и диастолического артериального давления. Благоприятные изменения ИММЛЖ при таких условиях были выявлены только в экспериментальной группе. Напротив, подобные результаты в контрольной группе не были продемонстрированы (Таблица 3).
Таблица 3. Изменение ИММЛЖ в зависимости от колебаний уровня Х-ЛПВП и диастолического артериального давления
По тенденции толщина межжелудочковой перегородки была снижена только в экспериментальной группе (p = 0,053, ES = 0,348, Q1; Q3: -2,0; 0,5), в то время как ЗСЛЖ не изменился в обеих группах. С другой стороны, параметры ЛП были значительно увеличены в экспериментальной группе после вмешательства, но в пределах нормального диапазона (p = 0,018, ES = 0,314, Q1; Q3: -0,75; 3,75) (Таблица 2). Кроме того, может быть продемонстрирована значимая корреляция между ИММЛЖ и ЛП у мужчин (р = 0,018), но не у женщин (р = 0,225).
Рассматривая результаты с разбивкой по квартилям HOMA и параметрам функции ЛЖ, можно отметить, что у женщин диаметр ЛП значительно возрастает с поправкой на возраст с квартилями (p = 0,001) и у мужчин КДДЛЖ (p = 0,055) (Таблица 4). Влияние HOMA-квартилей было подтверждено регрессионной моделью.
Таблица 4. HOMA-квартили для ИММЛЖ, ЛП, МЖП, PW и КДДЛЖ у мужчин и женщин
HOMA-IR
В экспериментальной группе уровень глюкозы в плазме крови натощак ≥5,6 ммоль/л был заметно снижен после шести недель диетического вмешательства по сравнению с исходным уровнем (p = 0.055, ES = 0.388, Q1;Q3: -1.30;-0.11), разницы с контрольной группой не обнаружено (р = 0,328, ES = 0,604, Q1; Q3: -0,94; 0,28).
В начале исследования повышенная концентрация инсулина натощак (≥ 58 пмоль/л) была зарегистрирована у 19 пациентов из экспериментальной группы и у 17 пациентов из контрольной группы; нормальный уровень (<58 пмоль/л) у 10 пациентов в экспериментальной группе против восьми пациентов в контрольной группе. Но только в экспериментальной группе наблюдали тенденцию к снижению концентрации инсулина после вмешательства (p = 0,053, ES = 0,232, Q1; Q3: -35,1; 9,4), а у пациентов со значением инсулина натощак ≥58 пмоль/л (p = 0,020, ES = 0,340, Q1; Q3: -42,7; 1,4) она была снижена статистически значимо.
Повышенный индекс HOMA-IR > 2,5 был выявлен у 14 пациентов в экспериментальной группе и у 11 пациентов в контрольной группе. Эугликемическая ИР (FPG <5,6 ммоль/л, HOMA-IR ≥ 2,5) в начале исследования была показана у восьми пациентов в экспериментальной группе и у четырех пациентов в контрольной группе. В конце исследования наблюдали тенденцию к снижению HOMA-IR (р = 0,053, ES = 0,218, Q1; Q3: -1,25; 0,25) в экспериментальной группе, особенно у пациентов с HOMA-IR > 2,5 (p = 0,068, ES = 0,340, Q1; Q3: -2,90; -0,22) (Таблица 5). В конце исследования только у 3 пациентов было показано значение HOMA-IR ≥ 2,5 (р = 0,063), и HOMA-IR ≥ 2,5 (p = 0,625) у двух пациентов в контрольной группе.
Таблица 5. Изменение характеристик пациента: сравнение биохимических показателей до и после диетического вмешательства
Другие биохимические факторы риска возникновения сердечно-сосудистых заболеваний
Все соответствующие биохимические параметры приведены в таблице 5. При подсчете клеток крови показатели всех компонентов были в нормальном диапазоне значений как в экспериментальной группе, так и в контрольной группе, вплоть до значительного снижения лейкоцитов в пределах нормы в экспериментальной группе (p < 0,05). Уровень общего холестерин (ОХ) не изменился в экспериментальной и контрольной группах после диетического вмешательства. Уровень холестерина-ЛПНП (Х-ЛПНП) почти не изменился в экспериментальной группе, а в контрольной группе немного снизился; уровень Х-ЛПВП не был изменен в обеих группах. После диетического вмешательства уровень триглицеридов был значительно повышен в экспериментальной группе (p = 0,011, ES = 0,292, Q1; Q3: -0,01; 0,30), но сохранялся без изменений в контрольной группе. Концентрации ТГ ≥1,7 ммоль/л были обнаружены в начале исследования у 27,6% пациентов в экспериментальной группе и 28,0% в контрольной группе. В конце исследования это соотношение составляло от 31,0 до 20,0%.
Функция почек, измеренная по уровню креатинина и скорости клубочковой фильтрации (СКФ), была нормальной у всех пациентов. После вмешательства изменения концентрации магния в сыворотке крови были значительно выше в экспериментальной группе по сравнению с контрольной группой (р = 0,005, ES = 0,708, Q1; Q3: -0,02; 0,05 против -0,06; 0,01). Уровень калия в сыворотке крови был значительно повышен после вмешательства в экспериментальной группе (р = 0,034, ES = 0,512, Q1; Q3: 0,0; 0,3 против -0,5; 0,1) по сравнению с контрольной группой. Однако увеличение концентрации как магния, так и калия в сыворотке крови после вмешательства было в пределах нормы.
Через 24 ч. экскреция калия с мочой (р = 0,059, ES = 0,326, Q1; Q3: -7,2; 30,2), а также экскреция магния были повышены (р = 0,018, ES = 0,507, Q1; Q3: -0,18; 1,66) в экспериментальной группе. Экскреция магния была значительно выше по сравнению с контрольной группой (р = 0,036, ES = 0,377, Q1; Q3: -0,13; 1,51 против -0,64; 0,46). Такой результат был получен вследствие соблюдения применяемых мер. Нормальная почечная функция может быть показана в результате 24-часового сбора мочи: экскреция альбумина, а также отношение альбумин/креатинин/24 ч. находилось в пределах нормы. Только в экспериментальной группе этот коэффициент был склонен к снижению после диетического вмешательства, в то время как в контрольной группе этот коэффициент был увеличен. Данная разница в обеих группах была снижена (р = 0,083, ES = 0,521, Q1; Q3: -0,09; 0,03 против -0,05; 0,22).
Нарушения ритма
В этом пилотном исследовании можно было наблюдать снижение АД в экспериментальной группе, но этот результат не был статистически значим, вероятно, из-за небольшого числа пациентов и огромной дисперсии значений АД. С другой стороны, в контрольной группе снижение ЖЭС было заметным с той же огромной дисперсией, что и в экспериментальной группе (p = 0,005, ES = 0,369, Q1; Q3: -935,0; 5,0). Частота сердечных сокращений снижалась только в экспериментальной группе (р = 0,027, ES = 0,256, Q1; Q3: -7,8; 0,8) (Таблица 6).
Таблица 6. Изменение характеристик пациента: сравнение суточного мониторирования ЭКГ по Холтеру до и после диетического вмешательства
Изменения осведомленности о симптомах, измеренных по визуальной аналоговой шкале (баллы VAS), также обнаружить не удалось.
Обсуждение
Метаболический синдром и его компоненты
Метаболический синдром - это бремя нашего столетия, и в Германии можно обнаружить его распространенность в зависимости от региона на уровне от 14 до 23% [34].
Предшественники МС, например, нарушенная толерантность к глюкозе, вызванная повышенным уровнем инсулина натощак с последующей инсулинорезистентностью, уже на ранней стадии приводят к структурным изменениям левого желудочка и влияют на диастолическую функцию. Данные факторы, по-видимому, действуют независимо от ИБС, особенно связанные с диастолической дисфункцией или сердечной недостаточностью [4, 5, 35]. Наши знания основаны на экспериментальных [36] и клинических исследованиях, касающихся МС [4, 5, 37, 38] а также на метаанализах [28].
Влияние микроэлементов на патологические процессы при МС изучено лишь частично. Существуют доказательства того, что важную роль играет магний, особенно в метаболизме глюкозы [10]. Кроме того, положительное влияние на метаболизм глюкозы обсуждается в отношении магния и коэнзима Q10 [21, 24]. Влияние коэнзима Q10 на метаболизм глюкозы может быть основано на многофакторных механизмах, т.е. посредством снижения окислительного стресса [39, 40].
В среднем пациенты, включенные в это исследование, имели избыточный вес, при этом абдоминальное ожирение измерялось с помощью ОТ, а также с помощью ОТР. Показатели этих основных компонентов МС, а также уровень глюкозы в плазме крови натощак не изменились после вмешательства. Снижение систолического артериального давления в экспериментальной группе в конце исследования не повлияло на результаты. Поэтому мы не обнаружили снижения показателей компонентов МС в экспериментальной группе. Результаты анализа, по-видимому, позволяют предположить, что эта специфическая комбинация микроэлементов улучшает кардиометаболический профиль у пациентов с АС.
Функция ЛЖ
МС и его компоненты – ИР/СД2, AГ и абдоминальное ожирение – связаны с нарушением функции митохондрий и повышенным уровнем окислительного стресса. Эти патофизиологические механизмы способствуют развитию диастолической дисфункции [4, 35, 37, 38]. Ikee et al. [41] обнаружили, что диастолическая дисфункция на первых порах является бессимптомным нарушением релаксации и/или растяжимости, связанным с нормальной систолической насосной функцией. Это зависит от преднагрузки, конечного диастолического давления и структуры стенки ЛЖ.
Мы обнаружили признаки доклинической диастолической дисфункции ЛЖ в параллели с метаболическими изменениями. Эти данные согласуются с результатами настоящего пилотного исследования при сравнении экспериментальной и контрольной групп. В начале исследования отношение E/A было ниже в экспериментальной группе, чем в контрольной. После вмешательства соотношение E/A значительно улучшилось в экспериментальной группе, но не в контрольной. Диастолическая дисфункция, оцененная по соотношению E/A, ухудшалась в зависимости от количества компонентов МС [42]. Изменения диастолической функции связаны с возрастом [32, 42, 43] и, кроме того, зависят от таких компонентов МС, как избыточный вес, СД2, АГ и ИБС [4, 35]. Кроме того, настоящее исследование показало, что ФВЛЖ может быть улучшена только в том случае, если ее значение изначально находилось в пределах нижней границы нормального диапазона (54–65%). Магний приводит к экономизации сердечной насосной функции [44]. В обзоре стоит отметить, что CoQ10 также улучшает показатели сердечной функции, такие как фракция выброса при сердечной недостаточности [45]. Это может быть подтверждено данным исследованием: результаты демонстрируют значительное улучшение ФВ ≤ 65% в экспериментальной группе, но этот эффект не был статистически значимым при сравнении обеих групп исследования (Таблица 2).
Различные авторы описали, что чем больше компонентов МС представлено, тем значительнее увеличивается распространенность диастолической дисфункции ЛЖ, измеряемой по диаметрам ЛП, левого желудочка и ИММЛЖ [4, 5, 7].
В экспериментальной группе настоящего исследования диаметр ЛП был увеличен и особенно зависим от квартилей HOMA, но не более, чем в верхнем пределе нормы. У мужчин, в отличие от женщин, была продемонстрирована сильная положительная корреляция между ИММЛЖ и ЛП на исходном уровне как признак диастолической дисфункции. Напротив, в контрольной группе этот диаметр был уменьшен. В какой степени НЖЭС имеют отношение к этому процессу, пока неизвестно. Измеренные по значению размера эффекта показатели функциональных параметров в экспериментальной группе в течение шести недель были в большей степени улучшены по сравнению с такими структурными параметрами, как ИММЛЖ. В целом в литературе данные о нарушениях метаболизма глюкозы и трансторакальной эхокардиографической оценке структурных и функциональных параметров не согласуются. Это может быть основано на исключении пожилых людей и пациентов с более высоким ИМТ [46]. В соответствии с исследованиями Rutter et al. [46] и Hwang et al. [47] мы обнаружили эти связи с различными параметрами диастолической дисфункции ЛЖ с помощью трансторакальной эхокардиографии. Аналогичные результаты по функции ЛЖ у пациентов с инсулинорезистентностью и гликемическими нарушениями были описаны Velagaleti et al. [48] с применением МРТ. Эти зависимости чаще были статистически значимыми у мужчин. В целом снижение ИММЛЖ в результате вмешательства в течение шести недель является интересной находкой. Механизмы модификации ИММЛЖ еще не до конца понятны. Принято считать, что артериальная гипертензия способствует развитию гипертрофии ЛЖ. Но изменения в измерении артериального давления в течение 24 часов вносят вклад только в 25–30% вариации массы ЛЖ [49]. Sundström et al. [50] описали в 2000 году, что различные параметры МС сильнее связаны с толщиной стенки ЛЖ и концентрическим ремоделированием, чем с гипертрофией ЛЖ.
Позже может быть показано, что изменения в ИММЛЖ тесно связаны с резистентностью к инсулину у животных и у людей. В эксперименте на животных у мышей в течение трех недель сопоставимо можно было обнаружить развитие структурных изменений из-за резистентности к инсулину [51]. Verma et al. [52] исследовали в 2016 году в подгруппе 10 пациентов с СД2 и провели эхо-исследования в начале исследования и через три месяца. Они обнаружили значительное уменьшение массы ЛЖ и улучшение диастолической функции. Данный механизм пока остается не изученным и нуждается в дальнейших объяснениях.
Влияние на инсулинорезистентность
Различные составы и длительность диетических вмешательств несопоставимы по своим эффектам. По этой причине результаты не согласованы [14, 22].
В настоящем исследовании 27,6% пациентов в экспериментальной группе и 16,0% в контрольной группе демонстрировали эугликемическую ИР, измеренную по HOMA-IR в начале исследования. Это предполагает, что подобные изменения в метаболизме глюкозы могут обнаруживаться у пациентов с избыточным весом задолго до проявления СД2. В конце исследования мы выявили, снижение уровня эугликемической ИР в экспериментальной группе до 10,3% и до 8,0% в контрольной группе. Только в экспериментальной группе эти показатели метаболизма глюкозы снижались после вмешательства (р = 0,063). Значительно повышенные концентрации магния в сыворотке крови в экспериментальной группе по сравнению с контрольной группой после вмешательства были связаны только со значительным снижением HOMA-IR в экспериментальной группе. Chutia и Lynrah [53] показали положительную корреляцию между уровнем инсулина натощак и уровнем HOMA у пациентов с СД2 по сравнению с контрольной группой без диабета. Корреляция между уровнем магния в сыворотке крови и уровнем инсулина натощак была обратной.
Низкие уровни витамина B12 были обнаружены у подростков с ожирением с клиническими признаками ИР [15]. Применение добавок витамина B12, фолата и коэнзима Q10 в этом исследовании было целесообразно по двум причинам: с одной стороны, в целом, большая часть населения испытывает дефицит этих микроэлементов, особенно пожилые люди [54], а с другой стороны, замена может улучшить метаболизм глюкозы со значительным снижением уровня инсулина натощак и HOMA-IR. ИМТ оставался неизменным на протяжении всего шестинедельного исследования.
Описанные эффекты коэнзима Q10 на метаболизм глюкозы различны. При интервенционном приеме коэнзима Q10 у пациентов с МС может быть выявлено положительное влияние на уровень инсулина в сыворотке крови и HOMA-IR [21]. Moazen et al. [20] и Azevedo et al. [5], наоборот, не подтвердили влияние коэнзима Q10 на уровень глюкозы в крови натощак и уровень HbA1C по сравнению с контрольной группой. Другие исследователи [24] обнаружили значительное снижение уровня глюкозы в плазме крови натощак и уровня HbA1C, но не сывороточного инсулина и HOMA-IR. Влияние на липидный профиль благоприятным не было.
Влияние на другие биохимические показатели
Наиболее часто исследуемым веществом является коэнзим Q10. Такие добавки как витамин С, Е, коэнзим Q10 и селен исключительно в комбинации также улучшают метаболизм глюкозы и липидов [22]. Прием фолиевой кислоты у пациентов с СД2 приводит к снижению уровня гомоцистеина, с другой стороны, повышает уровень глутатиона с обратным эффектом на уровень HbA1C, ТГ и Х-ЛПВП [14].
Как и результаты, полученные другими авторами [21, 24], это исследование не показало положительного влияния на липиды (ОХ, ТГ, Х-ЛПНП) со стороны CoQ10, который также назначали в более высоких дозировках.
C-реактивный белок (CrP) был немного повышен у 20 пациентов из экспериментальной группы и у 16 пациентов из контрольной группы. Даже при концентрации CrP в сыворотке > 0,7 мг/л риск слегка повышен [55]. Повышение CrP указывает на пациентов с избыточной массой тела и ожирением, а также с нарушениями обмена веществ, и на более высокий риск сердечно-сосудистых заболеваний. В нашем исследовании CrP был немного снижен после приема диетических добавок и повышен в контрольной группе. Этот эффект может быть связан с потреблением магния посредством приема пищевых добавок [11]. После введения коэнзима Q10 уровень высокочувствительного CrP также снижался, согласно данным Raygan et al. [21] и Shargorodski et al.[22], после приема 60 мг Q10 в сочетании с другими антиоксидантами, такими как витамины С, Е и селен.
Влияние на аритмии сердца
Применение магния и калия играют важную роль в ведении пациентов с АС [9, 12]. АС часто связаны с гипомагниемией, но механизм патологии этого процесса не до конца понятен из-за взаимодействия с другими электролитными нарушениями [44]. Гипомагниемия и гипокалиемия тесно связаны друг с другом, вызывая АС [10]. В этом пилотном исследовании влияние пищевых добавок на ЖЭС, НЖЭС и оценку VAS не может быть показано. Уменьшение ЖЭС в контрольной группе может быть основано на эффекте плацебо. В экспериментальной группе мы обнаружили значительное снижение частоты сердечных сокращений. Это может быть вызвано замедлением скорости проводимости синусового узла при пероральном введении магния [12]. В этом экспериментальном исследовании корреляция между изменениями функции ЛЖ и АС не была обнаружена.
Сильные стороны и ограничения
Сильные стороны этого исследования включают выборку пациентов с сердечно-сосудистыми нарушениями, такими как АГ, ИБС и частыми ЭС, а также средним избыточным весом, которые проходили лечение в клинике Outpatient Practice for Cardiology. Поэтому все были исследованы в одном центре, и все процедуры были проведены в одинаковых стандартизированных условиях. Ограничения заключаются в сравнительно небольшом количестве пациентов и проведении апостериорного анализа. В данном эхокардиографическом исследовании мы обычно не измеряли все параметры диастолической функции. Поскольку выбросы по несколькими параметрам обнаружены у разных пациентов, общая очистка данных представляется неуместной и предпочтение отдается использованию всех имеющихся данных. Тестируемые параметры следует оценивать с учетом состояния остальных пациентов.
Заключение
В данном пилотном исследовании диетическое вмешательство с определенной комбинацией микроэлементов в качестве дополнения к сопутствующей терапии препаратами для лечения заболеваний сердечно-сосудистой системы, по-видимому, улучшает кардиометаботическое состояние пациентов с АС. Диетическое вмешательство привело к значительному снижению уровня инсулина натощак ≥ 58 пмоль/л (р = 0,020), а индекс HOMA-IR снизился в экспериментальной группе через шесть недель (р = 0,053). В то же время после вмешательства в экспериментальной группе улучшились показатели диастолической функции ЛЖ: наблюдали значительное снижение индекса массы миокарда ЛЖ (р = 0,003) и тенденцию к уменьшению толщины межжелудочковой перегородки (р = 0,053), а также увеличению соотношения E/A (p = 0,051). Частота сердечных сокращений была значительно снижена (р = 0,027), но влияние на нарушения ритма, таких как ЭС, было менее выраженным. В обеих группах серьезных побочных эффектов не наблюдалось. Результаты этого пилотного исследования показывают важность проведения дальнейшего анализа.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)
Эльке Парси, Норман Биттерлих, Анна Винкельманн, Даниэла Рёслер, Кристин Метцнер
BMC Cardiovascular Disorders201818:220
Аннотация
Введение
Аритмии сердца (АС) очень распространены и могут возникать на фоне болезни сердца или изолированно. Причинами этих нарушений могут быть компоненты метаболического синдрома (МС) или дефицит микроэлементов, особенно магния, калия, витаминов группы B и коэнзима Q10. Обе причины могут также влиять друг на друга. Резистентность к инсулину (инсулинорезистентность, ИР) является фактором риска возникновения диастолической дисфункции. Одним из предварительных результатов настоящего пилотного исследования была оценка влияния диетического вмешательства со специфическими микроэлементами на снижение уровней ИР у пациентов с АС с целью улучшения функции левого желудочка (ЛЖ).
Методы
Был проведен анализ рандомизированного двойного слепого плацебо-контролируемого пилотного исследования у пациентов с CA (ЖЭС, НЖЭ, НЖ тахикардией), которые были привлечены к участию в исследовании с использованием данных от пациентов в возрасте от 18 до 75 лет из клиники амбулаторной кардиологической практики (Outpatient Practice of Cardiology). Аритмии оценивали по данным суточного мониторирования ЭКГ по Холтеру и стандартной эхокардиографии. Метаболизм глюкозы измеряли по уровню глюкозы и инсулина в крови натощак, а также индексу инсулинорезистентности HOMA-IR (Homeostasis Model Assessment of Insulin Resistance) в начале исследования и после шести недель приема пищевых добавок.
Результаты
В общей сложности 54 пациента с АС, распределенные по группам случайным образом, получали либо специфическую комбинацию микроэлементов, либо плацебо. Диетическое вмешательство привело к значительному снижению уровня инсулина в крови натощак ≥58 пмоль/л (р = 0,020) и индекса HOMA-IR (р = 0,053) в экспериментальной группе через шесть недель. В то же время после вмешательства в экспериментальной группе улучшились показатели диастолической функции ЛЖ: отмечено значительное снижение индекса массы миокарда ЛЖ (р = 0,003), а также тенденция как к уменьшению толщины межжелудочковой перегородки (р = 0,053), так и к увеличению соотношения E/A (р = 0,051). С другой стороны, экстрасистолии (ЭС) оставались неизменными в экспериментальной группе.
Выводы
В этом пилотном исследовании диетическое вмешательство с применением определенного сочетания микроэлементов в качестве дополнения к сопутствующей терапии препаратами для лечения заболеваний сердечно-сосудистой системы, по-видимому, улучшает кардиометаболическое здоровье у пациентов с АС. Необходимо проведение дальнейших исследований.
Регистрация исследования
Исследование было одобрено Международным Фрайбургским комитетом по этике (Freiburg Ethics Commission International) и ретроспективно зарегистрировано в международном реестре клинических исследований Национального института здоровья США, Clinical Trials.gov с идентификационным номером ID NCT 02652338 16 декабря 2015 года.
Ключевые слова
- Диастолическая функция ЛЖ
- ИММЛЖ
- Диетическое вмешательство
- Метаболизм глюкозы
- Экстрасистолы
Наджелудочковые (НЖЭС) и желудочковые экстрасистолы (ЖЭС) являются очень распространенными типами аритмии у пациентов с сердечно-сосудистыми патологиями. Частота возникновения НЖЭС на электрокардиограмме (ЭКГ) в покое составляет 10–20% [1], ЖЭС – 5–10% [2]. С возрастом их доля возрастает. Пациенты с такими компонентами метаболического синдрома, как артериальная гипертензия (АГ), абдоминальное ожирение, сахарный диабет 2 типа (СД2), нарушение толерантности к глюкозе (НТГ) или HOMA-IR, помимо АС различной степени тяжести также демонстрируют нарушения обмена в сердечной мышце и функции ЛЖ. У пациентов с абдоминальным ожирением НТГ, обусловленное ИР, уже на ранней стадии приводит к изменениям диастолической функции сердца различной степени тяжести [3, 4]. Диастолическую дисфункцию описывают с помощью различных параметров [5, 6], но в соответствии с действующими рекомендациями ESC по диагностике и лечению острой и хронической сердечной недостаточности, одним из важных параметров для описания диастолической функции является индекс массы миокарда левого желудочка (ИММЛЖ) [7].
Были опубликованы многочисленные исследования терапевтических вмешательств с применением магния [8, 9, 10, 11, 12], калия [13], витаминов группы B [14, 15, 16, 17, 18, 19] и коэнзима Q10 [20, 21, 22, 23, 24] и при лечении АС и кардиометаболических факторов риска. Недостаточное обеспечения организма магнием может быть клинически значимым триггером АС, а также быть связано с различными компонентами метаболического синдрома, такими как СД2 и инсулинорезистентность, а также с лечением ингибиторами протонной помпы [25] и диуретиками [12]. Гипомагниемия может быть вызвана недостаточным пероральным приемом магния внутрь, повышенным выделением почками, диареей или алкоголизмом. Гипомагниемия также часто сочетается с гипокалиемией [26].
Одна из целей этого пилотного исследования - выявление возможности улучшения функции ЛЖ у больных с нарушениями метаболизма глюкозы через шесть недель ежедневного диетического вмешательства с применением определенной комбинации микроэлементов.
Методы
Исследование популяции
Был проведен апостериорный анализ рандомизированного двойного слепого плацебо-контролируемого пилотного исследования у пациентов с АС, отобранных для участия в исследовании среди пациентов в возрасте 18–75 лет в клинике Outpatient Practice of Cardiology в Берлине, Германия. С апреля 2014 года по июль 2015 года было обследовано 74 пациента европеоидной расы с различными типами аритмии сердца (ЖЭС, НЖЭС, НЖ тахикардией). В целом, пациенты, которые завершили исследование, совершали пять посещений клиники Outpatient Practice of Cardiology. Во время первого посещения пациенты были подробно проинформированы об исследовании, были проведены необходимые исследования на предмет критериев включения в исследование и исключения. При условии соблюдения критериев и подписания пациентом письменного информированного согласия на участие в исследовании во время второго посещения пациентам выдавали таблетки плацебо в рамках вводного периода исследования. Время третьего посещения помечали как начальную временную точку, снова проводили обследование на предмет критериев включения и исключения, и пациенты были распределены по группам случайным образом. Следующее посещение происходило после трехнедельной фазы проведения вмешательства, перед шестинедельным периодом наблюдения.
Критериями включения являлись следующие показатели: ≥ 500 ЖЭС или ≥ 200 НЖЭС или ≥ 10 НЖ тахикардия при мониторировании ЭКГпо Холтеру в течение 18 часов. Основными критериями исключения были: возраст > 75 лет, ФВЛЖ ≤40%, прием спиронолактона> 50 мг/сут., торасемида> 20 мг/сут., прием витаминов и минералов, гипо- или гиперкалиемия, гипо- или гипермагниемия, нарушение функции почек, гипертиреоз, наличие кардиостимулятора, острая или хроническая диарея. Четырнадцать обследованных пациентов не соответствовали критериям включения: у них не было необходимого количества наджелудочковых или желудочковых экстрасистол, а у одного пациента была гипомагниемия.
На рисунке 1 показан профиль исследования 74 обследованных пациентов. Все включенные субъекты получали плацебо (две таблетки два раза в день) в течение однонедельного вводного периода исследования. После оценки мониторирования ЭКГ по Холтеру в начальной точке исследования и проверки на предмет критериев включения 60 пациентов были случайным образом распределены в экспериментальную (группа приема терапевтического средства) или контрольную (группа приема плацебо) группы. Продолжительность диетического вмешательства составила шесть недель. Во время рандомизированного двойного слепого, плацебо-контролируемого пилотного исследования участники должны были принимать по две таблетки два раза в день терапевтического средства (5 ккал, 145,8 мг магния, 469,2 мг калия, 3,0 мкг витамина В12, 400,0 мкг фолиевой кислоты, 48,0 мг ниацина и 60,0 мг коэнзима Q10) или плацебо (микрокристаллическая целлюлоза) с 200 мл воды.
 Рисунок 1. Профиль исследования
Рисунок 1. Профиль исследованияИсходы в отношении метаболизма глюкозы и функции ЛЖ
Поисковые исходы были представлены изменениями индекса HOMA-IR и функции ЛЖ после шести недель диетического вмешательства у пациентов с АС.
Клинические измерения компонентов метаболического синдрома
В начале исследования окружность талии (ОТ) определяли с помощью гибкой ленты с погрешностью измерений близким к 0,5 см. ОТ измеряли посередине между нижним краем ребра и гребнем подвздошной кости после обычного выдоха и в положении стоя. МС определяли с применением диагностических критериев International Diabetes Federation (IDF) [27]. Для соответствия определению IDF необходимы увеличение ОТ, а именно ≥94 см и ≥ 80 см для европейских мужчин и женщин соответственно, и любые два из следующих четырех компонентов: систолическое артериальное давление (АД) ≥ 130 мм рт. ст. или диастолическое АД ≥ 85 мм рт. ст., или лечение гипертонии, триглицериды (TG) ≥ 1,7 ммоль/л, холестерин-ЛПВП (Х-ЛПВП) < 1,29 ммоль/л у женщин и < 1,03 ммоль/л у мужчин или лечение нарушения липидного обмена, уровень глюкозы натощак ≥ 5,6 ммоль/л или ранее поставленный диагноз СД2. ОТ и отношение окружности талии к росту (ОТР) > 0,5 являются косвенными показателями абдоминального ожирения [28, 29].
Кроме того, эхокардиография (GE Medical Systems, Vivid S6), а также стандартная ЭКГ в 12 отведениях в покое (отведения по Эйнтховену, Голдбергу, Уилсону) были проведены и записаны на CUSTO CARD (программное обеспечение custo med GmbH, Мюнхен), как и мониторирование ЭКГ по Холтеру (CUSTO FLASH 500 Multiday, программное обеспечение custo med GmbH, Мюнхен) в течение не менее 18 часов. Результаты ЭКГ в покое и мониторирование по Холтеру анализировали с помощью компьютера с применением Миннесотского кода [30]. НЖЭС и ЖЭС были выявлены с помощью программного обеспечения и подтверждены двумя кардиологами.
Эхокардиографические исследования были выполнены двумя кардиологами в стандартных видах [31]: парастернальный доступ по длинной оси левого желудочка в 2D, с цветным допплеровским картированием и в М-режиме, парастернальный позиция приносящего и выносящего тракта ПЖ в 2D и с цветным допплеровским картированием, четырех-, пяти- и двухкамерные позиции, регистрируемые с верхушки сердца, 2D и с цветным допплеровским картированием, , позиция апикальной длинной оси, регистрируемая с верхушки сердца, в 2D и с цветным допплеровским картированием, а также измерение скорости кровотока через митральный клапан, аорту и трехстворчатый клапан, тканевая допплерография митрального кольца (показатель движения латерального края) в четырехкамерной позиции в соответствии с рекомендациями [32]. Верхний предел для ИММЛЖ у мужчин составляет ≥115 г/м2,,а у женщин ≥95 г/м2 [7]. Все параметры ЭХО-КГ, включая ИММЛЖ, были получены с помощью оборудования Vivid 6, GE Medical Systems, Ver. 11.2.0 b. 40.
Образцы крови и мочи для биохимической оценки были собраны в начальной точке исследования, через три и после шести недель диетического вмешательства (рис. 2).
 Рисунок 2. График исследования. Рекрутинг/начало вводного периода: при первом посещении пациенты были подробно проинформированы об исследовании, были проведены необходимые исследования для определения соответствия критериям включения и исключения. При условии соблюдения критериев и подписания пациентом письменного информированного согласия на участие в исследовании во время второго посещения пациентам выдавали таблетки плацебо в рамках вводного периода исследования. Начальная точка исследования: критерии включения и исключения были еще раз проверены, затем пациенты были распределены по группам случайным образом. Кроме того, антропологические параметры собирали при каждом посещении
Рисунок 2. График исследования. Рекрутинг/начало вводного периода: при первом посещении пациенты были подробно проинформированы об исследовании, были проведены необходимые исследования для определения соответствия критериям включения и исключения. При условии соблюдения критериев и подписания пациентом письменного информированного согласия на участие в исследовании во время второго посещения пациентам выдавали таблетки плацебо в рамках вводного периода исследования. Начальная точка исследования: критерии включения и исключения были еще раз проверены, затем пациенты были распределены по группам случайным образом. Кроме того, антропологические параметры собирали при каждом посещенииИспользуемые сокращения: E – эхокардиография; ECG – электрокардиограмма; ECGr – эхокардиография в покое; ECGh – мониторирование ЭКГ – по Холтеру; FR – трехдневная запись рациона; BU – образцы крови и мочи.
Лабораторные тесты
Все лабораторные анализы были проведены лабораторией Schottdorf MVZ GmbH, Аугсбург, Германия. Анализы содержания глюкозы (гексокиназный метод), гамма-глутамилтрансферазы (IFCC метод), гликированного гемоглобина (HbA1c) (турбидиметрический ингибиторный иммуноанализ, TINIA), инсулина (ECLIA), общего холестерина (TC) (метод CHOD-PAP), Х_ЛПНП и Х_ЛПВП(ферментативный колориметрический тест), ТГ (метод GPO-PAP) и чувствительный к CRP тест (турбидиметрический метод) проводили на анализаторе Roche. 24-часовую экскрецию магния и калия с мочой анализировали методом атомно-абсорбционной спектрометрии. HOMA являлся мерой для оценки инсулинорезистентности. HOMA-IR рассчитывали по концентрациям инсулина и глюкозы.
Статистический анализ
Статистические сравнения были сделаны между группами с использованием непараметрического U-критерия Манна-Уитни. Непараметрический критерий Уилкоксона применяли для сравнения данных в разные моменты времени внутри групп. Различия между категоризированными переменными были определены с помощью точного критерия Фишера. Влияние ковариат было проанализировано с помощью дисперсионного анализа (ANOVA). Все статистические тесты проводили в отношении популяции по протоколу и являлись двусторонними. Различия считали статистически значимыми при p <0,05. Данные представлены как среднее значение ± стандартное отклонение (SD). Линейное регрессионное моделирование было выполнено для выявления изменений различных компонентов кардиометаболических параметров в зависимости от ИММЛЖ и концентрации магния в сыворотке крови. Индекс размера эффекта d-Коэна определи как отношение разницы между двумя средними значениями к SD для данных. Порог значения размера эффекта (effect size, ES): маленький 0,20, средний 0,50, большой 0,80, очень большой 1,30 [33]. Приведены первый и третий квартили (Q1 и Q3 соответственно). Все анализы проводили с использованием программного обеспечения SPSS® для Windows (версия 22.0).
Результаты
Характеристики пациентов
Пятьдесят четыре пациента были оценены по протоколу, из них - 29 в экспериментальной группе и 25 в контрольной группе (рис. 1). Шесть пациентов не закончили исследование в соответствии с протоколом: у одного пациента в контрольной группе была искусственная гипергликемия, пять пациентов из исследуемой популяции потребляли менее 95% от назначения согласно исследованию (8%), четверо из этих пациентов были в контрольной группе.
О серьезных побочных эффектах на фоне диетического вмешательства не сообщалось. Один пациент из основной группы и один из контрольной группы сообщили о боли в желудке. Это могло быть вызвано приемом добавки. Прием добавок прекращен не был.
Предшествующие заболевания и лекарства
Артериальная гипертензия (АГ) была наиболее частым предшествующим заболеванием (65,5% в экспериментальной группе, 52,0% в контрольной группе). Ишемическая болезнь сердца (ИБС) была представлена у 27,6% пациентов в экспериментальной группе и у 28,0% в контрольной группе. Долгосрочное медикаментозное лечение бета-блокаторами, ингибиторами АПФ / антагонистами рецептора AT II, блокаторами кальциевых каналов, а также спиронолактоном было назначено 21 пациенту (72,4%) в экспериментальной группе и 16 пациентам (64,0%) в контрольной группе. СД2 был обнаружен у 10,3% пациентов в экспериментальной группе и у 8,0% в контрольной группе. В начальной точке исследования у 68,5% пациентов была дислипидемия (68,9% в экспериментальной, 68,0% в контрольной). Лечение статинами было зарегистрировано у 34,5% в экспериментальной группе и у 28,0% в контрольной группе. Дополнительные исходные характеристики обеих групп показаны в таблице 1.
Таблица 1. Исходные характеристики пациентов
Метаболический синдром и его компоненты
Индекс массы тела (ИМТ) ≥ 25 кг/м2 был зарегистрирован у 65,5% экспериментальной группы и у 72,0% контрольной группы в начале исследования. Абдоминальное ожирение с ОТР ≥0,5 было обнаружено в 72,4% экспериментальной группы и в 80,0% контрольной группы (таблица 1). Количество пациентов с критериями МС в соответствии с IDF по сравнению с исходным уровнем к концу исследования уменьшилось в экспериментальной группе с 16 до 15, а в контрольной группе увеличилось с 8 до 12. При исходном уровне у пяти пациентов (17,2%) в экспериментальной группе и у четырех (16,0%) в контрольной группе была атерогенная дислипидемия, а в конце исследования у четырех пациентов в экспериментальной группе (13,8%) и у 3 (12,0%) в контрольной группе.
Функция ЛЖ
У всех пациентов в начале исследования конечно-диастолический диаметр правого желудочка (КДДПЖ), левое предсердие (ЛП), конечно-систолический диаметр левого желудочка (КСДЛЖ), конечно-диастолический диаметр левого желудочка (КДДЛЖ), фракция выброса левого желудочка (ФВЛЖ), межжелудочковая перегородка (МЖП) и задняя стенка левого желудочка (ЗСЛЖ) были в пределах нормы. Тем не менее, у пациентов с ФВЛЖ 54–65% наблюдалось значительное увеличение ФВЛЖ (p = 0,020, ES = 0,995, Q1; Q3: 0,5; 15,0) в экспериментальной группе после вмешательства (Таблица 2).
Таблица 2. Изменение характеристик пациента: сравнение эхокардиографических показателей до и после диетического вмешательства
После диетического вмешательства индекс массы миокарда левого желудочка (ИММЛЖ) значительно снизился в экспериментальной группе (р = 0,003, ES = 0,260, Q1; Q3: -26,5; -2,2). Если различие проводить между мужчинами и женщинами, этот параметр также значительно снижен, особенно за счет уменьшения этого параметра у женщины (р = 0,035). КДДЛЖ (p = 0,050, ES = 0,210, Q1/Q3: -5,0; 1,0) были уменьшены, и улучшилось отношение E/A (p = 0,051, ES = 0,401, Q1; Q3: -0,04; 0,27) в нормальном диапазоне. В контрольной группе подобные результаты не были обнаружены. Но различия между этими двумя группами статистически не значимы.
Линейный регрессионный анализ показал, что ИММЛЖ в экспериментальной группе зависели от исходной концентрации магния в сыворотке крови и ее значения в ходе исследования. Изменение ИММЛЖ зависит от колебаний уровня Х-ЛПВП и диастолического артериального давления. Благоприятные изменения ИММЛЖ при таких условиях были выявлены только в экспериментальной группе. Напротив, подобные результаты в контрольной группе не были продемонстрированы (Таблица 3).
Таблица 3. Изменение ИММЛЖ в зависимости от колебаний уровня Х-ЛПВП и диастолического артериального давления
По тенденции толщина межжелудочковой перегородки была снижена только в экспериментальной группе (p = 0,053, ES = 0,348, Q1; Q3: -2,0; 0,5), в то время как ЗСЛЖ не изменился в обеих группах. С другой стороны, параметры ЛП были значительно увеличены в экспериментальной группе после вмешательства, но в пределах нормального диапазона (p = 0,018, ES = 0,314, Q1; Q3: -0,75; 3,75) (Таблица 2). Кроме того, может быть продемонстрирована значимая корреляция между ИММЛЖ и ЛП у мужчин (р = 0,018), но не у женщин (р = 0,225).
Рассматривая результаты с разбивкой по квартилям HOMA и параметрам функции ЛЖ, можно отметить, что у женщин диаметр ЛП значительно возрастает с поправкой на возраст с квартилями (p = 0,001) и у мужчин КДДЛЖ (p = 0,055) (Таблица 4). Влияние HOMA-квартилей было подтверждено регрессионной моделью.
Таблица 4. HOMA-квартили для ИММЛЖ, ЛП, МЖП, PW и КДДЛЖ у мужчин и женщин
HOMA-IR
В экспериментальной группе уровень глюкозы в плазме крови натощак ≥5,6 ммоль/л был заметно снижен после шести недель диетического вмешательства по сравнению с исходным уровнем (p = 0.055, ES = 0.388, Q1;Q3: -1.30;-0.11), разницы с контрольной группой не обнаружено (р = 0,328, ES = 0,604, Q1; Q3: -0,94; 0,28).
В начале исследования повышенная концентрация инсулина натощак (≥ 58 пмоль/л) была зарегистрирована у 19 пациентов из экспериментальной группы и у 17 пациентов из контрольной группы; нормальный уровень (<58 пмоль/л) у 10 пациентов в экспериментальной группе против восьми пациентов в контрольной группе. Но только в экспериментальной группе наблюдали тенденцию к снижению концентрации инсулина после вмешательства (p = 0,053, ES = 0,232, Q1; Q3: -35,1; 9,4), а у пациентов со значением инсулина натощак ≥58 пмоль/л (p = 0,020, ES = 0,340, Q1; Q3: -42,7; 1,4) она была снижена статистически значимо.
Повышенный индекс HOMA-IR > 2,5 был выявлен у 14 пациентов в экспериментальной группе и у 11 пациентов в контрольной группе. Эугликемическая ИР (FPG <5,6 ммоль/л, HOMA-IR ≥ 2,5) в начале исследования была показана у восьми пациентов в экспериментальной группе и у четырех пациентов в контрольной группе. В конце исследования наблюдали тенденцию к снижению HOMA-IR (р = 0,053, ES = 0,218, Q1; Q3: -1,25; 0,25) в экспериментальной группе, особенно у пациентов с HOMA-IR > 2,5 (p = 0,068, ES = 0,340, Q1; Q3: -2,90; -0,22) (Таблица 5). В конце исследования только у 3 пациентов было показано значение HOMA-IR ≥ 2,5 (р = 0,063), и HOMA-IR ≥ 2,5 (p = 0,625) у двух пациентов в контрольной группе.
Таблица 5. Изменение характеристик пациента: сравнение биохимических показателей до и после диетического вмешательства
Другие биохимические факторы риска возникновения сердечно-сосудистых заболеваний
Все соответствующие биохимические параметры приведены в таблице 5. При подсчете клеток крови показатели всех компонентов были в нормальном диапазоне значений как в экспериментальной группе, так и в контрольной группе, вплоть до значительного снижения лейкоцитов в пределах нормы в экспериментальной группе (p < 0,05). Уровень общего холестерин (ОХ) не изменился в экспериментальной и контрольной группах после диетического вмешательства. Уровень холестерина-ЛПНП (Х-ЛПНП) почти не изменился в экспериментальной группе, а в контрольной группе немного снизился; уровень Х-ЛПВП не был изменен в обеих группах. После диетического вмешательства уровень триглицеридов был значительно повышен в экспериментальной группе (p = 0,011, ES = 0,292, Q1; Q3: -0,01; 0,30), но сохранялся без изменений в контрольной группе. Концентрации ТГ ≥1,7 ммоль/л были обнаружены в начале исследования у 27,6% пациентов в экспериментальной группе и 28,0% в контрольной группе. В конце исследования это соотношение составляло от 31,0 до 20,0%.
Функция почек, измеренная по уровню креатинина и скорости клубочковой фильтрации (СКФ), была нормальной у всех пациентов. После вмешательства изменения концентрации магния в сыворотке крови были значительно выше в экспериментальной группе по сравнению с контрольной группой (р = 0,005, ES = 0,708, Q1; Q3: -0,02; 0,05 против -0,06; 0,01). Уровень калия в сыворотке крови был значительно повышен после вмешательства в экспериментальной группе (р = 0,034, ES = 0,512, Q1; Q3: 0,0; 0,3 против -0,5; 0,1) по сравнению с контрольной группой. Однако увеличение концентрации как магния, так и калия в сыворотке крови после вмешательства было в пределах нормы.
Через 24 ч. экскреция калия с мочой (р = 0,059, ES = 0,326, Q1; Q3: -7,2; 30,2), а также экскреция магния были повышены (р = 0,018, ES = 0,507, Q1; Q3: -0,18; 1,66) в экспериментальной группе. Экскреция магния была значительно выше по сравнению с контрольной группой (р = 0,036, ES = 0,377, Q1; Q3: -0,13; 1,51 против -0,64; 0,46). Такой результат был получен вследствие соблюдения применяемых мер. Нормальная почечная функция может быть показана в результате 24-часового сбора мочи: экскреция альбумина, а также отношение альбумин/креатинин/24 ч. находилось в пределах нормы. Только в экспериментальной группе этот коэффициент был склонен к снижению после диетического вмешательства, в то время как в контрольной группе этот коэффициент был увеличен. Данная разница в обеих группах была снижена (р = 0,083, ES = 0,521, Q1; Q3: -0,09; 0,03 против -0,05; 0,22).
Нарушения ритма
В этом пилотном исследовании можно было наблюдать снижение АД в экспериментальной группе, но этот результат не был статистически значим, вероятно, из-за небольшого числа пациентов и огромной дисперсии значений АД. С другой стороны, в контрольной группе снижение ЖЭС было заметным с той же огромной дисперсией, что и в экспериментальной группе (p = 0,005, ES = 0,369, Q1; Q3: -935,0; 5,0). Частота сердечных сокращений снижалась только в экспериментальной группе (р = 0,027, ES = 0,256, Q1; Q3: -7,8; 0,8) (Таблица 6).
Таблица 6. Изменение характеристик пациента: сравнение суточного мониторирования ЭКГ по Холтеру до и после диетического вмешательства
Изменения осведомленности о симптомах, измеренных по визуальной аналоговой шкале (баллы VAS), также обнаружить не удалось.
Обсуждение
Метаболический синдром и его компоненты
Метаболический синдром - это бремя нашего столетия, и в Германии можно обнаружить его распространенность в зависимости от региона на уровне от 14 до 23% [34].
Предшественники МС, например, нарушенная толерантность к глюкозе, вызванная повышенным уровнем инсулина натощак с последующей инсулинорезистентностью, уже на ранней стадии приводят к структурным изменениям левого желудочка и влияют на диастолическую функцию. Данные факторы, по-видимому, действуют независимо от ИБС, особенно связанные с диастолической дисфункцией или сердечной недостаточностью [4, 5, 35]. Наши знания основаны на экспериментальных [36] и клинических исследованиях, касающихся МС [4, 5, 37, 38] а также на метаанализах [28].
Влияние микроэлементов на патологические процессы при МС изучено лишь частично. Существуют доказательства того, что важную роль играет магний, особенно в метаболизме глюкозы [10]. Кроме того, положительное влияние на метаболизм глюкозы обсуждается в отношении магния и коэнзима Q10 [21, 24]. Влияние коэнзима Q10 на метаболизм глюкозы может быть основано на многофакторных механизмах, т.е. посредством снижения окислительного стресса [39, 40].
В среднем пациенты, включенные в это исследование, имели избыточный вес, при этом абдоминальное ожирение измерялось с помощью ОТ, а также с помощью ОТР. Показатели этих основных компонентов МС, а также уровень глюкозы в плазме крови натощак не изменились после вмешательства. Снижение систолического артериального давления в экспериментальной группе в конце исследования не повлияло на результаты. Поэтому мы не обнаружили снижения показателей компонентов МС в экспериментальной группе. Результаты анализа, по-видимому, позволяют предположить, что эта специфическая комбинация микроэлементов улучшает кардиометаболический профиль у пациентов с АС.
Функция ЛЖ
МС и его компоненты – ИР/СД2, AГ и абдоминальное ожирение – связаны с нарушением функции митохондрий и повышенным уровнем окислительного стресса. Эти патофизиологические механизмы способствуют развитию диастолической дисфункции [4, 35, 37, 38]. Ikee et al. [41] обнаружили, что диастолическая дисфункция на первых порах является бессимптомным нарушением релаксации и/или растяжимости, связанным с нормальной систолической насосной функцией. Это зависит от преднагрузки, конечного диастолического давления и структуры стенки ЛЖ.
Мы обнаружили признаки доклинической диастолической дисфункции ЛЖ в параллели с метаболическими изменениями. Эти данные согласуются с результатами настоящего пилотного исследования при сравнении экспериментальной и контрольной групп. В начале исследования отношение E/A было ниже в экспериментальной группе, чем в контрольной. После вмешательства соотношение E/A значительно улучшилось в экспериментальной группе, но не в контрольной. Диастолическая дисфункция, оцененная по соотношению E/A, ухудшалась в зависимости от количества компонентов МС [42]. Изменения диастолической функции связаны с возрастом [32, 42, 43] и, кроме того, зависят от таких компонентов МС, как избыточный вес, СД2, АГ и ИБС [4, 35]. Кроме того, настоящее исследование показало, что ФВЛЖ может быть улучшена только в том случае, если ее значение изначально находилось в пределах нижней границы нормального диапазона (54–65%). Магний приводит к экономизации сердечной насосной функции [44]. В обзоре стоит отметить, что CoQ10 также улучшает показатели сердечной функции, такие как фракция выброса при сердечной недостаточности [45]. Это может быть подтверждено данным исследованием: результаты демонстрируют значительное улучшение ФВ ≤ 65% в экспериментальной группе, но этот эффект не был статистически значимым при сравнении обеих групп исследования (Таблица 2).
Различные авторы описали, что чем больше компонентов МС представлено, тем значительнее увеличивается распространенность диастолической дисфункции ЛЖ, измеряемой по диаметрам ЛП, левого желудочка и ИММЛЖ [4, 5, 7].
В экспериментальной группе настоящего исследования диаметр ЛП был увеличен и особенно зависим от квартилей HOMA, но не более, чем в верхнем пределе нормы. У мужчин, в отличие от женщин, была продемонстрирована сильная положительная корреляция между ИММЛЖ и ЛП на исходном уровне как признак диастолической дисфункции. Напротив, в контрольной группе этот диаметр был уменьшен. В какой степени НЖЭС имеют отношение к этому процессу, пока неизвестно. Измеренные по значению размера эффекта показатели функциональных параметров в экспериментальной группе в течение шести недель были в большей степени улучшены по сравнению с такими структурными параметрами, как ИММЛЖ. В целом в литературе данные о нарушениях метаболизма глюкозы и трансторакальной эхокардиографической оценке структурных и функциональных параметров не согласуются. Это может быть основано на исключении пожилых людей и пациентов с более высоким ИМТ [46]. В соответствии с исследованиями Rutter et al. [46] и Hwang et al. [47] мы обнаружили эти связи с различными параметрами диастолической дисфункции ЛЖ с помощью трансторакальной эхокардиографии. Аналогичные результаты по функции ЛЖ у пациентов с инсулинорезистентностью и гликемическими нарушениями были описаны Velagaleti et al. [48] с применением МРТ. Эти зависимости чаще были статистически значимыми у мужчин. В целом снижение ИММЛЖ в результате вмешательства в течение шести недель является интересной находкой. Механизмы модификации ИММЛЖ еще не до конца понятны. Принято считать, что артериальная гипертензия способствует развитию гипертрофии ЛЖ. Но изменения в измерении артериального давления в течение 24 часов вносят вклад только в 25–30% вариации массы ЛЖ [49]. Sundström et al. [50] описали в 2000 году, что различные параметры МС сильнее связаны с толщиной стенки ЛЖ и концентрическим ремоделированием, чем с гипертрофией ЛЖ.
Позже может быть показано, что изменения в ИММЛЖ тесно связаны с резистентностью к инсулину у животных и у людей. В эксперименте на животных у мышей в течение трех недель сопоставимо можно было обнаружить развитие структурных изменений из-за резистентности к инсулину [51]. Verma et al. [52] исследовали в 2016 году в подгруппе 10 пациентов с СД2 и провели эхо-исследования в начале исследования и через три месяца. Они обнаружили значительное уменьшение массы ЛЖ и улучшение диастолической функции. Данный механизм пока остается не изученным и нуждается в дальнейших объяснениях.
Влияние на инсулинорезистентность
Различные составы и длительность диетических вмешательств несопоставимы по своим эффектам. По этой причине результаты не согласованы [14, 22].
В настоящем исследовании 27,6% пациентов в экспериментальной группе и 16,0% в контрольной группе демонстрировали эугликемическую ИР, измеренную по HOMA-IR в начале исследования. Это предполагает, что подобные изменения в метаболизме глюкозы могут обнаруживаться у пациентов с избыточным весом задолго до проявления СД2. В конце исследования мы выявили, снижение уровня эугликемической ИР в экспериментальной группе до 10,3% и до 8,0% в контрольной группе. Только в экспериментальной группе эти показатели метаболизма глюкозы снижались после вмешательства (р = 0,063). Значительно повышенные концентрации магния в сыворотке крови в экспериментальной группе по сравнению с контрольной группой после вмешательства были связаны только со значительным снижением HOMA-IR в экспериментальной группе. Chutia и Lynrah [53] показали положительную корреляцию между уровнем инсулина натощак и уровнем HOMA у пациентов с СД2 по сравнению с контрольной группой без диабета. Корреляция между уровнем магния в сыворотке крови и уровнем инсулина натощак была обратной.
Низкие уровни витамина B12 были обнаружены у подростков с ожирением с клиническими признаками ИР [15]. Применение добавок витамина B12, фолата и коэнзима Q10 в этом исследовании было целесообразно по двум причинам: с одной стороны, в целом, большая часть населения испытывает дефицит этих микроэлементов, особенно пожилые люди [54], а с другой стороны, замена может улучшить метаболизм глюкозы со значительным снижением уровня инсулина натощак и HOMA-IR. ИМТ оставался неизменным на протяжении всего шестинедельного исследования.
Описанные эффекты коэнзима Q10 на метаболизм глюкозы различны. При интервенционном приеме коэнзима Q10 у пациентов с МС может быть выявлено положительное влияние на уровень инсулина в сыворотке крови и HOMA-IR [21]. Moazen et al. [20] и Azevedo et al. [5], наоборот, не подтвердили влияние коэнзима Q10 на уровень глюкозы в крови натощак и уровень HbA1C по сравнению с контрольной группой. Другие исследователи [24] обнаружили значительное снижение уровня глюкозы в плазме крови натощак и уровня HbA1C, но не сывороточного инсулина и HOMA-IR. Влияние на липидный профиль благоприятным не было.
Влияние на другие биохимические показатели
Наиболее часто исследуемым веществом является коэнзим Q10. Такие добавки как витамин С, Е, коэнзим Q10 и селен исключительно в комбинации также улучшают метаболизм глюкозы и липидов [22]. Прием фолиевой кислоты у пациентов с СД2 приводит к снижению уровня гомоцистеина, с другой стороны, повышает уровень глутатиона с обратным эффектом на уровень HbA1C, ТГ и Х-ЛПВП [14].
Как и результаты, полученные другими авторами [21, 24], это исследование не показало положительного влияния на липиды (ОХ, ТГ, Х-ЛПНП) со стороны CoQ10, который также назначали в более высоких дозировках.
C-реактивный белок (CrP) был немного повышен у 20 пациентов из экспериментальной группы и у 16 пациентов из контрольной группы. Даже при концентрации CrP в сыворотке > 0,7 мг/л риск слегка повышен [55]. Повышение CrP указывает на пациентов с избыточной массой тела и ожирением, а также с нарушениями обмена веществ, и на более высокий риск сердечно-сосудистых заболеваний. В нашем исследовании CrP был немного снижен после приема диетических добавок и повышен в контрольной группе. Этот эффект может быть связан с потреблением магния посредством приема пищевых добавок [11]. После введения коэнзима Q10 уровень высокочувствительного CrP также снижался, согласно данным Raygan et al. [21] и Shargorodski et al.[22], после приема 60 мг Q10 в сочетании с другими антиоксидантами, такими как витамины С, Е и селен.
Влияние на аритмии сердца
Применение магния и калия играют важную роль в ведении пациентов с АС [9, 12]. АС часто связаны с гипомагниемией, но механизм патологии этого процесса не до конца понятен из-за взаимодействия с другими электролитными нарушениями [44]. Гипомагниемия и гипокалиемия тесно связаны друг с другом, вызывая АС [10]. В этом пилотном исследовании влияние пищевых добавок на ЖЭС, НЖЭС и оценку VAS не может быть показано. Уменьшение ЖЭС в контрольной группе может быть основано на эффекте плацебо. В экспериментальной группе мы обнаружили значительное снижение частоты сердечных сокращений. Это может быть вызвано замедлением скорости проводимости синусового узла при пероральном введении магния [12]. В этом экспериментальном исследовании корреляция между изменениями функции ЛЖ и АС не была обнаружена.
Сильные стороны и ограничения
Сильные стороны этого исследования включают выборку пациентов с сердечно-сосудистыми нарушениями, такими как АГ, ИБС и частыми ЭС, а также средним избыточным весом, которые проходили лечение в клинике Outpatient Practice for Cardiology. Поэтому все были исследованы в одном центре, и все процедуры были проведены в одинаковых стандартизированных условиях. Ограничения заключаются в сравнительно небольшом количестве пациентов и проведении апостериорного анализа. В данном эхокардиографическом исследовании мы обычно не измеряли все параметры диастолической функции. Поскольку выбросы по несколькими параметрам обнаружены у разных пациентов, общая очистка данных представляется неуместной и предпочтение отдается использованию всех имеющихся данных. Тестируемые параметры следует оценивать с учетом состояния остальных пациентов.
Заключение
В данном пилотном исследовании диетическое вмешательство с определенной комбинацией микроэлементов в качестве дополнения к сопутствующей терапии препаратами для лечения заболеваний сердечно-сосудистой системы, по-видимому, улучшает кардиометаботическое состояние пациентов с АС. Диетическое вмешательство привело к значительному снижению уровня инсулина натощак ≥ 58 пмоль/л (р = 0,020), а индекс HOMA-IR снизился в экспериментальной группе через шесть недель (р = 0,053). В то же время после вмешательства в экспериментальной группе улучшились показатели диастолической функции ЛЖ: наблюдали значительное снижение индекса массы миокарда ЛЖ (р = 0,003) и тенденцию к уменьшению толщины межжелудочковой перегородки (р = 0,053), а также увеличению соотношения E/A (p = 0,051). Частота сердечных сокращений была значительно снижена (р = 0,027), но влияние на нарушения ритма, таких как ЭС, было менее выраженным. В обеих группах серьезных побочных эффектов не наблюдалось. Результаты этого пилотного исследования показывают важность проведения дальнейшего анализа.
Список использованной литературы
- Conen D, Adam M, Roche F, Barthelemy J-C, Felber Dietrich D, Imboden M, et al. Premature atrial contractions in the general population: frequency and risk factors. Circulation. 2012;126:2302–8. doi.org. View ArticlePubMedGoogleScholar
- Massing MW, Simpson RJ Jr, Rautaharju PM, Schreiner PJ, Crow R, Heiss G. Usefulness of ventricular premature complexes to predict coronary heart disease events and mortality (from the atherosclerosis risk in communities cohort). Am J Cardiol. 2006;98:1609–12. doi.org. View ArticlePubMedGoogle Scholar
- Ryden L, Grant PJ, Anker SD, Berne C, Cosentino F, Danchin N, et al. ESC guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD: the task force on diabetes, pre-diabetes, and cardiovascular diseases of the European Society of Cardiology (ESC) and developed in collaboration with the European Association for the Study of diabetes (EASD). Eur Heart J. 2013;34:3035–87. doi.org. View ArticlePubMedGoogle Scholar
- Ayalon N, Gopal DM, Mooney DM, Simonetti JS, Grossman JR, Dwivedi A, et al. Preclinical left ventricular diastolic dysfunction in metabolic syndrome. Am J Cardiol. 2014;114:838–42. doi.org. View ArticlePubMedPubMedCentralGoogleScholar
- Azevedo A, Bettencourt P, Almeida PB, Santos AC, Abreu-Lima C, Hense H-W, Barros H. Increasing number of components of the metabolic syndrome and cardiac structural and functional abnormalities—cross-sectional study of the general population. BMC CardiovascDisord. 2007;7:17. doi.org. View ArticlePubMedPubMedCentralGoogleScholar
- Galderisi M. Diastolic dysfunction and diabetic cardiomyopathy: evaluation by Doppler echocardiography. J Am CollCardiol. 2006;48:1548–51. doi.org. View ArticlePubMedGoogle Scholar
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. ESC guidelines for the diagnosis and treatment of acute and chronic heart failure: the task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the heart failure association (HFA) of the ESC. Eur J heartfail. 2016. doi.org.
- Bashir Y, Sneddon JF, Staunton HA, Haywood GA, Simpson IA, McKenna WJ, Camm AJ. Effects of long-term oral magnesium chloride replacement in congestive heart failure secondary to coronary artery disease. Am J Cardiol. 1993;72:1156–62.View ArticlePubMedGoogleScholar
- Falco CN, Grupi C, Sosa E, Scanavacca M, Hachul D, Lara S, et al. Successful improvement of frequency and symptoms of premature complexes after oral magnesium administration. ArqBrasCardiol. 2012;98:480–7.View ArticlePubMedGoogleScholar
- Geiger H, Wanner C. Magnesium in disease. Clin Kidney J. 2012;5:i25–38. doi.org. ViewArticlePubMedPubMedCentralGoogleScholar
- Song Y, Ridker PM, Manson JE, Cook NR, Buring JE, Liu S. Magnesium intake, C-reactive protein, and the prevalence of metabolic syndrome in middle-aged and older U.S. women. DiabetesCare. 2005;28:1438–44.View ArticlePubMedGoogleScholar
- Stühlinger HG. Die Bedeutung von Magnesium beikardiovaskulärenErkrankungen. J Kardiol. 2002;9:389–95.Google Scholar
- Aburto NJ, Hanson S, Gutierrez H, Hooper L, Elliott P, Cappuccio FP. Effect of increased potassium intake on cardiovascular risk factors and disease: systematic review and meta-analyses. BMJ. 2013;346:f1378. doi.org. View ArticlePubMedPubMedCentralGoogle Scholar
- Child DF, Hudson PR, Jones H, Davies GK, De P, Mukherjee S, et al. The effect of oral folic acid on glutathione, glycaemia and lipids in type 2 diabetes. DiabetesNutrMetab. 2004;17:95–102.PubMedGoogle Scholar
- Ho M, Halim JH, Gow ML, El-Haddad N, Marzulli T, Baur LA, et al. Vitamin B12 in obese adolescents with clinical features of insulin resistance. Nutrients. 2014;6:5611–8. doi.org. View ArticlePubMedPubMedCentralGoogleScholar
- Knight BA, Shields BM, Brook A, Hill A, Bhat DS, Hattersley AT, Yajnik CS. Lower circulating B12 is associated with higher obesity and insulin resistance during pregnancy in a non-diabetic white British population. PLoS One. 2015;10:e0135268. doi.org. View ArticlePubMedPubMedCentralGoogle Scholar
- Sazonov V, Maccubbin D, Sisk CM, Canner PL. Effects of niacin on the incidence of new onset diabetes and cardiovascular events in patients with normoglycaemia and impaired fasting glucose. Int J ClinPract. 2013;67:297–302. doi.org. View ArticlePubMedGoogle Scholar
- Schwab S, Zierer A, Heier M, Fischer B, Huth C, Baumert J, et al. Intake of vitamin and mineral supplements and longitudinal association with HbA1c levels in the general non-diabetic population—results from the MONICA/KORA S3/F3 study. PLoS One. 2015;10:e0139244. doi.org. View ArticlePubMedPubMedCentralGoogle Scholar
- Sudchada P, Saokaew S, Sridetch S, Incampa S, Jaiyen S, Khaithong W. Effect of folic acid supplementation on plasma total homocysteine levels and glycemic control in patients with type 2 diabetes: a systematic review and meta-analysis. Diabetes Res ClinPract. 2012;98:151–8. doi.org. View ArticlePubMedGoogle Scholar
- Moazen M, Mazloom Z, Ahmadi A, Dabbaghmanesh MH, Roosta S. Effect of coenzyme Q10 on glycaemic control, oxidative stress and adiponectin in type 2 diabetes. J PakMedAssoc. 2015;65:404–8.PubMedGoogle Scholar
- Raygan F, Rezavandi Z, Dadkhah Tehrani S, Farrokhian A, Asemi Z. The effects of coenzyme Q10 administration on glucose homeostasis parameters, lipid profiles, biomarkers of inflammation and oxidative stress in patients with metabolic syndrome. Eur J Nutr. 2015. doi.org.
- Shargorodsky M, Debby O, Matas Z, Zimlichman R. Effect of long-term treatment with antioxidants (vitamin C, vitamin E, coenzyme Q10 and selenium) on arterial compliance, humoral factors and inflammatory markers in patients with multiple cardiovascular risk factors. NutrMetab (Lond). 2010;7:55. doi.org. View ArticleGoogleScholar
- Turk S, Baki A, Solak Y, Kayrak M, Atalay H, Gaipov A, et al. Coenzyme Q10 supplementation and diastolic heart functions in hemodialysis patients: a randomized double-blind placebo-controlled trial. HemodialInt. 2013;17:374–81. doi.org. View ArticlePubMedGoogleScholar
- Zahedi H, Eghtesadi S, Seifirad S, Rezaee N, Shidfar F, Heydari I, et al. Effects of CoQ10 supplementation on lipid profiles and glycemic control in patients with type 2 diabetes: a randomized, double blind, placebo-controlled trial. J Diabetes MetabDisord. 2014;13:81. doi.org. View ArticlePubMedPubMedCentralGoogle Scholar
- Classen HG, Grober U, Kisters K. Drug-induced magnesium deficiency. MedMonatsschrPharm. 2012;35:274–80.PubMedGoogle Scholar
- Kaye P. The role of magnesium in the emergency department. Emerg Med J. 2002;19:288–91. doi.org. ViewArticlePubMedPubMedCentralGoogleScholar
- Alberti KGM, Zimmet P, Shaw J. The metabolic syndrome—a new worldwide definition. Lancet. 2005;366:1059–62. doi.org. View ArticlePubMedGoogleScholar
- Schneider HJ, Friedrich N, Klotsche J, Pieper L, Nauck M, John U, et al. The predictive value of different measures of obesity for incident cardiovascular events and mortality. J ClinEndocrinolMetab. 2010;95:1777–85. doi.org. View ArticlePubMedGoogle Scholar
- Browning LM, Hsieh SD, Ashwell M. A systematic review of waist-to-height ratio as a screening tool for the prediction of cardiovascular disease and diabetes: 0.5 could be a suitable global boundary value. NutrResRev. 2010;23:247–69. doi.org. View ArticlePubMedGoogleScholar
- Prineas RJ, Crow RS, Blackburn HW. The Minnesota code manual of electrocardiographic findings: Standards and procedures for measurement and classification. Boston, Mass.: J. Wright; 1982.Google Scholar
- Lang RM, Badano LP, Mor-Avi V, Afilalo J, Armstrong A, Ernande L, et al. Recommendations for cardiac chamber quantification by echocardiography in adults: an update from the American Society of Echocardiography and the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2015;16:233–70. doi.org. ViewArticleGoogleScholar
- Nagueh SF, Appleton CP, Gillebert TC, Marino PN, Oh JK, Smiseth OA, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. J Am SocEchocardiogr. 2009;22:107–33. doi.org. View ArticleGoogle Scholar
- Cohen J. Statistical power analysis for the behavioral sciences. 2nd ed. Hillsdale: L. ErlbaumAssociates; 1988.Google Scholar
- Moebus S, Hanisch J, Bramlage P, Losch C, Hauner H, Wasem J, Jockel K-H. Regional differences in the prevalence of the metabolic syndrome in primary care practices in Germany. DtschArztebl Int. 2008;105:207–13. doi.org. View ArticlePubMedPubMedCentralGoogle Scholar
- von Bibra H, Paulus WJ, St John Sutton M, Leclerque C, Schuster T, Schumm-Draeger P-M. Quantification of diastolic dysfunction via the age dependence of diastolic function - impact of insulin resistance with and without type 2 diabetes. Int J Cardiol. 2015;182:368–74. doi.org. View ArticleGoogle Scholar
- Koliaki C, Roden M. Alterations of mitochondrial function and insulin sensitivity in human obesity and diabetes mellitus. Annu Rev Nutr. 2016;36:337–67. doi.org. View ArticlePubMedGoogle Scholar
- vonBibra H, Paulus W. DiastolischeDysfunktion. Kardiologe. 2016;10:47–55. doi.org. ViewArticleGoogleScholar
- Fontes-Carvalho R, Ladeiras-Lopes R, Bettencourt P, Leite-Moreira A, Azevedo A. Diastolic dysfunction in the diabetic continuum: association with insulin resistance, metabolic syndrome and type 2 diabetes. CardiovascDiabetol. 2015;14:4. doi.org. View ArticlePubMedPubMedCentralGoogle Scholar
- Littarru GP, Tiano L. Clinical aspects of coenzyme Q10: an update. Nutrition. 2010;26:250–4. doi.org. View ArticlePubMedGoogleScholar
- Quiles JL, Ochoa JJ, Battino M, Gutierrez-Rios P, Nepomuceno EA, Frias ML, et al. Life-long supplementation with a low dosage of coenzyme Q10 in the rat: effects on antioxidant status and DNA damage. Biofactors. 2005;25:73–86.View ArticlePubMedGoogleScholar
- Ikee R, Hamasaki Y, Oka M, Maesato K, Mano T, Moriya H, et al. High-density lipoprotein cholesterol and left ventricular mass index in peritoneal dialysis. PeritDialInt. 2008;28:611–6.PubMedGoogle Scholar
- Ahn M-S, Kim J-Y, Youn YJ, Kim S-Y, Koh S-B, Lee K, et al. Cardiovascular parameters correlated with metabolic syndrome in a rural community cohort of Korea: the ARIRANG study. J Korean Med Sci. 2010;25:1045–52. doi.org. View ArticlePubMedPubMedCentralGoogle Scholar
- Ochi A, Ishimura E, Tsujimoto Y, Kakiya R, Tabata T, Mori K, et al. Hair magnesium, but not serum magnesium, is associated with left ventricular wall thickness in hemodialysis patients. Circ J. 2013;77:3029–36.View ArticlePubMedGoogleScholar
- Grober U, Schmidt J, Kisters K. Magnesium in prevention and therapy. Nutrients. 2015;7:8199–226. doi.org. View ArticlePubMedPubMedCentralGoogleScholar
- DiNicolantonio JJ, Bhutani J, McCarty MF, O’Keefe JH. Coenzyme Q10 for the treatment of heart failure: a review of the literature. Open Heart. 2015;2:e000326. doi.org. View ArticlePubMedPubMedCentralGoogle Scholar
- Rutter MK, Parise H, Benjamin EJ, Levy D, Larson MG, Meigs JB, et al. Impact of glucose intolerance and insulin resistance on cardiac structure and function: sex-related differences in the Framingham heart study. Circulation. 2003;107:448–54.View ArticlePubMedGoogleScholar
- Hwang Y-C, Jee JH, Kang M, Rhee E-J, Sung J, Lee M-K. Metabolic syndrome and insulin resistance are associated with abnormal left ventricular diastolic function and structure independent of blood pressure and fasting plasma glucose level. Int J Cardiol. 2012;159:107–11. doi.org. View ArticlePubMedGoogle Scholar
- Velagaleti RS, Gona P, Chuang ML, Salton CJ, Fox CS, Blease SJ, et al. Relations of insulin resistance and glycemic abnormalities to cardiovascular magnetic resonance measures of cardiac structure and function: the Framingham heart study. CircCardiovasc Imaging. 2010;3:257–63. doi.org. View ArticlePubMedPubMedCentralGoogle Scholar
- Majahalme S, Turjanmaa V, Weder A, Lu H, Tuomisto M, Virjo A, Uusitalo A. Blood pressure levels and variability, smoking, and left ventricular structure in normotension and in borderline and mild hypertension. Am J Hypertens. 1996;9:1110–8.View ArticlePubMedGoogleScholar
- Sundström J, Lind L, Nyström N, Zethelius B, Andrén B, Hales CN, Lithell HO. Left ventricular concentric remodeling rather than left ventricular hypertrophy is related to the insulin resistance syndrome in elderly men. Circulation. 2000;101:2595–600.View ArticlePubMedGoogleScholar
- Zhang L, Jaswal JS, Ussher JR, Sankaralingam S, Wagg C, Zaugg M, Lopaschuk GD. Cardiac insulin-resistance and decreased mitochondrial energy production precede the development of systolic heart failure after pressure-overload hypertrophy. CircHeartFail. 2013;6:1039–48. doi.org. View ArticlePubMedGoogleScholar
- Verma S, Garg A, Yan AT, Gupta AK, Al-Omran M, Sabongui A, et al. Effect of Empagliflozin on left ventricular mass and diastolic function in individuals with diabetes: an important clue to the EMPA-REG OUTCOME trial? DiabetesCare. 2016;39:e212–3. doi.org. View ArticlePubMedGoogleScholar
- Chutia H, Lynrah KG. Association of Serum Magnesium Deficiency with insulin resistance in type 2 diabetes mellitus. J LabPhysicians. 2015;7:75–8. doi.org. View ArticlePubMedPubMedCentralGoogleScholar
- DGE. Referenzwertefür die Nährstoffzufuhr. 2nd ed. Neustadt an der Weinstrasse: NeuerUmschauBuchverlag; 2015.GoogleScholar
- Ridker PM. High-sensitivity C-reactive protein: potential adjunct for global risk assessment in the primary prevention of cardiovascular disease. Circulation. 2001;103:1813–8.View ArticlePubMedGoogleScholar





