3244
08 Сентября 2021
Авторское право © 2018, José González-Costello, Josep Comín-Colet, Josep Lupón, Cristina Enjuanes, Marta de Antonio, Lara Fuentes, Pedro Moliner-Borja, Nuria Farré, Elisabet Zamora, Nicolás Manito, Ramón Pujol, Antoni Bayés-Genis (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Хосе Гонсалес-Костелло, Хосеп Колин-Колет, Хосеп Лупон, Кристина Энхуанес, Марта де Антонио, Лара Фуэнтес, Педро Молинер-Борха, Нурия Фарре, Эли...
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Хосе Гонсалес-Костелло, Хосеп Колин-Колет, Хосеп Лупон, Кристина Энхуанес, Марта де Антонио, Лара Фуэнтес, Педро Молинер-Борха, Нурия Фарре, Эли...
Авторское право © 2018, José González-Costello, Josep Comín-Colet, Josep Lupón, Cristina Enjuanes, Marta de Antonio, Lara Fuentes, Pedro Moliner-Borja, Nuria Farré, Elisabet Zamora, Nicolás Manito, Ramón Pujol, Antoni Bayés-Genis (
doi.org)
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Хосе Гонсалес-Костелло, Хосеп Колин-Колет, Хосеп Лупон, Кристина Энхуанес, Марта де Антонио, Лара Фуэнтес, Педро Молинер-Борха, Нурия Фарре, Элизабет Самора, Николас Манито, Рамон Пухоль, Антони Байес-Генис
BMC Cardiovascular Disorders201818:206
Аннотация
Введение
Дефицит железа (ДЖ) у пациентов с хронической сердечной недостаточностью (ХСН) считается неблагоприятным прогностическим фактором. Цель нашего исследования – выявление взаимосвязи между летальностью и частотой госпитализаций и ДЖ у пациентов с ХСН.
Методы
Мы оценили степень ДЖ у пациентов с ХСН в трех университетских клиниках. По типам ДЖ разделяли на абсолютный (уровень ферритина < 100 мкг/л) и функциональный (коэффициент насыщения трансферрина железом < 20%, уровень ферритина от 100 до 299 мкг/л). Мы исключили пациентов, получавших внутривенные инъекции железа или эритропоэтина на период последующего наблюдения. Мы оценили использование ДЖ в качестве прогностического фактора летальности и частоты госпитализаций при сердечной недостаточности либо по любой другой причине методом однофакторного и многофакторного регрессионного анализа Кокса.
Результат
В исследовании включили 1684 пациента: 65% – мужчины, у 38% диагностирован диабет; средний возраст участников – 72 года, 37% принадлежали к функциональным классам III и IV, у 30% пациентов фракция выброса левого желудочка составляла более 45%. Пациенты получали качественное лечение, 87% и 88% из них получали лечение ингибиторами ренин-ангиотензина и бета-блокаторами соответственно. Средний коэффициент насыщения трансферина составил 20%, средний уровень ферритина – 155 нг/мл, средний уровень гемоглобина – 13 г/дл. ДЖ обнаружен у 53% пациентов; у 35% он был абсолютным, у 18% – функциональным. Средняя продолжительность последующего наблюдения составила 20 месяцев. ДЖ являлся предиктором летальности и частоты госпитализации по причине сердечной недостаточности или любых других причин при однофакторном, но не многофакторном анализе данных. С точки зрения прогноза различий между абсолютным и функциональным ДЖ найдено не было.
Вывод
Для группы пациентов с ХСН и высокой частотой случаев острой сердечной недостаточности с сохраненной фракцией выброса крови ДЖ не выступал в качестве предиктора летальности или частоты госпитализаций после поправки на наличие сопутствующих заболеваний, функциональный класс и проведение нейрогормонального лечения.
Ключевые слова
До 50% людей, страдающих хронической сердечной недостаточностью (ХСН), испытывают дефицит железа (ДЖ), который признан одним из факторов неблагоприятного прогноза развития данного заболевания вне зависимости от присутствия анемии и хронических болезней почек (ХБП) [1, 2]. Тем не менее в другом исследовании с участием взрослых пациентов, не находящихся в стационаре и утверждавших о наличии у них сердечной недостаточности, взаимосвязи между ДЖ и летальностью, обусловленной сердечной недостаточностью или иными причинами, выявлено не было. При этом уровень гемоглобина и С-реактивного белка являлись предикторами худшей выживаемости [3]. ДЖ часто сопутствуют анемия и (или) ХБП на фоне СН, при этом наличие ДЖ увеличивает риск летального исхода либо как самостоятельный фактор, либо вместе с анемией, ХБП или обоими заболеваниями [2].
Несмотря на то что роль ДЖ в развитии ХСН до сих пор не ясна и рассматривается в сочетании со многими факторами [4, 5, 6], лечение ДЖ у этих пациентов стало терапевтической целью. Прием железа внутрь не связан с увеличением физической активности пациентов с ХСН и нарушениями выброса крови [7]. Недавние рандомизированные исследования показали, что внутривенные инъекции препаратов железа увеличивают способность переносить физические нагрузки, увеличивают сердечную функцию, смягчают тяжесть симптомов и повышают качество жизни пациентов с ХСН и систолической дисфункцией левого желудочка [8, 9, 10, 11]. В недавнем исследовании CONFIRM-HF риск госпитализации в связи с ухудшением симптомов сердечной недостаточности оказалась ниже у пациентов, принимавших железа карбоксимальтозат, чем в группе участников, принимавших плацебо. В то же время отсутствуют исследования, изучающие частоту госпитализаций по причине ХСН или по любым причинам среди пациентов с ХСН и ДЖ.
Учитывая важность снижения смертности и частоты госпитализаций пациентов с ХСН, а также снижения частоты госпитализаций при внутривенном введении препаратов железа, мы решили провести оценку наличия ДЖ в качестве прогностического фактора в когорте, состоявшей из пациентов с ХСН, наблюдавшихся амбулаторно в нескольких медицинских центрах. Мы сделали упор на летальность и частоту госпитализаций из-за обострения ХСН либо по иным причинам.
Методы
Дизайн исследования
Данное исследование являлось ретроспективным обсервационным когортным исследованием пациентов с сердечной недостаточностью и направлено на определение наличия ДЖ и его влияния на частоту последующих госпитализаций и летальность в период наблюдения.
Состав участников
2495 пациентов с диагнозом «устойчивая ХСН» были включены в исследование в трех многопрофильных отделениях, специализирующихся на лечении ХСН, трех специализированных клиниках Испании. Пациенты были включены в проспективное исследование в период с 2005 по 2012 гг. Пациенты должны были иметь диагноз «ХСН» в соответствии с критериями, установленными Европейским кардиологическим сообществом [12]. Мы определяли ХСН с сохранением фракции выброса левого желудочка (ФВЛЖ) при ФВЛЖ более 50%, а также при присутствии объективных признаков нарушения функции сердца (увеличение левого предсердия, диастолическая дисфункция или повышение уровня натрийуретических пептидов). Пациенты, не прошедшие оценку уровня железа перед включением в исследование, а также те, у кого имелись признаки первичных нарушений функций клапанов и перикарда, были исключены из исследования. Из оставшихся 2172 пациентов по результатам оценки аптечных формуляров мы исключили пациентов, получавших внутривенные инъекции железосодержащих препаратов либо подкожные инъекции эритропоэтина в любое время в течение периода последующего наблюдения, поскольку такое лечение могло повлиять на результат исследования. В итоге были проанализированы данные 1684 пациентов. Лечение назначалось в соответствии со стандартом, установленным Европейским кардиологическим сообществом [12].
Каждый пациент предоставил письменное информированное согласие. Исследование проводилось в соответствии с требованиями Хельсинской декларации. Протокол исследования одобрен местными этическими комитетами.
Методика анализа объединенных данных
Сбор данных для исследования проводился проспективно, данные собирали непосредственно у каждого пациента. Конечными точками данного исследования было определение летальности от всех причин, частоты первичных госпитализаций в связи с СН, а также в связи с любыми причинами после помещения в специализированное для лечения СН отделение. Жизненный статус пациентов и частота госпитализаций оценивались путем изучения клинических баз данных, карт стационарного пациента, либо данных, полученных в ходе прямых контактов с пациентами и/или их родственниками. Наблюдения продолжались вплоть до смерти пациента либо последнего визита в амбулаторное лечебное учреждение до октября 2015 года. Если пациент по каким-либо причинам был утрачен для последующего наблюдения, мы связывались с ним/ней либо его/ее родственниками по телефону для получения данных о его жизненном статусе и/или количестве госпитализаций. В случае невозможности установления связи по телефону мы изучали электронную историю болезни пациента, предоставленную клиникой либо учреждением первичной медицинской помощи, и определяли текущий жизненный статус пациента и частоту госпитализаций. Если несмотря на эти шаги получить информацию о жизни/смерти и госпитализациях не удавалось, дата окончания наблюдения приравнивалась к дате последнего визита в амбулаторное лечебное учреждение. Во время последующего наблюдения пять пациентов перенесли операцию по пересадке сердца, что приравнивалось к смерти и окончанию периода исследования. Ни один из пациентов не пользовался устройствами, стимулирующими работу желудочка.
Содержание железа и другие лабораторные показатели
При включении пациента в исследовании оценивали следующие показатели крови, отражающие содержание железа: уровень железа в сыворотке крови (мкг/дл) измеряли методом спектрофотометрии; уровень ферритина (нг/мл) и трансферрина (мг/дл) измерялись методом иммунотурбидиметрии. Коэффициент насыщения трансферрина железом (КНТЖ) рассчитывали по формуле: КНТЖ = сыв. железо (мкг/дл)/[сыв. трансферрин (мг/дл) х 1,25] [13]. ДЖ считался абсолютным при уровне ферритина < 100 нг/мл, функциональным – при КНТЖ <20% и уровне ферритина 100–299 нг/мл [8].
Уровень гемоглобина измеряли методом лазерной колориметрии, анемию диагностировали при уровне гемоглобина < 12 г/дл у женщин и < 13 г/дл у мужчин. Концентрацию n-терминального мозгового натрийуретического пропептида (NT-proBNP) измеряли методом электрохемилюминесцентного иммуноанализа с помощью анализатора Elecsys («Роше Диагностикс», Базель (Швейцария)). Почечная функция оценивалась на основе коэффициента клубочковой фильтрации с использованием уравнения MDRD (назначение диеты при болезнях почек).
Статистический анализ
Нормальное распределение непрерывных переменных оценивали с использованием гистограмм и критерия Шапиро – Уилка. Сравнение количественных переменных между двумя группами проводили с помощью t-критерия Стьюдента, применявшегося при нормальном распределении величин, а также с помощью U-критерия Манна – Уитни при ненормальном распределении величин. Критерий Хи-квадрат использовали для анализа категориальных величин. При ожидаемом количестве клеток ниже 5 использовали критерий Фишера.
Проводили логарифмическую трансформацию непрерывных величин с неравномерным распределением таких как КНТЖ, уровень ферритина и NT-proBNP. Полученные показатели обозначали следующим образом: log-КНТЖ, log-ферритин и log-NT-proBNP. Чтобы определить корреляцию переменных, используемых в многофакторном регрессионном анализе, проводили оценку коллинеарности с использованием фактора увеличения дисперсии. Максимальный фактор увеличения дисперсии, отмеченный среди основных величин, был равен 1,5, что свидетельствовало о низкой коллинеарности.
Для оценки предикторов ДЖ, мы использовали многофакторный логистический регрессионный анализ. Все первоначальные величины, имевшие значимую однофакторную взаимосвязь (p < 0,10) либо считавшиеся клинически значимыми, вводились на основе модели обратного многомерного анализа с использованием критериев исключения с p > 0,10. Дополнительный бутстрэп-анализ (1000 циклов) многофакторной модели применяли для определения точности оцениваемой модели. Кроме того, для оценки многофакторной модели была определена величина R2.
Соотношение летальности и частоты госпитализаций, вызванных СН либо любыми другими причинами, рассчитывали путем отношения показателей частот у пациентов двух категорий: группы пациентов с ДЖ и пациентов без ДЖ. Значимость показателей оценивали с помощью критерия хи-квадрата Мантеля – Гензеля.
Выживаемость и время до первой госпитализации, связанной с сердечной недостаточностью или иными причинами, оценивали с использованием кривых выживаемости Каплана – Майера. Оценку того, является ли ДЖ предиктором уровня выживаемости или количества госпитализаций, проводили с использованием однофакторного регрессионного анализа пропорциональности рисков Кокса. Используя величины, являвшиеся статистическими значимыми в рамках однофакторного анализа (p < 0,10), а также клинически значимые величины проводили обратный многофакторный регрессионный анализ пропорциональности риска Кокса, критерий исключения составлял p > 0,10. ДЖ включен в окончательный многофакторный анализ, поскольку он является целью нашего исследования. Допущение пропорциональности в рамках регрессионного анализа оценивали путем остаточного анализа. Установленный показатель значимости p < 0,05 (двусторонний), при этом при проведении всех статистических оценок использовались программы SPSS версии 18 и Stata 14.
Результат
В исследовании участвовало 1684 пациента (см. рис. 1), их исходные характеристики представлены в таблице 1. На момент включения в исследование ДЖ наблюдался у 898 (53%) участников. У 35% он был абсолютным, у 18% – функциональным. У 953 (57%) участников не было выраженных признаков анемии, при этом ДЖ наблюдался у 460 (48%) пациентов. Из 731 пациентов, имевших признаки анемии, ДЖ наблюдался у 438 (60%).
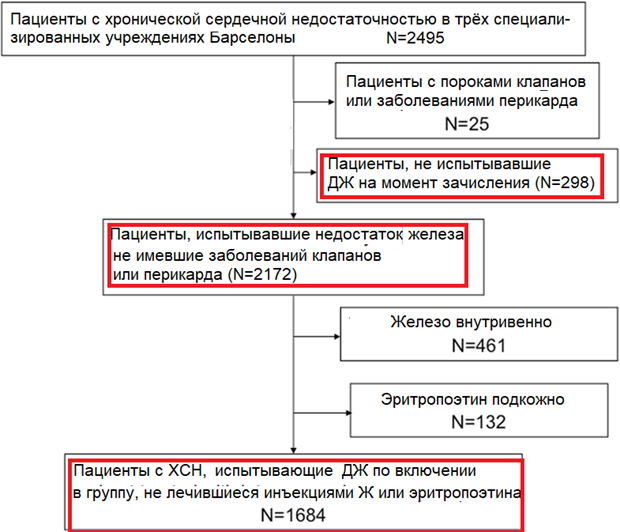 Рисунок 1. Алгоритм распределения участников.105 пациентов, помимо эритропоэтина, получали внутривенные инъекции препаратов железа
Рисунок 1. Алгоритм распределения участников.105 пациентов, помимо эритропоэтина, получали внутривенные инъекции препаратов железа
Таблица 1. Исходные характеристики пациентов, распределенных в группы по дефициту железа
Предикторы ДЖ, установленные в ходе многофакторного анализа, представлены в таблице 2. Величина R2 для многофакторной модели составила 0,05 (5%). Медиана длительности периода последующего наблюдения составила 20 месяцев (межквартильный размах: 12–47).
Таблица 2. Предикторы дефицита железа на основе логистического регрессионного анализа
Дефицит железа и смертность
Среди пациентов с ДЖ зарегистрировано 307 летальных исходов (34%), частота случаев составила 0,134 случаев в год; для сравнения: среди пациентов без ДЖ количество смертей составило 212 (27%), частота случаев – 0,101 в год. Коэффициент частоты случаев составил 1,32 (доверительный интервал (95%): 1,11– 1,57; р = 0,0017). По абсолютному и функциональному ДЖ летальность оказалась примерно одинаковой – 0,145 и 0,128 за год соответственно, p = 0,29. При анализе двух факторов определения ДЖ предиктором смертности являлось низкое значение показателя log-КНТЖ, а не log-ферритин. При многофакторном анализе ДЖ определен в качестве предиктора летальности. В таблице 3 показаны отношения рисков для исследуемых пациентов с использованием однофакторного и многофакторного регрессионного анализа Кокса. При введении показателя log-КНТЖ в многофакторную модель вместо традиционного определения ДЖ log-КНТЖ он не являлся статистически значимым предиктором летальности. На рис. 2 показаны различия между кривыми выживаемости, стратифицированными по ДЖ после корректировки по значимым для многофакторной модели ковариатам.
Таблица 3. Предикторы смертности на основе регрессионной модели Кокса
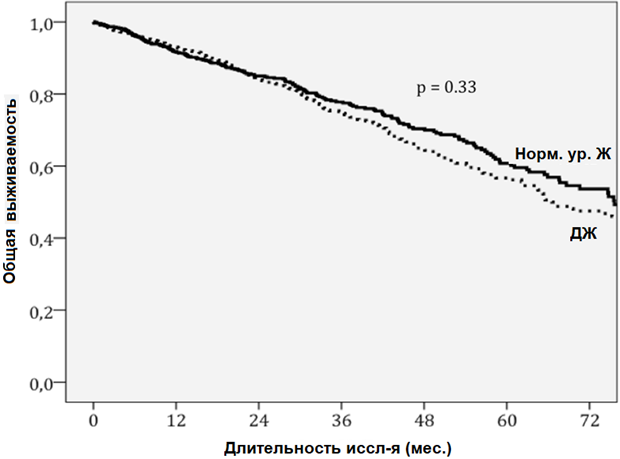 Рисунок 2. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрасту, полу, наличию сахарного диабета, функциональному классу III-LV по стандарту Нью-Йоркской кардиологической ассоциации, уровню гемоглобина, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, уровню натрия в сыворотке крови, лечению ингибитором ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками.
Рисунок 2. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрасту, полу, наличию сахарного диабета, функциональному классу III-LV по стандарту Нью-Йоркской кардиологической ассоциации, уровню гемоглобина, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, уровню натрия в сыворотке крови, лечению ингибитором ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками.
Дефицит железа и частота госпитализаций по причине сердечной недостаточности
Среди пациентов с ДЖ наблюдалось 246 (27%) случаев госпитализации, при этом частота составила 0,121 в год. Для сравнения: среди пациентов без ДЖ наблюдалось 182 (23%) случая госпитализации по поводу СН, частота случаев составила 0,097 в год. Общая частота случаев госпитализации составила 1,24 (доверительный интервал (95%): 1,03–1,51; p = 0,025). Значительных различий в частоте госпитализации по поводу СН у пациентов с функциональным и абсолютным ДЖ не обнаружено. Частота случаев составила 0,110 и 0,125 в год соответственно, p = 0,37. ДЖ не выступал в качестве предиктора частоты госпитализаций по причине СН в рамках многофакторного анализа. В таблице 4 отражены предикторы частоты госпитализации по причине СН после однофакторного и многофакторного анализа. На рис. 3 показаны кривые выживаемости по частоте госпитализации с СН, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам.
Таблица 4. Предикторы частоты госпитализаций на основе регрессионной модели Кокса
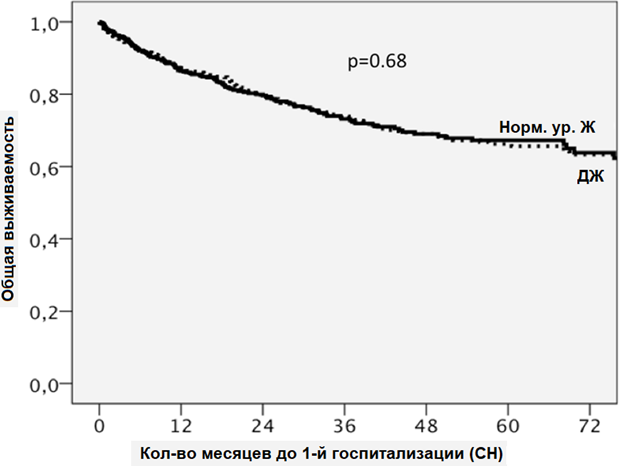 Рисунок 3. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрастy, наличию сахарного диабета, хронической обструктивной болезни легких, сердечной недостаточности с сохраненной фракцией выброса левого желудочка, ишемическим факторам, функциональному классу III–V по стандарту Нью-Йоркской кардиологической ассоциации, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, лечению ингибитором ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками.
Рисунок 3. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрастy, наличию сахарного диабета, хронической обструктивной болезни легких, сердечной недостаточности с сохраненной фракцией выброса левого желудочка, ишемическим факторам, функциональному классу III–V по стандарту Нью-Йоркской кардиологической ассоциации, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, лечению ингибитором ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками.
Дефицит железа и госпитализация по любым причинам
Среди пациентов с ДЖ наблюдалось 465 (52%) случаев госпитализации по любым причинам, при этом их частота составила 0,284 в год. Для сравнения: среди пациентов без ДЖ наблюдалось 182 (23%) случая госпитализации по любым причинам, частота случаев составила 0,226 в год. Общая частота случаев госпитализации составила 1,26 (доверительный интервал (95%): 1,09–1,44; p = 0.001).
У пациентов с функциональным ДЖ частота госпитализаций по любым причинам составила 0,266 в год; для сравнения: у пациентов с абсолютным ДЖ она составила 0,290, p = 0,36. ДЖ не выступал в качестве предиктора частоты госпитализации по различным причинам в рамках многофакторного анализа. В таблице 5 представлены предикторы частоты госпитализации по причине СН после однофакторного и многофакторного анализа. На рис. 4 показаны кривые выживаемости по частоте госпитализации по любым причинам, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам.
Таблица 5. Предикторы частоты госпитализации по любым причинам, вычисленные на основе регрессионной модели Кокса
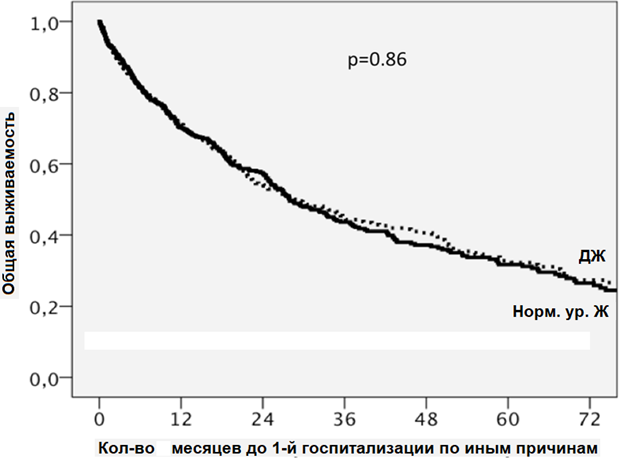 Рисунок 4. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрастy, наличию сахарного диабета, хронической обструктивной болезни легких, сердечной недостаточности с сохраненной фракцией выброса левого желудочка, функциональному классу III–V по стандарту Нью-Йоркской кардиологической ассоциации, частоте сердечных сокращений, уровню гемоглобина, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, лечению ингибиторами ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками
Рисунок 4. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрастy, наличию сахарного диабета, хронической обструктивной болезни легких, сердечной недостаточности с сохраненной фракцией выброса левого желудочка, функциональному классу III–V по стандарту Нью-Йоркской кардиологической ассоциации, частоте сердечных сокращений, уровню гемоглобина, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, лечению ингибиторами ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками
Обсуждение
Основными результатами данного исследования являются следующие наблюдения:
Дефицит железа и летальность
Ранее показано, что ДЖ является фактором увеличения летальности вне зависимости от наличия анемии или ХБП [1, 2, 14]. В то же время уровень гемоглобина является значимым предиктором летальности, что было показано Parikh et al. [3]. О причинах такого результата можно лишь предполагать, однако основным отличием нашего исследования является присутствие значительно большего количества пациентов с СНСФВЛ по сравнению с исследованием Jankowska et al. [1], куда не были включены пациенты с данным диагнозом, а также по сравнению с исследованием Klip et al. [14], где исследуемая группа включала 13% пациентов с СНСФВЛ. В исследовании Parikh et al. [3] данные для этой категории отсутствуют, однако, учитывая относительно высокие показатели среднего систолического давления, большое количество женщин в группе и возраст участников, можно предположить, что у многих пациентов данной когорты наблюдался СНСФВЛ. При оценке ДЖ в качестве предиктора летальности у пациентов с систолической дисфункцией в исследуемой нами когорте пациентов ДЖ не являлся значимым предиктором при многофакторном анализе. Пациенты в исследуемой нами когорте, вероятно, были старше, и у них чаще наблюдались ХБП и анемия по сравнению с пациентами, участвовавшими в трех вышеупомянутых исследованиях. Это может означать, что другие факторы помимо ДЖ могут играть более значимую роль в оценке летальности среди пациентов исследуемой нами когорты. В остальном переменные, являвшиеся показателями летальности в исследуемой нами группе, мало отличались от описанных ранее [9, 15].
Мы использовали определение ДЖ в соответствии со стандартом исследования FAIR-HF [8]. Тем не менее диагностика на основе КНТЖ и ферритина может быть неприемлемой в случаях СН на поздней стадии или при ее обострении, где ферритин не является надежным маркером ДЖ [16]. В исследуемой группе пациентов с ХСН при однофакторном анализе уровень ферритина не являлся предиктором летальности, а стимулом неблагоприятного прогноза являлся КНТЖ.
Дефицит железа и частота госпитализаций
Госпитализации по причине СН часто наблюдаются у пациентов с ХСН и ассоциированы с увеличением смертности [17], ухудшением качества жизни пациентов, а также экономической нагрузкой на систему здравоохранения [18]. Хотя ДЖ оказался одним из основных факторов качества жизни, связанного с состоянием здоровья пациентов с ХСН [19], мы не можем с уверенностью говорить о том, что взаимосвязь между ДЖ и увеличением частоты госпитализаций по причине СН или по иным причинам достаточно изучена. Наше исследование является первым исследованием такого рода. Мы выявили взаимосвязь между ДЖ и частотой госпитализации по причине СН с использованием однофакторной модели. При этом данная взаимосвязь не выявляется при использовании многофакторного анализа. Проанализировав предикторы частоты госпитализаций, связанных с СН, мы обнаружили их сходство с предикторами летальности. Различие заключалось в том, что низкий уровень натрия в сыворотке крови и низкий уровень гемоглобина ассоциированы с увеличением летальности, но не частоты госпитализаций по причине СН. С другой стороны, хроническая обструктивная болезнь легких, СНСФВЛ и ишемические факторы ассоциированы с увеличением частоты госпитализаций по причине СН, но не увеличением летальности. У пациентов с ХСН, подобных тем, которые участвовали в нашем исследовании или в недавних регистровых исследованиях, как правило, наблюдается целый ряд сопутствующих заболеваний, которые могут привести к госпитализации [20]. Именно поэтому мы включили в исследование показатель госпитализации по любым причинам. В однофакторной модели ДЖ выступил в роли предиктора частоты госпитализаций по любым причинам, но в то же время многофакторный анализ не выявил такой взаимосвязи. Обнаружено множество предикторов госпитализации по любым причинам, которые включали в себя все предикторы летальности и госпитализации по причине СН, за исключением пациентов женского пола и содержания натрия в сыворотке крови, включая частоту сердечных сокращений. Особенностью нашего анализа стало то, что СНСФВЛ ассоциирована с увеличением риска госпитализации по причине СН или любой иной причине. Это может быть связано не только с СН, но также с сопутствующими сердечно-сосудистыми и другими заболеваниями, наблюдающимися у пациентов с СН. [21]. Мы обнаружили, что одним из таких заболеваний у пациентов с СНСФВЛ является хроническая обструктивная болезнь легких [22]. Следует отметить, что в исследуемой нами группе это заболевание в значительной степени было ассоциировано с увеличением частоты госпитализаций по причине СН и любым причинам, но не с уровнем летальности. Это наблюдалось и в других исследованиях с участием пациентов с СН [23, 24].
Вероятно, что в процессе исследования могли присутствовать и другие факторы, которые могли снизить значимость ДЖ в качестве предиктора частоты госпитализаций. Тем не менее пациенты в исследуемой нами группе мало отличаются от обычных пациентов, встречающихся в клинической практике [18]. Полученные нами результаты призывают к осторожному трактованию факта ассоциации ДЖ с увеличением частоты госпитализаций по причине СН или любым причинам. Поэтому для дальнейшей оценки данной ассоциации необходимы дальнейшие исследования. Так, недавно был опубликован доклад, в котором ДЖ связан с частотой повторной госпитализации пациентов с острой СН в течение 30 дней после выписки [25].
Недостаток железа у пациентов без анемии
В ходе исследования FAIR-HF лечение ДЖ карбоксимальтозатом железа у пациентов с ХСН оказалось эффективным вне зависимости от установленной анемии [26]. Учитывая, что в нашем исследовании именно анемия, а не ДЖ, выступила в качестве предиктора летальности, мы изучили взаимосвязь между ДЖ и прогнозом у пациентов, не страдавших анемией. Хотя ДЖ оказался маркером увеличения смертности и частоты госпитализаций при однофакторном анализе, данная взаимосвязь не была выявлена при использовании многофакторного анализа.
Ограничения
Данное исследование не учитывает значимость других маркеров ДЖ, например, уровня растворимого рецептора трансферрина, уровня гепцидина или ферритиновый индекс, которые являются лучшими показателями для оценки метаболизма железа у пациентов с ХСН [5, 27, 28]. Кроме того, мы не включили показатели уровня С-реактивного белка, высокочувствительного сердечного тропонина Т, высокочувствительного растворимого ST2, которые были ранее ассоциированы с увеличением смертности у пациентов с ХСН [3, 15]. Мы не располагали данными об иных заболеваниях, не относящихся к сердечно-сосудистой системе, например, онкологических заболеваниях, нарушениях функции печени, которые вполне могли повлиять на исход среди пожилых участников.
Также мы исключили из исследования пациентов, получавших внутривенные инъекции железосодержащих препаратов или эритропоэтина, что могло бы привести к искажению результатов. В то же время на момент проведения исследования такое лечение не было одобрено соответствующими руководствами, и поскольку эти процедуры могли повлиять на уровень железа в организме, было решено исключить из исследования данных пациентов.
Также нами не был учтен фактор числа повторных госпитализаций, который является важным исходом, влияющим на качество жизни пациента с СН.
Вывод
В актуальной группе пациентов с ХСН ДЖ наблюдается у большей части участников. Тем не менее при применении многофакторного анализа его присутствие не является предиктором увеличения летальности или частоты госпитализаций по причине СН или любым иным причинам. Для оценки прогностической значимости фактора ДЖ потребуются новые исследования с участием пациентов с ХСН и большей частотой СНСФВЛ.
Список использованной литературы
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) ( Creative Commons — Attribution 4.0 International — CC BY 4.0)
Хосе Гонсалес-Костелло, Хосеп Колин-Колет, Хосеп Лупон, Кристина Энхуанес, Марта де Антонио, Лара Фуэнтес, Педро Молинер-Борха, Нурия Фарре, Элизабет Самора, Николас Манито, Рамон Пухоль, Антони Байес-Генис
BMC Cardiovascular Disorders201818:206
Аннотация
Введение
Дефицит железа (ДЖ) у пациентов с хронической сердечной недостаточностью (ХСН) считается неблагоприятным прогностическим фактором. Цель нашего исследования – выявление взаимосвязи между летальностью и частотой госпитализаций и ДЖ у пациентов с ХСН.
Методы
Мы оценили степень ДЖ у пациентов с ХСН в трех университетских клиниках. По типам ДЖ разделяли на абсолютный (уровень ферритина < 100 мкг/л) и функциональный (коэффициент насыщения трансферрина железом < 20%, уровень ферритина от 100 до 299 мкг/л). Мы исключили пациентов, получавших внутривенные инъекции железа или эритропоэтина на период последующего наблюдения. Мы оценили использование ДЖ в качестве прогностического фактора летальности и частоты госпитализаций при сердечной недостаточности либо по любой другой причине методом однофакторного и многофакторного регрессионного анализа Кокса.
Результат
В исследовании включили 1684 пациента: 65% – мужчины, у 38% диагностирован диабет; средний возраст участников – 72 года, 37% принадлежали к функциональным классам III и IV, у 30% пациентов фракция выброса левого желудочка составляла более 45%. Пациенты получали качественное лечение, 87% и 88% из них получали лечение ингибиторами ренин-ангиотензина и бета-блокаторами соответственно. Средний коэффициент насыщения трансферина составил 20%, средний уровень ферритина – 155 нг/мл, средний уровень гемоглобина – 13 г/дл. ДЖ обнаружен у 53% пациентов; у 35% он был абсолютным, у 18% – функциональным. Средняя продолжительность последующего наблюдения составила 20 месяцев. ДЖ являлся предиктором летальности и частоты госпитализации по причине сердечной недостаточности или любых других причин при однофакторном, но не многофакторном анализе данных. С точки зрения прогноза различий между абсолютным и функциональным ДЖ найдено не было.
Вывод
Для группы пациентов с ХСН и высокой частотой случаев острой сердечной недостаточности с сохраненной фракцией выброса крови ДЖ не выступал в качестве предиктора летальности или частоты госпитализаций после поправки на наличие сопутствующих заболеваний, функциональный класс и проведение нейрогормонального лечения.
Ключевые слова
- Хроническая сердечная недостаточность
- Дефицит железа
- Летальность
- Госпитализация
До 50% людей, страдающих хронической сердечной недостаточностью (ХСН), испытывают дефицит железа (ДЖ), который признан одним из факторов неблагоприятного прогноза развития данного заболевания вне зависимости от присутствия анемии и хронических болезней почек (ХБП) [1, 2]. Тем не менее в другом исследовании с участием взрослых пациентов, не находящихся в стационаре и утверждавших о наличии у них сердечной недостаточности, взаимосвязи между ДЖ и летальностью, обусловленной сердечной недостаточностью или иными причинами, выявлено не было. При этом уровень гемоглобина и С-реактивного белка являлись предикторами худшей выживаемости [3]. ДЖ часто сопутствуют анемия и (или) ХБП на фоне СН, при этом наличие ДЖ увеличивает риск летального исхода либо как самостоятельный фактор, либо вместе с анемией, ХБП или обоими заболеваниями [2].
Несмотря на то что роль ДЖ в развитии ХСН до сих пор не ясна и рассматривается в сочетании со многими факторами [4, 5, 6], лечение ДЖ у этих пациентов стало терапевтической целью. Прием железа внутрь не связан с увеличением физической активности пациентов с ХСН и нарушениями выброса крови [7]. Недавние рандомизированные исследования показали, что внутривенные инъекции препаратов железа увеличивают способность переносить физические нагрузки, увеличивают сердечную функцию, смягчают тяжесть симптомов и повышают качество жизни пациентов с ХСН и систолической дисфункцией левого желудочка [8, 9, 10, 11]. В недавнем исследовании CONFIRM-HF риск госпитализации в связи с ухудшением симптомов сердечной недостаточности оказалась ниже у пациентов, принимавших железа карбоксимальтозат, чем в группе участников, принимавших плацебо. В то же время отсутствуют исследования, изучающие частоту госпитализаций по причине ХСН или по любым причинам среди пациентов с ХСН и ДЖ.
Учитывая важность снижения смертности и частоты госпитализаций пациентов с ХСН, а также снижения частоты госпитализаций при внутривенном введении препаратов железа, мы решили провести оценку наличия ДЖ в качестве прогностического фактора в когорте, состоявшей из пациентов с ХСН, наблюдавшихся амбулаторно в нескольких медицинских центрах. Мы сделали упор на летальность и частоту госпитализаций из-за обострения ХСН либо по иным причинам.
Методы
Дизайн исследования
Данное исследование являлось ретроспективным обсервационным когортным исследованием пациентов с сердечной недостаточностью и направлено на определение наличия ДЖ и его влияния на частоту последующих госпитализаций и летальность в период наблюдения.
Состав участников
2495 пациентов с диагнозом «устойчивая ХСН» были включены в исследование в трех многопрофильных отделениях, специализирующихся на лечении ХСН, трех специализированных клиниках Испании. Пациенты были включены в проспективное исследование в период с 2005 по 2012 гг. Пациенты должны были иметь диагноз «ХСН» в соответствии с критериями, установленными Европейским кардиологическим сообществом [12]. Мы определяли ХСН с сохранением фракции выброса левого желудочка (ФВЛЖ) при ФВЛЖ более 50%, а также при присутствии объективных признаков нарушения функции сердца (увеличение левого предсердия, диастолическая дисфункция или повышение уровня натрийуретических пептидов). Пациенты, не прошедшие оценку уровня железа перед включением в исследование, а также те, у кого имелись признаки первичных нарушений функций клапанов и перикарда, были исключены из исследования. Из оставшихся 2172 пациентов по результатам оценки аптечных формуляров мы исключили пациентов, получавших внутривенные инъекции железосодержащих препаратов либо подкожные инъекции эритропоэтина в любое время в течение периода последующего наблюдения, поскольку такое лечение могло повлиять на результат исследования. В итоге были проанализированы данные 1684 пациентов. Лечение назначалось в соответствии со стандартом, установленным Европейским кардиологическим сообществом [12].
Каждый пациент предоставил письменное информированное согласие. Исследование проводилось в соответствии с требованиями Хельсинской декларации. Протокол исследования одобрен местными этическими комитетами.
Методика анализа объединенных данных
Сбор данных для исследования проводился проспективно, данные собирали непосредственно у каждого пациента. Конечными точками данного исследования было определение летальности от всех причин, частоты первичных госпитализаций в связи с СН, а также в связи с любыми причинами после помещения в специализированное для лечения СН отделение. Жизненный статус пациентов и частота госпитализаций оценивались путем изучения клинических баз данных, карт стационарного пациента, либо данных, полученных в ходе прямых контактов с пациентами и/или их родственниками. Наблюдения продолжались вплоть до смерти пациента либо последнего визита в амбулаторное лечебное учреждение до октября 2015 года. Если пациент по каким-либо причинам был утрачен для последующего наблюдения, мы связывались с ним/ней либо его/ее родственниками по телефону для получения данных о его жизненном статусе и/или количестве госпитализаций. В случае невозможности установления связи по телефону мы изучали электронную историю болезни пациента, предоставленную клиникой либо учреждением первичной медицинской помощи, и определяли текущий жизненный статус пациента и частоту госпитализаций. Если несмотря на эти шаги получить информацию о жизни/смерти и госпитализациях не удавалось, дата окончания наблюдения приравнивалась к дате последнего визита в амбулаторное лечебное учреждение. Во время последующего наблюдения пять пациентов перенесли операцию по пересадке сердца, что приравнивалось к смерти и окончанию периода исследования. Ни один из пациентов не пользовался устройствами, стимулирующими работу желудочка.
Содержание железа и другие лабораторные показатели
При включении пациента в исследовании оценивали следующие показатели крови, отражающие содержание железа: уровень железа в сыворотке крови (мкг/дл) измеряли методом спектрофотометрии; уровень ферритина (нг/мл) и трансферрина (мг/дл) измерялись методом иммунотурбидиметрии. Коэффициент насыщения трансферрина железом (КНТЖ) рассчитывали по формуле: КНТЖ = сыв. железо (мкг/дл)/[сыв. трансферрин (мг/дл) х 1,25] [13]. ДЖ считался абсолютным при уровне ферритина < 100 нг/мл, функциональным – при КНТЖ <20% и уровне ферритина 100–299 нг/мл [8].
Уровень гемоглобина измеряли методом лазерной колориметрии, анемию диагностировали при уровне гемоглобина < 12 г/дл у женщин и < 13 г/дл у мужчин. Концентрацию n-терминального мозгового натрийуретического пропептида (NT-proBNP) измеряли методом электрохемилюминесцентного иммуноанализа с помощью анализатора Elecsys («Роше Диагностикс», Базель (Швейцария)). Почечная функция оценивалась на основе коэффициента клубочковой фильтрации с использованием уравнения MDRD (назначение диеты при болезнях почек).
Статистический анализ
Нормальное распределение непрерывных переменных оценивали с использованием гистограмм и критерия Шапиро – Уилка. Сравнение количественных переменных между двумя группами проводили с помощью t-критерия Стьюдента, применявшегося при нормальном распределении величин, а также с помощью U-критерия Манна – Уитни при ненормальном распределении величин. Критерий Хи-квадрат использовали для анализа категориальных величин. При ожидаемом количестве клеток ниже 5 использовали критерий Фишера.
Проводили логарифмическую трансформацию непрерывных величин с неравномерным распределением таких как КНТЖ, уровень ферритина и NT-proBNP. Полученные показатели обозначали следующим образом: log-КНТЖ, log-ферритин и log-NT-proBNP. Чтобы определить корреляцию переменных, используемых в многофакторном регрессионном анализе, проводили оценку коллинеарности с использованием фактора увеличения дисперсии. Максимальный фактор увеличения дисперсии, отмеченный среди основных величин, был равен 1,5, что свидетельствовало о низкой коллинеарности.
Для оценки предикторов ДЖ, мы использовали многофакторный логистический регрессионный анализ. Все первоначальные величины, имевшие значимую однофакторную взаимосвязь (p < 0,10) либо считавшиеся клинически значимыми, вводились на основе модели обратного многомерного анализа с использованием критериев исключения с p > 0,10. Дополнительный бутстрэп-анализ (1000 циклов) многофакторной модели применяли для определения точности оцениваемой модели. Кроме того, для оценки многофакторной модели была определена величина R2.
Соотношение летальности и частоты госпитализаций, вызванных СН либо любыми другими причинами, рассчитывали путем отношения показателей частот у пациентов двух категорий: группы пациентов с ДЖ и пациентов без ДЖ. Значимость показателей оценивали с помощью критерия хи-квадрата Мантеля – Гензеля.
Выживаемость и время до первой госпитализации, связанной с сердечной недостаточностью или иными причинами, оценивали с использованием кривых выживаемости Каплана – Майера. Оценку того, является ли ДЖ предиктором уровня выживаемости или количества госпитализаций, проводили с использованием однофакторного регрессионного анализа пропорциональности рисков Кокса. Используя величины, являвшиеся статистическими значимыми в рамках однофакторного анализа (p < 0,10), а также клинически значимые величины проводили обратный многофакторный регрессионный анализ пропорциональности риска Кокса, критерий исключения составлял p > 0,10. ДЖ включен в окончательный многофакторный анализ, поскольку он является целью нашего исследования. Допущение пропорциональности в рамках регрессионного анализа оценивали путем остаточного анализа. Установленный показатель значимости p < 0,05 (двусторонний), при этом при проведении всех статистических оценок использовались программы SPSS версии 18 и Stata 14.
Результат
В исследовании участвовало 1684 пациента (см. рис. 1), их исходные характеристики представлены в таблице 1. На момент включения в исследование ДЖ наблюдался у 898 (53%) участников. У 35% он был абсолютным, у 18% – функциональным. У 953 (57%) участников не было выраженных признаков анемии, при этом ДЖ наблюдался у 460 (48%) пациентов. Из 731 пациентов, имевших признаки анемии, ДЖ наблюдался у 438 (60%).
 Рисунок 1. Алгоритм распределения участников.105 пациентов, помимо эритропоэтина, получали внутривенные инъекции препаратов железа
Рисунок 1. Алгоритм распределения участников.105 пациентов, помимо эритропоэтина, получали внутривенные инъекции препаратов железаТаблица 1. Исходные характеристики пациентов, распределенных в группы по дефициту железа
Предикторы ДЖ, установленные в ходе многофакторного анализа, представлены в таблице 2. Величина R2 для многофакторной модели составила 0,05 (5%). Медиана длительности периода последующего наблюдения составила 20 месяцев (межквартильный размах: 12–47).
Таблица 2. Предикторы дефицита железа на основе логистического регрессионного анализа
Дефицит железа и смертность
Среди пациентов с ДЖ зарегистрировано 307 летальных исходов (34%), частота случаев составила 0,134 случаев в год; для сравнения: среди пациентов без ДЖ количество смертей составило 212 (27%), частота случаев – 0,101 в год. Коэффициент частоты случаев составил 1,32 (доверительный интервал (95%): 1,11– 1,57; р = 0,0017). По абсолютному и функциональному ДЖ летальность оказалась примерно одинаковой – 0,145 и 0,128 за год соответственно, p = 0,29. При анализе двух факторов определения ДЖ предиктором смертности являлось низкое значение показателя log-КНТЖ, а не log-ферритин. При многофакторном анализе ДЖ определен в качестве предиктора летальности. В таблице 3 показаны отношения рисков для исследуемых пациентов с использованием однофакторного и многофакторного регрессионного анализа Кокса. При введении показателя log-КНТЖ в многофакторную модель вместо традиционного определения ДЖ log-КНТЖ он не являлся статистически значимым предиктором летальности. На рис. 2 показаны различия между кривыми выживаемости, стратифицированными по ДЖ после корректировки по значимым для многофакторной модели ковариатам.
Таблица 3. Предикторы смертности на основе регрессионной модели Кокса
 Рисунок 2. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрасту, полу, наличию сахарного диабета, функциональному классу III-LV по стандарту Нью-Йоркской кардиологической ассоциации, уровню гемоглобина, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, уровню натрия в сыворотке крови, лечению ингибитором ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками.
Рисунок 2. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрасту, полу, наличию сахарного диабета, функциональному классу III-LV по стандарту Нью-Йоркской кардиологической ассоциации, уровню гемоглобина, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, уровню натрия в сыворотке крови, лечению ингибитором ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками. Дефицит железа и частота госпитализаций по причине сердечной недостаточности
Среди пациентов с ДЖ наблюдалось 246 (27%) случаев госпитализации, при этом частота составила 0,121 в год. Для сравнения: среди пациентов без ДЖ наблюдалось 182 (23%) случая госпитализации по поводу СН, частота случаев составила 0,097 в год. Общая частота случаев госпитализации составила 1,24 (доверительный интервал (95%): 1,03–1,51; p = 0,025). Значительных различий в частоте госпитализации по поводу СН у пациентов с функциональным и абсолютным ДЖ не обнаружено. Частота случаев составила 0,110 и 0,125 в год соответственно, p = 0,37. ДЖ не выступал в качестве предиктора частоты госпитализаций по причине СН в рамках многофакторного анализа. В таблице 4 отражены предикторы частоты госпитализации по причине СН после однофакторного и многофакторного анализа. На рис. 3 показаны кривые выживаемости по частоте госпитализации с СН, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам.
Таблица 4. Предикторы частоты госпитализаций на основе регрессионной модели Кокса
 Рисунок 3. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрастy, наличию сахарного диабета, хронической обструктивной болезни легких, сердечной недостаточности с сохраненной фракцией выброса левого желудочка, ишемическим факторам, функциональному классу III–V по стандарту Нью-Йоркской кардиологической ассоциации, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, лечению ингибитором ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками.
Рисунок 3. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрастy, наличию сахарного диабета, хронической обструктивной болезни легких, сердечной недостаточности с сохраненной фракцией выброса левого желудочка, ишемическим факторам, функциональному классу III–V по стандарту Нью-Йоркской кардиологической ассоциации, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, лечению ингибитором ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками.Дефицит железа и госпитализация по любым причинам
Среди пациентов с ДЖ наблюдалось 465 (52%) случаев госпитализации по любым причинам, при этом их частота составила 0,284 в год. Для сравнения: среди пациентов без ДЖ наблюдалось 182 (23%) случая госпитализации по любым причинам, частота случаев составила 0,226 в год. Общая частота случаев госпитализации составила 1,26 (доверительный интервал (95%): 1,09–1,44; p = 0.001).
У пациентов с функциональным ДЖ частота госпитализаций по любым причинам составила 0,266 в год; для сравнения: у пациентов с абсолютным ДЖ она составила 0,290, p = 0,36. ДЖ не выступал в качестве предиктора частоты госпитализации по различным причинам в рамках многофакторного анализа. В таблице 5 представлены предикторы частоты госпитализации по причине СН после однофакторного и многофакторного анализа. На рис. 4 показаны кривые выживаемости по частоте госпитализации по любым причинам, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам.
Таблица 5. Предикторы частоты госпитализации по любым причинам, вычисленные на основе регрессионной модели Кокса
 Рисунок 4. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрастy, наличию сахарного диабета, хронической обструктивной болезни легких, сердечной недостаточности с сохраненной фракцией выброса левого желудочка, функциональному классу III–V по стандарту Нью-Йоркской кардиологической ассоциации, частоте сердечных сокращений, уровню гемоглобина, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, лечению ингибиторами ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретиками
Рисунок 4. Кривые выживаемости, стратифицированные по ДЖ после корректировки по значимым для многофакторной модели ковариатам: возрастy, наличию сахарного диабета, хронической обструктивной болезни легких, сердечной недостаточности с сохраненной фракцией выброса левого желудочка, функциональному классу III–V по стандарту Нью-Йоркской кардиологической ассоциации, частоте сердечных сокращений, уровню гемоглобина, логарифмической трансформации показателя N-терминального мозгового натрийуретического пропептида, лечению ингибиторами ангиотензинпревращающих ферментов или блокатором рецепторов ангиотензина-II, бета-блокаторами и диуретикамиОбсуждение
Основными результатами данного исследования являются следующие наблюдения:
- ДЖ наблюдался у больше чем половины амбулаторных пациентов с хронической СН.
- При использовании многофакторной модели ДЖ является предиктором летальности.
- При использовании многофакторной модели ДЖ не является предиктором частоты госпитализаций по причине СН или иным причинам.
Дефицит железа и летальность
Ранее показано, что ДЖ является фактором увеличения летальности вне зависимости от наличия анемии или ХБП [1, 2, 14]. В то же время уровень гемоглобина является значимым предиктором летальности, что было показано Parikh et al. [3]. О причинах такого результата можно лишь предполагать, однако основным отличием нашего исследования является присутствие значительно большего количества пациентов с СНСФВЛ по сравнению с исследованием Jankowska et al. [1], куда не были включены пациенты с данным диагнозом, а также по сравнению с исследованием Klip et al. [14], где исследуемая группа включала 13% пациентов с СНСФВЛ. В исследовании Parikh et al. [3] данные для этой категории отсутствуют, однако, учитывая относительно высокие показатели среднего систолического давления, большое количество женщин в группе и возраст участников, можно предположить, что у многих пациентов данной когорты наблюдался СНСФВЛ. При оценке ДЖ в качестве предиктора летальности у пациентов с систолической дисфункцией в исследуемой нами когорте пациентов ДЖ не являлся значимым предиктором при многофакторном анализе. Пациенты в исследуемой нами когорте, вероятно, были старше, и у них чаще наблюдались ХБП и анемия по сравнению с пациентами, участвовавшими в трех вышеупомянутых исследованиях. Это может означать, что другие факторы помимо ДЖ могут играть более значимую роль в оценке летальности среди пациентов исследуемой нами когорты. В остальном переменные, являвшиеся показателями летальности в исследуемой нами группе, мало отличались от описанных ранее [9, 15].
Мы использовали определение ДЖ в соответствии со стандартом исследования FAIR-HF [8]. Тем не менее диагностика на основе КНТЖ и ферритина может быть неприемлемой в случаях СН на поздней стадии или при ее обострении, где ферритин не является надежным маркером ДЖ [16]. В исследуемой группе пациентов с ХСН при однофакторном анализе уровень ферритина не являлся предиктором летальности, а стимулом неблагоприятного прогноза являлся КНТЖ.
Дефицит железа и частота госпитализаций
Госпитализации по причине СН часто наблюдаются у пациентов с ХСН и ассоциированы с увеличением смертности [17], ухудшением качества жизни пациентов, а также экономической нагрузкой на систему здравоохранения [18]. Хотя ДЖ оказался одним из основных факторов качества жизни, связанного с состоянием здоровья пациентов с ХСН [19], мы не можем с уверенностью говорить о том, что взаимосвязь между ДЖ и увеличением частоты госпитализаций по причине СН или по иным причинам достаточно изучена. Наше исследование является первым исследованием такого рода. Мы выявили взаимосвязь между ДЖ и частотой госпитализации по причине СН с использованием однофакторной модели. При этом данная взаимосвязь не выявляется при использовании многофакторного анализа. Проанализировав предикторы частоты госпитализаций, связанных с СН, мы обнаружили их сходство с предикторами летальности. Различие заключалось в том, что низкий уровень натрия в сыворотке крови и низкий уровень гемоглобина ассоциированы с увеличением летальности, но не частоты госпитализаций по причине СН. С другой стороны, хроническая обструктивная болезнь легких, СНСФВЛ и ишемические факторы ассоциированы с увеличением частоты госпитализаций по причине СН, но не увеличением летальности. У пациентов с ХСН, подобных тем, которые участвовали в нашем исследовании или в недавних регистровых исследованиях, как правило, наблюдается целый ряд сопутствующих заболеваний, которые могут привести к госпитализации [20]. Именно поэтому мы включили в исследование показатель госпитализации по любым причинам. В однофакторной модели ДЖ выступил в роли предиктора частоты госпитализаций по любым причинам, но в то же время многофакторный анализ не выявил такой взаимосвязи. Обнаружено множество предикторов госпитализации по любым причинам, которые включали в себя все предикторы летальности и госпитализации по причине СН, за исключением пациентов женского пола и содержания натрия в сыворотке крови, включая частоту сердечных сокращений. Особенностью нашего анализа стало то, что СНСФВЛ ассоциирована с увеличением риска госпитализации по причине СН или любой иной причине. Это может быть связано не только с СН, но также с сопутствующими сердечно-сосудистыми и другими заболеваниями, наблюдающимися у пациентов с СН. [21]. Мы обнаружили, что одним из таких заболеваний у пациентов с СНСФВЛ является хроническая обструктивная болезнь легких [22]. Следует отметить, что в исследуемой нами группе это заболевание в значительной степени было ассоциировано с увеличением частоты госпитализаций по причине СН и любым причинам, но не с уровнем летальности. Это наблюдалось и в других исследованиях с участием пациентов с СН [23, 24].
Вероятно, что в процессе исследования могли присутствовать и другие факторы, которые могли снизить значимость ДЖ в качестве предиктора частоты госпитализаций. Тем не менее пациенты в исследуемой нами группе мало отличаются от обычных пациентов, встречающихся в клинической практике [18]. Полученные нами результаты призывают к осторожному трактованию факта ассоциации ДЖ с увеличением частоты госпитализаций по причине СН или любым причинам. Поэтому для дальнейшей оценки данной ассоциации необходимы дальнейшие исследования. Так, недавно был опубликован доклад, в котором ДЖ связан с частотой повторной госпитализации пациентов с острой СН в течение 30 дней после выписки [25].
Недостаток железа у пациентов без анемии
В ходе исследования FAIR-HF лечение ДЖ карбоксимальтозатом железа у пациентов с ХСН оказалось эффективным вне зависимости от установленной анемии [26]. Учитывая, что в нашем исследовании именно анемия, а не ДЖ, выступила в качестве предиктора летальности, мы изучили взаимосвязь между ДЖ и прогнозом у пациентов, не страдавших анемией. Хотя ДЖ оказался маркером увеличения смертности и частоты госпитализаций при однофакторном анализе, данная взаимосвязь не была выявлена при использовании многофакторного анализа.
Ограничения
Данное исследование не учитывает значимость других маркеров ДЖ, например, уровня растворимого рецептора трансферрина, уровня гепцидина или ферритиновый индекс, которые являются лучшими показателями для оценки метаболизма железа у пациентов с ХСН [5, 27, 28]. Кроме того, мы не включили показатели уровня С-реактивного белка, высокочувствительного сердечного тропонина Т, высокочувствительного растворимого ST2, которые были ранее ассоциированы с увеличением смертности у пациентов с ХСН [3, 15]. Мы не располагали данными об иных заболеваниях, не относящихся к сердечно-сосудистой системе, например, онкологических заболеваниях, нарушениях функции печени, которые вполне могли повлиять на исход среди пожилых участников.
Также мы исключили из исследования пациентов, получавших внутривенные инъекции железосодержащих препаратов или эритропоэтина, что могло бы привести к искажению результатов. В то же время на момент проведения исследования такое лечение не было одобрено соответствующими руководствами, и поскольку эти процедуры могли повлиять на уровень железа в организме, было решено исключить из исследования данных пациентов.
Также нами не был учтен фактор числа повторных госпитализаций, который является важным исходом, влияющим на качество жизни пациента с СН.
Вывод
В актуальной группе пациентов с ХСН ДЖ наблюдается у большей части участников. Тем не менее при применении многофакторного анализа его присутствие не является предиктором увеличения летальности или частоты госпитализаций по причине СН или любым иным причинам. Для оценки прогностической значимости фактора ДЖ потребуются новые исследования с участием пациентов с ХСН и большей частотой СНСФВЛ.
Список использованной литературы
- Jankowska EA, Rozentryt P, Witkowska A, Nowak J, Hartman O, Ponikowska B, et al. Iron deficiency: an ominous sign in patients with systolic chronic heart failure. Eur Heart J. 2010;31:1872–80. View ArticleGoogle Scholar
- Klip IT, Jankowska EA, Enjuanes C, Voors AA, Banasiak W, Bruguera J, et al. The additive burden of iron deficiency in the cardiorenal-anaemia axis: scope of a problem and its consequences. Eur J Heart Fail. 2014;16:655–62. View ArticleGoogle Scholar
- Parikh A, Natarajan S, Lipsitz SR, Katz SD. Iron deficiency in community-dwelling US adults with self-reported heart failure in the National Health and nutrition examination survey III. Prevalence and association with anaemia and inflammation. Circ Heart Fail. 2011;4:599–606. View ArticleGoogle Scholar
- González-Costello J, Comin-Colet J. Iron deficiency and anaemia in heart failure: understanding the FAIR-HF trial. Eur J Heart Fail. 2010;12:1159–62. View ArticleGoogle Scholar
- Jankowska EA, Malyszko J, Ardehali H, Koc-Zorawska E, Banasiak W, von Haehling S, et al. Iron status in patients with chronic heart failure. Eur Heart J. 2013;34:827–34. View ArticleGoogle Scholar
- Haddad S, Wang Y, Galy B, Korf-Klingebiel M, Hirsch V, Baru AM, et al. Iron-regulatory proteins secure iron availability in cardiomyocytes to prevent heart failure. Eur Heart J. 2017;38:362–72. PubMedGoogle Scholar
- Lewis GD, Malhotra R, Hernandez AF, McNulty SE, Smith A, Felker M, et al. Effect of oral iron repletion on exercise capacity in patients with heart failure with reduced ejection fraction and iron deficiency. The IRONOUT HF randomized clinical trial. JAMA. 2017;317:1958–66. View ArticleGoogle Scholar
- Anker SD, Colet JC, Filippatos G, Willenheimer R, Dickstein K, Drexler H, et al. Ferric carboxymaltose in patients with heart failure and iron deficiency. N Engl J Med. 2009;361:2436–48. View ArticleGoogle Scholar
- Ponikowski P, van Veldhuisen DJ, Comin-Colet J, Ertl G, Komajda M, Mareev V, et al. Beneficial effects of long-term intravenous iron therapy with ferric carboxymaltose in patients with symptomatic heart failure and iron deficiency. Eur Heart J. 2014;36:657–68. View ArticleGoogle Scholar
- Jankowska EA, Tkaczyszyn M, Suchocki T, Drozd M, von Haeling S, Doehner W, et al. Effects of intravenous iron therapy in iron-deficient patients with systolic heart failure: a meta-analysis of randomized controlled trials. Eur J Heart Fail. 2016;18:786–95. View ArticleGoogle Scholar
- Van Veldhuisen DJ, Ponikowski P, van der Meer P, Metra M, Bohm M, Doletsky A, et al. Effect of ferric carboxymaltose on exercise capacity in patients with chronic heart failure and iron deficiency. Circulation. 2017;136:1374–83. View ArticleGoogle Scholar
- Ponikowski P, Voors AA, Anker SD, Bueno H, Cleland JGF, Coats AJS, et al. Guidelines for the diagnosis and treatment of acute and chronic heart failure. The task force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology. Developed with the special contribution of the heart failure association (HFA) of the ESC. Eur Heart J. 2016;37:2129–200. View ArticleGoogle Scholar
- Wu A. Tietz Clinical Guide to Laboratory Tests. 4th ed. St Louis, MO: Saunders Elsevier; 2006. p. 56–61. Google Scholar
- Klip IT, Comin-Colet J, Voors AA, Ponikowski P, Enjuanes C, Banasiak W, et al. Iron deficiency in chronic heart failure: an international pooled analysis. Am Heart J. 2013;165:575–82. View ArticleGoogle Scholar
- Lupón J, de Antonio M, Vila J, Peñafiel J, Galán A, Zamora E, et al. Development of a novel heart failure risk tool: the Barcelona bio-heart failure risk calculator (BCN bio-HF calculator). PLoS One. 2014;9:e85466. View ArticleGoogle Scholar
- Jankowska EA, Kasztura M, Sokolski M, Bronisz M, Nawrocka S, Oleskowska-Florek W, et al. Iron deficiency defined as depleted iron stores accompanied by unmet cellular iron requirements identifies patients at the highest risk of death after an episode of acute heart failure. Eur Heart J. 2014;35:2468–76. View ArticleGoogle Scholar
- Fang J, Mensah GA, Croft JB, Keenan NL. Heart failure-related hospitalization in the U.S., 1979 to 2004. J Am Coll Cardiol. 2008;52:428–34. View ArticleGoogle Scholar
- Berry C, Murdoch DR, McMurray JJ. Economics of chronic heart failure. Eur J Heart Fail. 2001;3:283–91. View ArticleGoogle Scholar
- Comin-Colet J, Enjuanes C, Gonzalez G, Torrens A, Cladellas M, Meroño O, et al. Iron deficiency is a key determinant of health-related quality of life in patients with chronic heart failure regardless of anaemia status. Eur J Heart Fail. 2013;15:1164–72. View ArticleGoogle Scholar
- Crespo-Leiro MG, Segovia-Cubero J, González-Costello J, Bayes-Genis A, López-Fernández S, Roig E, et al. Adherence to the ESC Heart Failure Treatment Guidelines in Spain: ESC Heart Failure Long-term Registry. Rev Esp Cardiol. 2015;68:785–93. View ArticleGoogle Scholar
- Lund LH, Donal E, Oger E, Hage C, Persson H, Haugen-Löfman I, et al. Association between cardiovascular vs. non-cardiovascular co-morbidities and outcomes in heart failure with preserved ejection fraction. Eur J Heart Fail. 2014;16:992–1001. View ArticleGoogle Scholar
- Iversen KK, Kjaergaard J, Akkan D, Kober L, Torp-Pedersen C, Hassager C, et al. Chronic obstructive pulmonary disease in patients admitted with heart failure. J Intern Med. 2008;264:361–9. View ArticleGoogle Scholar
- Rusinaru D, Saaidi I, Godard S, Mahjoub H, Battle C, Tribouilloy C. Impact of chronic obstructive pulmonary disease on long-term outcome of patients hospitalized for heart failure. Am J Cardiol. 2008;101:353–8. View ArticleGoogle Scholar
- Hawkins NM, Huang Z, Pieper KS, Solomon SD, Kober L, Velazquez EJ, et al. Chronic obstructive pulmonary disease is an independent predictor of death but not atherosclerotic events in patients with myocardial infarction: analysis of the valsartan in acute myocardial infarction trial (VALIANT). Eur J Heart Fail. 2009;11:292–8. View ArticleGoogle Scholar
- Núñez J, Comín-Colet J, Miñana G, Núñez E, Santas E, Mollar A, et al. Iron deficiency and risk of early readmission following hospitalization for acute heart failure. Eur J Heart Fail. 2016;18:798–802. View ArticleGoogle Scholar
- Filippatos G, Farmakis D, Comin Colet J, Dickstein K, Lüscher TF, Willenheimer R, et al. Intravenous ferric carboxymaltose in iron deficient chronic heart failure patients with and without anaemia: a subanalysis of the FAIR-HF trial. Eur J Heart Fail. 2013;15:1267–76. View ArticleGoogle Scholar
- Jankowska EA, von Haehling S, Anker SD, Macdougall IC, Ponikowski P. Iron deficiency and heart failure: diagnostic dilemmas and therapeutic perspectives. Eur Heart J. 2013;34:816–29. View ArticleGoogle Scholar
- Cullis JO. Diagnosis and management of anaemia of chronic disease: current status. Br J Haematol. 2011;154:289–30. View ArticleGoogle Scholar





