4202
06 Мая 2021
Renata V. Luthold, Gabriel R. Fernandes, Ana Carolina Franco-de-Moraes, Luciana G.D. Folchetti, Sandra Roberta G. Ferreira
Бразилия
Ключевые слова: витамин D, микробиота кишечника, грамотрицательные бактерии, воспаление
ТЕЗИСЫ
Предпосылка. Благодаря иммуномодулирующим свойствам, статус витамина D имеет значение не только при нарушениях со стороны костной системы, но и других заболеваниях. Имеются данные о том, что дефицит этого витамина приводит к ухудшению функции кишечного барьера, способствуя проникновению эндотоксинов в кровоток и системному воспалению. В немногочисленных исслед...
Бразилия
Ключевые слова: витамин D, микробиота кишечника, грамотрицательные бактерии, воспаление
ТЕЗИСЫ
Предпосылка. Благодаря иммуномодулирующим свойствам, статус витамина D имеет значение не только при нарушениях со стороны костной системы, но и других заболеваниях. Имеются данные о том, что дефицит этого витамина приводит к ухудшению функции кишечного барьера, способствуя проникновению эндотоксинов в кровоток и системному воспалению. В немногочисленных исслед...
Renata V. Luthold, Gabriel R. Fernandes, Ana Carolina Franco-de-Moraes, Luciana G.D. Folchetti, Sandra Roberta G. Ferreira
Бразилия
Ключевые слова: витамин D, микробиота кишечника, грамотрицательные бактерии, воспаление
ТЕЗИСЫ
Предпосылка. Благодаря иммуномодулирующим свойствам, статус витамина D имеет значение не только при нарушениях со стороны костной системы, но и других заболеваниях. Имеются данные о том, что дефицит этого витамина приводит к ухудшению функции кишечного барьера, способствуя проникновению эндотоксинов в кровоток и системному воспалению. В немногочисленных исследованиях изучался вопрос о том, могла ли связь между статусом витамина D и метаболическими нарушениями быть опосредована составом микробиоты кишечника.
Цель. Нами была изучена связь потребления витамина D и концентраций 25(OH)D, циркулирующего в крови, с составом микробиоты кишечника, маркерами воспаления и биохимических профилем у здоровых людей.
Методы. В этом анализе методом поперечного среза 150 молодых здоровых взрослых людей было стратифицировано на тертили в зависимости от потребления и концентраций витамина D, затем проводилось сравнение их клинического и воспалительного профиля. Для сравнения состава микробиоты использовали программное обеспечение DESeq2 и изменения, кратные log2 (log2FC), отражали сопоставление с эталонной концентрацией. Связь между 25(OH)D и микробиотой кишечника (секвенирование 16S рРНК, область V4) была проверена с помощью множественной линейной регрессии.
Результаты. Концентрация витамина D зависела от его потребления (r = 0,220, p = 0,008). Значимые различия по клиническим и воспалительным показателям отсутствовали во всех тертилях потребления. Однако по мере снижения концентрации 25(OH)D (p-тренд <0,05) наблюдалось повышение концентрации липополисахаридов. В подгруппе с наиболее высоким потреблением витамина D (эталон) по сравнению с другой подгруппой (первый плюс второй тертили) наиболее распространенными микроорганизмами были представители рода Prevotella (log2FC 1,67, p < 0,01), тогда как представители рода Haemophilus и рода Veillonella были наименее распространенными (log2FC −2,92 и −1,46, p < 0,01 соответственно). Такие показатели, как PCR (r = −0,170, p = 0,039), E-селектин (r = −0,220, p = 0,007) и распространенность представителей рода Coprococcus (r = −0,215, p = 0,008) и Bifdobacterium (r = −0,269, p = 0,001), имели обратную зависимость от 25(OH)D. После внесения поправки по возрасту, полу, сезону и индексу массы тела (ИМТ) сохранялась обратная зависимость от 25(OH)D для представителей рода Coprococcus (β = −9,414, p = 0,045) и Bifdobacterium (β = −1,881, p = 0,051), но после добавления в регрессионные модели маркеров воспаления их значимость пропадала.
1. Введение
Поступление витамина D в организм в первую очередь зависит от воздействия на кожу солнечного света, и лишь 20% этого витамина попадает в организм с пищей. Вопрос о том, оказывает ли пища, содержащая витамин D, непосредственное влияние на определение его концентраций в циркулирующей крови, по-прежнему остается спорным [1-6]. Витамин D2 (эргокальциферол) обнаруживается в дрожжевых и съедобных грибах, а также в некоторых овощах, тогда как витамин D3 (холекальциферол) содержится в продуктах животного происхождения. Именно последний синтезируется в коже под действие ультрафиолетового излучения спектра В [7]. Чтобы стать биологически активным, витамин D подвергается гидроксилированию в печени под действием 25-гидроксилазы и в почках под действием 1α-гидроксилазы. 1,25(OH)2D распознается специфическими рецепторами (VDR) в различных клетках, преимущественно в тонком кишечнике, что способствует усилению всасывания кальция, а также в костях, где обеспечивает регуляцию гомеостаза скелета. Нарушение всасывания или изменение метаболических характеристик приводят к нарушениям обмена кальция и фосфора, но, помимо этих хорошо известных функций, нарушения обмена витамина D были связаны с некоторыми другими заболеваниями.
Витамин D выполняет важные функции в формировании врожденных и приобретенных иммунных реакций, жизненном цикле клеток и метаболических процессах, о чем свидетельствует описанная связь между его дефицитом и распространенностью иммунноопосредованных нарушений, онкологических и кардиометаболических заболеваний [5, 7-10]. Была описана обратная зависимость между концентрациями этого витамина и распространенностью ожирения и сахарного диабета 2-го типа [11, 12]. О роли витамина D при этих заболеваниях может свидетельствовать обнаружение рецепторов VDR в бета-клетках, эндотелии, кардиомиоцитах и клетках, продуцирующих ренин [13-15]. Также есть данные, свидетельствующие о том, что неадекватный статус витамина D приводит к повышению концентрации воспалительных цитокинов и снижению чувствительности к инсулину, которые известны как факторы, патофизиологически связанные с кардиометаболическими заболеваниями [16, 17].
Совсем недавно было установлено, что вызванная микробиотой метаболическая эндотоксемия связана с повышенным кардиометаболическим риском [18]. Поскольку витамин D играет значимую роль в качестве модулятора функции иммунной системы тонкого кишечника, возможно, что его дефицит способен приводить к нарушению функции кишечного барьера, что создает благоприятные условия для транслокации в кровоток эндотоксинов - таких как липополисахариды (ЛПС). Известно, что ЛПС способствуют развитию слабо выраженного воспаления, что предрасполагает к инсулинорезистентности [19, 20]. Для оценки воспаления в клинических [21] и научных [22, 23] целях были использованы различные циркулирующие биомаркеры.
Некоторые представители микробиоты кишечника были связаны с системными воспалительными и метаболическими нарушениями. В частности, было показано, что грамотрицательные бактерии, в наружной мембране которых содержатся ЛПС, стимулируют иммунный ответ и вызывают метаболическую эндотоксемию, тогда как бифидобактерии снижают уровень эндотоксемии [18]. Было установлено, что Afefeermansia, хотя и относятся к грамотрицательным бактериям, улучшают барьерную функцию кишечника и оказывают благоприятное метаболическое действие [24].
Дефицит витамина D и отсутствие рецепторов VDR сопровождалось развитием дисбиоза кишечника и повышением восприимчивости к кишечным заболеваниям [25-27]. В немногочисленных исследованиях изучался вопрос о том, может ли статус витамина D влиять на развитие нарушений метаболизма глюкозы за счет модулирующего действия на состав микробиоты кишечника [28-30].
Желательно получить углубленное понимание основных механизмов кардиометаболических заболеваний, учитывая их влияния на показатели смертности населения.
Для оценки новых биомаркеров и предикторов кардиометаболических исходов было запланировано исследование Nutritionists’ Health Study (NutriHS) [31]. Это наблюдательное когортное исследование, проводимое посредством веб-технологии среди студентов и выпускников бразильских колледжей питания, позволило получить множество ретроспективных и перспективных данных. Исследование NutriHS дает уникальную возможность исследовать связь между питательными веществами и кардиометаболическими исходами, патофизиология которых включает неспецифическое воспаление. Эти связи должны быть подтверждены высоким качеством собранных данных.
Учитывая важность иммунной системы кишечника для ответа на микробные стимулы и иммуномодулирующую роль витамина D, мы предположили, что статус витамина D связан с микробиотой кишечника через неспецифическое воспаление. Мы исследовали связь приема витамина D и концентрации 25-гидроксивитамина D с составом фекальной микробиоты, маркерами воспаления и биохимическим профилем у молодых взрослых участников исследования NutriHS.
2. Методы
Подробное описание целей, популяции и протокола исследования NutriHS [31]. Вкратце, для включения в исследование NutriHS возраст участников должен был составлять 18 лет и старше, они должны были быть студентами или выпускниками колледжей питания; беременность относилась к критерии исключения. Для настоящего анализа методом поперечного среза приемлемой была случайная выборка из 150 участников в возрасте 18–40 лет, которые предоставили данные по изучаемым показателям. Критериями исключения были прием антибиотиков, пробиотиков, пребиотиков или метформина в последние шесть месяцев, а также диарея в течение двух недель, предшествующих сбору образцов кала. Комитет по этике исследований Школы общественного здравоохранения Университета Сан-Паулу одобрил проект NutriHS. От всех участников было получено электронное согласие на участие в исследовании.
Добровольцам предлагали заполнить структурированные и валидированные опросники онлайн, используя систему е-NutriHS (www.fsp.usp.br). В целях данного исследования были рассмотрены опросники, охватывающие социально-демографические показатели, состояние здоровья и физическую активность, а также частоту потребления различных пищевых продуктов. После заполнения опросников участников приглашали на плановый личных визит к врачу для физического обследования и сбора образцов биоматериала.
2.1. Антропометрия и измерение артериального давления
Все измерения проводили обученные сотрудники. Измерение массы тела проводилось на цифровых весах, позволяющих измерять массу до 200 кг с точностью измерения, близкой к 100 г., в положении стоя; на участниках была легкая одежда и они были без обуви. Для измерения роста использовали стадиометр (точность измерения 0,1 см). Индекс массы тела рассчитывали путем деления массы тела в килограммах на рост в метрах, возведенный в квадрат. Окружность талии измеряли в вертикальном положении на середине расстояния между последним ребром и гребнем подвздошной кости, используя гибкую и неэластичную сантиметровую ленту с точностью измерения 0,1 см.
Артериальное давление измеряли после 5-минутного отдыха в положении сидя, используя автоматический прибор (Omron HEM-712C, Omron Health Care). Было проведено три измерения артериального давления. Мы принимали во внимание среднее значение последних двух из трех измерений артериального давления. Среднее артериальное давление (АД) рассчитывали по формуле: диастолическое АД + 1/3 (систолическое АД - диастолическое АД) [32].
2.2. Оценка образа жизни: физическая активность и рацион питания
Для оценки физической активности был использован ранее валидированный Международный опросник физической активности [33, 34]. Уровень общей физической активности был выражен в количестве минут за неделю.
Данные о рационе питания были собраны с использованием валидированного опросника частоты потребления различных пищевых продуктов (www.gac-usp.com.br). Включенные в него вопросы служат получению информации о пищевых привычках людей в течение одного года с определением обычной индивидуальной порции путем выбора из списка, включающего 102 продукта питания. Участников также спрашивали об используемых пищевых добавках. Данные обрабатывались непосредственно в e-NutriHS с немедленным расчетом эквивалента суточного рациона и представлением данных о макро- и микронутриентах для пищевых продуктов и всего суточного рациона в соответствии с данными о пищевом составе из Национальной базы данных министерства сельского хозяйства США по питательным веществам для стандартной справки (ndb.nal.usda.gov). Количество каждого продукта питания было преобразовано в эквивалентное количество граммов в день. Общее потребление энергии указывали в количестве калорий в день, в то время как макроэлементы были представлены в абсолютных или относительных значениях к общей энергии, а микроэлементы - в абсолютном количестве в день. Потребление витамина D классифицировали на основании средней расчетной потребности, согласно которой адекватным считается потребление >10 нг/сут. [35].
Образцы крови были собраны натощак, через 12 часов после последнего приема пищи. Липидный профиль (общий холестерин, холестерин ЛПВП и триглицериды) был исследован ферментативными методами. Холестерин ЛПНП был рассчитан по формуле Фридевальда. Концентрацию глюкозы в плазме крови определяли глюкозооксидазным методом. Резистентность к инсулину рассчитывали с использованием гомеостатической модели оценки резистентности к инсулину – HOMA-индекса [36].
Концентрации цитокинов (ФНО-a, ИЛ-6, ИЛ-10, e-селектин и ИФН-γ) определяли с помощью системы Multiplex® (R&D Systems, Миннеаполис, штат Миннесота), а ЛПС – методом твердофазного иммуноферментного анализа (тИФА) (MyBioSource, Сан-Диего, штат Калифорния). Высокочувствительное определение концентрации С-реактивного белка и концентрации общего 25(OH)D (Elecsys 2012, Roche Diagnostics, Роткройц, Швейцария) проводили методом хемилюминесценции. Предел обнаружения 25(OH)D составлял 3,0 нг/мл; коэффициенты вариации в одной серии и между сериями анализов составляли 3,3% и 9,9%, соответственно. Категории статуса витамина D (достаточный, недостаточный или дефицит) были определены в соответствии с критериями Общества эндокринологов [35].
Аликвоты образцов кала хранили в холодильнике (6°C) в течение максимум 24 часов после взятия, а затем, до проведения анализа на микробиоту кишечника, помещали на хранение при температуре -80°C. Экстракцию ДНК проводили с использованием набора реагентов Maxwell® 16 DNA purification kit (Promega, Мэдисон, штат Висконсин), а протокол выполнялся с помощью анализатора Maxwell® 16 в соответствии с инструкциями производителя (Promega, Мэдисон, штат Висконсин). Caporaso и соавт. описали праймеры и ход работы для получения ампликона области V4 из 16s рРНК гена [37]. Полученная библиотека ампликонов была подвергнута секвенированию на платформе Illumina MiSeq в соответствии с инструкциями производителя. Для кластеризации операционных таксономических единиц (ОТЕ) нами было использовано программное обеспечение Qiime версии 1.8, а для присвоения таксономической группы - база данных GreenGenes 13.5.
2.3. Статистический анализ
Описательные данные выражены в виде средних значений со стандартными отклонениями, медиан и межквартильных интервалов или процентов. Нормальное распределение переменных оценивали с помощью критерия Колмогорова-Смимова. Если распределения были искажены, значения преобразовывали в логарифмическую, квадратную или обратную функцию, используемую перед анализом. Значения в таблицах были подвергнуты обратному преобразованию, чтобы вернуться к исходному масштабу.
Потребление витамина D и концентрация 25(OH)D для анализа были классифицированы на тертили. Для сравнения клинических показателей и показателей воспаления по всем тертилям был проведен дисперсионный анализ (или критерий Крускала-Уоллиса при наличии показаний). Для выявления различий был использован ретроспективный анализ Бонферрони. Коэффициент Пирсона или Спирмена использовали для проверки корреляций между потреблением витамина D (в пересчете на 1000 ккал) или его концентрацией (непрерывная переменная) и другими переменными.
Для сравнения состава микробиоты кишечника было использовано программное обеспечение DESeq2. Это программное обеспечение позволяет получить изменения, кратные log2, которые связаны с данной переменной, по сравнению со средним нормализованным количеством ОТЕ. Изменения, кратные log2, представляют собой сравнение с эталонным уровнем. Если различия между группами равны нулю, это означает, что между средними значениями групп разница отсутствует. В настоящей работе рассматривались только ОТЕ, относительная численность которых была выше 0,1%, и которые присутствовали в образцах кала у 80% участников. Были показаны данные по ОТЕ на уровне родов, выраженные как относительная численность. Коэффициент Спирмена служил для проверки корреляции между 25(OH)D и численностью родов.
Для анализа зависимостей между концентрациями 25(OH)D (зависимая переменная) и родовым составом бактерий (независимая переменная основного интереса) была использована множественная линейная регрессия с поправкой на возраст, пол, сезонность и ИМТ. Кроме того, к регрессионным моделям в соотношении один к одному были добавлены маркеры воспаления, значение Р которых в одномерном анализе было ниже 0,20, и их интерпретировали как независимые переменные.
Статистические анализы были проведены с использованием пакета программ обработки статистических данных для социальной науки (SPSS), версия 23 (IBM, Армонк, штат Нью Йорк), и R – для анализа микробиоты.
3. Результаты
Выборка была на 90,7% представлена женщинами, средний возраст которых составлял 24,9 ± 5,8 года, а среднее значение ИМТ было 23,6 ± 4,7 кг/м2. Избыточная масса тела или ожирение имели место в 28,5% случаев; все участники отрицали наличие у них артериальной гипертонии или сахарного диабета, но у четырех человек было зарегистрировано повышение концентрации глюкозы в плазме крови ≥100 мг/дл. У 81% всей выборки имело место низкое потребление витамина D и основным источником его было молоко, молочные продукты и яйца. Средняя концентрация 25(OH)D составляла 23,9 ± 9,7 нг/мл; у 24,0% было достаточное количество витамина D (≥30 нг/мл), у 39,3% отмечался недостаток (от ≥20 до 30 нг/мл) и у 36,7% был дефицит (<20 нг/мл). При взятии образцов крови весной значения были значительно ниже, чем в другие сезоны (20,3 ± 8,0 в сравнении с 25,8 ± 10,0 нг/мл, p = 0,01). При сопоставлении концентраций 25(OH)D с категориями ИМТ (≥ или <25 кг/м2) средние значения не отличались.
Демографические и клинические данные, сгруппированные по тертилям потребления витамина D, описаны в Таблице 1. Участники из третьего тертиля потребления витамина D были значительно старше, чем другие. Значения демографических, клинических и биохимических показателей между тертилями потребления витамина D не различались. Средние концентрации 25(OH)D увеличивались от первого тертиля к третьему (21,5 ± 9,0 в сравнении с 23,5 ± 10,0, в сравнении с 26,5 ± 9,6 нг/мл, соответственно, p = 0,013). Среднее значение ЛПС во втором тертиле потребления витамина D было выше, но с пограничной значимостью. Различия в средних концентрациях маркеров воспаления между тертилями отсутствовали.
Потребление витамина D, скорректированное на 1000 ккал, достоверно коррелировало с его концентрацией в сыворотке крови (r = 0,220, p = 0,008). При стратификации по категориям 25(OH)D различий между тертилями не наблюдалось, хотя имело место снижение средних значений CRP, ИФН-γ и HOMA-IR с пограничной значимостью. По мере повышения тертилей 25(OH)D наблюдалась достоверная тенденция к снижению средних значений ЛПС (Таблица 2).
Таблица 1. Число (в скобках указано процентное отношение) и средние значения (± стандартные отклонения) или медианы (межквартильный диапазон) демографических и клинических показателей с распределением по тертилям потребления витамина D, выраженного в количестве пг/сут.a' **
Таблица 2. Число (в скобках указано процентное отношение) и средние значения (± стандартные отклонения) или медианы (межквартильный диапазон) демографических и клинических показателей с распределением по тертилям концентраций витамина 25(OH)D.a' **
Фекальная микробиота во всей выборке была представлена, главным образом, таксономическими типами Firmicutes (49,9%), Bacteroidetes (29,4%), Verrucomicrobia (9,3%), Proteobacteria (5,9%) и Actinobacteria (2,6%), как показано на рис. 1. Пятнадцать преобладающих родов представлены на рис. 2.
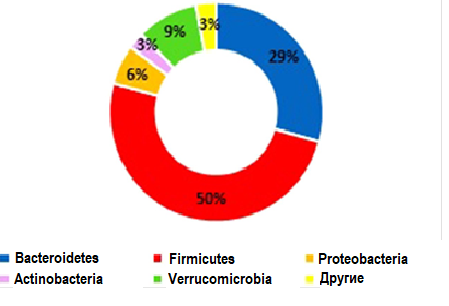 Рис. 1. Относительная численность основных таксономических типов в фекальной микробиоте всей выборки
Рис. 1. Относительная численность основных таксономических типов в фекальной микробиоте всей выборки
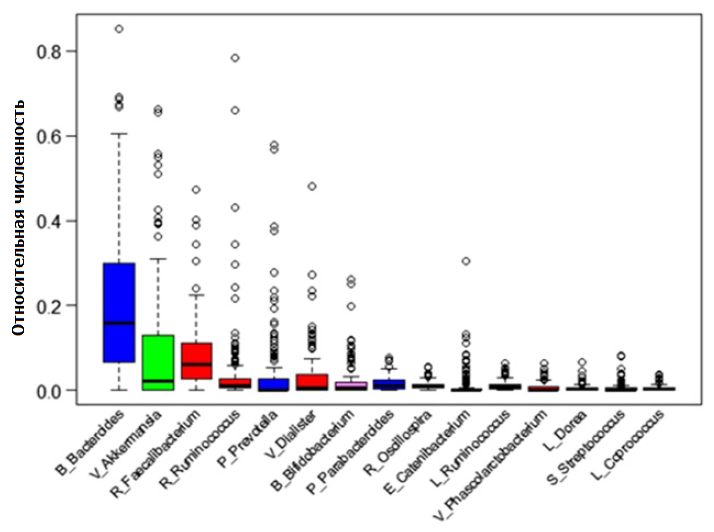 Рис. 2. Диаграмма рассеивания относительной численности основных родов в фекальной микробиоте. На оси X изображены 15 наиболее распространенных родов; первая заглавная буква представляет семейство, а название рода следует за символом подчеркивания
Рис. 2. Диаграмма рассеивания относительной численности основных родов в фекальной микробиоте. На оси X изображены 15 наиболее распространенных родов; первая заглавная буква представляет семейство, а название рода следует за символом подчеркивания
Значимые различия (p < 0,005) в численности родов микроорганизмов в образцах кала участников, включенных в третий тертиль потребления витамина D (группа A) и его концентраций (группа B), в сравнении с такими же показателями в первом и втором тертиле показаны на рис. 3.
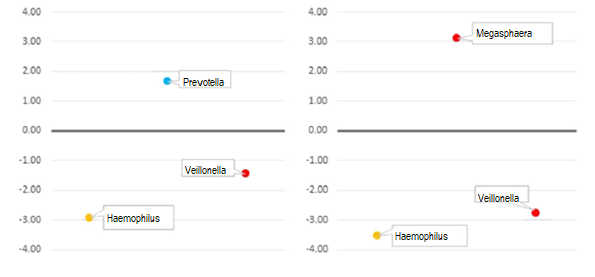 Рис. 3. Изменения средних показателей выбранных родов фекальной микробиоты, кратные Log2, полученные в исследуемой популяции с использованием программного обеспечения DESeq2. Третьи тертили сравнивали с суммой первого и второго. Роды различались на уровне р < 0,005. Красным кругом обозначены представители Firmicutes, синим кругом – Bacteroidetes, а желтым кругом - Proteobacteria. Панель A: отношение средних показателей третьего тертиля (эталонного) к показателям других тертилей потребления витамина D. Панель B: отношение средних показателей третьего тертиль (эталонного) к показателям других тертилей концентрации 25(OH)D.
Рис. 3. Изменения средних показателей выбранных родов фекальной микробиоты, кратные Log2, полученные в исследуемой популяции с использованием программного обеспечения DESeq2. Третьи тертили сравнивали с суммой первого и второго. Роды различались на уровне р < 0,005. Красным кругом обозначены представители Firmicutes, синим кругом – Bacteroidetes, а желтым кругом - Proteobacteria. Панель A: отношение средних показателей третьего тертиля (эталонного) к показателям других тертилей потребления витамина D. Панель B: отношение средних показателей третьего тертиль (эталонного) к показателям других тертилей концентрации 25(OH)D.
В подгруппе наиболее высокого потребления витамина D представители рода Prevotella были наиболее многочисленными (log2FC 1,67, p < 0,01), тогда как количество представителей родов Haemophilus и Veillonella было меньше (log2FC −2,92, p < 0,001 и −1,46, p < 0,01 соответственно), чем в другой подгруппе (первый и второй тертили в сумме). Что касается концентрации 25(OH)D, в подгруппе с наиболее высокими значениями наиболее многочисленным родом был Megasphaera (logFC 3,11, p < 0,001), а количество представителей Haemophilus и Veillonella было меньше (log2FC −3,53 и −2,78, p < 0,001 соответственно).
Выбранные для оценки коэффициенты корреляции представлены в таблице 3. Показатели воспаления коррелировали между собой и с ИМТ. Также CRP и E-селектин имели обратную зависимость от концентрации 25(OH)D. Численность представителей Coprococcus (r = −0,215, p = 0,008) и Bifdobacterium (r = −0,269, p = 0,001) находилась в обратной зависимости от его концентрации. Корреляции между Faecalibacterium (r = −0,143, p = 0,081) и Akkermansia (r = 0,093 p = 0,257) и 25(OH)D не достигали уровня статистической значимости.
На основании корреляций, показанных в таблице 3, мы проверили связь между концентрациями 25(OH)D и некоторыми микроорганизмами, используя поправки на возраст, пол, ИМТ и сезон (весна). Для каждого рода (Faecalibacterium, Coprococcus и Bifidobacterium) была построена отдельная модель, в которую были включены показатели воспаления (CRP, E-селектин и ИФН-γ) в качестве объясняющих направлений. Несмотря на недостоверную корреляцию между численностью представителей родов Akkermansia и Faecalibacterium и витамином D, эти роды были включены в первую модель, которая подтвердила отсутствие достоверных связей.
Таблица 3. Отдельные коэффициенты корреляции между клиническими показателями и численностью наиболее распространенных родов микроорганизмов в составе фекальной микробиоты
Независимая связь между весенним периодом и концентрациями 25(OH)D сохранялась во всех моделях (таблица 4). После добавления родов бактерий (модели 2) была выявлена обратная зависимость для Coprococcus (p = 0,045) и Bifidobacterium (p = 0,051), хотя для последнего значимость была пограничной. При включении в эти модели маркеров воспаления обратная зависимость от витамина наблюдалась только по CPR и E-селектину. В моделях 3 (с поправкой на CRP) зависимость была менее выраженной для Coprococcus (модель 3A, p = 0,056), но не для Bifidobacterium (модель 3B, p = 0,035). В моделях 4 (с поправкой на E-селектин) зависимость от 25(OH)D была значимой для Coprococcus (модель 4A, p = 0,034), но не для Bifidobacterium (модель 4B, p = 0,073). Несмотря на зависимость ИФН-γ от витамина, его включение в модели подтвердило, что Bifidobacterium (модель 5B, p = 0,037) имели независимую связь с зависимой переменной, чего не наблюдалось для Coprococcus (p = 0,079).
Таблица 4. Коэффициенты (в скобках указаны стандартные ошибки) моделей множественной линейной регрессии для связей между логарифмически преобразованными концентрациями 25(OH)D и численностью отдельных родов микроорганизмов с поправкой на несколько переменных
4. Обсуждение
Нами было установлено, что у участников исследования как потребление витамина D, так и концентрация 25(OH)D связаны с численностью определенных родов комменсальных микроорганизмов в составе микробиоты кишечника. Полученные нами данные об определенном соотношении родов микроорганизмов в зависимости от статуса витамина D позволяют выдвинуть гипотезу о том, что его модулирующее действие на иммунные клетки кишечника может влиять и на состав бактерий. Снижение иммунного ответа при дефиците витамина D может увеличить конкурентное преимущество бактерий рода Haemophilus и Veillonella, численность которых, как было установлено, была относительно более высокой в подгруппе лиц с низкими, по сравнению с самыми высокими, потреблением и концентрацией витамин D. Эти грамотрицательные бактерии могут объяснить более высокие уровни ЛПС, обнаруженные в этой подгруппе. С другой стороны, относительно небольшая доля бактерий, обладающих благоприятными свойствами, таких как представители родов Coprococcus и Bifidobacterium, может активировать иммунный ответ в кишечнике и индуцировать местное воспаление, что требует включения компенсаторных противовоспалительных механизмов, как те, которые зависят от 25(OH)D. Была обнаружена обратная зависимость маркеров воспаления от 25(OH)D. Полученные результаты подчеркивают роль витамина D в поддержании гомеостаза иммунной системы, и мы предполагаем, что это происходит частично за счет взаимодействия с микробиотой кишечника, хотя дизайн исследования не позволяет установить наличие причинно-следственных связей.
Особенностью нашего исследования стало включение в него здоровых молодых людей, обладающих знаниями и навыками в области питания. Мы обнаружили, что средние значения концентрации 25(OH)D увеличились от первого к третьему тертилю потребления витамина D, что между этими переменными существовала прямая зависимость. В литературе нет единого мнения относительно такой взаимосвязи, и в большинстве исследований значимой корреляции выявлено не было [1-6]. Не исключено, что нам удалось продемонстрировать такую взаимосвязь благодаря высокой достоверности диетологических данных, собранных в рассматриваемой популяции студентов и выпускников колледжей питания.
Клинический профиль трех подгрупп участников, стратифицированных в соответствии с концентрацией 25(OH)D, не отличался, хотя можно было ожидать ухудшения кардиометаболического профиля у лиц с недостаточностью или дефицитом витамина D. В целом, об обратной зависимости между статусом витамина D и ожирением, а также метаболическими нарушениями сообщалось у пожилых людей [12, 38-40]. Отсутствие связей между концентрацией 25(OH)D и этими переменными можно объяснить демографическими характеристиками рассматриваемой в нашем исследовании популяции. Тем не менее, в подгруппе с самыми низкими уровнями 25(OH)D наблюдались более высокие концентрации ЛПС, что может указывать на подверженность риску метаболической эндотоксемии. Фактически, ранее сообщалось, что у мышей с дефицитом витамина D, подвергшихся воздействию бактериального патогена, была продемонстрирована более выраженная транслокация эндотоксина и продукция воспалительных цитокинов [41]. Поскольку считают, что патофизиологической основой кардиометаболических заболеваний служит системное провоспалительное окружение, все эти данные представляются согласованными с результатами исследований, в которых статус витамина D был связан с проявлениями метаболического синдрома [12, 38-40]. Однако в недавно проведенном проспективном исследовании защитный эффект добавок, содержащих витамин D, не был подтвержден [42].
Интересно, что мы обнаружили значимую обратную зависимость между концентрацией 25(OH)D и концентрациями E-селектина и CRP. Это позволяет предположить, что даже среди здоровых людей статус витамина D может обеспечивать противовоспалительное действие. На самом деле, в нескольких исследованиях было описано, что 25(OH)D играет значительную роль в функционировании иммунной системы, позволяя связать более высокие его концентрации в сыворотке крови, а также более высокое потребление с более низким уровнем неспецифического воспаления [43-46]. У модельных животных и людей получены доказательства того, что витамин D модулирует иммунный ответ, снижая воспаление [29, 44, 47], что согласуется с нашими выводами об обратной зависимости между 25(OH)D, CRP и E-селектином.
Проведенный нами метагеномный анализ подтвердил, что представители Firmicutes и Bacteroidetes были самыми многочисленными таксономическими типами, и что род Bacteroides встречался чаще всего, согласно другим отчетам [48]. Интересным наблюдением в нашей популяции была относительно высокая численность Akkermansia; кроме того, мы обнаружили обратную зависимость между этим родом бактерий и метаболизмом глюкозы, а также воспалительными биомаркерами. Эта связи согласуется с результатами ранее проведенных исследований, показывающих, что Akkermansia muciniphila связана с благоприятным влиянием на метаболический и воспалительный профили [24, 49]. У модельных животных было продемонстрировано положительное влияние A. muciniphila на моторику кишечника, толщину слизистого слоя и метаболизм при ожирении и сахарном диабете 2-го типа [24]. Поскольку наша популяция состояла из лиц молодого возраста с адекватным состоянием жировой ткани организма и здоровым метаболическим профилем, высокое соотношение представителей данных родов не было непредвиденным результатом.
Анализ DeSeq2 позволил получить значимую информацию о соотношении некоторых родов в одной подгруппе (эталонная группа) в сравнении с другой (первый плюс второй тертили). Независимо от их численности во всей популяции, мы обнаружили, что в группе с наиболее высоким потреблением витамина D основным родом был Prevotella. В популяциях, употребляющих пищу, богатую углеводами и волокнами, уже описана повышенная численность бактерий рода Prevotella [50]. Употребление в пищу продуктов, богатых пищевыми волокнами, подтвержденное у участников исследования NutriHS (29,5 ± 17,8 г/сут., данные не приведены), было вполне адекватным, что могло способствовать относительно высокой численности бактерий рода Prevotella. Ранее считалось, что представители рода Haemophilus вызывают воспалительные заболевания кишечника и определяют уровни ЛПС, а представители рода Veillonella связаны с повышением концентрации воспалительных цитокинов [51, 52]. Эти грамотрицательные бактерии с наружным слоем ЛПС были менее многочисленными в наших подгруппах с самым высоким потреблением витамина D и с самыми высокими концентрациями 25(OH)D; кроме того, самая низкая концентрация ЛПС была обнаружена среди лиц, у которых был лучший статус витамина D. Не исключено, что у участников нашего исследования с худшим статусом витамина D и сниженной способностью к иммунному ответу на бактерии родов Haemophilus и Veillonella могла происходить транслокация эндотоксина через стенку кишечника, которая провоцировала развитие системного воспаления. Это предположение подтверждается исследованиями на животных, в которых добавление витамина D в рацион питания увеличивало экспрессию генов NOD2 и дефензинов, усиливая иммунный ответ против кишечных патогенов [53]. Также было показано, что 1,25(OH)2D3 индуцировал экспрессию соединительных белков и укреплял межклеточные соединения, улучшая барьерную функцию кишечника [24]. Для проверки этой гипотезы и выявления иммуномодулирующих возможностей микроорганизмов этих родов необходимы дополнительные механистические исследования.
При рассмотрении всей выборки в целом, после внесения поправки обратная зависимость между бактериями рода Coprococcus и Bifidobacterium и концентрацией 25(OH)D сохранялась. Оба рода были связаны с адекватным ИМТ и гомеостазом глюкозы, а также с продукцией бутирата и противовоспалительным действием [54-56]. Вполне возможно, что воздействие большого количества этих бактерий может ослаблять иммунный ответ. Была описана связь бактерий рода Coprococcus со статусом витамина D, когда этот витамин использовали в качестве пищевой добавки при лечении иммуноопосредованных заболеваний [56], но не у здоровых людей. У здоровых участников нашего исследования обнаружение обратной связи 25(OH)D с численностью бактерий рода Coprococcus может отражать гомеостаз иммунной системы кишечника и стабильное системное воспаление. Насколько нам известно, ни в одном исследовании не было выявлено связи между бактериями рода Bifidobacterium и статусом витамина D. В нашем линейном регрессионном анализе ослабление или исчезновение связи этих родов с тремя различными маркерами воспаления позволяет предположить, что воспаление может частично опосредовать связь между концентрацией витамина и микробиотой. Это согласуется с представленными данными о его противовоспалительном действии [57] и с провоспалительным состоянием при недостатке витамина D [58]. У нокаутных мышей VDR развивалось хроническое воспаление в желудочно-кишечном тракте даже при наличии непатогенной микрофлоры. Несмотря на споры о причинно–следственной связи [59], существует единое мнение в отношении того, что этот витамин является важным медиатором защиты кишечника от инфекционных агентов [60].
Наше исследование имеет ограничения, связанные главным образом с тем, что оно проводилось методом поперечного среза. Несмотря на ориентировочный характер, важно было выдвинуть гипотезу, подлежащую проверке в дальнейших исследованиях, касающихся новой проблемы, описываемой в литературе. Размер выборки не был небольшим, и мы имели возможность оценить широкий диапазон переменных для определения профиля кардиометаболического риска. Популяция нашего исследования, представленная молодыми диетологами, должна была обеспечить получение достоверных данных о питании, но стала причиной ограничения, связанного с ее однородностью с точки зрения пищевых привычек. Эти аспекты ограничивают обобщающие выводы для всего населения. Для подтверждения наших результатов также необходимы исследования с участием лиц пожилого возраста и лиц с более высоким уровнем риска. Учитывая возросшие в настоящее время показатели распространенности дефицита витамина D в популяциях, наше исследование открывает инновационный путь для улучшения понимания этого сценария.
Таким образом, наше исследование подтвердило, что модулирующее действие статуса витамина D на иммунную систему кишечника может влиять на состав комменсальных бактерий и наоборот. Относительно более высокая численность грамотрицательных бактерий, таких как представители родов Haemophilus и Veillonella, может быть следствием низкого потребления и/или концентрации витамина D. Относительно небольшая доля полезных бактерий, таких как представители родов Coprococcus и Bifidobacterium, может привести к развитию иммунного ответа и воспаления, что потребует противовоспалительных вмешательств, включая такие, которые зависят от 25(OH)D. Мы пришли к выводу, что роль витамина D в поддержании иммунного гомеостаза, по-видимому, частично обусловлена взаимодействиями с микробиотой кишечника. Для более подробного рассмотрения гипотезы, выдвинутой в нашем исследовании, желательно проведение дальнейших исследований с соответствующим дизайном.
Благодарность
Авторы благодарят исследователей и участников проекта NutriHS, а также Capes и FAPESP за финансовую поддержку
Список литературы
[1] Vieth R. Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety. Am J Clin Nutr 1999;69(5):842–56.
[2] Nesby-O'Dell S, Scanlon KS, Cogswell ME, Gillespie C, Hollis BW, Looker AC, et al. Hypovitaminosis D prevalence and determinants among African American and white women of reproductive age: third National Health and Nutrition Examination Survey, 1988–1994. Am J Clin Nutr 2002;76(1):187–92.
[3] Hollis BW. Circulating 25-hydroxyvitamin D levels indicative of vitamin D sufficiency: implications for establishing a new effective dietary intake recommendation for vitamin D. J Nutr 2005;135(2):317–22.
[4] Hyppönen E, Power C. Hypovitaminosis D in British adults at age 45 y: nationwide cohort study of dietary and lifestyle predictors. Am J Clin Nutr 2007;85(3):860–8.
[5] Wang TJ, Pencina MJ, Booth SL, Jacques PF, Ingelsson E, Lanier K, et al. Vitamin D deficiency and risk of cardiovascular disease. Circulation 2008;117(4):503–11.
[6] Salehpour A, Shidfar F, Hosseinpanah F, Vafa M, Razaghi M, Hoshiarrad A, et al. Vitamin D 3 and the risk of CVD in overweight and obese women: a randomized controlled trial. Br J Nutr 2012;108(10):1866–73.
[7] Hewison M. Vitamin D and the immune system: new perspectives on an old theme. Endocrinol Metab Clin North Am 2010;39(2):365–79.
[8] Cantorna MT. Vitamin D and its role in immunology: multiple sclerosis, and inflammatory bowel disease. Prog Biophys Mol Biol 2006;92(1):60–4.
[9] Michos ED, Melamed ML. Vitamin D and cardiovascular disease risk. Curr Opin Clin Nutr Metab Care 2008;11(1):7–12.
[10] Vaidya A. Vitamin D and cardio-metabolic disease. Metabolism 2013;62(12):1697.
[11] Wolden-Kirk H, Overbergh L, Christesen HT, Brusgaard K, Mathieu C. Vitamin D and diabetes: its importance for beta cell and immune function. Mol Cell Endocrinol 2011;347(1): 106–20.
[12] Kim HJ, Kang CK, Park H, Lee MG. Effects of vitamin D supplementation and circuit training on indices of obesity and insulin resistance in T2D and vitamin D deficient elderly women. J Exerc Nutr Biochem 2014;18(3):249.
[13] Chiu KC, Chu A, Go VLW, Saad MF. Hypovitaminosis D is associated with insulin resistance and β cell dysfunction. Am J Clin Nutr 2004;79(5):820–5.
[14] Schuch NJ, Garcia VC, Martini LA. Vitamin D and endocrine diseases. Arq Bras Endocrinol Metab 2009;53(5):625–33.
[15] Norman PE, Powell JT. Vitamin D and cardiovascular disease. Circ Res 2014;114(2):379–93.
[16] Herrmann M, Sullivan DR, Veillard A, McCorquodale T, Straub IR, Scott R, et al. Serum 25-Hydroxy vitamin D: a predictor of macrovascular and microvascular complications in patients with type 2 diabetes. Diabetes Care 2014;38(3):521–8.
[17] Wellen KE, Hotamisligil GS. Inflammation, stress, and diabetes. J Clin Invest 2005;115(5):1111–9.
[18] Cani PD, Delzenne NM. Gut microflora as a target for energy and metabolic homeostasis. Curr Opin Clin Nutr Metab Care 2007;10(6):729–34.
[19] Caricilli AM, Picardi PK, de Abreu LL, Ueno M, Prada PO, Ropelle ER, et al. Gut microbiota is a key modulator of insulin resistance in TLR 2 knockout mice. PLoS Biol 2011; 9(12):e1001212.
[20] Moraes ACF, Silva IT, Almeida-Pititto B, Ferreira SRG. Microbiota intestinal e risco cardiometabólico: mecanismos e modulação dietética. Arq Bras Endocrinol Metab 2014;58(4):317–27.
[21] Ridker PM, Buring JE, Shih J, Matias M, Hennekens CH. Prospective study of C-reactive protein and the risk of future cardiovascular events among apparently healthy women. Circulation 1998;98(8):731–3.
[22] Calder PC, Ahluwalia N, Albers R, Bosco N, Bourdet-Sicard R, Haller D, et al. A consideration of biomarkers to be used for evaluation of inflammation in human nutritional studies. Br J Nutr 2013;109(S1):S1–S34.
[23] Almeida-Pititto B, Ribeiro-Filho FF, Bittencourt MS, Lotufo PA, Bensenor I, Ferreira SR. Usefulness of circulating E-selectin to early detection of the atherosclerotic process in the Brazilian Longitudinal Study of Adult Health (ELSA-Brasil). Diabetol Metab Syndr 2016;8(19).
[24] Everard A, Belzer C, Geurts L, Ouwerkerk JP, Druart C, Bindels LB. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. PNAS 2013;110(22): 9066–71.
[25] Kong J, Zhang Z, Musch MW, Ning G, Sun J, Hart J, et al. Novel role of the vitamin D receptor in maintaining the integrity of the intestinal mucosal barrier. Am J Physiol Gastrointest Liver Physiol 2008;294:G208–16.
[26] Ooi JH, Li Y, Rogers CJ, Cantorna MT. Vitamin D regulates the gut microbiome and protects mice from dextran sodium sulfate-induced colitis. J Nutr 2013;143(10):1679–86.
[27] Bashir M, Prietl B, Tauschmann M, Mautner SI, Kump PK, Treiber G, et al. Effects of high doses of vitamin D3 on mucosa-associated gut microbiome vary between regions of the human gastrointestinal tract. Eur J Nutr 2015;55:1479–89.
[28] Mai V, McCrary QM, Sinha R, Glei M. Associations between dietary habits and body mass index with gut microbiota composition and fecal water genotoxicity: an observational study in African American and Caucasian American volunteers. Nutr J 2009;8(1):49.
[29] Ly NP, Litonjua A, Gold DR, Celedón JC. Gut microbiota, probiotics, and vitamin D: interrelated exposures influencing allergy, asthma, and obesity? J Allergy Clin Immunol 2011; 127(5):1087–94.
[30] Ciubotaru I, Green SJ, Kukreja S, Barengolts E. Significant differences in fecal microbiota are associated with various stages of glucose tolerance in African American male veterans. Transl Res 2015;166(5):401–11.
[31] Folchetti LGD, da Silva IT, de Almeida-Pititto B, Ferreira SRG. Nutritionists' Health Study cohort: a web-based approach of life events, habits and health outcomes. BMJ Open 2016; 6(8):e012081.
[32] Guyton AC, Hall JE. Textbook of medical physiology. 11th ed. Philadelphia: Saunders; 2006.
[33] Matsudo S, Araújo T, Marsudo V, Andrade D, Andrade E, Braggion G. Questinário internacional de atividade f1sica (IPAQ): estudo de validade e reprodutibilidade no Brasil. Rev Bras Ativ Fís Saúde 2001;6(2):05–18.
[34] Craig CL, Marshall AL, Sjöström M, Bauman AE, Booth ML, Ainsworth BE, et al. International physical activity questionnaire:12-country reliability and validity. Med Sci Sports Exerc 2003;35(8):1381–95.
[35] Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Endocrine Society. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011;96(7):1911–30.
[36] Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28:412–9.
[37] Caporaso JG, Lauber CL, Walters W, Berg-Lyons D, Huntley J, Fierer N, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. ISME J 2012;6(8):1621–4.
[38] Forman JP, Giovannucci E, Holmes MD, Bischoff-Ferrari HA, Tworoger SS,Willett WC, et al. Plasma 25-hydroxyvitamin D levels and risk of incident hypertension. Hypertension 2007; 49(5):1063–9.
[39] Shankar A, Sabanayagam C, Kalidindi S. Serum 25- hydroxyvitamin D levels and prediabetes among subjects free of diabetes. Diabetes Care 2011;34(5):1114–9.
[40] Salehpour A, Hosseinpanah F, Shidfar F, Vafa M, Razaghi M, Dehghani S, et al. A 12-week double-blind randomized clinical trial of vitamin D3 supplementation on body fat mass in healthy overweight and obese women. Nutr J 2012;11(1):78.
[41] Ryz NR, Lochner A, Bhullar K, Ma C, Huang T, Bhinder G, et al. Dietary vitamin D3 deficiency alters intestinal mucosal defense and increases susceptibility to Citrobacter rodentium induced colitis 2. Am J Physiol Gastrointest Liver Physiol 2015;309(9):G730–42.
[42] Jorde R, Sollid ST, Svartberg J, Schirmer H, Joakimsen RM, Njølstad I, et al. Vitamin D 20 000 IU per week for five years does not prevent progression from prediabetes to diabetes. J Clin Endocrinol Metab 2016;101(4):1647–55.
[43] Mora JR, Iwata M, von Andrian UH. Vitamin effects on the immune system: vitamins A and D take centre stage. Nat Rev Immunol 2008;8(9):685–98.
[44] Hewison M. An update on vitamin D and human immunity. Clin Endocrinol (Oxf) 2012;76:315–25.
[45] Bellia A, Garcovich C, D'Adamo M, Lombardo M, Tesauro M, Donadel G, et al. Serum 25-hydroxyvitamin D levels are inversely associated with systemic inflammation in severe obese subjects. Intern Emerg Med 2013;8(1):33–40.
[46] Mellenthin L, Wallaschofski H, Grotevendt A, Völzke H, Nauck M, Hannemann A. Association between serum vitamin D concentrations and inflammatory markers in the general adult population. Metab Clin Exp 2014;63(8):1056–62.
[47] Cantorna MT, McDaniel K, Bora S, Chen J, James J. Vitamin D, immune regulation, the microbiota, and inflammatory bowel disease. Exp Biol Med 2014;239(11):1524–30.
[48] Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR, et al. Enterotypes of the human gut microbiome. Nature 2011;473:174–80. [49] Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 2012;490(7418):55–60.
[50] Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SA, et al. Linking long-term dietary patterns with gut microbial enterotypes. Science 2011;334(6052):105–8.
[51] Said HS, SudaW,Nakagome S, ChinenH, Oshima K, KimS, et al. Dysbiosis of salivarymicrobiota in inflammatory bowel disease and its association with oral immunological biomarkers. DNA Res 2013;037.
[52] Van den Bogert B, Meijerink M, Zoetendal EG, Wells JM, Kleerebezem M. Immunomodulatory properties of Streptococcus and Veillonella isolates from the human small intestine microbiota. PLoS One 2014;9(12):e114277.
[53] Sokol H, Pigneur B, Watterlot L, Lakhdari O, Bermúdez-Humarán LG, Gratadoux JJ, et al. Faecalibacterium prausnitziiisan anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. Proc Natl Acad Sci U S A 2008;105:16731–6.
[54] Collado MC, Isolauri E, Laitinen K, Salminen S. Distinct composition of gut microbiota during pregnancy in overweight and normal-weight women. Am J Clin Nutr 2008;88(4):894–9.
[55] Wu X, Ma C, Han L, Nawaz M, Gao F, Zhang X, et al. Molecular characterisation of the faecal microbiota in patients with type II diabetes. Curr Microbiol 2010;61:69–78.
[56] Cantarel BL, Waubant E, Chehoud C, Kuczynski J, DeSantis TZ, Warrington J, et al. Gut microbiota in multiple sclerosis. J Invest Med 2015;63(5):729–34.
[57] Zhang Y, Leung DY, Richers BN, Liu Y, Remigio LK, Riches DW, et al. Vitamin D inhibits monocyte/macrophage proinflammatory cytokine production by targeting MAPK phosphatase-1. J Immunol 2012;188(5):2127–35.
[58] Cantorna MT. Mechanisms underlying the effect of vitamin D on the immune system. Proc Nutr Soc 2010;69(03):286–9.
[59] Mangin M, Sinha R, Fincher K. Inflammation and vitamin D: the infection connection. Inflamm Res 2014;63(10):803–19.
[60] Assa A, Vong L, Pinnell LJ, Avitzur N, Johnson-Henry KC, Sherman PM. Vitamin D deficiency promotes epithelial barrier dysfunction and intestinal inflammation. J Infect Dis 2014;210:1296–305.
Оригинал статьи доступен в электронном виде www.sciencedirect.com
www.metabolismjournal.com
Бразилия
Ключевые слова: витамин D, микробиота кишечника, грамотрицательные бактерии, воспаление
ТЕЗИСЫ
Предпосылка. Благодаря иммуномодулирующим свойствам, статус витамина D имеет значение не только при нарушениях со стороны костной системы, но и других заболеваниях. Имеются данные о том, что дефицит этого витамина приводит к ухудшению функции кишечного барьера, способствуя проникновению эндотоксинов в кровоток и системному воспалению. В немногочисленных исследованиях изучался вопрос о том, могла ли связь между статусом витамина D и метаболическими нарушениями быть опосредована составом микробиоты кишечника.
Цель. Нами была изучена связь потребления витамина D и концентраций 25(OH)D, циркулирующего в крови, с составом микробиоты кишечника, маркерами воспаления и биохимических профилем у здоровых людей.
Методы. В этом анализе методом поперечного среза 150 молодых здоровых взрослых людей было стратифицировано на тертили в зависимости от потребления и концентраций витамина D, затем проводилось сравнение их клинического и воспалительного профиля. Для сравнения состава микробиоты использовали программное обеспечение DESeq2 и изменения, кратные log2 (log2FC), отражали сопоставление с эталонной концентрацией. Связь между 25(OH)D и микробиотой кишечника (секвенирование 16S рРНК, область V4) была проверена с помощью множественной линейной регрессии.
Результаты. Концентрация витамина D зависела от его потребления (r = 0,220, p = 0,008). Значимые различия по клиническим и воспалительным показателям отсутствовали во всех тертилях потребления. Однако по мере снижения концентрации 25(OH)D (p-тренд <0,05) наблюдалось повышение концентрации липополисахаридов. В подгруппе с наиболее высоким потреблением витамина D (эталон) по сравнению с другой подгруппой (первый плюс второй тертили) наиболее распространенными микроорганизмами были представители рода Prevotella (log2FC 1,67, p < 0,01), тогда как представители рода Haemophilus и рода Veillonella были наименее распространенными (log2FC −2,92 и −1,46, p < 0,01 соответственно). Такие показатели, как PCR (r = −0,170, p = 0,039), E-селектин (r = −0,220, p = 0,007) и распространенность представителей рода Coprococcus (r = −0,215, p = 0,008) и Bifdobacterium (r = −0,269, p = 0,001), имели обратную зависимость от 25(OH)D. После внесения поправки по возрасту, полу, сезону и индексу массы тела (ИМТ) сохранялась обратная зависимость от 25(OH)D для представителей рода Coprococcus (β = −9,414, p = 0,045) и Bifdobacterium (β = −1,881, p = 0,051), но после добавления в регрессионные модели маркеров воспаления их значимость пропадала.
1. Введение
Поступление витамина D в организм в первую очередь зависит от воздействия на кожу солнечного света, и лишь 20% этого витамина попадает в организм с пищей. Вопрос о том, оказывает ли пища, содержащая витамин D, непосредственное влияние на определение его концентраций в циркулирующей крови, по-прежнему остается спорным [1-6]. Витамин D2 (эргокальциферол) обнаруживается в дрожжевых и съедобных грибах, а также в некоторых овощах, тогда как витамин D3 (холекальциферол) содержится в продуктах животного происхождения. Именно последний синтезируется в коже под действие ультрафиолетового излучения спектра В [7]. Чтобы стать биологически активным, витамин D подвергается гидроксилированию в печени под действием 25-гидроксилазы и в почках под действием 1α-гидроксилазы. 1,25(OH)2D распознается специфическими рецепторами (VDR) в различных клетках, преимущественно в тонком кишечнике, что способствует усилению всасывания кальция, а также в костях, где обеспечивает регуляцию гомеостаза скелета. Нарушение всасывания или изменение метаболических характеристик приводят к нарушениям обмена кальция и фосфора, но, помимо этих хорошо известных функций, нарушения обмена витамина D были связаны с некоторыми другими заболеваниями.
Витамин D выполняет важные функции в формировании врожденных и приобретенных иммунных реакций, жизненном цикле клеток и метаболических процессах, о чем свидетельствует описанная связь между его дефицитом и распространенностью иммунноопосредованных нарушений, онкологических и кардиометаболических заболеваний [5, 7-10]. Была описана обратная зависимость между концентрациями этого витамина и распространенностью ожирения и сахарного диабета 2-го типа [11, 12]. О роли витамина D при этих заболеваниях может свидетельствовать обнаружение рецепторов VDR в бета-клетках, эндотелии, кардиомиоцитах и клетках, продуцирующих ренин [13-15]. Также есть данные, свидетельствующие о том, что неадекватный статус витамина D приводит к повышению концентрации воспалительных цитокинов и снижению чувствительности к инсулину, которые известны как факторы, патофизиологически связанные с кардиометаболическими заболеваниями [16, 17].
Совсем недавно было установлено, что вызванная микробиотой метаболическая эндотоксемия связана с повышенным кардиометаболическим риском [18]. Поскольку витамин D играет значимую роль в качестве модулятора функции иммунной системы тонкого кишечника, возможно, что его дефицит способен приводить к нарушению функции кишечного барьера, что создает благоприятные условия для транслокации в кровоток эндотоксинов - таких как липополисахариды (ЛПС). Известно, что ЛПС способствуют развитию слабо выраженного воспаления, что предрасполагает к инсулинорезистентности [19, 20]. Для оценки воспаления в клинических [21] и научных [22, 23] целях были использованы различные циркулирующие биомаркеры.
Некоторые представители микробиоты кишечника были связаны с системными воспалительными и метаболическими нарушениями. В частности, было показано, что грамотрицательные бактерии, в наружной мембране которых содержатся ЛПС, стимулируют иммунный ответ и вызывают метаболическую эндотоксемию, тогда как бифидобактерии снижают уровень эндотоксемии [18]. Было установлено, что Afefeermansia, хотя и относятся к грамотрицательным бактериям, улучшают барьерную функцию кишечника и оказывают благоприятное метаболическое действие [24].
Дефицит витамина D и отсутствие рецепторов VDR сопровождалось развитием дисбиоза кишечника и повышением восприимчивости к кишечным заболеваниям [25-27]. В немногочисленных исследованиях изучался вопрос о том, может ли статус витамина D влиять на развитие нарушений метаболизма глюкозы за счет модулирующего действия на состав микробиоты кишечника [28-30].
Желательно получить углубленное понимание основных механизмов кардиометаболических заболеваний, учитывая их влияния на показатели смертности населения.
Для оценки новых биомаркеров и предикторов кардиометаболических исходов было запланировано исследование Nutritionists’ Health Study (NutriHS) [31]. Это наблюдательное когортное исследование, проводимое посредством веб-технологии среди студентов и выпускников бразильских колледжей питания, позволило получить множество ретроспективных и перспективных данных. Исследование NutriHS дает уникальную возможность исследовать связь между питательными веществами и кардиометаболическими исходами, патофизиология которых включает неспецифическое воспаление. Эти связи должны быть подтверждены высоким качеством собранных данных.
Учитывая важность иммунной системы кишечника для ответа на микробные стимулы и иммуномодулирующую роль витамина D, мы предположили, что статус витамина D связан с микробиотой кишечника через неспецифическое воспаление. Мы исследовали связь приема витамина D и концентрации 25-гидроксивитамина D с составом фекальной микробиоты, маркерами воспаления и биохимическим профилем у молодых взрослых участников исследования NutriHS.
2. Методы
Подробное описание целей, популяции и протокола исследования NutriHS [31]. Вкратце, для включения в исследование NutriHS возраст участников должен был составлять 18 лет и старше, они должны были быть студентами или выпускниками колледжей питания; беременность относилась к критерии исключения. Для настоящего анализа методом поперечного среза приемлемой была случайная выборка из 150 участников в возрасте 18–40 лет, которые предоставили данные по изучаемым показателям. Критериями исключения были прием антибиотиков, пробиотиков, пребиотиков или метформина в последние шесть месяцев, а также диарея в течение двух недель, предшествующих сбору образцов кала. Комитет по этике исследований Школы общественного здравоохранения Университета Сан-Паулу одобрил проект NutriHS. От всех участников было получено электронное согласие на участие в исследовании.
Добровольцам предлагали заполнить структурированные и валидированные опросники онлайн, используя систему е-NutriHS (www.fsp.usp.br). В целях данного исследования были рассмотрены опросники, охватывающие социально-демографические показатели, состояние здоровья и физическую активность, а также частоту потребления различных пищевых продуктов. После заполнения опросников участников приглашали на плановый личных визит к врачу для физического обследования и сбора образцов биоматериала.
2.1. Антропометрия и измерение артериального давления
Все измерения проводили обученные сотрудники. Измерение массы тела проводилось на цифровых весах, позволяющих измерять массу до 200 кг с точностью измерения, близкой к 100 г., в положении стоя; на участниках была легкая одежда и они были без обуви. Для измерения роста использовали стадиометр (точность измерения 0,1 см). Индекс массы тела рассчитывали путем деления массы тела в килограммах на рост в метрах, возведенный в квадрат. Окружность талии измеряли в вертикальном положении на середине расстояния между последним ребром и гребнем подвздошной кости, используя гибкую и неэластичную сантиметровую ленту с точностью измерения 0,1 см.
Артериальное давление измеряли после 5-минутного отдыха в положении сидя, используя автоматический прибор (Omron HEM-712C, Omron Health Care). Было проведено три измерения артериального давления. Мы принимали во внимание среднее значение последних двух из трех измерений артериального давления. Среднее артериальное давление (АД) рассчитывали по формуле: диастолическое АД + 1/3 (систолическое АД - диастолическое АД) [32].
2.2. Оценка образа жизни: физическая активность и рацион питания
Для оценки физической активности был использован ранее валидированный Международный опросник физической активности [33, 34]. Уровень общей физической активности был выражен в количестве минут за неделю.
Данные о рационе питания были собраны с использованием валидированного опросника частоты потребления различных пищевых продуктов (www.gac-usp.com.br). Включенные в него вопросы служат получению информации о пищевых привычках людей в течение одного года с определением обычной индивидуальной порции путем выбора из списка, включающего 102 продукта питания. Участников также спрашивали об используемых пищевых добавках. Данные обрабатывались непосредственно в e-NutriHS с немедленным расчетом эквивалента суточного рациона и представлением данных о макро- и микронутриентах для пищевых продуктов и всего суточного рациона в соответствии с данными о пищевом составе из Национальной базы данных министерства сельского хозяйства США по питательным веществам для стандартной справки (ndb.nal.usda.gov). Количество каждого продукта питания было преобразовано в эквивалентное количество граммов в день. Общее потребление энергии указывали в количестве калорий в день, в то время как макроэлементы были представлены в абсолютных или относительных значениях к общей энергии, а микроэлементы - в абсолютном количестве в день. Потребление витамина D классифицировали на основании средней расчетной потребности, согласно которой адекватным считается потребление >10 нг/сут. [35].
Образцы крови были собраны натощак, через 12 часов после последнего приема пищи. Липидный профиль (общий холестерин, холестерин ЛПВП и триглицериды) был исследован ферментативными методами. Холестерин ЛПНП был рассчитан по формуле Фридевальда. Концентрацию глюкозы в плазме крови определяли глюкозооксидазным методом. Резистентность к инсулину рассчитывали с использованием гомеостатической модели оценки резистентности к инсулину – HOMA-индекса [36].
Концентрации цитокинов (ФНО-a, ИЛ-6, ИЛ-10, e-селектин и ИФН-γ) определяли с помощью системы Multiplex® (R&D Systems, Миннеаполис, штат Миннесота), а ЛПС – методом твердофазного иммуноферментного анализа (тИФА) (MyBioSource, Сан-Диего, штат Калифорния). Высокочувствительное определение концентрации С-реактивного белка и концентрации общего 25(OH)D (Elecsys 2012, Roche Diagnostics, Роткройц, Швейцария) проводили методом хемилюминесценции. Предел обнаружения 25(OH)D составлял 3,0 нг/мл; коэффициенты вариации в одной серии и между сериями анализов составляли 3,3% и 9,9%, соответственно. Категории статуса витамина D (достаточный, недостаточный или дефицит) были определены в соответствии с критериями Общества эндокринологов [35].
Аликвоты образцов кала хранили в холодильнике (6°C) в течение максимум 24 часов после взятия, а затем, до проведения анализа на микробиоту кишечника, помещали на хранение при температуре -80°C. Экстракцию ДНК проводили с использованием набора реагентов Maxwell® 16 DNA purification kit (Promega, Мэдисон, штат Висконсин), а протокол выполнялся с помощью анализатора Maxwell® 16 в соответствии с инструкциями производителя (Promega, Мэдисон, штат Висконсин). Caporaso и соавт. описали праймеры и ход работы для получения ампликона области V4 из 16s рРНК гена [37]. Полученная библиотека ампликонов была подвергнута секвенированию на платформе Illumina MiSeq в соответствии с инструкциями производителя. Для кластеризации операционных таксономических единиц (ОТЕ) нами было использовано программное обеспечение Qiime версии 1.8, а для присвоения таксономической группы - база данных GreenGenes 13.5.
2.3. Статистический анализ
Описательные данные выражены в виде средних значений со стандартными отклонениями, медиан и межквартильных интервалов или процентов. Нормальное распределение переменных оценивали с помощью критерия Колмогорова-Смимова. Если распределения были искажены, значения преобразовывали в логарифмическую, квадратную или обратную функцию, используемую перед анализом. Значения в таблицах были подвергнуты обратному преобразованию, чтобы вернуться к исходному масштабу.
Потребление витамина D и концентрация 25(OH)D для анализа были классифицированы на тертили. Для сравнения клинических показателей и показателей воспаления по всем тертилям был проведен дисперсионный анализ (или критерий Крускала-Уоллиса при наличии показаний). Для выявления различий был использован ретроспективный анализ Бонферрони. Коэффициент Пирсона или Спирмена использовали для проверки корреляций между потреблением витамина D (в пересчете на 1000 ккал) или его концентрацией (непрерывная переменная) и другими переменными.
Для сравнения состава микробиоты кишечника было использовано программное обеспечение DESeq2. Это программное обеспечение позволяет получить изменения, кратные log2, которые связаны с данной переменной, по сравнению со средним нормализованным количеством ОТЕ. Изменения, кратные log2, представляют собой сравнение с эталонным уровнем. Если различия между группами равны нулю, это означает, что между средними значениями групп разница отсутствует. В настоящей работе рассматривались только ОТЕ, относительная численность которых была выше 0,1%, и которые присутствовали в образцах кала у 80% участников. Были показаны данные по ОТЕ на уровне родов, выраженные как относительная численность. Коэффициент Спирмена служил для проверки корреляции между 25(OH)D и численностью родов.
Для анализа зависимостей между концентрациями 25(OH)D (зависимая переменная) и родовым составом бактерий (независимая переменная основного интереса) была использована множественная линейная регрессия с поправкой на возраст, пол, сезонность и ИМТ. Кроме того, к регрессионным моделям в соотношении один к одному были добавлены маркеры воспаления, значение Р которых в одномерном анализе было ниже 0,20, и их интерпретировали как независимые переменные.
Статистические анализы были проведены с использованием пакета программ обработки статистических данных для социальной науки (SPSS), версия 23 (IBM, Армонк, штат Нью Йорк), и R – для анализа микробиоты.
3. Результаты
Выборка была на 90,7% представлена женщинами, средний возраст которых составлял 24,9 ± 5,8 года, а среднее значение ИМТ было 23,6 ± 4,7 кг/м2. Избыточная масса тела или ожирение имели место в 28,5% случаев; все участники отрицали наличие у них артериальной гипертонии или сахарного диабета, но у четырех человек было зарегистрировано повышение концентрации глюкозы в плазме крови ≥100 мг/дл. У 81% всей выборки имело место низкое потребление витамина D и основным источником его было молоко, молочные продукты и яйца. Средняя концентрация 25(OH)D составляла 23,9 ± 9,7 нг/мл; у 24,0% было достаточное количество витамина D (≥30 нг/мл), у 39,3% отмечался недостаток (от ≥20 до 30 нг/мл) и у 36,7% был дефицит (<20 нг/мл). При взятии образцов крови весной значения были значительно ниже, чем в другие сезоны (20,3 ± 8,0 в сравнении с 25,8 ± 10,0 нг/мл, p = 0,01). При сопоставлении концентраций 25(OH)D с категориями ИМТ (≥ или <25 кг/м2) средние значения не отличались.
Демографические и клинические данные, сгруппированные по тертилям потребления витамина D, описаны в Таблице 1. Участники из третьего тертиля потребления витамина D были значительно старше, чем другие. Значения демографических, клинических и биохимических показателей между тертилями потребления витамина D не различались. Средние концентрации 25(OH)D увеличивались от первого тертиля к третьему (21,5 ± 9,0 в сравнении с 23,5 ± 10,0, в сравнении с 26,5 ± 9,6 нг/мл, соответственно, p = 0,013). Среднее значение ЛПС во втором тертиле потребления витамина D было выше, но с пограничной значимостью. Различия в средних концентрациях маркеров воспаления между тертилями отсутствовали.
Потребление витамина D, скорректированное на 1000 ккал, достоверно коррелировало с его концентрацией в сыворотке крови (r = 0,220, p = 0,008). При стратификации по категориям 25(OH)D различий между тертилями не наблюдалось, хотя имело место снижение средних значений CRP, ИФН-γ и HOMA-IR с пограничной значимостью. По мере повышения тертилей 25(OH)D наблюдалась достоверная тенденция к снижению средних значений ЛПС (Таблица 2).
Таблица 1. Число (в скобках указано процентное отношение) и средние значения (± стандартные отклонения) или медианы (межквартильный диапазон) демографических и клинических показателей с распределением по тертилям потребления витамина D, выраженного в количестве пг/сут.a' **
Таблица 2. Число (в скобках указано процентное отношение) и средние значения (± стандартные отклонения) или медианы (межквартильный диапазон) демографических и клинических показателей с распределением по тертилям концентраций витамина 25(OH)D.a' **
Фекальная микробиота во всей выборке была представлена, главным образом, таксономическими типами Firmicutes (49,9%), Bacteroidetes (29,4%), Verrucomicrobia (9,3%), Proteobacteria (5,9%) и Actinobacteria (2,6%), как показано на рис. 1. Пятнадцать преобладающих родов представлены на рис. 2.
 Рис. 1. Относительная численность основных таксономических типов в фекальной микробиоте всей выборки
Рис. 1. Относительная численность основных таксономических типов в фекальной микробиоте всей выборки Рис. 2. Диаграмма рассеивания относительной численности основных родов в фекальной микробиоте. На оси X изображены 15 наиболее распространенных родов; первая заглавная буква представляет семейство, а название рода следует за символом подчеркивания
Рис. 2. Диаграмма рассеивания относительной численности основных родов в фекальной микробиоте. На оси X изображены 15 наиболее распространенных родов; первая заглавная буква представляет семейство, а название рода следует за символом подчеркиванияЗначимые различия (p < 0,005) в численности родов микроорганизмов в образцах кала участников, включенных в третий тертиль потребления витамина D (группа A) и его концентраций (группа B), в сравнении с такими же показателями в первом и втором тертиле показаны на рис. 3.
 Рис. 3. Изменения средних показателей выбранных родов фекальной микробиоты, кратные Log2, полученные в исследуемой популяции с использованием программного обеспечения DESeq2. Третьи тертили сравнивали с суммой первого и второго. Роды различались на уровне р < 0,005. Красным кругом обозначены представители Firmicutes, синим кругом – Bacteroidetes, а желтым кругом - Proteobacteria. Панель A: отношение средних показателей третьего тертиля (эталонного) к показателям других тертилей потребления витамина D. Панель B: отношение средних показателей третьего тертиль (эталонного) к показателям других тертилей концентрации 25(OH)D.
Рис. 3. Изменения средних показателей выбранных родов фекальной микробиоты, кратные Log2, полученные в исследуемой популяции с использованием программного обеспечения DESeq2. Третьи тертили сравнивали с суммой первого и второго. Роды различались на уровне р < 0,005. Красным кругом обозначены представители Firmicutes, синим кругом – Bacteroidetes, а желтым кругом - Proteobacteria. Панель A: отношение средних показателей третьего тертиля (эталонного) к показателям других тертилей потребления витамина D. Панель B: отношение средних показателей третьего тертиль (эталонного) к показателям других тертилей концентрации 25(OH)D.В подгруппе наиболее высокого потребления витамина D представители рода Prevotella были наиболее многочисленными (log2FC 1,67, p < 0,01), тогда как количество представителей родов Haemophilus и Veillonella было меньше (log2FC −2,92, p < 0,001 и −1,46, p < 0,01 соответственно), чем в другой подгруппе (первый и второй тертили в сумме). Что касается концентрации 25(OH)D, в подгруппе с наиболее высокими значениями наиболее многочисленным родом был Megasphaera (logFC 3,11, p < 0,001), а количество представителей Haemophilus и Veillonella было меньше (log2FC −3,53 и −2,78, p < 0,001 соответственно).
Выбранные для оценки коэффициенты корреляции представлены в таблице 3. Показатели воспаления коррелировали между собой и с ИМТ. Также CRP и E-селектин имели обратную зависимость от концентрации 25(OH)D. Численность представителей Coprococcus (r = −0,215, p = 0,008) и Bifdobacterium (r = −0,269, p = 0,001) находилась в обратной зависимости от его концентрации. Корреляции между Faecalibacterium (r = −0,143, p = 0,081) и Akkermansia (r = 0,093 p = 0,257) и 25(OH)D не достигали уровня статистической значимости.
На основании корреляций, показанных в таблице 3, мы проверили связь между концентрациями 25(OH)D и некоторыми микроорганизмами, используя поправки на возраст, пол, ИМТ и сезон (весна). Для каждого рода (Faecalibacterium, Coprococcus и Bifidobacterium) была построена отдельная модель, в которую были включены показатели воспаления (CRP, E-селектин и ИФН-γ) в качестве объясняющих направлений. Несмотря на недостоверную корреляцию между численностью представителей родов Akkermansia и Faecalibacterium и витамином D, эти роды были включены в первую модель, которая подтвердила отсутствие достоверных связей.
Таблица 3. Отдельные коэффициенты корреляции между клиническими показателями и численностью наиболее распространенных родов микроорганизмов в составе фекальной микробиоты
Независимая связь между весенним периодом и концентрациями 25(OH)D сохранялась во всех моделях (таблица 4). После добавления родов бактерий (модели 2) была выявлена обратная зависимость для Coprococcus (p = 0,045) и Bifidobacterium (p = 0,051), хотя для последнего значимость была пограничной. При включении в эти модели маркеров воспаления обратная зависимость от витамина наблюдалась только по CPR и E-селектину. В моделях 3 (с поправкой на CRP) зависимость была менее выраженной для Coprococcus (модель 3A, p = 0,056), но не для Bifidobacterium (модель 3B, p = 0,035). В моделях 4 (с поправкой на E-селектин) зависимость от 25(OH)D была значимой для Coprococcus (модель 4A, p = 0,034), но не для Bifidobacterium (модель 4B, p = 0,073). Несмотря на зависимость ИФН-γ от витамина, его включение в модели подтвердило, что Bifidobacterium (модель 5B, p = 0,037) имели независимую связь с зависимой переменной, чего не наблюдалось для Coprococcus (p = 0,079).
Таблица 4. Коэффициенты (в скобках указаны стандартные ошибки) моделей множественной линейной регрессии для связей между логарифмически преобразованными концентрациями 25(OH)D и численностью отдельных родов микроорганизмов с поправкой на несколько переменных
4. Обсуждение
Нами было установлено, что у участников исследования как потребление витамина D, так и концентрация 25(OH)D связаны с численностью определенных родов комменсальных микроорганизмов в составе микробиоты кишечника. Полученные нами данные об определенном соотношении родов микроорганизмов в зависимости от статуса витамина D позволяют выдвинуть гипотезу о том, что его модулирующее действие на иммунные клетки кишечника может влиять и на состав бактерий. Снижение иммунного ответа при дефиците витамина D может увеличить конкурентное преимущество бактерий рода Haemophilus и Veillonella, численность которых, как было установлено, была относительно более высокой в подгруппе лиц с низкими, по сравнению с самыми высокими, потреблением и концентрацией витамин D. Эти грамотрицательные бактерии могут объяснить более высокие уровни ЛПС, обнаруженные в этой подгруппе. С другой стороны, относительно небольшая доля бактерий, обладающих благоприятными свойствами, таких как представители родов Coprococcus и Bifidobacterium, может активировать иммунный ответ в кишечнике и индуцировать местное воспаление, что требует включения компенсаторных противовоспалительных механизмов, как те, которые зависят от 25(OH)D. Была обнаружена обратная зависимость маркеров воспаления от 25(OH)D. Полученные результаты подчеркивают роль витамина D в поддержании гомеостаза иммунной системы, и мы предполагаем, что это происходит частично за счет взаимодействия с микробиотой кишечника, хотя дизайн исследования не позволяет установить наличие причинно-следственных связей.
Особенностью нашего исследования стало включение в него здоровых молодых людей, обладающих знаниями и навыками в области питания. Мы обнаружили, что средние значения концентрации 25(OH)D увеличились от первого к третьему тертилю потребления витамина D, что между этими переменными существовала прямая зависимость. В литературе нет единого мнения относительно такой взаимосвязи, и в большинстве исследований значимой корреляции выявлено не было [1-6]. Не исключено, что нам удалось продемонстрировать такую взаимосвязь благодаря высокой достоверности диетологических данных, собранных в рассматриваемой популяции студентов и выпускников колледжей питания.
Клинический профиль трех подгрупп участников, стратифицированных в соответствии с концентрацией 25(OH)D, не отличался, хотя можно было ожидать ухудшения кардиометаболического профиля у лиц с недостаточностью или дефицитом витамина D. В целом, об обратной зависимости между статусом витамина D и ожирением, а также метаболическими нарушениями сообщалось у пожилых людей [12, 38-40]. Отсутствие связей между концентрацией 25(OH)D и этими переменными можно объяснить демографическими характеристиками рассматриваемой в нашем исследовании популяции. Тем не менее, в подгруппе с самыми низкими уровнями 25(OH)D наблюдались более высокие концентрации ЛПС, что может указывать на подверженность риску метаболической эндотоксемии. Фактически, ранее сообщалось, что у мышей с дефицитом витамина D, подвергшихся воздействию бактериального патогена, была продемонстрирована более выраженная транслокация эндотоксина и продукция воспалительных цитокинов [41]. Поскольку считают, что патофизиологической основой кардиометаболических заболеваний служит системное провоспалительное окружение, все эти данные представляются согласованными с результатами исследований, в которых статус витамина D был связан с проявлениями метаболического синдрома [12, 38-40]. Однако в недавно проведенном проспективном исследовании защитный эффект добавок, содержащих витамин D, не был подтвержден [42].
Интересно, что мы обнаружили значимую обратную зависимость между концентрацией 25(OH)D и концентрациями E-селектина и CRP. Это позволяет предположить, что даже среди здоровых людей статус витамина D может обеспечивать противовоспалительное действие. На самом деле, в нескольких исследованиях было описано, что 25(OH)D играет значительную роль в функционировании иммунной системы, позволяя связать более высокие его концентрации в сыворотке крови, а также более высокое потребление с более низким уровнем неспецифического воспаления [43-46]. У модельных животных и людей получены доказательства того, что витамин D модулирует иммунный ответ, снижая воспаление [29, 44, 47], что согласуется с нашими выводами об обратной зависимости между 25(OH)D, CRP и E-селектином.
Проведенный нами метагеномный анализ подтвердил, что представители Firmicutes и Bacteroidetes были самыми многочисленными таксономическими типами, и что род Bacteroides встречался чаще всего, согласно другим отчетам [48]. Интересным наблюдением в нашей популяции была относительно высокая численность Akkermansia; кроме того, мы обнаружили обратную зависимость между этим родом бактерий и метаболизмом глюкозы, а также воспалительными биомаркерами. Эта связи согласуется с результатами ранее проведенных исследований, показывающих, что Akkermansia muciniphila связана с благоприятным влиянием на метаболический и воспалительный профили [24, 49]. У модельных животных было продемонстрировано положительное влияние A. muciniphila на моторику кишечника, толщину слизистого слоя и метаболизм при ожирении и сахарном диабете 2-го типа [24]. Поскольку наша популяция состояла из лиц молодого возраста с адекватным состоянием жировой ткани организма и здоровым метаболическим профилем, высокое соотношение представителей данных родов не было непредвиденным результатом.
Анализ DeSeq2 позволил получить значимую информацию о соотношении некоторых родов в одной подгруппе (эталонная группа) в сравнении с другой (первый плюс второй тертили). Независимо от их численности во всей популяции, мы обнаружили, что в группе с наиболее высоким потреблением витамина D основным родом был Prevotella. В популяциях, употребляющих пищу, богатую углеводами и волокнами, уже описана повышенная численность бактерий рода Prevotella [50]. Употребление в пищу продуктов, богатых пищевыми волокнами, подтвержденное у участников исследования NutriHS (29,5 ± 17,8 г/сут., данные не приведены), было вполне адекватным, что могло способствовать относительно высокой численности бактерий рода Prevotella. Ранее считалось, что представители рода Haemophilus вызывают воспалительные заболевания кишечника и определяют уровни ЛПС, а представители рода Veillonella связаны с повышением концентрации воспалительных цитокинов [51, 52]. Эти грамотрицательные бактерии с наружным слоем ЛПС были менее многочисленными в наших подгруппах с самым высоким потреблением витамина D и с самыми высокими концентрациями 25(OH)D; кроме того, самая низкая концентрация ЛПС была обнаружена среди лиц, у которых был лучший статус витамина D. Не исключено, что у участников нашего исследования с худшим статусом витамина D и сниженной способностью к иммунному ответу на бактерии родов Haemophilus и Veillonella могла происходить транслокация эндотоксина через стенку кишечника, которая провоцировала развитие системного воспаления. Это предположение подтверждается исследованиями на животных, в которых добавление витамина D в рацион питания увеличивало экспрессию генов NOD2 и дефензинов, усиливая иммунный ответ против кишечных патогенов [53]. Также было показано, что 1,25(OH)2D3 индуцировал экспрессию соединительных белков и укреплял межклеточные соединения, улучшая барьерную функцию кишечника [24]. Для проверки этой гипотезы и выявления иммуномодулирующих возможностей микроорганизмов этих родов необходимы дополнительные механистические исследования.
При рассмотрении всей выборки в целом, после внесения поправки обратная зависимость между бактериями рода Coprococcus и Bifidobacterium и концентрацией 25(OH)D сохранялась. Оба рода были связаны с адекватным ИМТ и гомеостазом глюкозы, а также с продукцией бутирата и противовоспалительным действием [54-56]. Вполне возможно, что воздействие большого количества этих бактерий может ослаблять иммунный ответ. Была описана связь бактерий рода Coprococcus со статусом витамина D, когда этот витамин использовали в качестве пищевой добавки при лечении иммуноопосредованных заболеваний [56], но не у здоровых людей. У здоровых участников нашего исследования обнаружение обратной связи 25(OH)D с численностью бактерий рода Coprococcus может отражать гомеостаз иммунной системы кишечника и стабильное системное воспаление. Насколько нам известно, ни в одном исследовании не было выявлено связи между бактериями рода Bifidobacterium и статусом витамина D. В нашем линейном регрессионном анализе ослабление или исчезновение связи этих родов с тремя различными маркерами воспаления позволяет предположить, что воспаление может частично опосредовать связь между концентрацией витамина и микробиотой. Это согласуется с представленными данными о его противовоспалительном действии [57] и с провоспалительным состоянием при недостатке витамина D [58]. У нокаутных мышей VDR развивалось хроническое воспаление в желудочно-кишечном тракте даже при наличии непатогенной микрофлоры. Несмотря на споры о причинно–следственной связи [59], существует единое мнение в отношении того, что этот витамин является важным медиатором защиты кишечника от инфекционных агентов [60].
Наше исследование имеет ограничения, связанные главным образом с тем, что оно проводилось методом поперечного среза. Несмотря на ориентировочный характер, важно было выдвинуть гипотезу, подлежащую проверке в дальнейших исследованиях, касающихся новой проблемы, описываемой в литературе. Размер выборки не был небольшим, и мы имели возможность оценить широкий диапазон переменных для определения профиля кардиометаболического риска. Популяция нашего исследования, представленная молодыми диетологами, должна была обеспечить получение достоверных данных о питании, но стала причиной ограничения, связанного с ее однородностью с точки зрения пищевых привычек. Эти аспекты ограничивают обобщающие выводы для всего населения. Для подтверждения наших результатов также необходимы исследования с участием лиц пожилого возраста и лиц с более высоким уровнем риска. Учитывая возросшие в настоящее время показатели распространенности дефицита витамина D в популяциях, наше исследование открывает инновационный путь для улучшения понимания этого сценария.
Таким образом, наше исследование подтвердило, что модулирующее действие статуса витамина D на иммунную систему кишечника может влиять на состав комменсальных бактерий и наоборот. Относительно более высокая численность грамотрицательных бактерий, таких как представители родов Haemophilus и Veillonella, может быть следствием низкого потребления и/или концентрации витамина D. Относительно небольшая доля полезных бактерий, таких как представители родов Coprococcus и Bifidobacterium, может привести к развитию иммунного ответа и воспаления, что потребует противовоспалительных вмешательств, включая такие, которые зависят от 25(OH)D. Мы пришли к выводу, что роль витамина D в поддержании иммунного гомеостаза, по-видимому, частично обусловлена взаимодействиями с микробиотой кишечника. Для более подробного рассмотрения гипотезы, выдвинутой в нашем исследовании, желательно проведение дальнейших исследований с соответствующим дизайном.
Благодарность
Авторы благодарят исследователей и участников проекта NutriHS, а также Capes и FAPESP за финансовую поддержку
Список литературы
[1] Vieth R. Vitamin D supplementation, 25-hydroxyvitamin D concentrations, and safety. Am J Clin Nutr 1999;69(5):842–56.
[2] Nesby-O'Dell S, Scanlon KS, Cogswell ME, Gillespie C, Hollis BW, Looker AC, et al. Hypovitaminosis D prevalence and determinants among African American and white women of reproductive age: third National Health and Nutrition Examination Survey, 1988–1994. Am J Clin Nutr 2002;76(1):187–92.
[3] Hollis BW. Circulating 25-hydroxyvitamin D levels indicative of vitamin D sufficiency: implications for establishing a new effective dietary intake recommendation for vitamin D. J Nutr 2005;135(2):317–22.
[4] Hyppönen E, Power C. Hypovitaminosis D in British adults at age 45 y: nationwide cohort study of dietary and lifestyle predictors. Am J Clin Nutr 2007;85(3):860–8.
[5] Wang TJ, Pencina MJ, Booth SL, Jacques PF, Ingelsson E, Lanier K, et al. Vitamin D deficiency and risk of cardiovascular disease. Circulation 2008;117(4):503–11.
[6] Salehpour A, Shidfar F, Hosseinpanah F, Vafa M, Razaghi M, Hoshiarrad A, et al. Vitamin D 3 and the risk of CVD in overweight and obese women: a randomized controlled trial. Br J Nutr 2012;108(10):1866–73.
[7] Hewison M. Vitamin D and the immune system: new perspectives on an old theme. Endocrinol Metab Clin North Am 2010;39(2):365–79.
[8] Cantorna MT. Vitamin D and its role in immunology: multiple sclerosis, and inflammatory bowel disease. Prog Biophys Mol Biol 2006;92(1):60–4.
[9] Michos ED, Melamed ML. Vitamin D and cardiovascular disease risk. Curr Opin Clin Nutr Metab Care 2008;11(1):7–12.
[10] Vaidya A. Vitamin D and cardio-metabolic disease. Metabolism 2013;62(12):1697.
[11] Wolden-Kirk H, Overbergh L, Christesen HT, Brusgaard K, Mathieu C. Vitamin D and diabetes: its importance for beta cell and immune function. Mol Cell Endocrinol 2011;347(1): 106–20.
[12] Kim HJ, Kang CK, Park H, Lee MG. Effects of vitamin D supplementation and circuit training on indices of obesity and insulin resistance in T2D and vitamin D deficient elderly women. J Exerc Nutr Biochem 2014;18(3):249.
[13] Chiu KC, Chu A, Go VLW, Saad MF. Hypovitaminosis D is associated with insulin resistance and β cell dysfunction. Am J Clin Nutr 2004;79(5):820–5.
[14] Schuch NJ, Garcia VC, Martini LA. Vitamin D and endocrine diseases. Arq Bras Endocrinol Metab 2009;53(5):625–33.
[15] Norman PE, Powell JT. Vitamin D and cardiovascular disease. Circ Res 2014;114(2):379–93.
[16] Herrmann M, Sullivan DR, Veillard A, McCorquodale T, Straub IR, Scott R, et al. Serum 25-Hydroxy vitamin D: a predictor of macrovascular and microvascular complications in patients with type 2 diabetes. Diabetes Care 2014;38(3):521–8.
[17] Wellen KE, Hotamisligil GS. Inflammation, stress, and diabetes. J Clin Invest 2005;115(5):1111–9.
[18] Cani PD, Delzenne NM. Gut microflora as a target for energy and metabolic homeostasis. Curr Opin Clin Nutr Metab Care 2007;10(6):729–34.
[19] Caricilli AM, Picardi PK, de Abreu LL, Ueno M, Prada PO, Ropelle ER, et al. Gut microbiota is a key modulator of insulin resistance in TLR 2 knockout mice. PLoS Biol 2011; 9(12):e1001212.
[20] Moraes ACF, Silva IT, Almeida-Pititto B, Ferreira SRG. Microbiota intestinal e risco cardiometabólico: mecanismos e modulação dietética. Arq Bras Endocrinol Metab 2014;58(4):317–27.
[21] Ridker PM, Buring JE, Shih J, Matias M, Hennekens CH. Prospective study of C-reactive protein and the risk of future cardiovascular events among apparently healthy women. Circulation 1998;98(8):731–3.
[22] Calder PC, Ahluwalia N, Albers R, Bosco N, Bourdet-Sicard R, Haller D, et al. A consideration of biomarkers to be used for evaluation of inflammation in human nutritional studies. Br J Nutr 2013;109(S1):S1–S34.
[23] Almeida-Pititto B, Ribeiro-Filho FF, Bittencourt MS, Lotufo PA, Bensenor I, Ferreira SR. Usefulness of circulating E-selectin to early detection of the atherosclerotic process in the Brazilian Longitudinal Study of Adult Health (ELSA-Brasil). Diabetol Metab Syndr 2016;8(19).
[24] Everard A, Belzer C, Geurts L, Ouwerkerk JP, Druart C, Bindels LB. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. PNAS 2013;110(22): 9066–71.
[25] Kong J, Zhang Z, Musch MW, Ning G, Sun J, Hart J, et al. Novel role of the vitamin D receptor in maintaining the integrity of the intestinal mucosal barrier. Am J Physiol Gastrointest Liver Physiol 2008;294:G208–16.
[26] Ooi JH, Li Y, Rogers CJ, Cantorna MT. Vitamin D regulates the gut microbiome and protects mice from dextran sodium sulfate-induced colitis. J Nutr 2013;143(10):1679–86.
[27] Bashir M, Prietl B, Tauschmann M, Mautner SI, Kump PK, Treiber G, et al. Effects of high doses of vitamin D3 on mucosa-associated gut microbiome vary between regions of the human gastrointestinal tract. Eur J Nutr 2015;55:1479–89.
[28] Mai V, McCrary QM, Sinha R, Glei M. Associations between dietary habits and body mass index with gut microbiota composition and fecal water genotoxicity: an observational study in African American and Caucasian American volunteers. Nutr J 2009;8(1):49.
[29] Ly NP, Litonjua A, Gold DR, Celedón JC. Gut microbiota, probiotics, and vitamin D: interrelated exposures influencing allergy, asthma, and obesity? J Allergy Clin Immunol 2011; 127(5):1087–94.
[30] Ciubotaru I, Green SJ, Kukreja S, Barengolts E. Significant differences in fecal microbiota are associated with various stages of glucose tolerance in African American male veterans. Transl Res 2015;166(5):401–11.
[31] Folchetti LGD, da Silva IT, de Almeida-Pititto B, Ferreira SRG. Nutritionists' Health Study cohort: a web-based approach of life events, habits and health outcomes. BMJ Open 2016; 6(8):e012081.
[32] Guyton AC, Hall JE. Textbook of medical physiology. 11th ed. Philadelphia: Saunders; 2006.
[33] Matsudo S, Araújo T, Marsudo V, Andrade D, Andrade E, Braggion G. Questinário internacional de atividade f1sica (IPAQ): estudo de validade e reprodutibilidade no Brasil. Rev Bras Ativ Fís Saúde 2001;6(2):05–18.
[34] Craig CL, Marshall AL, Sjöström M, Bauman AE, Booth ML, Ainsworth BE, et al. International physical activity questionnaire:12-country reliability and validity. Med Sci Sports Exerc 2003;35(8):1381–95.
[35] Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Endocrine Society. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab 2011;96(7):1911–30.
[36] Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28:412–9.
[37] Caporaso JG, Lauber CL, Walters W, Berg-Lyons D, Huntley J, Fierer N, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms. ISME J 2012;6(8):1621–4.
[38] Forman JP, Giovannucci E, Holmes MD, Bischoff-Ferrari HA, Tworoger SS,Willett WC, et al. Plasma 25-hydroxyvitamin D levels and risk of incident hypertension. Hypertension 2007; 49(5):1063–9.
[39] Shankar A, Sabanayagam C, Kalidindi S. Serum 25- hydroxyvitamin D levels and prediabetes among subjects free of diabetes. Diabetes Care 2011;34(5):1114–9.
[40] Salehpour A, Hosseinpanah F, Shidfar F, Vafa M, Razaghi M, Dehghani S, et al. A 12-week double-blind randomized clinical trial of vitamin D3 supplementation on body fat mass in healthy overweight and obese women. Nutr J 2012;11(1):78.
[41] Ryz NR, Lochner A, Bhullar K, Ma C, Huang T, Bhinder G, et al. Dietary vitamin D3 deficiency alters intestinal mucosal defense and increases susceptibility to Citrobacter rodentium induced colitis 2. Am J Physiol Gastrointest Liver Physiol 2015;309(9):G730–42.
[42] Jorde R, Sollid ST, Svartberg J, Schirmer H, Joakimsen RM, Njølstad I, et al. Vitamin D 20 000 IU per week for five years does not prevent progression from prediabetes to diabetes. J Clin Endocrinol Metab 2016;101(4):1647–55.
[43] Mora JR, Iwata M, von Andrian UH. Vitamin effects on the immune system: vitamins A and D take centre stage. Nat Rev Immunol 2008;8(9):685–98.
[44] Hewison M. An update on vitamin D and human immunity. Clin Endocrinol (Oxf) 2012;76:315–25.
[45] Bellia A, Garcovich C, D'Adamo M, Lombardo M, Tesauro M, Donadel G, et al. Serum 25-hydroxyvitamin D levels are inversely associated with systemic inflammation in severe obese subjects. Intern Emerg Med 2013;8(1):33–40.
[46] Mellenthin L, Wallaschofski H, Grotevendt A, Völzke H, Nauck M, Hannemann A. Association between serum vitamin D concentrations and inflammatory markers in the general adult population. Metab Clin Exp 2014;63(8):1056–62.
[47] Cantorna MT, McDaniel K, Bora S, Chen J, James J. Vitamin D, immune regulation, the microbiota, and inflammatory bowel disease. Exp Biol Med 2014;239(11):1524–30.
[48] Arumugam M, Raes J, Pelletier E, Le Paslier D, Yamada T, Mende DR, et al. Enterotypes of the human gut microbiome. Nature 2011;473:174–80. [49] Qin J, Li Y, Cai Z, Li S, Zhu J, Zhang F, et al. A metagenome-wide association study of gut microbiota in type 2 diabetes. Nature 2012;490(7418):55–60.
[50] Wu GD, Chen J, Hoffmann C, Bittinger K, Chen YY, Keilbaugh SA, et al. Linking long-term dietary patterns with gut microbial enterotypes. Science 2011;334(6052):105–8.
[51] Said HS, SudaW,Nakagome S, ChinenH, Oshima K, KimS, et al. Dysbiosis of salivarymicrobiota in inflammatory bowel disease and its association with oral immunological biomarkers. DNA Res 2013;037.
[52] Van den Bogert B, Meijerink M, Zoetendal EG, Wells JM, Kleerebezem M. Immunomodulatory properties of Streptococcus and Veillonella isolates from the human small intestine microbiota. PLoS One 2014;9(12):e114277.
[53] Sokol H, Pigneur B, Watterlot L, Lakhdari O, Bermúdez-Humarán LG, Gratadoux JJ, et al. Faecalibacterium prausnitziiisan anti-inflammatory commensal bacterium identified by gut microbiota analysis of Crohn disease patients. Proc Natl Acad Sci U S A 2008;105:16731–6.
[54] Collado MC, Isolauri E, Laitinen K, Salminen S. Distinct composition of gut microbiota during pregnancy in overweight and normal-weight women. Am J Clin Nutr 2008;88(4):894–9.
[55] Wu X, Ma C, Han L, Nawaz M, Gao F, Zhang X, et al. Molecular characterisation of the faecal microbiota in patients with type II diabetes. Curr Microbiol 2010;61:69–78.
[56] Cantarel BL, Waubant E, Chehoud C, Kuczynski J, DeSantis TZ, Warrington J, et al. Gut microbiota in multiple sclerosis. J Invest Med 2015;63(5):729–34.
[57] Zhang Y, Leung DY, Richers BN, Liu Y, Remigio LK, Riches DW, et al. Vitamin D inhibits monocyte/macrophage proinflammatory cytokine production by targeting MAPK phosphatase-1. J Immunol 2012;188(5):2127–35.
[58] Cantorna MT. Mechanisms underlying the effect of vitamin D on the immune system. Proc Nutr Soc 2010;69(03):286–9.
[59] Mangin M, Sinha R, Fincher K. Inflammation and vitamin D: the infection connection. Inflamm Res 2014;63(10):803–19.
[60] Assa A, Vong L, Pinnell LJ, Avitzur N, Johnson-Henry KC, Sherman PM. Vitamin D deficiency promotes epithelial barrier dysfunction and intestinal inflammation. J Infect Dis 2014;210:1296–305.
Оригинал статьи доступен в электронном виде www.sciencedirect.com
www.metabolismjournal.com





