Scientific Reports | (2020) 10:8848
Gut metabolites and inflammation factors in non-alcoholic fatty liver disease: A systematic review and meta-analysis
Xiongfeng Pan, Shi Wu Wen, Atipatsa C . Kaminga, Aizhong LiuКишечные метаболиты и факторы воспаления при неалкогольной жировой болезни печени: систематический обзор и метаанализ
Введение
Неалкогольная жировая болезнь печени (НАЖБП) – ведущее хроническое заболевание печени в мире, которое становится растущей проблемой общественного здравоохранения из-за его неуклонного распространения в последние г...
Scientific Reports | (2020) 10:8848
Gut metabolites and inflammation factors in non-alcoholic fatty liver disease: A systematic review and meta-analysis
Xiongfeng Pan, Shi Wu Wen, Atipatsa C . Kaminga, Aizhong LiuКишечные метаболиты и факторы воспаления при неалкогольной жировой болезни печени: систематический обзор и метаанализ
Введение
Неалкогольная жировая болезнь печени (НАЖБП) – ведущее хроническое заболевание печени в мире, которое становится растущей проблемой общественного здравоохранения из-за его неуклонного распространения в последние годы, а также из-за риска трансформации в цирроз и гепатоцеллюлярную карциному. Следует отметить, что вмешательства, связанные с изменением образа жизни, остаются первой линией терапии НАЖБП. Например, в исследованиях было показано, что диетические и физические упражнения улучшают чувствительность к печеночным трансаминазам и инсулину, а также снижают индекс массы тела. Тем не менее, следует признать, что диетические и физические упражнения трудно выполнять и поддерживать в повседневной жизни – возможно, это связано с отсутствием мотивации, генетической предрасположенностью, адаптацией основных показателей метаболизма, неспособностью похудеть и гормональными нарушениями. Кроме того, метаанализ Кокрановской базы данных показал, что влияние лекарств (включая тиазолидиндионы, инсулиновые сенсоры, антиоксиданты и т.д.) в лечении НАЖБП очень неопределенно. Таким образом, эффективная терапия НАЖБП до сих пор недоступна, что стимулировало междисциплинарные исследования, чтобы лучше оценить потенциальный сложный патогенез НАЖБП.
Например, недавняя гипотеза о том, что дисфункция оси кишечник – печень (т.е. избыточный бактериальный рост, изменение проницаемости слизистой оболочки, дисбактериоз кишечника) может играть ключевую роль в продвижении молекулярного механизма НАЖБП и запуске развития неалкогольного жирового гепатоза печени (НЖГП) с простым стеатозом до неалкогольного стеатогепатита (НАСГ).
Кроме того, в нескольких исследованиях на людях было высказано предположение, что существует значительная разница в обилии микробиоты кишечника между пациентами с НАЖБП и здоровой контрольной группой. То есть дисбиоз микробиоты кишечника у пациентов с НАЖБП инициировал иммунный гомеостаз, что отличает их от здоровой контрольной группы. В связи с этим микробиота кишечника переносилась в печень через воротную вену, что приводило к чрезмерной активации иммунных клеток в печени. Кроме того, провоспалительные метаболиты кишечного происхождения, такие как пептидогликан, липотейхоевая кислота и липополисахарид, активируют сигнальные пути воспалительных цитокинов в печени, что в свою очередь приводит к тяжелому воспалению, фиброзу и повреждению печени при НАЖБП.
В настоящее время принято считать, что воспаление также является основным фактором, способствующим патогенезу и прогрессированию НАЖБП и поражению печени. Кроме того, некоторые данные свидетельствуют о том, что различные типы клеток печени взаимодействуют с системой микробиоты кишечника и ее метаболитами, и это взаимодействие активирует неконтролируемый иммунный ответ при НАЖБП. Микробиота кишечника и связанные с ней метаболиты могут запускать выработку каскада цитокинов, способствовать закреплению неблагоприятных воспалительных реакций и приводить к высвобождению различных маркеров воспаления. При неблагоприятном течении воспалительной реакции в печени вырабатываются различные сывороточные маркеры воспаления, включая интерлейкины (IL), фактор некроза опухоли (ФНО), С-реактивный белок (СРБ) и другие маркеры общего иммунитета. Таким образом, можно предположить, что микробиота кишечника, связанные с ней метаболиты и факторы воспаления при НАЖБП могут быть потенциальными мишенями для фармакологического и клинического лечения НАЖБП.
Отметим, что метаанализ широко используется в статистическом анализе для изучения данных ряда независимых исследований по одной и той же теме с целью определения общих тенденций. Таким образом, метаанализ нашел свое практическое применение во многих дисциплинах, включая педагогическую психологию и исследование биомаркеров. Несмотря на то, что в предыдущих обзорах обсуждалась взаимосвязь между НАЖБП и микробиотой кишечника и связанными с ней метаболитами или факторами воспаления, взаимодействие между микробиотой кишечника, связанными с ней метаболитами и факторами воспаления при НАЖБП неизвестно. Таким образом, целью данного исследования было обобщение результатов исследований взаимодействия микробиоты кишечника, связанных с ней метаболитов и факторов воспаления с НАЖБП с помощью систематического обзора и метаанализа.
Материалы
Поиск соответствующих научных статей, опубликованных не позднее сентября 2019 года, проводился в следующих базах данных: Web of Science, PubMed, Embase и Cochrane Library. Стратегия поиска и критерии включения в это исследование позволили получить в общей сложности 47 исследований, из которых только 11 соответствовали критериям метаанализа.
Обсуждение
Это исследование показало, что может существовать взаимодействие микробиоты кишечника, связанных с ней метаболитов и факторов воспаления с НАЖБП. Кроме того, в этом исследовании оценивалась эффективность пробиотической терапии в модификации факторов воспаления при НАЖБП.
Что касается микробиоты кишечника и кишечных метаболитов, то несмотря на то, что микробиота кишечника человека сильно варьировала, этот обзор показал, что пациенты с НАЖБП сообщали о большем количестве вредных бактерий (таких как гамма-протеобактерии) и меньше полезных бактерий (таких как Bifidobacteriaceae), чем в контрольной группе. Учитывая несколько противоречивых выводов смежных исследований с аналогичным дизайном (таких как Lachnospiraceae и Prevotellaceae), для подтверждения этих результатов необходимы дополнительные крупномасштабные исследования биоактивных метаболитов кишечника и метагеномных характеристик кишечной микробиоты при НАЖБП.
Известно, что диета с высоким содержанием жиров может вызвать дисбактериоз кишечника, а длительный дисбактериоз кишечника может привести к формированию различных кишечных метаболитов, включая триметиламин, КЖК, глюкагоноподобный пептид 1, липополисахарид, свободные жирные кислоты, свободный холестерин и этанол. Кроме того, эти кишечные метаболиты, такие как липополисахарид, могут стимулировать системную воспалительную реакцию, которая в свою очередь может активировать клетки Купфера для производства TNF-α и вызывать резистентность к инсулину. Таким образом, инсулинорезистентность увеличивает накопление триглицеридов в печени, способствуя синтезу триглицеридов, поглощению печенью свободных жирных кислот и периферическому липолизу при НАЖБП. В связи с этим у пациентов, страдающих НАЖБП, может наблюдаться дисбактериоз кишечника, сопровождающийся чрезмерным бактериальным ростом в тонком кишечнике и повышением уровня кишечных метаболитов, таких как эндотоксин. Следует отметить, что повышенная проницаемость кишечника может привести к усилению миграции бактерий, и при этом условии кишечные метаболиты и некоторые бактерии способны попадать в портальное кровообращение, проникая через кишечный барьер, и достигать печени. Клинические исследования также показали, что почти у всех пациентов с НАЖБП наблюдались аномальные уровни воспалительных цитокинов, которые запускали воспалительный ответ микрофлоры кишечника при НАЖБП. Кроме того, экспериментальные исследования показали, что цитокин-опосредованный окислительный стресс, дисфункция митохондрий и эндоплазматического ретикулума может способствовать развитию стеатогепатита из простого стеатоза через сигнальный путь толл-подобных рецепторов.
Накопленные данные свидетельствуют о том, что окислительный стресс играет важную роль в модели прогрессирования НАЖБП, основанной на гипотезе множественных поражений. На уровне органелл митохондрии и эндоплазматический ретикулум являются основными центрами образования АФК, продуцирующими проапоптотические перекисные липиды (4-гидрокси-2-ноненал) и Bax и способствующими синтезу дыхательных белков через PGC1α, а также переносу Ca2+ и ONOO. Следовательно, они могут способствовать активации звездчатых клеток, макрофагов и клеток Купфера, которые в дальнейшем способствуют эндоплазматическому ретикулуму и митохондриальной дисфункции, тем самым вызывая воспаление, фиброз и апоптоз при НАЖБП. Таким образом, эти результаты подтвердили гипотезу о том, что взаимодействие между печенью, иммунной системой и метаболитами, связанными с микрофлорой кишечника, играет ключевую роль в развитии НАСГ на фоне простого стеатоза.
Рассматривая кишечные метаболиты и воспалительные факторы при НАЖБП, накопленные данные показали, что сообщества микробиоты кишечника генерируют различные метаболиты, которые являются биологически активными веществами, взаимодействующими с клетками печени хозяина при НАЖБП. Среди них эндотоксин и липополисахарид являются активными метаболитами грамотрицательных компонентов бактериальной оболочки и значительно увеличивают (в основном за счет активации сигнального пути TLR4) высвобождение ряда факторов воспаления, включая IL-6, IL-12, IL-1β и TNF-α в развитии НАЖБП. Кроме того, воздействие эндотоксина и липополисахарида на печень вызывает патологические и метаболические изменения, которые провоцируют острую воспалительную реакцию и раннее накопление воспалительных клеток, таких как моноциты, нейтрофилы и лимфоциты. Кроме того, воспалительные клетки высвобождают протеазы, другие ферменты и активные метаболиты кислорода, что приводит к патологическому прогрессированию поражения печени при НАЖБП.
Следует отметить, что желчные кислоты являются регуляторами липидного обмена, метаболизма глюкозы и модулируют воспаление при НАЖБП. Таким образом, микробиота кишечника преобразует первичные желчные кислоты (включая хенодезоксихолевую кислоту и холевую кислоту в толстой и дистальном отделах тонкой кишки) во вторичные желчные кислоты, такие как урсодезоксихолевая кислотаурсодезоксихолевая кислота, литохолевая кислота и дезоксихолевая кислота. Кроме того, желчные кислоты могут регулировать состав микробиоты кишечника, которая, в свою очередь, может регулировать емкость и состав желчных кислот. Таким образом, разрушение взаимодействия желчных кислот с микрофлорой может способствовать развитию воспаления НАЖБП. Между тем, исследования показали, что фарнезоидный Х-рецептор (FXR) играет важную роль во взаимодействии желчных кислот и микрофлоры. Таким образом, желчные кислоты являются лигандами для FXR, члена семейства ядерных рецепторов гормонов, широко встречающихся в подвздошной кишке и печени, которые регулируют различные метаболические пути. Регуляция FXR-сигнала стала потенциальной мишенью для профилактики и лечения НАЖБП и связанных с ней метаболических нарушений. Кроме того, желчные кислоты и холевые кислоты не только обладают прямыми антибактериальными свойствами, но и смягчают воспалительную реакцию за счет ингибирования передачи сигналов NF-κB и генерации цитокинов в макрофагах, в основном за счет активации рецептора белка Takeda-G-5. Между тем, пептидогликан из грамположительных бактерий способствует воспалительной реакции, в первую очередь за счет активации митоген-активируемой протеинкиназы (MAPK)/NF-κB опосредованной генерации провоспалительных цитокинов. Впоследствии он также играет важную роль в активации иммунных клеток, таких как NK-клетки, дендритные клетки, макрофаги, В-клетки и макрофаги. Кроме того, бактериальная ДНК активирует MAPK/NF-κB (в основном через активацию сигнального пути TLR9).
Примечательно, что стеатоз печени считается доброкачественным началом НАЖБП, которое обратимо без серьезного поражения печени на этой стадии. Таким образом, предыдущее обсуждение в связи с результатами данного исследования проясняет роль микробиоты кишечника, связанных с ней метаболитов и факторов воспаления в патофизиологическом процессе стеатоза печени к неалкогольному стеатогепатиту (НАСГ). Есть надежда, что эти данные могут дать новые идеи для будущих исследований и разработки препаратов, направленных на предотвращение прогрессирования стеатоза печени до НАСГ, связанного со стеатогепатитом цирроза печени и гепатоцеллюлярной карциномы. Интересно, что недавний метаанализ также показал, что пробиотики снижают уровень печеночных трансаминаз, общего холестерина, ФНО-α и резистентности к инсулину у пациентов с НАЖБП. Тем не менее, в этом метаанализе были проанализированы исследования, в которых рассматривался только один воспалительный фактор – ФНО-α. В связи с этим в данном метаанализе не изучались другие уровни воспалительных факторов в отношении связи между пробиотиками и НАЖБП, которые рассматривались в исследовании.
Таким образом, это исследование показало, что существуют косвенные доказательства влияния вмешательств пробиотиков (полезной микробиоты кишечника) на воспаление и повреждение печени, которые указывают на значительное снижение факторов воспаления (СРБ и ФНО-α) при НАЖБП после использования пробиотиков. Тем не менее, не было выявлено статистически значимой разницы в концентрациях IL-6 между пациентами с НАЖБП и контрольной группой, что может быть связано с небольшими размерами выборки, включающей IL-6. Поэтому в будущем необходимы масштабные клинические исследования этого явления.
Кроме того, систематический обзор показал, что пентоксифиллин непосредственно нацелен на воспалительный процесс. В связи с этим снижение уровней АСТ и АЛТ может улучшить гистологические показатели печени у пациентов с НАЛФД/НАСГ. Однако терапия НАЖБП анти-ФНО-α может иметь значительные побочные эффекты. Таким образом, необходимы крупные, проспективные и хорошо спланированные рандомизированные контролируемые исследования для изучения препаратов с большей эффективностью при НАЖБП. Кроме того, стоит изучить новые терапевтические мишени для воспалительных сигнальных путей, а также лечение НАЖБП с СРБ в качестве
Несмотря на то, что в настоящее время эффективного лечения НАЖБП не существует, результаты этого систематического обзора/метаанализа свидетельствуют о том, что сеть микробиоты кишечника, связанных с ней метаболитов и факторов воспаления (особенно СРБ и ФНО-α) в настоящее время представляется инновационными и потенциально перспективными мишенями лечения. Будущие исследования должны быть сосредоточены на разработке более специфических новых терапевтических средств для лечения НАЖБП, основанных на биоинженерных технологиях с высокой эффективностью и специфичностью.
 Рис. 1. Диаграмма показывает различия в микробиоте кишечника у пациентов с НАЖБП и контрольной группы. Зеленая область демонстрирует снижение уровня микробиоты кишечника в группе с НАЖБП по сравнению с контрольной группой. Красные области показывают повышение уровня микробиоты кишечника в группе с НАЖБП по сравнению с контрольной группой. Средняя часть представляет противоречие в текущем исследовании.
Рис. 1. Диаграмма показывает различия в микробиоте кишечника у пациентов с НАЖБП и контрольной группы. Зеленая область демонстрирует снижение уровня микробиоты кишечника в группе с НАЖБП по сравнению с контрольной группой. Красные области показывают повышение уровня микробиоты кишечника в группе с НАЖБП по сравнению с контрольной группой. Средняя часть представляет противоречие в текущем исследовании.
А – Тип; В – Семейство; С - Род; НАЖБП – неалкогольная жировая болезнь печени.
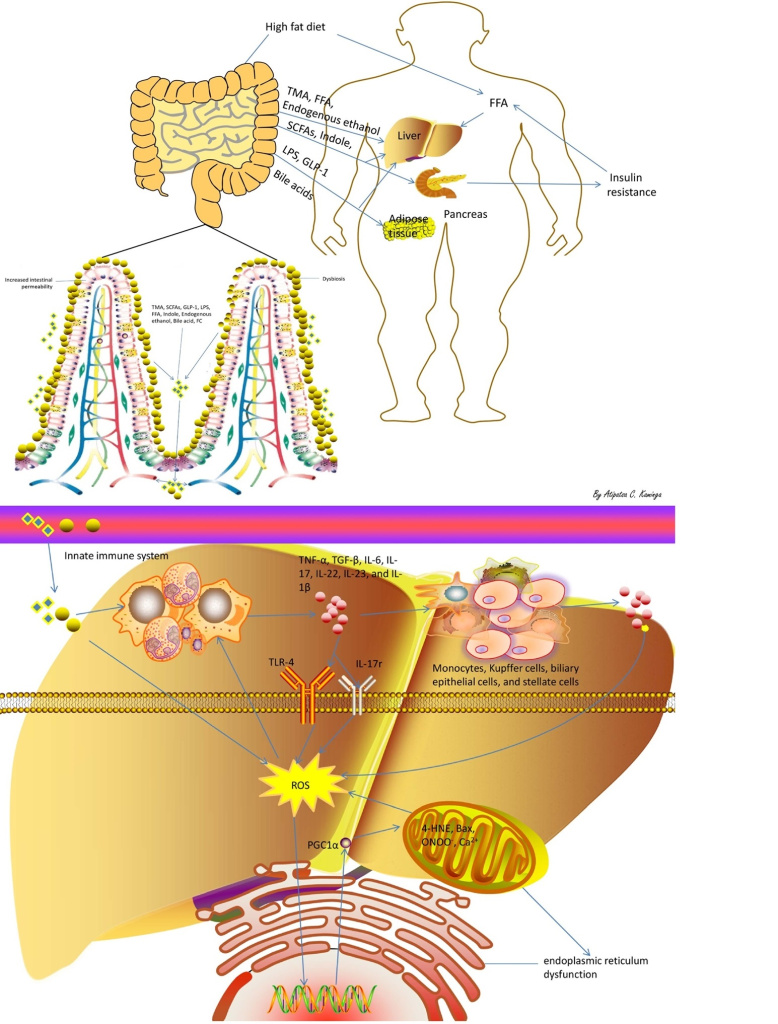 Рис. 2. Обобщена гипотеза о механизме влияния микробиоты кишечника, связанных с ней метаболитов и факторов воспаления на патофизиологию НАЖБП. ТМА, триметиламин; SCFAs (КЦЖК), короткоцепочечные жирные кислоты; GLP-1, глюкагоноподобный пептид 1; LPS, липополисахарид; FFA, свободные жирные кислоты; FS, свободный холестерин; ROS (АФК), активные формы кислорода; 4-HNE, 4-Гидроксиноненал; FMO3, Флавинсодержащая монооксигеназа 3; ТМАО, Триметиламиноксид; IL-1/−6/-17/-22/-23, интерлейкин-1/-6/-17/-22/-23; TNF-α, фактор некроза опухоли альфа; TLR-4, толл-подобный рецептор 4; Рецепторы IL-17r, интерлейкина-17.
Рис. 2. Обобщена гипотеза о механизме влияния микробиоты кишечника, связанных с ней метаболитов и факторов воспаления на патофизиологию НАЖБП. ТМА, триметиламин; SCFAs (КЦЖК), короткоцепочечные жирные кислоты; GLP-1, глюкагоноподобный пептид 1; LPS, липополисахарид; FFA, свободные жирные кислоты; FS, свободный холестерин; ROS (АФК), активные формы кислорода; 4-HNE, 4-Гидроксиноненал; FMO3, Флавинсодержащая монооксигеназа 3; ТМАО, Триметиламиноксид; IL-1/−6/-17/-22/-23, интерлейкин-1/-6/-17/-22/-23; TNF-α, фактор некроза опухоли альфа; TLR-4, толл-подобный рецептор 4; Рецепторы IL-17r, интерлейкина-17.
Перевод на русский язык научной статьи осуществлен в соответствии с условиями открытой лицензии Creative Commons Attributions (CC BY) (Creative Commons — Attribution 4.0 International — CC BY 4.0)





