Front. Endocrinol. 13:1053900.
doi.org
Specific alterations of gut microbiota in diabetic microvascular complications: A systematic review and meta-analysis
Jinni Hong, Tingting Fu, Weizhen Liu, Yu Du, Cunyun Min, Datao Lin
Специфические изменения микробиоты кишечника при диабетических микрососудистых осложнениях: систематический обзор и метаанализ
Знакомство
Сахарный диабет (СД) является эпидемией и причиной 80% преждевременных смертей во всем мире. По состоянию на 2021 г. в мире насчитывается около 537 миллионов пациентов с СД, а к 2045 г. этот показатель увеличится до 700 миллионов. СД вряд ли можно назвать заболеванием с простым повышением уровня глюкозы в крови, в большинстве случаев оно сопровождается множеством микрососудистых осложнений, включая диабетическую ретинопатию (ДР), диабетическую болезнь почек (ДБП) и диабетическую периферическую нейропатию (ДПН). Эти микрососудистые осложнения обусловливают высокую смертность и заболеваемость пациентов с СД и несут заметное социальное и экономическое бремя. Несмотря на доступность многочисленных методов лечения СД и его осложнений, число случаев заболевания по-прежнему растет. ДР является ведущей причиной офтальмологических заболеваний и слепоты среди населения трудоспособного возраста с распространенностью 77,8% в течение 15 лет среди больных СД. ДБП встречается примерно в 40% случаев СД, а 30–90% пациентов с СД могут страдать от ДПН. Эти тенденции подчеркивают настоятельную необходимость лучшего понимания диабетических микрососудистых осложнений (ДМО).
Значительный научный интерес к микробиоте кишечника совпал с глобальным ростом заболеваемости СД. Появление технологии секвенирования нового поколения значительно расширило наше понимание микробиоты кишечника и здоровья хозяина. Микробиота кишечника – это сложное микробное сообщество, представленное 1500 различными видами. СД и его осложнения связаны с дисбактериозом микробиоты кишечника. Различия в составе микробиоты кишечника наблюдались на животных моделях, а также у пациентов с СД и такими осложнениями, как ДКБ, ДР и ДПН. В частности, было доказано, что нарушенный эубиоз Bacteroidetes/Firmicutes связан с повышенной проницаемостью кишечника, когда продукты жизнедеятельности бактерий проникают через непроницаемый кишечный барьер, вызывая воспалительные реакции при диабете. Показано, что виды Lactobacillus fermentum, Akkermansia muciniphila, Bacteroides fragilis и Roseburia intestinalis связаны с чувствительностью к инсулину и метаболизмом глюкозы. Типы Bacteroidetes, Actinobacteria и Mucoromycota были истощены, в то время как роды Acidaminococcus, Escherichia и Enterobacter были обогащены у пациентов с ДР по сравнению с группой контроля (ГК). У пациентов с ДПН Firmicutes и Actinobacteria были повышены, в то время как Bacteroidetes было крайне мало. Уровень Bacteroides и Faecalibacterium был значительно снижен, в то время как Lachnoclostridium и Ruminococcus были много. У пациентов с ДБП отмечено заметное увеличение Acidaminococcus, Selenomonadales, Bilophila и Shigella, а также Proteobacteria, а богатство видов Syntrophaceticus schinkii и Citrobacter farmeri положительно коррелировало с соотношением креатинина/альбумина в моче. Примечательно, что Akkermansia в кишечнике может способствовать влиянию метформина (наиболее часто назначаемого препарата для лечения СД) на метаболизм глюкозы.
Хотя множество исследований, описывающих микробиоту кишечника пациентов с ДМО, дали многообещающие результаты, взаимосвязь между ними все еще остается спорной. Метаанализ более чем 2000 исследований микробиоты позволил предположить, что микробиота чередуется для дифференциации здоровых и больных популяций и служит биомаркером для диагностики или лечения СД. Поэтому мы провели метаанализ микробиоты кишечника пациентов с ДМО и изучили разнообразие и бактериальные характеристики микробиоты кишечника при ДМО.
Методика
Публикации (до 20 августа, 2022) о микробиоте кишечника у пациентов с ДМО были получены из PubMed, Web of Science, Embase и Cochrane.
Review Manager 5.3 был выполнен для оценки стандартизированной разности средних (СРС) и 95% доверительного интервала (ДИ), а также для расчета индексов альфа-разнообразия и относительного обилия микробиоты кишечника между пациентами с ДМО и с СД и ДМО со здоровой группой контроля (ГК).
Мы включили 13 исследований, в которых оценивали 329 пациентов с ДМО, 232 пациента с СД без ДМО и 241 пациента ГК.
Обсуждение
Как нам известно, этот метаанализ первый, где оценивали альфа-разнообразие и нарушения микробиоты при ДМО по сравнению с СД и ГК. Это исследование предоставило три основных вывода о микробных изменениях кишечника при ДМО. Во-первых, у пациентов с ДМО наблюдалось значительно более высокий уровень, но меньшее разнообразие микробиоты кишечника по сравнению с СД. И по сравнению с ГК пациенты с ДМО имели более низкое богатство микробиоты кишечника. Во-вторых, у них было представлено обилие Proteobacteria, а Firmicutes был истощен в ДМО по сравнению с ГК. Наконец, численность родов Bifidobacterium и Faecalibacterium была значимо ниже у лиц с ДМО по сравнению с СД. И по сравнению с ГК пациенты с ДМО демонстрировали более низкое содержание Faecalibacterium и Lactobacillus, но более высокое содержание Klebsiella. Все эти изменения могут быть связаны с микрососудистыми осложнениями при СД и служить перспективными мишенями для лечения ДМО.
Одним из распространенных показателей дисбактериоза является измененное общее микробное альфа-разнообразие, которое обозначает относительное обилие микробных видов в пространстве и времени в пределах конкретного сообщества. Индексы альфа-разнообразия включают OTU, ACE, Chao1, Simpson и Shannon. ACE и Chao1 фокусируются на видовом богатстве, Simpson и Shannon – на разнообразии. Как правило, более низкое альфа-разнообразие наблюдалось при ожирении и диабете и считалось вредным для хозяина. Альфа-разнообразие по богатству и разнообразию снижено у больных с ДР и ДБП по сравнению с ГК. Напротив, не было обнаружено различий в микробиоте кишечника между пациентами с СД с когнитивными нарушениями или без них. ДПН приводила к более серьезному нарушению богатства сообщества микробиоты, чем СД без ДМО. Эти результаты показали, что профиль микробиоты кишечника был изменен у пациентов с ДМО, но из-за крайне противоречивых результатов потребовалось дальнейшее исследование.
Proteobacteria –грамотрицательные бактерии, и оказалось, что они значительно различаются в микробиоте кишечника у пациентов с СД с желудочно-кишечной вегетативной нейропатией или без нее. Было доказано, что Proteobacteria отрицательно связаны со здоровьем человека и обнаружены в большем количестве в популяции с ожирением, чем в популяции без ожирения. Этот механизм может быть связан с регуляцией желчных кислот, которые являются метаболическим регулятором. В соответствии с этими результатами, в данном исследовании было обнаружено, что Proteobacteria значительно обогащены у лиц с ДМО по сравнению с ГК, что позволило сделать вывод, что с увеличением риска ДМО количество Proteobacteria увеличивается. Эти результаты могут также показать, что изменение микробиоты кишечника на уровне типа тесно связано с ДМО.
Типы Firmicutes и Bacteroidetes составляли более 90% от общего сообщества микробиоты кишечника человека. Изменения, влияющие на Firmicutes и Bacteroidetes, впервые были описаны у пациентов с ожирением, у которых наблюдалось увеличение количества Firmicutes за счет Bacteroidetes . Увеличение Firmicutes тесно связано с воспалением и модуляцией метаболизма, и предполагалось, что Firmicutes оказывает значимый эффект на усвоение калорий и увеличение веса. Уровень Bacteroidetes был значительно снижен у пациентов с ДР, а соотношение Firmicutes и Bacteroidetes было доказано повышенным у пациенток с гестационным диабетом. Но в отличие от этих результатов, не сообщалось об изменении или даже снижении соотношения Firmicutes и Bacteroidetes у пациентов с ожирением. В нашем исследовании Firmicutes были значительно истощены у лиц с ДМО по сравнению с ГК. Причина может быть связана с меньшим бактериальным разнообразием у пациентов с ожирением, чем у пациентов без ожирения. Поэтому дальнейшие исследования, связанные с этим параметром, должны быть в центре внимания.
В соответствии с результатами, представленными в этом исследовании относительно значительного снижения Bifidobacterium, Lactobacillus и Faecalibacterium у больных с ДМО (p < 0,05), аналогичные результаты наблюдались при ДР в исследовании Zhou. Bifidobacterium и Lactobacillus были грамположительными микроорганизмами, которые участвовали в восстановлении слизистого барьера кишечника. Они были обратно связаны с воспалением, гипергликемией и резистентностью к инсулину. Было показано, что Bifidobacterium продуцируют бактериоцин, который блокирует адгезию слизистой оболочки и сохраняет барьерную функцию кишечника. У пациентов с СД было достоверно более низкое содержание Bifidobacterium по сравнению со здоровыми пациентами. Пробиотики, а также йогурт или молоко, содержащие Bifidobacterium и Lactobacillus, снижали уровень глюкозы в крови натощак и гликозилированный гемоглобин типа A1c (HbA1c) у пациентов с СД. Сделан вывод о том, что урповень Bifidobacterium и Lactobacillus снижался по мере увеличения риска развития ДМО. Этот механизм может быть связан с истощением потенциальных кишечных патогенов, усилением антиоксидантной способности кишечника и активностью пищеварительных ферментов. Faecalibacterium были грамотрицательными, бутират-продуцирующими бактериями, которые, как было показано, отрицательно связаны с HbA1c. Было доказано, что Faecalibacterium увеличивает кишечный синтез глюкагоноподобного пептида-1, пептида YY, ацетата и бутирата, помогая поддерживать гомеостаз глюкозы.
В этом исследовании Faecalibacterium были снижены в группе ДМО, что подтверждают предыдущие сообщения, которые связывали Faecalibacterium с положительными метаболическими результатами. Эти результаты показали, что изменение микробиоты кишечника на уровне рода было тесно связано с ДМО, а увеличение количества Bifidobacterium, Lactobacillus и Faecalibacterium может быть ответственно за патологии ДМО. Klebsiella является естественным обитателем микробиома желудочно-кишечного тракта здоровых людей и животных, но она часто вызывает внекишечные инфекции, в том числе инфекции мочевыводящих путей, пневмонию и септицемию. Недавно было продемонстрировано увеличение количества Klebsiella при хронической болезни почек (ХБП), в этом исследовании было доказано, что количество Klebsiella увеличивается при хронической болезни почек по сравнению с ГК.
Симбиоз микробиоты помогает регулировать обмен веществ и снижать риск развития СД. Доказано, что дисбиоз микробиоты кишечника приводит к дисбалансу побочных продуктов кишечной микрофлоры и вызывает резистентность к инсулину, механизм развития которой неясен. В последнее время научный интерес вызывает механизм влияния микробиоты на СД и его осложнения. Во-первых, дисбиоз микробиоты приводил к выработке короткоцепочечных жирных кислот (КЦЖК), включая бутират, пропионат и ацетат, которые затем нарушали целостность кишечного барьера, активировали сигнальные каскады воспаления и, таким образом, способствовали повреждению многих органов. Во-вторых, триметиламиноксид (ТМАО), полученный из микробиоты, увеличивал накопление холестерина, приводил к резистентности к инсулину и повышал риск развития СД. В-третьих, было доказано, что изменения в составе микробиоты кишечника влияют на проницаемость кишечника и воспаление при СД. Липополисахарид (ЛПС), полученный из микробиоты, запускал нисходящие воспалительные пути и каскады экспрессии провоспалительных цитокинов, что приводило к воспалительным реакциям и усугубляло резистентность к инсулину. И последнее, но не менее важное: ароматические аминокислоты, полученные из микробиоты, включая индоксилсульфат и п-крезилсульфат, также известные как уремические токсины, могут индуцировать митохондриальную дисфункцию, повреждение подоцитов, утолщать базальную мембрану клубочков и, в конечном итоге, приводить к микровоспалению почек и периваскулярному фиброзу при ДБП.
В данном метаанализе род Bifidobacterium относился к типу Actinobacteria, роды Faecalibacterium и Lactobacillus — к типу Firmicutes, род Klebsiella — к типу Proteobacteria . Phyla Actinobacteria, Firmicutes и Proteobacteria были как КЦЖК-продуцирующими, так и ЛПС-продуцирующими бактериями. Таким образом, мы предположили, что нарушение целостности кишечного барьера, индуцированное КЦЖК, и воспаление, индуцированное ЛПС, могут быть важными частями механизма развития ДМО. Тем не менее, непосредственные мишени микробиоты кишечника и потенциальные механизмы требуют дальнейшего выяснения.
Выводы
В заключение мы продемонстрировали, что чередование альфа-разнообразия, обилия типов Proteobacteria и Firmicutes, а также обилие родов Bifidobacterium, Faecalibacterium, Lactobacillus и Klebsiella может быть связано с ДМО. Изменения микробных характеристик могут быть неинвазивными биомаркерами для мониторинга лечения ДМО. Тем не менее, наши выводы все еще нуждаются в проверке дальнейшими крупномасштабными, многоцентровыми и высококачественными исследованиями. Тем не менее, также сообщалось о противоречивых результатах, и поэтому необходимы дальнейшие исследования, чтобы полностью понять связь между микробиотой кишечника и ДМО.
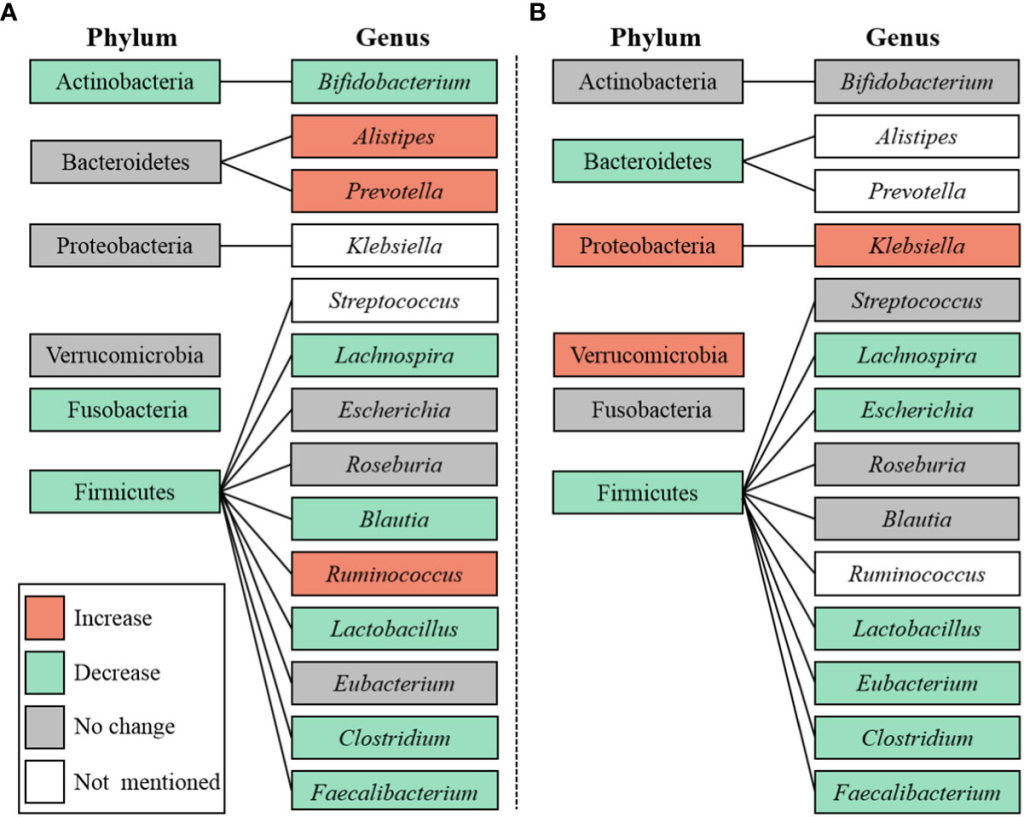 Рис. 1. Микробиота на уровне типа и рода. (A) DC v.s. DM; (B) DC v.s. HC.
Рис. 1. Микробиота на уровне типа и рода. (A) DC v.s. DM; (B) DC v.s. HC.






